
METABOLIZM
KSENOBIOTYKÓW
faza II (sprzęganie)
OPORNOŚĆ WIELOLEKOWA
Barbara Licznerska

Metabolizm
• I faza = rozkład
• II faza = sprzęganie
• III faza = sekrecja
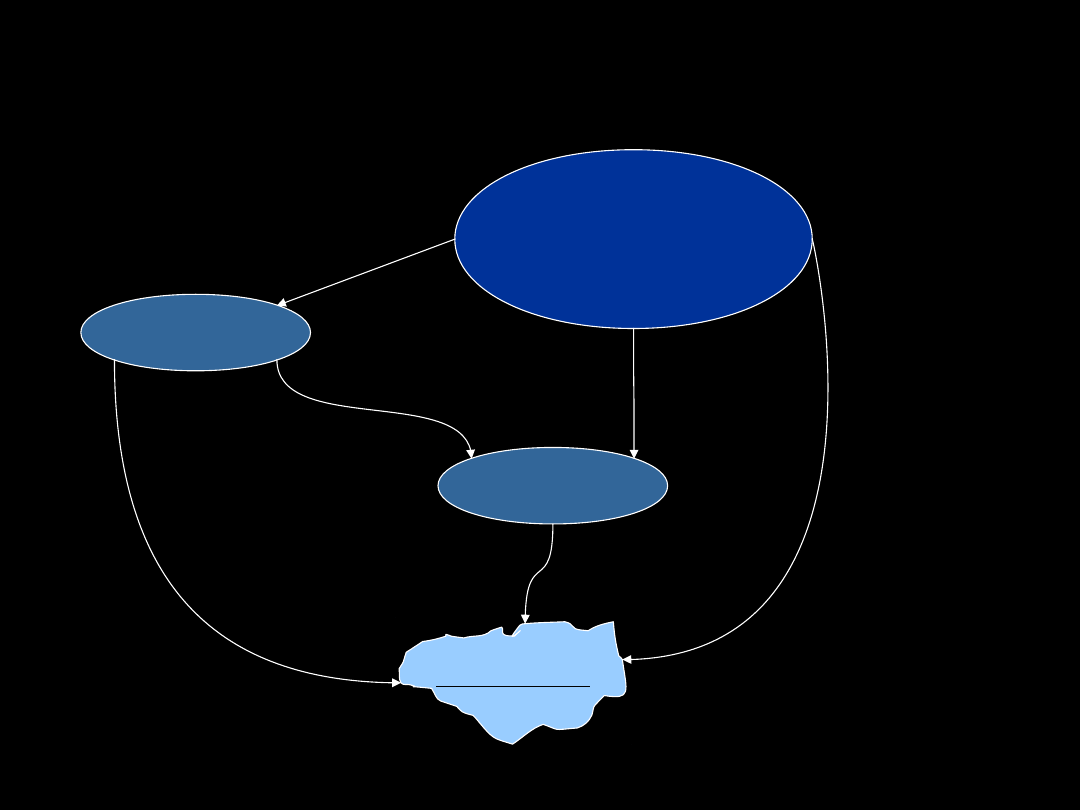
Biotransformacja leków
LEK
METABOLIT
METABOLIT
wydalanie
cyt P450
enzymy II fazy
enzymy II fazy

II faza
• Sprzęganie z kwasem glukuronowym =
glukuronidacja
• Sprzęganie z kwasem siarkowym
• Sprzęganie z kwasem octowym =
acetylacja
• Sprzęganie z aminokwasami
- glicyną
- kwasem glutaminowym
- metioniną = metylacja
- glutationem
- cysteiną

II faza
• Sprzęganie z kwasem glukuronowym =
glukuronidacja
• Sprzęganie z kwasem siarkowym
• Sprzęganie z kwasem octowym =
acetylacja
• Sprzęganie z aminokwasami
- glicyną
- kwasem glutaminowym
- metioniną =
metylacja
-
glutationem
- cysteiną
Sprzęganie
– schemat ogólny
substrat
(ego/endogenny)
produkt
Enzym
(typ, lokalizacja)
znaczenie
sekrecja

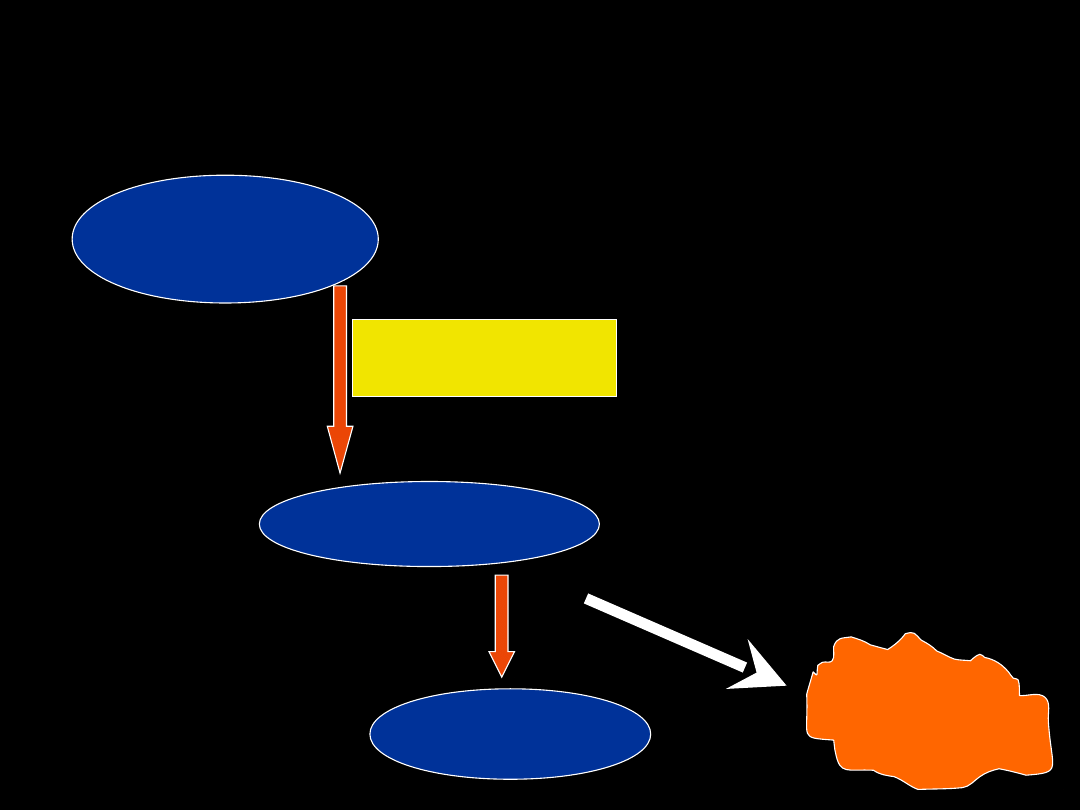
Sprzęganie
– mechanizm
Etap I
- aktywacja jednego z substratów
- niezbędna energia (ATP, UTP)
Etap II
- przeniesienie zaktywowanego
ugrupowana na drugi substrat
- udział transferaz
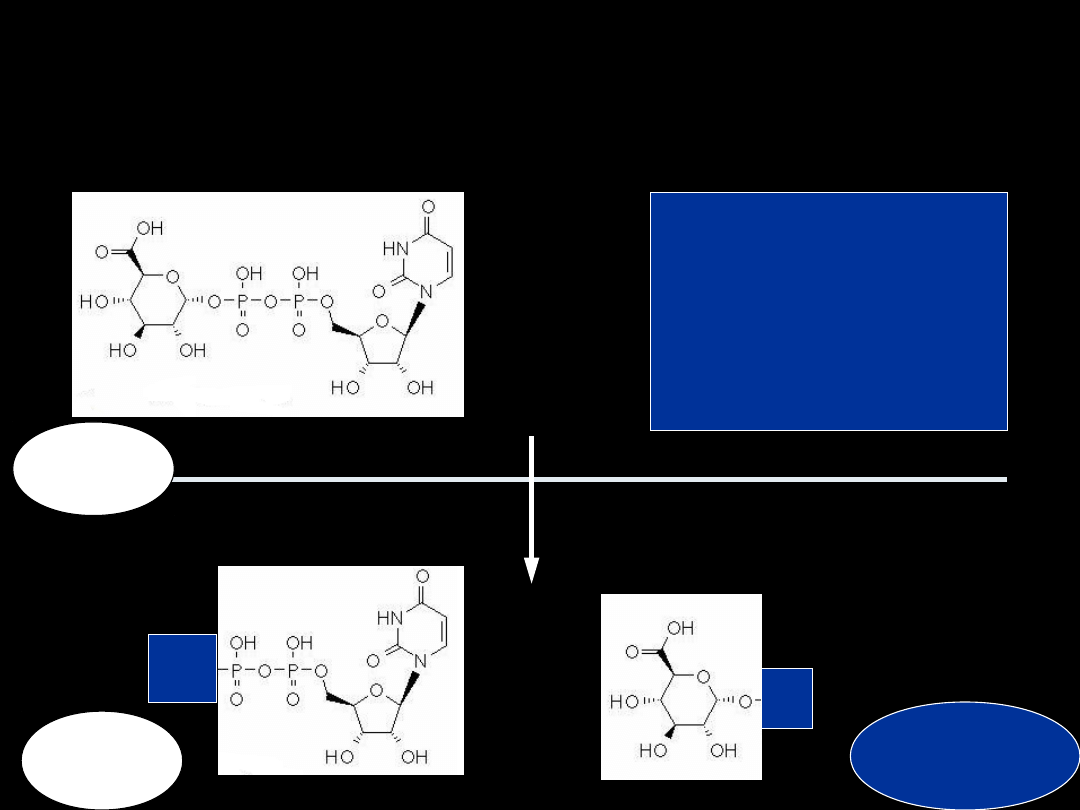
1. GLUKURONIDACJA
R-OH
R-COOH
R-SH
R-NH
2
UGT
glukuronid
UDP
R
HO
+
+
UDPGA

Skąd się bierze UDPGA?
• UDPGA
= kwas α-
urydynodifosforoglukuronowy
• cytoplazma (m.in. wątroby)
• substraty:
glukozo-1-fosforan, UTP, 2NAD
+
• enzymy (dwa etapy aktywacji):
- urydylilotransferaza UDP- glukozy
- dehydrogenaza UDP- glukozy

Glukuronozylotransferazy
• UGTs
= uridine diphosphate glucuronosyl
transferases
• frakcja mikrosomalna (ER):
wątroby, nerek, j.cienkiego, śledziony,
skóry, mózgu
• UGT1A1 – sprzęganie bilirubiny
(żółtaczka noworodków, zespół szarego dziecka,
zespół Gilberta)
• pełna aktywność 6-18 m.ż.
Przykłady ksenobiotyków
typ ksenobiotyku
typ
glukuronidu
alkohole, fenole
typ eterowy
kwasy karboksylowe
typ estrowy
tiofenole, disiarczek,
tetrametylotiuram
S-glukuronidy
aminy, sulfonamidy,
karbaminiany,
heterocykliczne związki
azotowe
N-glukuronidy

Znaczenie
• najczęstsza reakcja II fazy
(bo?)
• glukuronidy
- brak aktywności fizjologicznej
- lepiej rozpuszczalne w wodzie
- szybciej wydalane
• endogenne substraty:
steroidy, bilirubina
• reakcja odwracalna
- β-glukuronidaza
(gdzie?)
- wchłanianie zwrotne wolnych ksenobiotyków
- nowotwory jelit i pęcherza
2. SPRZĘG. Z KW.
SIARKOWYM
R-OH
R-NH
2
SULT
siarczan/
amidosufonian
PAP
-OR/HNR
H -
+
+
PAPS

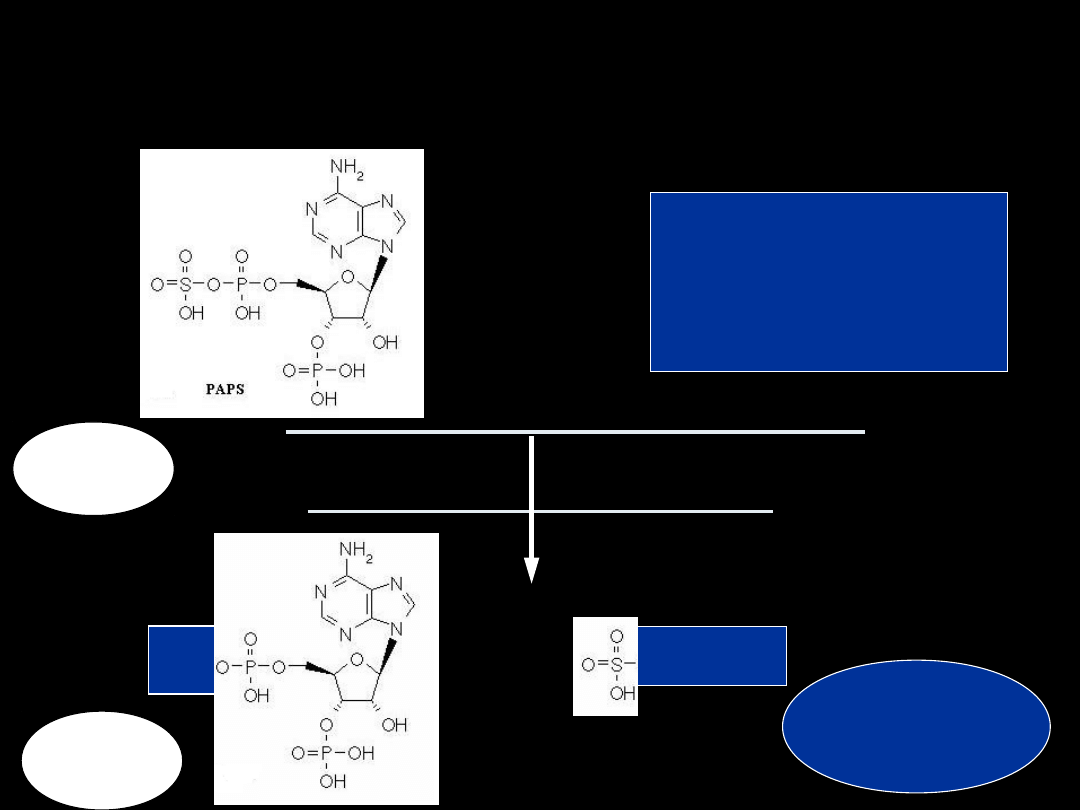
Skąd się bierze PAPS?
• PAPS = 5’-fosfosiarczan 3’-
fosfoadenozyny
• cytoplazma
• substraty:
SO
4-2
, Mg
2+
, 2 ATP
• enzymy (dwa etapy aktywacji)
– adenylilotransferaza siarczanowa
– kinaza adenylilosiarczanowa

Sulfotransferazy
• SULTs = sulfotransferases
• frakcja cytoplazmatyczna:
wątroby, nerek, jelit, mózgu,
nadnerczy,
jąder, jajników
• dojrzałość szybciej niż przy UGTs;
czasem niektóre formy aktywniejsze
u noworodków i dzieci niż u dorosłych
Przykłady ksenobiotyków
typ ksenobiotyku
typ produktu
alkohole, fenole
typ estrowy
(siarczany eterowe)
aminy aromatyczne
sulfaminiany

Znaczenie
• mniejsze niż glukuronidacja
(bo?)
• siarczany
lepiej rozpuszczalne w wodzie
• endogenne substraty
steroidy, heparyna, adrenalina,
serotonina, tyroksyna, cholina
• reakcja odwracalna
– sulfatazy (endogenne substraty)
– arylosulfatazy (ksenobiotyki) – ER, lizosomy

3. Acetylacja
(sprzęg. z kw. octowym)
ETAP I
aktywacja octanu
- mitochondrium wątroby
- efekt: CH
3
CO-S-CoA (tzw. aktywny octan)
- substraty: kwas octowy, ATP, CoA-SH
- enzym: acetylotransferaza acetylo-CoA
ETAP II
przeniesienie grupy acetylowej na ksenobiotyk
- cytoplazma wątroby, nerek, jelit, płuc,
śledziony
- efekt: acetylowe pochodne amin

N- acetylotransferazy
• NAT1, NAT2
• cytoplazma
• głównie
wątroba
, także
pęcherz
moczowy
•
wolni acetylatorzy NAT2
a rak pęcherza moczowego

Przykłady ksenobiotyków
typ ksenobiotyku
produkt
aminy aromatyczne acetylowa pochodna
sulfonamidy
hydrazydy

Znaczenie
• acetylowe pochodne
– metabolizm karcynogennych amin
aromatycznych!
– czasem mniej rozpuszczalne w wodzie
– uszkodzenie kanalików nerkowych i
przewodów moczowych
• endogenne substraty
acetylocholina, acetylokoenzym A
• reakcja odwracalna
– wątroba, nerki
– stosunek acetylacja/deacetylacji kluczowy
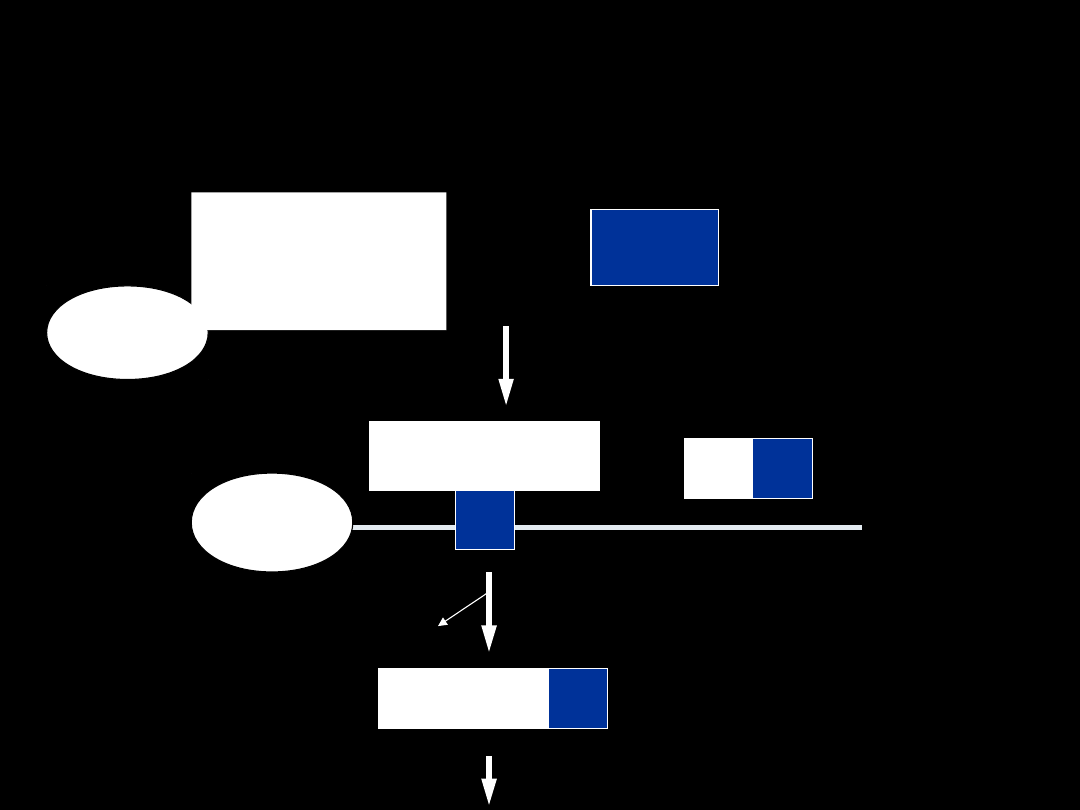
4. SPRZĘGANIE Z
GLUTATIONEM
RX
GST
GSR
+
+
GSH
Gly - Cys –
Glu
H
Gly - Cys – Glu
R
X
H
γ- glutamylotranspeptydaza
Gly – Cys
R
Glu
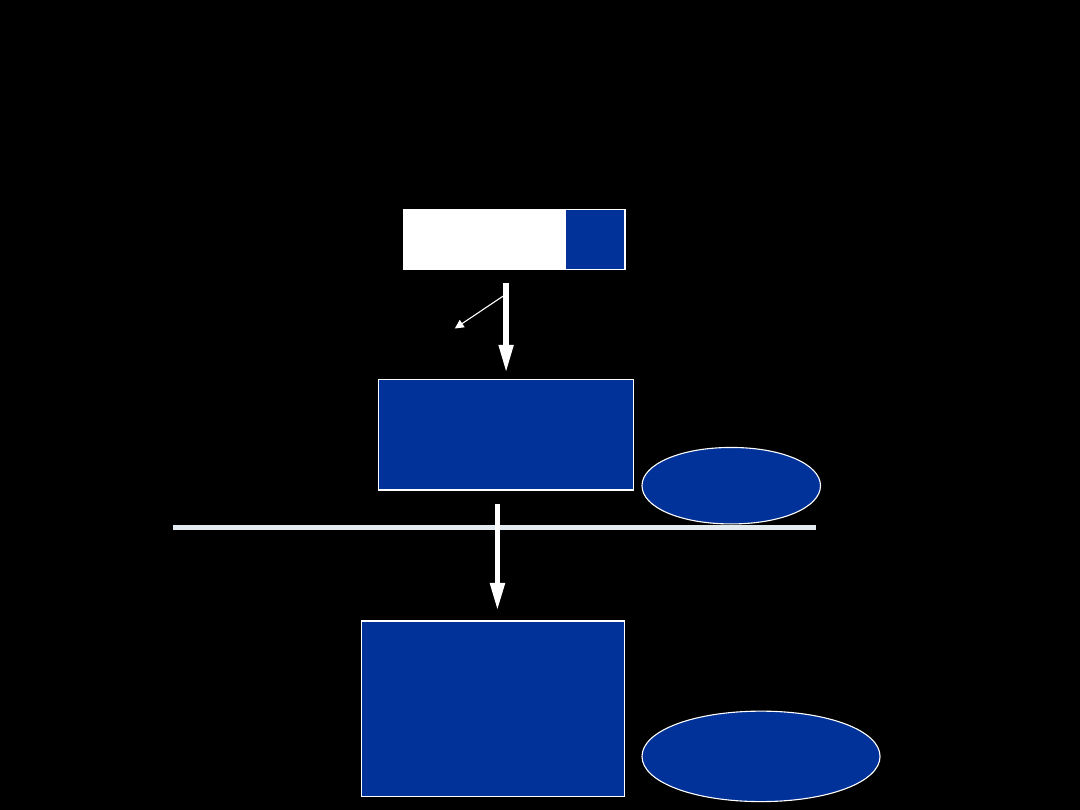
SPRZĘGANIE Z
GLUTATIONEM
cd
Gly – Cys -
R
Gly
dipeptydaza cysteinyloglicynowa
R
-S-CH
2
-CH-COOH
I
NH
2
koniugat
cysteiny
N-acetylotransferaza
R
-S-CH
2
-CH-COOH
I
NH-C=O
I
CH
3
kwasy
merkapturowe

Skąd się bierze glutation?
• tripeptyd: Glu-Cys-Gly
• wszystkie tkanki i narządy
S-transferazy glutationowe (GST)
- cytozol i mikrosomy
wątroby, nerek

Znaczenie
• detoksykacja
• ochrona przed:
– RFT
– wolnymi rodnikami
– reaktywnymi metabolitami
(np. epoksydy, chinony)

5. Metylacja
ETAP I
aktywacja metioniny
-
efekt: S-adenozynometionina (SAM)
- substraty: L-metionina, ATP, Mg
2+
- enzym: adenozylotransferaza metioninowa
ETAP II
przeniesienie grupy metylowej na ksenobiotyk
- cytoplazma wątroby, płuc, nadnerczy
- efekt: metylowa pochodne
- enzym: metylotransferazy

S-metylotransferaza
tiopuryny
• TPMT = thiopurine S-methyltransferase
• cytozol
głównie wątroby i erytrocytów
• istotna w metabolizmie tiopuryn –
leków p/nowotworowych,
np. 6-MP, azatiopryny, tioguaniny

Przykłady ksenobiotyków
typ substratu
typ
produktu
aminy alifatyczne
metylowa
pochodna
aminy aromatyczne
heterocykliczne
aminy III rzędowe
np. cholina, nikotyna, nikotynamid, pirydyna
alkohole, fenole
merkaptany
tiofenole

Znaczenie
• małe
– nie zwiększa rozpuszczalności
– nie przyspiesza wydalania
• endogenne substraty
– aminy katecholowe
– COMT (metylotransferaza katecholowa)
-> cytoplazma wielu narządów

6. Sprzęganie z glicyną
ETAP I
aktywacja obcego ksenobiotyku (sic!)
- mitochondrium wątroby i nerek
- efekt: benzoilo-CoA
- substraty: egzogenny kwas karboksylowy, ATP,
CoA
ETAP II
przeniesienie grupy acetylowej na glicynę
- cytoplazma i mitochondrium
- efekt: kwasy hipurowe

Znaczenie
• małe
(bo?)
• glicyna głównym aa sprzęgającym
• inne aa
– glutamina (dot. kwasu fenylooctowego)
– seryna
– arginina
– lizyna
– (tauryna, ornityna)

7. Redukcja
• faza I + faza II w jednej reakcji
• enzym: DT-diaforaza
= oksydoreduktaza NAD(P)H : akceptor
chinonowy
(wyjątek! - redukcja 2-ee)
• znaczenie:
bezpieczna redukcja toksycznych
chinonów do hydrochinonów
z pominięciem bardzo toksycznego
produktu pośredniego
enzym
lokalizacja
subkomórkowa
lokalizacja
tkankowa
UGT
UGT
ER
wątroba, nerki,
j.cienkie,
śledziona, skóra,
mózg
SULT
SULT
ER
wątroba, nerki,
jelita, mózg,
nadnercza,
jądra, jajniki
GST
GST
cytoplazma
wątroba, nerki
NAT
NAT
cytoplazma
wątroba,
pęcherz
moczowy
TPMT
TPMT
cytoplazma
wątroba,
erytrocyt
enzym
produkt do
usunięcia
droga
usuwania
UGT
UGT
glukuronid
mocz, żółć
SULT
SULT
siarczan/
amidosufonia
n
mocz
GST
GST
koniugat
cysteiny
żółć
GST
GST
kw.
merkapturow
y
mocz
NAT
NAT
pochodne
acetylowe
mocz
TPMT
TPMT
pochodna
metylowa

enzym
substrat
UGT
UGT
alkohole, fenole, kwasy karboksylowe,
aminy, sulfonaminy, karbaminiany,
heterocykliczne zw. azotowe
SULT
SULT
alkohole, fenole, aminy aromatyczne
GST
GST
WA, halogenowe WA, halogenowe
nitroalkany
NAT
NAT
aminy aromatyczne, sulfonamidy,
hydrazydy
TPMT
TPMT
aminy alifatyczne, aminy aromatyczne,
heterocykliczne aminy III rzędowe,
alkohole, fenole, tiofenole, merkaptany
acetylotransferaza
acetylotransferaza
glicynowa
glicynowa
arom. i heterocykliczne kwasy
karboksylowe, kwasy arylooctowe

Metabolizm wybranych
ksenobiotyków
enzy
m
substrat
inhibitor
induktor
NAT2
NAT2
izoniazyd, prokainamid,
klonazepam, kofeina,
sulfasalazyna, nitarzepam,
acebutotol
UGT
UGT
estron, morfina, oksazepam,
progesteron, testosteron, tyroksyna,
diklofenak, ketoprofem, naproksen,
inne NLPZ, kw. walproinowy,
meprobamat, chloramfenikol,
acetaminofen, acetaminofen
SULT
SULT
chloramfenikol., kw. żółciowe,
salicylamid, dopamina,
acetaminofen, glikole
polietylenowe, cholesterol
kw. salicylowy,
kw. benzoesowy,
naproksen
fenobarbital,
3-metylcholantren
MT
MT
adrenalina, dopamina, DOPA,
nikotyna, serotonina, 6-
merkaptopuryna, disulfiram,
spironolakton, azatiopryna,
tioguanina

Czynniki modulujące
metabolizm ksenobiotyków
GENETYCZNE
- formy polimorficzne genów enzymów
metabolizujących leki
- białka transportujące leki/metabolity
FIZJOLOGICZNE
- wiek
- płeć
- ciąża
- funkcjonalność narządów
- choroby
ŚRODOWISKO
- indukcja enzymatyczna
- inhibicja enzymatyczna
- dieta
- używki

OPORNOŚĆ
WIELOLEKOWA (MDR)
• Definicja MDR
• Cechy komórek opornych na
leczenie
• Podział MDR
• Czynniki MDR (przykłady)
• Znaczenie MDR

Oporność wielolekowa
(ang. MDR – multidrug
resistance)
system „obrony”
populacji komórek
nowotworowych
przed licznymi lekami
o różnej budowie chemicznej
i mechanizmie działania

Cechy komórki opornej
wielolekowa
1)
zmiany materiału genetycznego
- naprawy uszkodzeń indukowanych
przez leki
- nadekspresja niektórych białek
2) zmiana metabolizmu komórki
- hamowanie mechanizmu apoptozy
- wypływ leku z komórki
3) działania farmakologicznego leku w
komórce
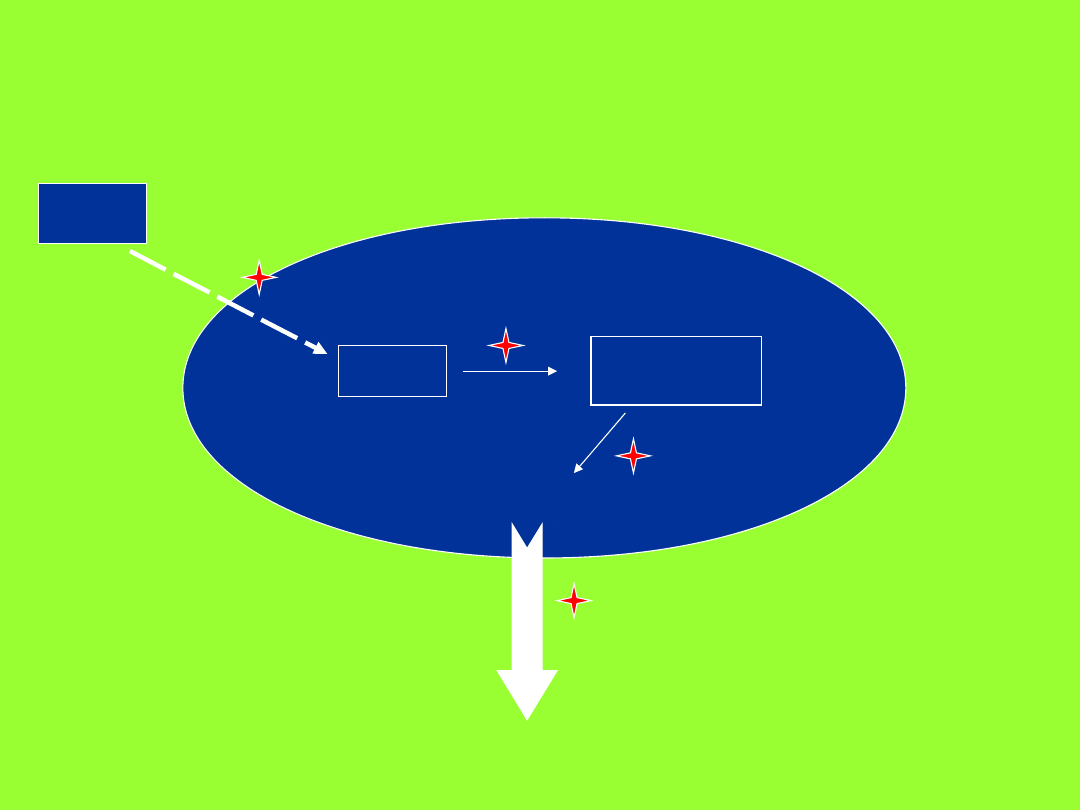
Mechanizmy powstawania
MDR
LEK
KOMÓRKA NOWOTWOROWA
LEK
LEK aktywny
ŚMIERĆ KOMÓRKI

Główne mechanizmy
MDR
punkt uchwytu
zmiana prowadząca do
MDR
przykład
1
wnikanie leku do
komórki
akumulacji leku w
komórce
aktywacja
transporterów np.
MDR
1
, MRP
2
aktywacja leku
w komórce
metabolizm leku /
brak aktywności
systemu aktywującego
lek
aktywacja transferaz
glutationowych /
izolacja leku w
wew.kom.
pęcherzykach
3
zniszczenie
komórki
docelowej
zmiana punktu
docelowego leku /
napraw uszkodzeń
mutacje genów
kodujących
topoizomerazy /
wzmocnienie
systemów
naprawczych
4
zatrzymanie
cyklu
komórkowego /
śmierć komórki
zahamowanie apoptozy
lub zatrzymania cyklu
komórkowego
mutacje p53,
aktywacja genu BCL-
2

Białka jako przyczyny
oporności wielolekowej
1) białka transporterowe
tzw. rodzina transporterów ABC –
np.MDR
1
, MRP
1
, MRP
2
, LRP
2) topoizomerazy
3) metalotioneiny
4) syntetaza tymidylanowa
5) O-6-alkilotransferaza
6) enzymy aktywujące glutation (np.
GST)
Glikoproteina P (MDR
1
)
• Budowa:
-1280 aa, 170 kDal
- 12 segmentów transbłonowych
- zewnątrzbłonowy fragment glikozylowany
- 2 miejsca wiążące ATP
• Rola:
aktywny transport leku poprzez błonę poza komórkę
• Mechanizm:
– Etap I – bezpośrednie wiązanie leku przez białko
– Etap II – przeniesienie wbrew gradientowi na zew. komórki
(ATP)

Glikoproteina P
ulega
nadekspresji
w około 55%
wszystkich
ludzkich
nowotworów

Inhibitory glikoproteiny P
I generacja
werapamil, cyklosporyna A
II generacja
valspodar, biricodar
III generacja
tariquidar, zosuquidar, laniquidar,
elacridar

Onkologiczne ligandy
transporterów rodziny ABC
TRANSPORTER LIGANDY
P-gp
aktynomycyna D, daunorubicyna,
doksorubicyna, docetaksel, etopozyd,
mitoksantron, paklitaksel, tenipozyd, topotekan,
winblastyna, winkrystyna, winorelbina
MDR2
paklitaksel, winblastyna
MRP1
doksorubicyna, epirubicyna, etopozyd,
metotreksat, mitoksantron, winkrystyna
MRP2
cisplastyna, doksorubicyna, etopozyd,
metoktreksat, mitoksantron, winkrystyna
BCRP
daunorubicyna, doksorubicyna, mitoksantron,
topotekan

ZAGADNIENIA NA ZALICZENIE
1.
Omów właściwości fizykochemiczne produktów II fazy
biotransformacji.
2.
Omów znaczenie II fazy metabolizmu.
3.
Wymień które enzymy II fazy metabolizmu biorą udział w
biotransformacji zarówno substancji egzo- jak i endogennych.
4.
Wymień enzymy i ich końcowe metabolity odpowiedzialne za
sprzęganie w II fazie metabolizmu.
5.
Omów układy enzymatyczne odpowiedzialne za biotransformację
NLPZ.
6.
Omów układy enzymatyczne odpowiedzialne za biotransformację
węglowodorów aromatycznych.
7.
Wymień układy enzymatyczne odpowiedzialne za
biotransformację alkoholi i fenoli.
8.
Wymień układy enzymatyczne odpowiedzialne za
biotransformację amin aromatycznych.
9.
Wyjaśnij czy polimorfizm genetycznym wpływa istotnie na
metabolizm leków.
10.
Wyjaśnij czy wiek ma wpływ na metabolizm ksenobiotyków.
11.
Omów spodziewany skutek terapii chloramfenikolem u kobiety
leczonej przewlekle fenobarbitalem.

Dziękuj
ę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
Wyszukiwarka
Podobne podstrony:
Pytania FINANSE Publiczn 2010-2011 dla II roku, Studia, III semestr, Finanse publiczne
Zadania na wykład RK X 2011 dla studentów, FINANSE I RACHUNKOWOŚĆ, Rachunek Kosztów
rachunkowośc 2011 dla studenta, Turystyka i rekreacja (TiR), podstawyrachunkowosci
CUN cz II 23 06 07 komentarz dla studentow
2010-2011 - Opiekunowie studenckich praktyk zawodowych w roku akademickim 2010-2011
filologia polska specjalnosc logopedia 2010 2011 (dla rozpoczynajacych I rok)
II faza, opornosc 2009 20010
Zagadnienia z fizyki dla studentow I roku, ZiIP PP 2010-2011, Semestr I, Fizyka techniczna
higiena dla studentów 2011 dr I Kosinska
Wyklad FP II dla studenta
DIETETYKApytania test pula - dla studentow 201001, Pielęgniarstwo, rok II, chirurgia, giełdy
imir-lab pytania dla studentow, AGH, I & II, Elektrotechnika
Plan i program praktyki dla studentów PEDAGOGIKI rozpoczynających studia w roku akadem 10 2011 i pó
Program praktyk pedagogicznych w przedszkolach dla studentów II roku Logopedii z audiologiąx
Zad MECH-IZR ESO II, Przykładowe zadania przygotowawcze dla studentów Wydziału Mechanicznego
Wprowadzenie do ekonometrii dla studentów część II, W tym przypadku y jest wektorem zaobserwowanych
więcej podobnych podstron