
Przedstawianie
wyników
analiz chemicznych

Przygotowanie danych
1. Przeliczenie wyników z mg/dm
3
na
formę miligramorównoważnikową
(mval/dm
3
)
2. Obliczenie udziału procentowego
poszczególnych jonów w składzie
chemicznym badanej próbki wody
3. Obliczenie błędu analizy

Przeliczenie:
mg/dm
mg/dm
3
3
na
mval/dm
mval/dm
3
3
gdzie: r – zawartość składnika wyrażona w formie
równoważnikowej
(w mval/dm
3
),
C – zawartość składnika w mg/dm
3
,
m
r
– masa równoważnikowa,
r
m
C
r
ć
ciowoś
warto
ś
jonowa
masa
r
m
Sposób 1

Przeliczenie: [mg/dm
3
] na
[mval/dm
3
]
Sposób
2
L
m
C
r
cz
gdzie: r – zawartość składnika wyrażona w formie równoważnikowej
(w mval/dm
3
),
C – zawartość składnika (w mg/dm
3
),
m
cz
– masa cząsteczkowa,
L – ładunek jonu (wartościowość)

Przeliczenie: [mg/dm
3
] na
[mval/dm
3
]
Sposób
3
Współczynnik
przeliczeniowy
Współczynnik
przeliczeniowy
Jon
B
Jon
B
Cl
-
0 , 0 2 8 2
K
+
0 , 0 2 5 5
S O
4
2 -
0 , 0 2 0 8
Na
+
0 , 0 4 3 5
HCO
3
-
0 , 0 1 6 3
C a
2
+
0 , 0 4 9 9
CO
3
2-
0 , 0 3 3 3
M g
2
+
0 , 0 8 2 2
Br
-
0 , 0 1 2 5
F e
2 +
0 , 0 3 5 8
J
-
0 , 0 0 7 9
F e
3
+
0 , 0 5 3 7
F
-
0 , 0 5 2 6
M n
2 +
0 , 0 3 6 4
NO
2
-
0 , 0 2 2 0
A l
3 +
0 , 1 1 1 2
NO
3
-
0 ,0 1 6 1
NH
4
+
0 , 0 5 8 7
B
C
r
gdzie: r– zawartość składnika wyrażona w formie równoważnikowej (w mval/dm
3
),
C – zawartość składnika (w mg/dm
3
),
B – współczynnik przeliczeniowy

Przykładowa tabela z przeliczonymi danymi
zawartość
składnik
mg/dm
3
mval/dm
3
% mval
HCO
3
-
317,2
5,2
51,5
SO
4
2-
134,4
2,8
27,7
Cl
-
74,4
2,1
20,8
r
A
10,1
100,0
Ca
2+
104,2
5,2
52,0
Na
+
66,7
2,9
29,0
Mg
2+
21,9
1,8
18,0
K
+
3,9
0,1
1,0
r
K
10
100,0
mineralizacja
722,7

Błąd
Błąd
analizy
analizy
100
[%]
A
K
A
K
B
r
r
r
r
gdzie:
r
K – suma milirównoważników
kationów,
r
A – suma milirównoważników
anionów.

Skrócone formy
zapisu
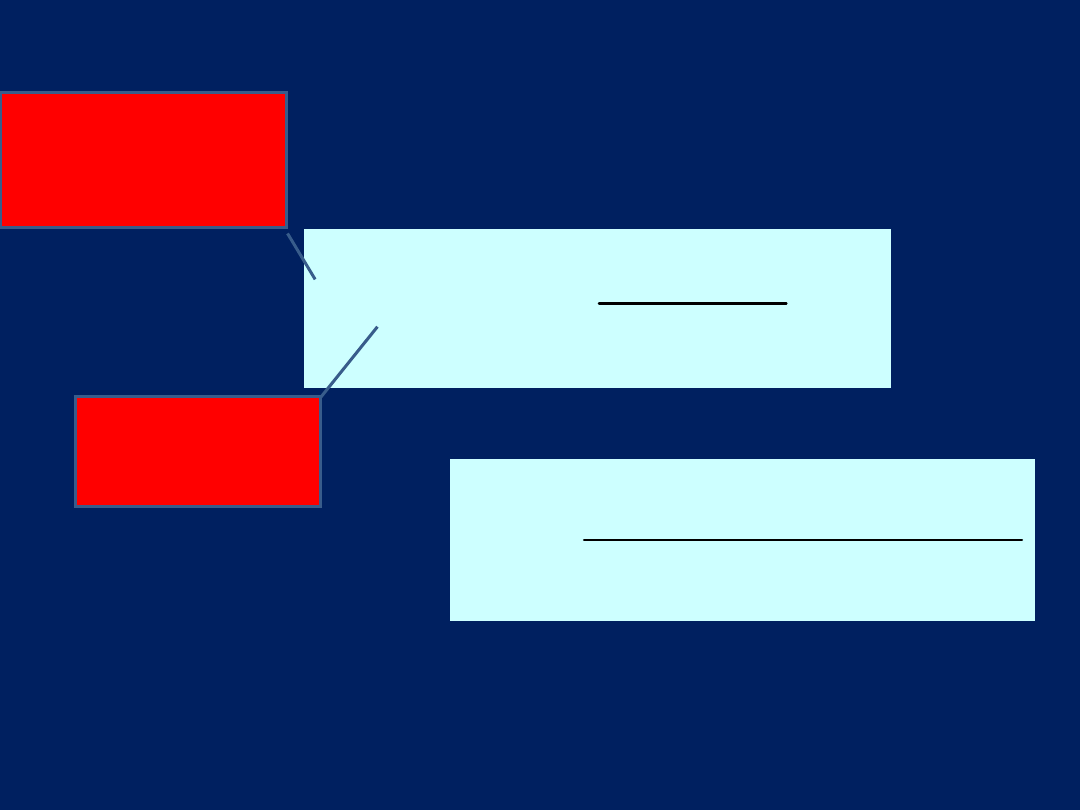
Wzór (formuła) Kurłowa
1
18
29
52
8
,
20
7
,
27
4
5
,
51
3
72
,
0
K
Mg
Na
Ca
Cl
SO
HCO
M
]
[
]
/
[
3
C
dm
g
T
kationy
aniony
M
G
Sp
Składniki
specyficzne
np. J, Br
gazy
Granica uwzględniania
1[%mval]

Zapis typu chemicznego
wody
wg Altowskiego-Szwieca
1. Uwzględnia się jony, których udział przekracza
17%mval
(w swojej grupie)
2. Nazwę typu wody rozpoczyna się od jonu,
którego udział jest największy,
niezależnie od tego czy jest to anion czy kation
3. Kolejne jony wymienia się zgodnie z
malejącym
udziałem
Np.:
HCO
3
-Ca-Na-SO
4
-
Cl-Mg
Typ chemiczny: woda wodorowęglanowo-wapniowo-sodowo-
-siarczanowo-chlorkowo-magnezowa

Odwzorowania wyników
pojedynczej analizy
chemicznej
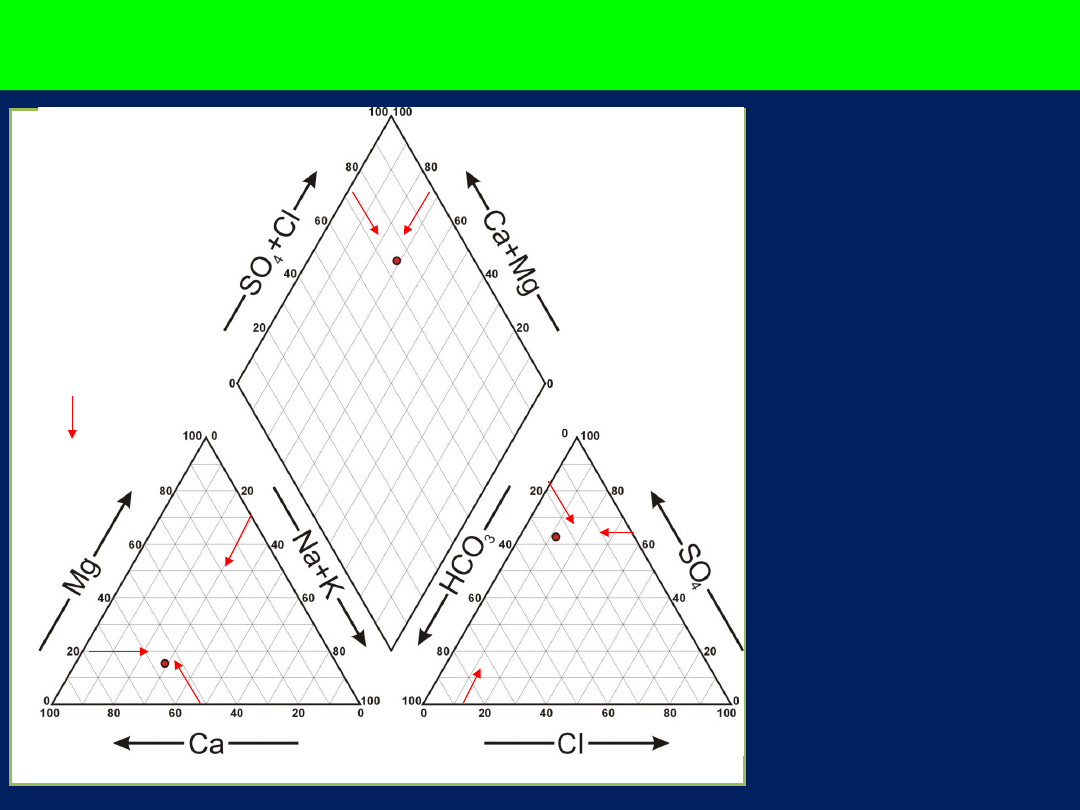
Diagram trójkątny (Pipera)
• Rzadko
stosowany do
przedstawiania
wyników
pojedynczej
analizy, raczej
do zbiorów
analiz
• Umożliwia
śledzenie
ewolucji składu
chemicznego
wód
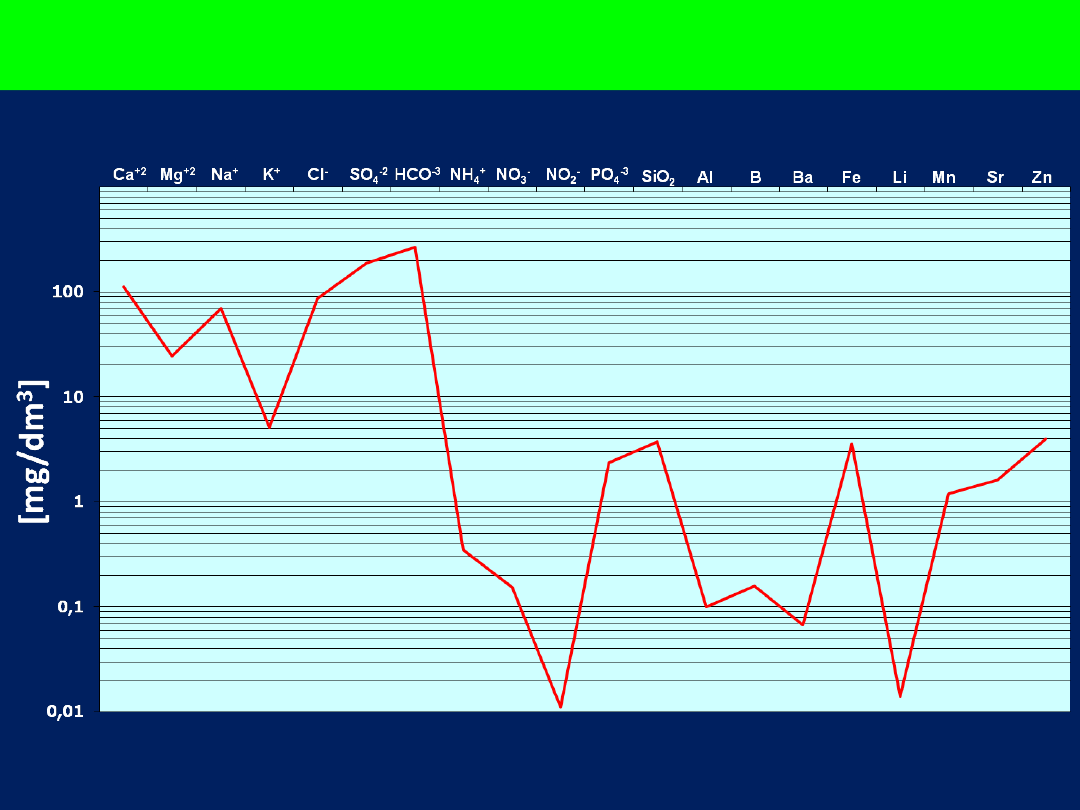
Diagram Schoellera
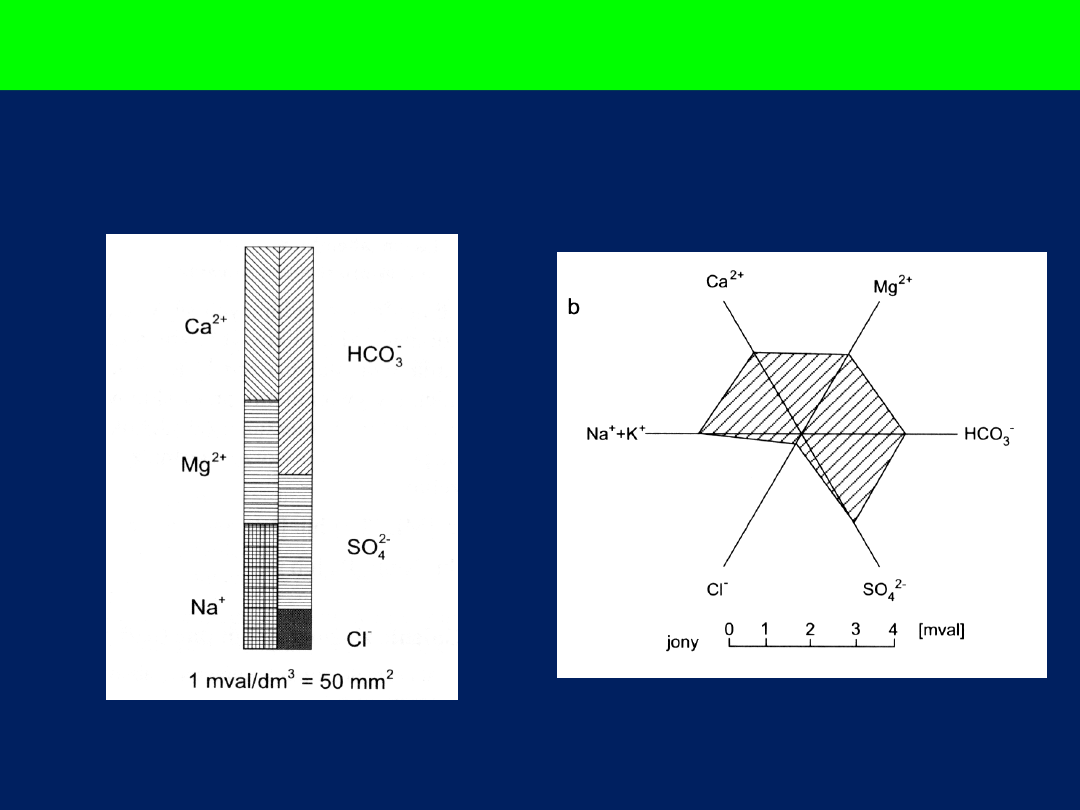
Diagramy
Collinsa
Tickela
Tickela
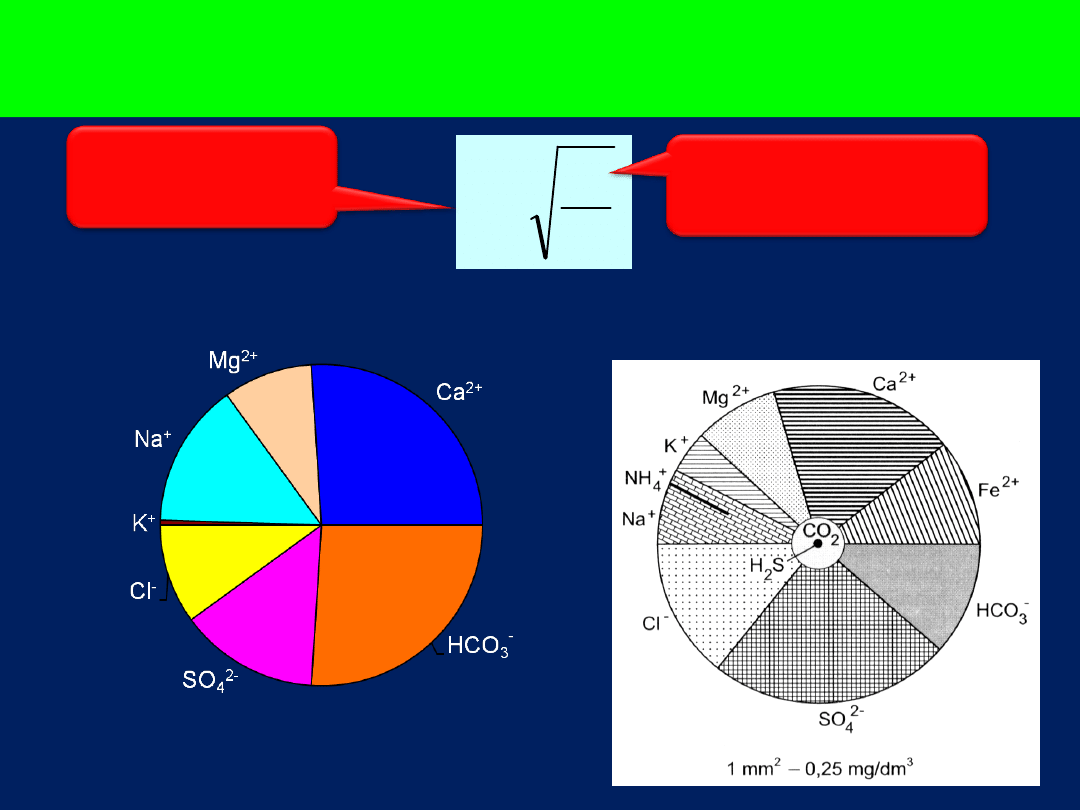
Diagram kołowy (Udlufta)
1mm
2
= 0,5mg/dm
3
M
r
Promień
koła
Mineralizacja
ogólna wody

Prezentacja zbiorów
analiz
Diagram Schoellera

Diagram Pipera

Literatura
:
1.
Macioszczyk A.: Hydrogeochemia. Wyd. Geol. Warszawa, 1987.
2.
Macioszczyk A., Dobrzyński M.,: Hydrogeochemia Strefy
aktywnej wymiany wód podziemnych. Wyd.PWN Warszawa
2002.
3.
Pazdro Z.: Hydrogeologia ogólna. Wyd. Geol. Warszawa, 1983.
4.
Kleczkowski A.S.: Hydrogeologia ziem wokół Polski. Wyd.Geol.
Warszawa 1979 .
5.
Paczyński
B., Sadurski A.(red): Hydrogeologia regionalna
Polski. Wyd. PIG Warszawa 2007
6.
Dowigałło J., Kleczkowiski A.S., Macioszczyk T., Różkowski A. (red.
nauk.): Słownik hydrogeologiczny, PIG, Warszawa 2002.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
czwiczenie1
4 Czwiczenia
Czwiczenia 4
1 Czwiczenia
czwiczenie 2 wprowadzenie
6 7 Czwiczenia
2 Czwiczenia, HYDROGEOLOGIA
Czwiczenia 3
6-7 Czwiczenia, HYDROGEOLOGIA
2 Czwiczenia
3 Czwiczenia
5 Czwiczenia, Ochrona Środowiska AGH, 2 rok, Hydrogeologia
Czwiczenia 2
Czwiczenie nr 0 procesy gleborworcze, 1. ROLNICTWO, Gleboznawstwo(1)
3 Czwiczenia, HYDROGEOLOGIA
5 Czwiczenia
więcej podobnych podstron