

Ogólne założenia
Białko występujące w płynach biologicznych wymaga
pewnego stopnia oczyszczenia, zanim zostanie
właściwie oznaczone (zmierzone), zbadane czy
zastosowane.
1.
Izolowanie białka od innych białek i cząsteczek
zostaje wykonane przez zastosowanie kombinacji kilku
metod opartych na takich właściwościach, jak
rozpuszczalność, ciężar cząsteczkowy, ładunek
cząsteczkowy i swoiste wiązanie się białka za
specyficznymi substancjami.
2.
Diagnostyka i cele terapeutyczne. Laboratoria
kliniczne rutynowo oczyszczają białka w celach
diagnostycznych. Np. białka osocza zwykle bada się
przez rozdział elektroforetyczny.

Techniki oczyszczania
1)
Rozpuszczalność białka jest uwarunkowana
stężeniem soli w roztworze.
Wysalanie. Dodając sole, takie jak siarczan amonu,
do roztworu białek wytrącamy niektóre z nich przy
określonym stężeniu soli, ale nie wytrącamy innych.
Taki typ separacji stosujemy w celu zwiększenia
ilości określonego białka w danej frakcji,
pochodzącej z bardzo złożonej mieszaniny białek,
takiej jak np. próbka osocza krwi.
Odsalanie. Niektóre białka do rozpuszczania w
wodzie wymagają obecności nieorganicznych jonów.
Długotrwała (intensywna) dializa wobec roztworu o
niskim stężeniu soli może więc spowodować
wypadanie niektórych białek z roztworu.

2)
Rozdział w oparciu o ciężar cząsteczkowy.
Dializa. Mieszaninę białek i małych rozpuszczalnych
związków można rozdzielić przez dializę z użyciem
półprzepuszczalnej błony. To czy dana cząsteczka
przejdzie lub nie przez błonę jest uwarunkowane
rozmiarem porów w błonie dializacyjnej.
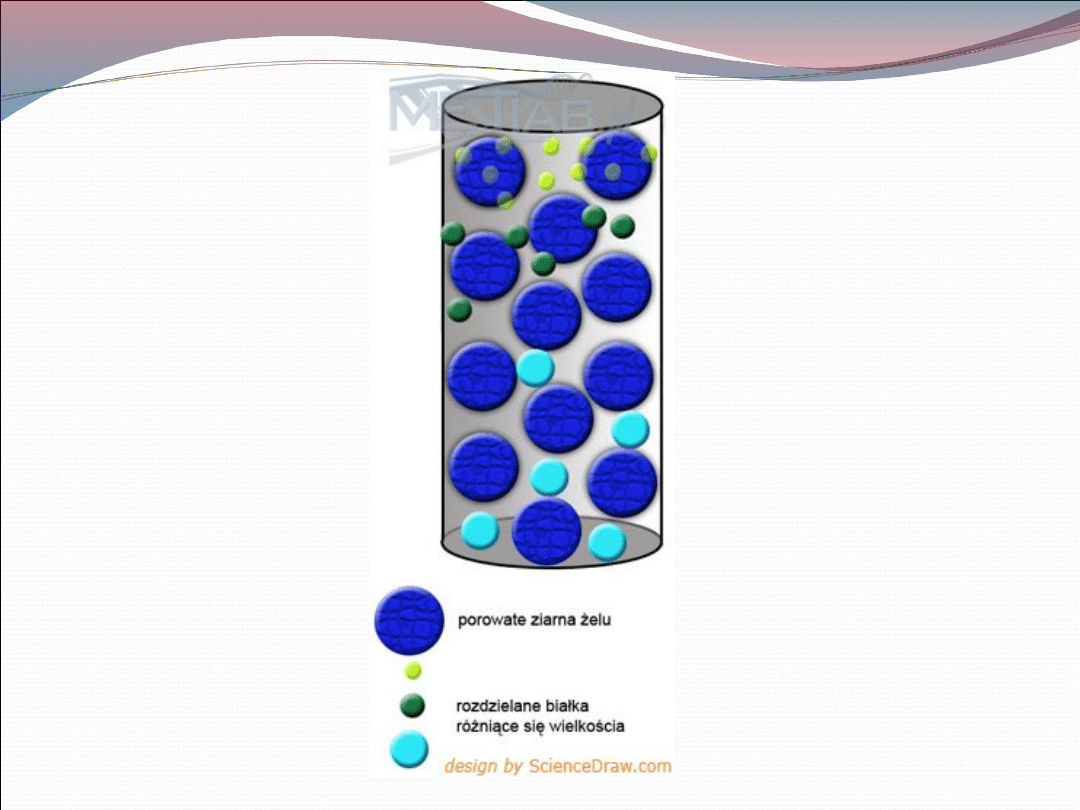
Sączenie molekularne (chromatografia
molekularno-sitowa, filtracja żelowa) wykorzystuje
kolumny z nierozpuszczalnego polimeru
węglowodanowego w kształcie porowatych ziaren.
Małe cząsteczki mogą wnikać do otworów ziaren a
duże nie. W związku z tym objętość rozpuszczalnika
dostępna dla małych cząsteczek jest większa niż dla
dużych i dlatego mniejsze cząsteczki przepływają
wolniej. Szybkość przepływu przez kolumnę zależy
od ich wielkości i kształtu. Sączenie molekularne jest
wykorzystywane zarówno do wyznaczania ciężaru
cząsteczkowego, jak i rozdziału białek.
Sączenie molekularne

Ultrawirowanie. Duża szybkość wirowania
powoduje rozdział roztworu białek na wiele
składowych.
Szybkość z jaką sedymentują (opadają) białka
podczas zastosowania siły odśrodkowej, zależy od
ich wielkości i kształtu. Im białka o podobnym
kształcie są większe tym szybciej sedymentują.
Dane z badań ultrawirowania często są
przedstawione w jednostkach Svedberga (S), które
odnoszą się do szybkości opadania białka podczas
wirowania.

Elektroforeza w żelu poliakrylamidowym z
dodecylosiarczanem sodu (SDS), wykonana
na usieciowanym żelu poliakrylamidowym, w
obecności SDS i czynnika redukującego, jak np.
β-merkaptoetanolu, rozdziela białka na
podstawie ciężaru cząsteczkowego.

3) Rozdział białek na podstawie ładunku
cząsteczki.
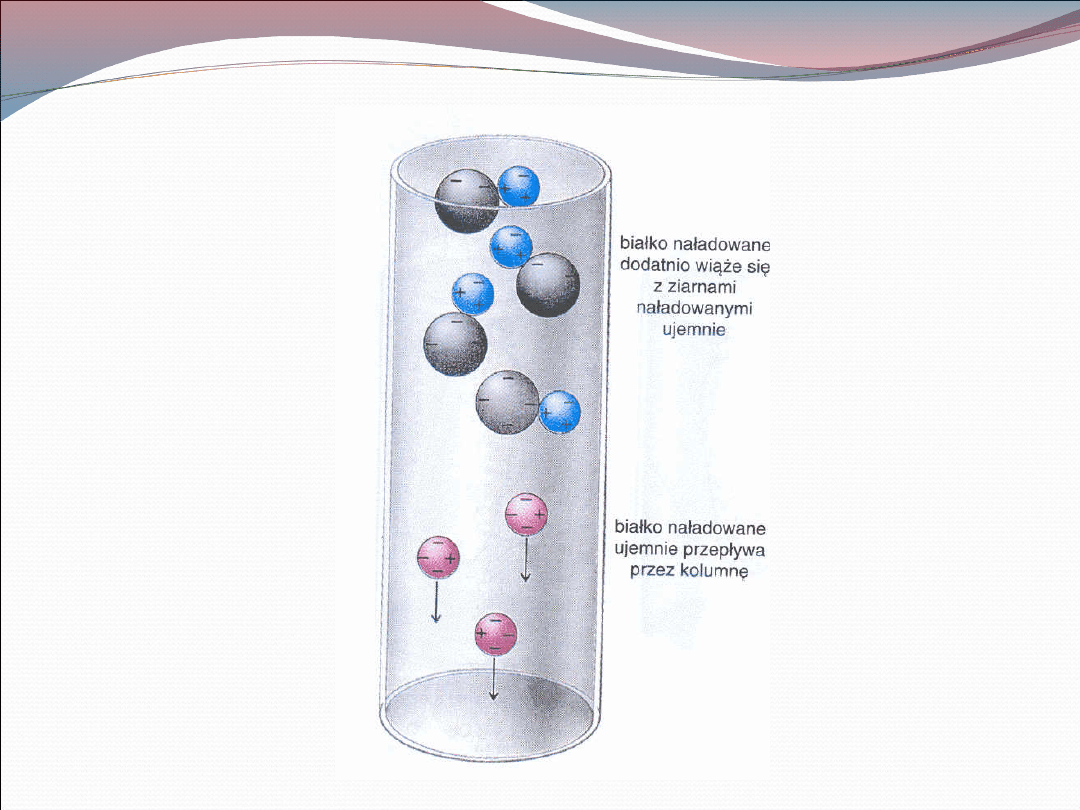
Chromatografia jonowymienna
Białka wiążą się z żywicą jonowymienną w kolumnie.
Siła związania konkretnego białka zależy od ilości reszt
dostępnych do interakcji z żywicą jonowymienną.
Stosowana jest kolumna z nierozpuszczalnym
materiałem jonowymiennym zawierającym grupy
polianionowe lub polikationowe. W odpowiednim pH
grupy te łączą odmiennie naładowane ugrupowania
poprzez interakcję jonową.
Białka mogą być wypłukiwane z wymieniacza przez
wymycie roztworem zawierającym sole , które niszczą
elektrostatyczne interakcje białek z żywicą
jonowymienną.
Jeżeli kolumnę przepłukuje się roztworem soli o
stopniowo wzrastającym stężeniu to słabo związane
białka będą wymyte przed silnie związanymi.

Wysokosprawna chromatografia cieczowa
(HPLC)
Jest podobna do chromatografii jonowymiennej i
innych chromatograficznych metod, w których
roztwór białek jest przepuszczany przez specjalne
złoża zawierające przyłączone boczne grupy wiążące
się w zależności od typu złoża, jonowo lub
chydrofobowo z białkami.
HPLC różni się od konwencjonalnych chromatografii
tym, że jest prowadzona przy zwiększonym
ciśnieniu. Tka wysokociśnieniowa chromatografia
jest szybsza, a wyniki wykazują lepszą rozdzielczość
niż w chromatografii niskociśnieniowej.

Elektroforeza. Metoda wykorzystująca pole
elektryczne do nadania ruchu jakimkolwiek
cząsteczką posiadającym ładunek. Naładowane
cząsteczki poruszają się w polu elektrycznym z
szybkością określoną stosunkiem ich ładunku do
masy oraz ich kształtem.
Metody elektroforetyczne:
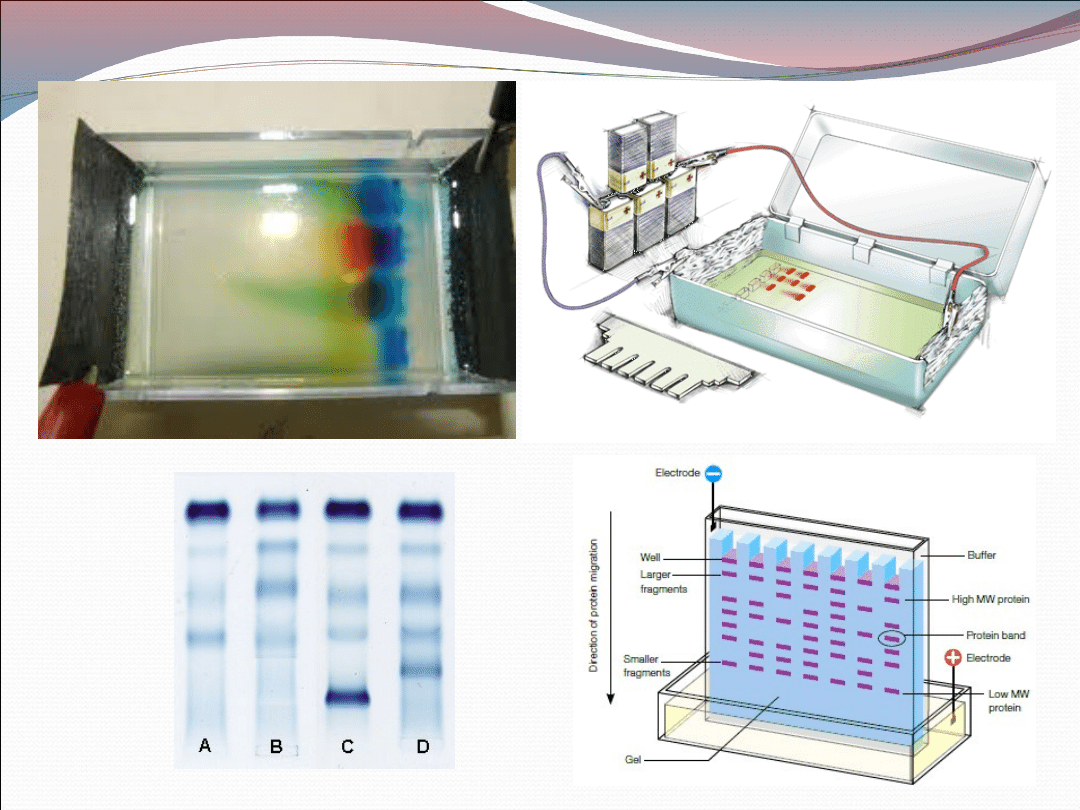
Elektroforeza żelowa jest często stosowana w
diagnostyce białek osocza. Próbka nanoszona jest
wąskim pasmem na matrycę (podłoże) i poddawana
elektroforezie w tym podłożu, które jest zwykle żelem
poliakrylamidowym lub agarozowym. Po
elektroforezie białka są wybarwiane. Poszczególne
białka ukazują się w różnych pasmach w zależności
od ich ładunku, rozmiaru i kształtu.

W izoelektrycznym ogniskowaniu, do utworzenia
gradientu wykorzystuje się kwasy
poliaminopolikarboksylowe o znanych wartościach pl.
(pl.-punkt izoelektryczny – pH w którym cząsteczka
nie ma ładunku wypadkowego i nie porusza się w
polu elektrycznym.) określone białko wędruje do
części gradientu o identycznym pl.
Elektroforeza w żelu poliakrylamidowym z SDS
rozdziela białka na podstawowe ich wielkości.
Kapilarna elektroforeza cieczowa jest techniką, w
której elektroforetyczny rozdział naładowanych
cząsteczek odbywa się w stanie wolnym w roztworze
w rurkach kapilarnych o bardzo małych otworach. Do
stabilizacji sił konwekcji niepotrzebne jest podłoże
(matryca), ponieważ w kapilarach ciepło
elektroforezy szybko się rozprasza.

4) Rozdział przez swoistą zdolność wiązania
(powinowactwo)
Chromatografia powinowactwa (adsorpcyjna)
Technika ta jest oparta na właściwości jaką mają niektóra
białka, a mianowicie możliwości silnego łączenia się z
inną cząsteczką (zwaną ligandem) przez specyficzne,
niekowalencyjne wiązanie
Ligand jest kowalencyjnie związany z powierzchnią
większych nawodnionych cząstek porowatego materiału,
tworząc kolumnę chromatograficzną. Jeżeli roztwór
zawierający mieszaninę białek jest przepuszczany przez
kolumnę, badane białko selektywnie absorbuje się i wiąże
z cząsteczkami liganda, podczas gdy inne białka
przepływają przez kolumnę bez przeszkód. Po odpłukaniu
resztek innych białek zaabsorbowane białko może być
wymyte bardziej stężonym roztworem czystego liganda,
który współzawodniczy o białko z ligandem związanym.


Precypitacja przeciwciałami
Przeciwciała to swoiste białka, które można otrzymać i
użyć do reakcji z żądanym białkiem, znajdującym się
w mieszaninie innych białek (np. wyciąg tkankowy czy
płyn ustrojowy). Interakcja białka i przeciwciała może
wytworzyć wystarczająco duży kompleks antygen-
przeciwciało, aby go oddzielić przez wirowanie,
umożliwiając odzyskanie poszukiwanego białka.
Do utworzenia większego kompleksu niż kompleks
antygen przeciwciało konieczne jest często dodanie
króliczych globulin anty-gamma do mieszaniny
przeciwciała z białkiem i odzyskania tego potrójnego
kompleksu przez wirowanie.
Podobnie jak ligand przeciwciała mogą być
przytwierdzone do nawodnionych matryc i tworzyć
kolumny w chromatografii powinowactwa.

Paulina Sołtys
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
Wyszukiwarka
Podobne podstrony:
12. Metody oczyszczania białek (1), Biotechnologia w Ochronie Środowiska
12. Metody oczyszczania białek (1), Biotechnologia w Ochronie Środowiska
Metody badania białek, Materiały - Biotechnologia
metody oczyszczania ścieków
Biologia ściągi, ściąga bio, Biologiczne metody oczyszczania ścieków:
chemiczne metody oczyszczania, Ekologia, Gospodarka odpadami, Energetyka, Ścieki przemysłu spożywcze
Biologiczne metody oczyszczania gleby
15[1]. Chartakterystyka i metody oczyszczania sciekow z zastosowaniem zloz biologicznych, pytania dy
metody oznaczania białek
W10 Oczyszczanie białek i badanie ich oddziaływań z kwasami nukleinowymi
Prezentacja Naturalne metody oczyszczania ścieków
MECHANICZNE METODY OCZYSZCZANIA SCIEKOW I ZWIAZANE Z NIMI TECHNOLOGIE, ochrona środowiska UTP bydgos
OPIS TECHNOLOGICZNY OCZYSZCZALNI, Wysokoefektywne metody oczyszczania ścieków
więcej podobnych podstron