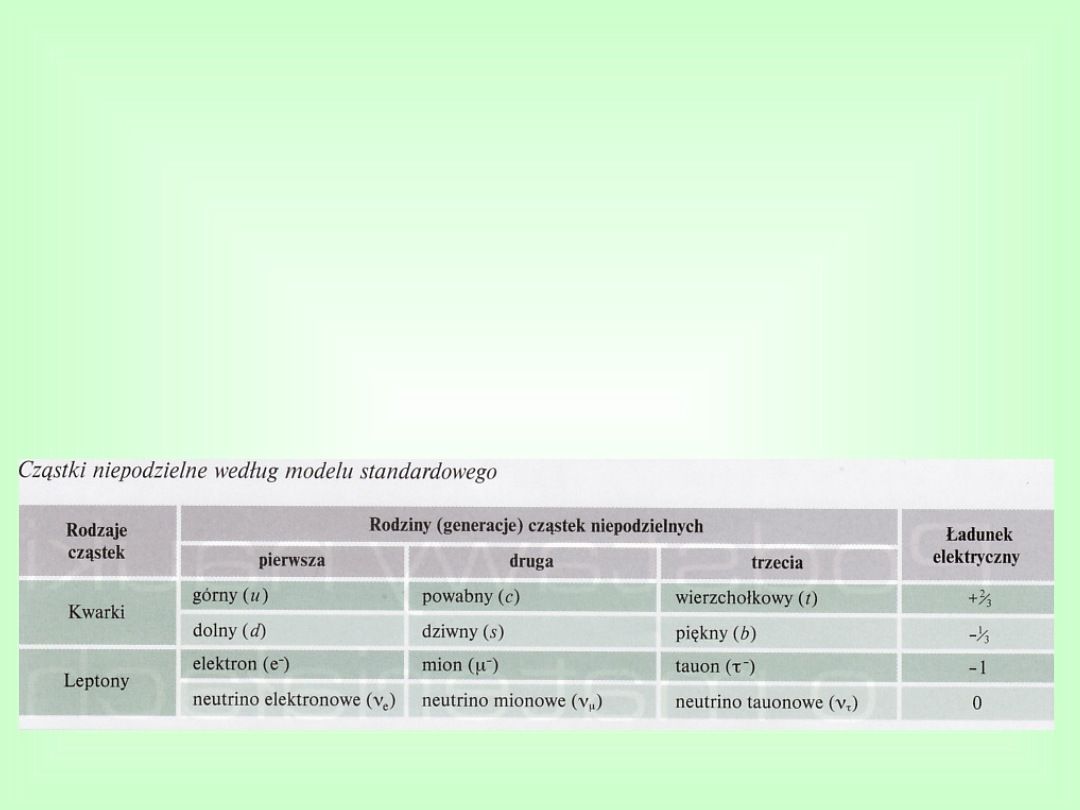
Materia i jej składniki
Materia składa się z wielu cząstek elementarnych (ponad
300)
Całość zjawisk związanych z elementarnymi cząstkami
materii i oddziaływaniami między nimi opisuje tzw.
model
standardowy
Według współczesnej wiedzy materia zbudowana jest z
6
kwarków i 6
leptonów, które są cząstkami niepodzielnymi,
wchodzącymi (w grupach lub pojedynczo) w skład innych
cząstek materii

Najważniejsze cząstki
elementarne
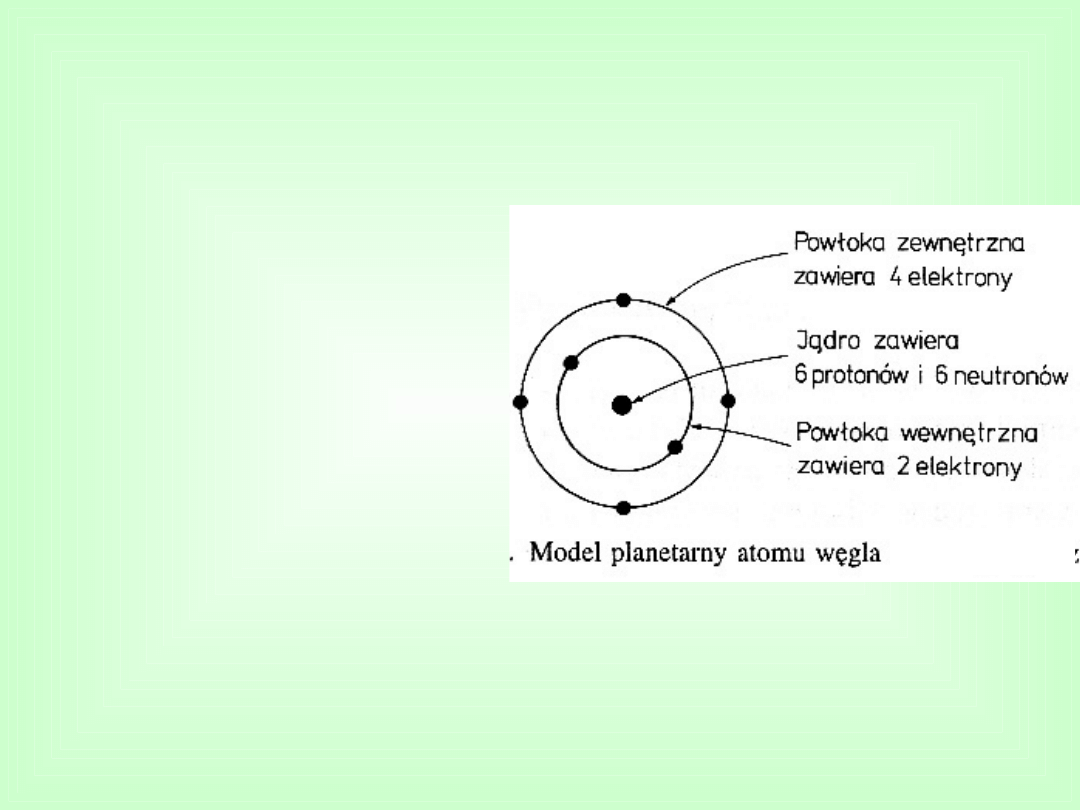
Klasyczny model budowy
atomu
Jądra o średnicy 10
-12
cm,
zawierającego
głównie
protony
i
neutrony,
skupiającego prawie całą
masę
atomu
i
posiadającego
ładunek
dodatni.
Liczba
elektronów
odpowiada
liczbie
protonów w jądrze, tak że
atom
jako
całość
jest
elektrycznie obojętny.
Atom zbudowany jest
z:
Części zewnętrznej o
średnicy 10
-7
– 10
-8
cm
zawierającej krążące wokół
jądra elektrony.
Oderwanie elektronu od
atomu
lub
przyłączenie
elektronu
do
atomu,
powoduje, ze staje się on
odpowiednio
jonem
dodatnim lub ujemnym.
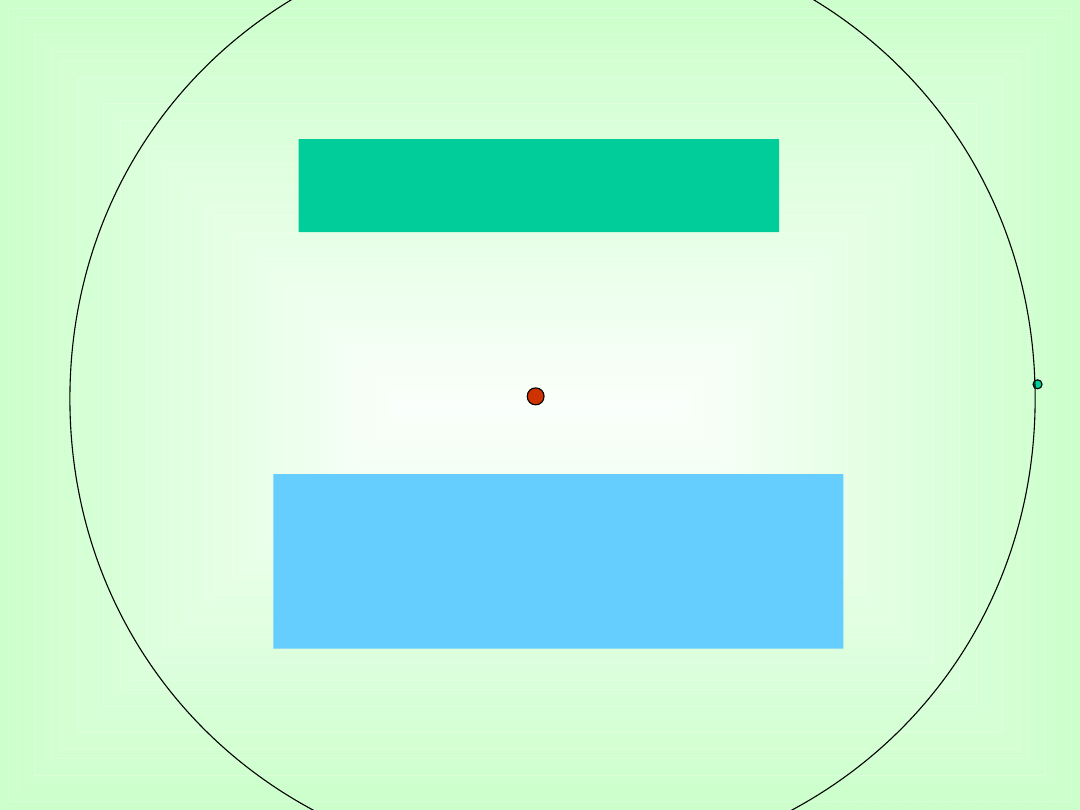
Wniosek: atomy są „puste”
Jądro - średnica - 10
-12
mm
Średnica atomu - 10
-7
mm
Model
Jądro = główka szpilki o średnicy
ok. 1mm
To średnica atomu = 10 m
Elektron
Jądro

Właściwości materii
Właściwości fizyczne i chemiczne materii zależą od:
Struktury elektronowej atomów, a w efekcie od rodzaju
tworzących ją pierwiastków.
Rodzaju wiązań występujących między atomami.
Sposobu ułożenia atomów.

Wiązania pomiędzy atomami
Spójność ciał stałych jest wynikiem działania sił
przyciągania pomiędzy atomami.
Tworzenie się wiązań między atomami polega na
wymianie lub uwspólnieniu elektronów walencyjnych
Ze względu na charakter sił przyciągania w ciałach stałych
występują następujące rodzaje wiązań:
Wiązania pierwotne –
jonowe, kowalencyjne (atomowe) i
metaliczne
,
Wiązania wtórne – międzycząsteczkowe zwane często
wiązaniami Van der Waalsa,
Wiązania mieszane.
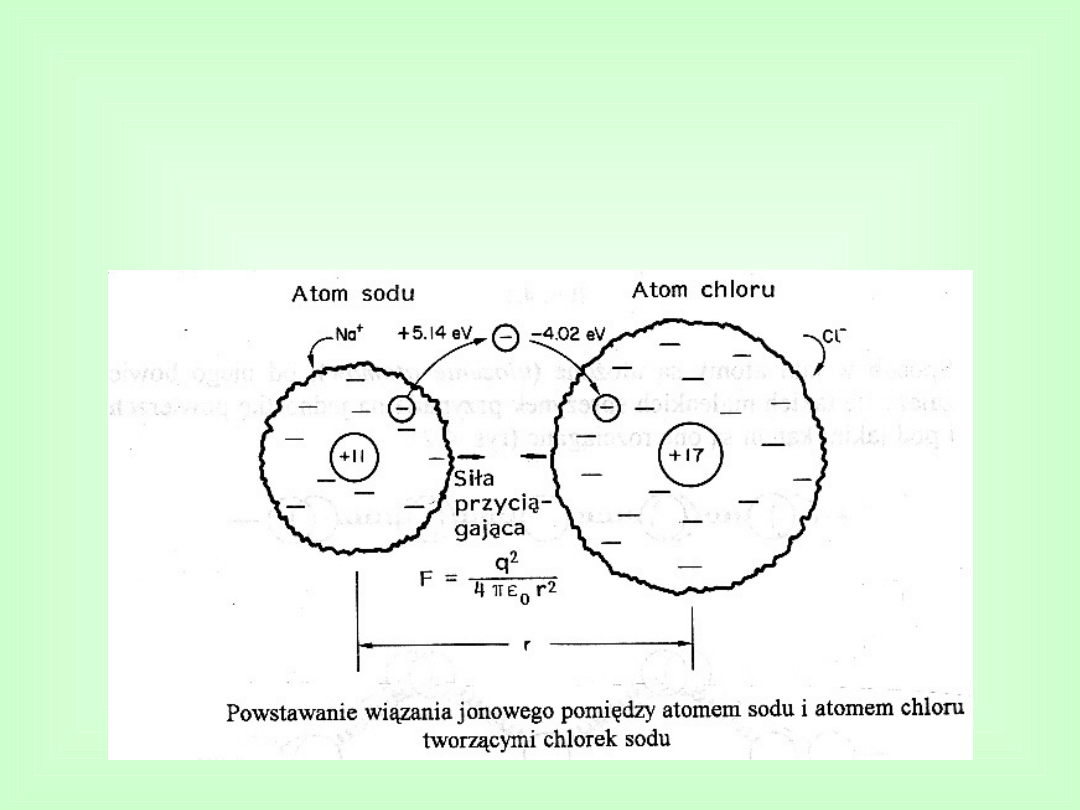
Wiązania jonowe
Polegają na elektrostatycznym przyciąganiu pomiędzy
dodatnimi i ujemnymi jonami.
Przykładem wiązań jonowych są te, które występują w
chlorku sodu (NaCl) czyli w popularnej soli kuchennej.
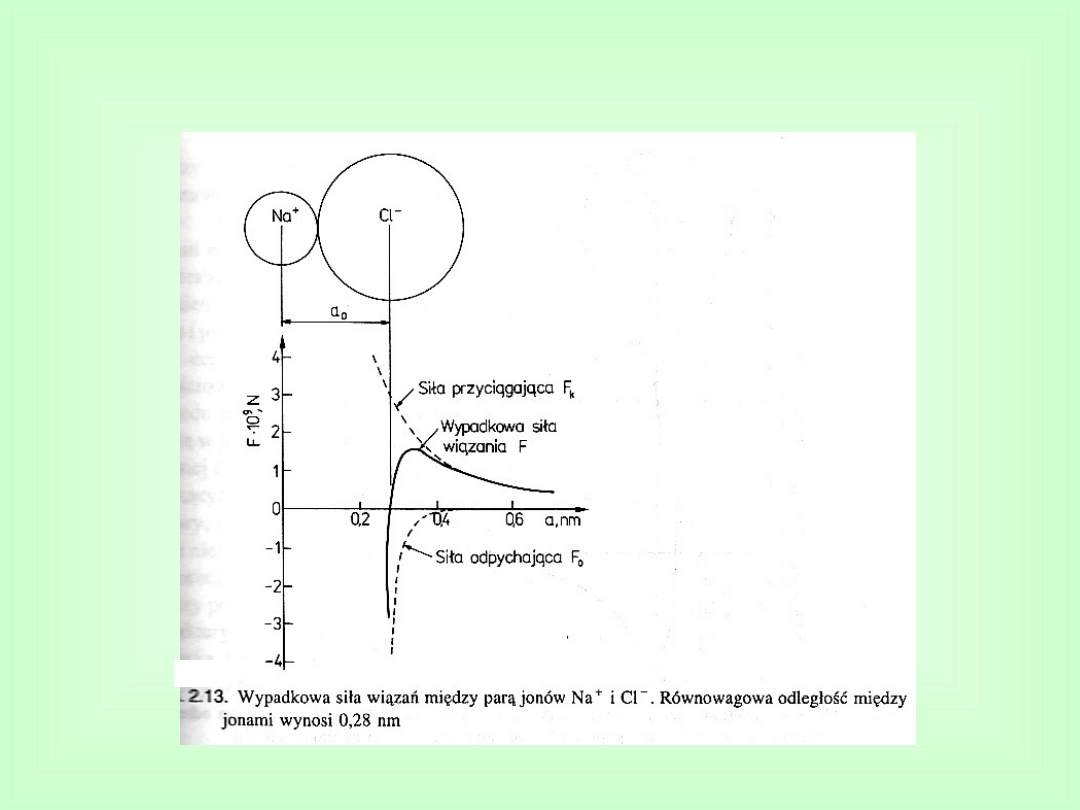
Wiązania jonowe
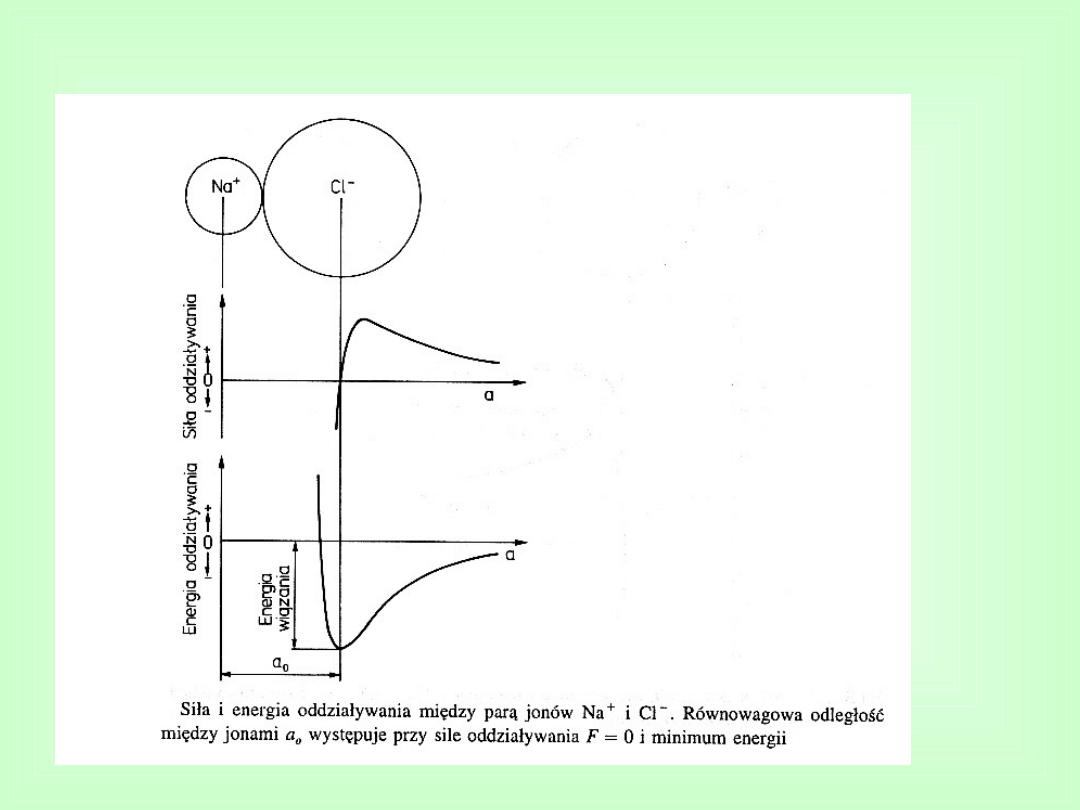
Równowagowej odległości
między jonami odpowiada
minimum
energii
oddziaływań,
nazywane
energią wiązania
Wiązania jonowe
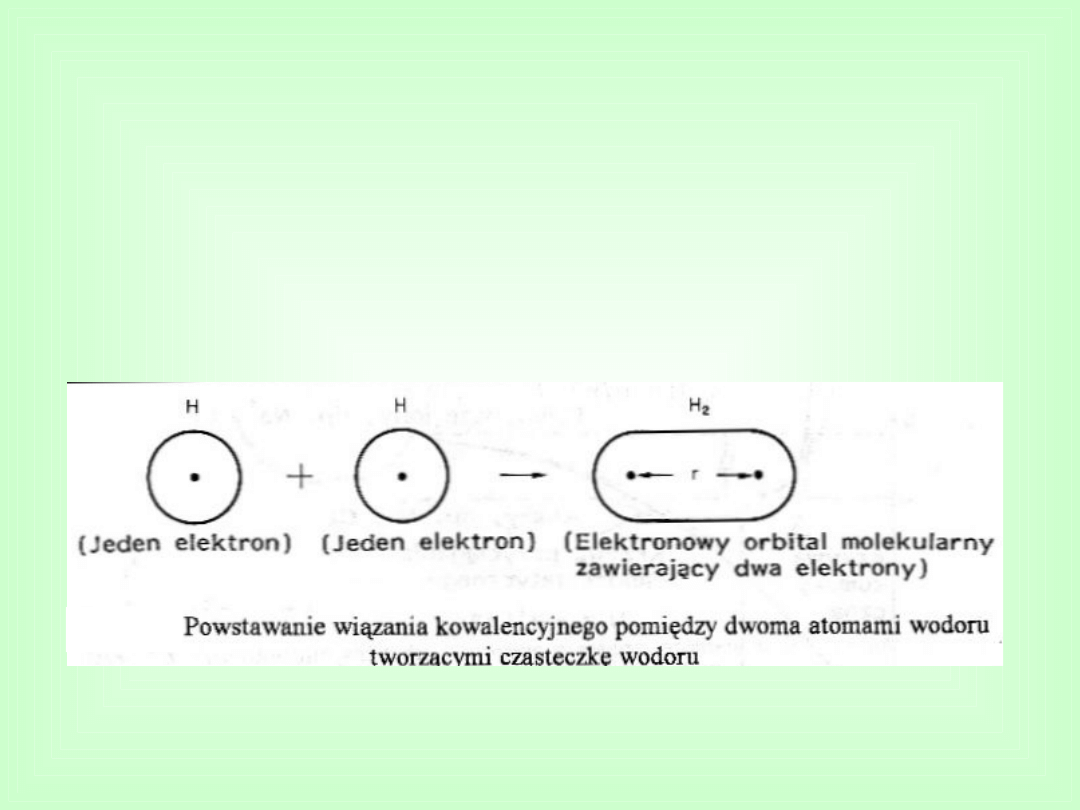
Wiązania kowalencyjne
Powstają w wyniku dążenia atomów do utworzenia
trwałych 2 lub 8 elementowych konfiguracji przez powstanie
wspólnych elektronowych par wiążących.
Przykładem wiązania kowalencyjnego jest wiązanie w
cząsteczce wodoru
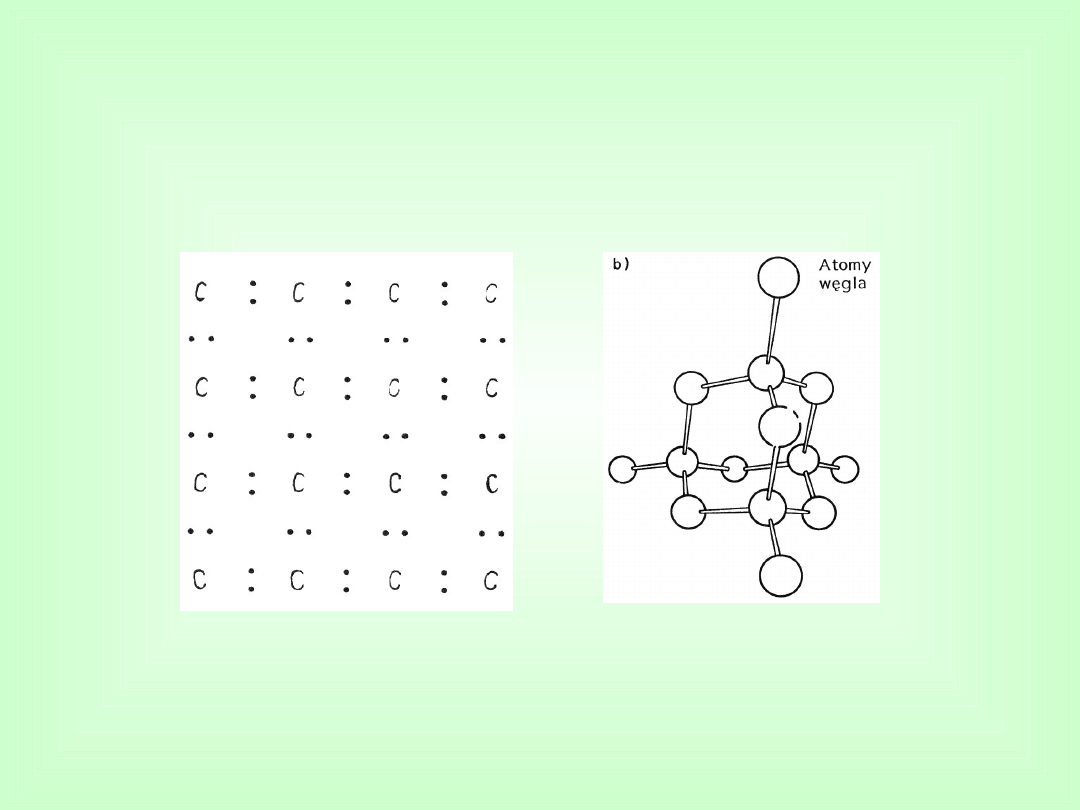
Przykładem „czystego” wiązania kowalencyjnego jest
wiązanie pomiędzy atomami węgla w
diamencie.
Wiązania kowalencyjne
Sieć krystaliczna diamentu
model dwuwymiarowy
Sieć krystaliczna diamentu
model przestrzenny

Wiązania kowalencyjne
Wiązania kowalencyjne są bardzo silne – dlatego
kryształy z tymi wiązaniami są bardzo twarde i
wytrzymałe i na ogół mają wysoką temperaturę topnienia.
Oprócz diamentu w prawie czystej postaci występują w
krzemie i germanie oraz w węgliku krzemu, natomiast
duży ich udział w takich metalach jak wolfram, molibden
czy tantal powoduje wysoką temperaturę topnienia tych
metali.

Wiązania metaliczne
Jak sama nazwa wskazuje są one dominującym (choć nie
jedynym) rodzajem wiązań występujących w metalach i
stopach metali.
W metalu elektrony o najwyższej energii mają tendencję do
porzucania „swoich” atomów (które stają się jonami) i
tworzenia „chmury” dość swobodnie poruszających się
elektronów tzw. gazu elektronowego.
Poruszające się pomiędzy jonami elektrony stanowią
„lepiszcze” wiążące jony na zasadzie elektrostatycznego
przyciągania
Właściwości gazu elektronowego uzasadniają takie
typowe właściwości metali jak : dobre przewodnictwo
elektryczne i cieplne, plastyczność i metaliczny połysk.
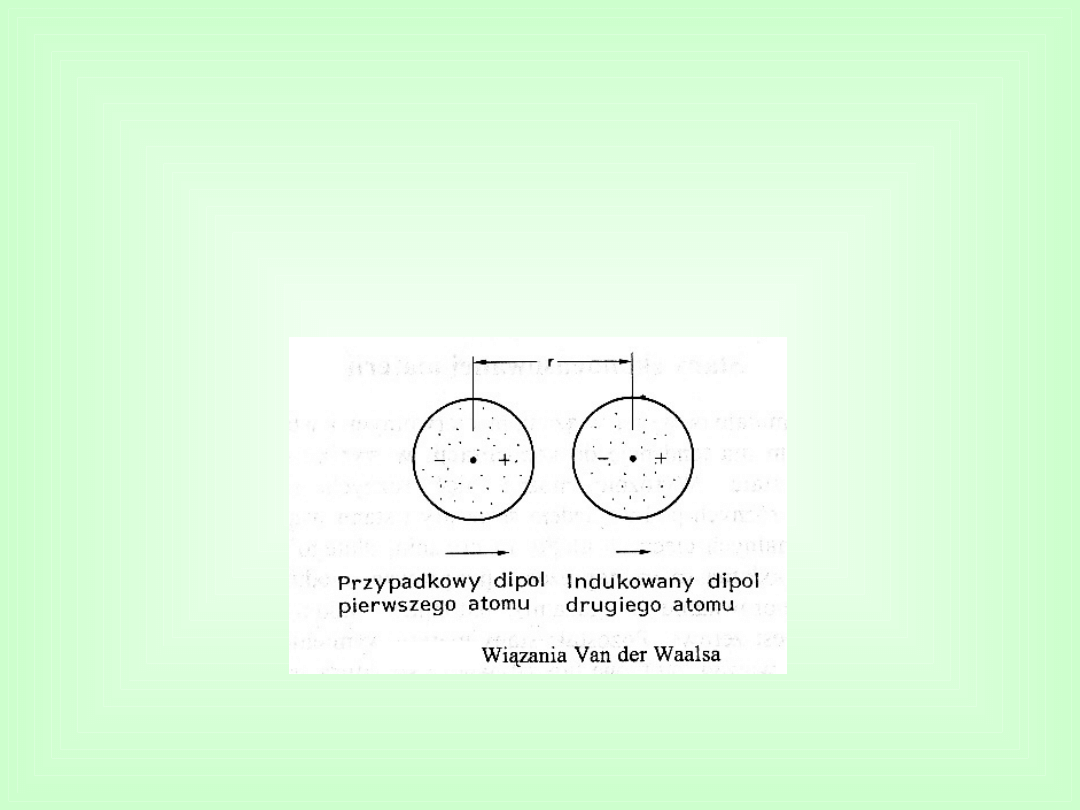
Wiązania wtórne
Wiązania Van der Waalsa
Należą do najsłabszych wiązań międzyatomowych, ale
bardzo istotnych.
Źródłem sił przyciągania w tego rodzaju wiązaniach są
dipole elektryczne tzn. cząsteczki lub atomy o pewnej
biegunowości, która wynika z asymetrii chwilowego
rozkładu ładunku przestrzennego atomu względem jądra.
Przykładem jest ciekły azot, który jest cieczą w
temperaturze -198
o
C dzięki siłom Van der Waalsa pomiędzy
cząsteczkami N
2
(o wiązaniach kowalencyjnych)
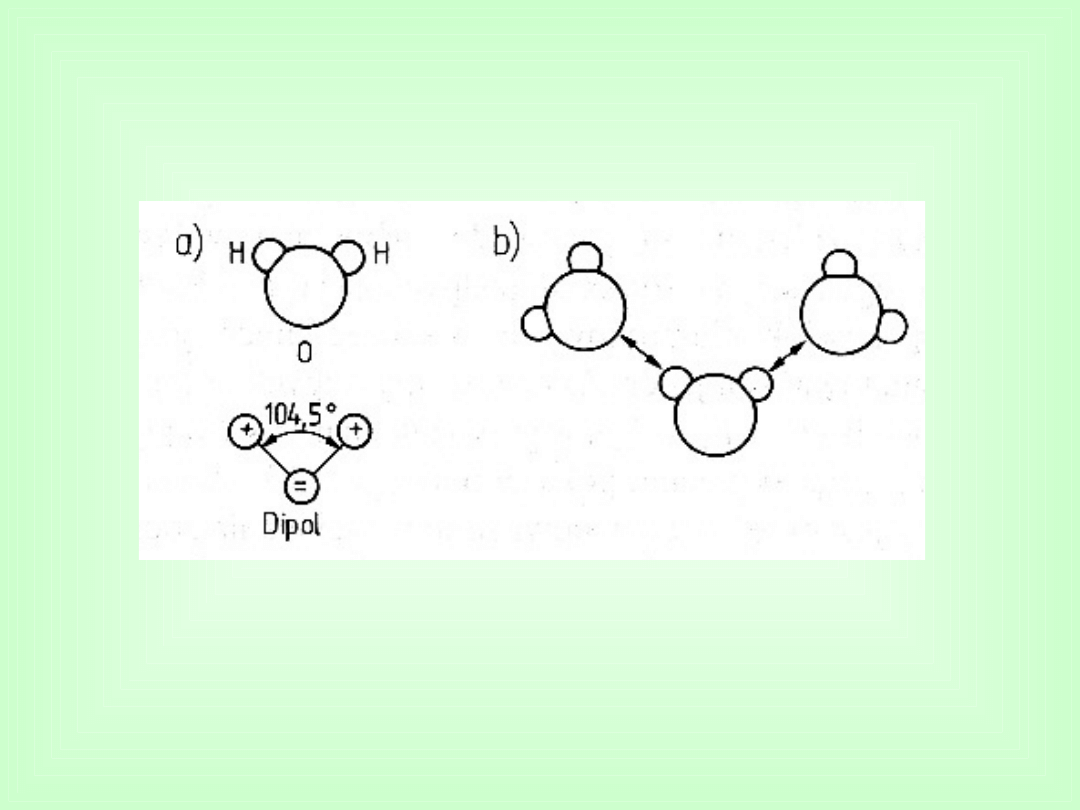
Wiązania wodorowe
Wiązania wtórne
Występują między innymi w wodzie i powodują, że jest ona
cieczą w „normalnych” warunkach.
Bez tych wiązań woda wrzałaby w temperaturze – 80
o
C i
życie w tej postaci, w jakiej je znamy na Ziemi, nie mogłoby
istnieć.
Łączą między sobą łańcuchy polimerowe, tworząc z nich
ciała stałe.
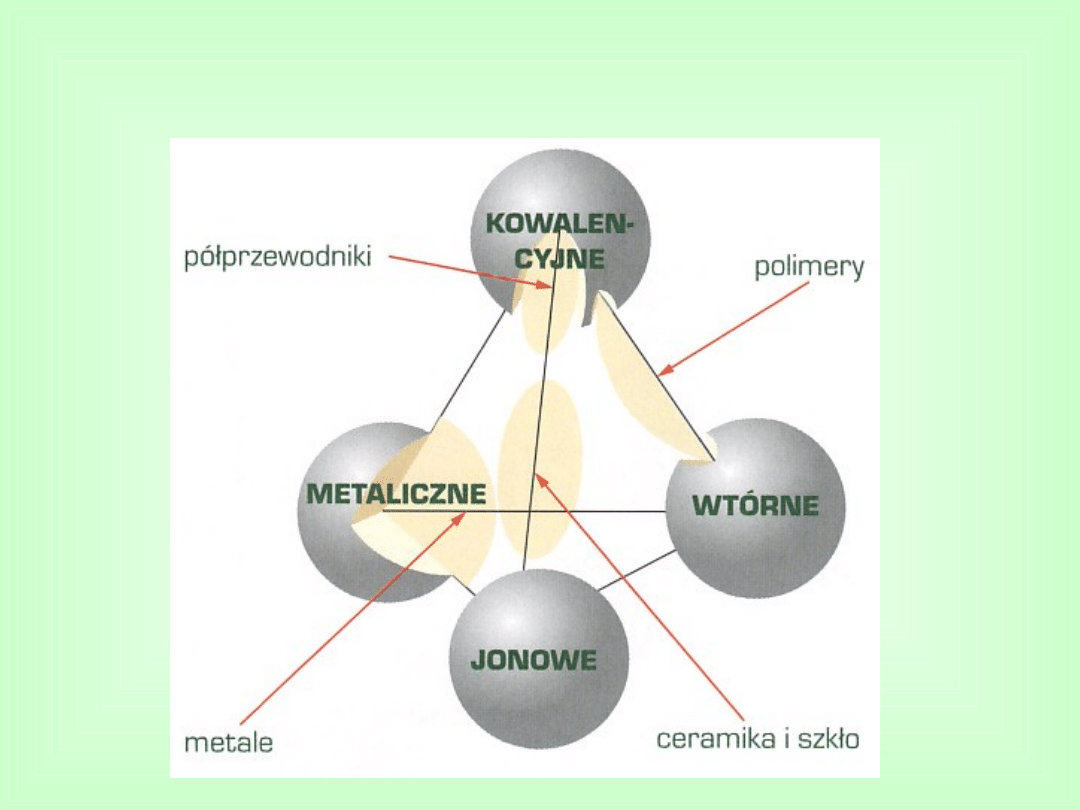
Rodzaje wiązań występujących w
podstawowych grupach materiałów
inżynierskich
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
02 materiały wykład II
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
02 - Materiały podkładowe, Stomatologia, Materiałoznawstwo stomatologiczne
oiur 02 materialy 01
Cw 02 Materia organiczna
02 materialy wyklad I id 549503 Nieznany (2)
0 02 Material pomocniczy z szer Nieznany (2)
02 Materiały Trudności specyficzne dysleksja
02 materiały wykład II
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
11.02 Siwiec-Barcik - Niewydolność oddechowa, MEDYCZNE -materiały z kursów, PACJENT WENTYLOWANY MECH
OOZ, Medycyna, Pobr materiały, VI rok-2015-10-02, VI rok, Zdrowie Publiczne
15.02.06-Anemia-materiały do wykładu, studia, 4 rok, farmakologia, materiały, C21W15-niedokrwistosci
rachunkowość ćwiczenia 25-02-2001, Materiały z zajęć, Rachunkowość
więcej podobnych podstron