
Odkrycia materiałów
promieniotwórczych
MateriaŁ promieniotwórczy
Każdy materiał zawierający izotopy
promieniotwórcze.

W końcu 1897 roku Maria
Skłodowska Curie zajeła się
zagadnieniem :
promieniowania uranu
Pierwsze badania Maria Skłodowska-Curie
rozpoczęła w bardzo prymitywnych
warunkach. W badaniach swoich
posługiwała się elektroskopem,
połączonym z komorą jonizacyjną.
Poddając systematycznie związki uranowe
różnym czynnikom chemicznym oraz
badając ich promieniowanie Maria
Skłodowska-Curie stwierdziła, że nowe
promieniowanie (Becquerela) jest
własnością uranu, niezależnie od tego w
jakim związku chemicznym uran
występuje.
Oddziaływania zewnętrzne jak grzanie,
oziębianie, naświetlanie różnym
promieniowaniem, pole magnetyczne
itd. nie wywierają żadnego wpływu na
własności uranu. Wtedy to Maria
Skłodowska-Curie po raz pierwszy na
świecie nazwała tę nową cechę
materii promieniotwórczością
(radioaktywnością)
Po przeprowadzonych obserwacjach
Maria Skłodowska Curie doszła do
wniosku że takie właściwości moga
mieć też inne pierwiastki.W tym
celu przeprowadziła dalsze
badania.
Badania doprowadziły ją do w 1898 r. Do
odkrycia kolejnego promieniotwórczego
pierwiastka - toru .
Maria Skłodowska-Curie, badając
systematycznie różne materiały pod
kątem ich promieniowania,zaczęła
badać też minerały zawierające uran i
tor.
Badając ich promieniotwórczość
spostrzegła, że niektóre z nich
(blenda smolista, chalkolit, autunit
czy toryt) nieoczekiwanie wykazują
wyższą aktywność niżby to
odpowiadało zawartości w nich
uranu
Maria Skłodowska Curie wraz z mężem
Piotrem Curie w 1898 r.wyodrebniła
nowe pierwiastki, które nazwała
radem i polonem.
Pierwiastki te znajdowały się w blendzie
smolistej – mierału którego złoża
występują w różnychczęściach globu
Uran
Wśród pierwiastków występujących
naturalnie na Ziemi ma największą
liczbę atomową (92) jest słabo
promieniotwórczy
.
W uranie naturalnym występują głównie
dwa izotopy 235U (mniej niż 1%) i 238U
(ponad 99% ).
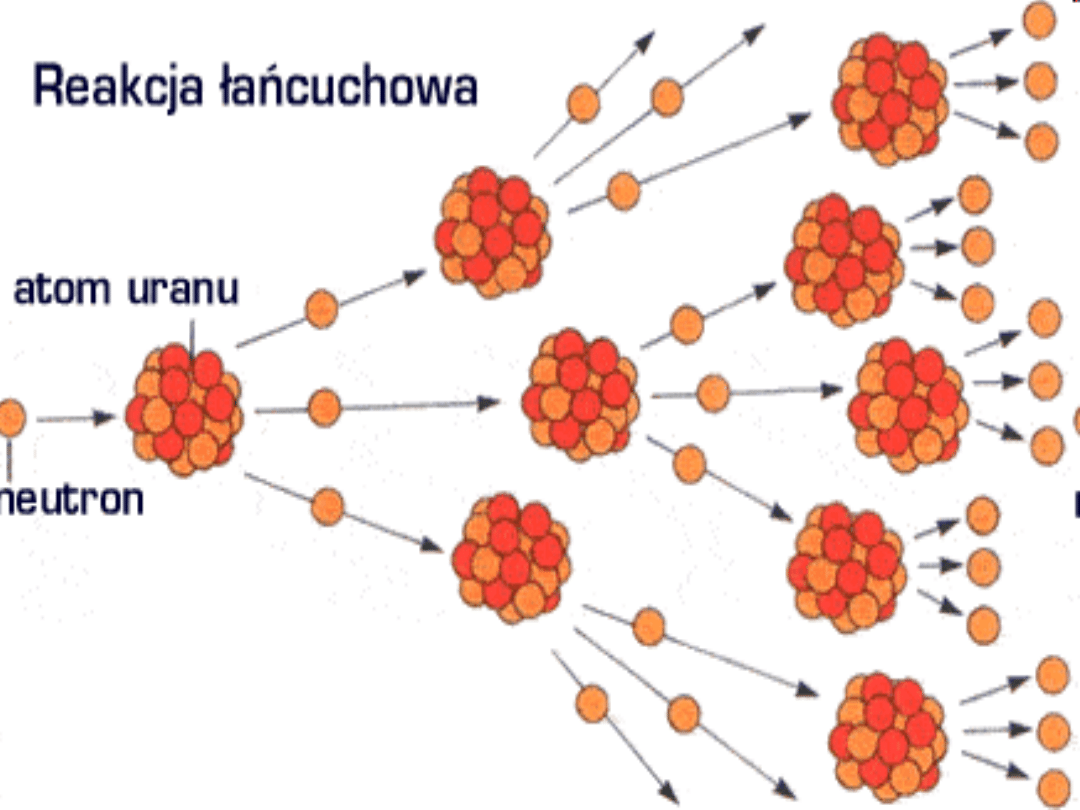
Izotop 235U ulega rozszczepieniu
spontanicznemu oraz pod wpływem neutronów
termicznych (rozszczepienie jądra atomowego) .
Izotop 238U pochłania neutrony i następnie
przekształca się w 239Pu (pluton), który jest
rozszczepialny.
Syntetyczny izotop 233U jest rozszczepialny,
otrzymuje się go przez bombardowanie 232Th
neutronami
.
Występuje w dużym stężeniu w
minerałach najważniejszymi
minerałami uranu są:
blenda uranowa
uraninit
Karnotyt
Największe złoża rud uranu znajdują
się w: Kongo (Wyżyna Katanga),
Północnej Kanadzie, USA (Utah,
Kolorado), w Jachymowie w Czechach,
Turkiestanie, Tiuji Mujun, Tybecie.

Blenda uranowa

Uraninit

Karnotyt

Zastosowanie uranu
:
Głównym zastosowaniem jest użycie izotopu 235U
jako materiału rozszczepialnego w bombach
jądrowych oraz reaktorach jądrowych, które znalazły
zastosowanie w elektrowniach atomowych oraz w
napędzie okrętów podwodnych. Uran naturalny
zawiera zbyt mało izotopu 235U by mógł być użyty
jako materiał rozszczepialny i wymaga
przetworzenia zwiększającego zawartość tego
izotopu w procesie zwanym wzbogacaniem. W
wyniku tego przetworzenia uzyskuje się uran
wzbogacony oraz odpad zwany uranem zubożonym.
Do wzbogacania uranu używa się wirówek
wzbogacających.
Teoretycznie jeden gram uranu (czyli
kulka o średnicy ok. 0,5 cm) może
dostarczyć ok. 20 miliardów dżuli
(20×109 J) energii. Jest to ilość
odpowiadająca spaleniu ok. 1,5 t węgla.
"Uran jest zatem na razie najbardziej
skondensowanym źródłem energii
wykorzystywanym przez człowieka".
Tor
Tor występuje w skorupie ziemskiej w ilości
12 ppm czyli około sześciokrotnie częściej
niż uran. Najważniejszym minerałem toru
jest monacyt
Tor występujący naturalnie składa się
praktycznie wyłącznie z izotopu 232Th.
Izotop ten jest nietrwały, jednak ze
względu na długi (14 mld. lat) czas
połowicznego rozpadu, radioaktywność
produktów wykorzystujących oczyszczony
tor jest niewielka.
Zastosowanie:
Tor jest ważnym dodatkiem stopowym,
zwiększającym wysokotemperaturową
wytrzymałość metali, np. magnezu.
Stosuje się go również w czujnikach
fotoelektrycznych, jako dodatek stopowy
(w ilości 2%), do "czerwonych" elektrod
wolframowych stosowanych w metodzie
spawania TIG, a tlenek toru w
wysokogatunkowych soczewkach.
Tor, tak jak uran i pluton, może być użyty
jako paliwo w reaktorach jądrowych. Jako
paliwo jądrowe jest potencjalnie dużo
lepszym kandydatem niż powszechnie
stosowany uran. Przede wszystkim w
reakcji rozpadu nie powstaje pluton tylko
uran-233 (pierwiastek praktycznie nie
nadający się do skonstruowania broni). Po
drugie reaktor oparty na torze może z
powodzeniem spalać odpady radioaktywne
z tradycyjnych uranowych elektrowni
jądrowych. Po trzecie w przeciwieństwie do
cyklu jądrowego opartego na uranie gdzie
98% procent paliwa nie ulega spalaniu (i
tworzy kłopotliwe odpady radioaktywne),
tor w niektórych typach reaktorów może
ulec spaleniu w całości eliminując problem
odpadów.
Rad
Rad posiada 33 izotopy. Wszystkie jego izotopy są
niestabilne. Najtrwalszy z nich jest izotop 226,
który ma czas połowicznego rozpadu 1599 lat.
Izotopy radu występujące w szeregu
promieniotwórczym aktynu i toru noszą nazwy
zwyczajowe:
223Ra: aktyn X, AcX (powstaje z 227Ac po
rozpadzie α i β; szereg uranowo-aktynowy)
224Ra: tor X, ThX (powstaje z 228Th po
rozpadzie α; szereg torowy)
228Ra: mezotor I, MsThI lub MsTh1 (powstaje
z 232Th po rozpadzie α; szereg torowy)
Zastosowanie
Najważniejsze związki radu to sole Ra2+ (chlorek i
węglan) które były używane w terapii
nowotworowej i do produkcji farb
luminescencyjnych. Obecnie rad nie jest już
stosowany, ze względu na dużą radioaktywność,
powodującą białaczkę u osób uczestniczących w
produkcji soli radu.
Znaczenie biologiczne:
Rad pośrednio zwiększa szybkość mutagenezy
organizmów, szczególnie żyjących w jaskiniach.
Średnia zawartość radu w kościach i tkankach
ludzkich wynosi ok. 2x10-9 ppm. Działanie
mutacyjne radu w środowisku jaskiniowym
spotęgowane jest przez radon, który powstaje z
radu i przenika do izolowanej atmosfery jaskini.
Obecność radu w dzisiejszym środowisku
naturalnym człowieka jest związana m.in. z
kopalinami wchodzącymi w skład betonu. Rad
dostający się do organizmu drogą oddechową jest
10 razy bardziej kancerogenny niż spożyty.
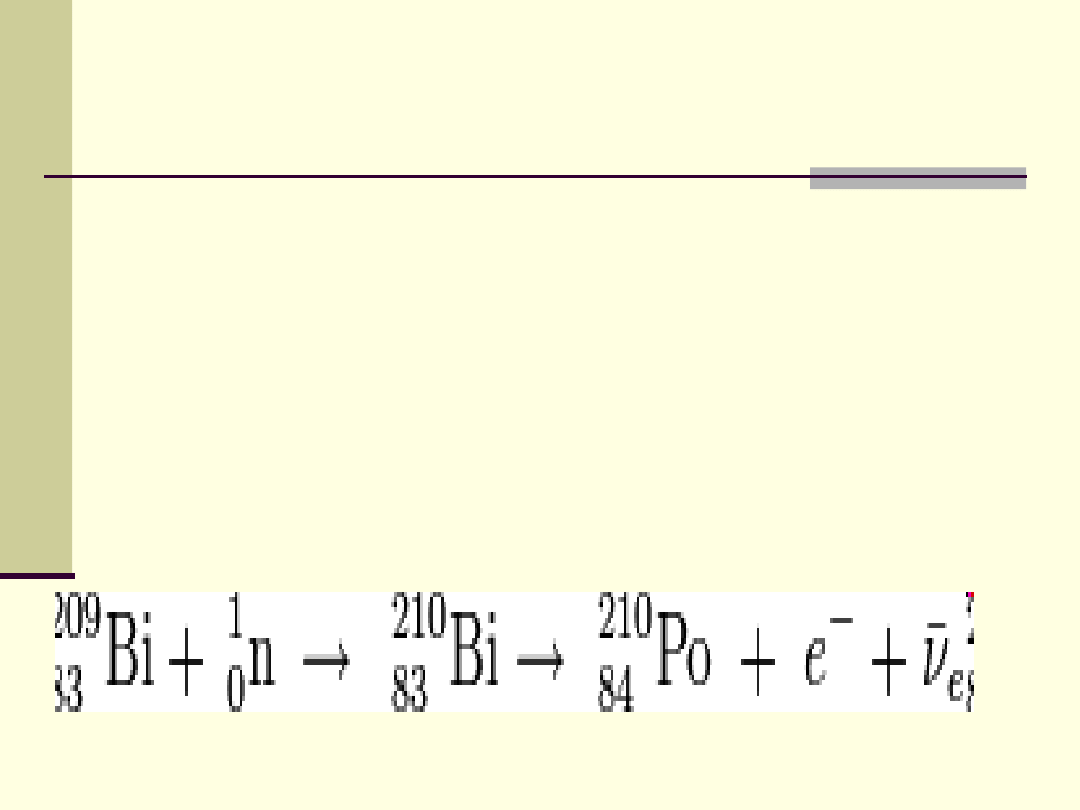
Polon
Polon występuje w skorupie ziemskiej w śladowych
ilościach w rudach uranu oraz jako tlenek. Jego
stężenie w tych rudach jest jednak tak małe, że
przemysłowo opłaca się go otrzymywać na drodze
wcześniej wspomnianego bombardowania
bizmutu neutronami:
Posiada 33 izotopy z przedziału mas 188-220.
Nie posiada trwałych izotopów. Względnie
najtrwalszy jest izotop 209 (okres
połowicznego rozpadu 103 lata),
paradoksalnie nie występuje on jednak
naturalnie, lecz został otrzymany w wyniku
sztucznej syntezy jądrowej poprzez
bombardowanie bizmutu neutronami.
Najtrwalszym, naturalnie występującym
izotopem jest izotop 210. Okres połowicznego
rozpadu tego izotopu to 138,3 dni. Produktem
tego rozpadu jest stabilny izotop ołowiu
206Pb.
Działanie na organizmy żywe
Polon wprowadzony do organizmu jest silnie toksyczny.
LD50 dla polonu wynosi ok. 1 mikrograma, co czyni go
ok. 250 000 razy bardziej trującym niż cyjanowodór.
Emitowane cząstki alfa z łatwością niszczą strukturę
tkanek ludzkiego organizmu, jeśli tylko dostanie się on
tam poprzez inhalację, połknięcie lub absorpcję. Polon nie
przenika przez skórę, toteż znajdując się na zewnątrz
ciała nie stanowi tak wielkiego zagrożenia. Izotopy polonu
214Po i 218Po, jako produkty rozpadu radonu w
śladowych ilościach znajdują się w powietrzu wewnątrz
pomieszczeń. Corocznie w Stanach Zjednoczonych
powodują one 15-22 tys. zgonów na raka płuc.
Dodatkowe zagrożenie stwarza palenie tytoniu, do
którego liści przenika polon obecny w nawozach
fosforowych. Duże stężenie polonu-210 stwierdzono w
organizmie Aleksandra Litwinienki, otrutego w listopadzie
2006 roku w Londynie. Polon prawdopodobnie pochodził z
jednego z rosyjskich reaktorów jądrowych i został mu
podany w herbacie. Litwinienko zmarł w ciągu 23 dni.
LITERATURA:
John Simmons „100 Najwybitniejszych
uczonych wszech czasów”
„Wikipedia” Internet
DZIĘKUJEMY ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
07 04 Materialy promieniotworcze i radioaktywne
Ćwiczenia 3, Biofizyka, IV Semestr, Materia i promieniowanie, ćwiczenia
Ćwiczenia 2, Biofizyka, IV Semestr, Materia i promieniowanie, ćwiczenia
MATERIALY PROMIENIOTWORCZE, BHP, STRAŻAK
Ćwiczenia 4, Biofizyka, IV Semestr, Materia i promieniowanie, ćwiczenia
Ćwiczenia 1, Biofizyka, IV Semestr, Materia i promieniowanie, ćwiczenia
07 04 Materialy promieniotworcze i radioaktywne
Ćwiczenia 3, Biofizyka, IV Semestr, Materia i promieniowanie, ćwiczenia
Wpływ promieniowania jonizującego na materiał biologiczny
Nielaserowe promieniowanie optyczne materialy szkoleniowe
GENETYKA, Szkoła, Biologia, genetyka, gen prezentacje, Najnowsze odkrycia w dziedzinie genetykiFigur
b11 ?danie osłabienia promieniowania przy przechodzeniu przez materię
Oddziaływanie promieniowania jonizującego z materią
4 oddzialywanie promieniowania z materia reakcje jadrowe
Materiały dydaktyczne, TABLICA 46, Skutki odkryć geograficznych
LABFIZ01, Promieniowanie i struktura materii
Oddziaływanie promieniowania jonizującego z materią
więcej podobnych podstron