
Układy
koloidal
ne
Tomasz Jezierski, WB I,
Gr. 4
CHEMIA

Co to takiego układy
koloidalne?
Układ koloidalny (inaczej: koloid, układ
koloidowy, roztwór koloidalny) to
niejednorodna mieszanina, zwykle
dwufazowa, tworząca układ dwóch
substancji, w którym jedna z substancji
jest rozproszona w drugiej. Rozdrobnienie
(czyli dyspersja) substancji rozproszonej
jest tak duże, że fizycznie mieszanina
sprawia wrażenie substancji jednorodnej,
jednak nie jest to wymieszanie na
poziomie pojedynczych cząsteczek.

Koloidy są stanem pośrednim pomiędzy
roztworami rzeczywistymi, które są
układami fizycznie jednorodnymi o
rozdrobnieniu cząsteczkowym a
zawiesinami i mieszaninami
niejednorodnymi.
Pojęcie koloidu do chemii po raz pierwszy
wprowadził Graham, dla określenia
substancji o właściwościach zbliżonych do
kleju.
Do koloidów należą zarówno:
• układy fizycznie jednorodne
• roztwory substancji
wielkocząsteczkowych
• układy fizycznie niejednorodne o dużym
stopniu rozdrobnienia - koloidy fazowe.

Część układu tworzącą fazę ciągłą
stanowi ośrodek dyspersyjny
(rozpraszający), a drugą stanowi fazę
zdyspergowaną (rozproszoną).
Cząstki fazy rozproszonej dla kolidów
mają rozmiary od 1nm do 100nm,
czyli od 10
-7
do 10
-5
cm.
Cząstki fazy rozproszonej mogą mieć
kształty blaszkowate, nitkowate oraz
kuliste.
Wyróżnia się układy monodyspersyjne
- koloidy w których cząstki fazy
rozproszonej mają jednakową wielkość
oraz - polidyspersyjne, w których
cząstki mają różne wymiary.

W zależności od wartości dyspergowania
koloidy dzieli się na:
• koloidy asocjacyjne
-
układy w których
substancja rozproszona samorzutnie przechodzi w
stan koloidalny.
• koloidy dyspersyjne
- układy, w których
substancję rozproszoną otrzymuje się przez
wymuszone rozdrobnienie.
W zależności od powinowactwa do
rozpuszczalnika, koloidy dzieli się na:
• koloidy liofilowe
(hydrofilowy dla układów, gdzie
ośrodkiem rozpraszającym jest woda) mające duże
powinowactwo do rozpuszczalnika, dzięki czemu
cząstki koloidalne otaczają się cząsteczkami
rozpuszczalnika, co nadaje im trwałość.
• koloidy liofobowe
(hydrofobowe) posiadające
małe powinowactwo do rozpuszczalnika i na swojej
powierzchni gromadzące ładunek elektryczny.
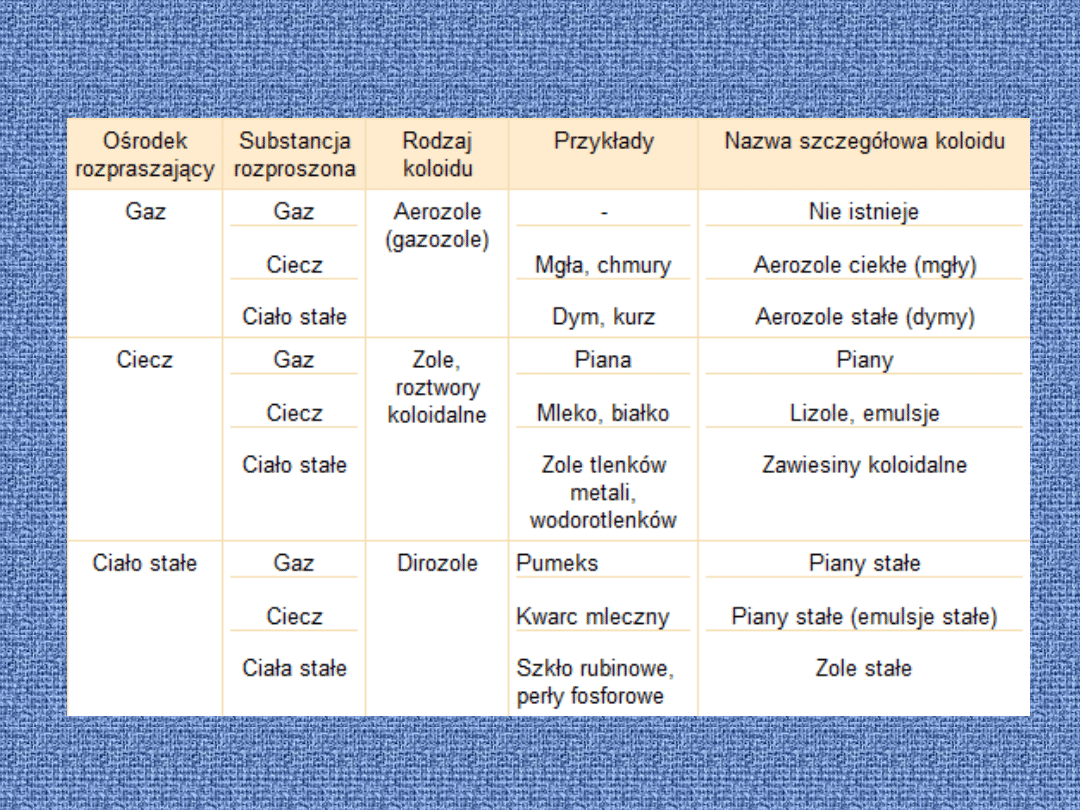
Podział koloidów ze
względu na stan
skupienia:
Układy koloidowe i związane z nimi zjawiska posiadają specyficzną dla
siebie nomenklaturę.

Rozpowszechnienie
koloidów
Koloidy są bardzo powszechne w przyrodzie. Między
innymi koloidami są;
• wszelkiego rodzaju zanieczyszczenia znajdujące
się w wodzie. Mogą być pochodzenia
organicznego i nieorganicznego i powodują wzrost
mętności wody. Mogą wpływać na pracę zaworów
oraz czujników znajdujących się na przewodach a
jako substancje mogą być szkodliwe dla
człowieka,
• to różnego rodzaju naturalne produkty
spożywcze, takie jak; śmietana - koloid tłuszczu w
mleku, masło - koloid wody w tłuszczu, mleko -
składa się z kropelek białek i tłuszczu
rozproszonych w wodzie.
• galarety, żelatyna,

• dym, który jest uwalniany podczas
spalania drewna, węgla. Zawiera cząstki
fazy stałej o rozmiarach rzędu 1 ľm
rozproszone w fazie gazowej.
• mgła, która jest zawiesiną bardzo małych
kropel wody (o średnicy poniżej 0,05 mm)
lub lodu w powietrzu
• smog, który jest mieszaniną mgły i dymu,
• białka kurze,
• oprócz tego w przyrodzie występuje dużo
związków, których cząsteczki mają
wymiary charakterystyczne dla układów
koloidalnych, zwane są one eukoloidami
(np. skrobia, celuloza, kauczuk, keratyna,
kolagen glikogen itd.), znane są również
syntetyczne eukoloidy, jak polistyreny i
inne tworzywa sztuczne.

Należy tutaj wspomnieć o koloidach, które
odgrywają dużą rolę w biologicznym
funkcjonowania organizmów żywych a w tym i
człowieka. Koloidami w organizmie człowieka
są różnego rodzaju substancje białkowe, jak i
również włosy, paznokcie, skóra, wiązadła, itp.
Osocze krwi, które jest mieszaniną kilkunastu
rozpuszczonych białek, jest również roztworem
koloidowym (zol). Z osocza, drogą
frakcjonowanego wysalania, możemy wydzielić
poszczególne białka. Żółć - emulgator dla
tłuszczy - jest również roztworem koloidalnym.
Z tego wynika, że organizm ludzki
rozpatrywany z punktu widzenia pewnych jego
właściwości jest roztworem koloidalnym o
różnych stanach skupienia.

Metody otrzymywania i
oczyszczania układów
koloidalnych
Metody otrzymywania zależą od stanu
skupienia ośrodka rozpraszającego i
substancji rozproszonej. Wyróznia się
dwie podstawowe metody otrzymywania
układów koloidalnych:
• dyspersyjna
• kondensacyjna

Metody dyspersyjne
Rozdrobnienie aż do uzyskania rozdrobnienia
koloidalnego osiąga się albo mechanicznie (np.
młyn koloidalny), albo elektrycznie (łuk
elektryczny).
Ten ostani spoób szczególnie stosuje się do
otrzymania zoli metali, tlenków metali,
koloidalnego grafitu itp.
W metodach dyspersyjnych wykorzystuje się
również ultradzwięki (drgania akustyczne o
częstości rzędu 20000 Hz). Otrzymuje się w ten
sposób m.in. zole barwników, krochmalu, gipsu
itp.)
Do tej grupy metod można zaliczyć peptyzację.
Stosuje się tutaj peptyzatory (substancje o
silnych własnościach adsorbcyjnych), które
rozdzielają złączone cząstki koloidalne.

Metody kondensacyjne
W metodach tej grupy rozdrobnienie
koloidalne osiąga się w wyniku łączenia
pojedyńczych cząsteczek chemicznych.
Stosuje się w tym celu takie procesy
chemiczne jak:
• polimeryzacja
• zmniejszenie rozpuszczalności (np.
otrzymywanie koloidalnego roztworu siarki
w wodzie przez wlewanie do wody
nasyconego roztworu siarki w alkoholu)
• redukcja
• utlenianie (np. H
2
S --> S koloidalna)
• wymiana (AgNO
3
+ KI --> AgI + AgNO
3
)

Metody oczyszczania
• Do oczyszczania roztworów koloidów
stosuje się wiele metod. najważniejszymi
są;
• dializa (elektrodializa)
• filtracja (ultrafiltracja)
• wymiana jonowa (wykorzystanie jonitów)
W metodach tych stosuje się błony
półprzepuszczalne (membrana), przez
które przechodzą zanieczyszczenia
(elektrolity), a które są nieprzepuszczalne
dla cząstek o rozdrobnieniu koloidalnym.

Dializa.
W dializatorze po jednej stronie membrany
znajduje się zanieczyszczony roztwór
koloidalny, a druga strona omywana jest
czystym rozpuszczalnikiem. Substancje o
rozdrobnieniu cząsteczkowym przechodzą
przez memebranę do zewnętrznej cieczy i
mogą być w ten sposób usunięte z koloidu,
zwłaszcza gdy ciecz zewnętrzna bedzie
wymieniana w sposób ciągły.
Elektrodializa. Jest to proces dializy
przeprowadzony w polu elektrycznym,
panującym między dwiema elektrodami z
siatki platynowej, umieszczonymi w
bocznych częściach aparatu, w pobliżu
membran półprzepuszczalnych.
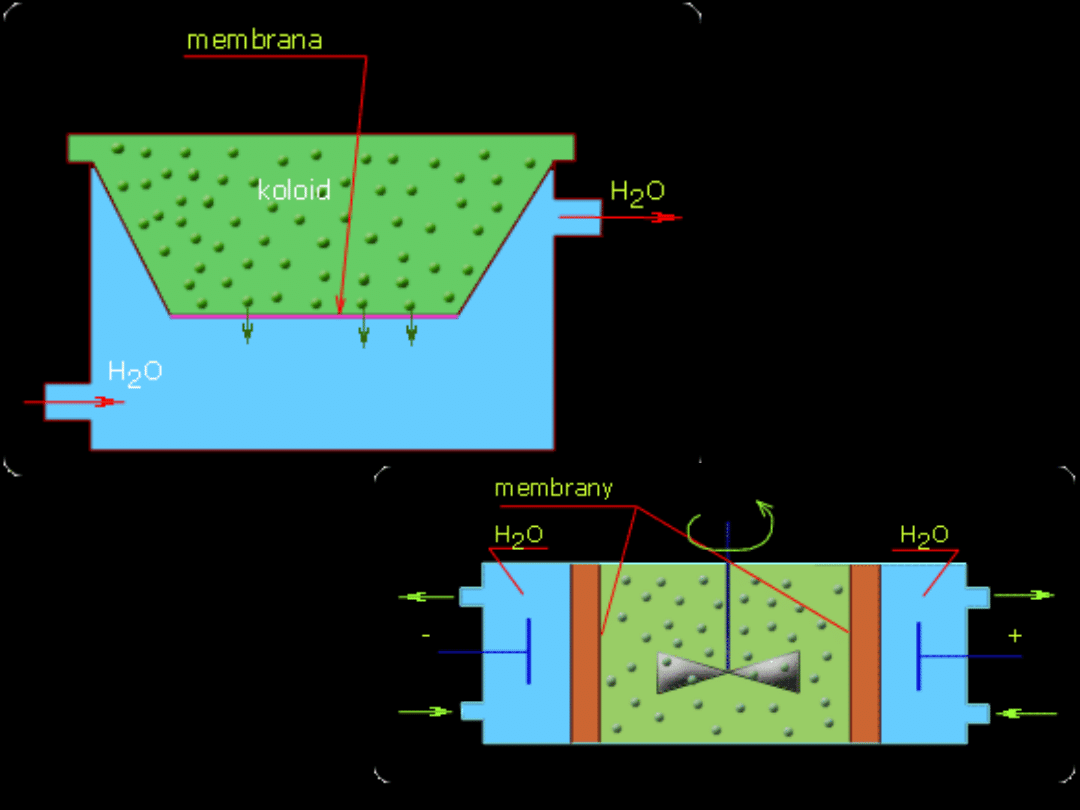
Dializat
or
Elektrodi
ali-zator

Ultrafiltracja, jest to
ultrasączenie zolu przez
sączki o odpowiednich
porach pod
zmniejszonym
ciśnieniem.

WŁAŚCIWOŚCI
UKŁADÓW
KOLOIDALNYCH
Właściwości mechaniczne
Właściwości optyczne
Absorpcja światła
Właściwości elektryczne

Właściwości mechaniczne
Jedną z najbardziej charakterystycznych
cech układów koloidalnych są ruchy
Browna. Zjawisko polega na ciągłych
chaotycznych ruchach postępowych,
obrotowych i drgających, fazy
rozproszonej w ośrodku ciekłym lub
gazowym. Ruchy Browna można
zaobserwować przypatrując się np.
cząstkom kurzu oświetlonym cienką
wiązką światła w zaciemnionym
pomieszczeniu.

Właściwości optyczne
Jedną z najbardziej charakterystycznych cech układów
koloidalnych jest efekt Tyndalla. Polega on na tym, że
jeżeli przez roztwór koloidalny przepuszczamy wiązkę
światła, to wskutek uginania się promieni na
cząstkach fazy rozproszonej, mniejszych od długości
fali, światło staje się widoczne w postaci smugi
świetlnej. Intensywność tego efektu jest tym większa
im większa jest różnica między współczynnikami
załamania fazy rozproszonej i ośrodka dyspersyjnego.
Efekt Tyndalla został wykorzystany w konstrukcji
ultramikroskopu, który ma duże zastosowanie w
różnorodnych badaniach koloidów, np. liczenie
cząsteczek, obserwacja ruchów Browna, pomiar
szybkości koagulacji i inne. Kształty geometryczne
cząstek fazy rozproszonej o wymiarach
odpowiadających rozdrobnieniom koloidalnym
możemy obserwować jedynie w mikroskopie
elektronowym.

Absorpcja światła
Niektóre układy koloidalne mają silniejszą
absorpcję aniżeli rozproszenie światła.
Pomiar absorpcji światła jest jedną z metod
badania układów koloidalnych, pozwala on
na oznaczanie stężenia fazy rozproszonej i
na śledzenie przebiegu koagulacji. Barwa
układów koloidalnych uwarunkowana jest
zarówno przez absorpcję, jak i przez
rozproszenie światła. Zależy ona od
wielkości, kształtu i stopnia agregacji
cząstek fazy rozproszonej. W świetle
rozproszonym może być ona inna niż w
świetle przechodzącym. Ten sam układ
koloidalny może mieć różną barwę w
zależności od stopnia rozproszenia.

Właściwości
elektryczne
Na skutek adsorpcji jonów elektrolitu z roztworu
na powierzchni cząstki koloidalnej powstaje
ładunek elektryczny. W wyniku tej adsorpcji
tworzy się podwójna warstwa elektryczna
złożona z powłoki wewnętrznej, czyli
adsorpcyjnej, przylegającej mocno do
powierzchni zewnętrznej, będącej warstwą
jonów przeciwnego znaku. Zależnie od tego jakie
jony są adsorbowane na powierzchni, cząstka
może być naładowana albo ujemnie albo
dodatnio. Jednak znak ładunku elektrycznego nie
jest ich cechą charakterystyczną. Ta sama
bowiem cząstka koloidalna może mieć ładunek
dodatni lub ujemny, zależnie od środowiska. Na
przykład koloidalny jodek srebra AgJ w roztworze
zawierającym jony srebra jest naładowany
dodatnio, w roztworze zaś zawierającym jony
jodkowe ujemne

Roztwory koloidalne są układami
nietrwałymi. Proces przechodzenia zolu w
żel nosi nazwę koagulacji.
Na trwałość roztworów koloidalnych
liofobowych (wodorotlenki metali, halogenki
srebra) a także liofilowych (białko) wpływa
występowanie ładunku elektrycznego na
powierzchni cząstki koloidalnej oraz
solwatacja cząstek.
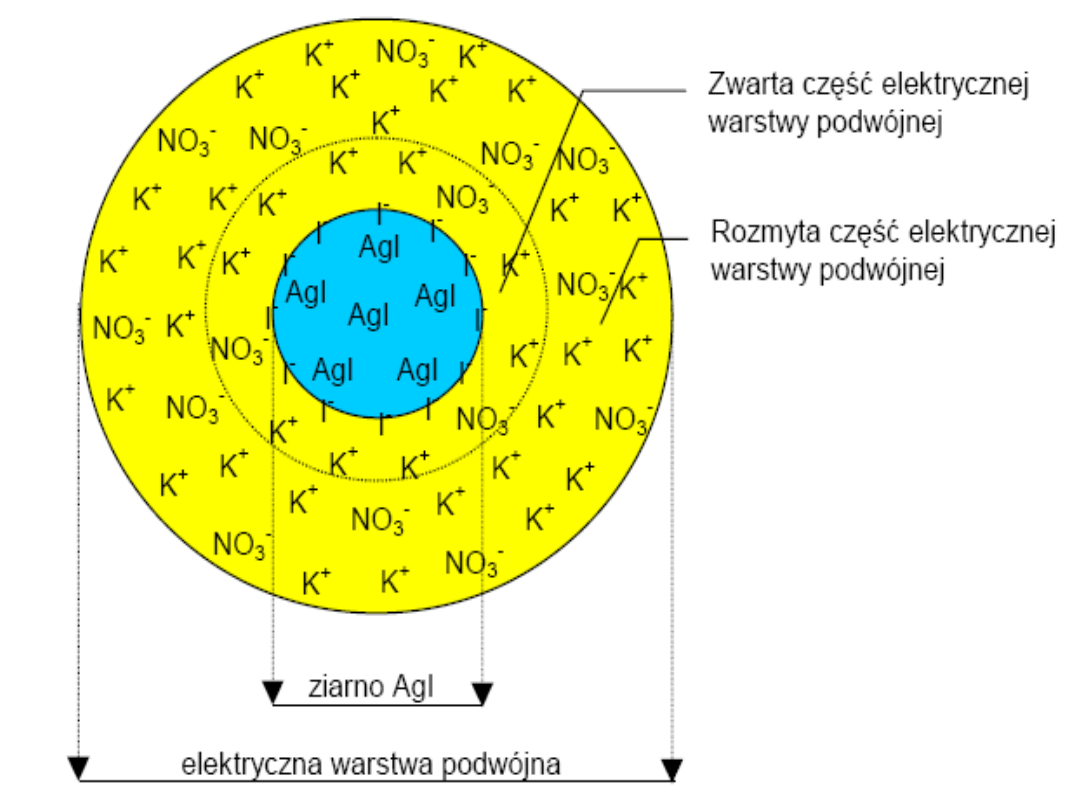
Cząstka dowolnego koloidu posiadająca
ładunek nosi nazwę miceli. Przykładem
miceli może być cząstka jodku potasu:
KOAGULACJA UKŁADÓW
KOLOIDALNYCH

SCHEM
AT
BUDOW
Y
MICELI
AgI
WYTRĄ-
CONEG
O
NADMIA
-REM KI

Micela składa się z jądra, w skład
którego wchodzą obojętne
cząsteczki. Na powierzchni jądra
absorbowane są z roztworu wspólne
jony w przypadku KI jony jodkowe I-.
Warstwa ta nosi nazwę warstwy
adsorbcyjnej i wiąże się ona luźno z
warstwą rozmytą albo dyfuzyjną
zawierającą jony K+.
Jadro razem z warstwą adsorpcyjną
nosi nazwę granuli.
Na granicy faz jądro cząstki
koloidalnej - roztwór, powstaje
podwójna warstwa elektryczna.

Podwójna warstwa elektryczna
Podwójna warstwa elektryczna składa się z
dwóch części (rys.9), warstwy
adsorbcyjnej i dyfuzyjnej. Istnienie
dwóch warstw jest powodem, że cząstka
taką możemy przedstawić jako
kondensator, którego jedną okładką jest
powierzchnia cząstki, a druga okładka
rozciąga się na pewną odległość w głąb
cieczy.
W zjawiskach elektrokinetycznych ważną
rolę odgrywa wartość potencjału na granicy
pomiędzy warstwą adsorpcyjną a dyfuzyjną
względem głębi roztworu.

Nosi on nazwę potencjału
elektrokinetycznego. Istnienie
potencjału elektrokinetycznego
odgrywa zasadniczą rolę w
zjawiskach elektrokinetycznych.
Zjawiska elektrokinetyczne obejmują:
elektroosmozę, elektroforezę,
potencjał sedymentacji i
potencjał przepływu (powstanie
różnicy potencjałów na końcach
kapilary, przez którą przepływa
ciecz).
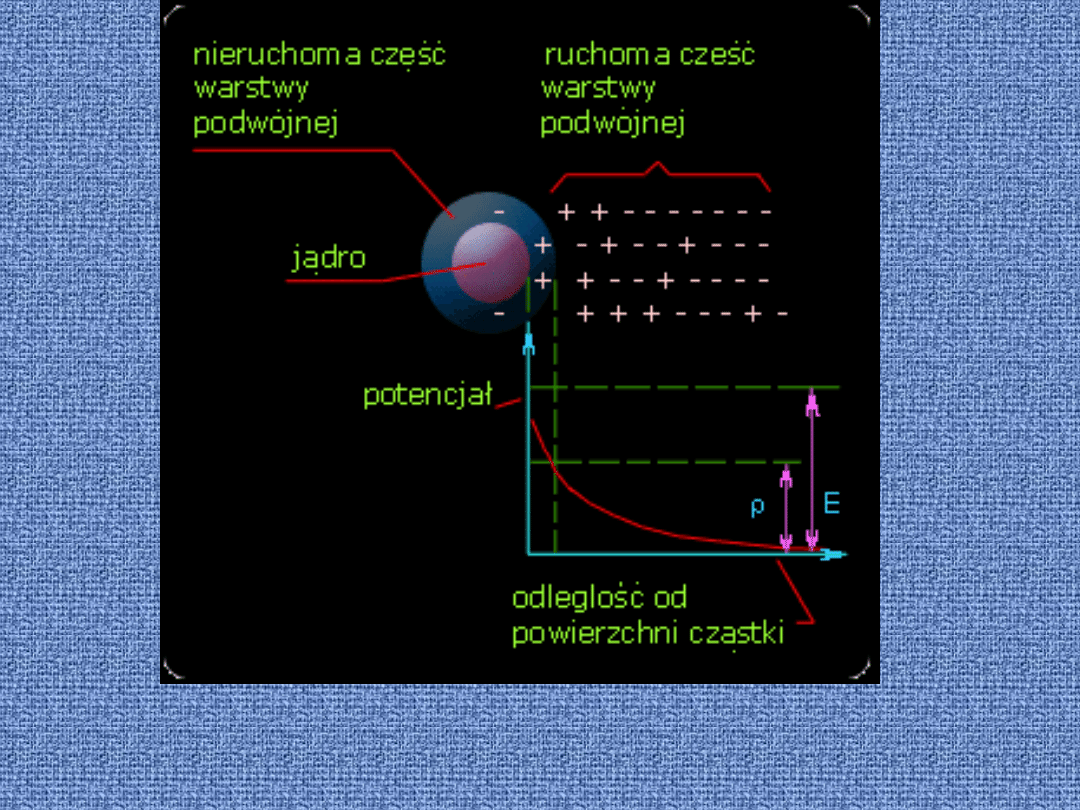
Podwójna warstwa elektryczna i potencjał
elektrokinetyczny.

Koagulację można wywołać
następującymi czynnikami:
• dodatek elektrolitu
• zmianę temperatury
• czynniki mechaniczne
• dodatek nieelektrolitu
(odwadniającego)
• przepływ prądu
• działanie światła

Natomiast trwałość roztworów
koloidalnych warunkują dwa
podstawowe czynniki:
• ładunek na powierzchni cząstki
koloidalnej (głównie dotyczy to
koloidów liofobowych)
• solwatacja (głównie koloidy
liofilowe)

Największy wpływ na koagulacje
wywiera dodanie elektrolitu. Minimalna
liczba minimoli danego elektrolitu
niezbędna do skoagulowania 1 cm3
roztworu koloidalnego, nosi nazwę
progu koagulacji. Ten ostatni zależy
od rodzaju dodawanego elektrolitu i
wartościowości dodawanych jonów.
Dla zoli o znaku dodatnim wartość
progu koagulacji zależy od
wartościowości anionu.
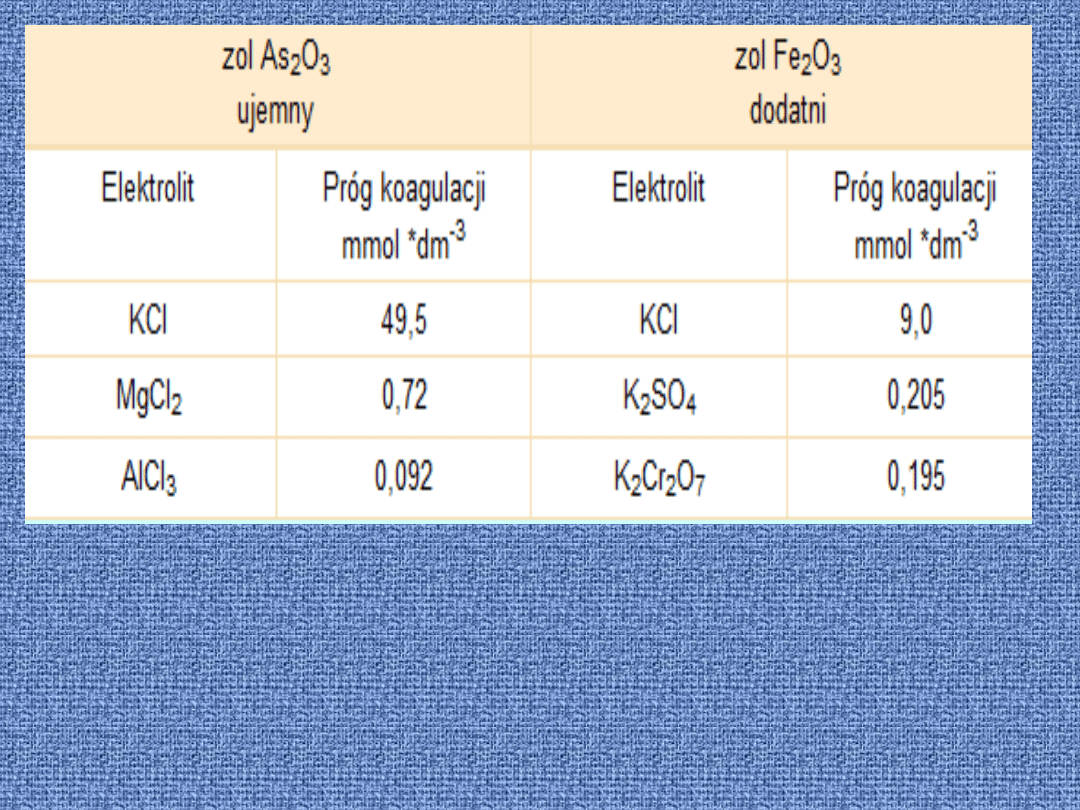
Wartości progów koagulacji
dla zoli As
2
O
3
oraz Fe
2
O
3

Znaczenie koloidów w
budownictwie
Rozpowszechnienie i znaczenie układów
koloidalnych w budownictwie jest ogromne
Szczególnie rozpowszechnione są kwasoodporne
zaprawy i kity krzemianowe oparte na szkle
wodnym, które stanowi układ częściowo
zdysocjowanych krzemianów sodu lub potasu oraz
koloidalnego roztworu kwasu krzemowego. Asfalty
stanowiące podstawowy surowiec w budowie dróg,
pod względem fizykochemicznym są układami
koloidalnymi. Fazę rozproszoną stanowią
wielkocząsteczkowe asfalteny zaś fazę
rozpraszającą niskocząsteczkowe oleje zwane
maltenami.

Minerały ilaste ( gliny ) szeroko stosowane w
przemyśle ceramicznym stanowią koloidalny
układ cząstek mineralnych w wodzie.
Większość klejów i lakierów zarówno
naturalnych i syntetycznych , to układy
koloidalne np. klej kazeinowy jest koloidalnym
roztworem kazeiny w wodzie.
Układy koloidalne ( roztwory mydła, bitumity,
szkło wodne i in. ) stosuje się jako dodatki do
gipsu, polepszając jego właściwości i regulujące
czas wiązania. Poprzez dodanie do odpowiednio
przygotowanych mas betonowych emulgatorów
( mydeł, białek ) pianobetony.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
Wyszukiwarka
Podobne podstrony:
Układy koloidalne, chemia(2)
Biologiczne układy koloidalne 3, studia-biologia, Licencjat, sem 3-4, biofizyka
UKŁADY KOLOIDALNE (22.01), Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
APD 5 układy bramkowe
Układy Napędowe oraz algorytmy sterowania w bioprotezach
Układy wodiociągowe ze zb przepł końcowym i hydroforem
uklady dyspersyjne
15 Uklady PLL i t s
W3B Układy fazowe
UKŁADY ENERGOELEKTRONICZNE W GRZEJNICTWIE 5F SZER
Uklady kombinacyjne
12 Podstawy automatyki Układy sterowania logicznego
Inf przestrz wekt uklady rown
więcej podobnych podstron