
POLITECHNIKA WROCŁAWSKA
Wydział Chemiczny
CHEMIA OGÓLNA
WYKŁAD
Prof. Piotr Drożdżewski
(pok. 204, A-3)
Konsultacje: Wtorek, godz. 11:15 – 13:00
Środa, godz. 11:15 – 13:00

ZALECANE PODRĘCZNIKI
Literatura podstawowa:
1. M.J. Sienko, R.A. Plane, Chemia - podstawy i zastosowania, WNT, W-wa, 2002
2. I. Barycka, K. Skudlarski, Podstawy Chemii, Wyd. P.Wr., Wrocław, 2001
3. P. Mastalerz, Elementarna Chemia Nieorganiczna, Wydaw. Chem. 1997
4. L. Jones, P. Atkins., Chemia ogólna, PWN, 2004
5. A. Bielański, Podstawy chemii nieorganicznej, PWN, Warszawa, 2003
Literatura uzupełniająca:
1. J. E. Brady, J. R. Holum, Fundamentals of chemistry, Wiley & Sons, N.Y. 2002
2. Praca zbiorowa, Obliczenia w chemii nieorganicznej, Wyd. PWr., 2002
3. System elektronicznych korepetycji (e – learning)
Uzyskanie pozytywnej oceny z egzaminu końcowego
WARUNKI ZALICZENIA

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
PODSTAWOWE
POJĘCIA
CHEMII
Przedmiot chemii: zjawiska chemiczne i fizyczne, substancje proste i
złożone, pierwiastki i związki chemiczne, mieszaniny fizyczne.
Główne działy chemii: analityczna, fizyczna, nieorganiczna,
organiczna. Atom jako najmniejsza, chemicznie niepodzielna część
pierwiastka: podstawowe składniki – jądro (protony i neutrony),
elektrony. Względna masa atomowa. Nuklid, liczba atomowa i
masowa, symbol nuklidu. Izotopy – średnia masa atomowa.
Cząsteczka jako najmniejsza część związku chemicznego: masa
cząsteczkowa, prawo stałości składu. Mol jako jednostka liczności,
liczba Avogadra – przykłady ilustrujące jej wielkość. Masa molowa.
Symbole i wzory chemiczne. Symbole pierwiastków: pochodzenie,
zasady pisowni. Wzory związków chemicznych: empiryczne,
cząsteczkowe i strukturalne. Wzory jonów. Modele cząsteczek.

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Przedmiot chemii
CHEMIA zajmuje się badaniem
BUDOWY
,
WŁAŚCIWOŚCI
I
PRZEMIAN MATERII
Budowa materii:
− ustalenie składu jakościowego (jakie pierwiastki)
− ustalenie składu ilościowego (proporcje pomiędzy ilościami pierwiastków)
− ustalenie połączeń pomiędzy atomami
− ustalenie przestrzennego rozkładu atomów
− budowa atomu
Właściwości:
− chemiczne – zdolność substancji do przekształcania się w inną substancję
− fizyczne – obserwowane, mierzone bez zmiany tożsamości substancji
Przemiany materii:
− chemiczne – połączone ze zmianą składu i właściwości materii
− fizyczne – zachowanie składu materii
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
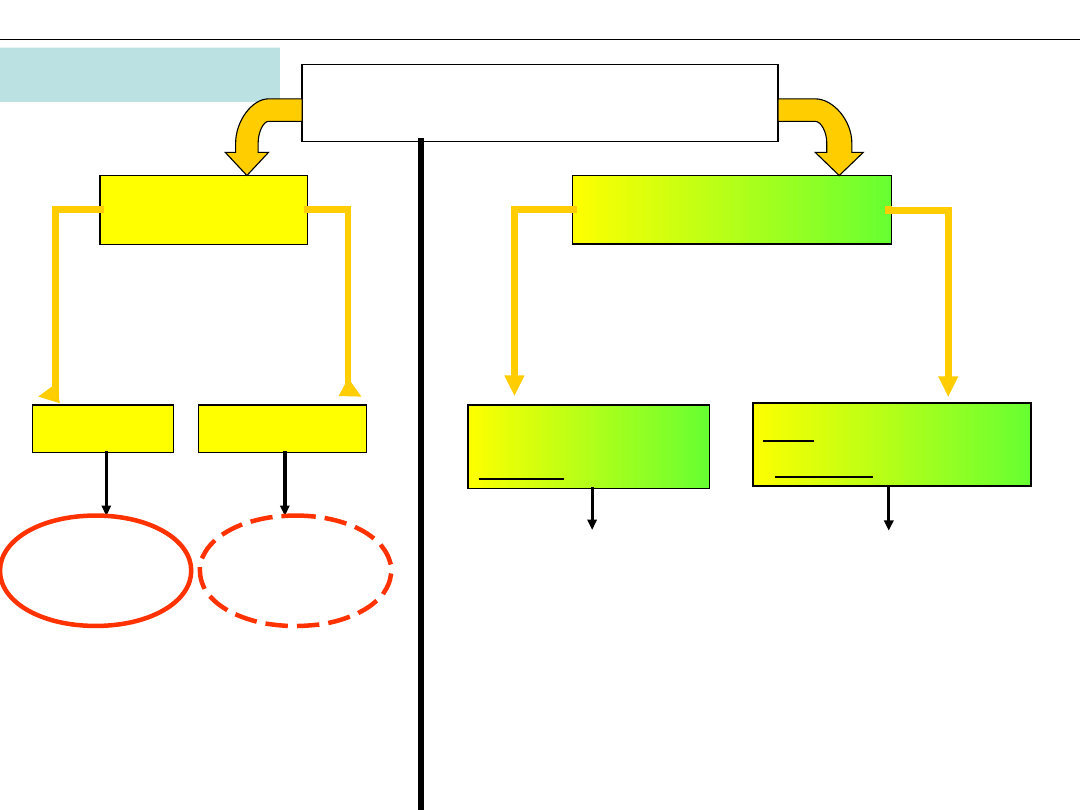
Obiekt chemii
SUBSTANCJE
CZYSTE
MIESZANINY
PROSTE
ZŁOŻONE
JEDNORODNE
homogeniczne
NIEJEDNORODNE
heterogeniczne
PIERWIASTKI
ZWIĄZKI
CHEMICZNE
ROZTWORY
- przemieszani
e
sięga aż do
pojedynczych
cząstek
ODRĘBNE FAZY
FAZA to jednorodna
część układu
ograniczona
powierzchnią
graniczną
- Stały skład,
- Ściśle określone
właściwości
- Zmienny skład,
- Właściwości
zależne od składu
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
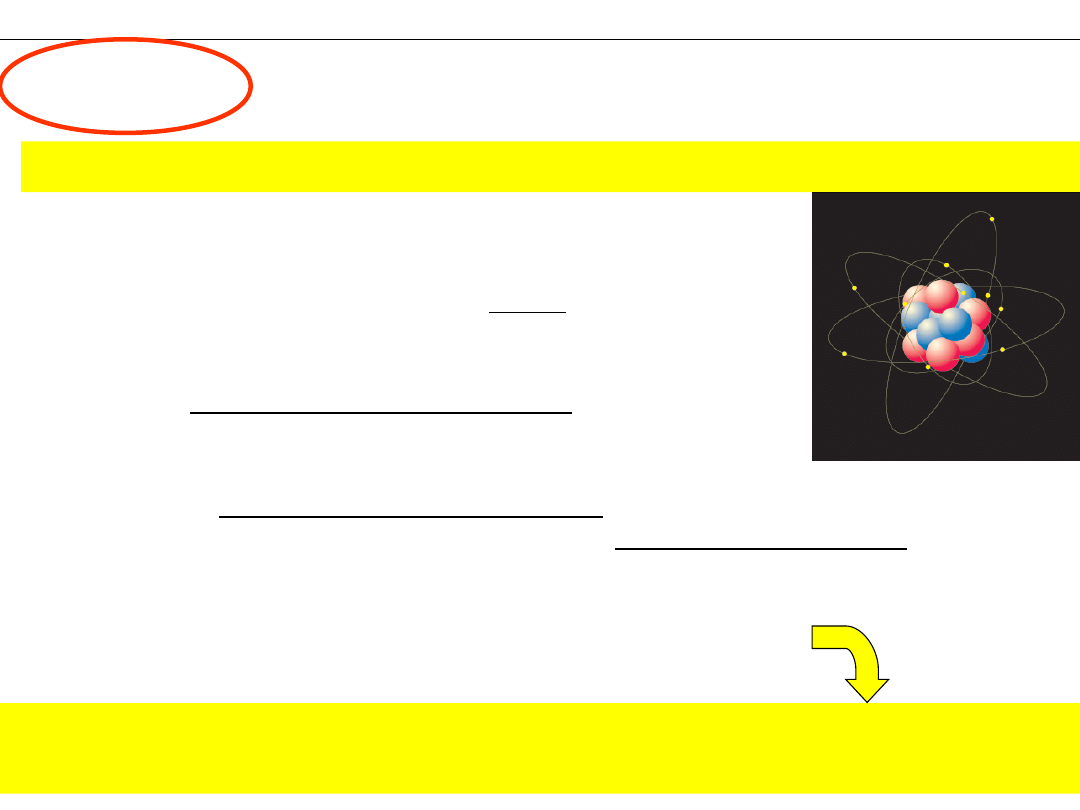
PIERWIASTEK
–
Substancja nie dająca się rozłożyć metodami
chemicznymi.
ATOM
– Najmniejsza, chemicznie niepodzielna część pierwiastka
7. Liczba protonów (a tym samym liczba elektronów)
decyduje o przynależności atomu do danego
pierwiastka.
PIERWIASTEK
–
Substancja złożona z atomów
o jednakowej liczbie
protonów.
+ +
+
1. Atomy są zbudowane z cząstek subatomowych:
elektronów,
protonów
i
neutronów
2.
Protony
i
neutrony
tworzą jądro atomu.
Prawie cała masa atomu skupiona jest w
jądrze.
3. Elektrony tworzą w przestrzeni chmurę otaczającą jądro.
Elektrony mają ujemny ładunek elektryczny.
4. Ładunek elektronu jest nazywany ładunkiem elementarnym
1e = 1,602·10
-19
C.
5.
Protony
mają dodatni ładunek elektryczny, równy co do
wartości ładunkowi elektronu.
Neutrony
są elektrycznie obojętne.
6. W atomie, liczba elektronów jest równa liczbie
protonów
co powoduje, że atom jest elektrycznie obojętny.
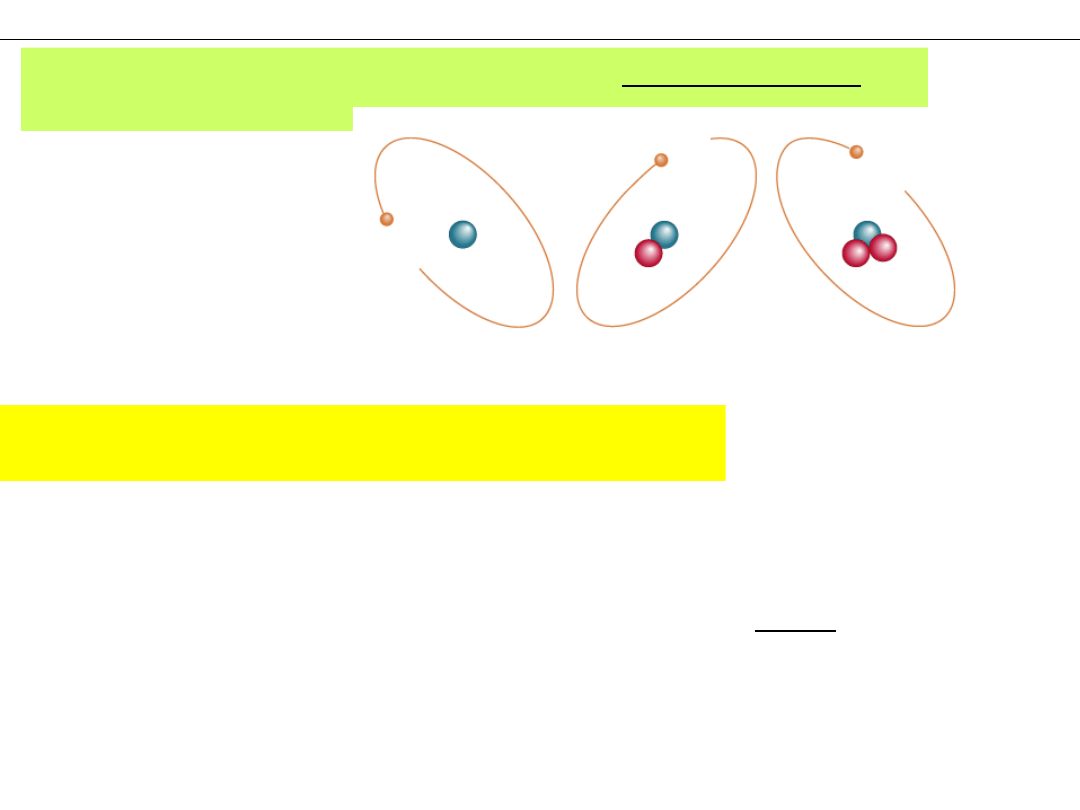
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Atomy tego samego pierwiastka mogą różnić się liczbą
neutronów
.
ATOMY WODORU
Prot
Deuter
Tryt
NUKLID – Zbiór atomów o jednakowym składzie jąder
(te same liczby
protonów
i
neutronów
)
Nuklid opisuje się
ogólnie:
Z
A
X
X – symbol pierwiastka
Z – liczba atomowa jest równa liczbie
protonów
w
jądrze i decyduje o symbolu pierwiastka (X).
A – liczba masowa jest równa sumie
protonów
i
neutronów
(czyli liczbie nukleonów) w
jądrze.
Liczba neutronów (N) w jądrze atomu wynosi N
= A - Z
Przykłady nuklidów:
Cs
,
Co
,
H
137
55
60
27
1
1
1
H,
60
Co,
137
Cs,
H-1, Co-60, Cs-
137

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Większość naturalnych pierwiastków składa się z wielu nuklidów,
zwanych wtedy izotopami
IZOTOPY to zbiory atomów tego samego pierwiastka (taka
sama liczba
protonów
) różniące się liczbą
neutronów
w
jądrze.
Np. 3 nuklidy to 3 izotopy
wodoru.
H
,
H
,
H
3
1
2
1
1
1
•PIERWIASTEK
–
Substancja złożona z atomów o tej samej liczbie
atomowej Z (czyli o tej samej liczbie
protonów
i elektronów).
•Atomy danego pierwiastka mogą różnić się liczbą
neutronów
(IZOTOPY).
•Liczba Z decyduje o właściwościach chemicznych pierwiastka,
ponieważ decyduje o liczbie elektronów.
PODSUMOWANIE:
0, 1 lub 2
neutrony
w jądrze.
Te izotopy wodoru posiadają odpowiednio:
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
WZGLĘDNA MASA ATOMOWA
Masy atomów i innych cząstek podaje się w umownych jednostkach [u],
zdefiniowanych jako:1 u = 1/12 część masy nuklidu węgla
12
C
Względna masa atomowa jest to liczba wskazująca ile razy masa
danego atomu
jest większa od 1/12 masy atomu węgla
12
C. Jest to wielkość
bezwymiarowa.
Przykład:
Masa atomu (lub masa nuklidu, izotopu)
12
C wynosi 12,000000
Masa atomu (lub masa nuklidu, izotopu)
13
C wynosi 13,003355
Względna masa atomowa pierwiastka (mieszaniny izotopów)
jest średnią ważoną z mas izotopów tego pierwiastka.
Naturalny węgiel zawiera 98,89 % izotopu
12
C i 1,11%
izotopu
13
C
(pominięto niewielkie ilości innych izotopów)
Względna masa atomowa węgla jest średnią ważoną:
(12,000000 98,89 + 13,003355 1,11)/100 =
12,011
Przykład:
Ze składu procentowego wynika, że w 10000 atomów
węgla jest około 9889 atomów izotopu
12
C i 111 atomów
izotopu
13
C.
Na tej podstawie średnią masę atomową można obliczyć
jako:
(9889 12,000000 + 111 13,003355)/10000 = 12,011

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
NAZWY I SYMBOLE PIERWIASTKÓW
Każdy pierwiastek ma nazwę i własny symbol chemiczny.
Nazwy pierwiastków zostały przyjęte zwyczajowo lub nadane przez
odkrywców. Nazwy niekiedy związane są z właściwościami pierwiastków.
Chlor
grec. chloros – żółtozielony
Jod
grec. ioedes – fioletowy
Wodór grec. hydro genes – tworzący wodę
Chrom grec. chroma – barwa
Bar
grec. barys – ciężki
Fosfor grec. fos foros – niosący światło
Miedź łac. cuprum – z Cypru
Sód
– składnik sody
Lutet
łac. Lutetia – Paryż
Polon
– Polska
Kiur
– Maria Curie (Skłodowska)
Cztery pierwiastki: Itr, Iterb, Terb, Erb – do szwedzkiego miasta Ytterby

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
NAZWY I SYMBOLE PIERWIASTKÓW
SYMBOL PIERWIASTKA
–
jedna lub dwie litery,
(wyjątkowo trzy)
z których pierwsza jest zawsze
DUŻA
a druga -
mała
Obecny system symboli
chemicznych zaproponował w 1811
r. chemik szwedzki Jons Jakob
Berzelius
według
zasady,
że
symbolem
pierwiastka
będzie
początkowa litera łacińskiej nazwy
pierwiastka. Jeśli kilka pierwiastków
miało te same litery początkowe,
symbol uzupełniało się drugą literą.
Jons Jakob Berzelius
(1779 - 1848)
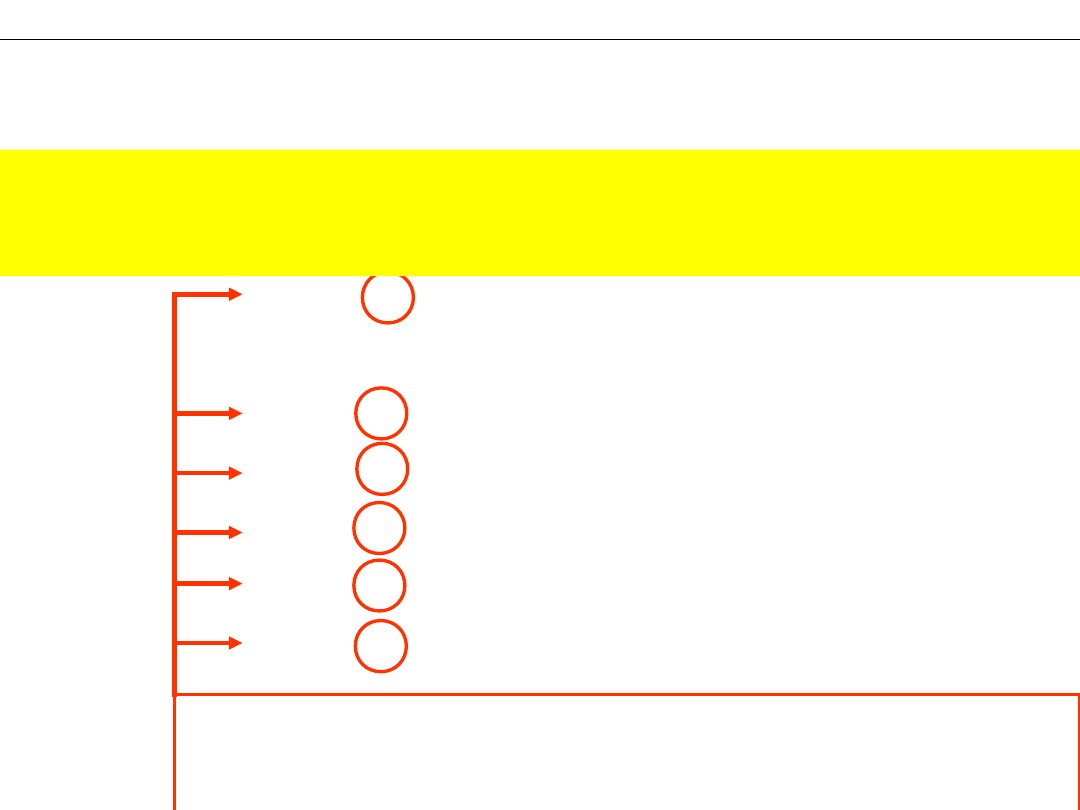
Wodór
H
łac.
H
ydrogenium
Hel
He
łac.
He
lium
Węgiel
C
łac.
C
arboneum
Miedź
Cu
łac.
Cu
prum
Fosfor
P
łac.
P
hosphorus
Potas
K
łac.
K
alium – pol. potaż
Tlen
O
łac.
O
xygenium – pol. tlić
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
NAZWY I SYMBOLE PIERWIASTKÓW
Symbole niektórych pierwiastków nie mają
bezpośredniego związku z ich nazwami w języku
polskim !
SYMBOL PIERWIASTKA
–
jedna lub dwie litery,
(wyjątkowo trzy)
z których pierwsza jest zawsze
DUŻA
a druga -
mała

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Symbole i względne masy atomowe
pierwiastków.
(z notatek J. Daltona)
Dawne symbole pierwiastków
John Dalton (1766 – 1844)

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
ZWIĄZEK CHEMICZNY - Substancja złożona z co najmniej dwóch
różnych pierwiastków, występujących w
określonym, charakterystycznym stosunku
ilościowym.
PRAWO STAŁOŚCI SKŁADU: Każdy związek chemiczny ma stały i
niezmienny skład jakościowy i ilościowy
Joseph Louis Proust
(1754 – 1826)
lub:
Prawo stosunków stałych
Stosunek mas pierwiastków tworzących związek jest
zawsze jednakowy i nie zależy od pochodzenia lub
metody otrzymywania danego związku.
Przykład: Z pomiarów wynika, że masa tlenu
zawartego w wodzie stanowi zawsze
8/9 masy wody, a masa wodoru -
1/9.
Powyższe prawo ma uzasadnienie w jednakowej
budowie
cząsteczek
tworzących związek.
ZWIĄZKI CHEMICZNE

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Związek chemiczny składa się z jednego rodzaju
cząsteczek
,
w których atomy pierwiastków połączone są w
jednakowy,
ściśle określony sposób.
MASA CZĄSTECZKOWA – masa jednej cząsteczki wyrażona w jednostkach [u]
Przykład: Cząsteczka wody zbudowana jest z
1 atomu tlenu i 2 atomów wodoru. Masa
cząsteczki wody wynosi:
16 + 2 · 1 = 18
(w
jednostkach [u])
Atom
wodor
u
Atom
tlenu
Atom
wodor
u
Uzasadnienie PRAWA STAŁOŚCI SKŁADU
(Stosunków Stałych)
- stosunek mas poszczególnego rodzaju
atomów do masy cząsteczki wody
m
wodoru
/ m
wody
= 2 · 1 / 18 =1/9
m
tlenu
/ m
wody
= 16 / 18 = 8/9
- dla dowolnej ilości wody zawierającej
n
cząsteczek:
m
wodoru
/ m
wody
= (2·1)·
n
/ 18·
n
=1/9
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Wzór EMPIRYCZNY – podaje tylko skład związku czyli rodzaj
pierwiastków i najprostsze proporcje pomiędzy
ich ilościami
WZORY ZWIĄZKÓW CHEMICZNYCH (CZĄSTECZEK)
H
2
O – na 1 atom tlenu przypadają 2 atomu wodoru
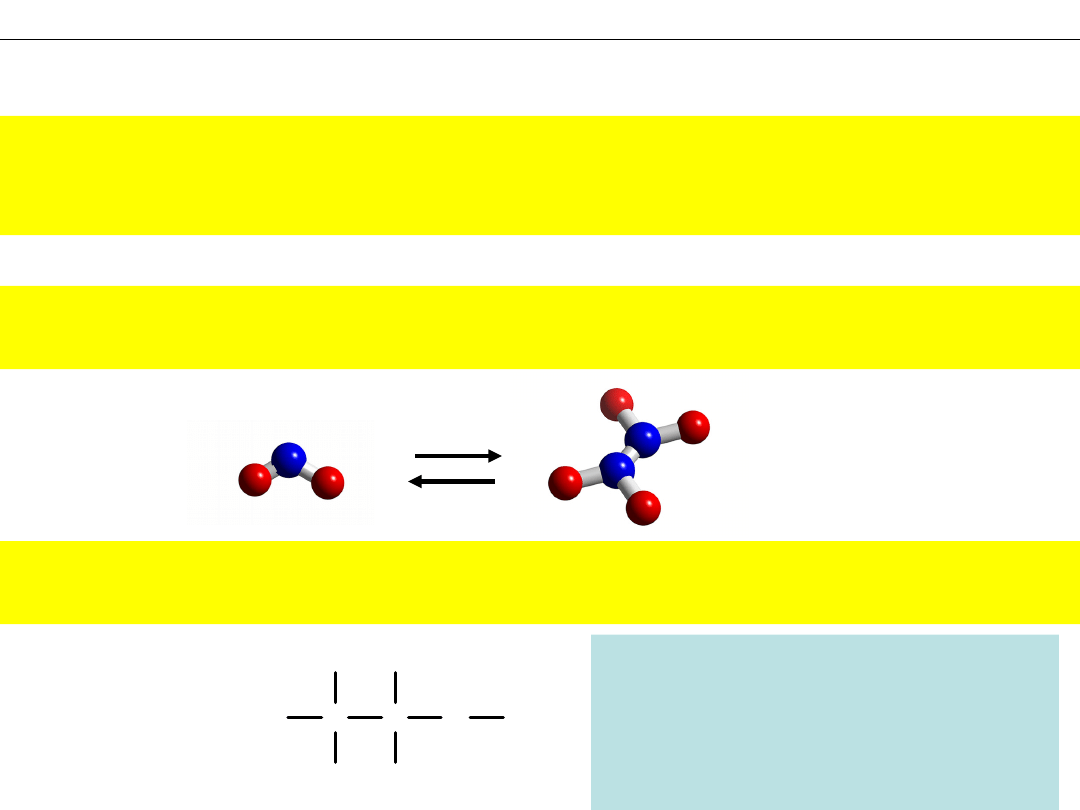
NO
2
– na 1 atom azotu przypadają 2 atomy tlenu
Wzór CZĄSTECZKOWY – podaje symbole i liczby atomów
tworzących cząsteczkę
Wzór STRUKTURALNY – podaje symbole, liczby
i połączenia atomów w cząsteczce
NO
2
N
2
O
4
C
2
H
5
OH
C C O H
H
H
H
H
H
Wzór strukturalny nie oddaje
przestrzennego ułożenia
atomów w cząsteczce – do
tego służą modele
cząsteczek
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
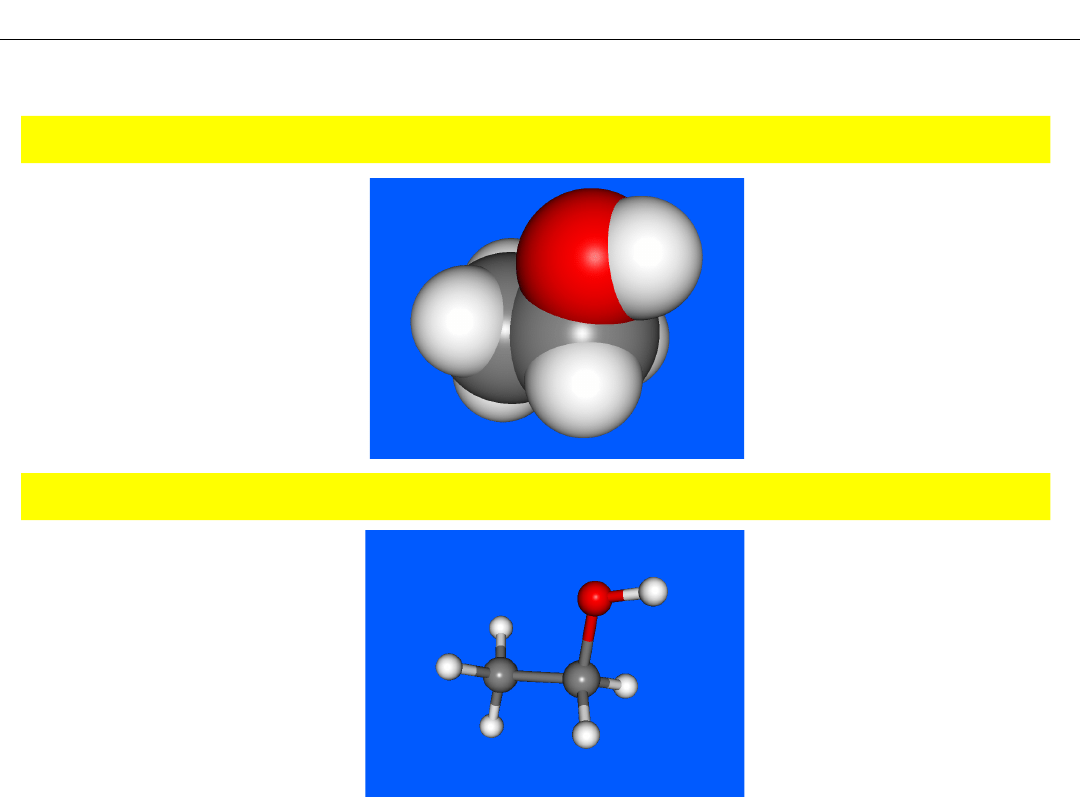
Model CZASZOWY – atomy jako przenikające się częściowo kule
MODELE CZĄSTECZEK
Model KULKOWO-PRĘTOWY – atomy jako kule, wiązania jako pręty
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
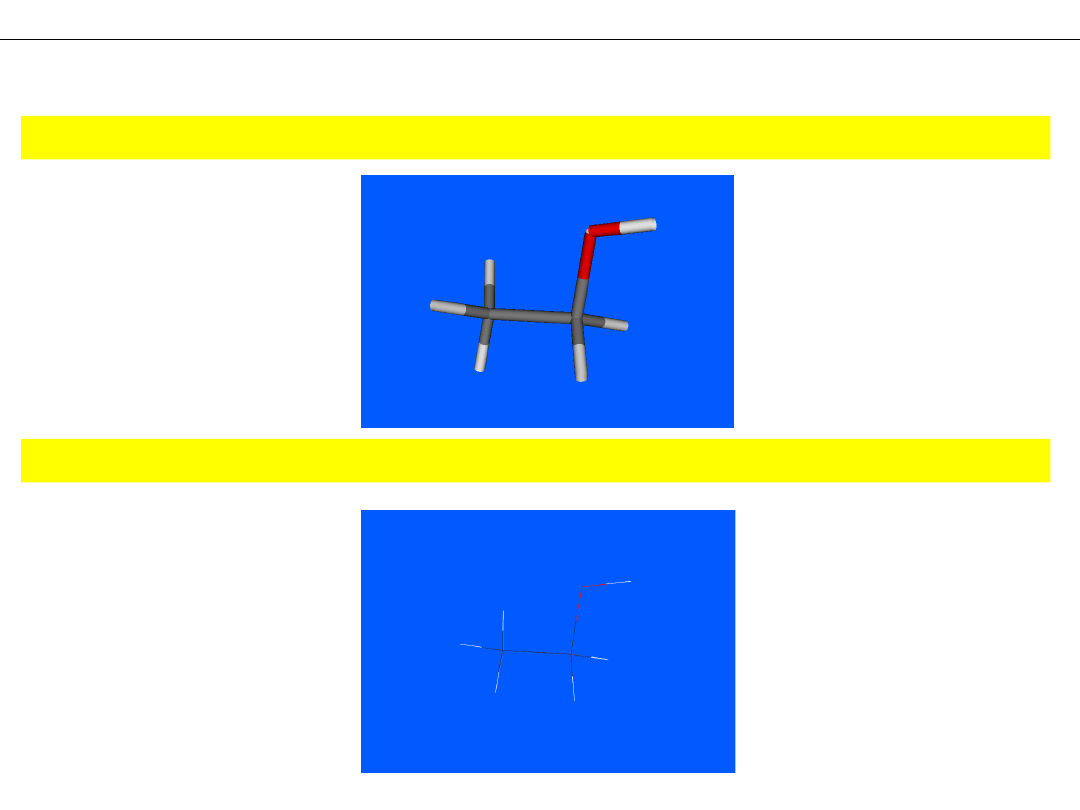
Model RURKOWY – atomy i wiązania jako rurki
MODELE CZĄSTECZEK
Model DRUCIKOWY – atomy i wiązania jako cienkie, kolorowe linie (druty)
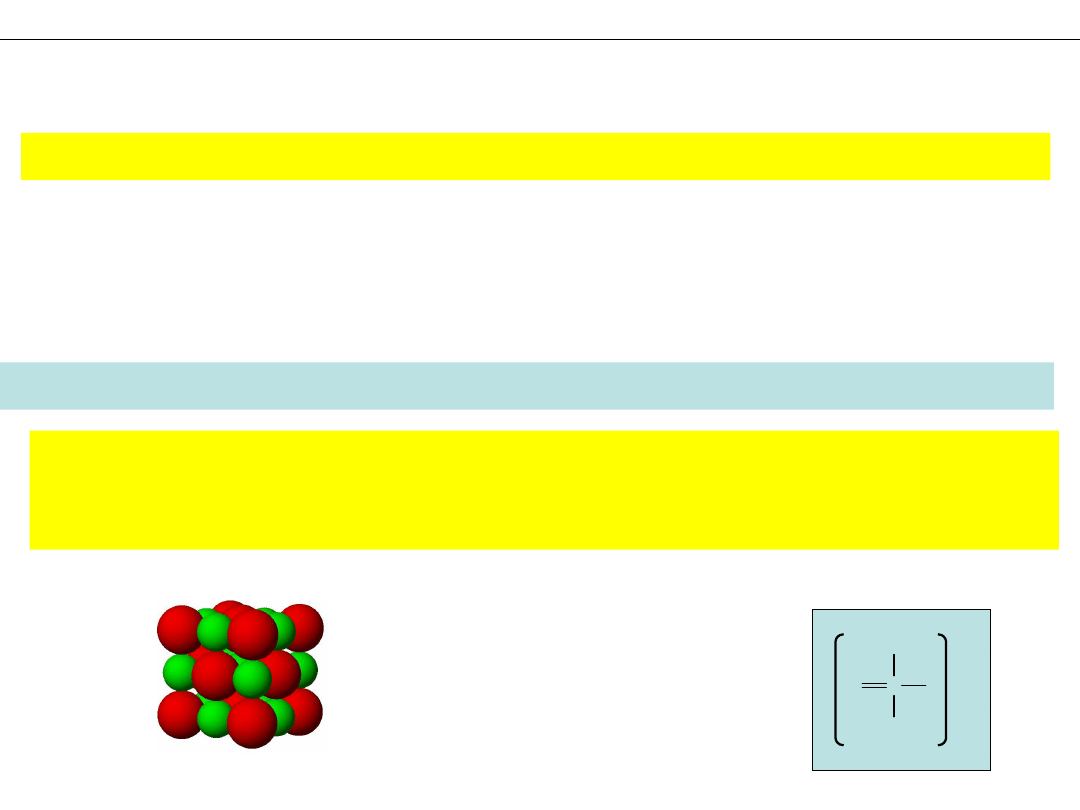
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
JON – cząstka posiadająca ładunek elektryczny
WZORY JONÓW I ZWIĄZKÓW JONOWYCH
Kation – jon dodatni, np: K
+
, Ca
2+
, Al
3+
, Ti
4+
, NH
4
+
, UO
2
2+
Anion – jon ujemny, np: Cl
–
, S
2–
, NO
3
–
, SO
4
2–
, PO
4
3–
Ładunek jonu jest równy całkowitej wielokrotności ładunku elektronu
Jony powstają przez przyłączenie lub oderwanie elektronów
od obojętnych cząstek
stąd:
ZWIĄZEK JONOWY – substancja zbudowana z kationów i
anionów w takich proporcjach, że ich ładunki się
całkowicie kompensują.
Ca
3
(PO
4
)
2
Przykład: Fosforan wapnia
Wzór strukturalny
PO
4
3–
P
O
O
O
O
3–
Przykład: Chlorek sodu
Wzór stechiometryczny: NaCl
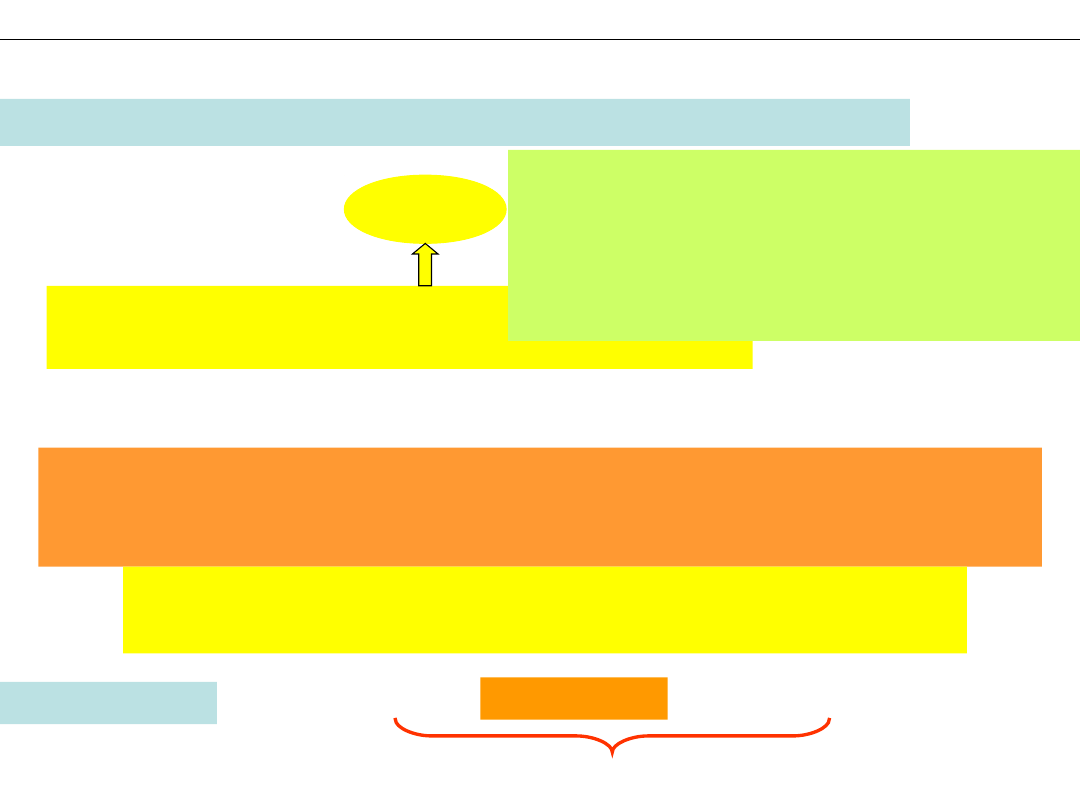
Ta liczba ma nazwę MOL – jednostka
liczności
Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
LICZNOŚĆ MATERII - MOL
Nazwy innych liczb:
12 – tuzin
15 – mendel
60 – kopa
144 – gros
1 u = 1/12 część masy nuklidu węgla
12
C ≈ 1,66054·10
-24
g
Ile razy 1 gram jest większy od 1 u ?
1g / 1,66054·10
-24
g = 6,023 ·10
23
(liczba Avogadra)
Wartość MOLA (liczby Avogadra) jest znana tylko w przybliżeniu.
Jej dokładną, chociaż nieznaną wartość podaje definicja:
MOL jest to liczba cząstek równa liczbie atomów
zawartych w dokładnie 12 g nuklidu
węgla
12
C.
MASA MOLOWA
M
(g/mol) - masa 1 mola
substancji
Związek pomiędzy MASĄ MOLOWĄ a MASĄ CZĄSTECZKOWĄ
(ATOMOWĄ)
TA SAMA LICZBA !
Masa atomowa
12
C wynosi
12
u , a masa molowa równa się
12
g

Wykład 1 - PODSTAWOWE POJĘCIA CHEMII. SYMBOLE I WZORY CHEMICZNE
Jak duża jest liczba MOL = 6,023 ·10
23
?
Przykład 1 – Mol dowolnego gazu zajmuje w
warunkach normalnych objętość
22,4
dm
3
.
Przykład 2 – Czy 1 molem podręczników chemii można pokryć Ziemię?
║
║
1 000 000 000
Odp: Około 200 000 lat !
16 cm
24 cm
2 cm
W szklance jest około 0,01 mola gazu.
Jak długo potrwa opróżnianie szklanki z
prędkością
1 000 000 000
cząsteczek na sekundę?
Odp:
około 40 mln warstw
– 850 km !
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
01 Pojęcia Podstawowe, Elementy
01 Pojecia podstawowe, klasyfikacj
01 E CELE PODSTAWYid 3061 ppt
Metodyka Obiektowa pojęcia podstawowe
Makaron, 01 - inf . podstawowe
ABC pieczenia cias3, 01 - inf . podstawowe
Krab, 01 - inf . podstawowe
Rokitnik, 01 - inf . podstawowe
Kuchnia meksykańska, 01 - inf . podstawowe
Pojęcia podstawowe, excel
więcej podobnych podstron