
MOL, MASA MOLOWA I
PODSTAWOWE PRAWA
CHEMICZNE

Mol jest to zbiór N elementów
materii.
N = 6,02 ·10
23
Przykład:
SO
3
to 1 mol czyli 6,02 ·10
23
cząsteczek tlenku
siarki (VI)
lub
H
2
O + SO
3
H
2
SO
4
czyli 1 mol cząsteczek wody reaguje z jednym
molem cząsteczek tlenku siarki(VI), tworząc
jeden mol cząsteczek kwasu siarkowego (VI).

Przykładowe zadanie wykorzystujące
definicję mola.
W naczyniu znajduje się 1,024 ·10
23
atomów
siarki. Oblicz, ile to moli.
Do rozwiązania zadania wystarczy skorzystać
z definicji mola:
1 mol
6,02 ·10
23
atomów siarki
x moli
1,024 ·10
23
atomów siarki
atomów
atomów
mol
x
23
23
10
02
,
6
10
024
,
1
1
x = 0,2 mola
Rozwiązanie: 1,024
·10
23
atomów siarki
stanowi 0,2 mola
tego pierwiastka.
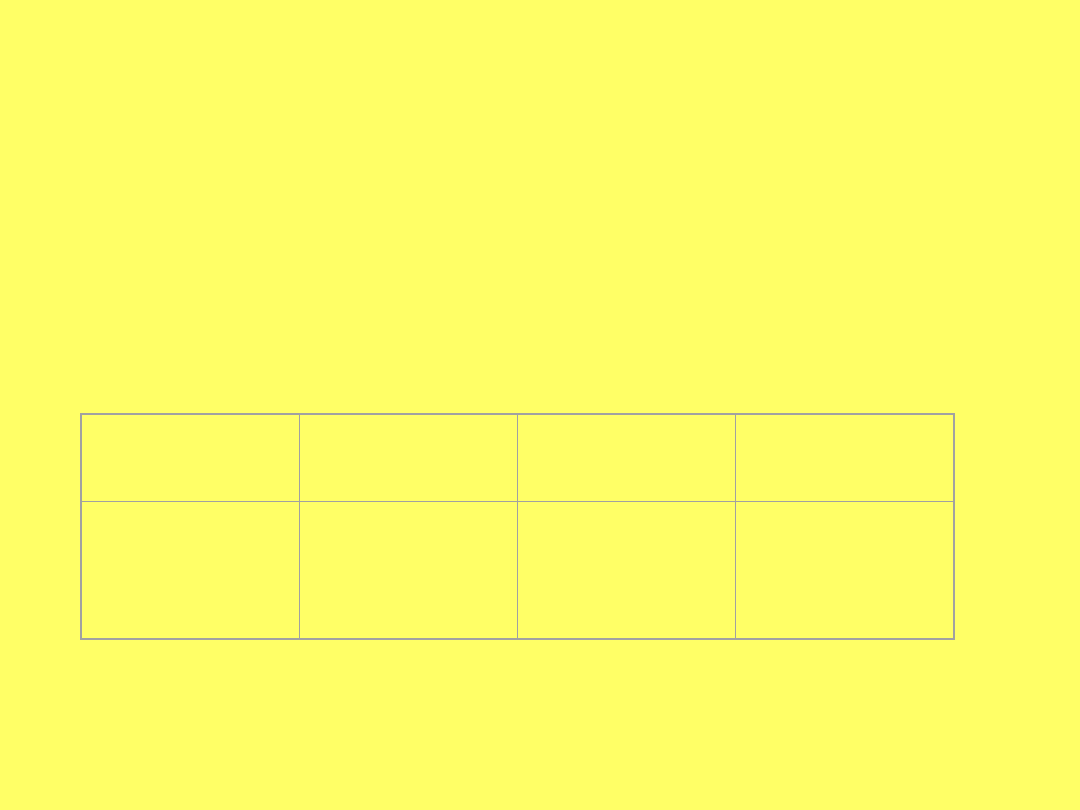
Masa molowa jest to masa 1 mola danej
substancji. Masę molową wyrażamy w g·mol
-1
, a
oznaczamy literą M. Masa molowa atomów
danego pierwiastka jest równa liczbowo jego
masie atomowej, a masa molowa danego
cząsteczek substancji pierwiastkowej lub
związku chemicznego jest równa liczbowo jego
masie cząsteczkowej.
Mol i masa molowa wybranych
substancji.
substancja
m
at
lub m
cz
Mol
Masa
molowa
C
O
2
CO
2
12 u
32 u
44 u
6,02·10
23
at
6,02·10
23
cz
6,02·10
23
cz
12 g·mol
-1
32 g·mol
-1
44 g·mol
-1
Przykładowe zadanie wykorzystujące definicję
masy molowej.
Chemik do pewnego doświadczenia potrzebuje 0,2
mola wodorotlenku sodu. Ile gramów substancji
należy odważyć do tego doświadczenia?
Do rozwiązania tego zadania potrzebna jest
definicja masy molowej.
M
(NaOH)
= 40 g/mol
1 mol
40g
0,2 mola
x g
mol
mola
x
1
40
2
,
0
x =
8g
Rozwiązanie: do
doświadczenia należy
odważyć 8 g NaOH.

Prawo zachowania masy: łączna masa wszystkich
substratów reakcji chemicznej jest równa łącznej
masie wszystkich produktów powstających w
wyniku tej reakcji.
Przykład:
CuSO
4
+ 2NaOH
Cu(OH)
2
+ Na
2
SO
4
substra
ty
produkty
160g+ 2·40g
98g + 142g
240g
240g
=

Prawo stałości składu – jeżeli dwa pierwiastki
łączą się w określony związek chemiczny, to zawsze
na ściśle określoną liczbę gramów jednego
pierwiastka przypada ściśle określona liczba gramów
pozostałych pierwiastków, co oznacza, że skład
chemiczny danego związku jest zawsze stały.
Przykład:
1mol FeS zawiera 1 mol Fe (56g) i mol S (32g).
Czyli stosunek masowy żelaza do siarki w tym
związku wynosi 56:32, czyli 7:4.

Gęstość jest to stosunek masy do objętości:
= m/V
Wielkość tę wyrażamy najczęściej w kg/m
3
, g/m
3
lub w g/cm
3
.
Przykład:
Ile cm
3
alkoholu etylowego należy odmierzyć, aby
ilość ta zawierała 46 g, czyli 1 mol tej substancji?
=0,79 g/cm
3
.
1 cm
3
alkoholu
0,79g
x cm
3
alkoholu
46 g
g
cm
g
x
79
,
0
1
46
3
x= 58,23
cm
3
Rozwiązanie: należy
odmierzyć 58,23 cm
3
alkoholu.
Prawa gazowe

Objętość molowa jest to objętość, jaką zajmuje 1
mol gazu doskonałego w warunkach normalnych.
V
Mol
= M/
Warunki normalne: ciśnienie : 1013,25 hPa,
temperatura: 273 K (0°C).
1 mol dowolnego gazu w warunkach normalnych
zajmuje stała objętość 22,4 dm
3
.
Przykład:
Ile cząsteczek tlenku węgla (II) znajduje się w
probówce o objętości 10 dm
3
? V= 22,4 dm
3
N =
6,02·10
23
cząsteczek
22,4 dm
3
6,02 ·10
23
cząsteczek 10 dm
3
x
cząsteczek

3
23
10
4
,
22
.
10
02
,
6
10
cz
dm
x
3
x = 2,69 ·10
23
cząsteczek
Rozwiązanie: w probówce tlenku węgla (II) o
objętości 10 dm
3
znajduje się 2,69 ·10
23
cząsteczek tego gazu.
Prawo Avogadra – w jednakowych objętościach
różnych gazów, w tych samych warunkach ciśnienia i
temperatury, znajduje się jednakowa liczba
cząsteczek.
Prawo Gay-Lussaca czyli prawo stałych
stosunków objętościowych – objętości reagujących
ze sobą gazów oraz gazowych produktów ich reakcji
odmierzone w tych samych warunkach (ciśnienia i
temperatury) pozostają do siebie w stosunku
niewielkich liczb całkowitych.

N
2
+ 3H
2
2NH
3
1
mol
3 mole
2 mole
22,4 dm
3
67,2
dm
3
44,8 dm
3
lub po
uproszczeniu
1
:
3
:
2
interpretacja
objętościowa prawo
Gay-Lussaca
Prawo
Avogadra
Obliczenia stechiometryczne.
Stechiometria – zajmuje się stosunkami
ilościowymi, w jakich reagują pierwiastki i związki
chemiczne. Stosunki te wyrażane są wzorami
chemicznymi oraz uzgodnionymi równaniami
reakcji.

Przykład:
Oblicz ile gramów magnezu należy poddać
spalaniu, aby otrzymać 8g tlenku magnezu.
2Mg + O
2
2MgO
Interpretacja molowa: spalenie 2 moli
magnezu prowadzi do utworzenia 2 moli
tlenku magnezu.
W treści zadania ilości substancji są określone
w gramach, a zatem układając proporcję,
również użyjemy tych jednostek, bowiem
ustalenie, jaką masę mają 2 mole magnezu,
czy 2 mole tlenku magnezu, nie stanowią już
problemu.
48g Mg
80g MgO
x g Mg
8g
MgO

g
g
g
x
80
8
40
x = 4,8 g
Rozwiązanie: należy spalić 4,8 g
magnezu.
Zadanie domowe: proszę przeanalizować wszystkie
zadania od strony 69 do strony 79 oraz rozwiązać
dwa dowolne zadania, których treść podana jest
również na wyżej wymienionych stronach w akapicie
sprawdź, czy potrafisz. Zadania proszę przesłać
mailem.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Mol i masa molowa id 306822 Nieznany
Podstawowe prawa chemiczne
Podstawowe prawa chemiczne
Chemia - Mol i masa molowa, Liceum Matura, Chemia, Chemia(1)
mol i masa molowa cz1 zadania
ściąga chemia mol i masa molowa
Mol i masa molowa zadania
Mol i masa molowa, Mol i masa molowa
Podstawowe prawa chemiczne
mole2, MOL,MASA MOLOWA - ZADANIA
Chemia Mol, Masa molowa
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Mol i masa molowa id 306822 Nieznany
Podstawowe prawa chemiczne
więcej podobnych podstron