
Podstawowe prawa
chemiczne
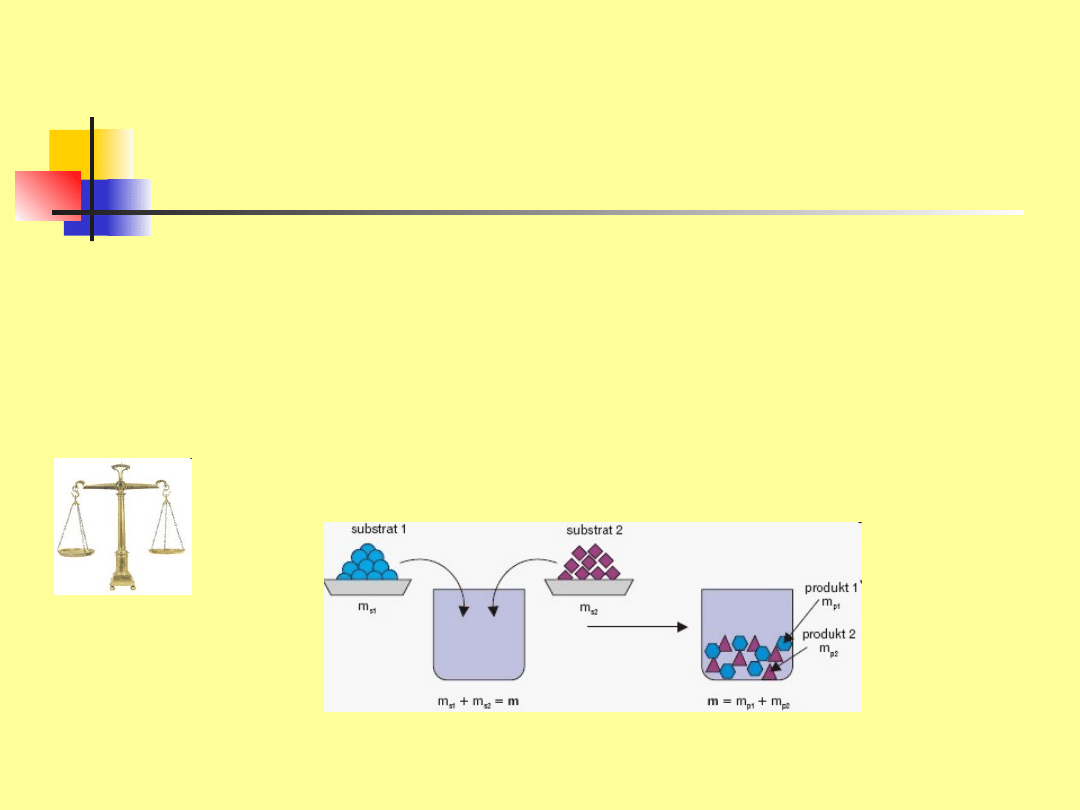
Prawo zachowania masy
W układzie zamkniętym łączna masa substratów przed
reakcją jest równa łącznej masie produktów po reakcji.
masa substratów = masa produktów

Prawo zachowania masy
Zachowanie masy podczas reakcji chemicznych
stwierdzili i prawo zachowania masy w chemii
sformułowali, niezależnie od siebie Rosjanin
Michaił Łomonosow (1756) i Francuz Antoine
Lavoisier (1785).
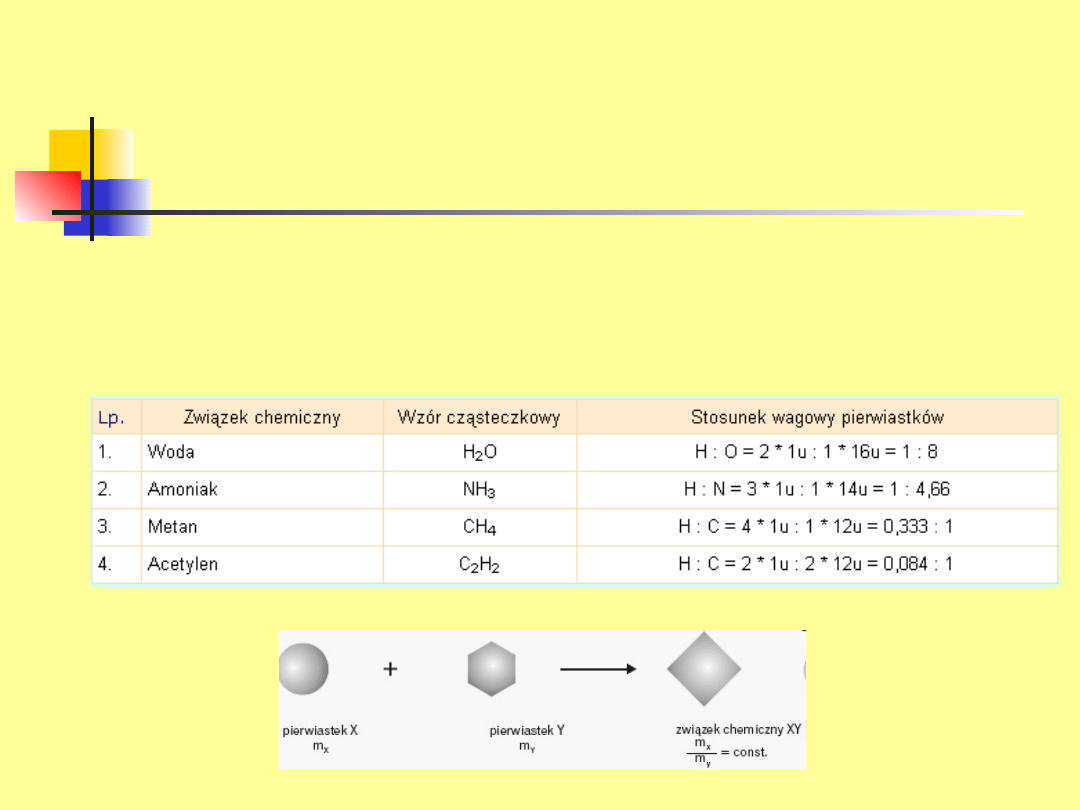
Prawo stałości składu
Stosunek masowy pierwiastków w związku chemicznym
jest dla danego związku wielkością stałą.

Prawo stałości składu
Prawo to zostało sformułowane w 1799 roku przez
Josepha Louisa Prousta.
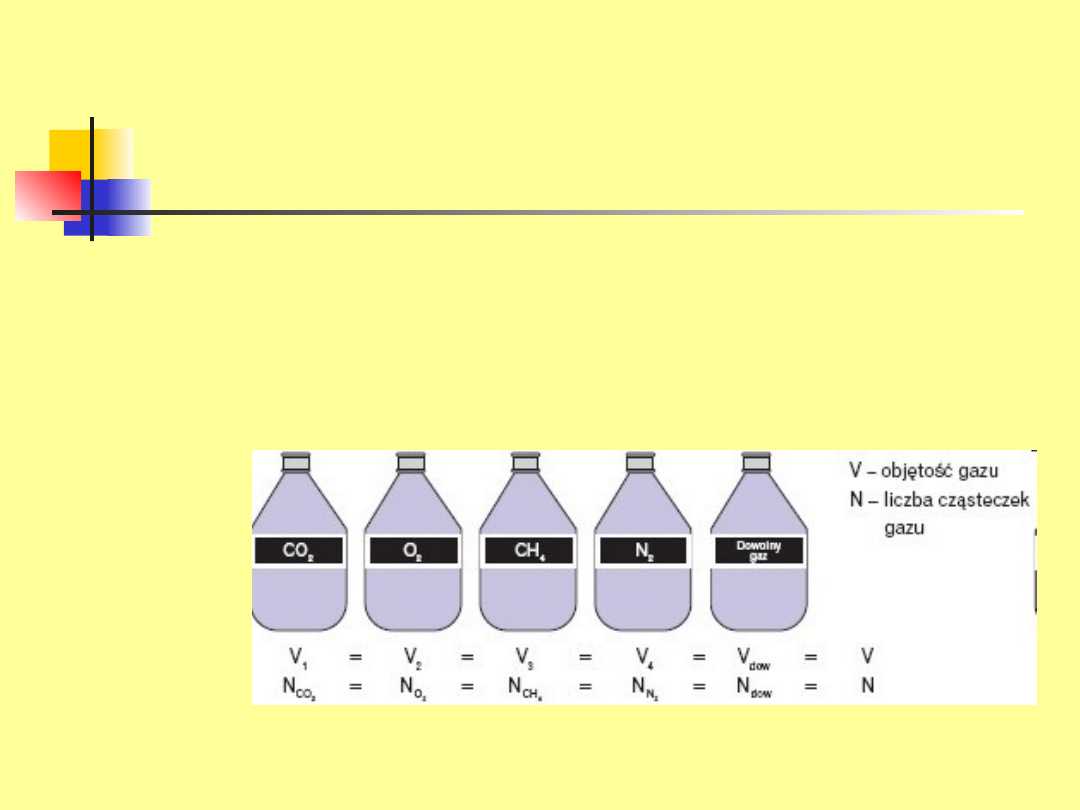
Prawo Avogadra
W jednakowych objętościach różnych gazów i par, w
stałej temperaturze i ciśnieniu, znajduje się jednakowa
liczba cząsteczek.

Prawo Avogadra
W warunkach normalnych mol dowolnego gazu zajmuje 22,4
dm
3
. A to oznacza, że w warunkach normalnych 22,4 dm
3
tlenu, dwutlenku węgla, helu i wielu innych gazów będzie
zawierało 6,02 * 10
23
cząsteczek lub atomów, czyli po prostu
1 mol.
N
a
= 6,02 * 10
23
Liczba Avogadra
1 mol = 6,02 * 10
23
cząsteczek/atomów

Prawo Avogadra
Prawo to zostało
sformułowane jak sama
nazwa wskazuje przez
włoskiego fizyka Amadeo
Avogadra w XIX wieku.

Prawo stałych stosunków
objętościowych gazów
Gazy łączą się w stosunkach, które można wyrazić
niewielkimi liczbami całkowitymi pod warunkiem, że
temperatura i ciśnienie są stałe. Liczbami tymi są
współczynniki stechiometryczne reakcji.
2 H
2
+ O
2
→ 2 H
2
O
2 : 1 : 2
N
2
+ 3 H
2
→ 2 NH
3
1 : 3 : 2

Prawo stałych stosunków
objętościowych gazów
Prawo to odkrył na
drodze doświadczalnej i
sformułował chemik i
fizyk francuski Gay-
Lussac w 1808 roku.

Prawo zachowania energii
W układzie izolowanym suma wszystkich rodzajów
energii układu jest stała (nie zmienia się w czasie).
Energia w układzie izolowanym nie może być ani
utworzona, ani zniszczona, może jedynie zmienić się
forma energii.
Różne składowe energii całkowitej, np.:
energia kinetyczna, potencjalna, wewnętrzna,
chemiczna i masy nie muszą być zachowane i mogą
swobodnie w siebie przechodzić

Prawo działania mas
zwane prawem Guldberga
i Waagego
W stanie równowagi chemicznej stosunek iloczynu stężeń produktów
reakcji (w potęgach ich współczynników stechiometrycznych) do
iloczynu stężeń substratów (w potęgach ich współczynników
stechiometrycznych) jest w danych warunkach ciśnienia i
temperatury wielkością stałą i charakterystyczną dla danej reakcji.
K
c
= k
prod
/ k
substr
Wielkość „K
c
” będąca ilorazem stałych szybkości reakcji
wyznaczających równowagę nosi nazwę stałej równowagi
chemicznej.
K
c
- oznacza stężeniową stałą równowagi chemicznej (zwaną w
skrócie stałą równowagi) - wielkość charakterystyczną dla
danej reakcji w danej temperaturze.
Zależność powyższa znana jest pod nazwą prawa działania mas
(Guldberga i Waagego), lub prawa równowagi chemicznej.

Prawo działania mas
zwane prawem Guldberga
i Waagego
Wartość stałej równowagi zależy od “kierunku” zapisu
równania chemicznego i temperatury, np:
H
2
+ I
2
↔ 2 HI 2 HI ↔ H
2
+ I
2
K
c
= [HI]
2
/ [H
2
] * [I
2
] K
c
= [H
2
] *
[I
2
] / [HI]
2

Prawo działania mas
zwane prawem Guldberga
i Waagego
Prawo to zostało
wprowadzone
wyprowadzone w 1864 r.
przez norweskich
chemików Guldberga i
Waagego.

Prawa elektrolizy
Faraday’a
1. Masa m substancji wydzielonej na elektrodzie jest wprost
proporcjonalna do natężenia prądu I płynącego przez
elektrolit i do czasu t przepływu prądu, tj. do ładunku
elektrycznego Q, który przepłynął przez elektrolit.
m = k I t = k Q
gdzie k - równoważnik elektrochemiczny substancji
2. Ładunek wymagany do wydzielenia się lub wchłonięcia
jednostkowej masy m określony jest wzorem:
Q = FmZ/M
gdzie Q jest tym ładunkiem, M - tzw. masą molową danego
jonu, a F - stałą Faradaya

Prawa elektrolizy
Faraday’a
Przykład.
•Ile gramów miedzi wydzieli się na katodzie platynowej
podczas elektrolizy wodnego roztworu
Cu(NO3)2prądem o natężeniu 1A w czasie 9650
sekund?
–Dane: I = 1 At = 9650 sMCu=63,5 g/molF = 96 500 C
–Szukane: m = ?
–Rozwiązanie:
•reakcja na katodzie: Cu
2+
+2e = Cu → z = 2
•m = kIt= [M/(zF)]·It = [63,5/(2·96 500)]·1· 9650=3,17
g
–Odpowiedź: Na katodzie wydzieli się 3,17 g miedzi

Prawa elektrolizy
Faraday’a
Prawo to sformułował
angielski fizyk i chemik
Michael Faraday.

Prawo podziału Nernsta
Dla dwu nie mieszających się, będących w
kontakcie i pozostających ze sobą w
równowadze cieczy, stosunek stężeń (ściślej
aktywności) trzeciego składnika,
rozpuszczonego w każdej z tych cieczy, jest stały
w danych warunkach temperatury i ciśnienia.
Stosunek ów nazywa się współczynnikiem
podziału i nie zależy od ilości substancji, a
zmienia się ze zmianą temperatury i ciśnienia.
Prawo to jest podstawą procesów ekstrakcji.

Prawo podziału Nernsta
Oznaczając przez cI oraz cII stężenia
substancji rozpuszczonej w fazach I oraz II
można zapisać:
R = cI / cII
gdzie r – współczynnik podziału
Prawo podziału Nernsta stosuje się w tej
formie
w roztworach rozcieńczonych w przypadku, gdy
stan cząsteczkowy substancji rozpuszczonej
jest jednakowy w obu fazach.

Prawo podziału Nernsta
Prawo to zostało
sformułowane przez
niemieckiego fizyka i
chemika Walthera
Hermanna Nernsta.

Dziękuję za uwagę.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Podstawowe prawa chemiczne
Podstawowe prawa chemiczne
MOL MASA MOLOWA I PODSTAWOWE PRAWA CHEMICZNE
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Podstawowe prawa chemiczne
Podstawowe prawa chemiczne
Podstawowe pojęcia i prawa chemiczne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Podstawowe pojęcia i prawa chemiczne, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
wyznaczenie współczynnika lepkości na podstawie prawa Stokesa, Uczelnia PWR Technologia Chemiczna, S
I.wykl nieorg, Wprowadzenie - podstawowe pojęcia, prawa chemiczne, jednostki
ukladokres, Układ okresowy pierwiastków, układ periodyczny pierwiastków, tablica grupująca pierwiast
podstawy prawa wykl, Prawo dz 9
Podstawy prawa cywilnego cz 2
Prawa chemiczne
Podstawy obliczeń chemicznych 6
więcej podobnych podstron