
Podstawowe prawa
chemiczne
1

Chemia nowożytna jest nauką:
•o substancjach, ich właściwościach, oraz
przemianach fizycznych i chemicznych jakim te
substancje ulegają
•o warunkach wpływających na kierunek,
szybkość i zasięg tych przemian
•o efektach energetycznych przemian
•o stosunkach ilościowych mas substancji
biorących w nich udział
Chemia jest nauką teoretyczną i doświadczalną.
Wyniki badań stanowią podstawę do uogólnień w postaci
wzorów matematycznych, praw i teorii, wykorzystywanych
następnie w procesach przekształcania substancji.
Badania chemiczne polegają na obserwacji procesów
zachodzących samorzutnie w przyrodzie oraz procesów
prowadzonych w ściśle kontrolowanych warunkach

1650 Anglia
wyjaśnienie
prawa
gazowego
przez
założenie,
że gaz składa się z cząstek
Robert BOYLE
1627 - 1691
lub
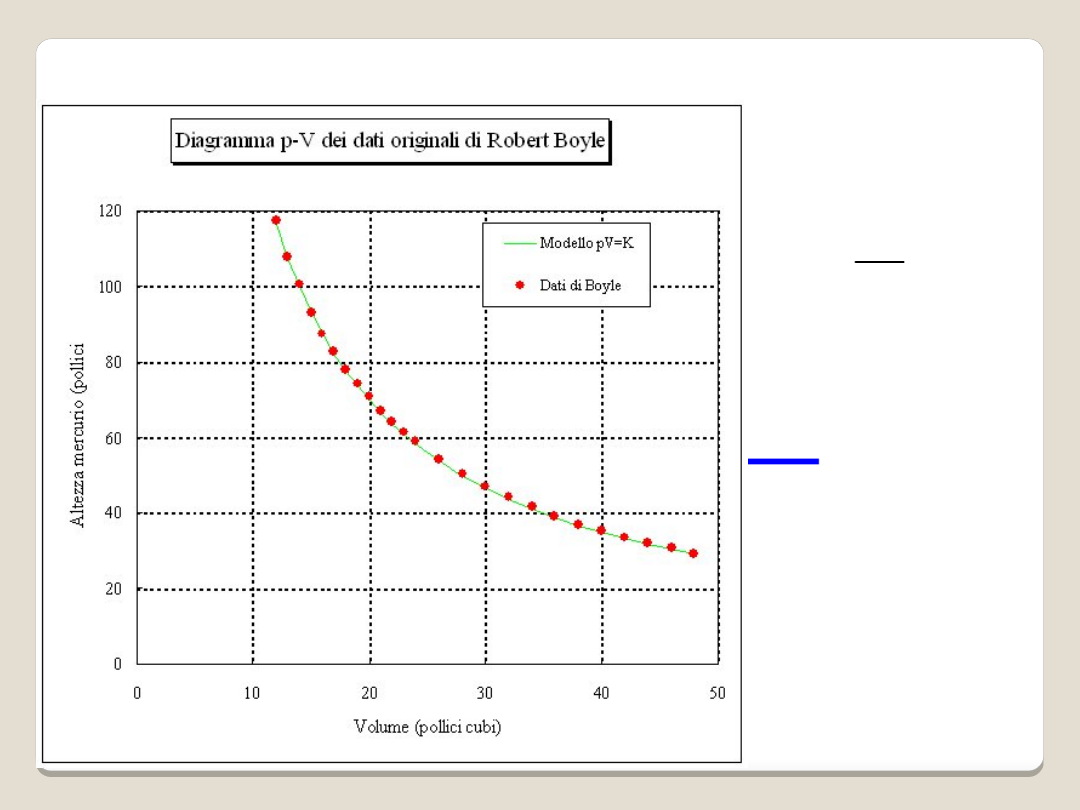
pV = const (gdy T = const)
Edme Mariotte
1676 (Francja)
"W stałej temperaturze objętość V
danej masy gazu jest odwrotnie
proporcjonalna do jego ciśnienia p."
Prawo Boyle-Marriotte’a
p
V
1
~
4
p
V
1
~
Masa gazu i temperatura = const
Masa gazu
Ciśnienie
Prawo Boyle-Marriotte’a
5
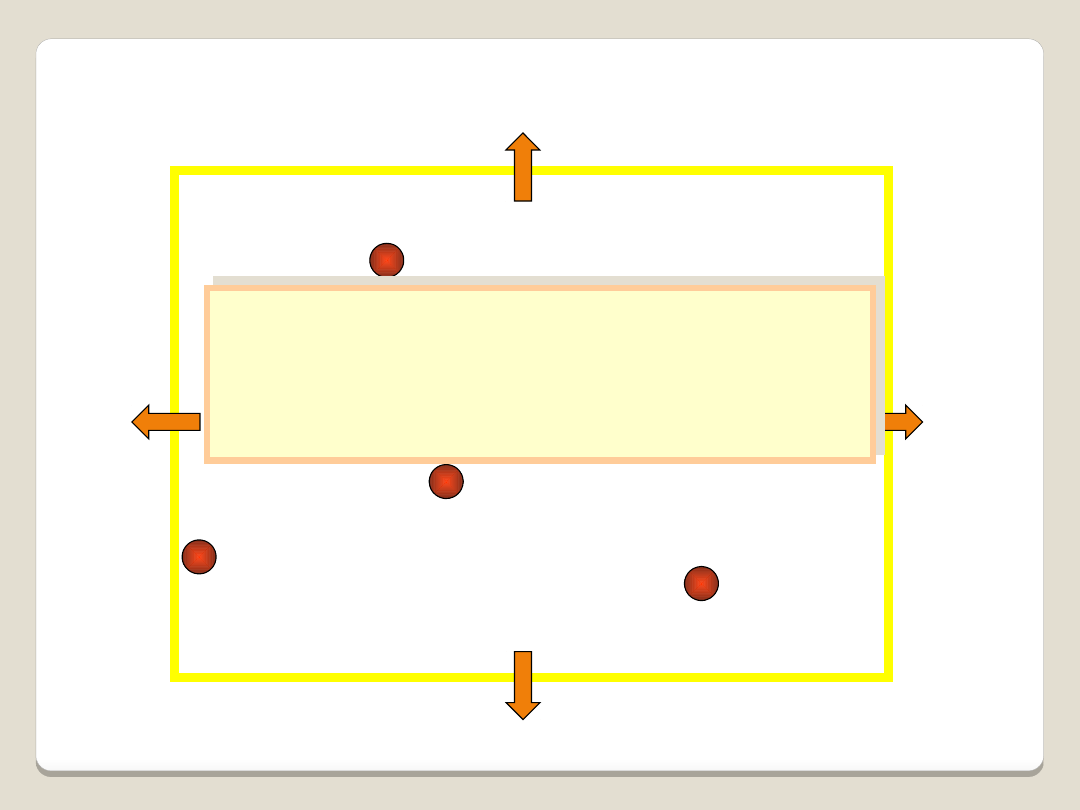
Jeżeli ciśnienie gazu jest wynikiem zderzeń
cząstek ze ścianami naczynia, to zmniejszając
np. dwukrotnie objętość naczynia - zwiększymy
dwukrotnie liczbę zderzeń, czyli dwukrotnie
zwiększymy ciśnienie.
Jeżeli ciśnienie gazu jest wynikiem zderzeń
cząstek ze ścianami naczynia, to zmniejszając
np. dwukrotnie objętość naczynia - zwiększymy
dwukrotnie liczbę zderzeń, czyli dwukrotnie
zwiększymy ciśnienie.
Wyjaśnienie w oparciu o koncepcję atomistyczną
6
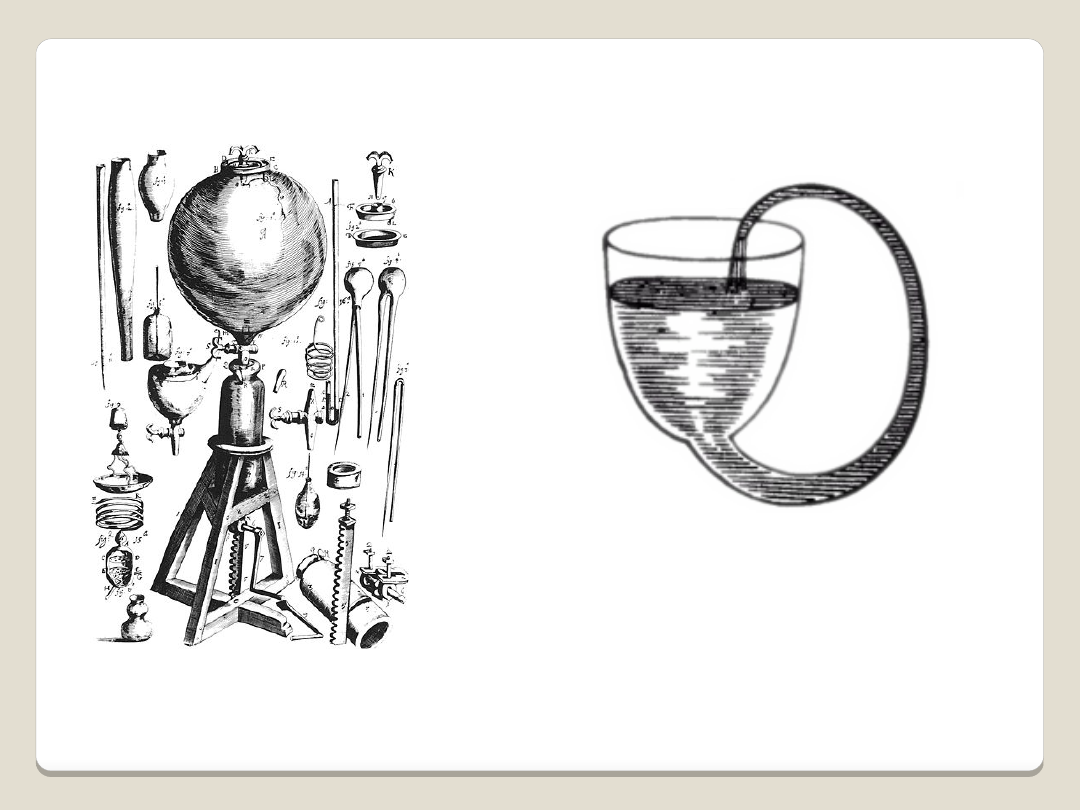
„Samonapełniająca się flaszka”
Boyle’a
Pneumatical Engine
– pompa
próżniowa przy pomocy której
wykonywał eksperymenty z gazami
Wynalazki Boyle’a
7

p - ciśnienie
V - objętość
E
śr
- średnia energia kinetyczna
wszystkich cząstek w gazie
p - ciśnienie
V - objętość
E
śr
- średnia energia kinetyczna
wszystkich cząstek w gazie
Daniel BERNOULLI
1700 - 1782
1738 Szwajcaria
ilościowe
sformułowanie teorii
kinetycznej gazów
Bazylea XVII w.
Bazylea XVII w.
śr
E
3
2
pV
8
2
2
2
2
kin
3
1
2
4
śr
mv
mv
mv
mv
1
E
4
2
2
2
2
�
�
=
+
+
+
�
�
�
�
Co to jest średnia energia
kinetyczna cząsteczek w gazie?
v
1
v
2
v
3
v
4
m
m
m
m
9
śr
2
pV
E
3
=
..jak pamiętamy Bernoulli wykazał:
R
T
pV
m
śr(m)
2
E
3
R
T
=
śr(m)
3
E
RT
2
=
dla 1 mola gazu doskonałego
dla 1 mola gazu doskonałego
m
(m)
10
śr
2
pV
E
3
=
m
(m)
śr(m)
3
E
RT
2
=
dla 1 mola gazu doskonałego
dla 1 mola gazu doskonałego
śr
2
pV
E
3
=
śr
3
E
nRT
2
=
dla n moli gazu doskonałego
dla n moli gazu doskonałego
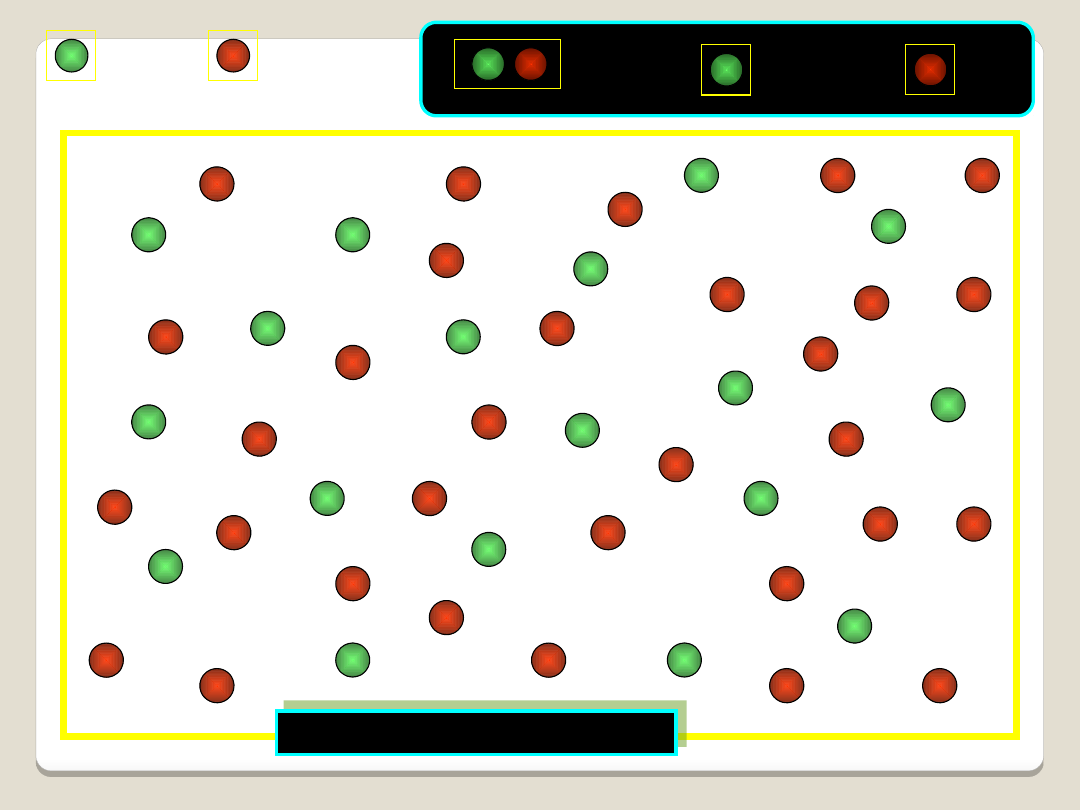
pV = nRT
RÓWNANIE CLAPEYRONA
11
WARUNKI NORMALNE - definicja
ciśnienie: 101,325 kPa
temperatura: 0°C (273,15 K)
Objętość 1 mola gazu w warunkach normalnych:
R
T
pV
m
p
RT
V
m
R = 8,3145 J mol
-1
K
-1
R = 8,3145 J mol
-1
K
-1
l22,4 dm
3
12

Amadeo AVOGADRO
1776 - 1856
1811 Włochy
pojęcie cząsteczki jako
najmniejszej części związku
chemicznego
w konsekwencji koncepcji atomistycznej
Daltona oraz prawa Gay-Lussaca:
w konsekwencji koncepcji atomistycznej
Daltona oraz prawa Gay-Lussaca:
W takich samych warunkach ciśnienia i temperatury, te same
objętości różnych gazów zawierają takie same liczby cząsteczek.
W takich samych warunkach ciśnienia i temperatury, te same
objętości różnych gazów zawierają takie same liczby cząsteczek.
Prawo Avogadro
Prawo Avogadro
13

Definicja mola i masy molowej
Masa molowa jest to taka ilość gramów
substancji, która jest równa liczbowo jej
masie atomowej lub cząsteczkowej
1 mol to ilość substancji, która zawiera taką samą
liczbę cząsteczek lub atomów jaka zawarta jest
w 12 gramach
C
12
6
N
A
= 6,022·10
23
liczba
Avogadro
liczba
Avogadro
14

N
A
= 6,022·10
23
liczba Avogadro
liczba Avogadro
Jak wyobrazić sobie tę liczbę?
ostatnia osoba w szeregu zobaczy światło po....
300 milionach lat!
300 milionach lat!
15
pV = nRT
pV = const
p = const·T
V = const·T
stała
objętość V
stałe
ciśnienie p
stała
temperatura T
przemiana
izochoryczna
przemiana
izotermiczna
przemiana
izobaryczna

Michaił ŁOMONOSOW
1711 - 1765
1748 Rosja
prawo zachowania masy
*)
A + B + C + ...... = D + E + .....
substraty
produkty
sumaryczna masa substratów reakcji jest równa
sumarycznej masie produktów
sumaryczna masa substratów reakcji jest równa
sumarycznej masie produktów
*)
niezależnie 1777 A. Lavoisier (Francja)
17
A + B = C + D
+
=
+
Teoria atomistyczna wyjaśnia prawo
zachowania masy:
18

Prawo zachowania masy
– deficyt masy w reakcjach chemicznych
C + O
2
CO
2
+
DH
DH = - 32820 J/g
Ale to wcale nie oznacza, że tyle cząsteczek brakuje!
2
mc
E
2
2
300000000
32820
c
H
m
dla 1 g C
= -3,6·10
-10
g
12
10
5
2
CO
m
m
cząsteczek CO
2
odpowiada to masie
g
m
CO
23
10
3
,
7
2
masa cząsteczki CO
2
To bardzo mało i zwykle można ten efekt pominąć,
ale…
19

Antoine LAVOISIER
1734 - 1794
1789 Francja
Obalenie teorii flogistonu
Teoria flogistonu – zakładała występowanie w
ciałach palnych substancji zwanej flogistonem
(cieplikiem).
pojęcie pierwiastka chemicznego
konsekwencją reakcji
chemicznych są efekty cieplne
spalanie polega na łączeniu się z
tlenem
20

„pierwiastek to substancja, której
żadnymi znanymi sposobami nie można
rozdzielić na substancje prostsze”
„
pierwiastek to substancja, której
żadnymi znanymi sposobami nie można
rozdzielić na substancje prostsze”
Definicja pierwiastka wg.
Lavoisier’a:
21

Współczesna definicja
pierwiastka chemicznego:
substancja złożona z atomów
o jednakowej liczbie protonów
w jądrze atomowym
22

Koniec XVIII w. -
dzięki pracom Lavoisiera chemia staje się
nauką ilościową
• udowodnienie istnienia wodoru
• woda składa się z wodoru i tlenu
• diament jest odmianą grafitu
• oddychanie jest procesem spalania
• powietrze składa się z co najmniej dwóch składników „oxygenu” i
„azotu”
• stworzenie zasad nazewnictwa chemicznego
Kilka przykładów jego osiągnięć:
23
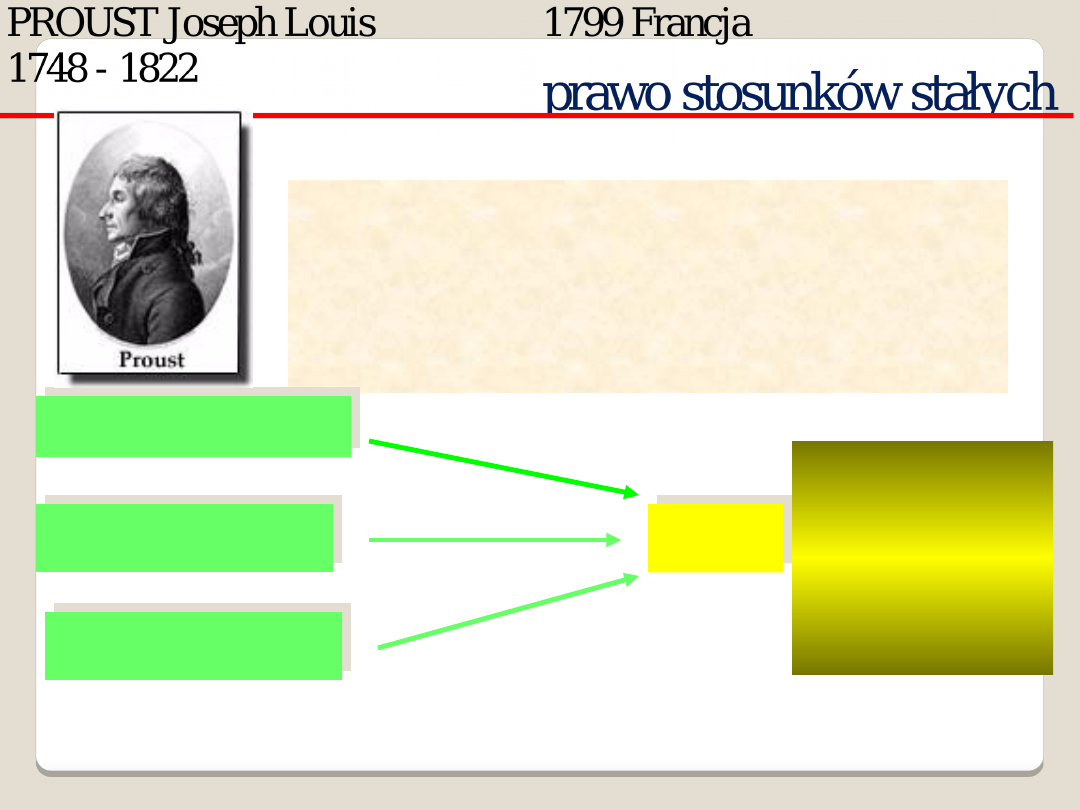
Każdy
związek
chemiczny,
niezależnie
od
sposobu
otrzymania ma stały skład
jakościowy i ilościowy
NaOH + HCl
NaOH + HCl
Na + Cl
2
Na + Cl
2
Na
2
O + HCl
Na
2
O + HCl
NaCl
NaCl
39,3%
sodu
60,7%
chloru
24
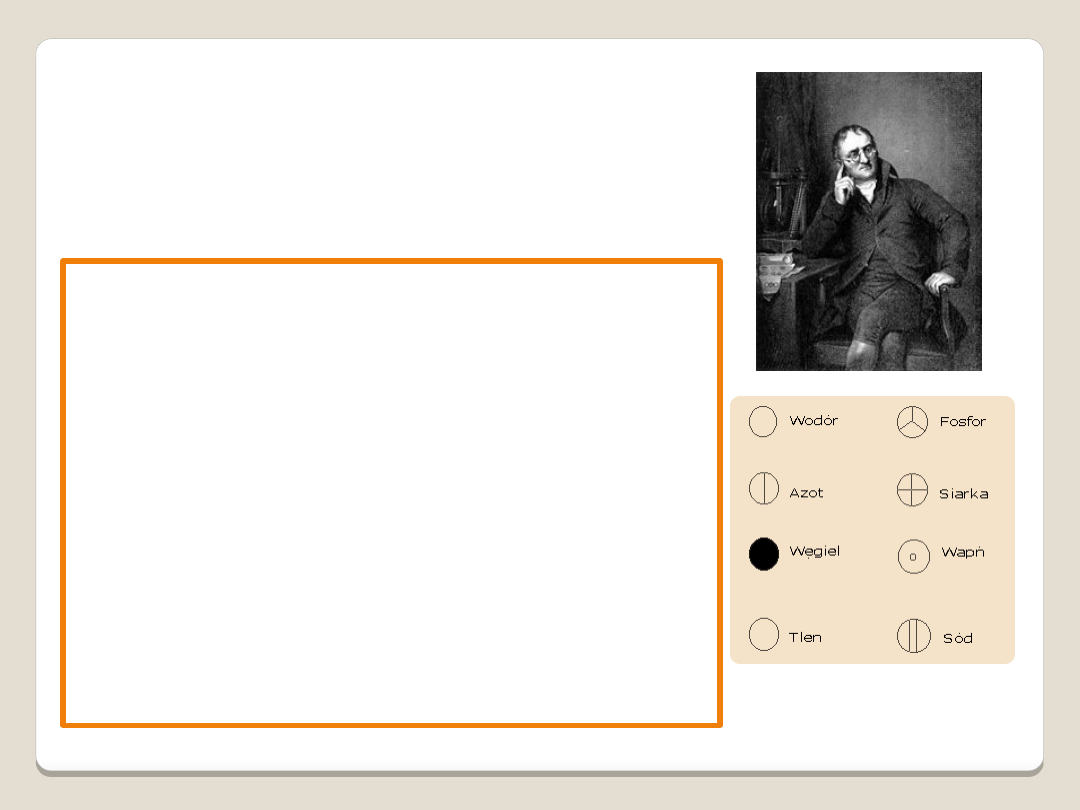
Symbole chemiczne
pierwiastków J. Daltona
Podstawowe założenia teorii Daltona:
•Materia złożona jest z niewidzialnych atomów
•Wszystkie atomy jednego pierwiastka mają
identyczną masę i pozostałe właściwości
•Każdy pierwiastek zbudowany jest z
niepowtarzalnych atomów, różniących się od
innych masą
•Atomy są niezniszczalne i nie podlegają
przemianom podczas reakcji chemicznych,
zmienia się tylko ich wzajemne ułożenie i
powiązanie
•Cząsteczka związku chemicznego składa się
ze skończonej i niewielkiej liczby atomów
różnych pierwiastków
John Dalton (1766 - 1844) – dojrzała
teoria atomistyczna
A new System of Chemical Philosophy
25
=
p
1
+
p
2
p
1
p
2
P
PRAWO DALTONA
PRAWO DALTONA
Każdy związek chemiczny, niezależnie od
sposobu otrzymania ma stały skład
jakościowy i ilościowy
Każdy związek chemiczny, niezależnie od
sposobu otrzymania ma stały skład
jakościowy i ilościowy
Czas miał pokazać, że twierdzenie to jest słuszne dla grupy związków
zwanych:
daltonidami
Należą do nich wszystkie substancje gazowe i ciekłe.
np. H
2
O, CH
4,
C
2
H
5
OH, SO
2
, HCl, HNO
3,
etc.
Czas miał pokazać, że twierdzenie to jest słuszne dla grupy związków
zwanych:
daltonidami
Należą do nich
wszystkie
substancje gazowe i ciekłe.
np. H
2
O, CH
4,
C
2
H
5
OH, SO
2
, HCl, HNO
3,
etc.
W grupie związków będących ciałami stałymi wyróżnia się grupa:
bertolidów
związków, które nie spełniają prawa stałości składu:
np. TiO
1+x
Zn
1+x
O, Ag
x
Sb
1-x
Se
2
W grupie związków będących ciałami stałymi wyróżnia się grupa:
bertolidów
związków, które nie spełniają prawa stałości składu:
np. TiO
1+x
Zn
1+x
O, Ag
x
Sb
1-x
Se
2
Prawo DALTONA
27

Budowa atomu
28

Składniki jądra atomowego - nukleony
protony (+) i neutrony (0)
liczba atomowa Z - liczba protonów w jądrze
liczba masowa A - liczba nukleonów w jądrze
liczba neutronów N = A - Z
X
A
Z
symbol
pierwiastka
Cl
35
17
jądro izotopu chloru
17 protonów, 18 neutronów (35-17)

podstawowe
definicje
atom pierwiastka X określony przez liczbę
atomową Z i liczbę masową A
nuklidy o takiej samej liczbie atomowej Z
nuklidy o takiej samej liczbie masowej A
NUKLID
NUKLID
IZOTOPY
IZOTOPY
IZOBARY
IZOBARY
X
A
Z
Cl
Cl
36
17
35
17
V
Ti
50
23
50
22
cecha
proton
neutron
ładunek
-e
0
masa
1836m
e
1840m
e
klasyczny
promień
~10
-15
m
~10
-15
m
moment
magnetyczny
tak
tak
struktura
wewnętrzna
uud
udd
charakterystyka nukleonów
m
e
= 9,108·10
-31
kg
e = -1,602·10
-19
C
u – kwark górny (+2/3)e
d – kwark dolny (-1/3)e
Jak przedstawić strukturę protonu?
Jak przedstawić strukturę protonu?
u
u
d
+(2/3)e
-(1/3)e
+(2/3)e
u
d
kwark
górny
kwark
dolny
gluon
uud
Jak przedstawić strukturę neutronu?
Jak przedstawić strukturę neutronu?
u
d
kwark
górny
kwark
dolny
gluon
u
d
+(2/3)e
-(1/3)e
d
-(1/3)e
udd
Jądro atomowe....
Jądro atomowe....
...to pojedynczy proton (w atomie wodoru) lub układ złożony z protonów
i neutronów utrzymujący się dzięki tzw.
SIŁOM JĄDROWYM
C
14
6

Masa atomowa
-
to masa pojedynczego atomu
Bezwzględna masa atomowa
– jednostka [kg]
Względna masa atomowa
– jednostka [u] (unit, dalton)
np. masa atomu siarki = 5.3 *10
-26
[kg]
12
6
27
1
1u
masy atomu
C
12
1u
1,66·10
kg
-
=
=
6 protonów
6 protonów
+ 6 neutronów
35

*)
powrócimy do tego problemu na dalszych wykładach
Ten sam pierwiastek może zawierać atomy o
różnej masie tzw.
izotopy
*)
, dlatego wprowadza
się pojęcie
średniej masy atomowej
M
pierwiastka, którą możemy wyznaczyć znając
masy atomów tego pierwiastka oraz ich
zawartości procentowe.
Masa atomowa
36
7,1%
M
2
=6,01
92,9%
M
1
= 7,01
Średnia masa atomowa litu M
Li
skład atomowy litu:
.
a
.
m
.j
41
,
6
01
,
7
100
9
,
92
01
,
6
100
1
,
7
M
Li
37

UKŁAD OKRESOWY
UKŁAD OKRESOWY
średnie masy atomowe
38
Joseph Louis GAY-LUSSAC
1778 - 1850
Prawo stosunków objętościowych
Stosunki objętościowe gazów uczestniczących
w reakcji chemicznej wyrażają się za pomocą
niewielkich liczb całkowitych
H
2
O
2
H
2
H
2
O
H
2
O
+
=
2 : 1 : 2
39

Masa cząsteczkowa
jest sumą średnich mas
atomowych atomów
wchodzących w skład
cząsteczki
i
cz
M
M
M
KCN
= M
K
+ M
C
+ M
N
= 39,1+12,0+14,0 = 65,1 [u]
40

A
)
a
(
cz
N
M
m
Masy atomów i cząsteczek
Masy atomów i cząsteczek
1 mol substancji zawiera N
A
= 6,022·10
23
cząsteczek (atomów) i ma masę
(w gramach) równą liczbowo jej masie cząsteczkowej (atomowej) M
1 mol substancji zawiera N
A
= 6,022·10
23
cząsteczek (atomów) i ma masę
(w gramach) równą liczbowo jej masie cząsteczkowej (atomowej) M
zatem masa atomu (cząsteczki) wynosi:
zatem masa atomu (cząsteczki) wynosi:
1 < M <
100000
10
-27
kg < m
cz(a)
< 10
-22
kg
41

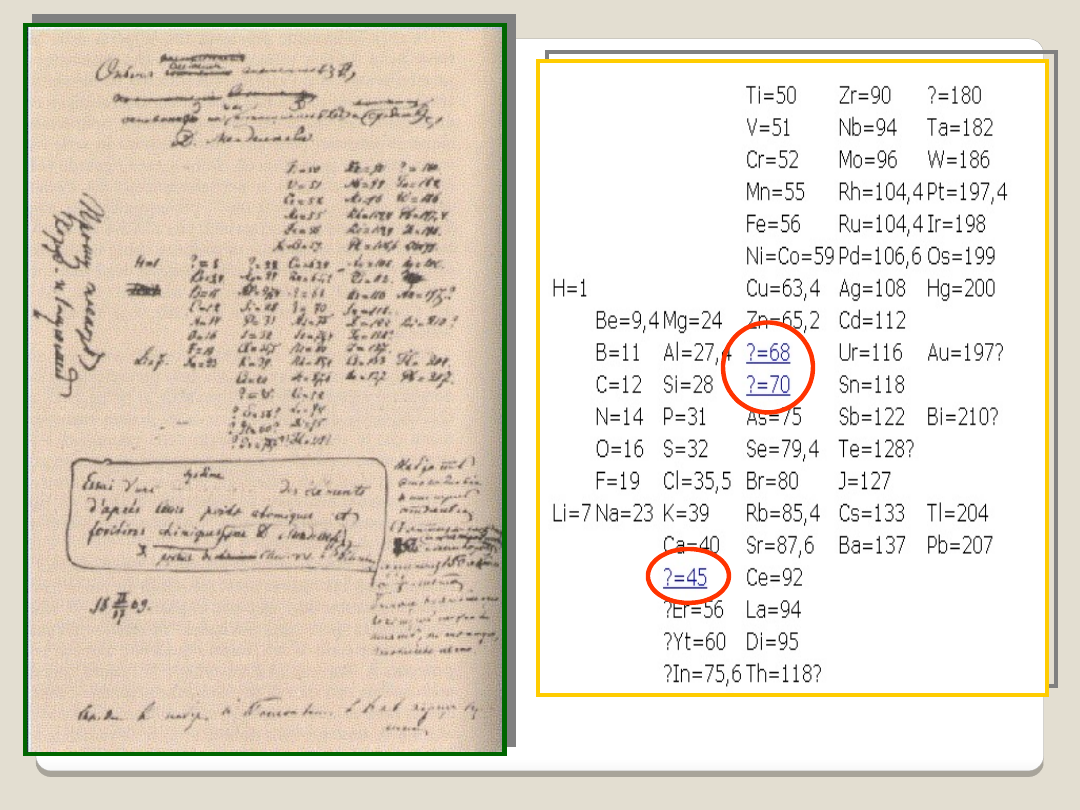
MENDELEJEW Dymitr
Iwanowicz1834 - 1907
1869 Rosja
prawo
okresowości
chemia staje się nauką teoretyczną
chemia staje się nauką teoretyczną
42
43
H
Na
Li Be
Mg
K Ca
Ti V Cr Mn Fe Co Ni Cu Zn
As Se Br
B C
N O
F
Al Si
P
S Cl
Rb Sr Y Zr
Mo
Ru Rh
Cs Ba La
Ta W
Os Ir
Pd Ag Cd
Sb Te
I
Sn
Bi
Pb
Hg
Au
Pt
Ce
Tb
Th
U
Er
1,01
6,94
9,01
10,81 12,01 14,01 16,00 19,00
4,00
20,18
22,99 24,30
26,98 28,09 30,97 32,07 35,50 39,95
39,10 40,08 44,96 47,88 50,94 52,00 54,94 55,85 58,93 58,69 63,55 65,40 69,72 72,61 74,92 78,96 79,90 83,80
85,47 87,62 89,91 91,22 92,91 95,94 97,90 101,07 102,91 106,42 107,87 112,41 114,82 118,71 121,75 127,60 126,91 131,29
132,91 137,33 138,90 178,49 180,95 183,85 186,21 190,20 192,22 195,08
200,59 204,38 207,20 208,98 208,98 209,99 222,02
223,02 226,03 227,03
140,12 140,91 144,24 144,91 150,36 151,97 157,25 158,93
164,93 167,26
173,04 174,97
232,04 231,04 238,03 237,05 244,06 243,06 247,07 247,07 251,08 252,08 257,10 258,10 259,10 260,10
70
1
3
4
11
12
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
18
17
16
15
14
13
10
2
9
8
7
6
5
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
72
73
74
75
76
78
79
80
81
82
83
84
85
86
87
88
89
58
59
60
61
62
63
64
65
66
67
68
69
71
90
91
92
93
94
95
96
97
98
99
100
101
102
103
77
Lantanowce
Aktynowce
Układ okresowy pierwiastków
Mo
Nb
196,97
162,50
168,93
1869 rok
Sc
Ge
Ga
1886
1886
1879
1879
1875
1875
44
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Prawo zachowania masy – deficyt masy w reakcjach chemicznych
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Podstawowe prawa chemiczne
Podstawowe prawa chemiczne
Podstawowe prawa chemiczne
MOL MASA MOLOWA I PODSTAWOWE PRAWA CHEMICZNE
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Podstawowe prawa chemiczne
Podstawowe pojęcia i prawa chemiczne, ~FARMACJA, I rok, chemia (ciul wie co), Semestr I
Podstawowe pojęcia i prawa chemiczne, Notatki i materiały dodatkowe, Chemia, materiały dodatkowe
wyznaczenie współczynnika lepkości na podstawie prawa Stokesa, Uczelnia PWR Technologia Chemiczna, S
I.wykl nieorg, Wprowadzenie - podstawowe pojęcia, prawa chemiczne, jednostki
ukladokres, Układ okresowy pierwiastków, układ periodyczny pierwiastków, tablica grupująca pierwiast
podstawy prawa wykl, Prawo dz 9
Podstawy prawa cywilnego cz 2
Prawa chemiczne
Podstawy obliczeń chemicznych 6
więcej podobnych podstron