
Niewirusowe
Niewirusowe
(syntetyczne
(syntetyczne
) nośniki
) nośniki
DNA
DNA
Magdalena Dudek
Paulina Kucharzewska

Metody wprowadzania transgenu (genu
reporterowego lub terapeutycznego) oraz
syntetycznych oligonukleotydów do komórek
docelowych:
- fizyczna (mikroiniekcja, elektroporacja,
metoda biolistyczna – strzelba genowa),
- chemiczna (DEAE-dekstran, Ca
2+
,
syntetyczne nośniki DNA)
- wirusowe (adenowirusowe, AAV, retrowirusy
i inne).
Metody
transfekcji

Syntetyczne nośniki DNA
Grupę niewierusowych nośników DNA tworzą
różne związki chemiczne i struktury
ponadmolekularne (supramolekularne)
obdarzone ładunkiem dodatnim:
-
lipidy i liposomy kationowe
-
LIPOPLEKSY
- kationowe polipeptydy i białka
- polimery i kopolimery kationowe,
-
dendrymery
POLIPLEK
SY
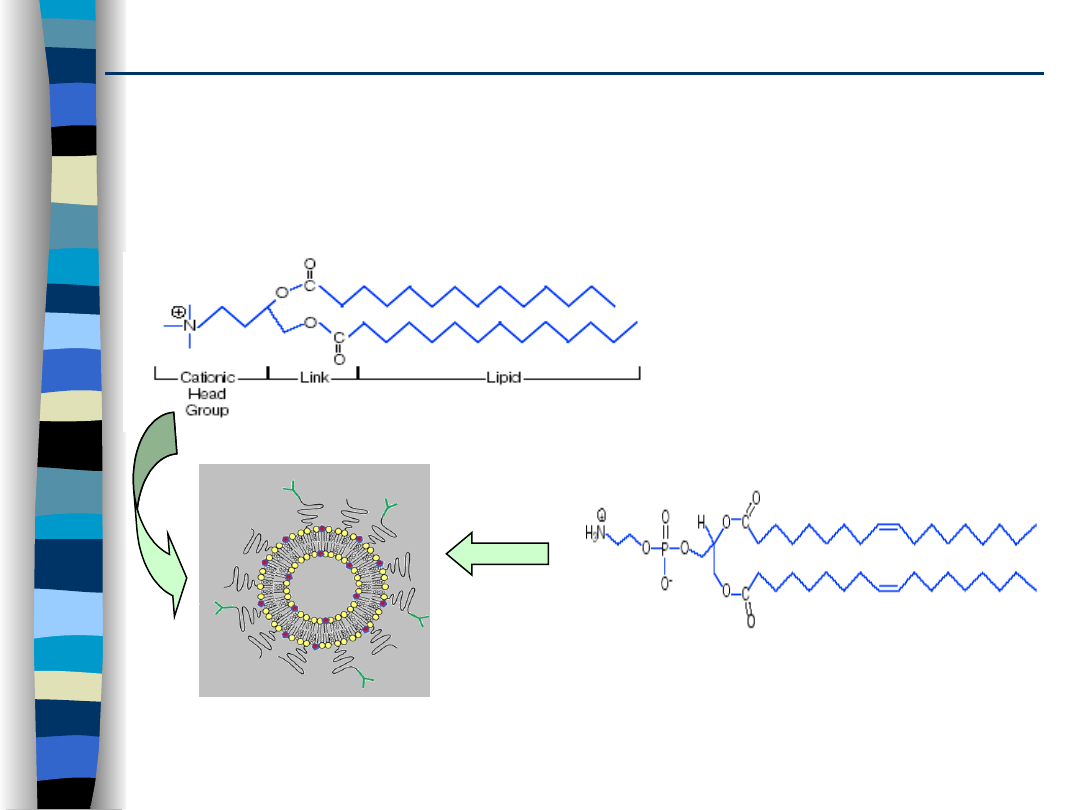
Liposomy to sferyczne, dwuwarstwowe struktury
składające się z cząsteczek lipidu obdarzonego ładunkiem
‘+’ i cząsteczek lipidu obojętnego elektrostatycznie.
Lipidy i liposomy kationowe
DOTMA
(lipofektyna)
DOPE (L-
dioleilofosfatydyloetanoloamina)
obojętny lipid
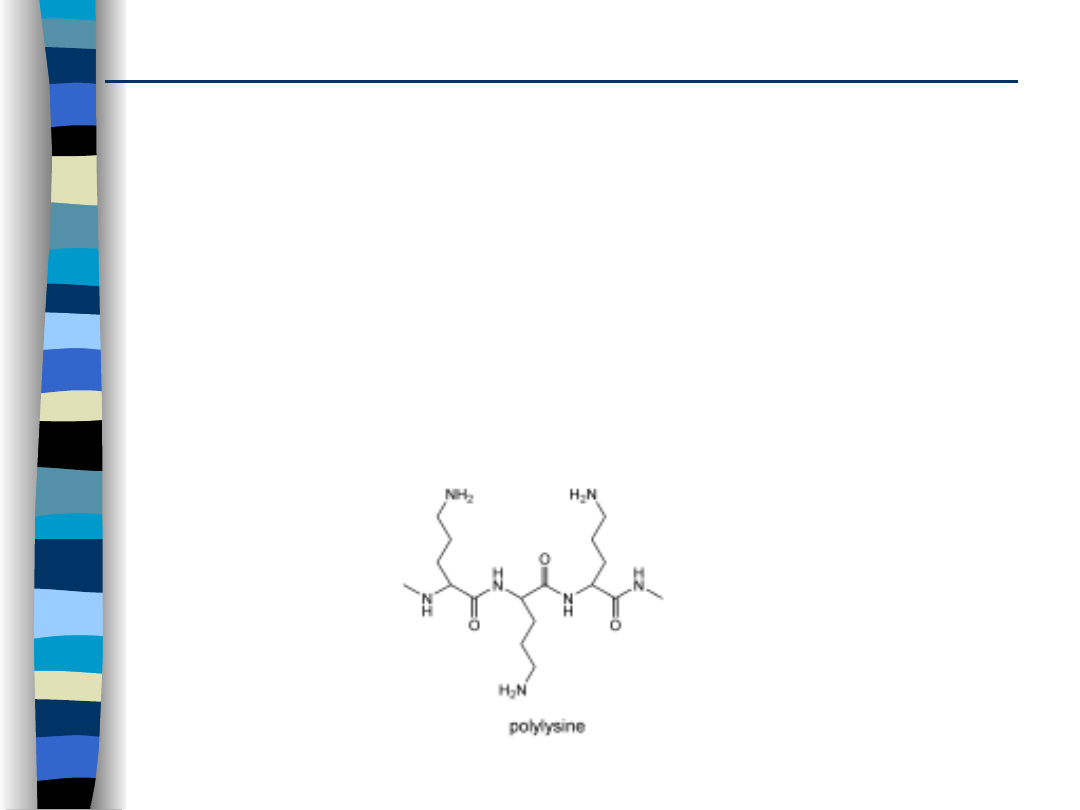
Kationowe polipeptydy i białka
- poli- L-lizyna (PLL)
- poli- L- ornityna
- białka np. protamina, histony, ludzka
albumina
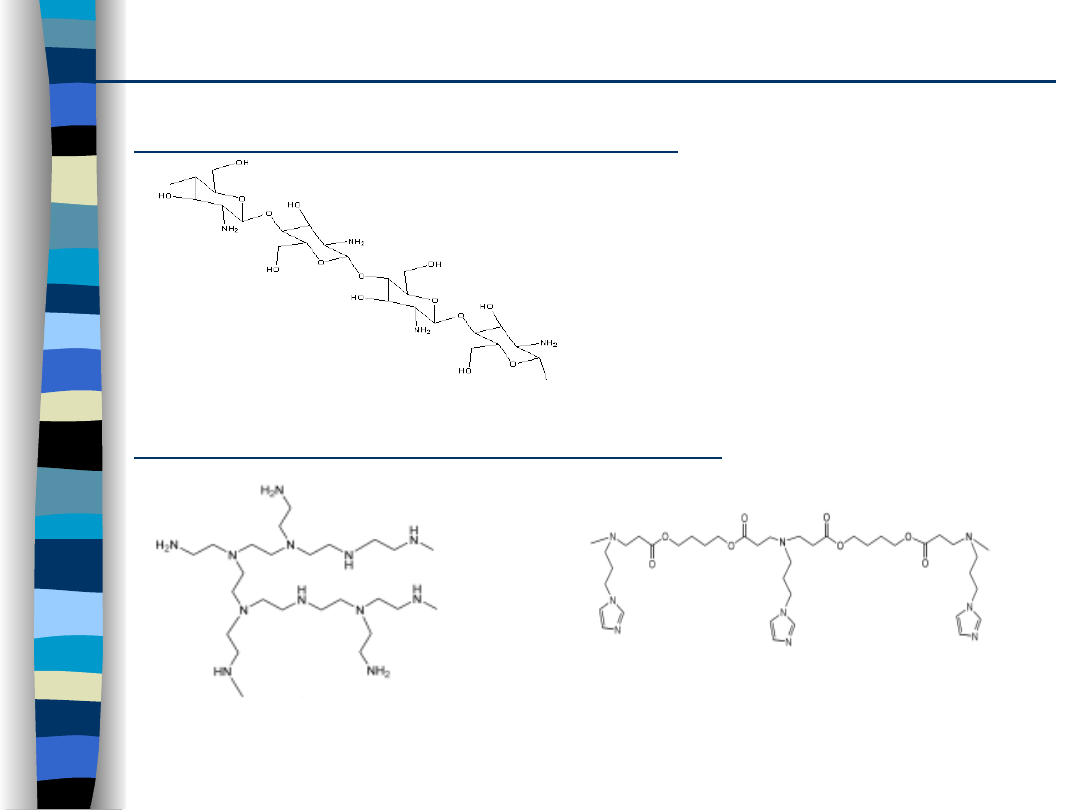
Polimery i kopolimery kationowe
Syntetyczne polimery kationowe
Naturalne polimery kationowe
chitozan
rozgałęziona PEI
poli – β aminoestry
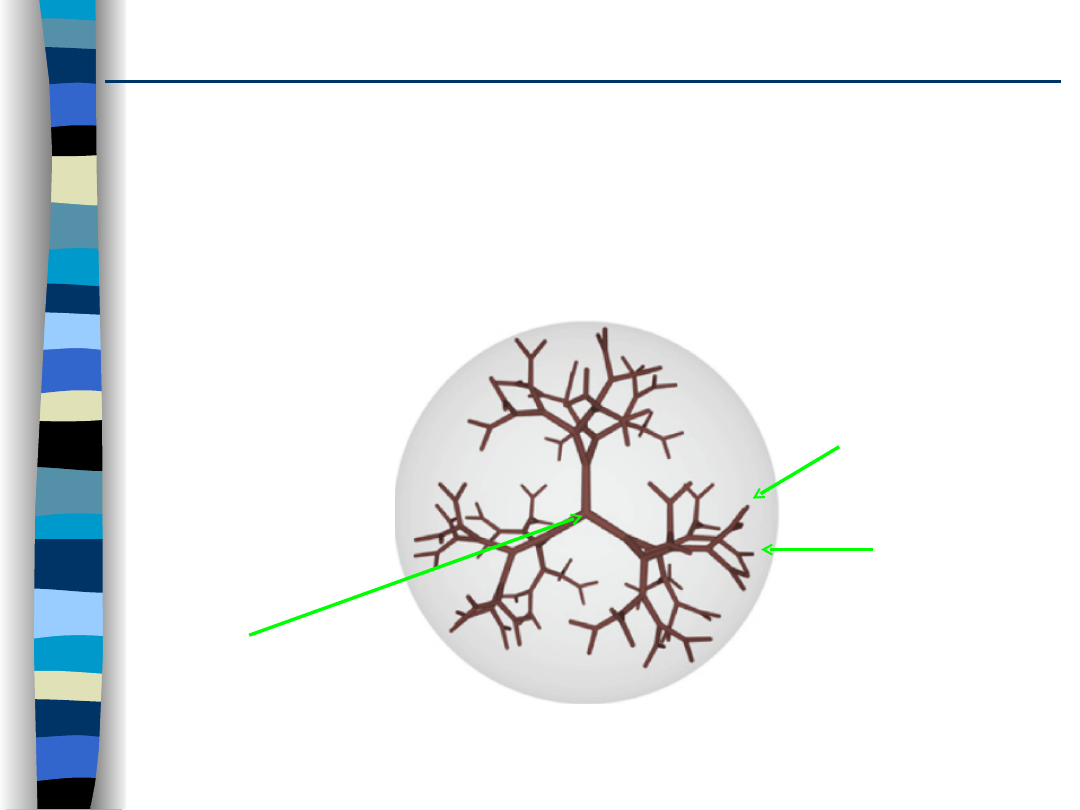
Dendrymery
Dendrymery to wysokocząsteczkowe polimery o
dobrze zdefiniowanej architekturze i wyróżniające
się jednorodnością i rozkładem ładunków, np.
polimery poliamidoaminowe (PAMAM).
rdzeń (amoniak,
D-glukoza)
grupy
funkcyjne

Zalety niewierusowych
nośników DNA
brak ograniczenia wielkości transgenu
brak integracji z genomem
małe ryzyko rekombinacji genetycznej
możliwe podawanie systemowe
możliwość transfekowania wielu typów
komórek
nie powodują odczynu zapalnego i mogą
być wielokrotnie stosowane

Pożądane właściwości
niewirusowych nośników:
-
biokompatybilność (brak toksyczności i
immunogenności, stabilność in vivo)
- łatwe w podawaniu klinicznym, bez powikłań
genetycznych (mutagenności) i odpowiedzi
układu odpornościowego,
- niewygórowany koszt i prosty schemat syntezy,
- produkowane w dużej ilości z dużą wydajnością
- stabilne w czasie przechowywania,
- wysoka wydajność transfekcji komórek,
- wysoka specyficzność transfekcji

Bariery uniemożliwiające obecnie
stosowanie kompleksów DNA-syntetyczne
nośniki w terapii:
1. Produkcja, formowanie i stabilność.
2. Bariery pozakomórkowe:
- opsoniny
-
komórki fagocytujące
- macierz pozakomórkowa
- enzymy trawienne
3. Bariery wewnątrzkomórkowe:
- błona komórkowa
- endosomy/lizosomy
- błona jądrowa

Produkcja, formowanie i stabilność
stosunek nośnik kationowy/DNA - określa on rozmiar
kompleksu i jego powierzchniowy ładunek (rozmiar
kompleksu a wydajność pobierania w drodze endocytozy)
stabilność podczas przechowywania – liofilizacja
polipleksów i lipopleksów w obecności substancji
ochronnych (cukry)
steryczna stabilizacja nośników
-
niewirusowe nośniki w
celach terapeutycznych muszą być stosowane w dużych
stężeniach (agregacja i precypitacja). Rozwiązanie –
kowalencyjne przyłączanie polietylenoglikolu (PEG) do
lipopleksów i polipleksów
cytotoksyczność wysokocząsteczkowych nośników
(PEI800 – uszkodzenie błony komórkowej)– stosowanie
niskocząsteczkowych polikationów np. chitosan, PEI25

1. Dotarcie DNA do powierzchni komórki
2. Związanie się kompleksu zawierającego
DNA do błony komórkowej
3. Przejście kompleksu przez błonę
4. Przejście DNA przez cytoplazmę
5. Wejście DNA do jądra komórkowego
6. Umiejscowienie się DNA w odpowiednim
miejscu w jądrze komórkowym
Warunki udanego transferu genów do
komórek

Bariera pozakomórkowa
In vivo, w obecności osocza, kompleksy o
wypadkowym ładunku dodatnim mają utrudniony
dostęp do tkanek docelowych. Przyczyny:
agregacja kompleksów w krwi,
duży, dodatni ładunek odpowiedzialny za
niespecyficzne oddziaływanie z macierzą
zewnątrzkomórkową, powierzchnią wielu komórek,
białkami osocza,
opłaszczenie kompleksów przez białka osocza-
opsoniny i ich eliminacja z krwiobiegu i płynów
pozakomórkowych w wyniku fagocytozy przez komórki
żerne w wątrobie i śledzionie,
aktywacja układu dopełniacza i eliminacja nośników

Bariera pozakomórkowa
Próby zwiększenia stabilności kompleksów nośnika z DNA w
krwiobiegu:
-utworzenie na zewnętrznej powłoce nośników niewirusowych
warstwy hydrofilowej z kopolimerów
np. kopolimer metakrylanowo-metakrylamidowy
(HPMA) czy polietylenoglikol (PEG) przyłączone
kowalencyjnie do kompleksów polilizyna/DNA nadają oporność
na działanie białek surowicy i zapobiegają agregacji.
PE
G
Stopień stabilizacji rośnie
wraz z długością łańcucha
polimeru oraz jego gęstością
na powierzchni cząsteczek
nośnika
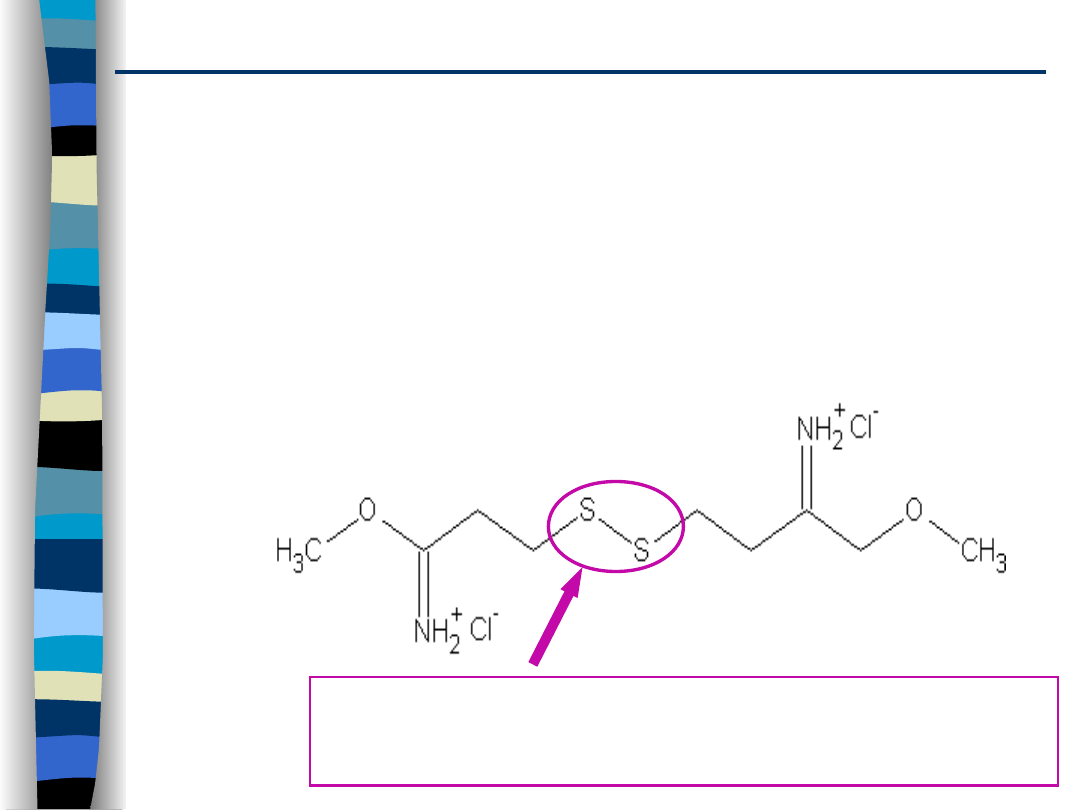
-znaczne zwiększenie stabilności kompleksu kopolimer-DNA
poprzez usieciowanie niektórych składników kopolimerowych
na zewnętrznej warstwie kompleksu
np. nośnik oparty na poli-L-lizynie, której I-rzędowe grupy
aminowe usieciowane są za pomocą czynnika sprzęgającego
dimetylo-3,3’-ditiobispropionoimidu (DTBP), kompleks ten
dodatkowo jest pokryty PEG maskującym ładunek i
zwiększającym rozpuszczalność kompleksu.
DTBP
Bariera pozakomórkowa
mostki disiarczkowe ulegające redukcji w
cytoplazmie zmniejszają stabilizację całego
kompleksu i umożliwiają uwalnianie DNA

Bariera pozakomórkowa
Zwiększenie specyficzności transfekcji komórek za pomocą
nośników zawierających swoiste ligandy dla receptorów na
powierzchni komórek docelowych :
- nośnik lipidowo-peptydowy złożony z liposomów
kationowych oraz cząsteczek peptydu z trójaminokwasowym
motywem RGD (oddziaływanie nośnika z receptorami
integrynowymi powierzchni komórek),
- nośniki z mannozylową pochodną cholesterolu (man-C4-
Chol) – wydajna transfekcja komórek z receptorami dla
mannozy np.makrofagi,
- kationowy polimer poli-L-lizyna/galaktoza – wydajna
transfekcja in vivo komórek z receptorami
asjaloglikoproteinowymi (np. hepatocyty),
- nośniki z ligandem w postaci transferyny – wydajna
transfekcja komórek nowotworowych.
Ligandy dołączone do końca długich linkerów (łączników)
np. PEG
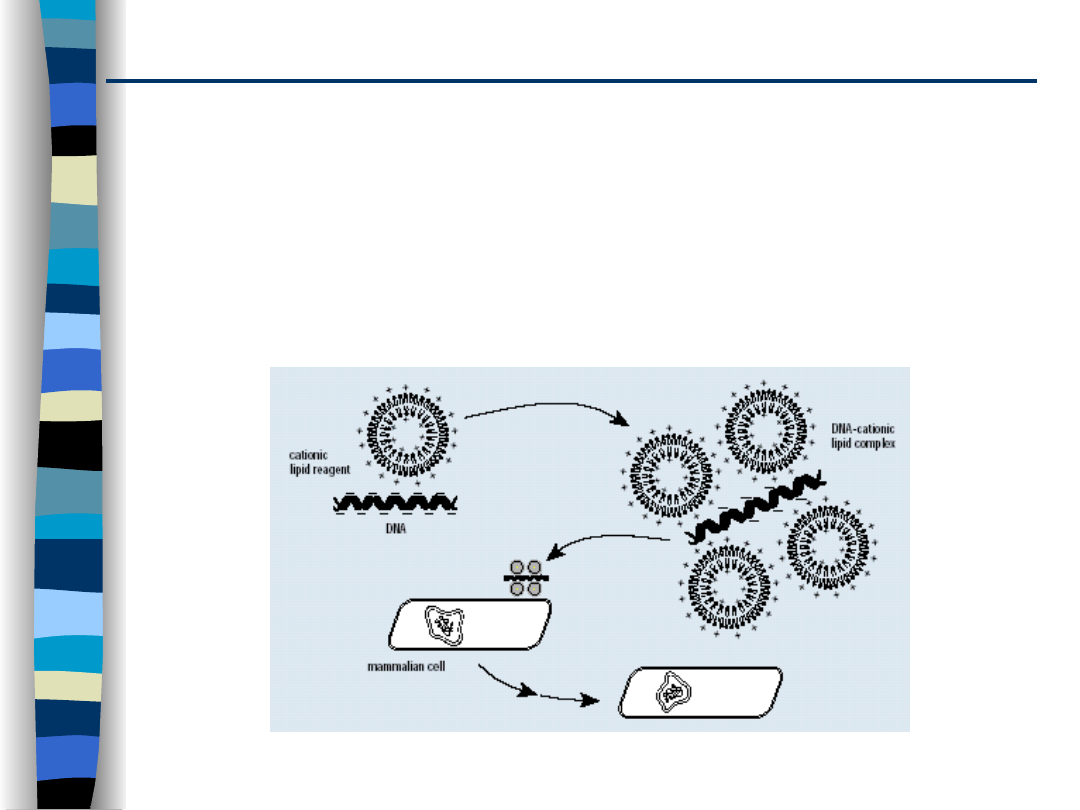
Bariera wewnątrzkomórkowa
Lipopleksy i polipleksy łączą się z daną komórką za sprawą
oddziaływań z ujemnie naładowanymi proteoglikanami na
powierzchni komórek, bądź za sprawą receptorów dla
ligandów obecnych na powierzchni nośników. Oba
mechanizmy prowadzą do pobrania tych związków przez
komórkę na drodze endocytozy.
Bariera wewnątrzkomórkowa
Stabilność i losy endosomu
ENDOCYTOZA
endosmoliza
fuzja z lizosomem
(aktywacja enzymów
litycznych
uwolnienie kompleksu do
cytoplazmy
zniszczenie kompleksu i
degradacja terapeutycznego
DNA

Bariera wewnątrzkomórkowa
Wydajność uwalniania kompleksów nośnik-DNA z endosomów do
cytoplazmy jest uzależniona od obecności w nośniku składnika
zdolnego do destabilizacji błony endosomu.
Wykorzystywane czynniki fuzyjne:
- w liposomach – fosfatydyloetanoloamina (DOPE),
- podjednostki pewnych toksyn bakterii z rodzaju Diphteria i
Pseudomonas,
- elementy strukturalne niektórych wirusów np. białka
kapsydu adenowirusa albo fragment hemaglutyniny wirusa
grypy.
Inne związki:
-melityna (kationowy peptyd, główna toksyna jadu pszczelego
o własnościach litycznych),
- polietylenoimina PEI – przy spadku pH z 7 do 5 stopień
protonacji PEI wzrasta z 20 do 45% - napływ jonów Cl
-
i
osmotyczne pęcznienie endosomów („efekt gąbki protonowej”)

Bariery wewnątrzkomórkowe
Wejście transgenu do jądra komórki:
- pasywne - plazmidowy DNA może wniknąć do
jądra, podczas podziału komórki (łatwość
transfekowania komórek intensywnie dzielących
się)
- aktywne – plazmidowy DNA związany z białkiem
lub inna cząsteczką zawierającą sygnał lokalizacji
jądrowej (NLS) rozpoznawany przez receptory
jądrowe z rodziny
importyn

– konstrukcja nośników syntetycznych z
wirusowymi sygnałami lokalizacji jądrowej w
połączeniu z innymi białkami np. białko fuzyjne
GAL4-NLS (GAL4 – drożdżowy czynnik
transkrypcyjny)
-ligandy: FGF i laktoza wydają się wpływać na
lepszy transport polipleksów do jądra
- sekwencje nukleotydowe wprowadzane do
plazmidowego DNA (sekwencje najwyższej
zgodności dla czynników transkrypcyjnych)
Zwiększenie wydajności transferu
transgenu do jądra

Literatura:
M.E. Davis, Non-viral gene delivery systems,
Current Opinion in Biotechnology, 13:128-131,
2002
M.Thomas, A.M. Klibanov, Non-viral gene
therapy: polycation-mediated DNA delivery,
Appl Microbiol Biotechnol, 62:27-34, 2003
S. Szala, Terapia genowa, Wydawnictwo
Naukowe PWN, Warszawa 2003

DZIĘKUJEMY ZA
UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
Naukowcy chcą stworzyć syntetyczne ludzkie DNA
Nośnik informacji genetycznej DNA
DNA jako nośnik informacji genetycznej1
DNA jako nośnik informacji genetycznej
DNA JAKO NOŚNIK INFORMACJI GENETYCZNEJ
Microsoft kupił syntetyczne DNA do przechowywania danych
Stworzono 8 literowe, syntetyczne DNA
Replikacja DNA i choroby związane
Barwniki naturalne i syntetyczne w żywności
Elektroforeza DNA komórkowego BioAut1, BioAut2 i Ch1
DNA Eng2
3 ogolny schemat replikacji i onkogeza DNA wirusowa
Materiał genetyczny, mutacje, systemy naprawy DNA, test Amesa
osteoporoza i dna
Izolacja DNA z komórek prokariotycznych i eukariotycznych
Met. izol. oczysz.DNA dla studentów, Biologia molekularna
1-Kefir chroni przed mutacjami w DNA, ZDROWIE-Medycyna naturalna, Poczta Zdrowie
więcej podobnych podstron