
1
MITOCHONDRIALNY ŁAŃCUCH
ODDECHOWY
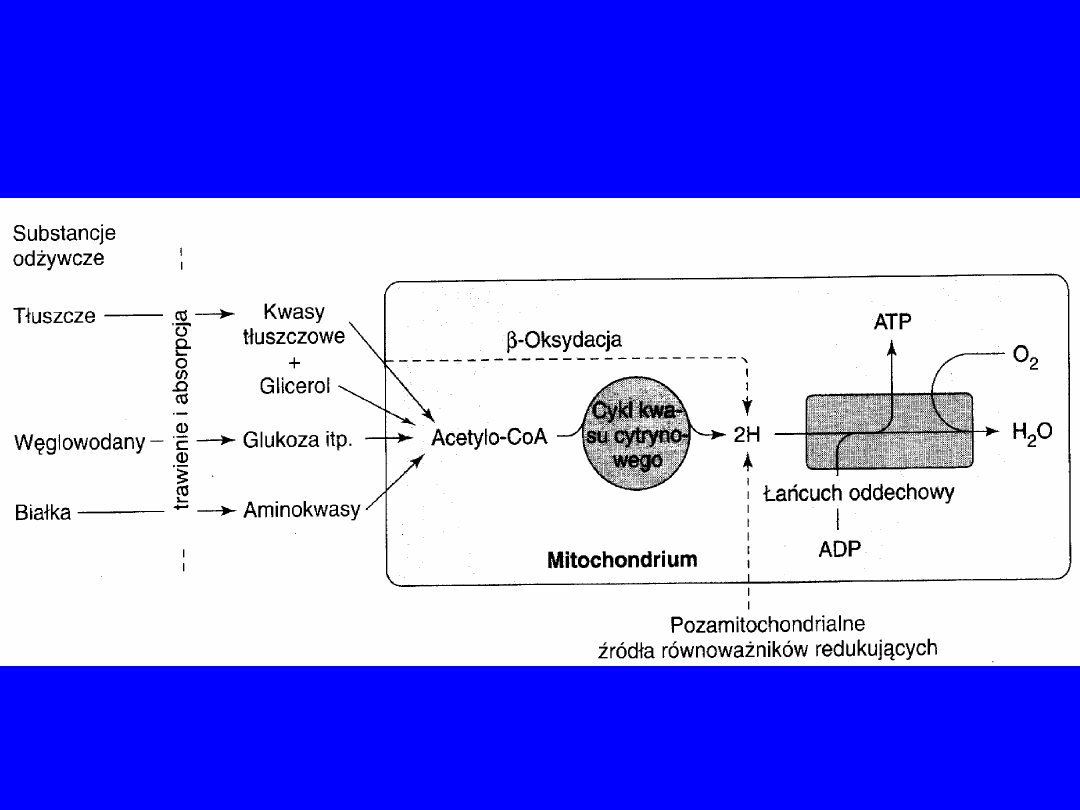
2

3
OKSYDACYJNA FOSFORYLACJA
Proces syntezy ATP, zachodzący w wyniku
przeniesienia elektronów z NADH lub FADH
2
na O
2
przez szereg przenośników elektronów
Główne źródło ATP u organizmów oddychających
tlenowo
• Przepływ elektronów z NADH i FADH
2
do O
2
przez
KOMPLEKSY BIAŁKOWE
umiejscowione w
wewnętrznej
błonie mitochondrium powoduje
wypompowanie elektronów z matriks
mitochondrialnej
• Powstaje siła protonomotoryczna składająca się
z gradientu pH i transbłonowego potencjału
elektrycznego
• Synteza ATP zachodzi na skutek powrotnego
przepływu
protonów przez kompleks
enzymatyczny do matriks
mitochondrialnej

4
Mitochondria
zawierają zespoły oddechowe, enzymu cyklu
cytrynowego i enzymy warunkujące utlenianie
kwasów tłuszczowych
Błona zewnętrzna
; łatwo przepuszczalna dla
większości małych cząsteczek i jonów; białko
transbłonowe poryna tworzące kanały o dużych
porach
Błona wewnętrzna
; silnie pofałdowana; tworzy
grzebienie mitochondrialne; nieprzepuszczalna dla
wszystkich jonów i
cząsteczek polarnych; ATP,
cytrynian przenoszone są przy
udziale
nośników;
wyróżnia się dwie strony błony wewnętrznej –
matriksową lub (N; ujemny potencjał
błonowy) i
cytoplazmatyczną (P; dodatni
potencjał błonowy)
Przestrzeń międzybłonowa
Matriks mitochondrialna otoczona błoną
wewnętrzną

5
Transport elektronów przez łańcuch oddechowy
jest wymuszany różnicą potencjałów między
NADH i O
2
= 1,14 V
Sekwencja przenośników elektronów w łańcuchu oddechowym
NADH
Reduktaza NADH-Q
Q flawoproteiny z
FADH
2
reduktaza cytochromowa
Cyt c
Oksydaza cytochromowa
O
2

6
Składowe łańcucha oddechowego
ułożone wg. ich wzrastającego
potencjału red-ox
• substrat zredukowany ma najniższy
potencjał i jest najsilniejszym
reduktorem
• tlen ma najwyższy potencjał i jest
najsilniejszym utleniaczem
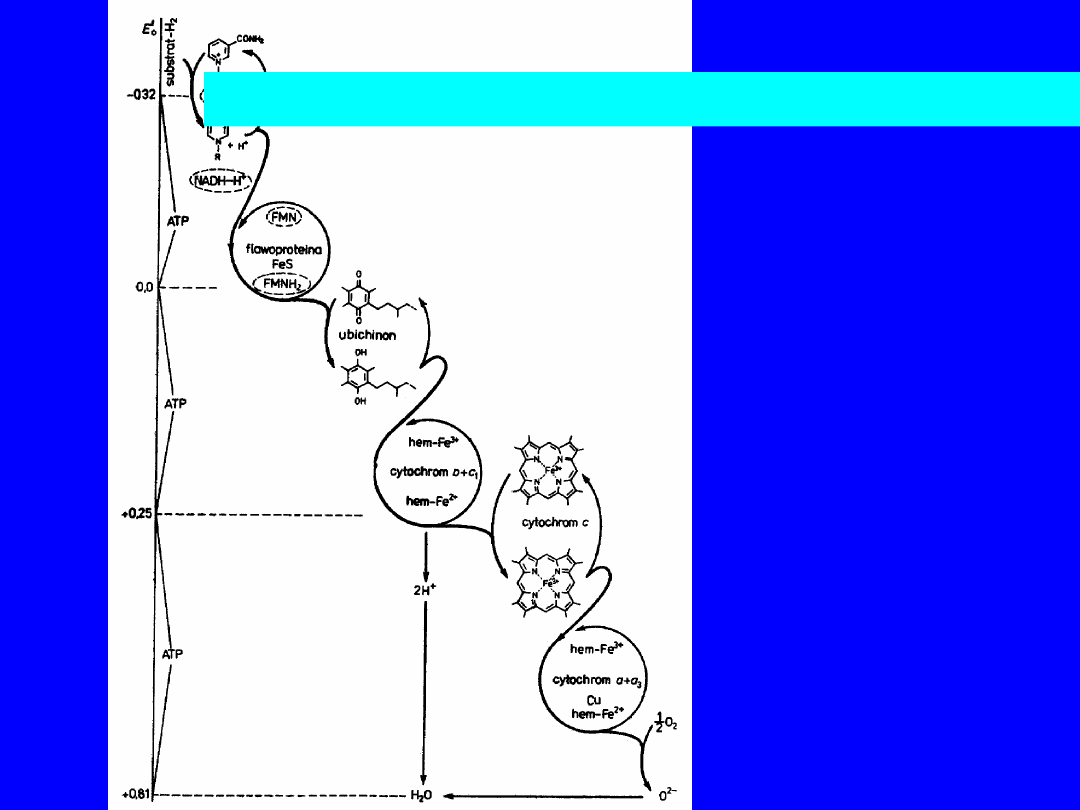
7
Przepływ elektronów przez różne układy redoks
8
Układy enzymatyczne
Substraty pomocnicze
Substraty pomocnicze
Układy enzymatyczne
Układy enzymatyczne

9
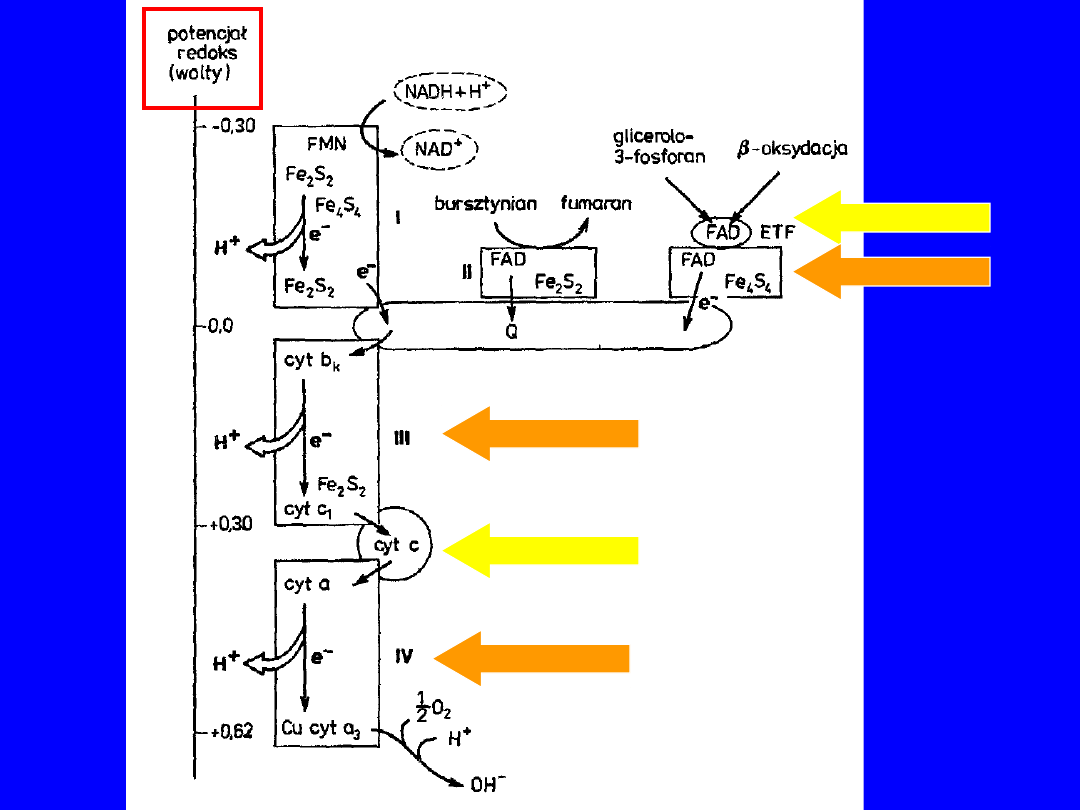
SKŁAD ŁAŃCUCHA ODDECHOWEGO
Trzy
pompy protonowe
(wielkie kompleksy
białkowe) połączone dwoma
przenośnikami
elektronów
1.
Reduktaza NADH-Q
(I)
I.
ubichinon
(Q)
2.
Reduktaza cytochromowa
(III)
II.
cyt c
3.
Oksydaza cytochromowa
(IV)
oraz
•
reduktaza bursztynian-Q
(II) (nie pompuje
protonów, ale
przenosi
elektrony)
• Grupy przenoszące elektrony to: flawina,
centra żelazo-
siarkowe, hemy, jony miedzi
10

11
Na tym poziomie wprowadzane są elektrony z NADH
• Enzym; m.cz. 880 kDa; 34 łańcuchy polipetydowe;
większa od
rybosomu
Kodowana wspólnie przez dwa genomy: jądrowy
i mitochondrialny
Choroby mitochondrialne
• mutacja reduktazy NADH-Q powoduje
dziedziczną wzrokową
neuropatię Lebera
; utrata
wzroku dziedziczona na drodze matczynej
pojawiająca się w średnim wieku;
• organy silnie uzależnione od oksydacyjnej
fosforylacji
(nerwowy, serce)
najbardziej podatne na mutacje
mitochondrialnego DNA
Akumulacja mutacji mitochondrialnych przez kilkadziesiąt lat może być
przyczyną starzenia się i zaburzeń zwyrodnieniowych
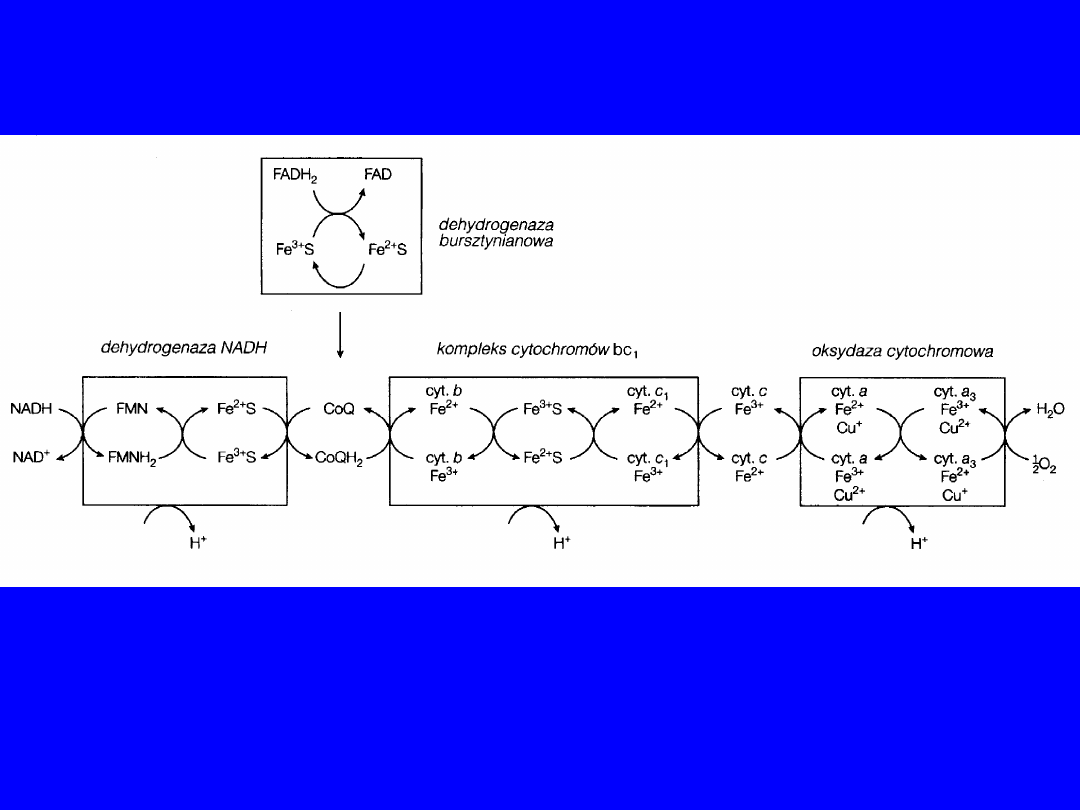
Reduktaza NADH-Q
; dehydrogenaza NADH lub kompleks I
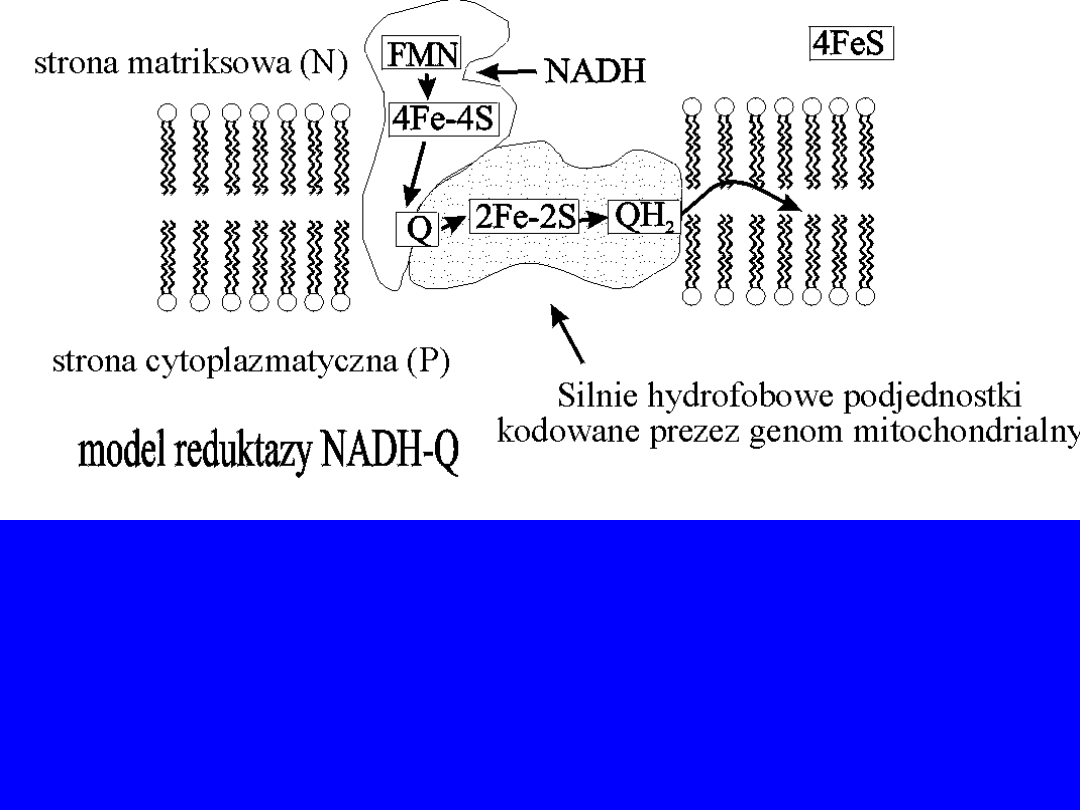
12
Reakcje
1.
Związanie NADH i przeniesienie 2 elektronów na
grupę
prostetyczną kompleksu – FMN, który
przechodzi w formę
FMNH
2
2.
Przekazanie elektronów na szereg centrów
żelazo-siarkowych (białka z żelazem związanym
niehemowo)
3.
przekazanie elektronów z centrów Fe-S na
koenzym Q zwany też ubichinonem Q

13
Kilka
rodzajów centrów Fe-S
• najprostszy to
[Fe-S]
– atom żelaza tetraedycznie
skoordynowany z grupami
hydrosulfidowymi czterech reszt
cysteinowych
białka;
•
[2Fe-2S]
– zawiera dwa atomy żelaza i oprócz 4
reszt cysteiny,
dodatkowa dwa
nieorganiczne siarczki; [4Fe-4S] -–ma 4
atomy
żelaza - 4 nieorganiczne siarczki + 4 reszty cysteiny
Reduktaza NADH-Q zawiera centra typu
[2Fe-2S] i
[4Fe-4S]
• Atomy Fe tych centrów przechodzą na zmianę ze
stanu Fe
2+
(zredukowany) do Fe
3+
(utlenione)

14
ubichinon Q
• pochodna chinonowa z długim łańcuchem
izoprenowym
• najczęściej 10 jednostek izoprenowych (Q10)
• izoprenowy ogon nadaje Q charakter silnie
niepolarny i
umożliwia ruchliwość w
hydrofobowym rdzeniu błony
• po przyjęciu 1
e
jest redukowany do
anionowej
formy
wolnego rodnika semichinonu
;
redukacja drugim
elektronem daje
ubichinol (QH
2
)
Przejście 2 elektronów z NADH-Q
powoduje
wypompowanie czterech H
+
z matriks na stronę
cytoplazmatyczna wewnętrznej błony
mitochondrialnej

15
KOMPLEKS REDUKTAZA BURSZTYNIAN-Q
(kompleks II)
Integralne białko błony wewnętrznej
FADH
2
powstaje w cyklu Krebsa podczas
utleniania
fumaranu przez
dehydrogenazę bursztynianową
;
FADH
2
nie opuszcza kompleksu; jego elektrony
przenoszone są na centra Fe-S a następnie na
Q,
który przekazuje je na łańcuch
oddechowy
Podobnie przekazują swoje elektrony
cząsteczki FADH
2
współpracujące z
dehydrogenazą glicero-
fosforanową
i dehydrogenazą acyloCoA
W przeciwieństwie do reduktazy NADH-Q
kompleks
reduktazy bursztynian-Q
nie
jest pompą protonową
W konsekwencji podczas utlenienia FADH
2
powstaje
mniej ATP niż podczas
utlenienia NADH
16
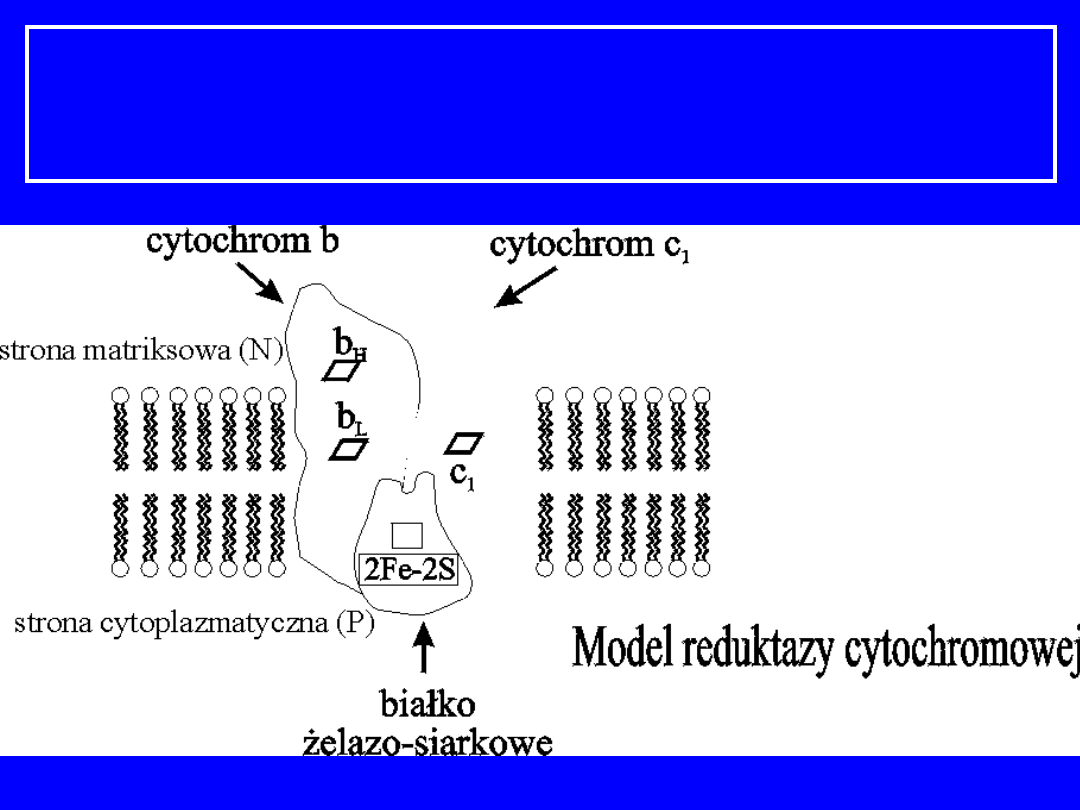
Reduktaza cytochromowa
; reduktaza
ubichinol-cytochrom C; kompleks cytochromów
bc
1
; kompleks III

17
Cytochromy
białka transportujące elektrony; zawierają
hem
jako
grupę prostetyczną
podczas transportu elektronów żelazo przechodzi z
(2+) do (3+)
W reduktazie umieszczone są
2 typy cytochromów
– b i c
1
Grupą prostetyczną cytochromów b, c
1
i c jest
żelazoporfiryna IX,
taka sama jak hem w
hemoglobinie i mioglobinie
Cytochrom b zawiera dwa hemy
b
L
i b
H
,
różniące się
powinowactwem do elektronów
Hem cytochromów c i c
1
w przeciwieństwie do b
związany jest z białkiem kowalencyjnie, wiązaniami
tioeterowymi (grupa SH-
cysteiny + reszta
winylowa hemu)
Reduktaza zawiera białka
Fe-S
i kilka innych
łańcuchów
polipeptydowych
18
Proces
przenoszenia
elektronów przez
reduktazę
cytochromową jest
dość
skomplikowany –
cykl Q
Umożliwia to
przeniesienie
elektronów z
przenośnika
dwuelektronowego
(QH
2
) na
jednoelektronowy
(cyt c)
Cytochrom b
funkcjonuje jako
mechanizm zawracający
elektrony do obiegu i
jest tym składnikiem
reduktazy, który
umożliwia skuteczne
wykorzystanie
elektronów z QH
2

19
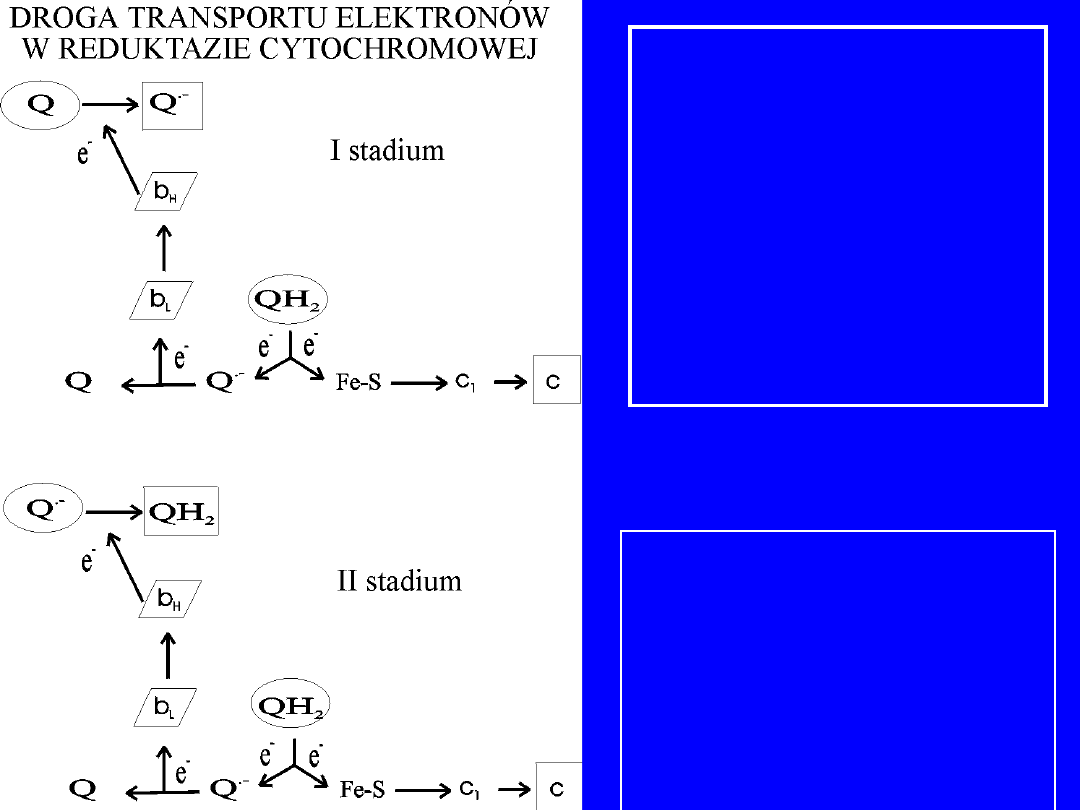
cykl Q
Ubichilol przenosi jeden z dwóch elektronów do
kompleksu FeS; ten elektron przchodzi dalej do
cytochromu c
1
i cytochromu c,
który usuwa
elektron z kompleksu
Jednoelektronowe przeniesienie powoduje
przeksztłcenie
ubichinolu (QH
2
) w anion
semichinonowy (Q
.-
)
Q
.-
oddaje elektron na b
L
i wraca do formy Q,
swobodnie
dyfundując w błonie
b
L
redukuje b
H
, który redukuje Q do Q
.-
Drugi elektron w postaci Q
.-
jakby czeka “za
kulisami”
Następnie druga cząsteczka QH
2
wchodzi w reakcję,
tak samo jak
pierwsza czyli 1e
-
zostaje
przeniesiony na centrum Fe-S, dalej
do cytc
1
i c
Drugi e
-
przechodzi z nowo utworzonego Q
.-
do b
L
a
następnie do
b
H
Ale tym razem b
H
redukuje Q
.-
a nie Q i zamyka cykl
Sumarycznie dwa QH
2
są utlenione do dwu Q, a
jedna
redukowana do QH
2

20
Oksydaza cytochromowa
Tworzy ją kompleks składający się z
10
podjednostek
, z których
trzy (podjednostka I, II i
III) są kodowane przez genom
mitochondrialny
Zawiera
dwa hemy A
(hem a i hem a
3
) i
dwa jony
miedzi (Cu
A
i
Cu
B
);
umieszczone w różnych
częściach oksydazy
cytochromowej;
jednostki oksydoredukcyjne zwane są cytochromem
a i
cytochromem a
3
i mieszczą się w
podjednostce II i I
Hem A różni się od hemu cytochromów c i c
1
:
Grupa formylowa zastąpiona grupą metylową
Łańcuch węglowodorowy C
15
zastępuje grupę
winylową
Hem nie jest związany kowalencyjnie z
białkiem

21
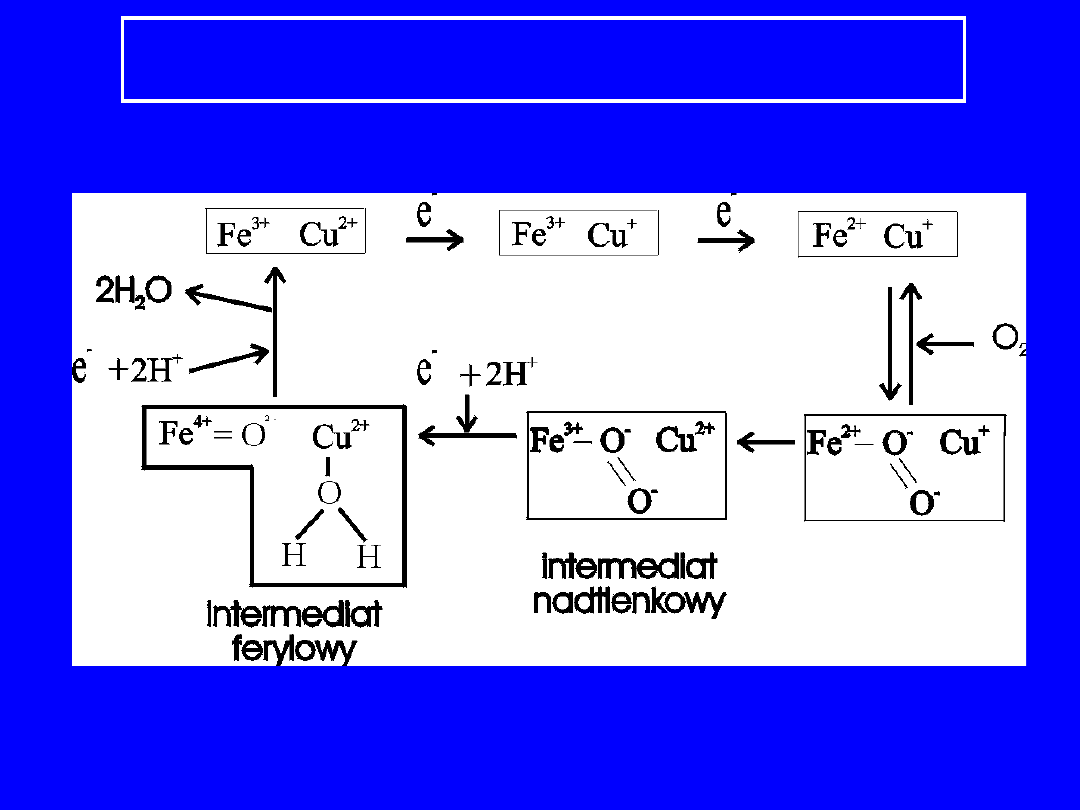
Oksydaza cytochromowa
PRZENOSI ELEKTRONY Z FERROCYTOCHROMU C
(FORMA ZREDUKOWANA) NA TLEN
CZĄSTECZKOWY
4 cyt c
(+2)
+ 4H
+
+ O
2
4 cyt c
(+3)
+
2 H
2
O
tlen przyjmuje 4 elektrony co powoduje jego
całkowitą redukcję
i wpompowanie protonów z
matriks na cytoplazmatyczną
stronę
wewnętrznej błony mitochondrialnej
Ferrocytochrom c oddaje elektron na centrum
hemu a-Cu
B
;
następnie na hem a
3
-Cu
B
; po
przejściu przez szereg reakcji O
2
ulega redukcji do 2
H
2
O
!!! w procesie redukcji niebezpieczeństwo
;
częściowa redukcja (nie 4 elektronowa) powoduje
powstanie wolnych rodników
O
2
+ e
-
O
2
-
anion nadtlenkowy
22
Oksydaza cytochromowa
!!! w procesie redukcji
niebezpieczeństwo
Zapobiega temu wiązanie O
2
w centrum a
3
-Cu
B
oksydazy cytochromowej pomiędzy jonami Fe
2+
a
Cu
+
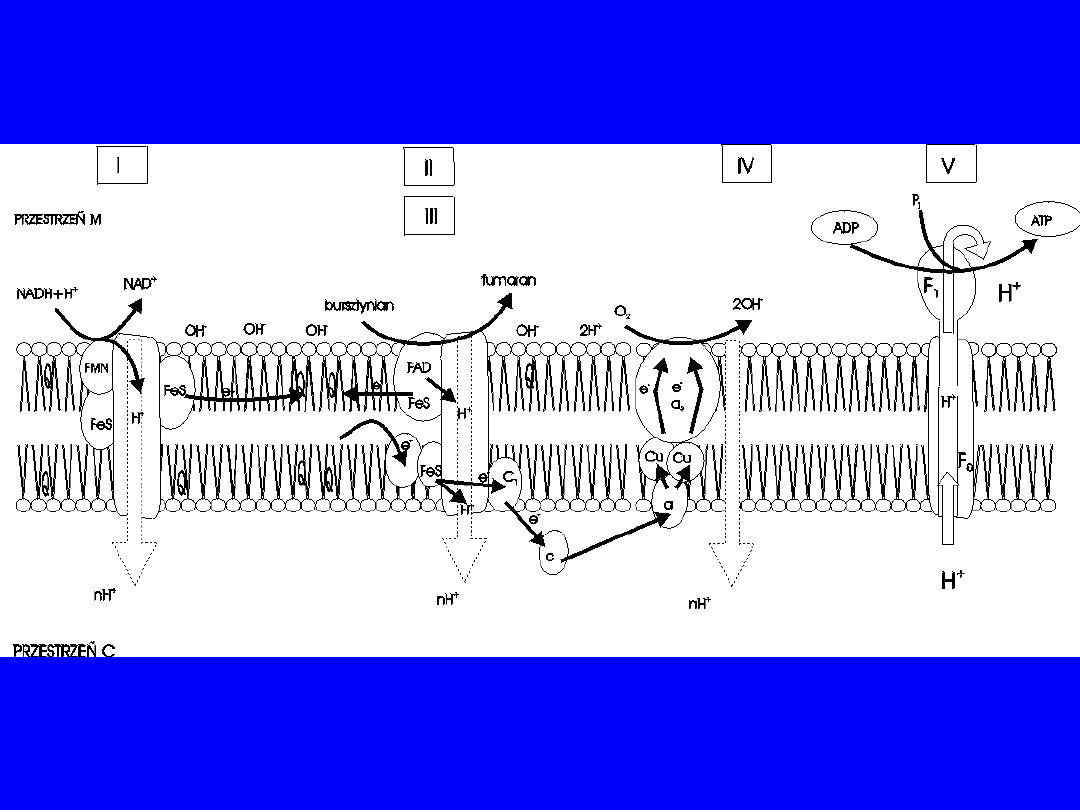
23

24
INHIBITORY TRANSPORTU ELEKTRONÓW W ŁAŃCUCHU ODDECHOWYM
Rotenol
(jad rybi) i
amytal
,
barbiturany
(amobarbital) – w
reduktazie NADH-Q;
uniemożliwiają wykorzystanie
NADH jako
substratu; przepływ elektronów z bursztynianu
jest sprawny
Antymycyna A
,
dimerkaptopropanol
(BAL) –
działa na poziomie cytochromu b
H
w reduktazie
cytochromowej
Inhibitory łańcucha oddechowego

25
INHIBITORY TRANSPORTU ELEKTRONÓW W ŁAŃCUCHU ODDECHOWYM
CN
-
, N
3-
i CO
– na poziomie oksydazy
cytochromowej;
cyjanek i azydek reagują z
formą żelazową hemu a
3
; tlenek
węgla
hamuje formę żelazawą
karboksyna, TTFA
( czynnik chelatujący Fe) - IV
miejsce-
blokowanie przenoszenia
równoważników redukcyjnych z
DH
bursztynianowej na CoQ
Inhibitory łańcucha oddechowego

26
INHIBITORY OKSYDACYJNEJ FOSFORYLACJI
Inhibitory syntazy ATP
wiążą się z kompleksem syntazy ATP i hamują
aktywność
Dicykoheksylokarbodiimid (DCCP) – przyłącza
się do grup
hydrofobowych białka
Oligomycyna – blokuje przepływ protonów przez
kanał
protonowy podjednostki F
o
syntazy ATP uniemożliwiając
fosforylację
oksydacyjną.
Atraktylozyd- inhibitor translokazy ADP/ATP

27
związki rozprzęgające fosforylację oksydacyjna, a nie
hamujące transportu elektronów (mogą go nawet
przyspieszać)
likwidują wytwarzane transportem elektronów
różnice stężenia
protonów po obu stronach
wewnętrznej błony
mitochondrialnej.
Wspólnymi cechami
są
niewielkie
rozmiary
i
hydrofobowy
charakter cząsteczki oraz
zdolność do oddysocjowania i
przyłączania
protonu
Działają
– przyłączając protony po jednej strony
błony, w
środowisku o niskim pH, a następnie
przechodzą na drugą
stronę błony, do
środowiska o wysokim pH, gdzie proton ulega
odłączeniu
Niektóre były używane jako środki zapobiegające otyłości (hamowanie
syntezy ATP), ale
ze względu na szkodliwe skutki uboczne zostały
wycofane
.
CZYNNIKI ROZPRZĘGAJĄCE OKSYDACYJNĄ FOSFORYLACJĘ

28
CZYNNIKI ROZPRZĘGAJĄCE OKSYDACYJNĄ FOSFORYLACJĘ
zwarcie gradientu protonowego i wytworzenie ciepła
• Rozłączenie utleniania w łańcuchu oddechowym i
fosforylacji
• niekontrolowane oddychanie (ADP i P
i
nie
ogranicza)
2,4 dinitrofenol (DNP
) i inne związki kwaśne
aromatyczne
rozpuszczalne w lipidach ;
związek ten przenosi protony
przez błonę
mitochondrialną; ATPaza nie syntetyzuje ATP
ponieważ siła protonomotoryczna uległa
rozproszeniu
dinitrokrezol, dikumarol,
CCCP
(m-
chlorokarabanylocyjanidofenylohydrazon)
Karbonylocyjanek-p-
trifluorometoksyfenylohydrazon (FCCP)

29
Utrata kontroli oddechowej prowadzi do zwiększonego
pobierania tlenu i
utleniania NADH
Rozkojarzona fosforylacja oksydacyjna – zjawisko
biologicznie korzystne –
źródło utrzymania ciepła u
zwierząt hibernujących; przystosowanie do
niskich
temperatur
Termogeneza – brunatna tkanka tłuszczowa; bardzo bogata
w mitochondria
błona wewnętrzna tych mitochondriów zawiera dużo
termogeniny
(zw.
białkiem rozprzęgającycm)
dimer podjednostek podobny do
translokazy ATP-
ADP; stanowi ona drogę przepływu protonów z
cytoplazmy do matriks; powoduje zwarcie mitochondrialnej
baterii
protonowej
Zwarcie przez termogeninę jest aktywowane przez –
kwasy tłuszczowe –
uwalnianie kwasów tłuszczowych
jest kontrolowane przez
noradrenalinę -
kontrola hormonalna
Mitochondria – “mianiaturowe grzejniki”
Analogiczny mechanizm wykorzystuje brukselka; dostarcza
ciepło do kwiatostanów; bardziej pachnie i przyciąga owady
CZYNNIKI ROZPRZĘGAJĄCE OKSYDACYJNĄ FOSFORYLACJĘ
zwarcie gradientu protonowego i wytworzenie ciepła
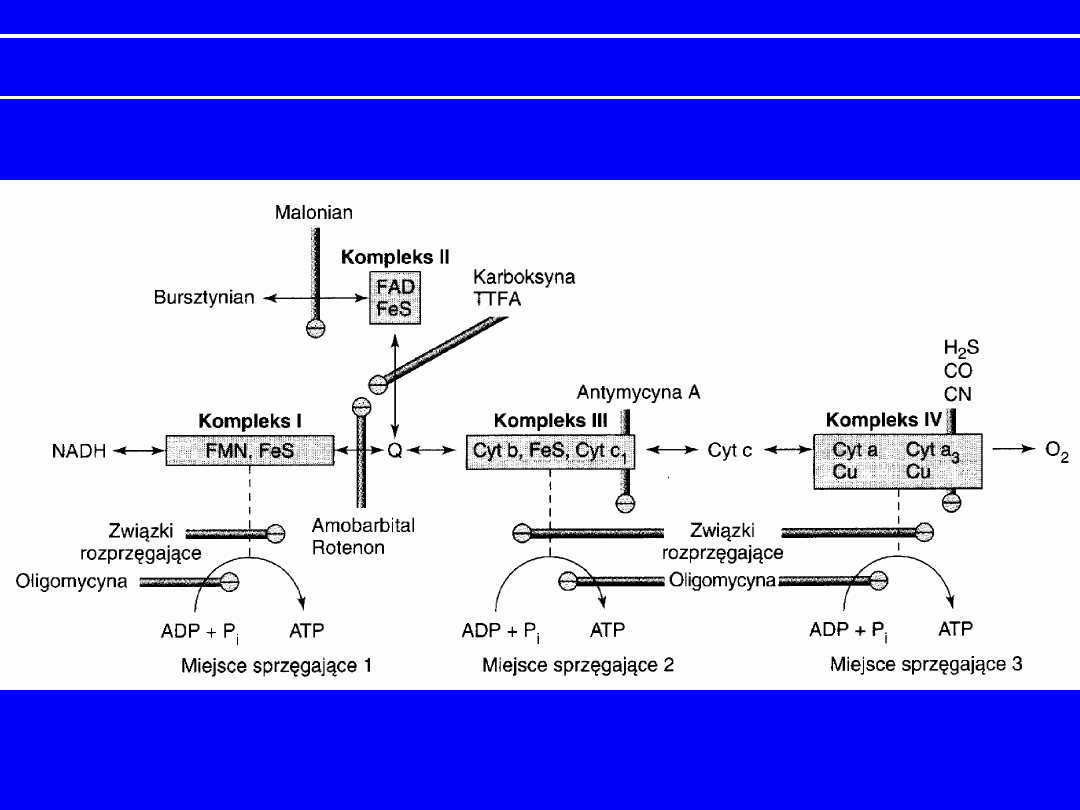
30
Hamowanie łańcucha oddechowego przez różne związki
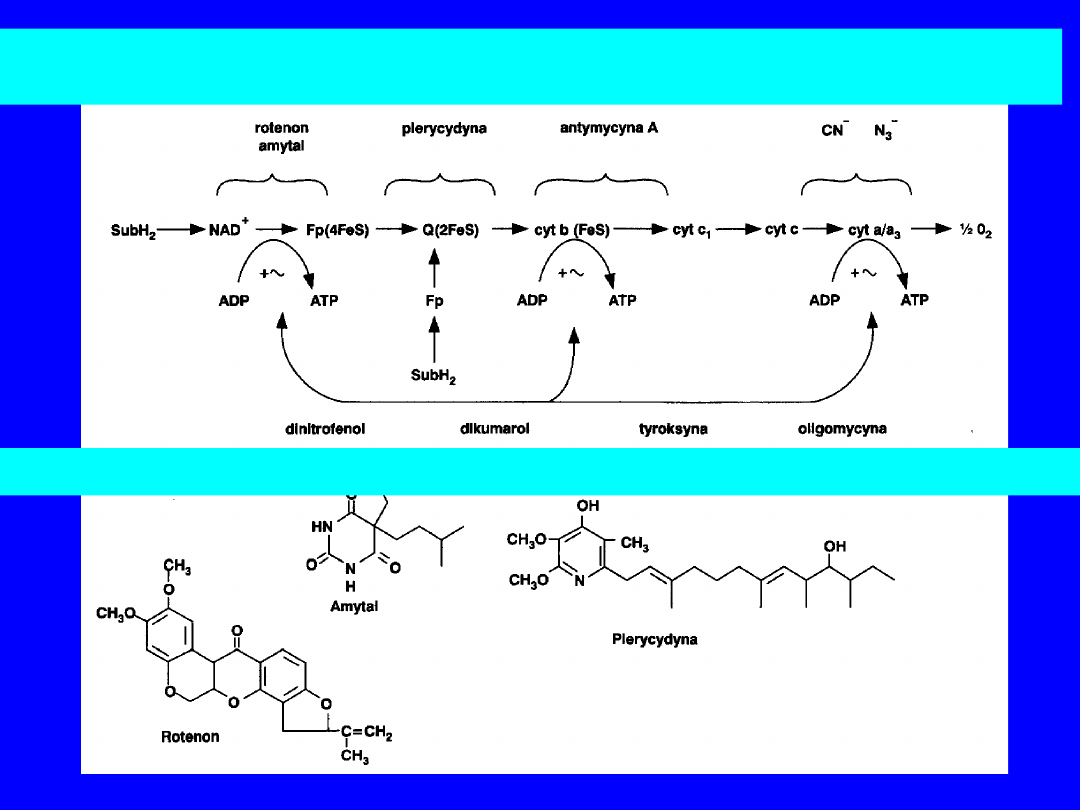
31
INHIBITORY TRANSPORTU ELEKTRONÓW W ŁAŃCUCHU
ODDECHOWYM
CZYNNIKI ROZPRZĘGAJĄCE OKSYDACYJNĄ FOSFORYLACJĘ

32
Przepływ elektronów z NADH do O
2
jest
procesem egzoergicznym
NADH + 1/2 O
2
+ H
+
H
2
O + NAD+ G =
-220 kJ/mol
Energia swobodna utleniania jest wykorzystana do
procesu
endoergicznego
czyli syntezy ATP
ADP + P
i
+ H
+
H
2
O G = 30,5 kJ/mol
Syntezę ATP przeprowadza zespół podjednostek w
wewnętrznej błonie mitochondrialnej
Mitochondrialna ATPaza lub
ATPaza H+ lub syntaza ATP
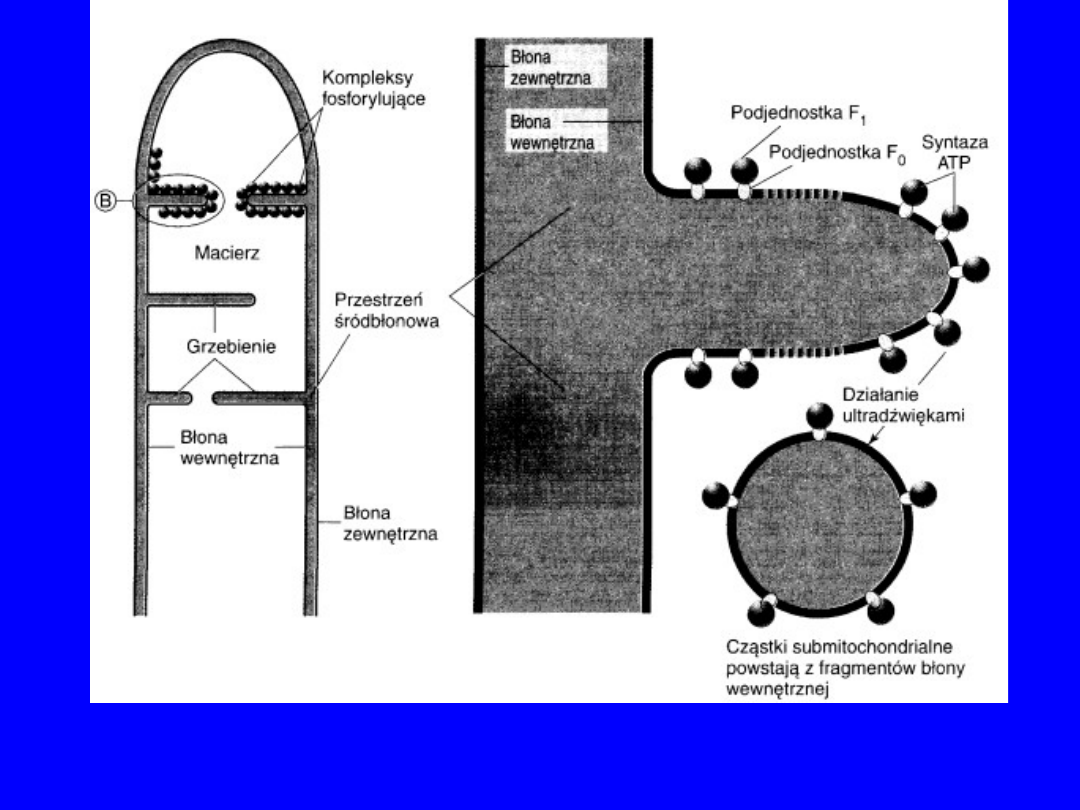
33
Błony mitochondrialne i kompleksy fosforylacyjne
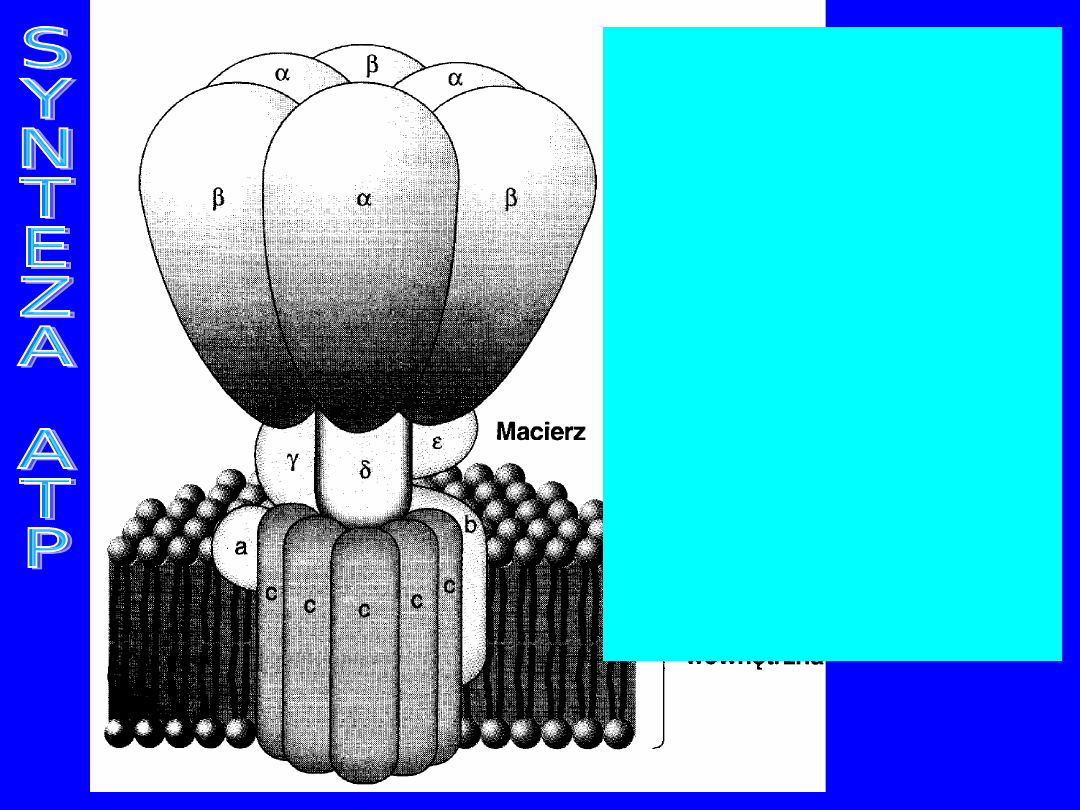
34
Mitochondrialna
ATPaza F
0
F
1
Składnik F
1
złożony
jest z
podjednostek ,, i .
F
0
zawiera
podjednostki
a,b,c, które zatopione
są w
dwuwarstwowej
warstwie lipidowej
wewnętrznej
błony
mitochondrialnej.

35
MECHANIZM REAKCJI
Synteza/hydroliza ATP i translokacja
protonów zachodzą
w dwóch różnych i
dających się rozdzielić częściach enzymu.
Posiadają 3 pary katalitycznych podjednostek
;
zawierają więc 3 potencjalne centra
aktywne;
współdziałanie tych centrów
stanowi istotny element
procesu syntezy
ATP
Substraty reakcji (ADP i nieorganiczny
fosforan), ani jej produkt (ATP) nie tworzą
kowalencyjnego wiązania z enzymem.
Translokacja protonów i synteza/hydroliza
ATP zachodzą
z udziałem dwóch różnych
sektorów enzymu.

36
Translokacja protonów a fragment Fo
.
Kluczową rolę odgrywa podjednostka c sektora
Fo
OSCP (oligomycyna B) i DCCD (N,N,-
dicyclophexyl-
carboimide) - inhibitory
translokacji protonów wiążą
się z
aminokwasami w łańcuchu peptydowym
podjednostki C. Łańcuch ten tworzy konformację -
helisy przechodzi dwukrotnie przez całą
szerokość błony tworząc rodzaj kanału w poprzek
błony; polarne reszty aminokwasowe (m.in.kwas
asparaginowy) zwrócone są to
wnętrza
struktury takiego kanału, ułatwiając
przechodzenie protonów.

37
1961 r – hipoteza chemiosmotyczna ; Peter
Mitchell
transport elektronów i synteza ATP są sprzężone
przez gradient
protonowy utworzony w poprzek
błony mitochondrialnej;
siła protonomotoryczna jest czynnikiem
napędzającym syntezę
ATP przez kompleks
ATPazy
• synteza ATP widoczna jest w mikroskopie
elektronowym;
sferyczne wypustki (buławki)
po matriksowej stronie błony
wewnętrznej
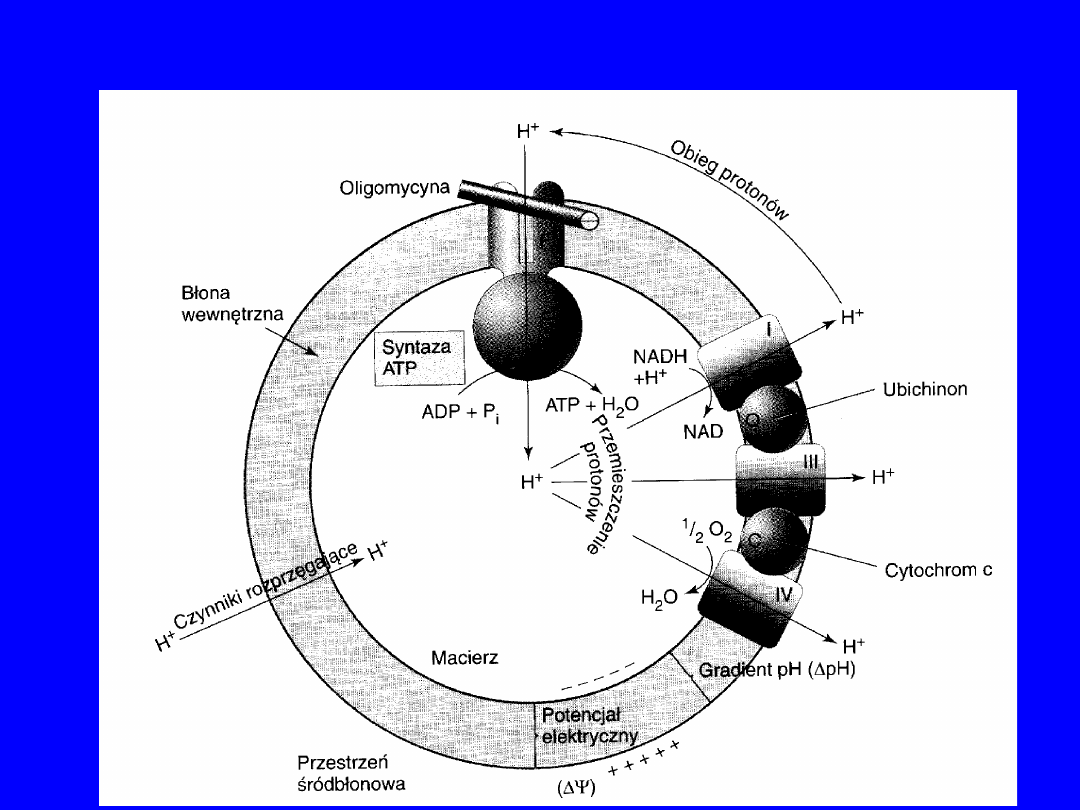
38
Sprzężenie chemiosmotyczne i synteza ATP

39
Translokaza ATP-ADP
nośnik nukleotydów adeninowych
• ATP i ADP nie mogą swobodnie dyfundować
przez
wewnętrzną błonę
mitochondrialną
Translokaza jest nośnikiem antyportowym
ADP
c
3-
+ ATP
m
4-
ADP
m
3-
+ ATP
c
4-
c – strona cytoplazmatyczna; m-matriksowa

40
FOSFORYLACJA SUBSTRATOWA
Przykład
1
Glikoliza
Glukoza
aldehyd 3-fosfoglicerynowy + NAD
+
+ P
i
dehydrogenaza aldehydu 3-
fosfoglicerynowego
3-fosfogliceroilo-1-fosforan + NADH + H
+
kwas 1,3 dwu-fosfo-glicerynowy +
ADP
kinaza fosfoglicerynowa
kwas 3-fosfoglicerynowy +
ATP

41
MECHANIZM REAKCJI
grupa aldehydowa przyłącza się do grupy –SH
enzymu,
następnie ulega odwodorowaniu, a
wodór zostaje
przeniesiony na NAD
+
;
powstaje przy tym makroergiczne wiązanie
tioestrowe, ulegające rozerwaniu w wyniku
fosforolizy. Enzym zostaje odtworzony, jako produkt
pojawia się 3-fosfoglicero-1-fosforan
makroergicznie związany kwas fosforowy
zostaje
przeniesiony na ATP przez enzym,
kinazę
fosfoglicerolową
; powstaje
przy tym 3-fosfoglicerynian i ATP.
Całkowity ciąg reakcji, w którym w przedstawiony
sposób powstaje ATP nosi nazwę
fosforylacji
substratowej

42
FOSFORYLACJA SUBSTRATOWA
Przykład 2
Glikoliza
Kwas 3-fosfo-glicerynowy
fosfogliceromutaza
kwas 2-fosfo-glicerynowy
hydrataza fosfoenolopirogronianowa
fosfoenolopirogronian + ADP
kinaza pirogronianowa
pirogronian +
ATP

43
FOSFORYLACJA SUBSTRATOWA
Przykład 3 z cyklu Krebsa
Oksydacyjna dekarboksylacja pirogronianu
Kompleks –
dehydrogenaza -ketoglutaranu
12 podjednostek dekarboksylazy oksoglutaranowej; 24
sukcynylotransferazy z grupą lipoamidową i 12
dehydrogenazy amidu
kwasu liponowego
-ketoglutaran + NAD
+
+ CoA
bursztynyloCoA
+ CO
2
+ NADH+H
+

44
syntaza bursztynylo CoA
COOH
COOH
CH
2
GDP+ P
i
GTP CH
2
+ HSCoA
CH
2
CH
2
COSCoA
COOH
Sukcynylo-CoA
bursztynian
Bursztynylo-CoA
GTP + ADP GDP + ATP
Dwufosfokinaza nukleozydów = kinaza nukleotydylofosforanowa
Wiązanie tioestrowe G=-8kcal/mol
FOSFORYLACJA SUBSTRATOWA
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
Łańcuch oddechowy, fosforylacja oksydacyjna
Łańcuch oddechowy i fosforylacja oksydacyjna
biochemia łańcuch oddechowy i fosforylacja
Łańcuch oddechowy, fosforylacja oksydacyjna
lancuch oddechowy, Biomechanika kliniczna
CKT, łańcuch oddechowy(1)
łańcuch oddechowy
Łańcuch oddechowy
lancuch oddechowy
Biochemia wykład 6 Łańcuch oddechowy
5 Wstep do metabolizmu; cykl Krebsa i lancuch oddechowy
inhibitory łańcucha oddechowego
Lancuch oddechowy, Weterynaria Lublin, Weterynaria 1, Biochemia, Biochemia
Materiały, 7 2 ŁAŃCUCH ODDECHOWY
łańcuch oddechowy
06 BIOCHEMIA lancuch oddechowyid 6261 ppt
Łańcuch oddechowy, biochemia
więcej podobnych podstron