
PROCESY TRANSPORTU W ROZTWORACH
ELEKTROLITÓW
HENRYK SCHOLL
KATEDRA CHEMII OGÓLNEJ I NIEORGANICZNEJ
WYDZIAŁ FIZYKI I CHEMII
UNIWERSYTETU ŁÓDZKIEGO
E-mail: hscholl@chemul.uni.lodz.pl

2
Omówione do tej pory termodynamiczne metody umożliwiają wyznaczanie
wielkości charakterystycznych dla stanów równowagi.
Określenie rodzaju i szybkości procesów doprowadzających układ do
stanu
równowagi wykracza poza ramy termodynamiki.
Zmiany w układach chemicznych, a więc i w roztworach elektrolitów nie
znajdujących się w stanie równowagi, polegają na reakcjach chemicznych
i na procesach transportu.
Scharakteryzujmy krótko podstawowe rodzaje transportu w
roztworach elektrolitów:
1)
Przewodzenie prądu elektrycznego
- jest transportem
naładowanych cząstek na skutek działania zróżnicowanego pola
elektrycznego.
2) Konwekcja
- jest transportem substancji pod wpływem
zewnętrznych sił mechanicznych lub impulsu związanego z ruchem
części układu, różniących się np. gęstością.
3
3) Przewodzenie ciepła
- jest transportem substancji na skutek istnienia
gradientu temperatury.
4) Dyfuzja
- jest transportem substancji, uwarunkowanym różnymi
wartościami potencjału chemicznego wewnątrz układu oraz między
układem a jego otoczeniem.
Zdefiniujmy na wstępie pojęcie
gęstości przepływu
:
jest to ilość określonej wielkości termodynamicznej (moli, dżuli,
kulombów), która przepływa w jednostce czasu (1s) przez jednostkę
przekroju poprzecznego (1m
2
).
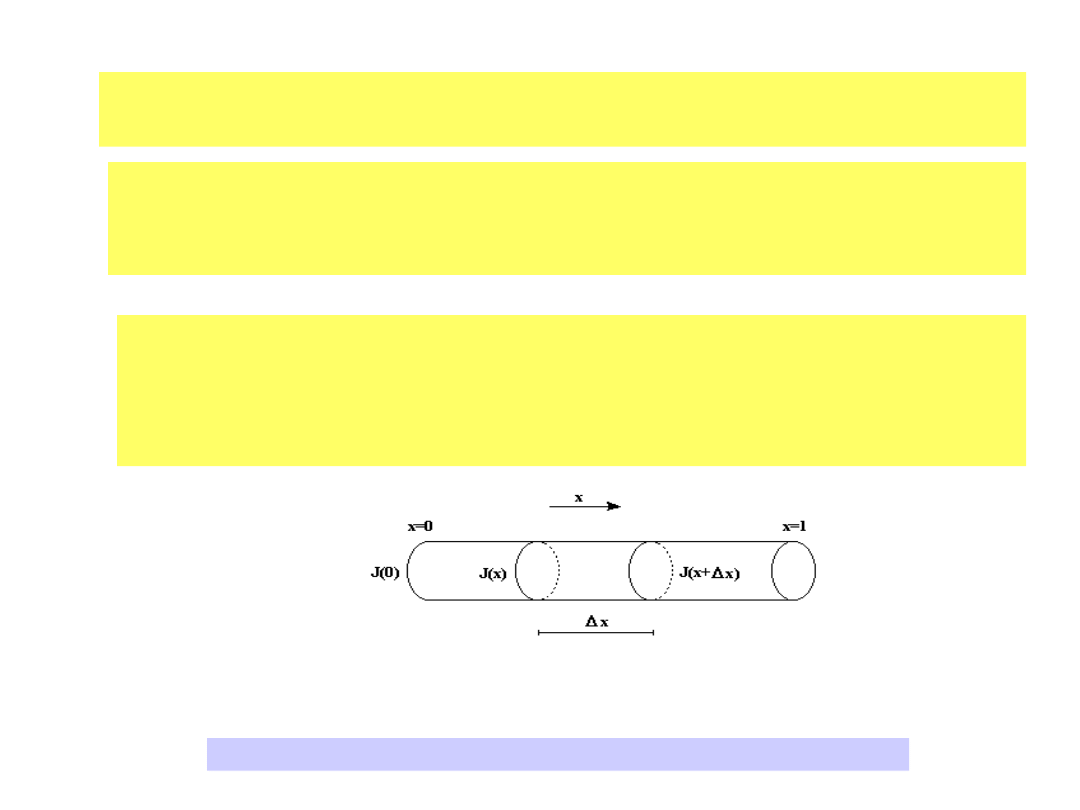
Ilustracja do rozważań o przepływie dyfuzyjnym
4
Rozważa się rurę o przekroju A i długości l przy założeniu, że
zmiany wielkości termodynamicznych mogą występować
jedynie w kierunku podłużnym.
Gęstość przepływu J jest funkcją osi podłużnej x.
Zmiana ilości wielkości termodynamicznej, np. zmiana ilości
substancji, zachodząca w jednostce czasu jest opisana
zależnością:
0
1 J
J
dt
dM
(1)
Dla odcinka x gęstość przepływu J jest ciągłą funkcją x we wnętrzu
rury. Chwilową zmianę ilości wielkości termodynamicznej w tym
odcinku rury można wyrazić wzorem:
x
A
x
J
x
x
J
t
M
(2)

5
Dzieląc obie strony równania przez Ax = V i biorąc pod uwagę
gęstości graniczne otrzymamy:
t
M
V
J
x
(3)
ponieważ wyrażenie na gęstość jest oczywiste:
M
V
(4)
t
J
x
to:
(5)
Dla
ciała
trójwymiarowego,
ograniczonego
przez
powierzchnię S, posługujemy się analizą wektorową. Wektor
dS jest wektorem unormowanym, skierowanym od ciała na
zewnątrz.

6
dS
J
t
M
(6)
Gęstości przepływu wielkości termodynamicznych są wprost
proporcjonalne do wielkości fizycznych charakteryzujących
substancję w rozważanym punkcie układu.
Należy równocześnie pamiętać, że podczas dyfuzji mamy do
czynienia z nieuporządkowanym ruchem cieplnym cząstek.
Ponieważ jednak występuje tu
gradient stężenia
i przepływ
cząstek w kierunku mniejszego stężenia przeważa nad
przepływem w kierunku przeciwnym, to cząstki wędrują
do obszaru o mniejszym stężeniu.

Szybkość dyfuzji
jest określona zależnością empiryczną znaną
również pod nazwą I prawa Ficka:
7
J
D
dc
dx
dyf
(7)
Lub inaczej:
J
D c
dyf
grad
(8)
gdzie
D jest współczynnikiem dyfuzji
o wymiarze [m
2
s
-1
]
lub częściej stosowane [cm
2
s
-1
].
Dla większości nieorganicznych kationów i anionów jest w
roztworach ciekłych rzędu 10
-6
cm
2
s
-1
.
Należy jednocześnie nadmienić, że szczegółowe rozważania
dyfuzji, wysoce przydatne w teorii procesów elektrodowych,
opiera się na tzw. II prawie Ficka o równaniu podstawowym:
c
t
D
c
x
2
2
(9)

8
Rozpatrzmy teraz sposób w jaki rozwiązano zagadnienie obliczenia
wartości prądu dyfuzyjnego w reakcji elektrodowej:
Ox + ne Red
Przyjęto, dla ułatwienia, że obie formy depolaryzatora nie są
naładowane. Wówczas na powierzchni elektrody będą się
znajdować cząstki "Ox" i "Red" w zależności od odległości od
elektrody i czasu pokonania tej odległości, tj. c
ox
(x,t) i c
Red
(x,t).
Dla opisu zachodzącego procesu przyjęto ponadto kilka założeń:
1)
elektroda ma płaską powierzchnię o wielkości A i jest
dostatecznie duża, by można pominąć zakłócenia dyfuzji na jej
krawędziach;
2) dyfuzja wzdłuż osi x jest do powierzchni A prostopadła
i rozpatrywana wyłącznie na dodatniej części osi x;
3) wyjściowe stężenia cząstek w roztworze , tzn. przed
rozpoczęciem procesu dyfuzji wynoszą:
c
ox
(x,0) = c
0
Ox
i c
Red
(x,0) = 0 dla x 0;

9
4) objętość elektrolitu jest dostatecznie duża, tak, że w czasie przebiegu
reakcji stężenia obu form depolaryzatora w głębi roztworu nie zmieniają
się, tzn.
c
ox
(x,t) c
0
ox
i c
Red
(x,t) 0 jeśli x ;
5) każda cząstka "Ox" po przyjęciu elektronu w reakcji utleniania
i redukcji tworzy formę "Red" depolaryzatora. Oznacza to, że strumienie
przepływu są równe i przeciwne co do znaku: J
ox
(0,t) = -J
Red
(0,t)
6) Reakcja wymiany elektronu w omawianym procesie jest bardzo szybka
i tym samym formy depolaryzatora "Ox" i "Red" są w stanie stałej
równowagi i spełniają równanie Nernsta zapisane w postaci:
c
t
c
t
nF E E
RT
Ox
d
( , )
( , )
exp
(
)
Re
0
0
0
(10)
W takich warunkach dyfuzja obydwu rodzajów cząstek spełnia II-gie
prawo Fick'a, co ilustrują równania:
c
t
D
c
x
Ox
Ox
Ox
2
2
(11)
c
t
D
c
x
d
d
d
Re
Re
Re
2
2
(12)

10
Rozwiązaniem tych równań są stężenia form "Ox" i "Red"
w funkcji odległości i czasu dyfuzji. Rozwiązania powyższych
równań przeprowadzono poprzez transformacje Laplace'a.
Jeśli teraz bodziec powodujący migrację jonów (cząstek) jest
proporcjonalny do gradientu potencjału chemicznego,
to współczynnik proporcjonalności nosi nazwę
ruchliwości (u).
Opisuje on przepływ substancji przy jednostkowym stężeniu
i jednostkowym gradiencie potencjału chemicznego. Wówczas
przepływ dyfuzyjny opisuje równanie:
J
uc
dU
dx
u RT
dc
dx
dyf
(13)

PRZEWODNICTWO ROZTWORÓW ELEKTROLITÓW
W ramach podstawowego kursu fizyki omówione zostały reguły
rządzące przepływem prądu elektrycznego przez przewodniki
metaliczne i przez półprzewodniki różnych typów.
Omówmy obecnie zjawiska towarzyszące przepływowi prądu
elektrycznego przez roztwory elektrolitów, elektrolity stałe
i stopione sole.
11
Transport ładunku opisuje (na zasadach rządzących dyfuzją) prawo
Ohma podane w postaci:
j
d
dx
(14)
Gdzie: - jest przewodnictwem właściwym,
- jest potencjałem wewnętrznym fazy

Z kolei gęstość prądu jest określona prawem Faradaya:
12
j
z FJ
i
i
i
(15)
gdzie J
i
jest gęstością przepływu "i"-tego składnika układu.
Ta postać prawa Faraday'a wyraża równoważność transportu
naładowanej elektrycznie materii oraz transportu ładunków
elektrycznych. Przypomnijmy, że dla przepływu materii to prawo jest
znane pod postacią:
m = k i t (16)
Bodziec powodujący elektrolityczne przenoszenie ładunków jest
wielkością analogiczną do gradientu potencjału chemicznego, tj.
gradientu energii elektrycznej odniesionej do jednostki ilości substancji
x
F
z
c
u
J
i
i
(17)
gdzie u
i
jest ruchliwością "i"-tego składnika.
Wielkość, która definiuje
ruchliwość elektrostatyczną
ma postać:
U
z Fu
i
i
i
(18)
Co z kolei prowadzi do formuły przewodności właściwej:
z FUc
i
i i
i
(19)
Lub w postaci:
z F uc
i
i i
i
2
2
(20)
Stąd definicja
przewodności molowej
uwzględniająca odpowiednio ruchliwości kationów i
anionów:
13
z F u FU
i
i
i
2
(21)
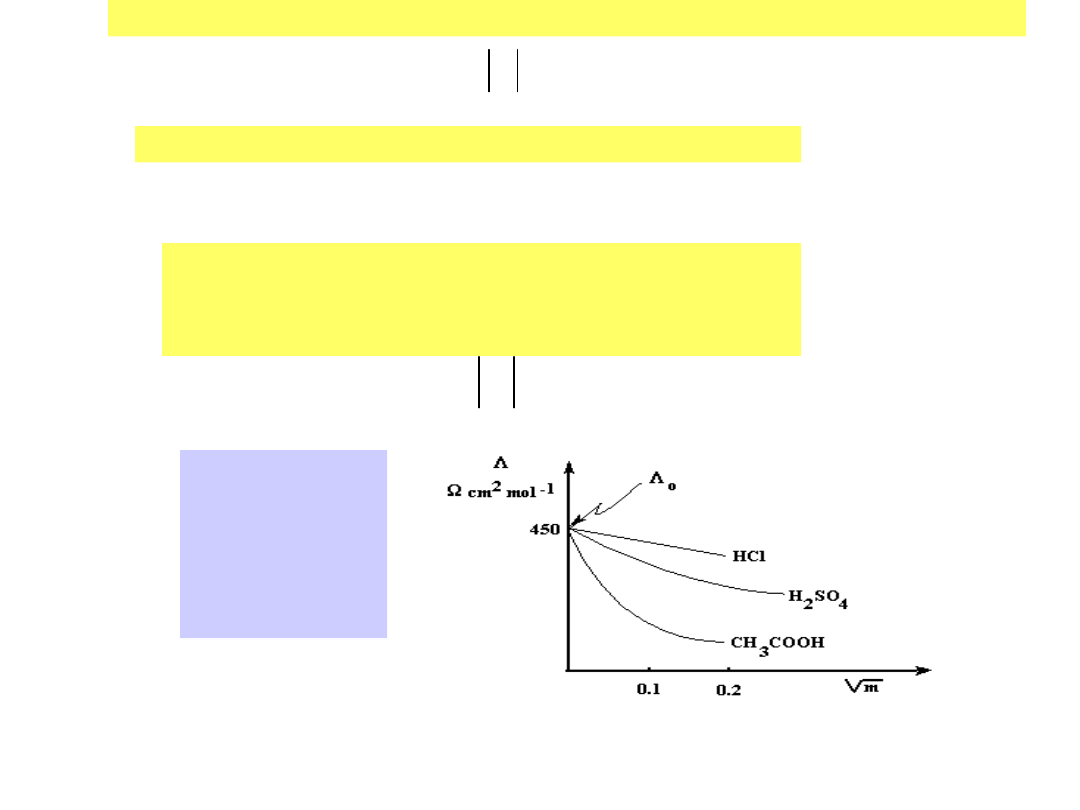
Zależność
przewodnictwa
molowego
= /
c
od stężenia i
rodzaju
elektrolitu

14
Stąd blisko do sformułowania przez
Ostwalda prawa rozcieńczeń
pozwalającego na obliczenie przybliżonej nietermodynamicznej
stałej dysocjacji:
K
c
c
o
o
'
2
2
1
(22)
W miarę zwiększania stężenia roztworu elektrolitu zmienia się
wpływ sił międzyjonowych na prędkość wędrówki jonów.
Zanim sprecyzujemy ten wpływ przypomnijmy ogólne zależności,
jakie występują podczas ruchu kulistej cząstki o promieniu r
(jonu) przez lepkie środowisko (rozpuszczalnik) o współczynniku
lepkości
. Definiuje to
prawo Stokesa
:
u
f
r
i
i
6
(23)
gdzie f
i
jest siłą działającą na cząstki.
Siły międzyjonowe wpływają dwojako na prędkość wędrówki
jonów. Mamy do czynienia z
efektem elektroforetycznym
i z efektem czasu relaksacji
:
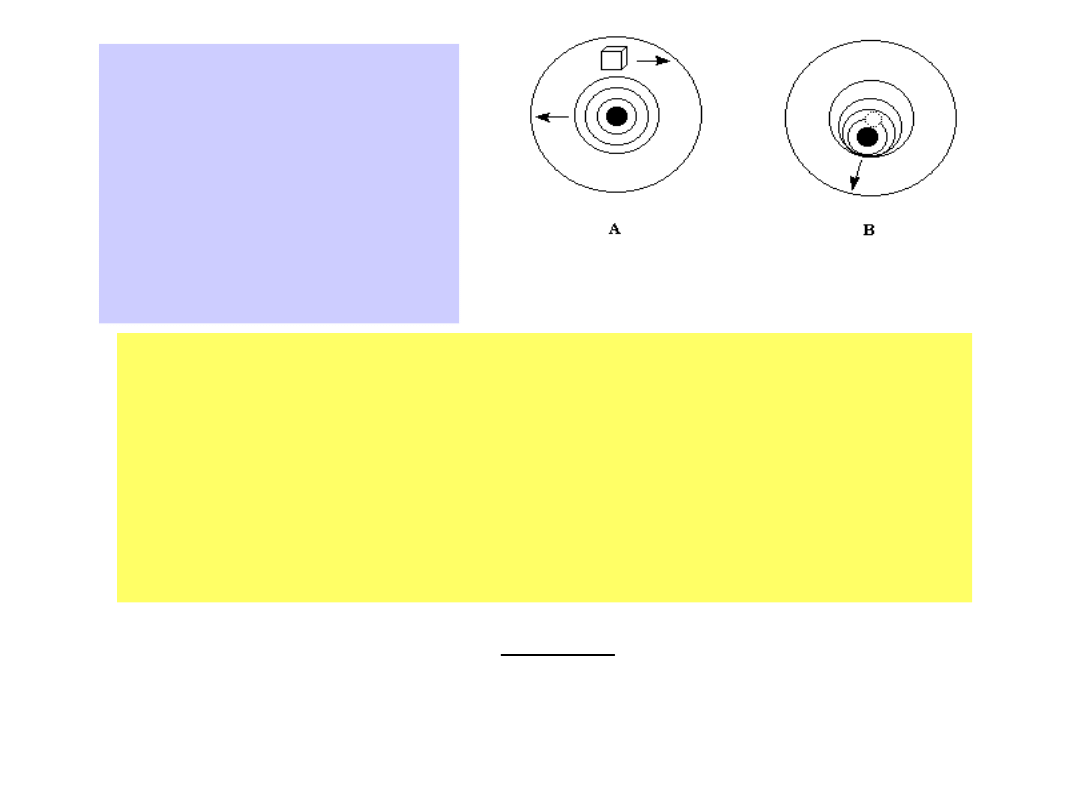
15
A)
Efekt elektroforetyczny. Jon
porusza się w kierunku
przeciwnym niż atmosfera
jonowa.
B)
Efekt
relaksacyjny.
Skończonego
czasu
wymaga
odtworzenie
atmosfery jonowej podczas
ruchu
jonu.
Wtedy
położenie jonu nie
pokrywa
się ze środkiem atmosfery
jonowej
W przypadku
efektu elektroforetycznego
jony pociągają za sobą
cząsteczki rozpuszczalnika, pozostałe poruszają się w kierunku
przeciwnym, więc obydwa ruchy wzajemnie się hamują.
Do prawa Stokesa, jako siłę f
i
powodującą ruch jonu,
wprowadzimy siłę elektryczną (z i e F) stanowiącą iloczyn
ładunku jonu zi i natężenia pola elektrycznego. Mamy wówczas
prędkość ruchu atmosfery jonowej:
V
zeF
x
i
6
(24)
16
Określone opóźnienie (relaksacja) ruchu jonu związane jest
z odtwarzaniem się kulistej symetrii atmosfery jonowej wokół jonu
centralnego, przesuwającego się pod wpływem pola elektrycznego.
Po oddaleniu się jonu centralnego zarówno zanikanie atmosfery
jonowej, jak i jej "reinkarnacja" są wykładniczymi funkcjami czasu.
Zakończenie tych procesów (zanikanie odtwarzanie) jest podwójnym
upływem czasu (tzw.
czasu relaksacji
) rzędu 10
-7
do 10
-9
s.
Istotą zjawiska jest to, że podczas ruchu jonu centralnego (ruchu
wywołanego wpływem zewnętrznego pola elektrycznego) położenie
centrum jonu nie pokrywa się z położeniem środka atmosfery jonowej –
tym samym wypadkowa oddziaływań jest różna od zera.
Efekt czasu relaksacji jest istotny ze względu na to, że natężenie pola
elektrycznego wytworzonego przez atmosferę jonową powodują małe
zmiany symetrii atmosfery jonowej i osłabiają znaczenie oddziaływania
zewnętrznego pola elektrycznego.
17
Przy jego wysokich wartościach pola elektrycznego jony
przegrupowują się na tyle szybko, że nie zdąży się przegrupować
atmosfera jonowa, zanikają obydwa efekty – relaksacyjny
i elektroforetyczny.
To "prucie" atmosfery jonowej przez jony zostało nazwane "efektem
Wiena", który dla słabych elektrolitów stwierdził ponadto, że silne
pole elektryczne podwyższa wartość stałej dysocjacji słabego
elektrolitu.
Dla sformułowania udziałów ładunków przenoszonych przez kationy
i aniony używa się pojęcia
liczb przenoszenia
t
i
, znanych z kursu
chemii fizycznej.
Podstawiając zależności pomiędzy liczbami przenoszenia
a ruchliwością otrzymuje się
wzór Hendersona
:
E
u u
u u
RT
F
a
a
dyf
ln
1
2
(25)

18
Potencjał dyfuzyjny jest wielkością wchodzącą w skład potencjałów
składających się na
wartość siły elektromotorycznej
.
Eliminuje się go poprzez stosowanie odpowiednich kluczy
elektrolitycznych, zawierających z reguły nasycony roztwór
obojętnego elektrolitu.
Przedstawiony tu zarys procesów transportu w roztworach
elektrolitów odnosi się do procesów w "nieruchomym" roztworze.
Odrębne zagadnienia wiążą się z procesami transportu,
takimi jak dyfuzja do wirującej elektrody, dyfuzja do narastającej
kropli (w polarografii) itd.
Pozostawmy to do wykładów specjalizacyjnych.
K O N I E C
DZIĘKUJĘ ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
Wyszukiwarka
Podobne podstrony:
PROCESY TRANSPORTU W ROZTWORACH ELEKTROLITÓW 3
PROCESY TRANSPORTU W ROZTWORACH ELEKTROLITOW
13 Równowagi w roztworach elektrolitówid 14769 ppt
modelowanie procesˇw transportowych
ElektroterapiaDarek ppt
Logistyka produkcji zajmuje się procesami transportowymi(2)-[ www.potrzebujegotowki.pl ], Ściągi i w
12 Badanie procesów relaksacyjnych w obwodach elektrycznych
więcej podobnych podstron