Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
RÓWNOWAGI
W ROZTWORACH
ELEKTROLITÓW
Równowagi w wodnych roztworach słabych kwasów i
zasad. Stałe równowagi, prawo rozcieńczeń Ostwalda.
Chemiczne wskaźniki pH roztworu.

Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Elektrolity mocne i
słabe
Elektrolity mocne
α = 100%
dysocjacja całkowita
– MOCNE KWASY:
Przykłady:
Elektrolity słabe
α ≤ 3%
dysocjacja częściowa, niewielka
HCN , H
2
CO
3
, H
2
S,
HNO
2
, H
2
SO
3
,
H
2
SiO
3
, kwasy
organiczne
Przykłady:
– WSZYSTKIE SOLE
– MOCNE ZASADY:
HCl , HNO
3
– SŁABE KWASY:
NH
3
.H
2
O
(dawniej NH
4
OH)
– SŁABE ZASADY:
podział wg stopnia dysocjacji
w niezbyt stężonych roztworach (0,1M i mniejsze)
NaOH, KOH
PRZ
YPO
MNI
ENIE
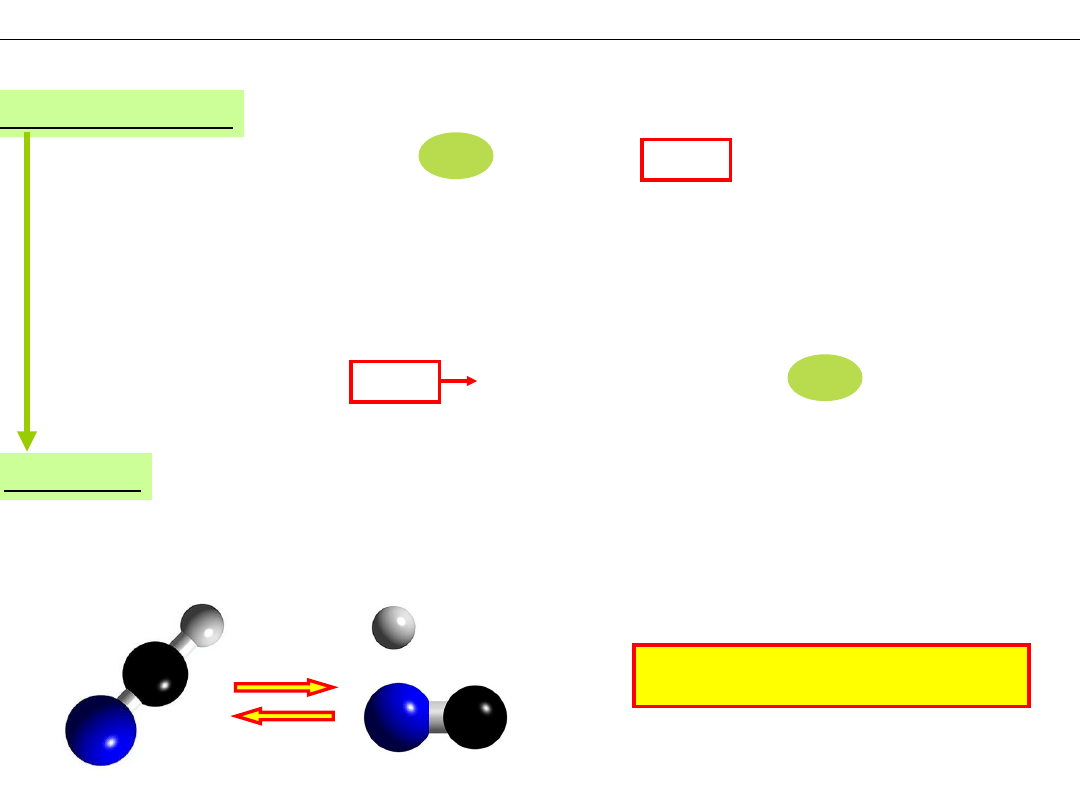
[H+] = 10
−5
mol/dm
3
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Dysocjacja słabych kwasów i
zasad
Roztwór HCN o stężeniu c
a
= 0,1 M wykazuje pH=5.
−log[H+] =5
Doświadczenie:
HCN = H
+
+ CN
−
– zapis uproszczony
HCN + H
2
O = H
3
O
+
+ CN
−
HCN jest bardzo mało zdysocjowany. Wiązanie H–CN jest silne
– woda z trudem je rozrywa, a obecne w roztworze jony H
+
i CN
−
chętnie łączą się z powrotem w cząsteczki HCN.
Wniosek:
Stężenie jonów H
+
: pH=5.
HCN H
+
+ CN
−
Reakcja odwracalna - równowagowa
HCN + H
2
O
H
3
O
+
+
CN
−
H
C
N
−
N
C
H
+
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
HCN H
+
+
CN
−
Stała równowagi – STAŁA DYSOCJACJI
K
a
[
HCN
]
[
H
+
]
· [
CN
−
]
K
=
a
Jakie wartości dla:
c
a
= 0,1 M
pH=5; [H
+
]=10
−5
c
a
− 10
−5
10
−5
· 10
−5
[X]-
stężenia
w stanie
równowagi!
c
a
− [
H
+
]
[
H
+
]
· [
H
+
]
=
=
=
0,1
10
−5
· 10
−5
10
−9
c
a
>> 10
−5
Równowaga w roztworze słabego
kwasu
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
NH
3
·H
2
O NH
4
+
+ OH
−
[NH
3
·H
2
O]
[NH
4
+
]
· [OH
−
]
K
=
b
Równowaga w roztworze słabej
zasady
STAŁA DYSOCJACJI
K
b
= – logK
b
K
b
= 10
−4,7
= 2 ·10
−5
= 2 ·10
−5
Jakie jest pH roztworu NH
3
·H
2
O o stężeniu c
a
= 0,1 M?
Jakie jest [OH
−
]?
Rozwiązanie:
c
a
−
[OH
−
]
[OH
−
]
· [OH
−
]
=
K
b
=
c
a
[OH
−
]
2
[OH
−
]
2
= K
b
c
a
=2 ·10
−5
·0,1
Jakie jest [H
+
]?
Zawsze obowiązuje iloczyn jonowy wody K
w
= [H
+
] [OH
−
]=10
−14
[OH
−
]
=
2 ·10
−6
1,4·10
−3
=
K
w
[OH
−
]
[H
+
]=
=
10
−14
1,4·10
−3
=7,1·10
−12
pH= –log7,1·10
−12
= 11,1
pK
b
= 4,7
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
– STĘŻENIE ROZTWORU
C
a
STAŁA DYSOCJACJI
K
b
– STOPIEŃ DYSOCJACJI
α
Czy
istnieje związek
pomiędzy tymi wielkościami?
α = n
o
liczność cząsteczek które uległy dysocjacji
liczność cząsteczek wprowadzonych do roztworu
=
n
z
α =
n
o
/V
n
z
/V
=
c
o
= c
a
c
z
Stężenie cząsteczek które zdysocjowały,
rozpadły się na jony, a więc nie istnieją !!!
...ale...
...ale można je obliczyć ze stężeń produktów dysocjacji
Jeżeli w 1 dm
3
zdysocjuje
c
z
cząsteczek HCN
HCN H
+
+ CN
−
c
z
c
z
c
z
to powstanie
c
z
jonów H
+
i
c
z
jonów CN
−
c
z
=
[
H
+
] [
CN
−
]
=
c
z
V – objętość
roztworu
K (c
a
− c
a
·α)
(c
a
·α)
· (c
a
·α)
=
a
c
a
(1− α)
c
a
·α
2
2
=
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
HCN H
+
+ CN
−
c
z
= [H
+
] c
z
= [CN
−
]
α =
c
a
c
z
=
c
a
[H
+
]
= c
a
[CN
−
]
[H
+
] = [CN
−
] =
c
a
· α
[
HCN
]
[
H
+
]
· [
CN
−
]
K
=
a
Równanie reakcji dotyczy tylko
tej części cząsteczek, jonów
które dysocjują lub powstają.
Stała równowagi dotyczy
wszystkich wymienionych w niej
cząstek, obecnych w roztworze.
cząsteczki które dysocjują
(c
z
=c
a
·α)
cząsteczki które pozostały po dysocjacji
Z równania reakcji wynika:
=
Ka (1− α)
c
a
·
α
2
Prawo Rozcieńczeń Ostwalda
Dla elektrolitów bardzo słabych (α <<1):
K
a
c
a
·
α
2
α
Ka
c
a
1
c
a
α
(100%)
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
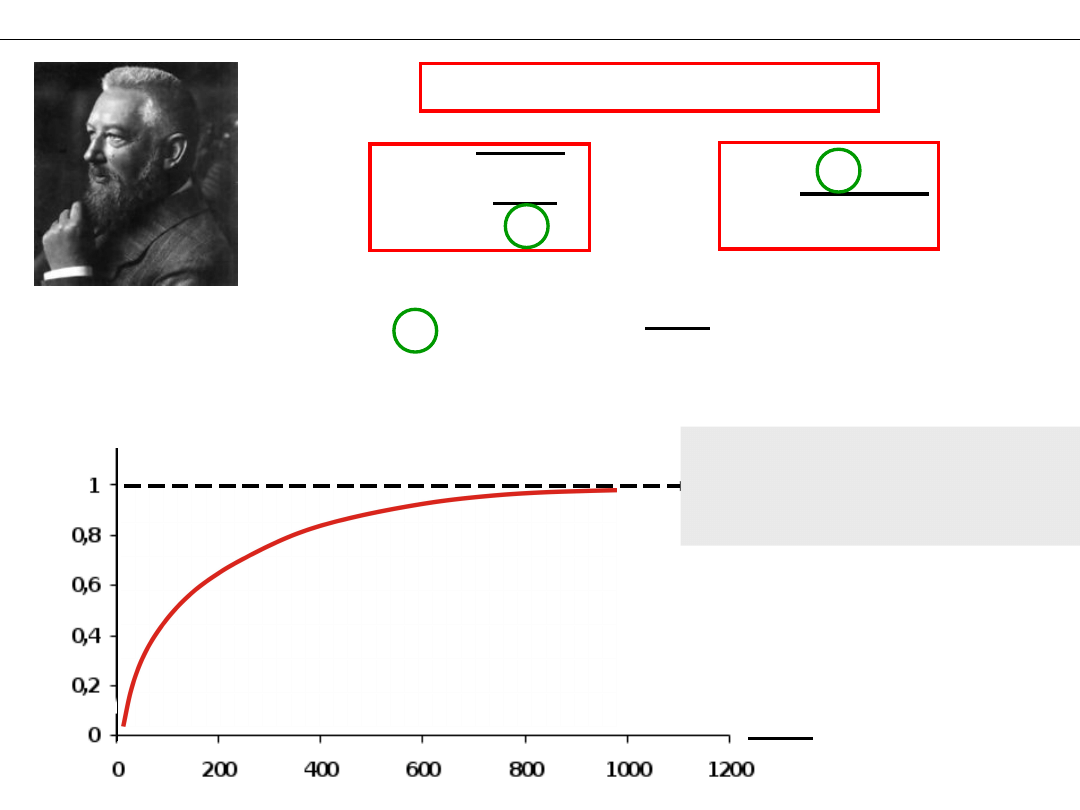
Prawo Rozcieńczeń Ostwalda
Wilhelm Friedrich Ostwald
(1853−1932)
Nobel 1909
α=
Ka
c
a
Forma uproszczona
=
Ka (1− α)
c
a
·
α
2
Forma dokładna
c
a
– stężenie
1
c
a
– rozcieńczenie
Przy dużym rozcieńczeniu
każdy elektrolit
dysocjuje całkowicie.
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
REGUŁA PRZEKORY W DYSOCJACJI SŁABYCH ELEKTROLITÓW
Zadanie: Jaki jest stopień dysocjacji HCN w 0,1 M roztworze?
Jak ten stopień dysocjacji można zmniejszyć? K
a
=10
−9
HCN H
+
+
CN
−
α=
Ka
c
a
Forma uproszczona
=
10
−9
0,1
0,01 %
=
Ka (1− α)
c
a
·
α
2
Forma dokładna
Czy skorzystanie ze
wzoru uproszczonego
(1− α)
=10
−4
10
−4
= 1–
1
= 0,9999
SŁUSZNE!
było słuszne?
Jak zmniejszyć stopień dysocjacji?
Przesunąć równowagę „w LEWO” –
HCN H
+
+ CN
−
– zwiększyć stężenie H
+
lub CN
–
– czyli dodać np:
HCl
lub
KCN
[HCN]
[H
+
]
· [CN
−
]
K
=
a
Jaki jest stopień dysocjacji
0,1 M HCN w 0,2 M roztworze HCl
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Jak zmniejszyć stopień dysocjacji?
Przesunąć równowagę „w LEWO” –
HCN H
+
+ CN
−
HCl – mocny kwas –
100 % dysocjacji
HCl H
+
+ Cl
−
0,2 M
0,2 M
0,2 M
Nie można stosować
PRAWA ROZCIEŃCZEŃ
– dodatek HCl !
=
α=
Ka
c
a
=
Ka (1− α)
c
a
·
α
2
c
a
– [CN
−
]
([H
+
]+[H
+
])
· [CN
−
]
HCl
HCN
<<<
>>>
=
0,2·[CN
−
]
0,1
K
a
=
2·[CN
−
]
=
10
−9
[CN
−
]
=
5·10
−10
=
[CN
−
]
c
a
α
=
5·10
−10
0,1
=
5·10
−9
=
0,0000005 %
[bez HCl
α = 0,01 %
]
Słabszy
kwas
Silniejszy
kwas
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Dysocjacja kwasów
wielozasadowych
Przykład: – kwas węglowy H
2
CO
3
H
2
CO
3
H
+
+ HCO
3
−
(1)
HCO
3
−
H
+
+ CO
3
2−
(2)
Stałe dysocjacji
[H
2
CO
3
]
[H
+
]
· [HCO
3
−
]
K
a1
=
= 9,1·10
−7
[HCO
3
−
]
[H
+
]
· [CO
3
2−
]
K
a2
=
= 2,7·10
−10
Obydwie równowagi
istnieją jednocześnie
Jony H
+
są wspólne
α
1
=
[HCO
3
−
]
c
a
α
2
=
[HCO
3
−
]
[CO
3
2−
]
α
2
>
α
1
Równowaga (2) przesunięta "w LEWO" przez jony H
+
pochodzące z reakcji (1).
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Chemiczne wskaźniki pH roztworu.
Wskaźniki pH – związki chemiczne, których barwa zmienia się
zależnie od pH środowiska, w którym się
znajdują.
Zmiana barwy następuje w specyficznym dla
każdego wskaźnika zakresie pH.
Przykłady:
Oranż metylowy
pH.
3
0
5
14
Fenoloftaleina
pH. 0
9
14
Błękit bromotymolowy
pH.
6
0
8
14

Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Chemiczne wskaźniki pH roztworu.
Wskaźniki uniwersalne – mieszaniny różnych
wskaźników
Wskaźniki o różnych zakresach zmiany
barwy
typowe barwy dla różnych pH
Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Dlaczego wskaźniki zmieniają
barwę?
Oranż metylowy (orm) – równowaga dwóch form: H(orm) i H
2
(orm)
+
W roztworze, obie formy współistnieją w równowadze:
H(orm) + H
+
H
2
(orm)
+
[H
+
] · [H(orm)]
[H
2
(orm)
+
]
K
=
=10
4
Barwa jest wyraźnie czerwona lub żółta
gdy odpowiedniej formy jest co najmniej
10 razy więcej niż drugiej.
K
·
[H(orm)]
[H
2
(orm)
+
]
=
[H
+
]
Przy jakich wartościach pH tak się dzieje?
[H
2
(orm)
+
]
[H(or
m)]
= 10
[H
2
(orm)
+
]
[H(or
m)]
= 0,1
lub
=
[H
+
]
10
−1
10
4
=10
−5
pH=3
pH=5
3
5
H
2
(orm)
+
H(orm)
pH. 0
14
10
4
·
[H(orm)]
[H
2
(orm)
+
]
=
[H
+
]
=
10
10
4
=10
−3

Wykład 13 – RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW
Naturalne wskaźniki pH roztworu.
pH < 5,5 jasnożółta
Herbata czarna
pH > 7,5 ciemnobrązowa
Sok z czerwonej kapusty.
pH
0
7
14
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
13 Równowagi w roztworach elektrolitów słabych
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
1 Równowagi w roztworach elektrolitów Kwasy i zasady
6 pHelek ul, Temat: Równowaga w roztworach elektrolitów
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
,podstawy chemii nieorganicznej L,Równowagi w roztworach elektrolitów
więcej podobnych podstron