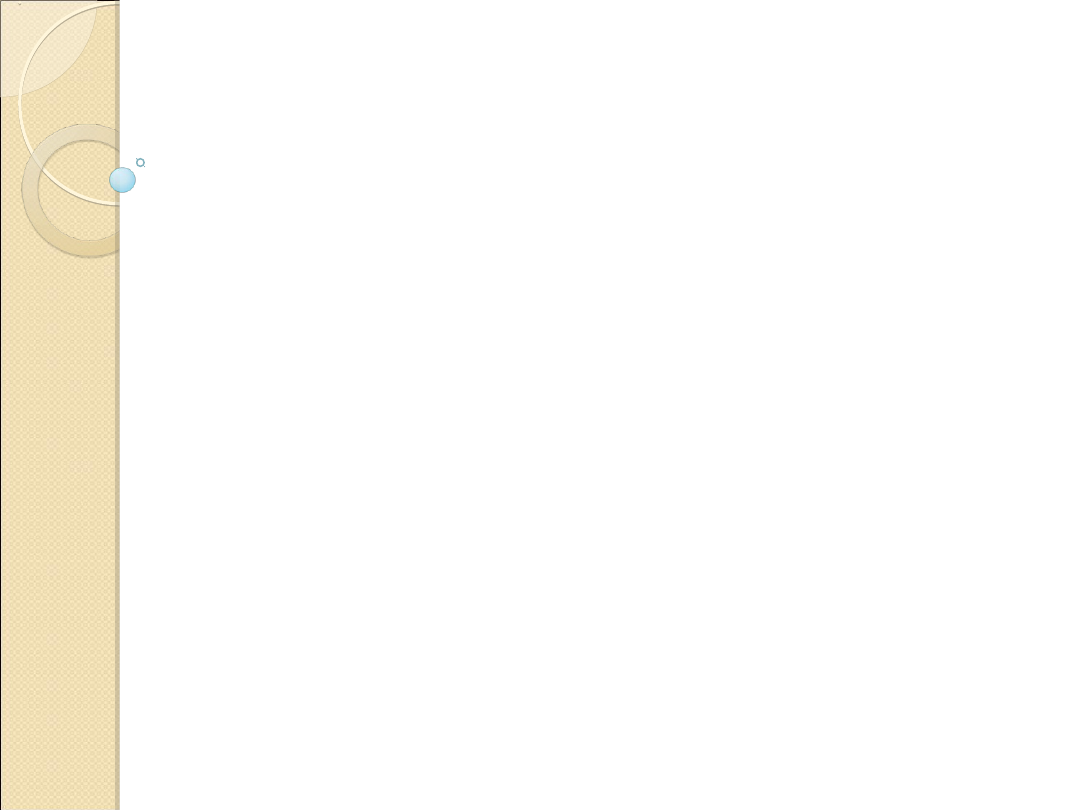
Herpeswirus typ 1 i 2
Herpeswirus typ 1 i 2
ptaków
ptaków
Agnieszka Owerko

Z
Z
akaźne zapalenie krtani i tchawicy
akaźne zapalenie krtani i tchawicy
kur
kur
(Infectious laryngotracheitis ILT)
(Infectious laryngotracheitis ILT)
•
Zakaźne zapalenie krtani i tchawicy jest ostrą
wirusową chorobą układu oddechowego kur i
bażantów, charakteryzującą się
krwotocznym
zapaleniem błony śluzowej
krtani i górnej
części tchawicy oraz
spadkiem produkcji jaj
.
•
Pierwszy przypadki zachorowań odnotowano
w USA, w 1925roku, a następnie
rozpowszechniła się na świecie, przede
wszystkim w krajach
o dużej koncentracji
intensywnie hodowanego
drobiu
.
•
ILT jest
pierwszą
chorobą wirusową drobiu,
przeciwko której opracowana
szczepionkę
.

Etiologia
Etiologia
Chorobę wywołuje wirus należący do rodziny
Herpesviridae, podrodziny Alphaherpesvirinae,
aktualnie oznaczany jako Gallid herpesvirus 1.
Kompletne cząstki wirusa mają średnicę 195-
250nm.
Zawierają
dwułańcuchowy DNA
.
Wirion z zewnątrz osłonięty jest
otoczką,
co
decyduje o wrażliwości zarazka na rozpuszczalniki
tłuszczowe.
Wykazują
duże zróżnicowanie w zjadliwości
dla
kurcząt i embrionów-od szczepów bardzo
zjadliwych powodujących
wysoką zachorowalność i
śmiertelność
do szczepów o
słabej zjadliwości
wywołujących łagodną lub niezauważalną infekcję.


Patogeneza
Patogeneza
Źródłem zakażenia są
ptaki chore
- wirus w dużych
ilościach znajduje się w wykrztusinie z tchawicy i
może być wydalany do 10 dni po zakażeniu; oraz
zakażone latentnie
- w tym stanie może pozostawać
do 15 tygodni po zakażeniu.
Ponadto w sposób pośredni wirus ILT może być
przenoszony
na odzieży czy obuwi
u przez obsługę,
a także za pośrednictwem
sprzętu do obsługi,
ściółki i paszy
.
Możliwe jest też
mechaniczne przenoszenie
wirusa
ILT przez
gryzonie i psy
.
Zakażenie następuje w wyniku
kontaktu
bezpośredniego
ptaków lub
pośrednio
drogą układu
oddechowego, rzadziej przewodu pokarmowego.

Patogeneza
Patogeneza
Na zakażenie
największą wrażliwość
wykazują
kury
(Gallus gallus). Ptaki chorują w każdym
wieku, najbardziej charakterystyczne zmiany
występują u kur dorosłych.
Chorobę stwierdzono również
u bażantów i pawi
.
Indyki
wydają się odporne na zachorowanie, ale w
ich surowicy występują przeciwciała dla wirusa
ILT.
Indyki
, a także
kaczki
mogą ulegać
zakażeniu
bezobjawowemu
i rozprzestrzeniać wirus.
Okres
wylęgania
choroby wynosi
od 6 do 12 dni
przy zakażeniu naturalnym, natomiast 2-4 dni po
zakażeniu eksperymentalnym.
Zakażenie szybko rozprzestrzenia się w obrębie
kurnika, natomiast przeniesienie się infekcji na
inne stada może trwać do kilku tygodni.

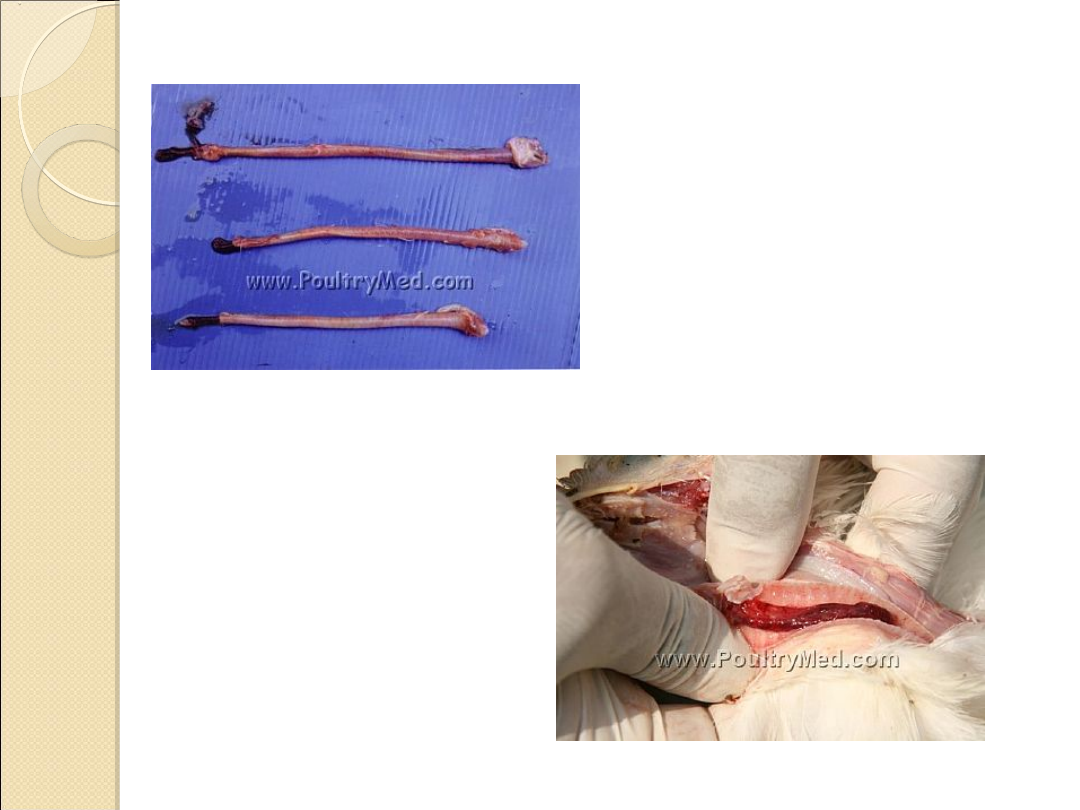
Objawy kliniczne
Objawy kliniczne
Choroba może występować w
ostrej
formie epidemicznej i
łagodnej
endemicznej.
W przebiegu ostrym
u chorych ptaków występują
nasilające się objawy oddechowe w postaci
prychania,
ciężkiego oddechu
oraz
odkrztuszania krwawego wysięku
z
tchawicy. Oddychaniu towarzyszą swoiste świszczące
odgłosy. Objawom tym często towarzyszy
ropne zapalenie
spojówek i obrzęk powiek
. Czasami spotykamy jedno- lub
dwustronny
obrzęk zatok podoczodołowych
oraz
żółte
naloty
na tylnej ścianie podniebienia i w okolicy krtani.
Chore ptaki są
osowiałe
,
nie mają apetytu
, a u niosek
spada
nieśność
.
Choroba może trwać około
2 tygodni
.
Ta postać choroby przebiega z
wysoką
zachorowalnością
(90-100%) i zróżnicowaną
śmiertelnością(średnio 10-20%).

Objawy kliniczne
Objawy kliniczne
Przy łagodnej postaci
ILT u ptaków obserwuje się
zapalenie
spojówek, wyciek z nosa oraz obrzęk
zatok.
Chore ptaki są nieznacznie osowiałe i zwykle po 2
tygodniach wracają do zdrowia.
Chorobie może towarzyszyć
spadek produkcji
nieśnej
o 5-25%, bez zmian na skorupach. Niekiedy
nieśność spada znacznie lub całkowicie zanika.
Zachorowalność
jest zwykle
niska
(około 5%) z
jeszcze mniejszą śmiertelnością (0,1-2%).
Na przebieg choroby i śmiertelność wpływają złe
warunki chowu, niedobory witaminy A, a także
zakażenie innymi patogenami, zwłaszcza pałeczkami
E. colli i Pasteurella.

Zmiany anatomo- i
Zmiany anatomo- i
histopatologiczne
histopatologiczne
Zmiany sekcyjne
są zlokalizowane
w jamie
nosowej, krtani i tchawicy
. Błona śluzowa jamy
nosowej i górnej części tchawicy jest
przekrwiona i pokryta śluzem
. W obrzękłej i
przekrwionej
krtani
stwierdza się masy śluzowo-
włóknikowe z domieszką krwi, które
zatykają
światło
tego narządu.
W łagodnej postaci
zmiany mogą ograniczyć się
do obrzęku i przekrwienia spojówek oraz stanu
zapalnego zatok podoczodołowych.
Zmiany mikroskopowe
to powiększenie komórek
nabłonka oddechowego, zanik rzęsek,
pojawienie się syncytii.

Diagnostyka
Diagnostyka
Rozpoznanie na podstawie objawów klinicznych i zmian
anatomopatologicznych jest możliwe w przypadkach
przebiegających z krwotocznym zapaleniem błony
śluzowej górnej części tchawicy.
Należy je jednak potwierdzić badaniem laboratoryjnym, do
którego pobiera się materiał od świeżo padłych lub
żywych ptaków(po eutanazji) w początkowej fazie choroby.
Rozcierem zakaża się zarodki kurze na błonę
kosmówkowo-omoczniową. Po 5-7 dniach inkubacji
obserwuje się zgrubienie błon płodowych oraz wystąpienie
na nich ognisk martwicowych.
W hodowli komórek wątroby lub nerki zarodka kurzego
wirus daje wyraźny efekt cytopatyczny.
Badanie histologiczne pozwala na szybkie rozpoznanie
zakażenia wirusem ILT ze względu na obecność ciałek
wtrętowych Seifrieda.


Diagnostyka
Diagnostyka
W badaniach serologicznych do wykrywania przeciwciał
dla wirusa ILT stosuje się immunodyfuzję w żelu
agarowym, seroneutralizację i test ELISA.
Odczyn seroneutralizacji jest najbardziej przydatny.
Mieszaniny surowicy i wirusa trzyma się co najmniej
godzinę w temperaturze pokojowej, a następnie zakaża
nimi zarodki lub hodowle komórek nerki 3-
5tygodniowych kurcząt. U ptaków o pełnej wrażliwości,
które nie zetknęły się z zarazkiem, indeks neutralizacji
ich surowicy nie przekracza 19. Indeks 20 i więcej
uważa się za dowód zetknięcia się ptaka z zarazkiem i
przebycie zakażenia.
W rozpoznaniu choroby biorą też udział szybkie testy,
takie jak technika hybrydyzacji DNA (umożliwiająca
rozpoznanie szczepów zjadliwych i niezjadliwych za
pomocą sond nukleinowych) metoda PCR, mikroskopia
elektronowa, bezpośredni odczyn immunofluorescencji.

Choroba Mareka (Marek’s
Choroba Mareka (Marek’s
disease- MD)
disease- MD)
Choroba Mareka jest wirusową chorobą
drobiu
grzebiącego
atakującą kury, przepiórki japońskie
i indyki.
Charakteryzuje się klinicznie występowaniem u
ptaków
porażeń nóg, skrzydeł lub ogona
, a
sekcyjnie obecnością
zmian nowotworowych
w
narządach wewnętrznych.
Choroba ta znana jest od dawna, po raz pierwszy
została opisana w 1907roku przez węgierskiego
uczonego Josepha Mareka pod nazwą
polyneuritis, jako porażenna choroba nóg i
skrzydeł u ptaków.

Etiologia
Etiologia
Chorobę Mareka wywołuje wirus z rodziny
Herpesviridae.
Wirus choroby Mareka(MDV) jest związanym z
komórką herpeswirusem o właściwościach
limfotropowych. W 1992 roku uległ on
reklasyfikacji i został zaliczony do podrodziny
Alphaherpesvirinae, rodziny Herpesviridae.
Heksagonalny kapsyd
ma średnicę 85-100nm, a
opłaszczone cząstki występujące w komórkach
nabłonkowych brodawek skóry mają średnicę
150-160nm.
Genom MDV stanowi linearna,
dwuniciowa
cząsteczka DNA
.

Serotypy i patotypy
Serotypy i patotypy
Wyróżnia się
3 serotypy
wirusa MD, są one
odróżnialne serologicznie, pomimo że mają także
wspólne antygeny.
Wirulencja i onkogenność
są związane tylko z
serotypem 1
MDV, do którego należą wszystkie
szczepy zjadliwe.
Do serotypu 2 należą szczepy naturalnie apatogenne
występujące u kur, natomiast serotyp 3 stanowią
apatogenne herpeswirusy izolowane od indyków.
Obecnie w serotypie 1 wyróżnia się
cztery patotypy
oznaczone jako
umiarkowane
(mild- mMDV),
wirulentne
(virulent- vMDV),
bardzo wirulentne
(vvMDV) oraz
bardzo
wirulentne plus
(vv+MDV)-
które obecnie są dominujące.

Patogeneza
Patogeneza
Zakażenie wirusem MDV przenosi się głównie poziomo.
Źródłem
zakażenia są chore kurczęta
, będące siewcami
wirusa. Ich skreatynizowane,
martwe komórki nabłonkowe
zawierające w pełni
zjadliwy wirus
, dostający się wraz ze
złuszczającym się nabłonkiem i drobinkami kurzu
do
układu oddechowego kurcząt
.
Następnie drogą krwi dostaje się
do grasicy i bursy
Fabrycjusza
, zaburza ich funkcje i rozpoczyna się
immunosupresja.
Potem namnaża się w innych narządach limfoidalnych
np.śledzionie, dostaje się
do krwiobiegu
i tą drogą do
innych narządów wewnętrznych, gdzie tworzą się różnego
rodzaju zmiany.
We krwi krążą
zakażone limfocyty
zawierające kompletne
cząstki wirusa,
powstaje trwała wiremia
, która
jest cechą
charakterystyczną
zakażenia wirusem choroby Mareka.

Patogeneza
Patogeneza
Siewstwo wirusa
rozpoczyna się już po 5 dniach od
zakażenia i trwa całe życie.
Ten stale powtarzający się cykl dotyczy zarówno ptaków
szczepionych, jak i nie szczepionych. Ptaki szczepione
mogą być nosicielami wirusa zjadliwego i jego siewcami
do środowiska.
W ściółce, kurzu i pyle
wirus pozostaje zakaźny
przez
wiele miesięcy w temperaturze 20-25°C i przez kilka lat
w temperaturze 4°C.
W przenoszeniu wirusa bierną rolę odgrywa
pleśniakowiec lśniący, który w
sposób mechaniczny
może transportować wirusa do sąsiadujących obiektów.
Najbardziej wrażliwe na zakażenie są
ptaki młode
do
6tygodnia życia, lecz możliwe jest zakażenie ptaków
między 12 a 24 tygodniem życia, a nawet starszych.

Objawy kliniczne
Objawy kliniczne
W przebiegu choroby Mareka mogą występować różne objawy.
Wyróżniamy
poniższe postacie kliniczne
, jednakże często
jedna forma może przechodzić w drugą i w większości
obiektów mamy do czynienia z występowaniem kilku postaci w
jednym obiekcie.
Postać nadostra:
charakteryzuje się gwałtownym przebiegiem,
najczęściej
bez objawów klinicznych
; atakuje ptaki do
4tygodnia życia; śmiertelność jest wysoka, do 80% ptaków w
stadzie.
Postać ostra:
okres inkubacji wynosi 2-3 tygodnie, przebiega z
wysoką śmiertelnością, nawet do 70% ptaków w stadzie; część
ptaków mimo procesu chorobowego może nie wykazywać
objawów klinicznych; obserwuje się
porażenia dotyczące
w
szczególności
nóg, skrzydeł i szyi
; występują trudności w
poruszaniu się; brak apetytu i wychudzenie; w okresie
porażennym ptak
leży w pozycji szpagatu
; widoczna jest
bladość grzebienia i dzwonków
.

Objawy kliniczne
Objawy kliniczne
Postać klasyczna:
okres inkubacji jest znacznie
dłuższy, a śmiertelność wynosi około 10-15%,
padnięcia trwają od kilku tygodni do kilku miesięcy;
występuje zwykle u kur znajdujących się na początku
sezonu nieśności; choroba zaczyna się od
objawów
porażennych
, występuje
paraliż nóg i skrzydeł
, ptaki
przyjmują charakterystyczną
postawę szpagatu
;
czasami obserwuje się kręcz szyi, a także objawy ze
strony układu oddechowego;
wychudzenie i biegunka
pojawiają się przy uszkodzeniu nerwów przewodu
pokarmowego; postaci tej mogą towarzyszyć zmiany
w gałce ocznej-
zmiany kształtu źrenicy, plamistość lub
szarość tęczówki
, utrata zdolności akomodacji oka; u
starszych ptaków pojawia się płyn w jamie brzusznej

Objawy kliniczne
Objawy kliniczne
Paraliż przejściowy:
może wystąpić u ptaków w wieku
do 5 tygodni, zaczyna się 8-12 dni po zakażeniu i
dotyczy 50% stada; charakteryzuje się
nagłym
porażeniem szczególnie nóg i szyi
; wiele
zaatakowanych ptaków później wykazuje postać
kliniczną choroby Mareka
Przyjęty jest też podział na:
Formę nerwową
występującą u kurcząt między 12 a 20
tygodniem życia, charakteryzującą się zaatakowaniem
nerwów obwodowych, a klinicznie występowaniem
porażeń; kurczęta padają w ciągu 3 dni do 3 tygodni
od wystąpienia pierwszych objawów klinicznych;
choroba trwa około 3 miesięcy.
Formę narządową
– nowotworową, występującą u kur
na początku nieśności.
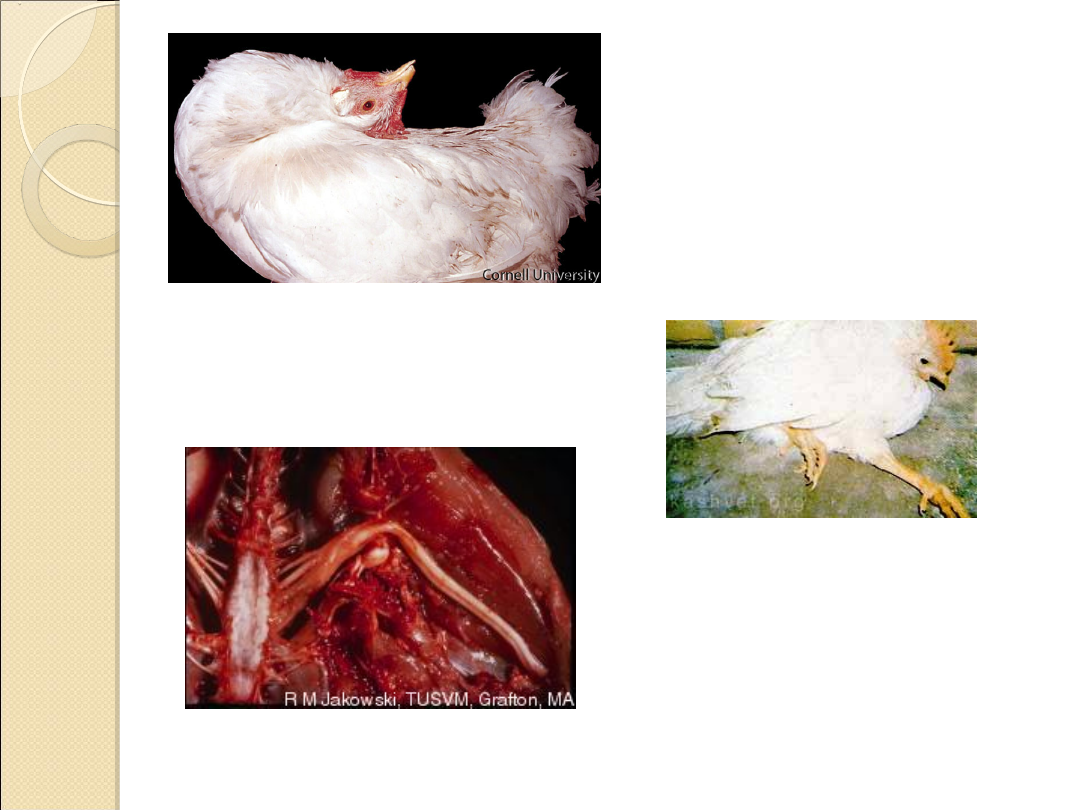

Zmiany
Zmiany
anatomopatologiczne
anatomopatologiczne
Mają one
charakter nowotworowy
. Typowe są
chłoniaki
o barwie szarej lub białokremowej w tkance
narządu tuż pod jego powierzchnią.
Najczęściej
guzy nowotworowe
występują w
śledzionie, wątrobie, jajniku, nerkach, płucach i
sercu. Obserwuje się znaczne powiększenie tych
narządów, zgrubienie ścian żołądka gruczołowego, na
którego błonie śluzowej mogą występować liczne,
głębokie owrzodzenia otoczone ciemnoczerwoną
obwódką.
Przy objawach porażennych stwierdza się
zmiany w
nerwach kulszowych i splotu barkowego
,
polegających na zmianie barwy an żółtawą,
obserwowany jest ich obrzęk, zanik prążkowania oraz
guzy nowotworowe wzdłuż włókien.

Diagnostyka
Diagnostyka
Izolacja i identyfikacja wirusa MD –
do badania
przesyła się chore zwierzęta wykazujące objawy
kliniczne, materiał pobrany od ptaków padłych nie
nadaje się do badań wirusologicznych, ze względu
na ścisłe związanie wirusa z komórką, który ginie
wraz z jej śmiercią. Wirus jest izolowany z
limfocytów krwi lub komórek guzów
nowotworowych, śledziony, wątroby i innych
narządów, a także pióra, skóra ze szlaku barkowego,
ud i skrzydeł. Leukocyty lub uzyskana zawiesina
komórek służą do zakażenia hodowli komórek nerki
kurzej. Wirus MD można izolować bezpośrednio
zakładając hodowlę komórek nerki chorej kury,
wówczas wirus powoduje wyraźny efekt
cytopatyczny.

Diagnostyka
Diagnostyka
Efekt cytopatyczny charakteryzuje się początkowo
pojawieniem się dużych, okrągłych komórek, silnie
załamujących światło. Po dalszej inkubacji powstają
różnej wielkości łysinki
w zależności od szczepu wirusa
MD, w ten sposób określa się miano wirusa wyrażając je
jako TCID50 lub PFU (Plaque Forming Units).
Na podstawie okresu powstawania łysinek, ich wielkości
i kształtu możliwe jest
odróżnienie serotypów
od siebie.
Łysinki tworzone przez serotyp 3 pojawiają się wcześniej
i są większe niż łysinki tworzone przez serotyp 1.
Serotyp 2 tworzy łysinki bardzo drobne, mniejsze od
tworzonych prze serotyp 3, a także czas ich
powstawania jest znacznie dłuższy. Łysinki można także
identyfikować używając swoistych przeciwciał
znakowanych fluoresceiną lub przeciwciał
monoklonalnych.

Diagnostyka
Diagnostyka
Wirus choroby Mareka można izolować używając
zarodków
kurzych zakażonych dożółtkowo
. Jako
inokulum służą rozciery narządów
wewnętrznych. Po 9 dniach inkubacji widoczne
są na błonie kosmówkowo-omoczniowej guzki
wielkości główki szpilki. Za wynik dodatni
uznaje się występowanie zmian na błonach u co
najmniej 30% zarodków. Do potwierdzenia tych
zmian służą odczyny serologiczne, takie jak
immunofluorescencja.

Diagnostyka
Diagnostyka
Wykrywanie markerów wirusowych w tkankach-
jest
to wykrywanie wirusa bez jego izolacji w hodowlach
komórkowych, mogą służyć też do identyfikacji izolatów
wirusa MD w hodowlach komórkowych.
Wykrywanie antygenu wirusowego- wykorzystuje się
przeciwciała monoklonalne przygotowane przeciw
epitopom wspólnym dla trzech serotypów oraz
typowospecyficznym dla każdego serotypu. Antygeny
wirusowe są wykrywane w końcówkach piór, w
cytolitycznie zakażonych tkankach limfoidalnych lub
zakażonych hodowlach komórkowych. Najczęściej
stosowane są testy immunofluoroscencyjne,
immunoperoksydazowe, test precypitacji (AGID) oraz
ELISA.
Można użyć także łańcuchowej reakcji polimerazowej
(PCR), sondy DNA i mikroskopu elektronowego.

Diagnostyka
Diagnostyka
Wykrywanie przeciwciał
Test immunodyfuzji w żelu agarowym (AGID, AGP) –służy
do wykrywania przeciwciał w surowicy ptaka. Do
odpowiednich baseników w agarze nanosi się antygen
MDV, surowicę standardową dodatnią i ujemną oraz
badane surowice. Wynik dodatni to pojawienie się po 24-
48 godzinach linii precypitacyjnych między antygenem a
badaną surowicą.
Test immunodyfuzji radialnej (RID) – służy do wykrywania
antygenów wirusa MDV w końcówkach piór. Pobiera się
pióra z wewnętrznej powierzchni skrzydła, ud lub ze
szlaku barkowego. Końcówki piór wbija się w agar z
dodatkiem surowicy standardowej dodatniej anty-MDV.
Pojawienie się, po 24-48 godzinach pierścieni
precypitacyjnych wokół piór świadczy o wyniku dodatnim,
czyli obecności wirusa MD.

Diagnostyka
Diagnostyka
Odczyn immunofluorescencji (IF) – stosuje się go do
wykrywania antygenów wirusowych w tkankach
zakażonych kurcząt lub do identyfikacji przeciwciał w
surowicach ptaków. Stosowany jest odczyn pośredni i
bezpośredni. W teście bezpośrednim globuliny
pochodzące z surowicy kurcząt zakażonych MDV są
łączone z izotiocyjanianem fluoresceiny, natomiast w
teście pośrednim koniugat stanowi antykurza
gammaglobulina.
Test seroneutralizacji – zasadą tego testu jest
zobojętnienie wirusa przez swoiste przeciwciała, dzięki
czemu nie posiada on właściwości zakaźnych. Test ten
wykonywany jest dwoma sposobami: metodą alfa, przy
stałej dawce badnej surowicy i różnych rozcieńczeniach
wirusa oraz metodą beta, czyli przy stałej dawce wirusa i
różnych rozcieńczeniach surowicy.

Diagnostyka
Diagnostyka
Test immunoenzymatyczny ELISA – w teście tym
wykorzystuje się zdolność wiązania antygenu
wirusowego i swoistego przeciwciała z
koniugatem znakowanym peroksydazą
chrzanową. Zwykle jest to immunoglobulina
królicza lub kozia sporządzona przeciwko
gammaglobulinie kurzej. Swoistość reakcji, czyli
związanie kompleksu antygen-przeciwciało z
koniugatem objawia się reakcja barwną
występującą po dodani substratu. Jej natężenie
odczytuje się w spektrofotometrze. Technikę
ELISA stosuje się do wykrywania przeciwciał jak
i antygenów wirusa MD.

Szczepienia
Szczepienia
Obecnie stosowane są trzy typy szczepionek:
szczepionki heterologiczne oparte na herpeswirusie
indyczym, szczepionki oparte na szczepach
atentuowanych należących do serotypu 1 oraz
szczepionki oparte na naturalnie apatogennych
szczepach wirusa, należących do serotypu 2.
Wirus szczepionkowy namnażając się u kurcząt
prowadzi do stałej infekcji. Szczepienie zmniejsza
namnażanie szczepów terenowych i ich
rozprzestrzenianiu się u kurcząt, zapobiega
powstawaniu zmian w tkankach limfatycznych i obniża
poziom wiremii terenowego szczepu MDV.
Szczepienie nie hamuje zakażenia wirusem zjadliwym,
ani jego namnażania w organizmie, hamuje jedynie
powstawanie zmian nowotworowych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
PTASZORY, weterynaria, 5 rok semestr 1, choroby ptaków
cechy ptakow karta pracy
Choroby ptaków ze zmianami w poszczególnych układach 2, weterynaria, choroby ptaków, choroby ptaków,
Dokument 12.01.2015, weterynaria, 5 rok semestr 1, choroby ptaków
Odloty ptaków do ciepłych krajów, Przyroda 3-latki
choroby zakazne ptakow, łowiectwo
Plan - Co słychać u ptaków wiosną , plany
ekologia sprawozdanie z rozmieszczenia ptaków w zakolu Wisły przy wawelu Gołąb miejski
UKŁAD ODDECHOWY PTAKÓW
Zmysły ptaków związanie z pobieraniem pokarmu
powrót ptaków Y7LJWEOPVL7UBDDKRGNUWZRFLPHBRFKJWSOZQVI
ekologia sprawozdanie z rozmieszczenia ptaków w zakolu Wisły przy wawelu Wykres słupkowy i kołow
20 najpopularniejszych ptaków lęgowych w Polsce
CHOROBY PTAKOW-legi, weterynaria
rozmanazanie golebi zima CZ3, wet, CHOROBY PTAKÓW, Gołębie
znieczulenie ptaków i gadów - mat. dla studentów III roku, CHIRURGIA I ANESTEZJOLOGIA
więcej podobnych podstron