
SciLab. wpływ
temperatury i ciśnienia na
prężność parcjalną chloru
w wyniku rekacji Deacona.
2HCl + 0,5O
2
=H
2
O + Cl
2

ciśnienie parcjalne
Ciśnienie cząstkowe (ciśnienie parcjalne) - ciśnienie,
jakie wywierałby dany składnik mieszaniny gazów,
gdyby w tej samej temperaturze sam zajmował
objętość całej mieszaniny.
Ciśnienia cząstkowe można wyliczyć wykorzystując
równanie
gdzie:
pi - ciśnienie cząstkowe składnika "i"
ni - liczność (liczba moli) składnika "i"
p
i
=
n
i
/
(
s
+
sV
*
a
)
*
P

• Ciśnienie całego układu :
gdzie:
p - ciśnienie mieszaniny,
n - liczba moli,
k - łączna liczność składników
mieszaniny

Co obliczamy ?
• Szukane jest ciśnienie parcjalne
chloru w układzie reakcyjnym w
skład którego wchodzą cząsteczki
HCl O
2
Cl
2
H
2
O. Dane to liczba moli
poszczególnych składników. Ciśnienie
parcjalne liczymy dla różnych
temperatur reakcji. Zakładamy że
wszystkie te składniki występują w
postaci gazowej

W pierwszej kolejności obliczamy stałą
równowagi termodynamicznej i tworzymy
wykres
dGHCl=[-95.92 -97.59 -99.09 -100.30 -102.38] ;
dGH2O=[-224.073 -214.18 -203.67 -192.760
-181.506];
dGreak=dGHCl*V(1,1)+dGH2O*V(1,4);
R=8.314*10^(-3);
lnKp=-dGreak./(R*T);
Kp=exp(lnKp)
f=1../T
xset('window',0)
plot(f,lnKp,'-o')
coefs=regress(f,lnKp)
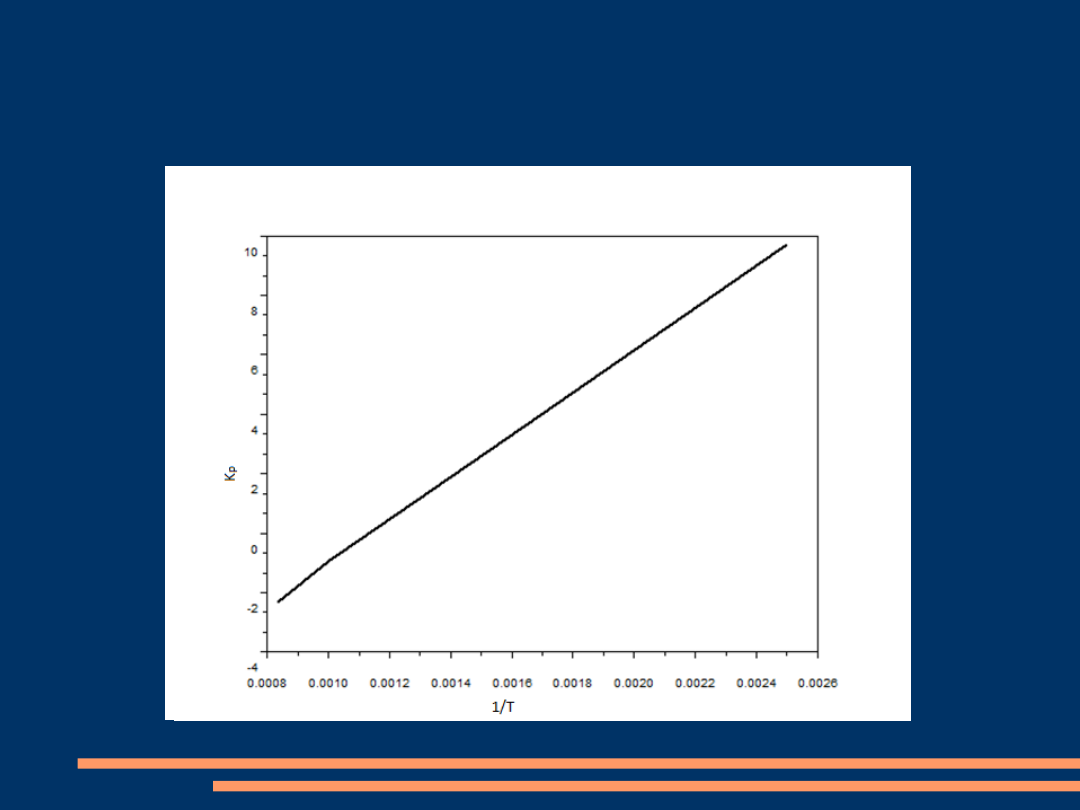
Wykres

Dalej liczymy ciśnienie parcjalne w stanie równowagi, oraz używamy pętli „for”
w celu obliczenia stałych równowagi wyznaczonych dla konkretnych temperatur
w celu obliczenia p chloru w tej trmp. (skok temperatury co 100K)
s=sum(n0);
sV=sum(V);
P=1
function z=grze(a)
ni=n0+V*a
p=ni/(s+sV*a)*
z=Kp1-p(1,3)*p(1,4)*(p(1,1)^V(1,1))*(p(1,2)^V(1,2))
endfunction
a0=0.8
T1=400
for i=1:6
Ti(1,i)=T1+100*i
f1=1/Ti(1,i);
lnKp1=coefs(1,1)+coefs(2,1)*f1;
Kp1=exp(lnKp1)
[a,z,info(1,i)]=fsolve(a0,grze);
for j=1:4
nir(1,j)=n0(1,j)+V(1,j)*a;
if nir(1,j)<0 then write(%io(2),"zly punkt startu")
abort
end
end

Tworzymy wykres zależności prężności parcjalnej chloru od temperatur
b info
xset('window',1)
plot(Ti,pCl2,'-o')
P1=[0.5 1 10 25 50]
Kp1=Kpr(1,1)
function z1=grze1(a)
ni=n0+V*a
p=P1(1,k)*ni/(sum(n0)+sum(V)*a)
z1=Kp1-(p(1,3)*p(1,4))*(p(1,1)^V(1,1))*(p(1,2)^V(1,2))
endfunction
a0=0.8
for k=1:5
[a,z1,info(1,k)]=fsolve(a0,grze1);
infp(1,k)=info(1,k);
for j=1:4
nir(1,j)=n0(1,j)+V(1,j)*a
if nir(1,j)<0 then write(%io(2),"zly punkt startu")
break
end
end

Liczmy prężność parcjalną dla Cl
2
b(1,i)=a;
a0=a
pCl2(1,i)=n0(1,3)+V(1,3)*a;
pr=nir/sum(nir)*P;
Kpr(1,i)=pr(1,3)*pr(1,4)*pr(1,2)^V(1,2)*pr(1,1)^V(1,1)
end
Wyniki:
Prężność parcjalna dla chloru w różnych temperaturach
wynosi :
8592818 Pa
8766365 Pa
9207877 Pa
9337179 Pa
9421098 Pa
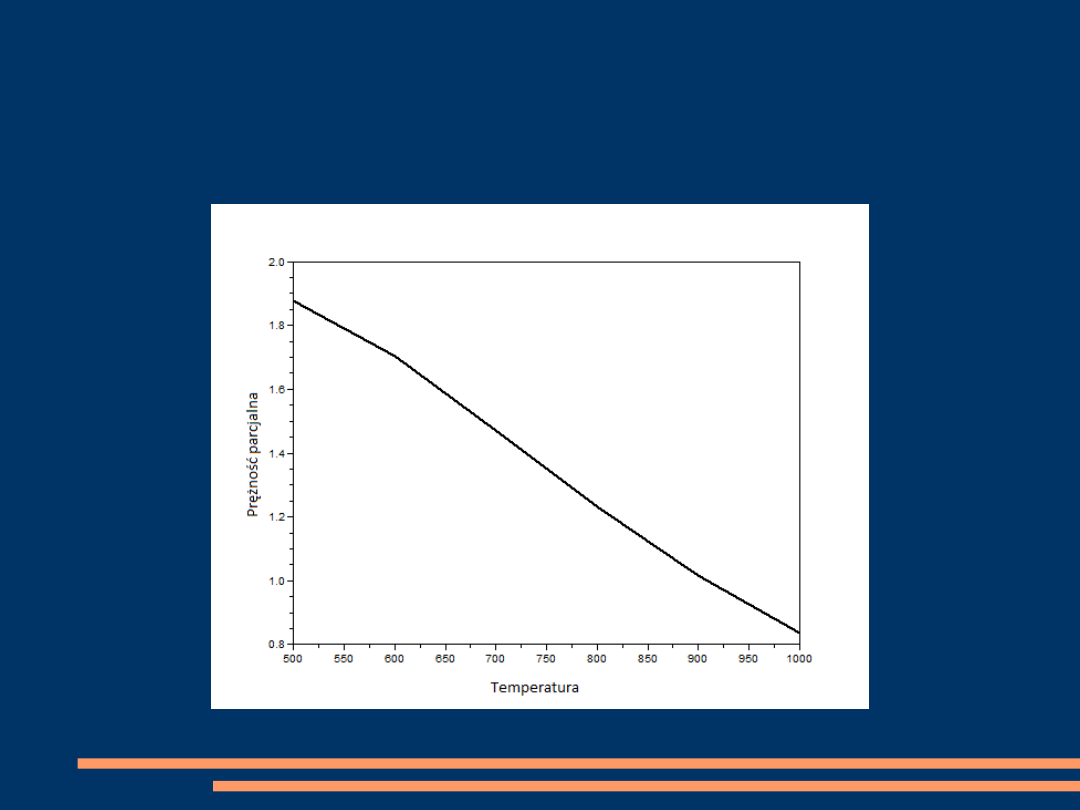
Wykres
Jakub
Mielcarek
Gr. 13T1
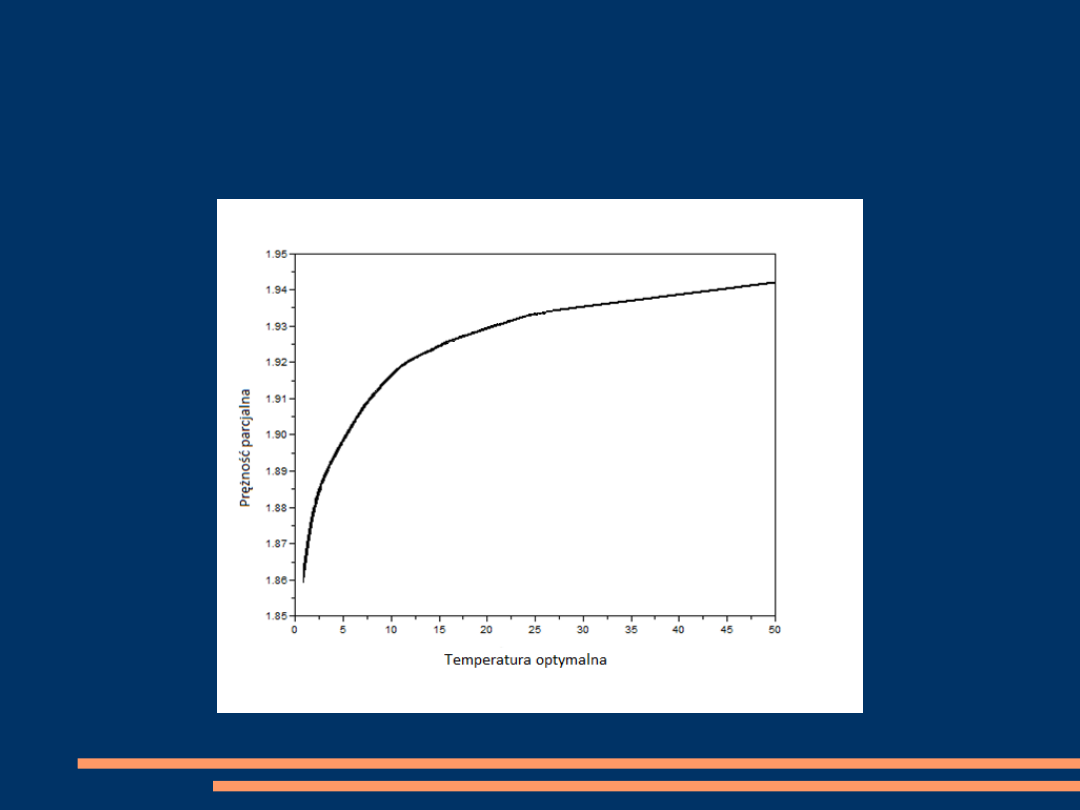
Wykres temperatury od
prężności parcjalnej Cl
2
.
Document Outline
Wyszukiwarka
Podobne podstrony:
Tablica cisnien parcjalnych tlenu
Praktyczna interpretacja pomiarów cisnienia
cisnienie
OCENA ZAGROŻEŃ PRZY EKSPLOATACJI URZĄDZEŃ POD CIŚNIENIEM
POMIAR NATĘŻENIA PRZEPŁYWU W PRZEWODZIE POD CIŚNIENIEM I KORYCIE OTWARTYM
Podstawowe wiadomosci o programie SciLab wykresy
czujnik cisnienia spalin
Dyrektywa 1987 404 EWG Zbiorniki ciśnieniowe
linia cisnien, STUDIA, Polibuda - semestr II, Hydraulika i hydrologia, laborki z hydro, laborki
10. Regulacja ciśnienia tętniczego krwi, licencjat(1)
Piezorezystancyjny czujnik ciśnienia w kolektorze dolotowym (2)
Obliczenie wymaganego ciśnienia instalacji
6 ?DANIE PROFILU CISNIENIA I NATEZENIA PRZEPLYWU GAZOW W RURUCIEGU(1)
więcej podobnych podstron