
1
Gestational Trophoblastic
Nepolasma (GTN)
Wojmir Ziętkowiak
2004-10-11

2
• GTN – accounts for less than 1% of female
gynecologic malignancies:
• the highest incidence is in Taiwan 1:135
pregnancies, in USA 1:2000
• approximately 80% hydatidiform moles will follow
benign course,
• 20% will develop malignant trophoblastic disease
with local metastatic spread,
• it is more common in women below 20 and above 39
years,
• etiology ist’t completly explaind. It may be: deficit
of proteins or virus infections, or other factors

3
Classification of GTD
Morphological diagnosis
1. Hydatidiform mole:
a.non-invasive complete
b. non invasive partial
c. invasive
2. Choriocarcinoma
3. Morbus
trophoblasticus
presistens (uncertain)
• Clinical diagnosis
• 1. Non-metastatic
• 2. Metastatic:
• a. local (pelvic)
• b. extra-pelvic

4
Pathology
• Hydatidiform moles are characterized by clusters of
villi with hydropic changes, hyperplasia of the
trophoblast and absence of fetal vassels.
• Invasive moles differ from this – presence of
invasion into the uterine myometrium.
• Choriocarcinoma consists of anaplastic
trophoblastic tissue with cytotrophoblast and
syncitotrophoblast elements and no identifiable villi.
• Molar pregnancies are usually assiociated with first
trimester bleeding, ectopic pregnancies or threated
abortions.

5
Signs and symptoms in
patients with hydatidiform
mole
• vaginal bleeding – 94%,
• abdominal pain – 45%,
• uterus larger than dates – 33%,
• toxemia: nausea, vomiting 23%,
preeclampsia 10%

6
Clinical signs appear most commonly
between the 10-14th week.
The diagnosis fo hydatidiform mole should be
strongly suspected if:
• the absence of fetal heart tones,
• finding of pregnancy toxemia before 24
week of pregnancy,
• HCG titers higher than ususal
Despite these clinical manifestation the diagnosis is often not
made until grape-like villi are expelled from the uterus.

7
Carefull monitoring of HCG level is an
essential part of both diagnosis and
managemet.
Pregnancy test or biologic assays have no
place in routine management.
HCG consists of an alfa and beta chain. The alfa
chain is cross – reactive to LH and historically
has been the source of some confusion in
diagnosis and managenent. For this reason a
radioimmunoassay of beta subunit of HCG is
ordinarily required.

8
The ovarian tumors in GTD are
theca lutein cysts resulting
from high level of circulating
HCG (20% of cases).
Theca lutein cysts should be left
unditurbed. These tumors
regress with decreasing HCG
titers.

9
Treatment
• In absence of labor uterine evacuation should be
carried out without delacy.
• Dilatation and suction curretage is the preferred
method of evacuation and can be accomplished in
uterus over 12 week size with minimal risk.
• The complete disappearance of beta HCG occurs
in about 90 days after evacuation of molar
pregnancy by suction.
• We recomend the program outlined for
monitoring patients after evacuation of a
hydatidiform mole.

10
1. Quantitative HCG determinations:
a. weekly until 3 consecutive normal values are obtained,
b. monthly 6x months,
c. every 2 months x 6 months
2. Oral contraception x 12 months,
3. Chest X-rays
4. Pelvic examianation every 2 weeks until HCG normal
level , than every 2 months x 6 months

11
Normal values of HCG in nonpregnant women is:
• HCG below 250 ngml
• beta HCG below 1ng/ml or below 5 IU per L
Woman after molar pregnancy should’t become pregnant
through 1 year. The chance of recurrent mole in a
subsequent pregnancy is about 2%.
Malignant trophoblastic disease as evidenced by plateau or
rising HCG titers, the presence of metastases or tissue
diagnosis of chorioca are indications for treatment -
chemiotherapy

12
Clinical staging classification
of GTN
Stage O
Molar pregnancy:
-a low risk
-a high risk
Stage I
Confined of uterine
corpus
Stage II
Metastases to pelvis
and vagina
Stage III
Metastases to lung
Stage IV
Distant metastases
(brain, liver)

13
Factors assiociated with poor prognosis (high risk
categories) include:
• initial beta HCG titers of more than 100.000/24h,
• persistence of disease longer than 4 months after
initial therapy,
• brain or liver metastases or
• failure with previous chemotherapy

14
Stages 0 to III – all have good prognosis and
respond to single agent chemiotherapy.
Stage IV – combination chemiotherapy.
Indications for chemiotherapy of GTN:
• rising HCG after evacuation,
• very high HCG after evacuation (25.000 IU/l after 4
weeks),
• HCG not falling 4 months after evacuation,
• pulmonary, vulvar or vaginal metastases,
• metastases at any other site,
• heavy vaginal bleeding or evidence of gastrointestinal or
intraperitoneal bleeding,
• histological evidence of chorioca,
• raised HCG with clinical picture strongly suggestive of
chorioca if patient is too ill for a suitable biopsy

15
Chorioca – occurs 1:100.000 of GTN
is prededed by hadatidiform mole in
50%,
in other cases divided between
abortions including ectopic
pregnancy and normal pregnancy.
It is highly malignant tumor and has a
propesity for hematogenous spread.

16
Metastases in GTN (chorioca)
• lung
60%
• brain
40%
• liver
16%
• kidney 13%
• myometium 10%
• spleen 9%
• bones 9%
• overies 6%
• lymph nodes 6%
• pancreas
2%

17
Intracranial metastases are often manifested by
focal neurological signs. The diagnosis should
be suspected when there is a history of previous
pregnancy and elevated HCG titers
Treatment:
Treatment:
1. Suction curettage and oxytocin (after curretage
in 80% beta HCG declines within 8-10 weeks to
normal value),
2. Chemiotherapy – is now commonly used to
manage in patients with GTN. Patients with
invasive mole or chorioca or evidence of
metastases require immediate chemiotherapy.
Patients with low risk GTN are initialy treated
by single agent chemiotherapy

18
Methotrexate – 0,4 mg/kg daily for 5 days
every 2 week i.m.
Actinomycin D – 10-12 micrograms daily for 5
days every 2 week i.v.
This therapy (both regiment) have significant
toxity, and more recently moderate MTX
with leucovorin (calcium folinate) – 6 mg
38h after each injection of MTX (i.m.)
Essentionally 100% of low risk GTN will be
cured by this approach.
No genetic defects in children born to women
after MTX therapy have been reported.

19
Management in malignant GTN
in patients with low risk
•
MTX with leucovorin or Actinomycin D x 5 days,
•
Repeat cycle overy 2 weeks if recover from toxity,
•
monitor induced toxity (WBC, granulocytes,
platelets, creatine),
•
monitor oncolytic effect (HCG),
•
give one course of chemiotherapy after firs normal
HCG value,
•
HCG titers monthly for 6 months, every 2 montsh
for 6 months,
•
oral contraception for 12 months
Patients with high-risk tumors are initially
treated with combination therapy (EMA-Co
and Bagshow programs)

20
Regimen for high risk
patients.
EMA-Co
Day 1 – etoposide 100mg/m over 30 min.
actinomycin 0,5 mg i.v.
MTX 300 mg/m
i.v. infusion over 12h
Day 2 – etoposide + actinomycin (like day1)
+ leucovorin 15 mg p.o.
Day 8 – vincristine 1,0 mg/m i.v.
cyclophosphamide 600 mg/m i.v.

21
Patients with brain or liver
metastases are generally treated
with local irridiation (2000rads),
Surgery is rarely required for drug
resistant disease or patients who
are good surgical candidate,
request sterilisation (after 45 years)
and have nonmetastatic GTN
Treatment

22
Materiał i metoda
•Grupę badaną stanowiło 90
kobiet w okresie
okołomenopauzalnym w wieku
od 41 do 55 lat.
•Badania przeprowadzono w
latach 1998-2001

23
Materiał i metoda
• Z każdą pacjentką trzykrotnie omówiono
dolegliwości związane z objawami zespołu
klimakterycznego (w czasie kwalifikacji
do badania, po 3 miesiącach, oraz po 6
miesiącach od rozpoczęcia leczenia).
• W czasie rozmowy wypełniono ankiety
zawierające pytania pozwalające na ocenę
objawów wypadowych według indeksu
Kuppermana

24
Materiał i metoda
• Po badaniu podmiotowym,
przedmiotowym oraz badaniach
dodatkowych (mammografia, usg)
pacjentki podzielono na grupy w
zależności od stosowanego preparatu
HTZ

25
Materiał i metoda
• Grupa I - 25 pacjetek, u których zastosowano 2 mg
mikronizowanego 17-estradiolu i 1 mg octanu
noretisteronu (Kliogest ®),
• Grupa II - 25 kobiet stosujących dwufazowy preparat
zawierający 14 tabletek z 2 mg estradiolu oraz 14 tabletek z
2 mg estradiolu oraz 10 mg dydrogesteronu (Femoston ®).
• Grupa III - 15 pacjentek, u których zastosowano cyklicznie
11 tabletek zawierających po 2 mg walerianianu estradiolu i
10 tabletek zawierających po 2 mg walerianianu estradiolu i
1 mg octanu cyproteronu (Climen ®).
• Grupa IV - 25 pacjentek leczonych sekwencyjnie
drażetkami zawierającymi po 1 mg walerianianu estradiolu i
2 mg estriolu oraz drażetekami zawierającymi 1 mg
walerianianu estradiolu, 2 mg estriolu i 0,25 mg
lewonorgestrelu (Cyclo-Menorette ®).

26
Skala Kuppermana
– uderzenia krwi do głowy – 4 pkt.
– pocenie się – 2 pkt.,
– zaburzenia snu – 2 pkt.,
– nerwowość – 2 pkt.,
– przygnębienie (depresje) – 1 pkt.,
– zawroty głowy – 1 pkt.,
– osłabienie ogólne – 1 pkt.,
– bóle stawów – 1 pkt.,
– bóle głowy – 1 pkt.,
– bicie lub kołatanie serca – 1pkt.,
– parestezje – 1 pkt.

27
Skala Kuppermana
• Stopień nasilenia objawów
klimakterycznych przedstawiono w skali:
lekkie objawy – 15 do 19 pkt., średnie
objawy – 20 do 35 ptk., ciężkie objawy –
ponad 35 pkt.
• Wskaźnik klimakteryczny obliczano
mnożąc punkty, (brak skargi odpowiadał
0 punktów, objawy lekkie – 1 punkt,
objawy średnio nasilone – 2 punkty,
objawy silnie zaznaczone – 3 punkty)

28
Ankieta oceny nasilenia objawów klimakterycznych wg. Kuppermana
Nazwisko i imię :
stosowany lek :
przed rozpoczęciem
leczenia
po trzech miesiącach
leczenia
po sześciu miesiącach
leczenia
Lp.
rodzaj objawu
brak
objawów
(x0)
objawy
lekko
nasilone
(x1)
objawy
średnio
nasilone
(x2)
objawy
silnie
nasilone
(x3)
1.
uderzenia krwi do głowy
(4 pkt.)
2. pocenie się (2 pkt.)
3. zaburzenia snu (2 pkt.)
4. nerwowość (2 pkt.)
5.
przygnębienie (depresja)
(1 pkt.)
6. zawroty głowy (1 pkt.)
7. osłabienie ogólne (1 pkt.)
8. bóle stawów (1 pkt.)
9. bóle głowy (1 pkt.)
10.
bicie lub kołatanie serca (1
pkt.)
11. parestezje (1 pkt.)

29
Skala Kuppermana
– Na podstawie uzyskanych wyników
porównano stopień nasilenia
objawów przed rozpoczęciem
leczenia oraz po 3 i 6 miesiącach. Do
obliczeń statystycznych użyto testu
Manna-Whitneya i Friedmana.

30
Materiał i metoda
• W pracy oceniano wartości profilu -
lipidowego (cholesterol całkowity,
cholesterol frakcji HDL i LDL oraz
triglicerydy)
• Dwa wskaźniki określające ryzyko
rozwoju miażdżycy, tj. stosunek
stężenia cholesterolu całkowitego do
frakcji HDL oraz stosunek stężenia
triglicerydów do frakcji HDL.

31
Materiał i metoda
• Oznaczenia wykonywano z surowicy
krwi, którą pobierano przed
rozpoczęciem obserwacji oraz po 3 i
6 miesiącach od momentu
rozpoczęcia podawania leku.
• Pobranie krwi odbywało się 12
godzin po ostatnim posiłku w
godzinach rannych (7-10 rano).

32
Materiał i metoda
– Oznaczenia cholesterolu całkowitego,
frakcji HDL oraz triglicerydów
wykonywano przy użyciu testu
enzymatycznego – kolorymetrii
Cormay
®.
– Stężenia LDL cholesterolu obliczono
ze wzoru: LDL = TC – HDL – (TG-A/5)
(mg/dl).

33
Nasilenie objawów zespołu klimakterycznego u 25
pacjentek leczonych Kliogestem® przed
rozpoczęciem terapii oraz w 3 i 6 miesiącu leczenia,
ocenianych w skali Kuppermana.
przed HTZ
liczba pacjentek (%)
po 3 m-ch terapii
liczba pacjentek (%)
po 6 m-ch terapii
liczba pacjentek (%)
ciężkie
16
64,0
0
0,0
0
0,0
średnie
9
36,0
0
0,0
0
0,0
lekkie
0
0,0
5
20,0
0
0,0
brak
0
0,0
20
80,0
25
100,0
p0,001
p0,001
Wyniki
test Manna-
Whitneya
Objawy

34
Nasilenie objawów zespołu klimakterycznego 25 u
pacjentek leczonych Femostonem® przed
rozpoczęciem terapii oraz w 3 i 6 miesiącu leczenia,
ocenianych w skali Kuppermana.
Objawy
przed HTZ
liczba pacjentek (%)
po 3 m-ch terapii
liczba pacjentek (%)
po 6 m-ch terapii
liczba pacjentek (%)
ciężkie
17
68,0%
0
0,0%
0
0,0%
średnie
8
32,0%
0
0,0%
0
0,0%
lekkie
0
0,0%
6
24,0%
0
0,0%
brak
0
0,0%
19
76,0%
25
100,0%
p0,001
p0,001
Wyniki
test Manna-
Whitneya

35
Nasilenie objawów zespołu klimakterycznego u 15
pacjentek leczonych Climenem® przed
rozpoczęciem terapii oraz w 3 i 6 miesiącu leczenia,
ocenianych w skali Kuppermana.
Objawy
przed HTZ
liczba pacjentek (%)
po 3 m-ch terapii
liczba pacjentek (%)
po 6 m-ch terapii
liczba pacjentek (%)
ciężkie
10
66,6%
0
0,0%
0
0,0%
średnie
5
33,3%
0
0,0%
0
0,0%
lekkie
0
0,0%
5
33,3%
0
0,0%
brak
0
0,0%
10
66,6%
15
100,0%
p0,001
p0,001
Wyniki
test Manna-
Whitneya

36
Nasilenie objawów zespołu klimakterycznego u 25
pacjentek leczonych Cyclo-Menorette® przed
rozpoczęciem terapii oraz w 3 i 6 miesiącu
leczenia, ocenianych w skali Kuppermana.
Objawy
przed HTZ
liczba pacjentek (%)
po 3 m-ch terapii
liczba pacjentek (%)
po 6 m-ch terapii
liczba pacjentek (%)
ciężkie
14
56,0
0
0,0
0
0,0
średnie
11
44,0
0
0,0
0
0,0
lekkie
0
0,0
7
28,0
1
4,0
brak
0
0,0
18
72,0
24
96,0
p0,001
p0,005
Wyniki
test Manna-
Whitneya

37
Analiza profilu
lipidowego krwi w
zależności od
stosowanego
preparatu
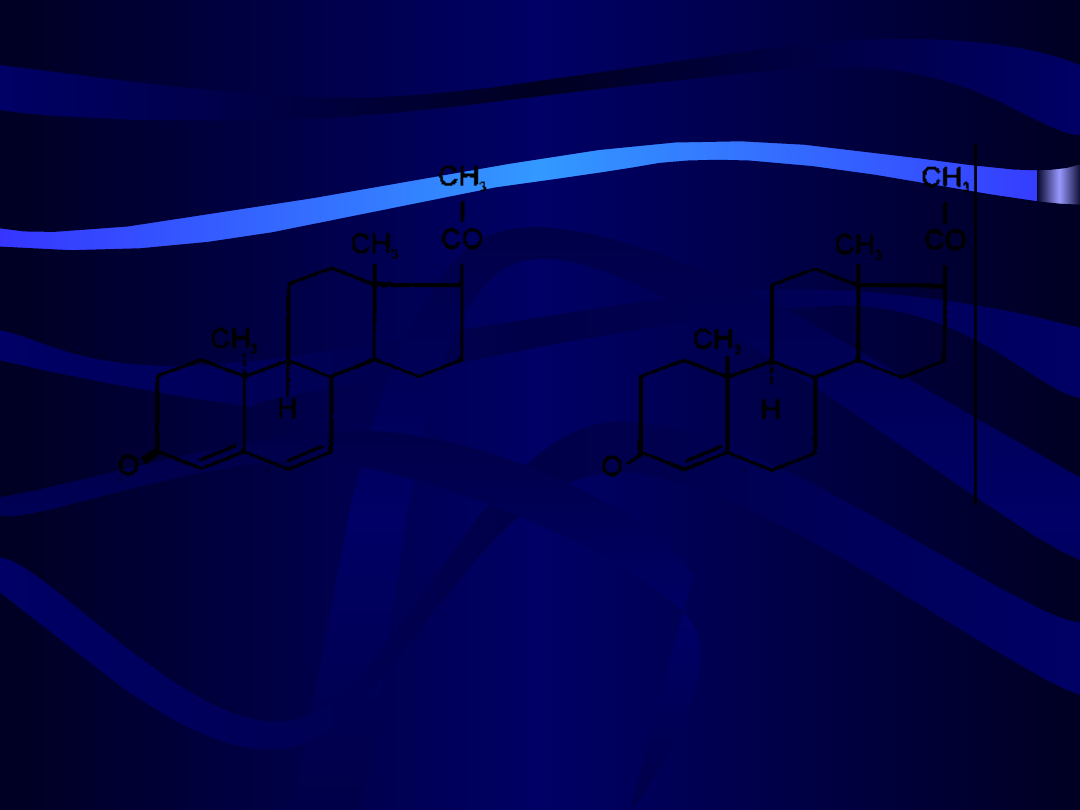
38
dydrogesteron
progesteron
39
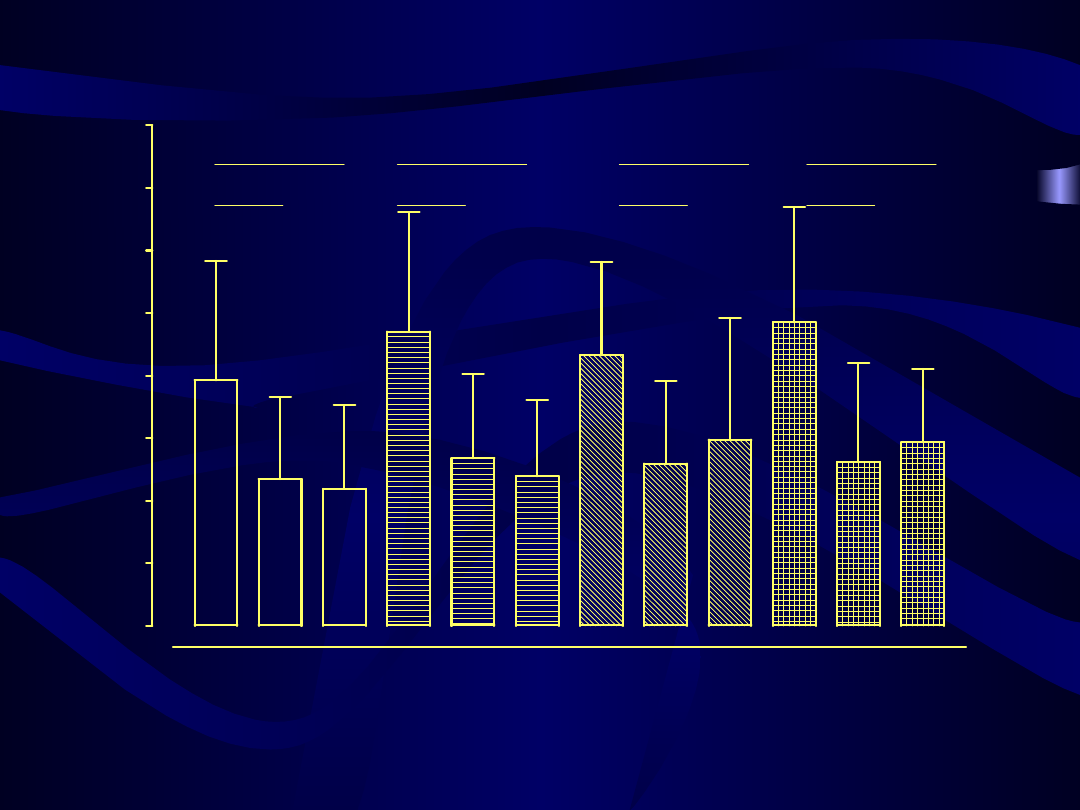
Stężenie cholesterolu całkowitego przed, w czasie 3 i 6 miesięcy hormonalnej terapii zastępczej
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
140
160
180
200
220
240
260
280
300
p = 0.0001
p < 0.0001
p < 0.0001
p < 0.0001
p = 0.0012
p = 0.0103
p < 0.0001
p = 0.0002
Kliogest
Femoston
Climen
Cyclo-Menorette
m
g/
dl
40
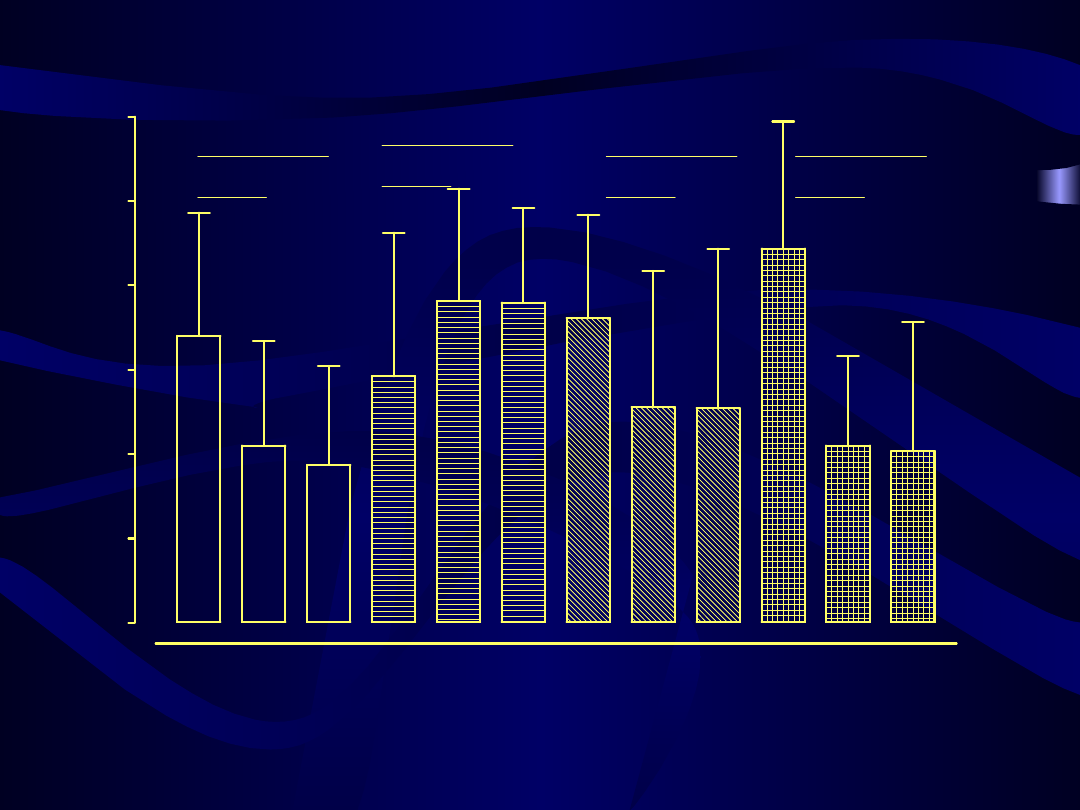
Stężenie cholesterolu frakcji HDL przed, w czasie 3 i 6 miesięcy hormonalnej terapii zastępczej
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
30
40
50
60
70
80
90
Kliogest
Femoston
Climen
Cyclo-Menorette
p = 0.0003
p = 0.0003
p = 0.0244
p = 0.0197
p = 0.0494
n.s.
p < 0.0001
p = 0.0001
m
g/
dl
41
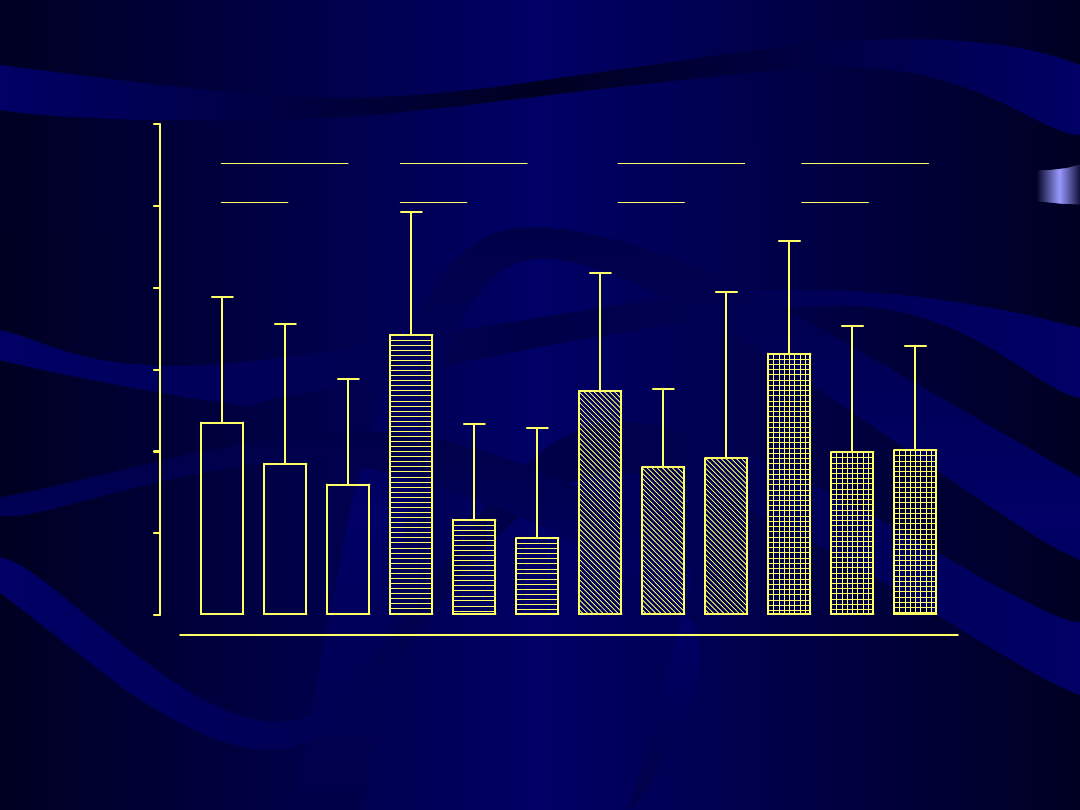
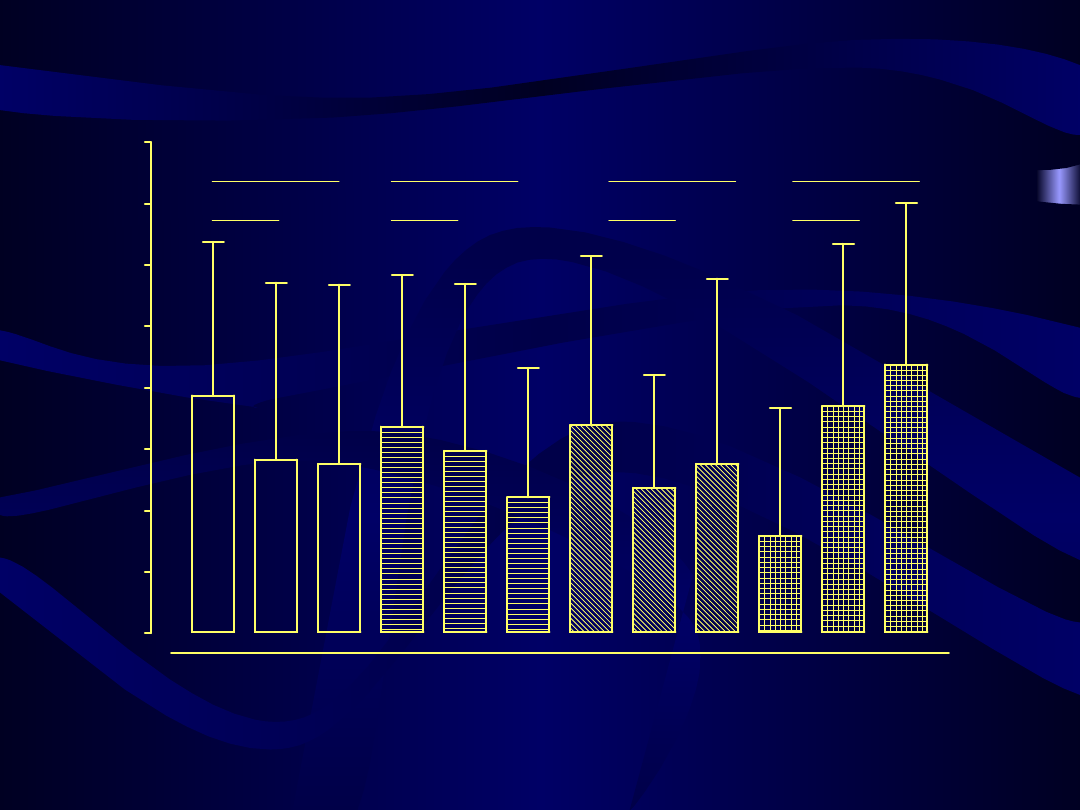
Stężenie cholesterolu frakcji LDL przed, w czasie 3 i 6 miesięcy hormonalnej terapii zastępczej
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
80
100
120
140
160
180
200
p = 0.0053
p = 0.0127
p < 0.0001
p < 0.0001
p = 0.0353
p = 0.0730
p = 0.0003
p = 0.0047
Kliogest
Femoston
Climen
Cyclo-Menorette
m
g/
dl
42
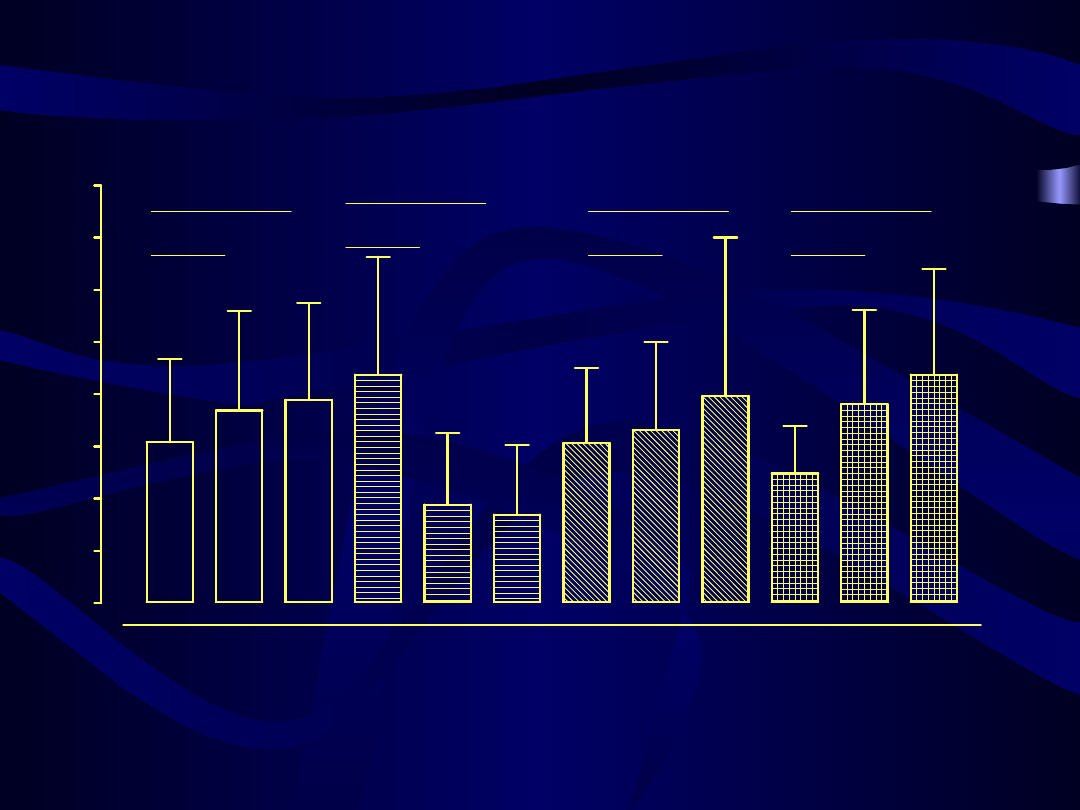
Stężenie triglicerydów przed, w czasie 3 i 6 miesięcy hormonalnej terapii zastępczej
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
60
80
100
120
140
160
180
200
220
p = 0.0033
p = 0.0343
p = 0.0445
p = 0.0184
n.s.
n.s.
p = 0.0080
p = 0.0009
Kliogest
Femoston
Climen
Cyclo-Menorette
m
g/
dl
43
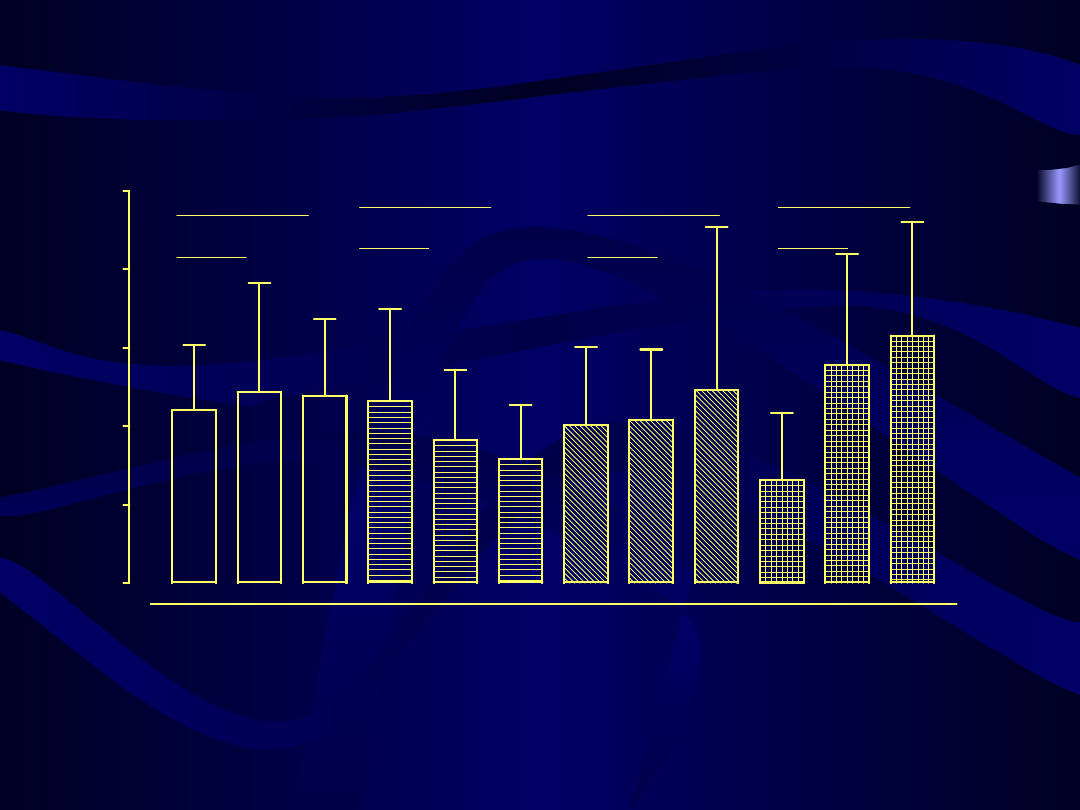
Wartość wskaźnika cholesterol całkowity/cholesterol frakcji HDL przed, w czasie 3 i 6
miesięcy hormonalnej terapii zastępczej
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
2.0
2.5
3.0
3.5
4.0
4.5
5.0
5.5
6.0
p = 0.0332
p = 0.0311
p < 0.0001
p < 0.0001
n.s.
n.s.
p = 0.0006
p = 0.0040
Kliogest
Femoston
Climen
Cyclo-Menorette
44
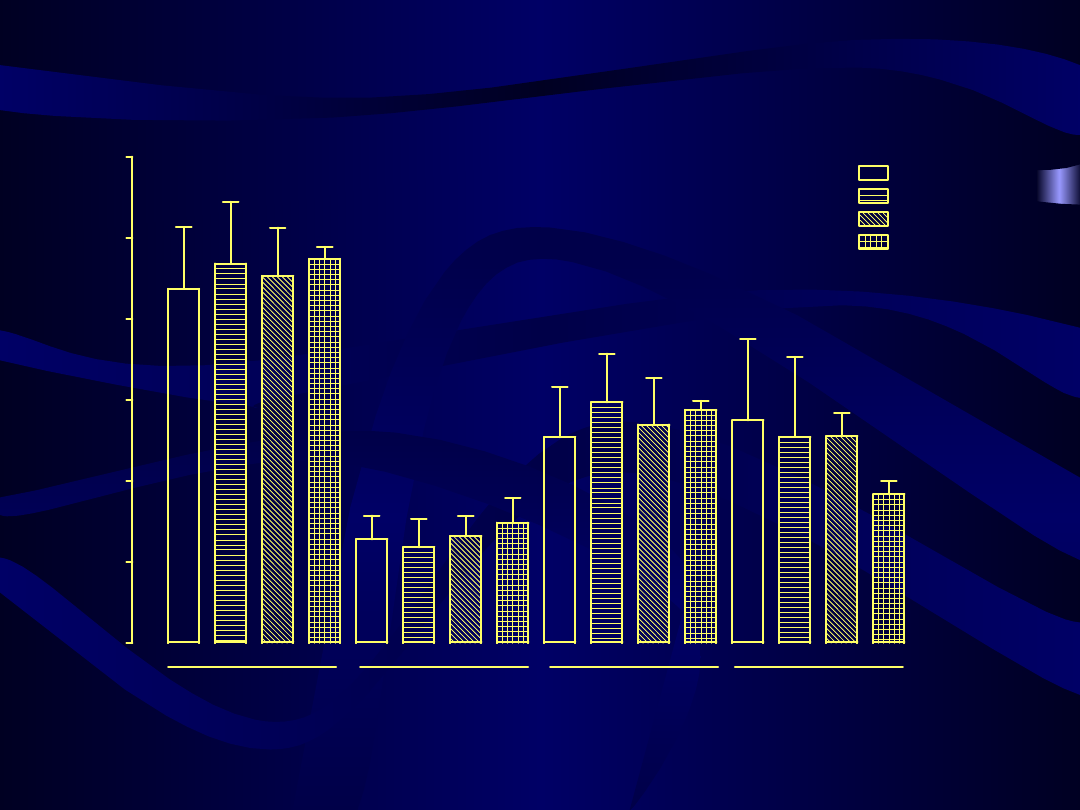
Wartość wskaźnika triglicerydy/cholesterol frakcji HDL przed, w czasie 3 i 6 miesięcy
hormonalnej terapii zastępczej
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
3 m
6 m
0
1
2
3
4
5
n.s.
n.s.
p = 0.0051
p = 0.0002
n.s.
n.s.
p = 0.0001
p < 0.0001
Kliogest
Femoston
Climen
Cyclo-Menorette
45
Porównanie wyjściowego profilu lipidowego między grupami leczonymi różnymi preparatami
HTZ
0
50
100
150
200
250
300
n.s.
p = 0.0003
p = 0.0003
n.s.
cholesterol całkowity
HDL
LDL
triglicerydy
Kliogest
Femoston
Climen
Cyclo-Menorette
m
g/
dl
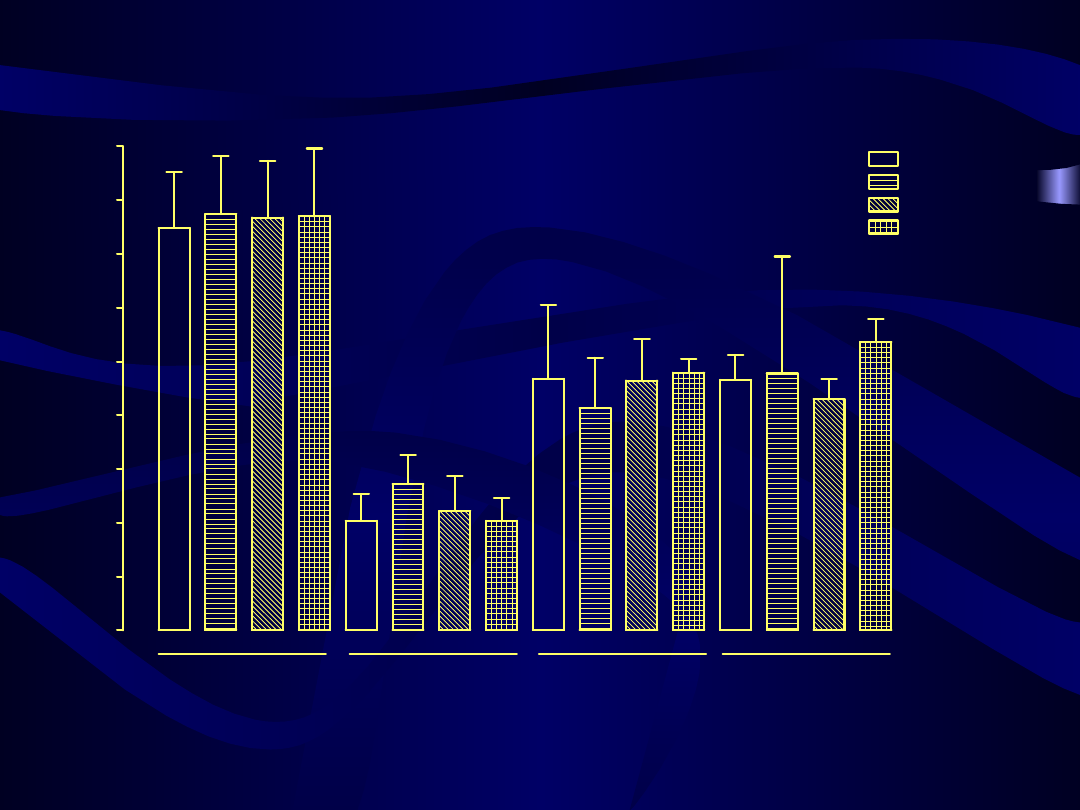
46
Porównanie profilu lipidowego między grupami leczonymi różnymi preparatami HTZ po 3
miesiącach terapii
0
25
50
75
100
125
150
175
200
225
n.s.
p < 0.001
n.s.
cholesterol całkowity
HDL
LDL
triglicerydy
n.s.
Kliogest
Femoston
Climen
Cyclo-Menorette
m
g/
dl
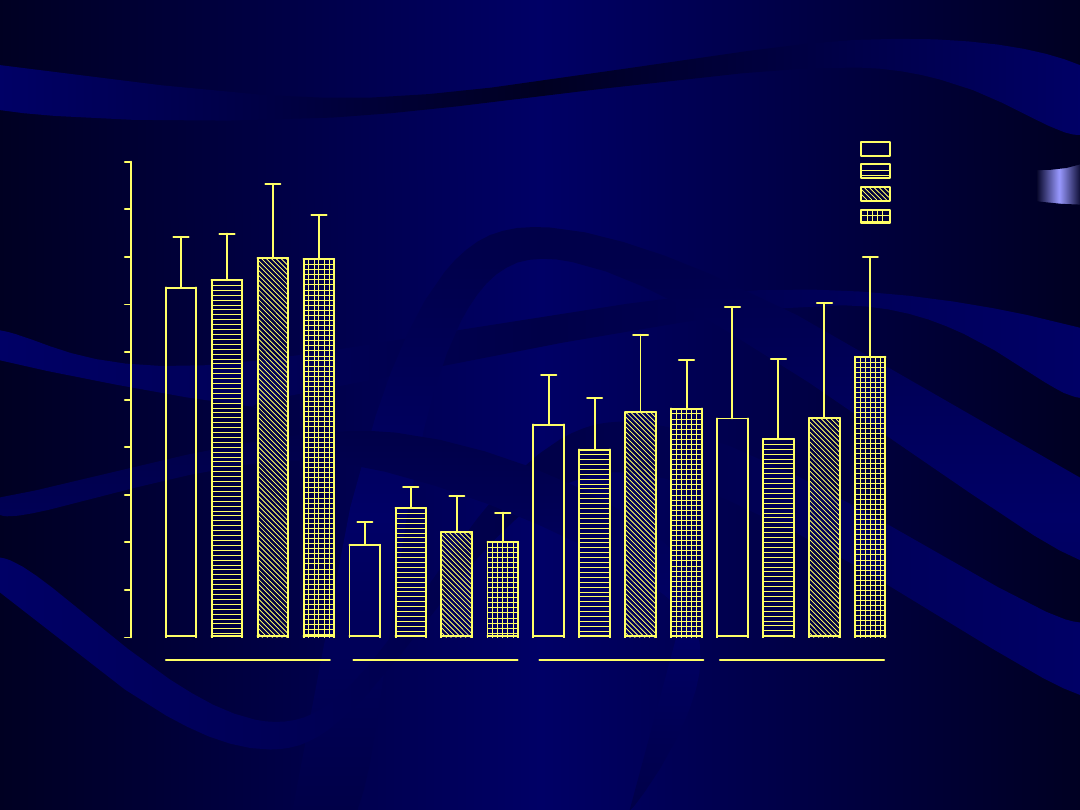
47
Porównanie profilu lipidowego między grupami leczonymi różnymi preparatami HTZ po 6
miesiącach terapii
0
25
50
75
100
125
150
175
200
225
250
p < 0.001
p = 0.012
cholesterol całkowity
HDL
LDL
triglicerydy
n.s.
Kliogest
p = 0.043
Femoston
Climen
Cyclo-Menorette
m
g/
dl
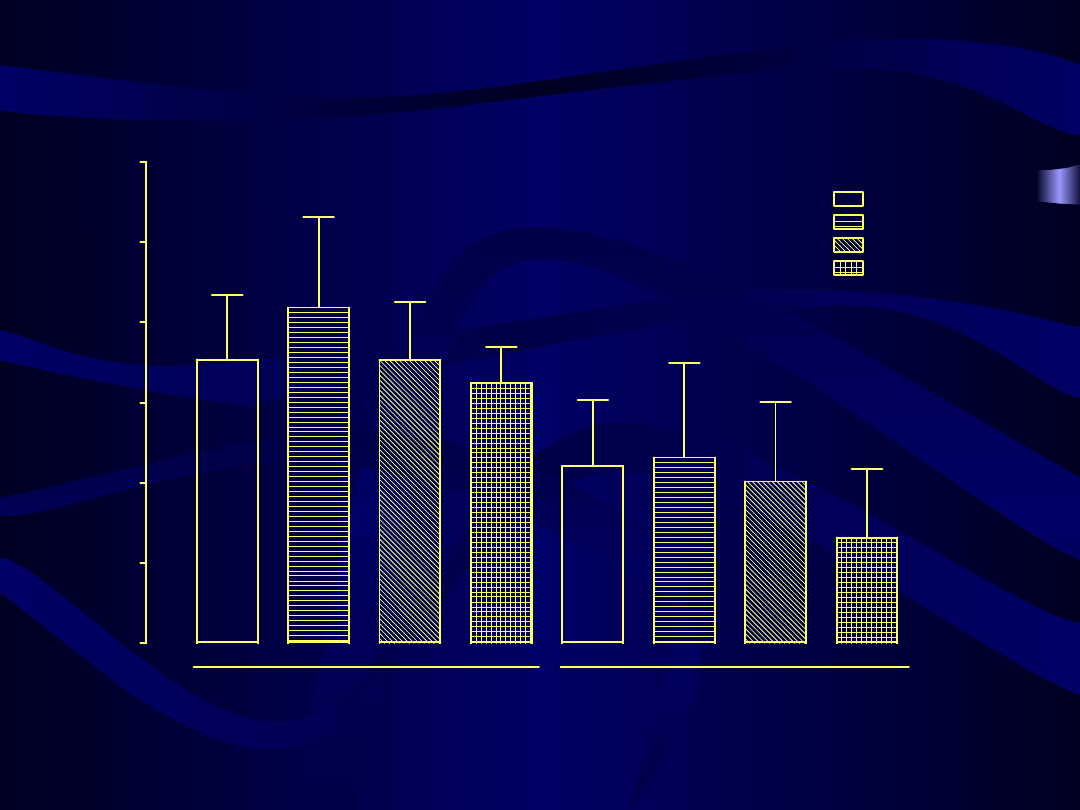
48
Porównanie wyjściowych wartości wskaźników ryzyka rozwoju miażdżycy między grupami
leczonymi różnymi preparatami HTZ
0
1
2
3
4
5
6
p < 0.001
p = 0.001
cholesterol całkowity/HDL
triglicerydy/HDL
Kliogest
Femoston
Climen
Cyclo-Menorette
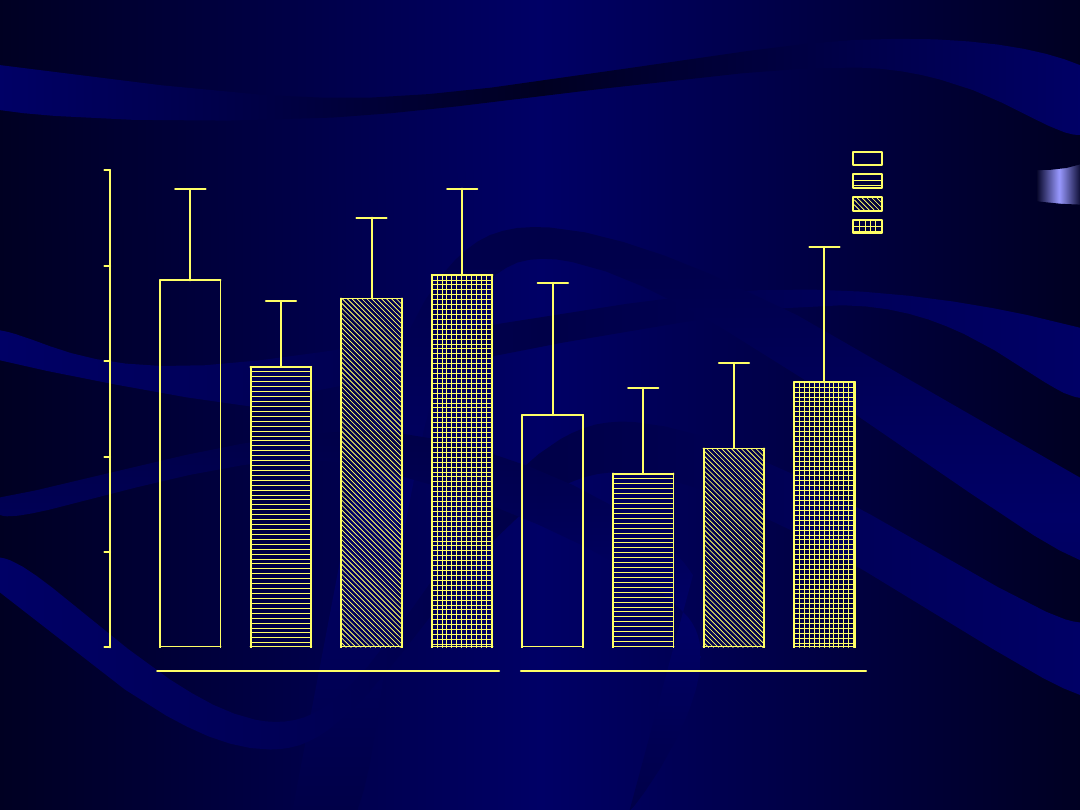
49
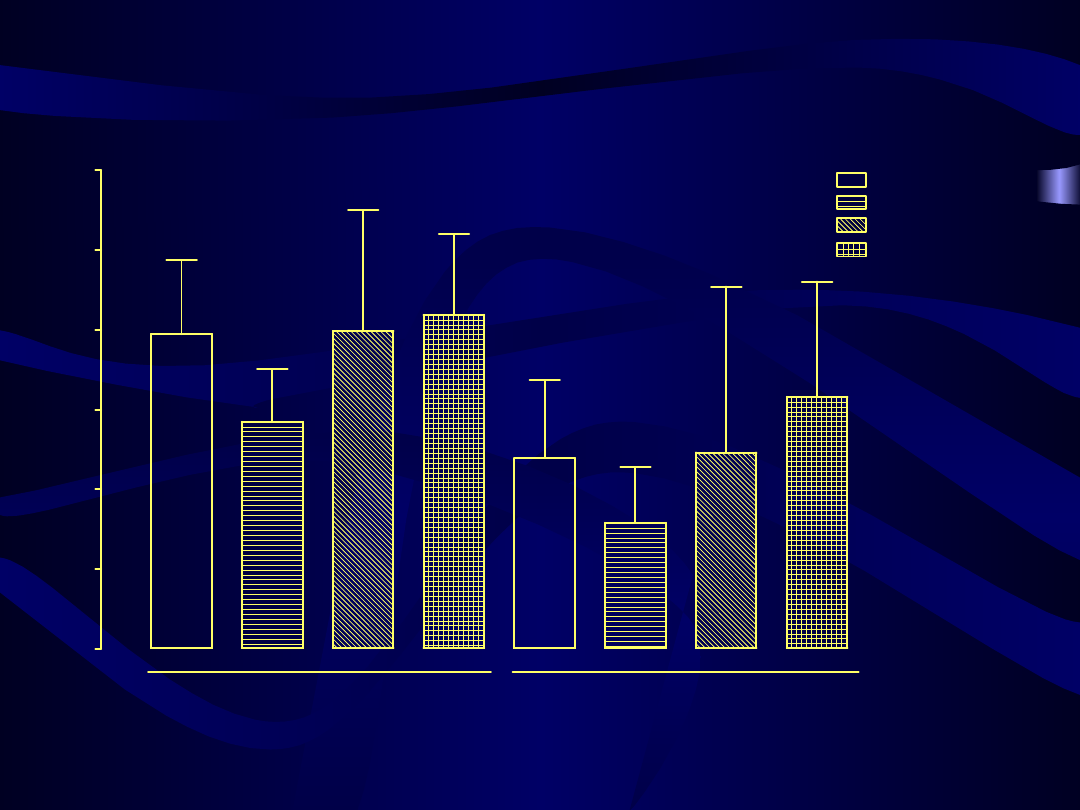
Porównanie wartości wskaźników ryzyka rozwoju miażdżycy między grupami leczonymi
różnymi preparatami HTZ po 3 miesiącach terapii
0
1
2
3
4
5
p < 0.001
p = 0.057
cholesterol całkowity/HDL
triglicerydy/HDL
Kliogest
Femoston
Climen
Cyclo-Menorette
50
Porównanie wartości wskaźników ryzyka rozwoju miażdżycy między grupami leczonymi
różnymi preparatami HTZ po 6 miesiącach terapii
0
1
2
3
4
5
6
p < 0.001
cholesterol całkowity/HDL
triglicerydy/HDL
Kliogest
Femoston
p < 0.001
Climen
Cyclo-Menorette

51
Wnioski:
1. Stosowanie hormonalnej terapii zastępczej w
okresie okołomenopauzalnym u kobiet w oparciu
o preparaty złożone zawierające estradiol
pozwala na skuteczne przeciwdziałanie objawom
zespołu klimakterycznego.
2. Terapia estrogenowo-progestagenna znacznie
obniża stężenia cholesterolu całkowitego, oraz
jego frakcji LDL.
3. Dydrogesteron
stosowany
jako
składnik
kombinowanej
terapii
estrogenowo-
progestagennej w okresie okołomenopauzalnym
wykazuje
najkorzystniejsze
działanie
profilaktyczne dla układu sercowo-naczyniowego
przez wzrost frakcji HDL cholesterolu.

52
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
Wyszukiwarka
Podobne podstrony:
Osteochondritis dissecans in association with legg calve perthes disease
Interruption of the blood supply of femoral head an experimental study on the pathogenesis of Legg C
ABC Of Arterial and Venous Disease
nOTATKI, L7 ' English Disease'
Dietary Patterns Associated with Alzheimer’s Disease
Perthes Disease
19 Health and Diseases1
Some?finitions of Disease
Alzheimer's Disease
Infectious Disease Pathology, 4
2011 2 MAR Chronic Intestinal Diseases of Dogs and Cats
diseases
Mechanism of Disease II
Metastatic bone disease,Wykł B Drozdzowska
Intertrochanteric osteotomy in young adults for sequelae of Legg Calvé Perthes’ disease—a long term
więcej podobnych podstron