
Autor:
Beata Szwagrzyk

Prezentacja może służyć jako:
•
samouczek dla uczniów szkół średnich
• materiał do powtórzenia i usystematyzowania wiadomości
•
pomoc
dydaktyczna
dla
nauczyciela
chemii,
wprowadzającego trudny temat izomerii optycznej.
Między slajdami poruszamy się klikając w dowolnym
miejscu myszką (wówczas pojawi się następny slajd, w
kolejności zaproponowanej przez autorkę prezentacji) lub
klikając na wybranym obiekcie (o jego dostępności
świadczy
rączka
, pojawiająca się po najechaniu nań
myszą).
Ponadto w każdej chwili możesz przejść do dowolnego
slajdu, wybierając jego numer z listy widocznej po lewej
stronie lub u dołu slajdu. Numer aktualnie wyświetlanego
slajdu jest wyróżniony kolorem niebieskim. Aby przerwać
oglądanie prezentacji naciśnij klawisz Esc (o ile nie
oglądasz jej w przeglądarce internetowej – wówczas x w
prawym górnym rogu).
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2

Zagadnienia
Rodzaje izomerii; „miejsce” izomerii
optycznej
Izomeria optyczna
Najważniejsze pojęcia – uczniowskie
„zmory”
Ciekawostki
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
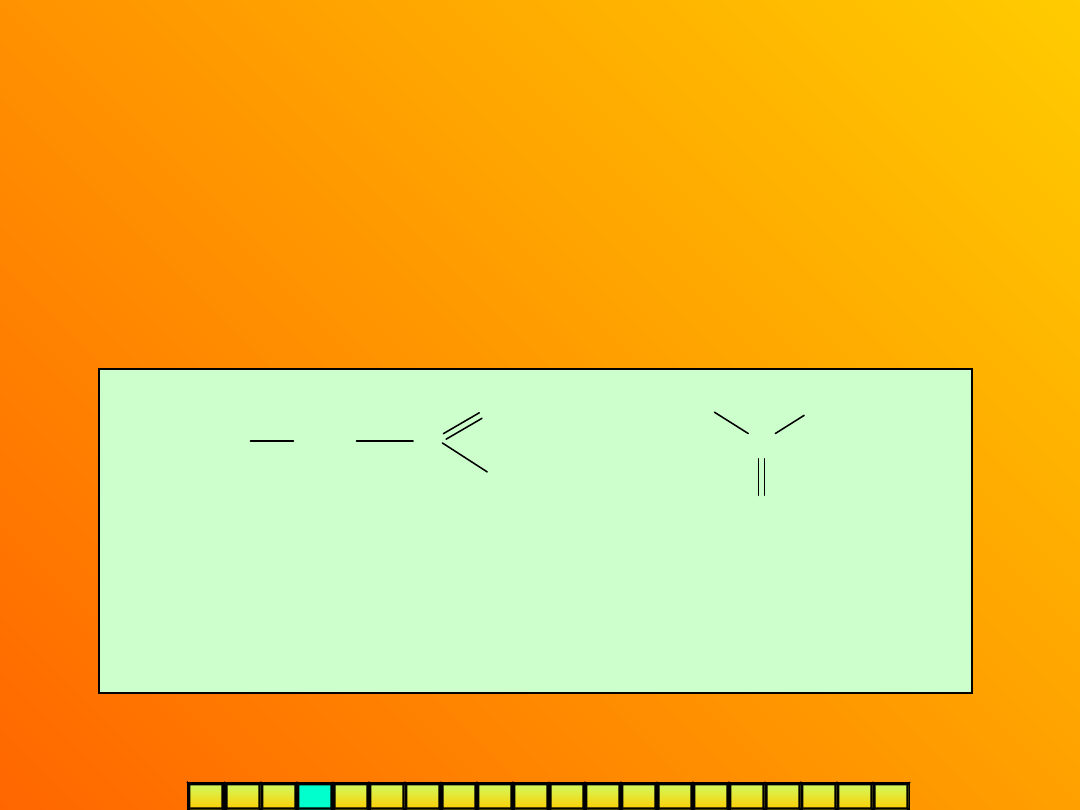
Jest to zjawisko istnienia związków chemicznych o identycznym
wzorze sumarycznym, ale różniących się budową – strukturą
cząsteczek. Związki takie nazywamy
izomerami.
Izomeria występuje bardzo powszechnie w świecie związków
organicznych, np.:
I Z O M E R I A
CH
3
CH
2
C
O
H
CH
3
C
CH
3
O
propanal
(aldehyd)
propanon (keton)
WZÓR SUMARYCZNY:
C
3
H
6
O
1
3
4
5
7 8 9 10 11 12 13 14 15
20
19
18
17
16
2
6
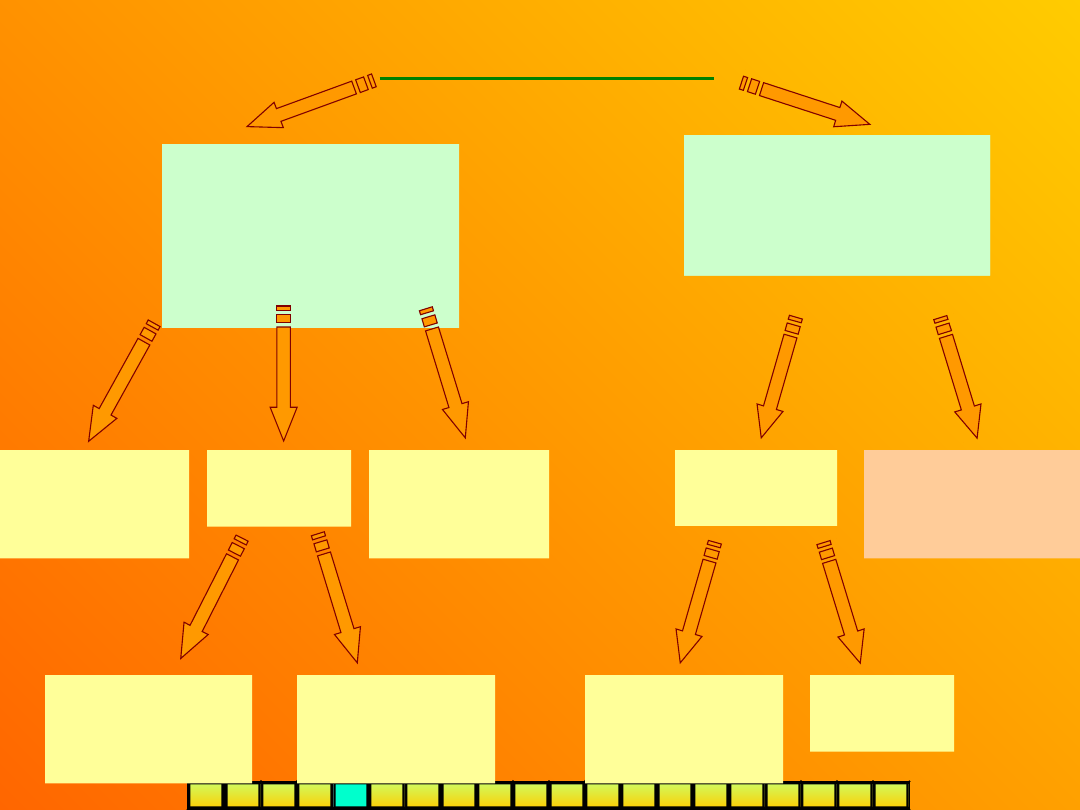
I Z O M E R I A
konstytucyjn
a
(strukturalna
)
przestrzenna
(stereoizomer
ia)
-izomery różnią się kolejnością i
sposobem powiązania atomów w
cząsteczce
-izomery, mając tą samą
konstytucję, różnią się
rozmieszczeniem atomów w
przestrzeni
1
3 4
5
7 8 9 10 11 12 13 14 15
20
19
18
17
16
2
6
przestrzenna
(stereoizomer
ia)
geometrycz
na (cis-
trans)
optyczna
(enancjomeri
a)
diastereo-
izomeria
inne
łańcuchowa
(szkieletow
a)
położeni
a
funkcyjna
(metameria
)
podstawnika
(podstawieni
a)
wiązania
wielokrotneg
o

izomery
optyczne
chiralność
diastereoizom
ery
enancjome
ry
konfigurac
ja D i L
asymetrycz
ny atom
węgla
wzory
stereochemiczne
racem
at
odmian
a
mezo-
WAŻNE POJĘCIA
Kliknij gdziekolwiek poza kształtami, a poznasz je w kolejności
zaproponowanej przez autorkę lub na wybranym obiekcie, jeśli sam
chcesz zadecydować o „kie-runku zwiedzania”.
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2

to nieidentyczność przedmiotu z jego lustrzanym odbiciem
(niemożność nałożenia na odbicie lustrzane).
Pomyśl – chiralne czy
achiralne?
Wskazówka!
Obiekt jest chiralny,
jeśli nie posiada
płaszczyzny ani
środka symetrii (może
mieć osie symetrii).
Oczywiście
, że
chiralne!
Zauważ, że prawy but jest odbiciem
lustrzanym lewego (jeśli masz
wątpliwości, to ściągnij bambosze,
podejdź do lustra i porównaj jeden z nich
z lustrzanym odbiciem drugiego). A czy
są takie same (spróbuj założyć np. prawy
na lewą nogę!)?
CHIRALNOŚĆ
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2

chiralne
achiralne
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
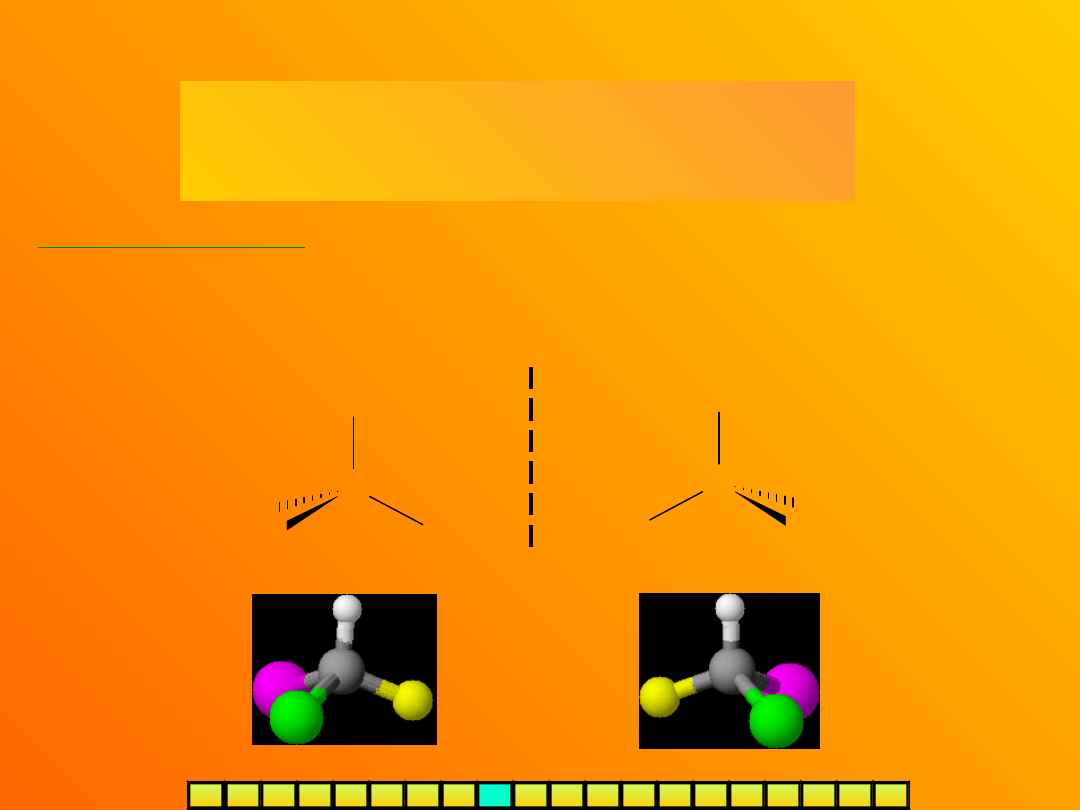
ENANCJOMERY (IZOMERY OPTYCZNE)
- to po prostu chiralne cząsteczki, a więc
dwa izomery będące swoimi
lustrzanymi odbiciami
Najważniejszym centrum chiralności jest
asymetryczny atom
węgla (C*)
–
węgiel tetraedryczny, połączony z czterema różnymi podstawnikami, np.:
Cząsteczka jest chiralna tylko wtedy, jeśli posiada przynajmniej jedno
centrum chiralności
(warunek konieczny, ale niewystarczający – patrz:
forma mezo).
lustr
o
C
H
F
Br
Cl
C
H
F
Br
Cl
*
*
1
3 4 5
7 8
9
10 11 12 13 14 15
20
19
18
17
16
2
6
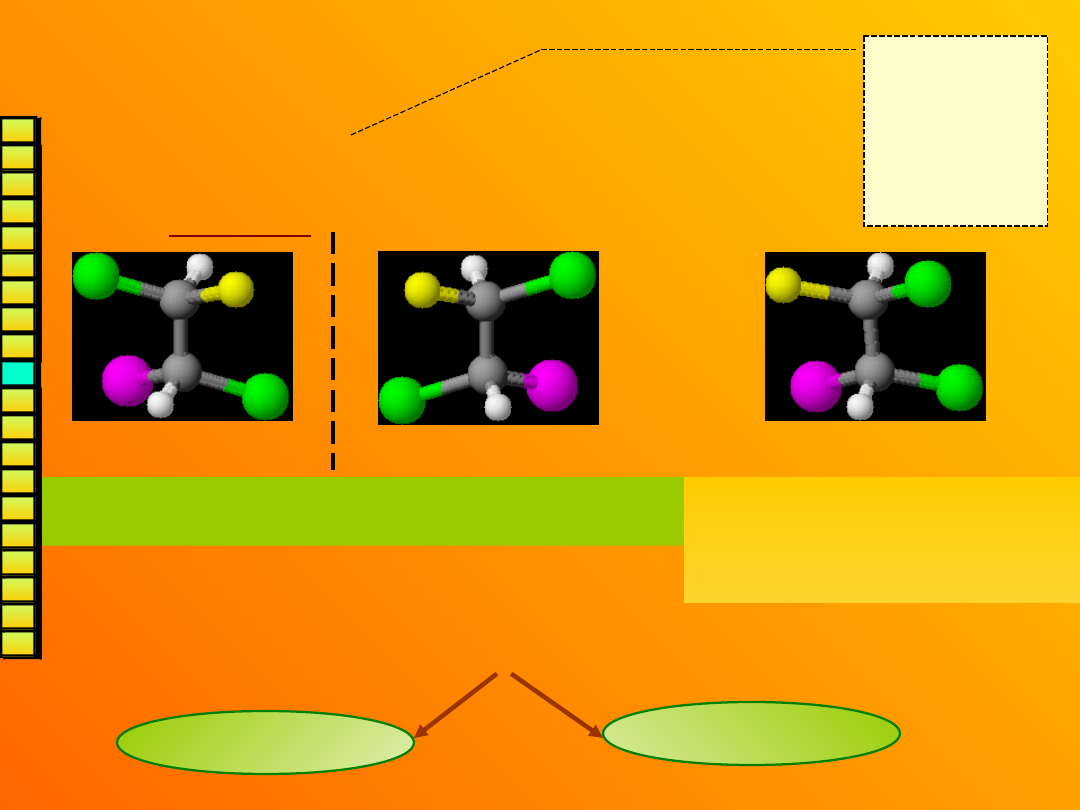
Para izomerów optycznych
(enancjomerów) różni się
konfiguracją
(czyli rozmieszczeniem podstawników)
wokół każdego atomu C* np.:
Aby zmienić
konfigurację
wystarczy
zamienić
miejscami
dwa
podstawniki
.
Właściwości
enancjomerów
chemiczn
e
To są enancjomery – są lustrzanymi odbiciami (różnią
się konfiguracjami obu centrów asymetrii).
Ta cząsteczka nie jest lustrza-
nym odbiciem żadnej z nich
(różni się konfiguracją tylko
jednego centrum).
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
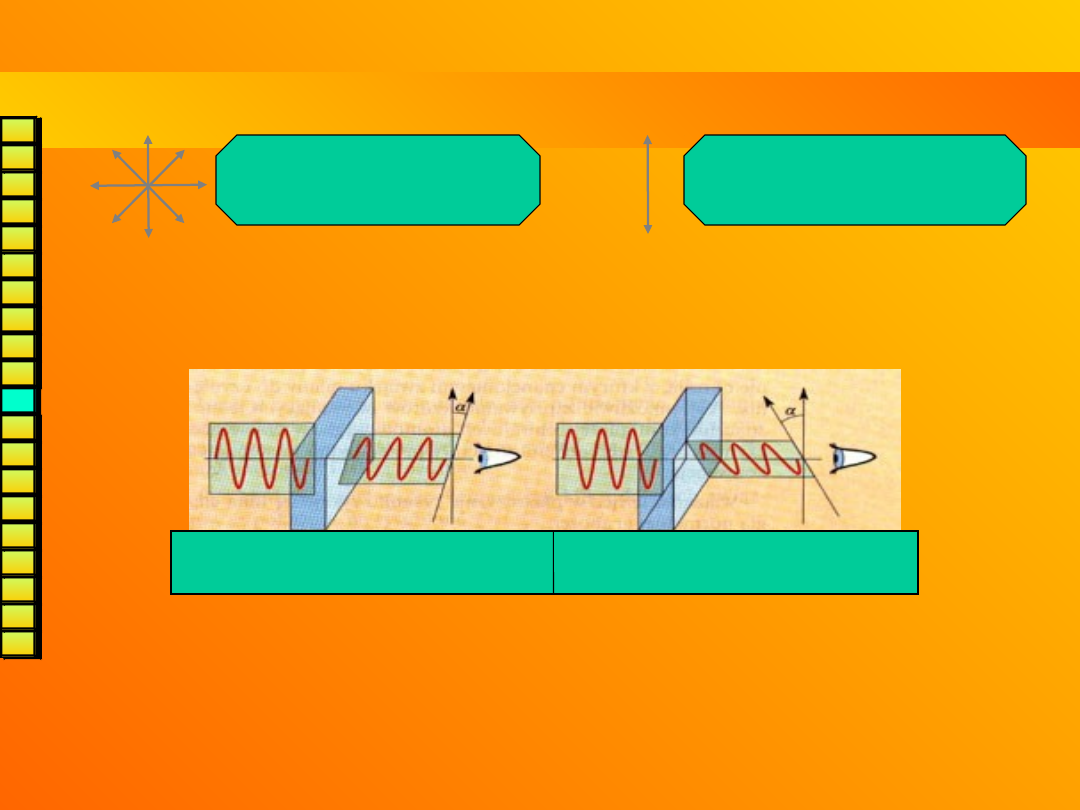
enancjomerów są takie same z wyjątkiem oddziaływania ze światłem
spolaryzowanym.
światło niespolaryzowane
(drgania we wszystkich
płaszczyznach)
światło spolaryzowane
(drgania tylko w jednej
płaszczyżnie)
Enancjomery
skręcają płaszczyznę polaryzacji
(o ten sam
kąt ale w przeciwnych kierunkach!) – są
optycznie
czynne
.
Enancjomer prawoskrętny
(+)
Enancjomer lewoskrętny
(-)
Uwaga!
Równomolowa mieszanina obu enancjomerów – tzw.
mieszanina racemiczna (racemat) ()
jest oczywiście
optycznie nieczynna, podobnie jak substancje achiralne
(skręcalność obydwu enancjomerów jest wzajemnnie
równoważona).
Właściwości
fizyczne
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2

POLARYMETR
Jest przyrządem służacym do badania czynności optycznej i pomiaru
kąta skręcenia płaszczyzny polaryzacji przez roztwór badanej
substancji.
Jego główne części to:
źródło światła
polaryzator
(polaryzuje światło – polaryzator foliowy, tzw.polaroid lub
odpowiednio przygotowany kryształ substancji dwójłomnej, np. pryzmat
nikola),
rurka polarymetryczna
(wypełniona roztworem badanej substancji)
analizator
(przez jego obrót, aż do momentu uzyskania maksymalnego
natężenia światła, możemy określić
)
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
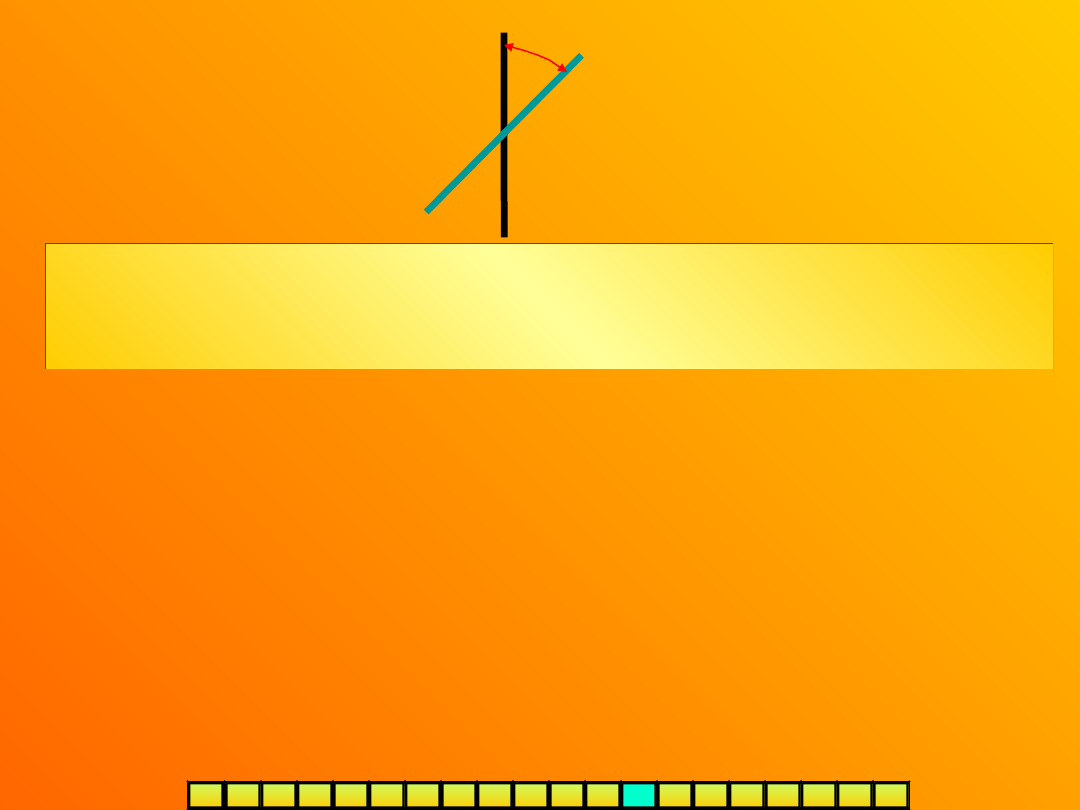
płaszczyzna polaryzacji
światła padającego
płaszczyzna polaryzacji światła po przejściu przez
substancję optycznie czynną
-kąt skręcenia płaszczyzny polaryzacji
(wielkość kąta, o jaki należy obrócić
analizator, aby skompensować
skręcenie)
Dla danej temperatury i długości fali wielkość kąta
zależy od
rodzaju substancji
oraz
liczby cząsteczek
znajdujących się na drodze wiązki światła podczas jej
przechodzenia przez rurkę polarymetryczną. Zdolność danej substancji do
wykazywania czynności optycznej określa tzw.
skręcalność właściwa []
, czyli
liczba stopni, o jaką została skręcona
płaszczyzna polaryzacji światła w rurce o
długości 1dm, zawierającej 1g badanego
związku w 1cm
3
roztworu,
co obliczamy ze
wzoru:
d
l*
- obserwowany kąt skręcenia (ze znakiem „+” dla substancji prawoskrętnych, a „-” dla
lewoskrętnych)
l – długość rurki [dm]
d – gęstość czystej cieczy lub stężenie roztworu [g/cm
3
]
np. skręcalność właściwa -glukozy wynosi
+112
0
, a -fruktozy
–133,5
0
Pomiary polarymetryczne umożliwiają identyfikację substancji oraz określenie
ich stężenia w roztworze (zastosowanie m.in. w przemyśle cukrowniczym).
1
3 4 5
7 8 9 10 11 12
13
14 15
20
19
18
17
16
2
6

enancjomerów są również identyczne z wyjątkiem reakcji ze
związkami optycznie czynnymi.
Ponieważ chiralność może być stwierdzona tylko w
kontakcie z innym obiektem chiralnym.
Spróbuj:
I
. Złapać szklankę (obiekt achiralny) raz
prawą, a raz lewą ręką (chiralne!).
II
. Nałożyć pieciopalczastą , np. prawą
rękawiczkę (chiralna) na prawą, a następnie –
lewą rękę.
Widzisz
różnicę?
Podobnie - enancjomery reagują z tą samą łatwością z
substancjami achiralnymi, a z różną – z chiralnymi.
Dlaczego
Właściwości chemiczne
1
3 4 5
7 8 9 10 11 12 13
14
15
20
19
18
17
16
2
6
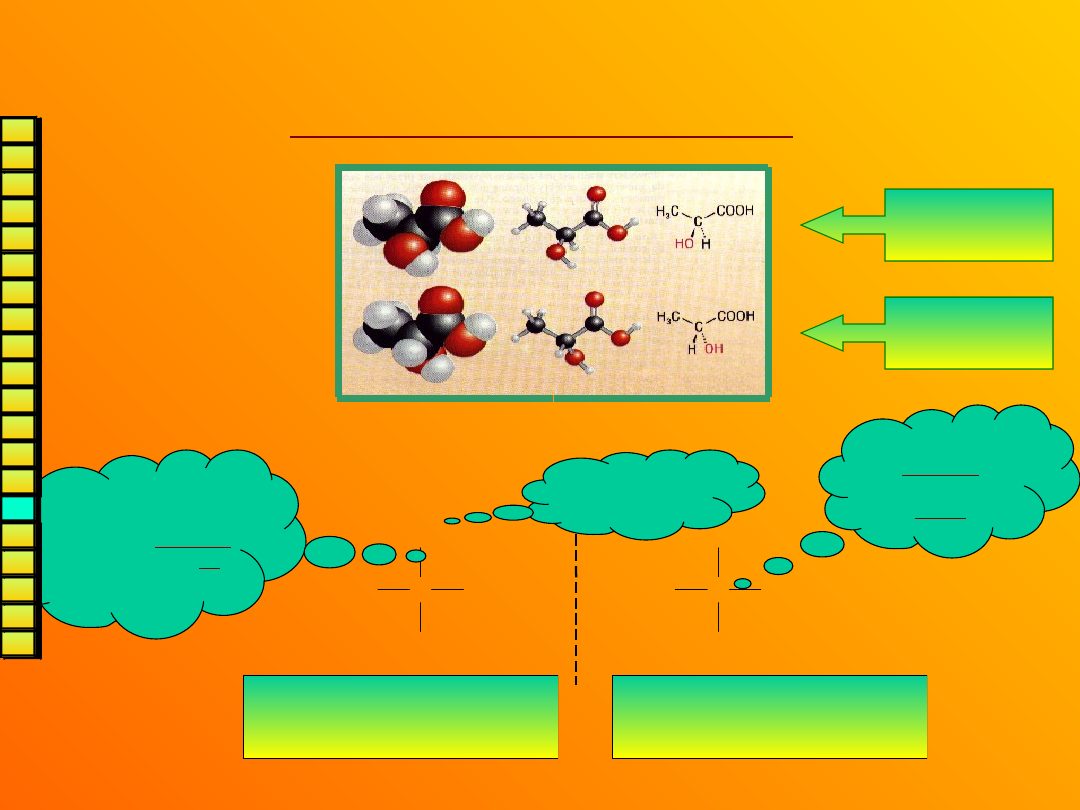
Wzory
stereochemiczne
czyli – jak rysować stereoizomery?
Można
tak:
Ale znacznie prościej tak (wzory rzutowe
Fischera):
Kwas
L-(+)-mlekowy
Kwas
D-(-)-mlekowy
COOH
C
CH
3
HO
H
COOH
C
CH
3
H
OH
Kwas L-(+)-
mlekowy
Kwas D-(-)-
mlekowy
bardziej
utleniona
grupa – u góry
łańcuch główny
rysujemy w pionie,
a wiązania pionowe
są skierowane za
płaszczyznę
rzutowania
wiązania
poziome
skierowane są
przed
płaszczyznę
rzutowania
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
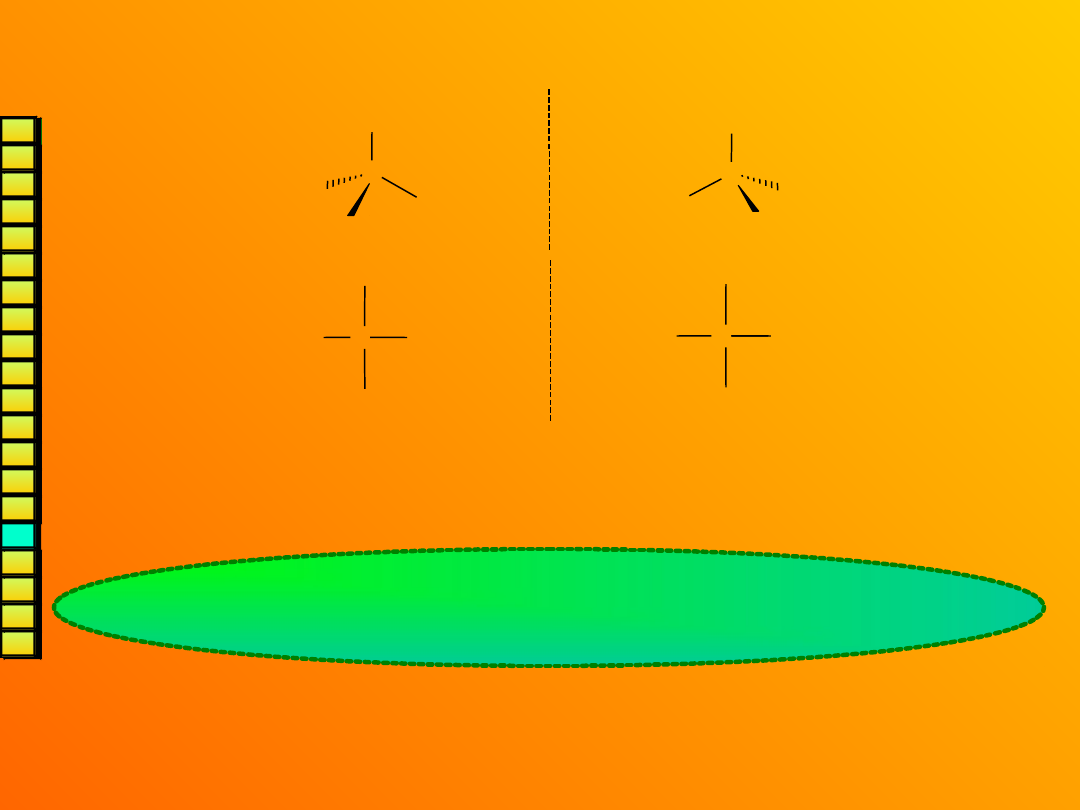
Konfiguracja D i
L.
CHO
CH
2
OH
H
C
HO
C
H
OH
CH
2
OH
CHO
HO
H
C
CHO
CH
2
OH
C
CHO
HOH
2
C
OH
H
Wzorzec:
aldehyd L-(-)-glicerynowy
aldehyd L-(-)-glicerynowy
(łac. laevus – lewy; grupa –OH
po lewej stronie atomu węgla)
aldehyd D-(+)-glicerynowy
aldehyd D-(+)-glicerynowy
(łac. dexter – prawy; grupa –OH
po prawej stronie atomu węgla)
Jeśli jakiś enancjomer można przekształcić w aldehyd L-
glicerynowy lub z niego otrzymać, to przypisujemy mu symbol
L (analogicznie D).
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
Prznależność do szeregu D lub L i kierunek skręcenia (+ lub -) to cechy niezależne!
Symbole D i L stosuje się głównie w przypadku aminokwasów i cukrów. Na studiach
poznasz bardziej uniwersalną metodę określania konfiguracji absolutnej (wg reguł
Cahna – Ingolda – Preloga).
DIASTEREOIZOMERIA
COOH
C
C
COOH
OH
HO
H
H
COOH
C
C
COOH
H
H
HO
OH
COOH
C
C
COOH
OH
H
H
OH
*
*
*
*
*
*
enancjomery
diastereoizomer
y
diastereoizomer
y
Diastereoizomery
–
stereoizomery nie będące swoimi
lustrzanymi odbiciami (różnią się konfiguracją nie wszystkich
centrów asymetrii).
Kwas L-(+)-winowy
Kwas D-(-)-winowy
Kwas mezo-
winowy
Ostatnia cząsteczka posiada płaszczyznę
symetrii !!!
Pomimo obecności asymetrycznych atomów węgla (aż dwóch) jest
achiralna. Taki izomer nazywamy formą
mezo-.
Uwaga!
1
3 4 5
7 8 9 10 11 12 13 14 15
20
19
18
17
16
2
6
LICZBA STEREOIZOMERÓW
1
3 4 5
7 8 9 10 11 12 13 14 15
20
19
18
17
16
2
6
n
Liczba
stereoizom
erów
Liczba par
enancjome
rów
Przykład substancji
1
2
2,3-dichlorobutanal
3
fruktoza (odmiana łańcuchowa)
4
LICZBA STEREOIZOMERÓW
Jeśli cząsteczka posiada
n
asymetrycznych atomów węgla, to jej
wzorowi odpowiada
2
n
stereoizomerów, co stanowi
2
n
/2
par
enancjomerów (lub mniej – w przypadku form mezo-) np.:
bromochlorofluorometan
glukoza (odmiana łańcuchowa)
2
4
8
16
1
2
4
8
Brakujące elementy uzupełnisz
kolejnymi kliknięciami
Brakujące elementy uzupełnisz
kolejnymi kliknięciami
Glukoza i jej stereoizomery
CH O
C
C
C
C
H
OH
OH
CH
2
OH
H
OH
HO
H
H
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
*
D-glukoza
CH O
C
C
C
C
OH
OH
OH
CH
2
OH
H
OH
H
H
H
D-alloza
CH O
C
C
C
C
OH
OH
OH
CH
2
OH
HO
H
H
H
H
D-altroza
CH O
C
C
C
C
H
OH
OH
CH
2
OH
HO
H
HO
H
H
D-mannoza
CH O
C
C
C
C
OH
H
OH
CH
2
OH
H
OH
H
HO
H
D-guloza
CH O
C
C
C
C
OH
H
OH
CH
2
OH
HO
H
H
HO
H
D-idoza
CH O
C
C
C
C
H
H
OH
CH
2
OH
H
OH
HO
HO
H
D-galaktoza
CH O
C
C
C
C
H
H
OH
CH
2
OH
HO
H
HO
HO
H
D-taloza
Są to tylko D-stereoizomery (grupa –OH po prawej stronie najniższego
asymetrycznego atomu węgla), będące diastereoizomerami. Każdemu z
nich odpowiada jeszcze enancjomer L – razem 8*2=2
4
czyli 16
stereoizomerów.
1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2

1
1
6
6
3
3
4
4
5
5
7
7
8
8
9
9
10
10
11
11
12
12
13
13
14
14
15
15
20
20
19
19
18
18
17
17
16
16
2
2
Organizmy są
stereoselektywne
, tzn.
wytwarzają lub wykorzystują do swoich celów
tylko konkretne enancjomery! Na przykład:
(-) – karwon
nadaje zapach mięcie ogrodowej,
(+) – karwon
jest składnikiem olejku
kminkowego
kwas L-(+)– mlekowy
powstaje z glikogenu
podczas pracy mięśni, powodując „zakwasy”,
podczas gdy
kwas D-(-)– mlekowy
jest produktem fermentacji
mlekowej cukrów, zachodzącej tam, gdzie coś
ulega kwaszeniu - znajduje sie w kiszonej
kapuście, ogórkach czy kwaśnym mleku (powstaje
racemat).
Wszystkie naturalne
cukry
należą do szeregu
konfigu-racyjnego
D
, a
aminokwasy
białkowe do
szeregu
L
!
Chemik, syntezując jakąś substancję w
probówce może otrzymać jedynie
mieszaninę racemiczną. Aby uzyskać jeden z
enancjomerów musi ją bardzo mozolnie
rozdzielać na składniki lub oddając hołd
niezrównanej naturze – użyć na jednym z
etapów enancjomeru wyprodukowanego
przez organizm żywy!.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
izomeria optyczna
Chemia wykłady, koło II sem v.3.0 - do nauki, Izomeria optyczna
Izomeria optyczna id 221213 Nieznany
Chemia wykłady, koło II sem v.3.0, Izomeria optyczna
2 13 Izomeria optyczna
Chemia wykłady, koło II sem v.3.01, Izomeria optyczna
izomeria optyczna, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
Chemia org. - Izomeria optyczna 1, SZKOŁA, CHEMIA, Organiczna
Izomeria optyczna, studia
Chemia org. - Izomeria optyczna 2, Studia - materiały, semestr 2, Chemia, Organiczna
Chemia wykłady, koło II sem v.3.0 długopis, Izomeria optyczna
Izomeria optyczna
izomeria optyczna, Biostereochemia, stereochemia, Biostereochemia, Biostereo seminarka, biostereo, P
Izomeria optyczna, Chemia
Chemia wykłady, koło II sem v.2.0, Izomeria optyczna
izomeria optyczna
izomeria optyczna
Izomeria optyczna K W&N Ś
więcej podobnych podstron