Cz. XXI Izomeria optyczna
1. Stereoizomeria – typ izomerii związanej z różnym rozmieszczeniem atomów lub grup
atomów w przestrzeni. (różne rozmieszczenie przy określonym atomie węgla – strona
prawa, lewa, za płaszczyzną, przed płaszczyzną). W ramach stereoizomerii wyróżnia
się izomerię optyczną (enancjomerię), izomerię geometryczną, konformacyjną.
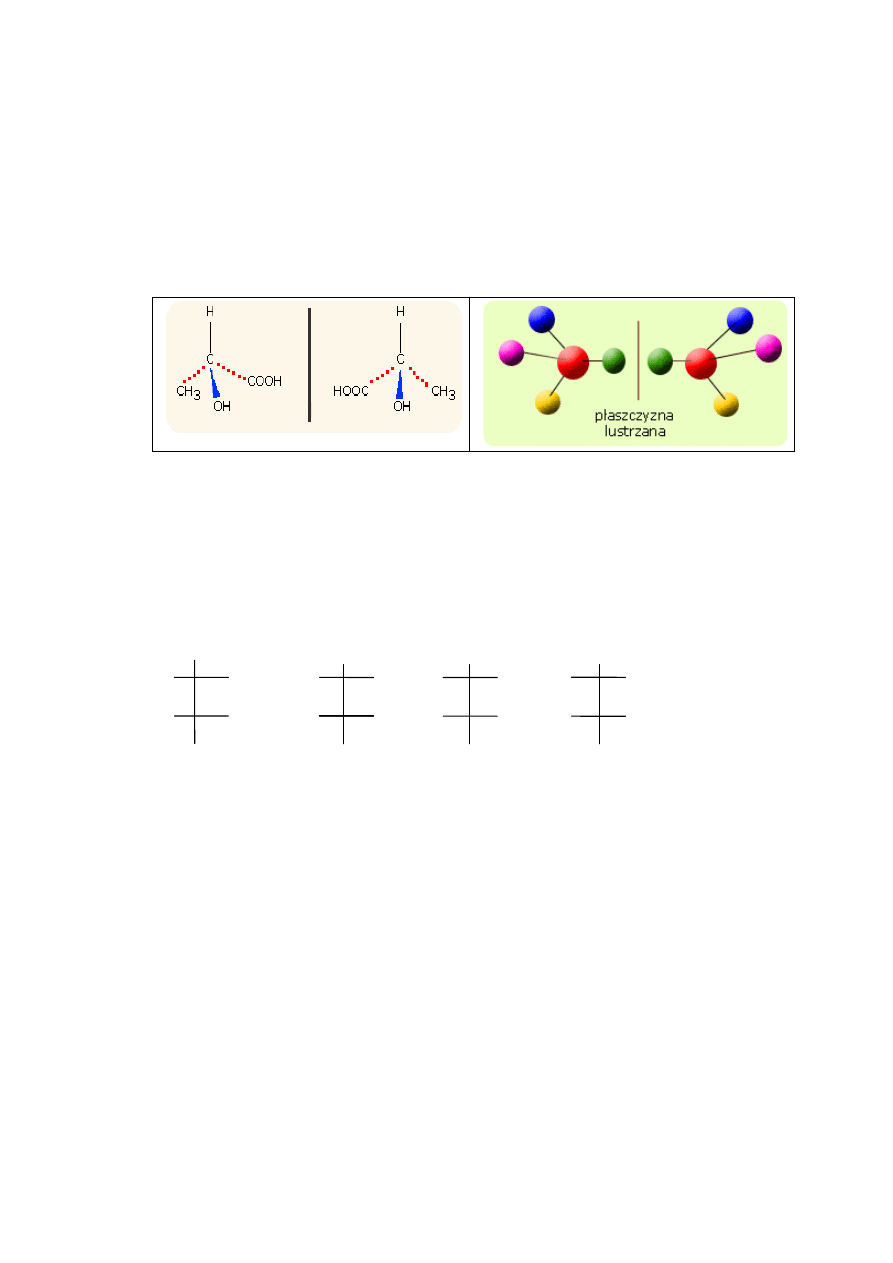
Izomeria optyczna – enancjomeria – cząsteczki enancjomerów mają się do siebie jak
obiekt do swojego odbicia lustrzanego (lub prawa i lewa dłoń – mogą przylegać do
siebie ale nie mogą się nałożyć). Takie cząsteczki określa się jako chiralne
(cząsteczki, które dają się nałożyć są achiralne). Izomery optyczne wykazują
czynność optyczną - skręcanie w prawo (prawoskrętne [+]), w lewo (lewoskrętne [–])
płaszczyznę światła spolaryzowanego. Izomerię optyczną mogą wykazywać związki,
które posiadają w swoich cząsteczkach asymetryczny (chiralny) atom C. Przykład
poniżej – kwas α-hydroksopropanowy (kwas mlekowy – kwas 2-hydroksopropanowy)
[* Uwaga węgiel z grupy karboksylowej ma zawsze lokant 1, w systemie alfabetu
greckiego węgiel, z którym powiązania jest grupa karboksylowa oznacza się jako alfa,
a następne odpowiedni beta, gamma, delta].
C
γ
H
3
– C
β
H
2
– C
α
H(OH) - COOH - kwas α-hydroksobutanowy
(2-hydroksobutanowy),
C
γ
H
3
– C
β
H(OH) – C
α
H
2
- COOH - kwas β –hydroksobutanowy
(3-hydroksobutanowy),
Izomeria optyczna
Związki chemiczne nie mające
lustrzanych odbić
Związki chemiczne mające
lustrzane odbicia
ENANCJOMERY
CH
3
CH
3
I I
H
- C -
Cl
Cl
- C -
H
I I
CH
2
CH
2
I I
CH
3
CH
3
DIASTEREOIZOMERY
Cl
H
I I
H
3
C
- C -
H
H
3
C
- C -
Cl
I I
H
3
C
- C -
H
H
3
C
- C -
H
I I
Br
Br
C
γ
H
2
(OH) – C
β
H
2
– C
α
H
2
- COOH - kwas γ–hydroksobutanowy
(4-hydroksobutanowy).
W powyższych przykładach 1: C alfa i 2: C beta są chiralne.
Związki zawierające więcej niż jeden chiralny atom węgla mogą ale nie muszą
wykazywać izomerii optycznej – efekt końcowy skręcalności jest „sumą” skręcalności
na poszczególnych chiralnych atomach węgla, stąd „suma” skręceń (+) i (-) może
wykazać brak skręcalności.
Diastereoizomery – stereoizomery nie będące enancjomerami, tzn. których cząsteczki
nie pozostają do siebie jak przedmiot i odbicie lustrzane.
Przykład: pentan-2,3-diol, zawiera dwa atomy węgla chiralne może tworzyć cztery
stereo izomery:
CH
3
– CH
2
–*CH – *CH – CH
3
I I
OH OH
CH
3
CH
3
CH
3
CH
3
H * OH HO * H H * OH HO * H
HO * H H * OH H * OH HO * H
C
2
H
5
C
2
H
5
C
2
H
5
C
2
H
5
I II III
IV
Izomer I i II stanowią parę enancjomerów, izomer III i IV stanowią pary enancjomerów,
ale para I i III , para II i IV, para II i III; I i IV nie są enancjomerami, są natomiast
diastereoizomerami.
Liczbę stereoizomerów oblicza się podnosząc do kwadratu liczbę chiralnych atomów w
cząsteczce związku, w powyższym przykładzie 2
2
= 4. Heksoza–cukier 6-cioęglowy C
6
H
12
O
6
posiada w cząsteczce 4 chiralne atomy węgla (stąd 4
2
= 16) posiada 16 stereoizomerów.
Właściwości enancjomerów
1. Enancjomery mają identyczne właściwości fizyczne z wyjątkiem kierunku skręcania płaszczyzny
polaryzacji światła
2. Enancjomery wykazują identyczne właściwości chemiczne; wyjątkiem jest ich zachowanie się w
stosunku do optycznie czynnych reagentów. Oznacza to, że jeżeli reagent jest optycznie czynny,
jego wpływ na oba enancjomery nie jest identyczny podczas ataku i dlatego szybkość reakcji jest
różna - w niektórych przypadkach tak dalece różna, że reakcja z jednym izomerem w ogóle nie
zachodzi.
Równocząsteczkowa mieszanina enacjomerów nie wykazuje optycznej czynności i nosi
nazwę mieszaniny recemicznej
Odmiana racemiczna jest optycznie nieczynna. Jest wynikiem równoważenia skręcalności
cząsteczki jednego izomeru przez skręcalność cząsteczki drugiego izomeru.
W celu zaznaczenia racemicznego charakteru określonej próbki stosuje się znak (+/-), jak na
przykład
kwas (+/-)-mlekowy.
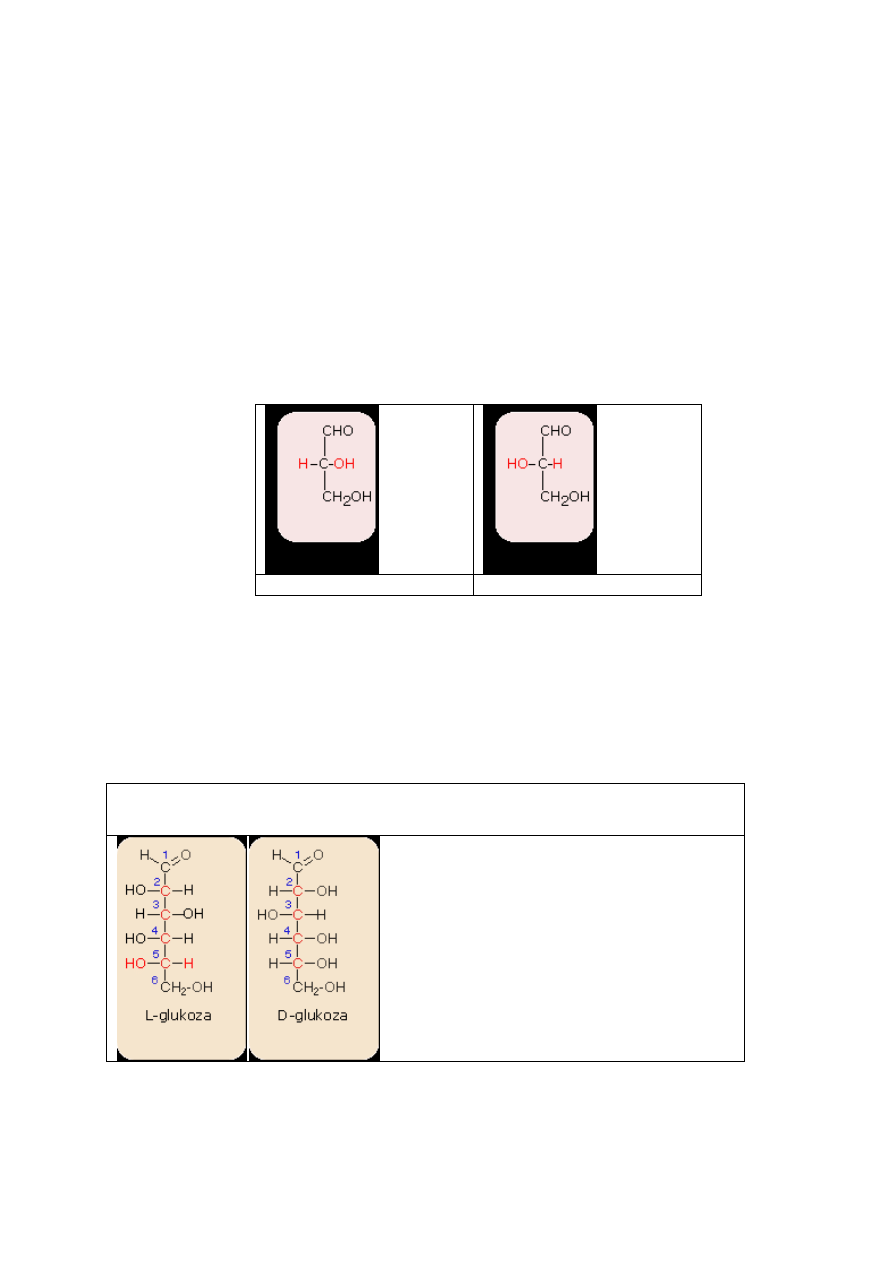
Konfiguracja D- i L-
Często dla względnego charakteryzowania cząstek chiralnych wprowadzono pojęcie
konfiguracji D- i L-, co uwidocznione jest w nazwach związków. Na przykład - aldehyd D-
glicerynowy, aldehyd L-glicerynowy Punktem odniesienia dla konfiguracji D- i L- jest
budowa cząsteczki aldehydu glicerynowego a konkretnie położenie podstawników H- oraz
HO- przy środkowym węglu.
D-aldehyd glicerynowy
L-aldehyd glicerynowy
Najczęściej konfigurację D- i L- spotykamy w grupie cukrów. Jeżeli cząsteczki cukrów
prostych swoją budową nawiązuje do D-aldehydu glicerynowego, zaliczane są do szeregu D,
natomiast te, których budowa nawiązuje do L-aldehydu glicerynowego, zaliczane są do
szeregu L.
Uporządkowanie na szeregi D i L następuje według konfiguracji podstawników, przy czym
bierzemy pod uwagę to centrum chiralności, które jest najbardziej oddalone od grupy
karbonylowej.
W prezentowanych przykładach w nazwie zaznaczono skręcalność optyczną i konfiguracją D- i L-
.Uzyskano tym sposobem pełniejszą nazwę optycznie czynnego związku chemicznego. Na przykład -
D(+) - aldehyd glicerynowy, L(-) - aldehyd glicerynowy
.
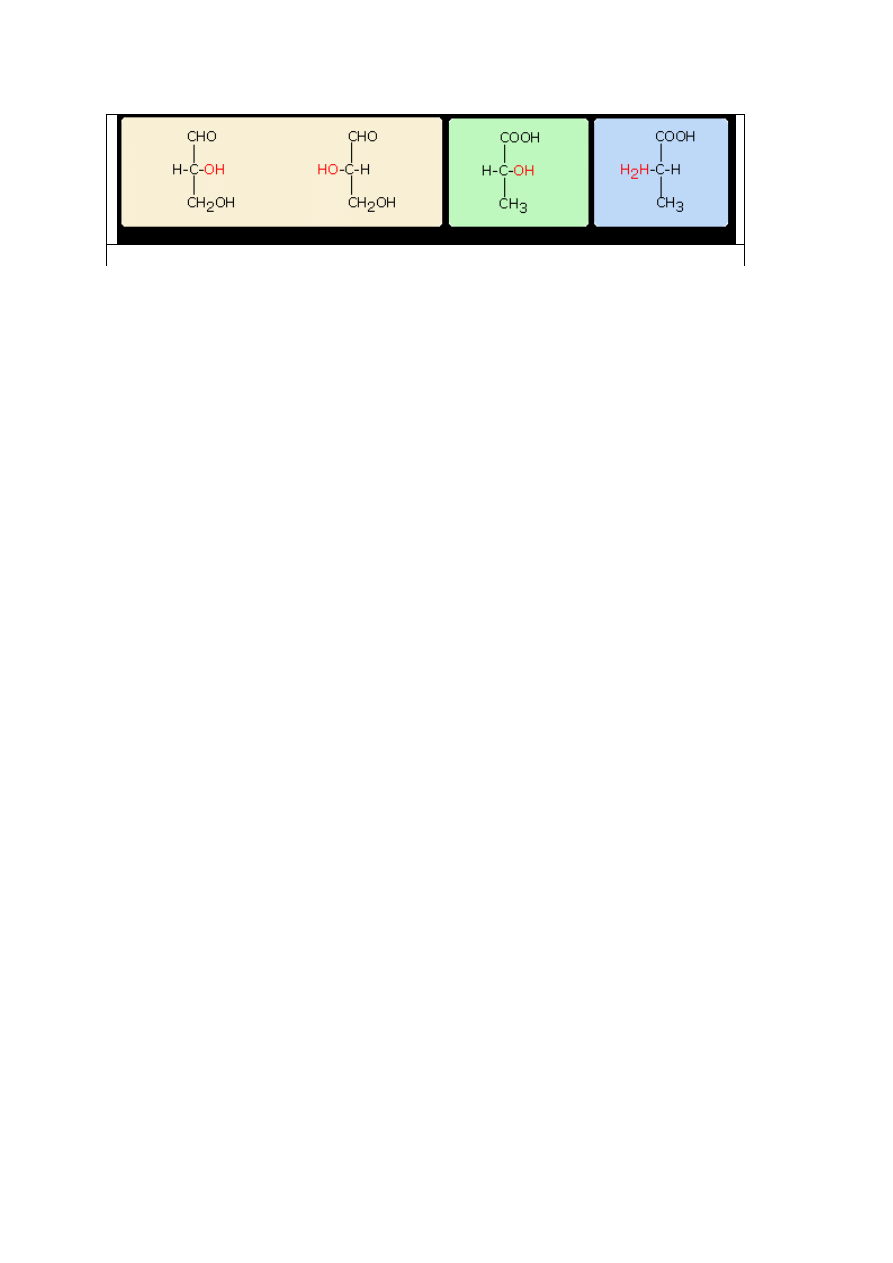
D(+) aldehyd gicerynowy/L(-) a.glicerynowy D(-) kw. mlekowy/ L(+) alanina
Wyszukiwarka
Podobne podstrony:
Izomeria 4 id 221207 Nieznany
Izomeria[1] id 221209 Nieznany
Izomeria 2 id 221205 Nieznany
izomeria optyczna
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
więcej podobnych podstron