
Izomeria związków organicznych
izomeria łańcuchowa
izomeria położenia
izomeria z różnymi podstawnikami w cząsteczce
o
enacjomery
o
diastereoizomery
Rodzaje izomerii
Pierwsze możliwe przestrzenne rozmieszczenie atomów węgla w cząsteczce występuje gdy cząsteczka
zawiera 4 atomy węgla (C4H10). W takiej cząsteczce są możliwe dwa sposoby połączenia atomów węgla w
cząsteczce: w postaci łańcucha n-butanu i w postaci rozgałęzionej, czyli metylopropanu (izobutan).
Na przedstawionym modelu widzimy, że cząsteczki zawierają taką samą liczbę atomów tego samego
pierwiastka, lecz atomy te są połączone z sobą w inny sposób. Innym przykładem jest związek chemiczny o
wzorze sumarycznym - C5H12. Związek chemiczny o takim wzorze może posiadać trzy odmiany
strukturalne. Takie związki różniące się przestrzennym rozmieszczeniem atomów nazywa się izomerami.
Rodzaje izomerii występujące w związkach organicznych przedstawia poniższy schemat.
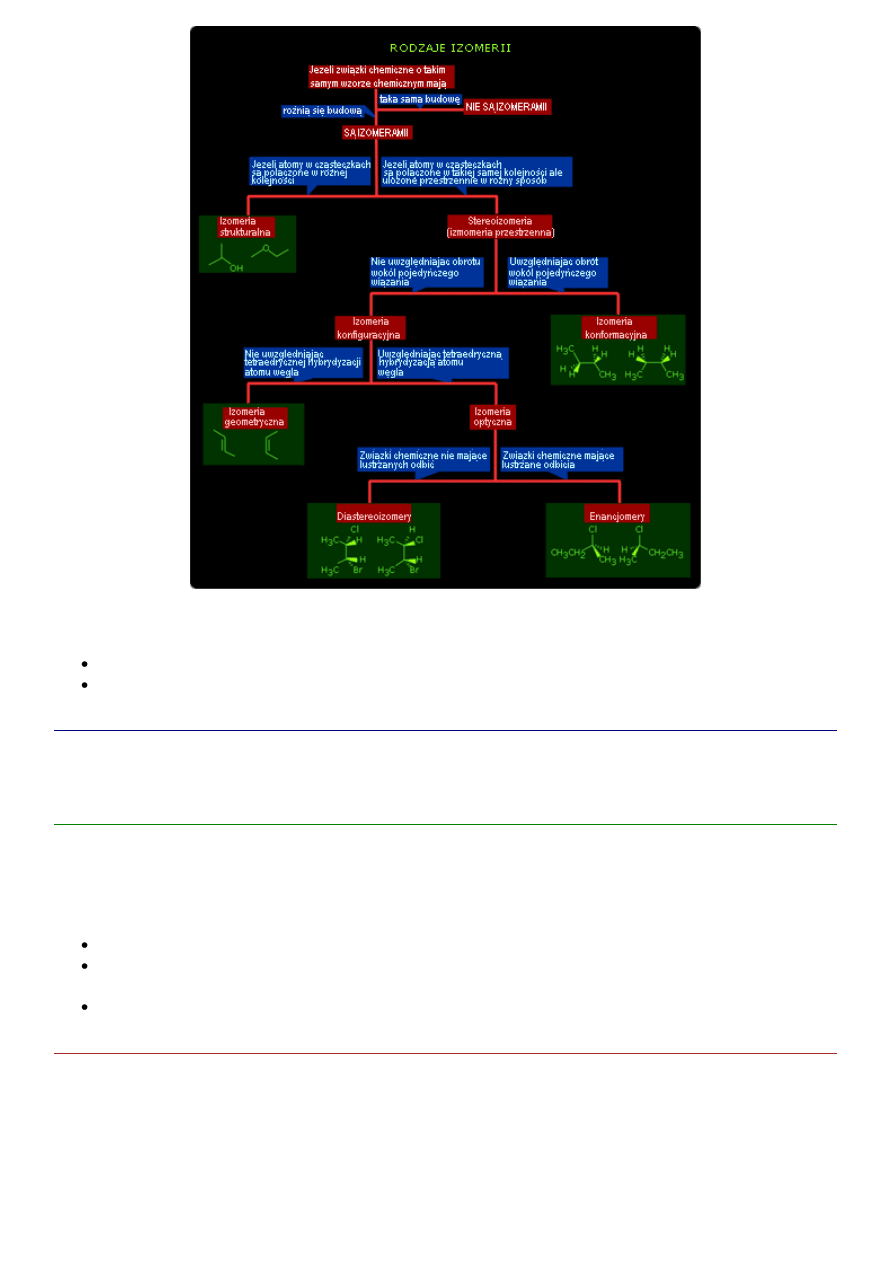
Wyróżnia się izomerię
strukturalną
steroeoizomeria (przestrzenna)
Izomeria strukturalna
Izomeria strukturalna
- polega na występowaniu związków izomerycznych, w których atomy tych samych
pierwiastków są ze sobą połączone w różnej kolejności
W odniesieniu do węglowodorów i ich pochodnych wyróżniamy izomerię
izomerię łańcuchową
, gdzie atomy węgla mogą przyjmować różne ułożenia w łańcuchu
izomerię położenia
, gdzie mamy do czynienia z różnym położeniem wiązań nienasyconych oraz
różnym położeniem podstawników w cząsteczce
izomerię z różnymi podstawnikami w cząsteczce
Izomeria łańcuchowa
W cząsteczkach węglowodorów począwszy od butanu atomy węgla mogą przyjmować różne ułożenia w
łąńcuchu
C
4
H
10

Ze wzrostem liczby atomów węgla szybko wzrasta ilość izomerów.
C
5
H
12
Dla cząsteczki posiadającej 10 atomów węgla izomerów jest 75, dla 20 atomów węgla - 366319, dla 30
atomów węgla - 411109 izomerów.
Nazwa
Wzór
sumaryczny
Wzór
półstrukturalny
Ilość
izomerów
Nazwa
Wzór
sumaryczny
Wzór
półstrukturalny
Ilość
izomerów
Metan
CH
4
CH
4
1
Heksan
C
6
H
14
CH
3
(CH
2
)
4
CH
3
5
Etan
C
2
H
6
CH
3
CH
3
1
Heptan
C
7
H
16
CH
3
(CH
2
)
5
CH
3
9
Propan
C
3
H
8
CH
3
CH
2
CH
3
1
Oktan
C
8
H
18
CH
3
(CH
2
)
6
CH
3
18
Butan
C
4
H
10
CH
3
CH
2
CH
2
CH
3
2
Nonan
C
9
H
20
CH
3
(CH
2
)
7
CH
3
35
Pentan
C
5
H
12
CH
3
(CH
2
)
3
CH
3
3
Dekan
C
10
H
22
CH
3
(CH
2
)
8
CH
3
75
Izomeria położenia
Izomeria położenia dotyczy położenia podstawnika lub wiązania wielokrotnego w cząsteczce.
Przykłady:
C
3
H
7
-Cl
1-chloropropan
CH
3
-CH
2
-CH
2
-Cl
2-chloropropan
CH
3
-CHCl-CH
3
C
5
H
10
Izomeria z różnymi podstawnikami w cząsteczce
Stereoizomeria
Stereoizomeria
- to szczególny rodzaj izomerii, gdzie atomy połączone są między sobą w identycznej
kolejności ale różnią się sposobem rozmieszczenia atomów w przestrzeni. Wyróżniamy tutaj następujące
rodzaje izomerii;
izomeria geometryczna
izomeria optyczna
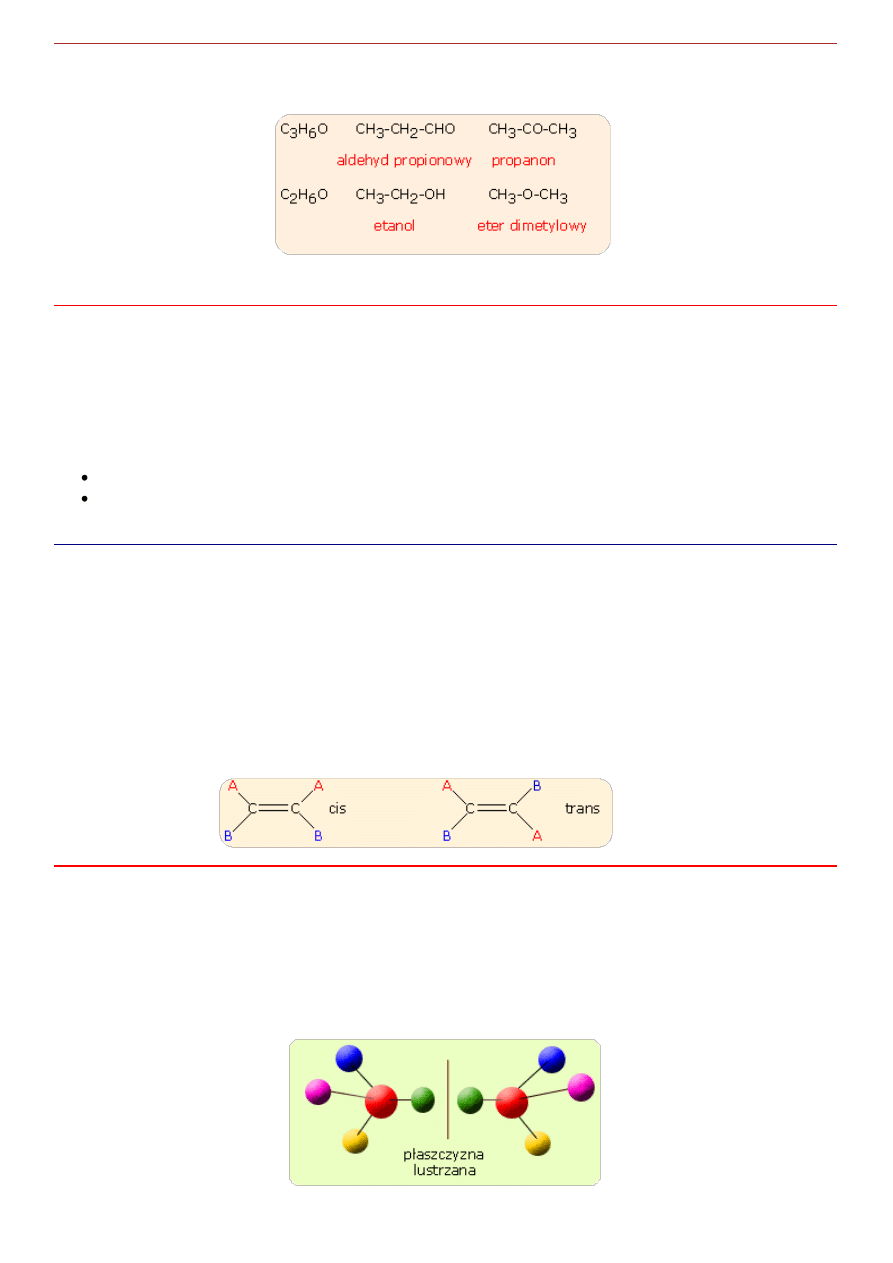
Izomeria geometryczna
Ten typ izomerii występuje wówczas, gdy w układzie przestrzennym cząsteczki zaznacza się określona
płaszczyzna.
Jeżeli wyróżnione grupy cząsteczki leżą po tej samej stronie płaszczyzny mamy do czynienia z izomerem
cis a jeżeli po przeciwnych stronach z izomerem trans.
Konfigurację izomerów geometrycznych rozróżnia się za pomocą nazw, które zawierają przedrostek cis- lub
-trans, co wskazuje na usytuowanie grup po tej samej lub po przeciwnej stronie cząsteczki. Patrz rysunek
Izomeria optyczna
Jest to rodzaj stereoizomerii występującej w cząsteczkach chiralnych, które zawierają atom węgla, do
którego przyłączone są cztery różne grupy. Taki atom nosi nazwę centrum chiralności.
A to oznacza, że dla każdej cząsteczki posiadającej centrum chiralności możemy znalezć drugą cząsteczkę
będącą jej lustrzanym odbiciem
Izomeria optyczna wiąże się ze zdolnością skręcania płaszczyzny światła spolaryzowanego. Substancje
takie nazywa się optycznie czynnymi; skręcające płaszczyznę światła spolaryzowanego w prawo - nazywa
się prawoskrętnymi /+/, a skręcajace w lewo -lewoskrętnymi /-/.
Związki skręcające płaszczyznę światła w prawo zaznacza się za pomocą symbolu (+) przed nazwą
związku, skręcające w lewwo symbolem (-). Na przykład - (+) - glukoza, (-) - fruktoza
Izomery bedące wzajemnymi odbiciami lustrzanymi noszą nazwę enacjomerów
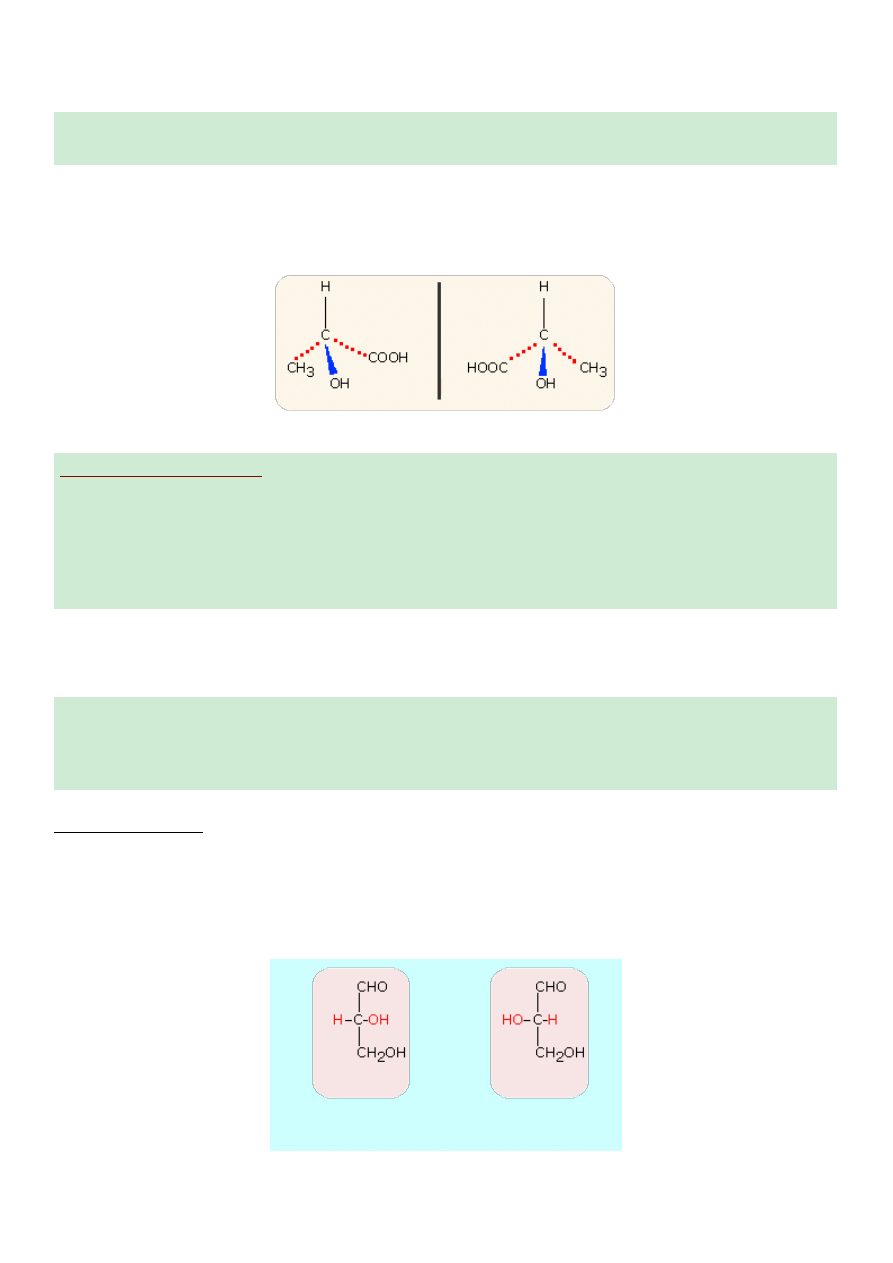
Przykład - kwas mlekowy
Właściwości enancjomerów
1. Enancjomery mają identyczne właściwości fizyczne z wyjątkiem kierunku skręcania płaszczyzny
polaryzacji światła
2. Enancjomery wykazują identyczne właściwości chemiczne; wyjątkiem jest ich zachowanie się w
stosunku do optycznie czynnych reagentów. Oznacza to, że jeżeli reagent jest optycznie czynny, jego
wpływ na oba enancjomery nie jest identyczny podczas ataku i dlatego szybkość reakcji jest różna - w
niektórych przypadkach tak dalece różna, że reakcja z jednym izomerem w ogóle nie zachodzi.
Równocząsteczkowa mieszanina enacjomerów nie wykazuje optycznej czynności i nosi nazwę mieszaniny
racemicznej
Odmiana racemiczna jest optycznie nieczynna. Jest wynikiem równoważenia skręcalności cząsteczki
jednego izomeru przez skręcalność cząsteczki drugiego izomeru.
W celu zaznaczenia racemicznego charakteru określonej próbki stosuje się znak (+/-), jak na przykład
kwas (+/-)-mlekowy.
Konfiguracja D- i L-
Często dla względnego charakteryzowania cząstek chiralnych wprowadzono pojęcie konfiguracji D- i L-, co
uwidocznione jest w nazwach związków. Na przykład - aldehyd D-glicerynowy, aldehyd L-glicerynowy
Punktem odniesienia dla konfiguracji D- i L- jest budowa cząsteczki aldehydu glicerynowego a konkretnie
położenie podstawników H- oraz HO- przy środkowym węglu.
D-aldehyd glicerynowy
L-aldehyd glicerynowy
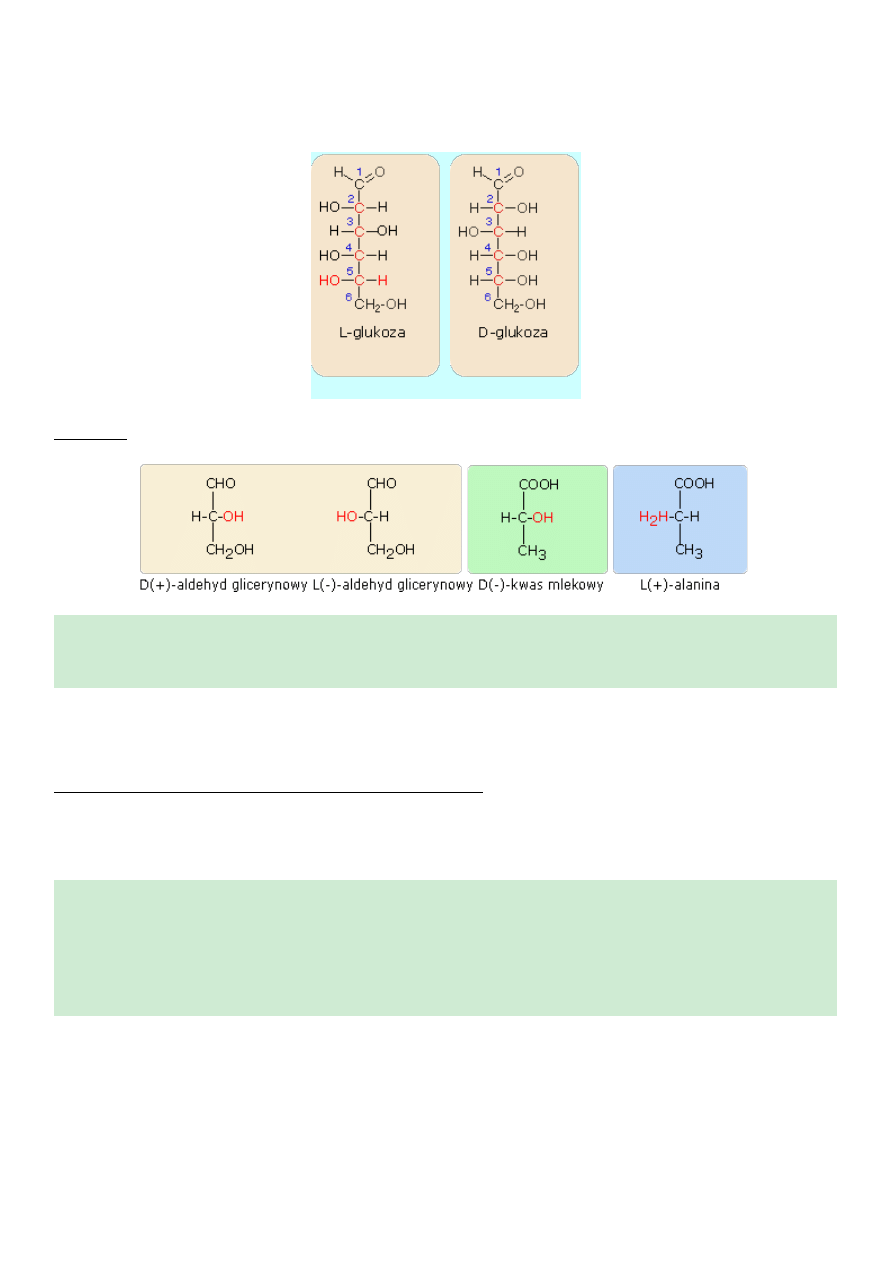
Najczęściej konfigurację D- i L- spotykamy w grupie cukrów. Jeżeli cząsteczki cukrów prostych swoją
budową nawiązuje do D-aldehydu glicerynowego, zaliczane są do szeregu D, natomiast te, których budowa
nawiązuje
do
L-aldehydu
glicerynowego,
zaliczane
są
do
szeregu
L.
Uporządkowanie na szeregi D i L następuje według konfiguracji podstawników, przy czym bierzemy pod
uwagę to centrum chiralności, które jest najbardziej oddalone od grupy karbonylowej.
L-Glukoza
D-glukoza
Przykłady konfiguracji D- i L-.
W prezentowanych przykładach w nazwie zaznaczono skręcalność optyczną i konfiguracją D- i L-
.Uzyskano tym sposobem pełniejszą nazwę optycznie czynnego związku chemicznego. Na przykład -
D(+) - aldehyd glicerynowy, L(-) - aldehyd glicerynowy.
Często zachodzi potrzeba opisania konfiguracji w sposób prostszy i wygodniejszy, niż rysowanie jej za
każdym razem. Najbardziej użyteczny sposób, obecnie zalecany, polega na stosowaniu symboli
R i S
.
Konfiguracja R (łac. rectus -prawy) i S (łac. sinister - lewy)
W celu odczytania konfiguracji na podstawie modelu lub wzoru, podstawnikom przy asymetrycznym
atomie trzeba najpierw przypisać numery od 1 do 4 według tzw. reguł pierwszeństwa.
Reguły pierwszeństwa podstawników
Reguła 1. Jeżeli wszystkie cztery atomy połączone z centrum chiralności są różne, to pierwszeństwo grup
zależy od liczb atomowych, przy czym priorytet ma atom o wiekszej liczbie atomowej. Jeżeli dwa atomy
są izotopami tego samego pierwiastka, to pierwszeństwo ma atom o większej liczbie masowej.
Reguła 2 Jeżeli nie można na podstawie reguły 1 ustalić wzglednego pierwszeństwa dwóch grup, to
należy przeprowadzic podobne porównanie następnych atomów w tych grupach.
Następnie spoglądamy na cząsteczkę w taki sposób, aby grupa o najniższym pierwszeństwie (4) była jak
najdalej od nas oddalona. Trzeba pamiętać, żeby asymetryczny atom węgla znajdował się bliżej obserwatora
niż podstawnik 4. Przy takim ustawieniu podstawniki 1, 2, 3 zwrócone są w stronę patrzącego i można
wyobrazić sobie, że układają się na okręgu. Jeżeli kolejność 1, 2, 3 jest zgodna z kierunkiem ruchu
wskazówek zegara, to taką konfigurację oznaczamy symbolem R a odwrotnej konfiguracji przypisujemy
symbol S. Na przykład dla bromochlorojodometanu konfiguracje przedstawiają się następująco.
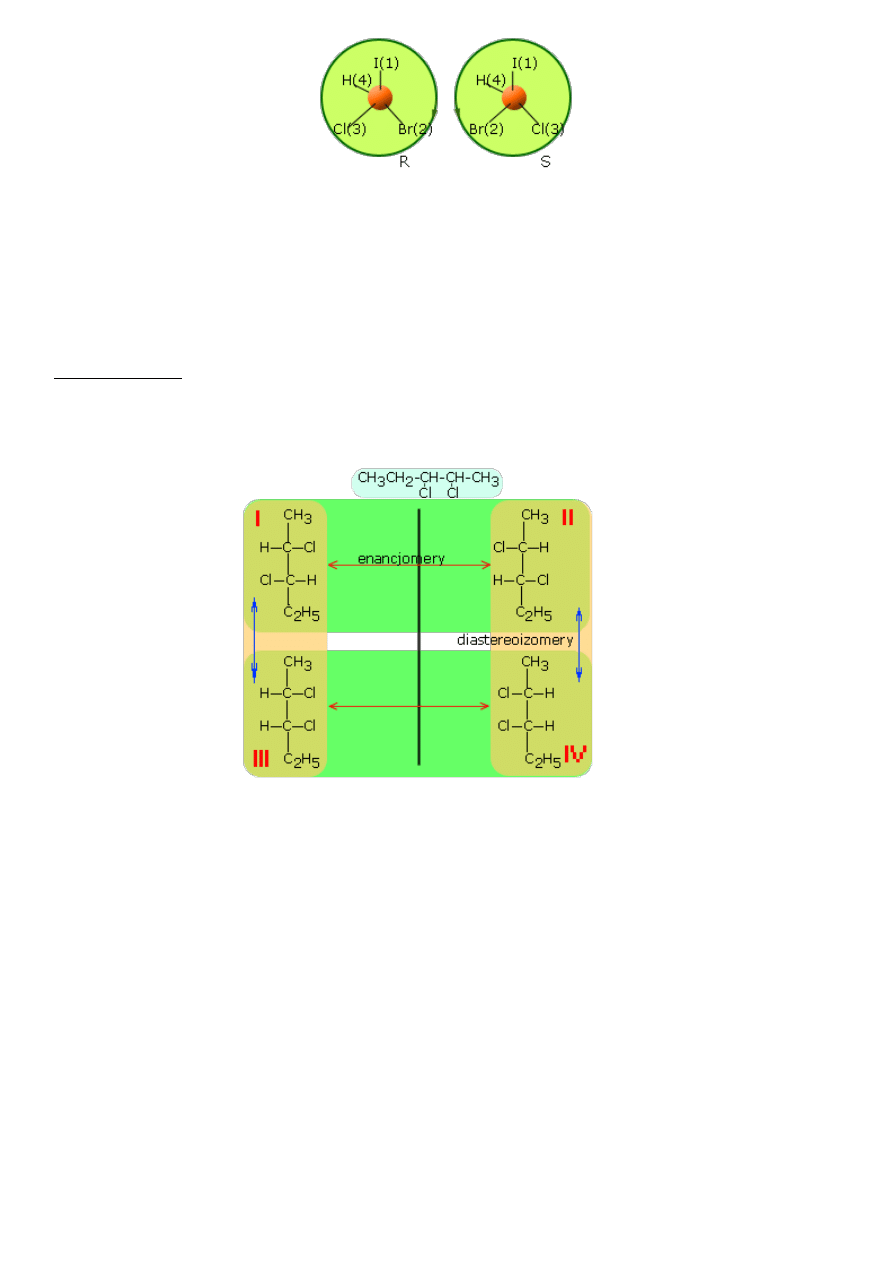
Dlaczego tak wygląda pierwszeństwo podstawników?
Ponieważ liczby atomowe Z podstawników
odpowiednio wynoszą I - 53, Br - 35, Cl - 17, H - 1. Prostym przykładem związku, który wymaga
stosowania reguły 2, jest optycznie czynny alkohol amylowy. Q związku tym przy asymetrycznym atomie
znajduje się atom wodoru, grupa metylowa - CH
3
, grupa etylowa - CH
2
CH
3
i hydroksymetylowa -CH
2
OH.
Wodór otrzymuje numer 4, ponieważ Z = 1. Z reguły 2 wynika, że grupa -CH
2
OH otrzymuje numer 1,
zawiera bowiem tlen o Z = 8, grupa -CH
2
CH
3
otrzymuje numer 2 (na drugiej pozycji znajduje się węgiel o Z
= 6) a grupa -CH
3
numer 4.
Diastereoizomery
Istnieje grupa związków chemicznych, która zawiera więcej jak jedno centrum chiralności. W tej grupie
związków chemicznych obok już wcześniej zdefiniowanych enacjomerów spotykamy się z izomerami nie
będące wzajemnymi lustrzanymi odbiciami. Noszą one nazwę diastereoizomerów.
W przedstawionym przykładzie struktury I i II oraz III i IV są enancjomerami, natomiast struktura III jest
diastereoizomerem zarówno związku I, jak i związku II oraz struktura IV jest diastereoizomerem związków
I i II.
Rozpatrując poniższy przykład (2,3-dichlorobutan), widzimy, że cząsteczka zawiera dwa centra chiralności.
Struktury I i II są enacjomerami (nie można na siebie nałożyć), natomiast struktury III i IV mimo że
posiadają centra chralności możemy na siebie nałożyć (wystarczy strukturę III obrócić o 180
o
, a pokryje się
ona całkowicie ze strukturą IV).
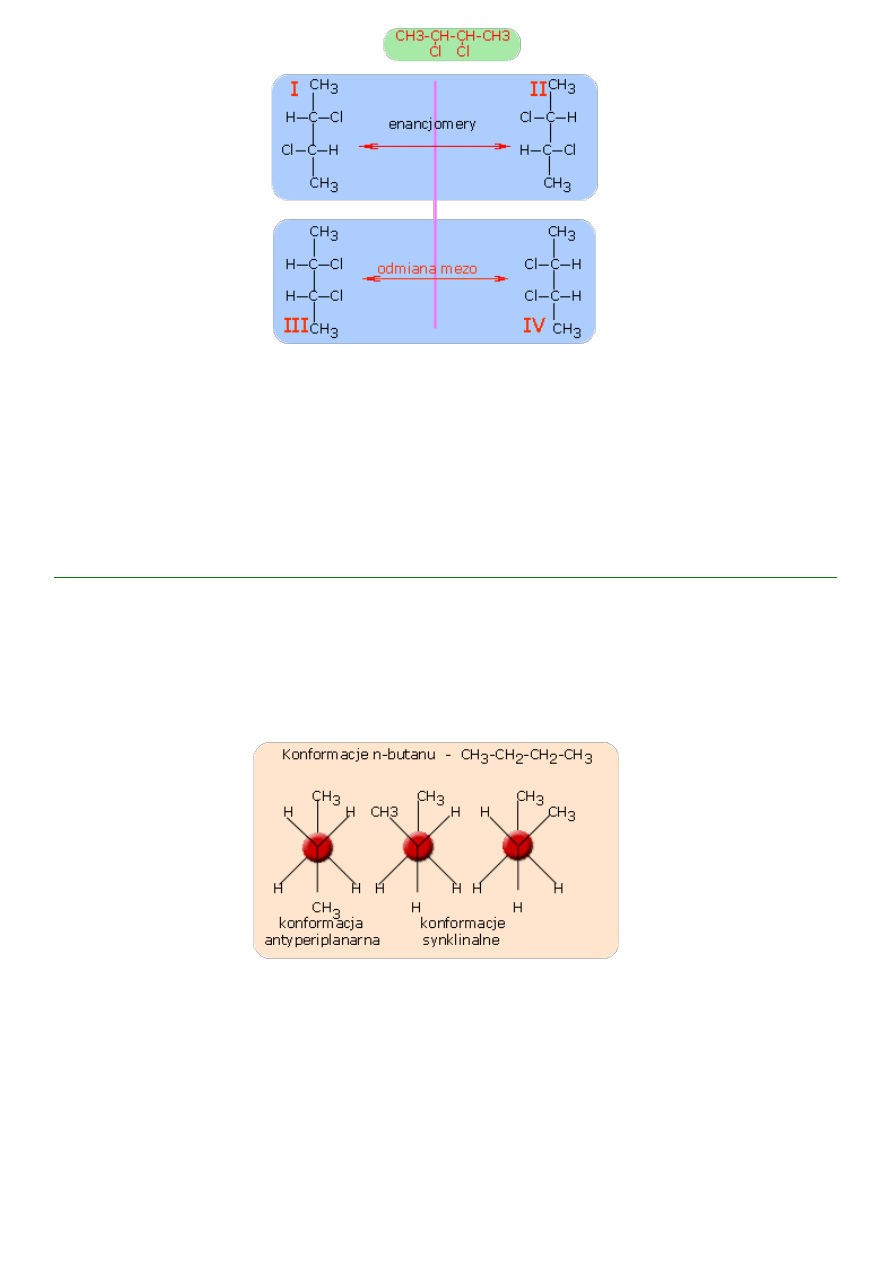
W przykładzie mamy tylko trzy struktury stereoizomeryczne, tj. I, II i III.
Związki chemiczne
, którego cząsteczki dają się nałożyć na swoje odbicia lustrzane, mimo iż zawierają centra
chiralności noszą nazwę
mezo
.
W zależności od ilości asymetrycznych atomów węgla (n), ilość izomerów optycznie czynnych
(enancjomerów) obliczamy ze wzoru 2
n
.
Przykładowo czasteczki o dwóch asymetrycznych atomach węgla dają cztery izomery optycznie czynne.
Izomery konformacyjne
Izomery konformacyjne
to stereoizomery różniące się między sobą rozmieszczeniem atomów w przestrzeni.
Różne
konformacje
powstają przez obrót poszczególnych części cząsteczki wokół wiązań pojedyńczych i
geometrycznie nie przystają do siebie (patrz przykład)
Konformacje różnią się tylko stanem energetycznym gdzie najkorzystniejszą jest konformacja najuboższa
energetycznie.
Konformacja ma znaczenie dla cząsteczek alkanów oraz ich pochodnych.
Wyszukiwarka
Podobne podstrony:
Izomeria 4 id 221207 Nieznany
Izomeria[1] id 221209 Nieznany
Izomeria optyczna id 221213 Nieznany
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
więcej podobnych podstron