
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.

ALDEHYDY
I
KETONY

Grupa karbonylowa
Aldehydy i ketony
Aldehydy
Nazewnictwo
Otrzymywanie
Właściwości chemiczne
Aldehydy nienasycone
Aldehydy aromatyczne
Ketony
Nazewnictwo
Otrzymywanie
Właściwości chemiczne
Właściwości fizyczne i zastosowanie aldehydów i
ketonów
Podsumowanie
Dla dociekliwych
Spis treści
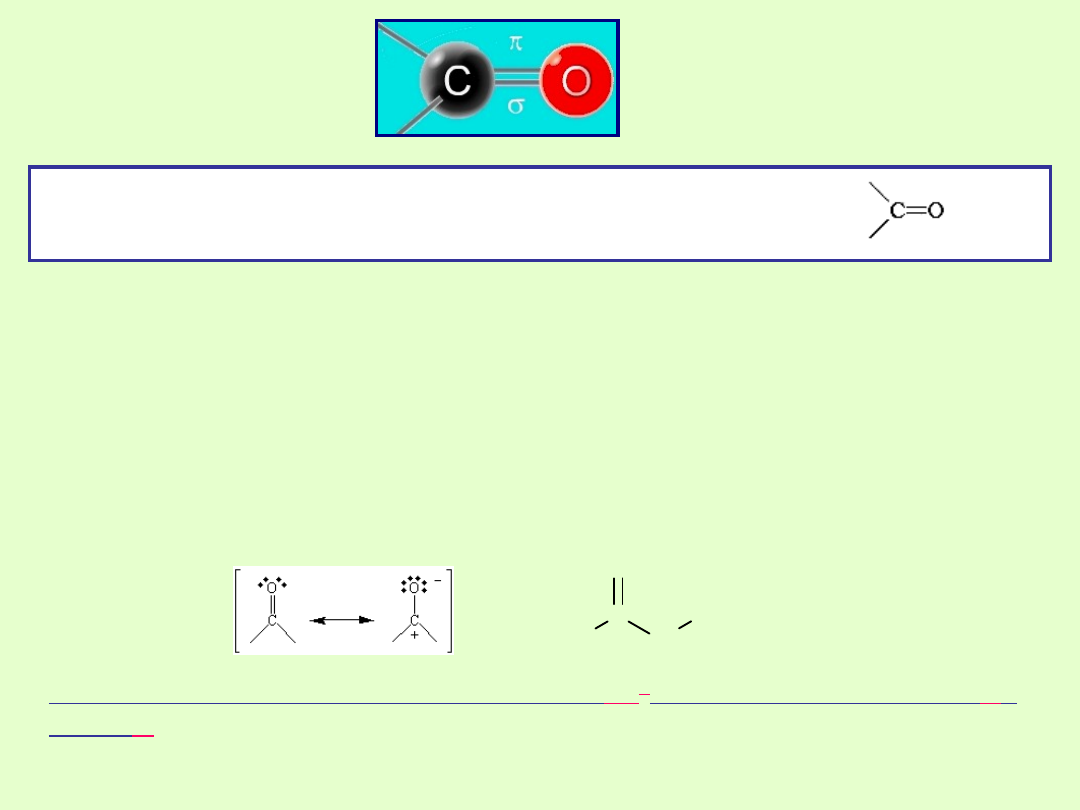
Grupa
karbonylowa
Grupa karbonylowa jest pod względem geometrycznym podobna do
podwójnego wiązania C=C. Wokół atomu C o hybrydyzacji sp
2
rozmieszczone są 3 podstawniki. Ułożone są one w jednej płaszczyźnie,
a kąt pomiędzy nimi przyjmuje wartość zbliżoną do 120
o
.
Wiązanie C=O jest krótsze niż C=C (1,22 Å i 1,43Å) i znacznie
silniejsze, co nie oznacza mniej reaktywne. Wiązanie karbonylowe jest
mocniej spolaryzowane, co rzutuje na wysoką reaktywność. Na atomie
tlenu gromadzi się duży cząsteczkowy ładunek ujemny, a na
karbonylowym atomie węgla cząsteczkowy ładunek dodatni.
Karbonylowy atom węgla o hybrydyzacji
sp
2
tworzy 3 wiązania typu
σ
i
jedno
π
Grupa karbonylowa jest grupą funkcyjną dwóch ważnych związków:
aldehydów i ketonów.
CH
3
CH
2
C
O
CH
3
Grupa karbonylowa to grupa funkcyjna, w której atom tlenu
połączony jest z atomem węgla podwójnym wiązaniem
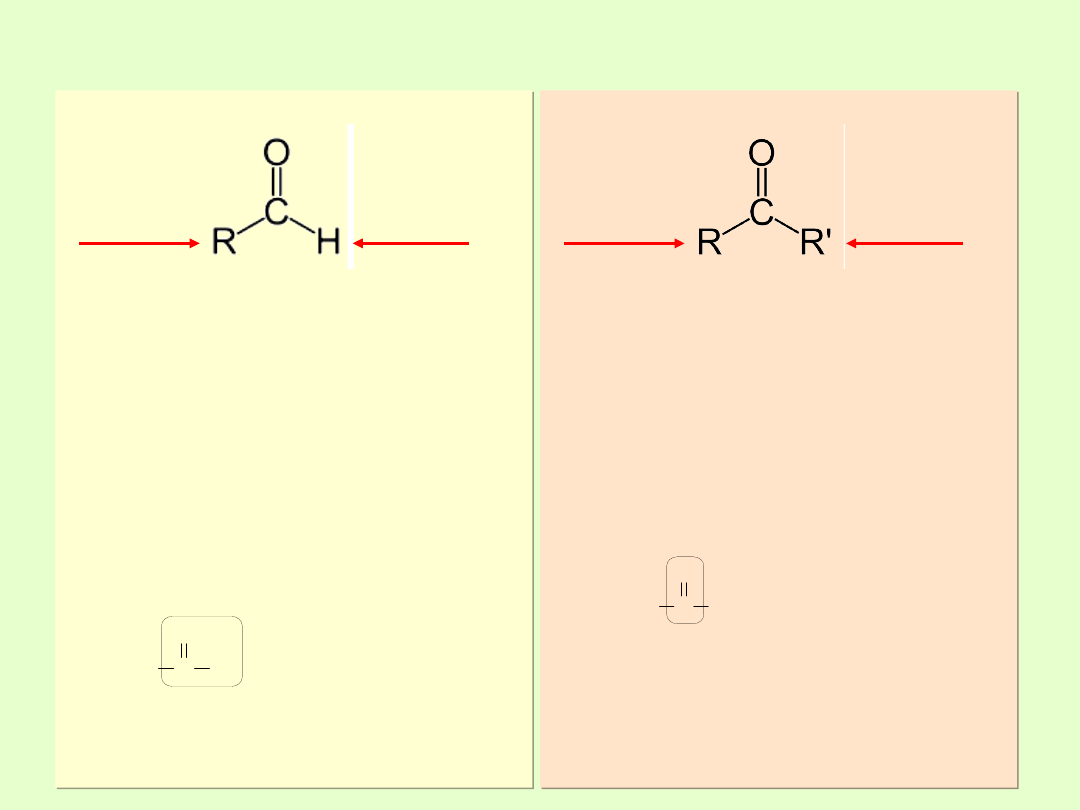
Aldehydy i ketony
ALDEHYDY
Aldehydy są to związki organiczne,
w cząsteczkach których grupa
karbonylowa połączona jest
jednym wiązaniem pojedynczym z
atomem wodoru, a drugim z resztą
węglowodorową cząsteczki.
W aldehydach grupa C=O
występuje na końcu łańcucha
węglowego, łączy się z nim
pojedynczym wiązaniem
C–C, czwarte wiązanie jest
wysycone atomem wodoru.
W metanalu wyjątkowo grupa
karbonylowa połączona jest z dwoma
atomami wodoru
ALDEHYDY
Aldehydy są to związki organiczne,
w cząsteczkach których grupa
karbonylowa połączona jest
jednym wiązaniem pojedynczym z
atomem wodoru, a drugim z resztą
węglowodorową cząsteczki.
W aldehydach grupa C=O
występuje na końcu łańcucha
węglowego, łączy się z nim
pojedynczym wiązaniem
C–C, czwarte wiązanie jest
wysycone atomem wodoru.
W metanalu wyjątkowo grupa
karbonylowa połączona jest z dwoma
atomami wodoru
KETONY
Ketony to związki organiczne
zawierające grupę karbonylową,
która jest połączona z dwiema
grupami węglowodorowymi.
W ketonach grupa C=O
występuje wewnątrz łańcucha
węglowego cząsteczek, atom
węgla grupy karbonylowej jest
drugorzędowy.
KETONY
Ketony to związki organiczne
zawierające grupę karbonylową,
która jest połączona z dwiema
grupami węglowodorowymi.
W ketonach grupa C=O
występuje wewnątrz łańcucha
węglowego cząsteczek, atom
węgla grupy karbonylowej jest
drugorzędowy.
grupa aldehydowa
C
O
H
R
grupa karbonylowa
C
O
R
R
Rodnik
alkilowy
lub
arylowy
Atom
wodoru
Rodnik
alkilowy
lub
arylowy
Rodnik
alkilowy
lub
arylowy
ALDEHYDY
Grupa aldehydowa
Najprostszy aldehyd
Aldehyd alifatyczny
Aldehyd aromatyczny
Aldehyd cykliczny
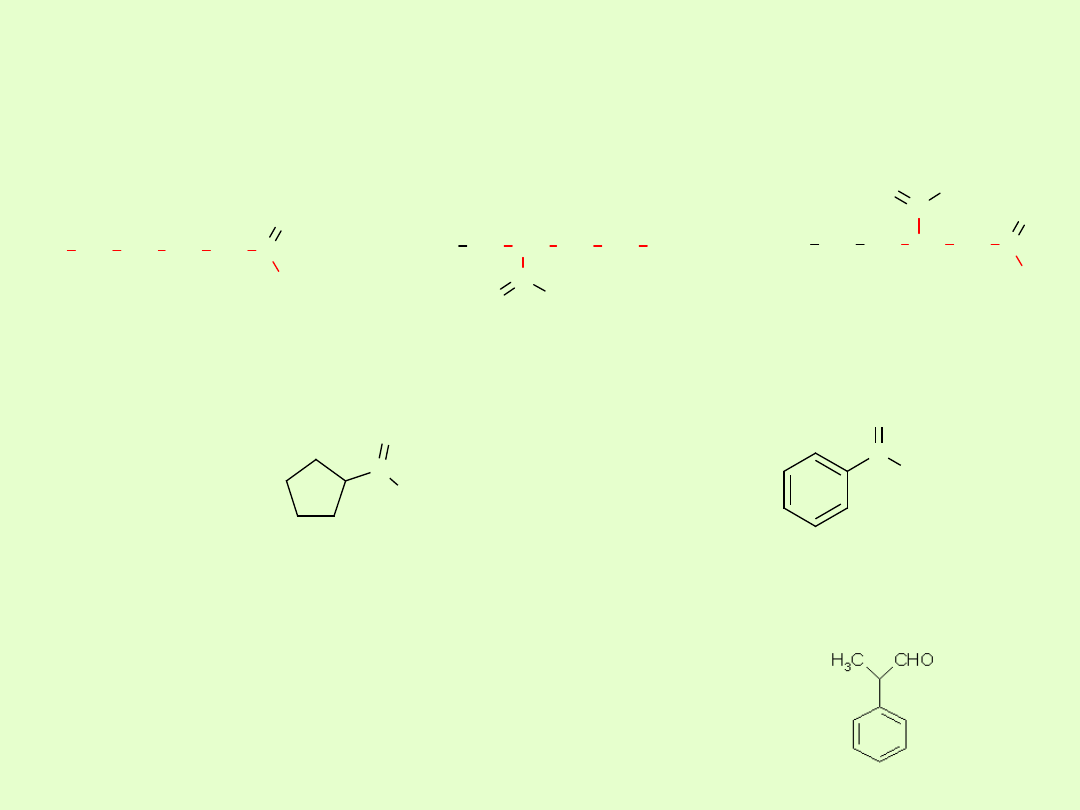
W przypadku aldehydów cyklicznych i aromatycznych, stosuje się
przyrostek
-karboaldehyd:
Nazwę aldehydu alifatycznego tworzy się od nazwy odpowiedniego
alkanu, do której dodaje się przyrostek
-al
. Łańcuch macierzysty musi
zawierać grupę —CHO i atom węgla tej grupy numeruje się jako C1.
CH
3
CH
2
CH
2
CH
2
CH
2
C
H
O
CH
3
CH
2
CH CH
2
CH
2
CH
3
C
O
H
CH
3
CH
2
CH
2
CH CH
2
C
H
O
C
H
O
heksanal
2-etylopentanal
2-propylobutanodial
Nazewnictwo
Jeżeli grupa aldehydowa znajduje się w łańcuchu bocznym pierścienia,
to pierścień uważa się za podstawnik, a nazwę tworzy się tak jak w
przypadku aldehydów acyklicznych np.:
cyklopentanokarboaldehyd
benzenokarbaldeh
yd
C
H
O
C
H
O
2-fenylopropanal
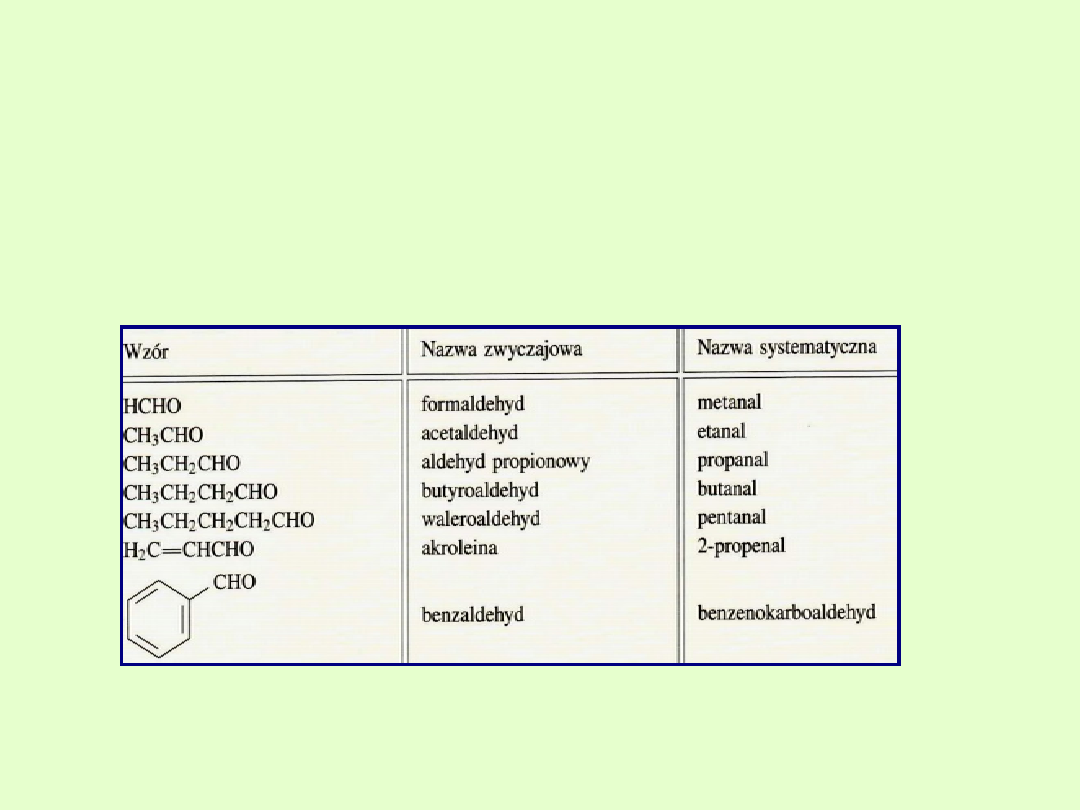
Niektóre proste i dobrze znane aldehydy zachowały swoje nazwy
zwyczajowe, które zostały uznane przez IUPAC.
Nazwy zwyczajowe aldehydów pochodzą od nazw zwyczajowych
odpowiednich kwasów karboksylowych, w których słowo "kwas"
zastąpiono słowem "aldehyd", np. aldehyd mrówkowy, aldehyd octowy
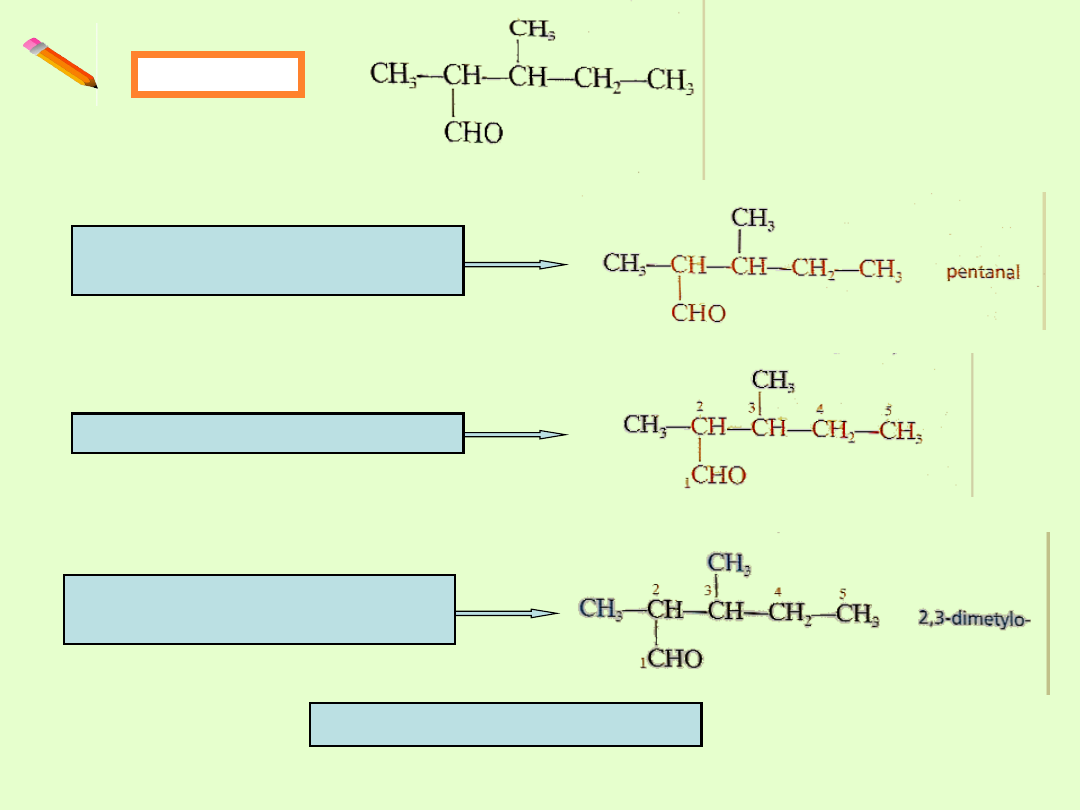
Przykład
Wybór głównego łańcucha
węglowego.
Ponumerowanie atomów C
Nazwanie i określenie
położenia podstawników
2,3 - dimetylopentanal
Szereg homologiczny
metanal - HCHO - aldehyd mrówkowy, formaldehyd
etanal - CH
3
CHO - aldehyd octowy, acetaldehyd
propanal - CH
3
–CH
2
–CHO - aldehyd propionowy
butanal - CH
3
–CH
2
–CH
2
–CHO - aldehyd masłowy
pentanal - CH
3
–CH
2
–CH
2
–CH
2
–CHO - aldehyd
walerianowy
Szereg homologiczny
metanal - HCHO - aldehyd mrówkowy, formaldehyd
etanal - CH
3
CHO - aldehyd octowy, acetaldehyd
propanal - CH
3
–CH
2
–CHO - aldehyd propionowy
butanal - CH
3
–CH
2
–CH
2
–CHO - aldehyd masłowy
pentanal - CH
3
–CH
2
–CH
2
–CH
2
–CHO - aldehyd
walerianowy
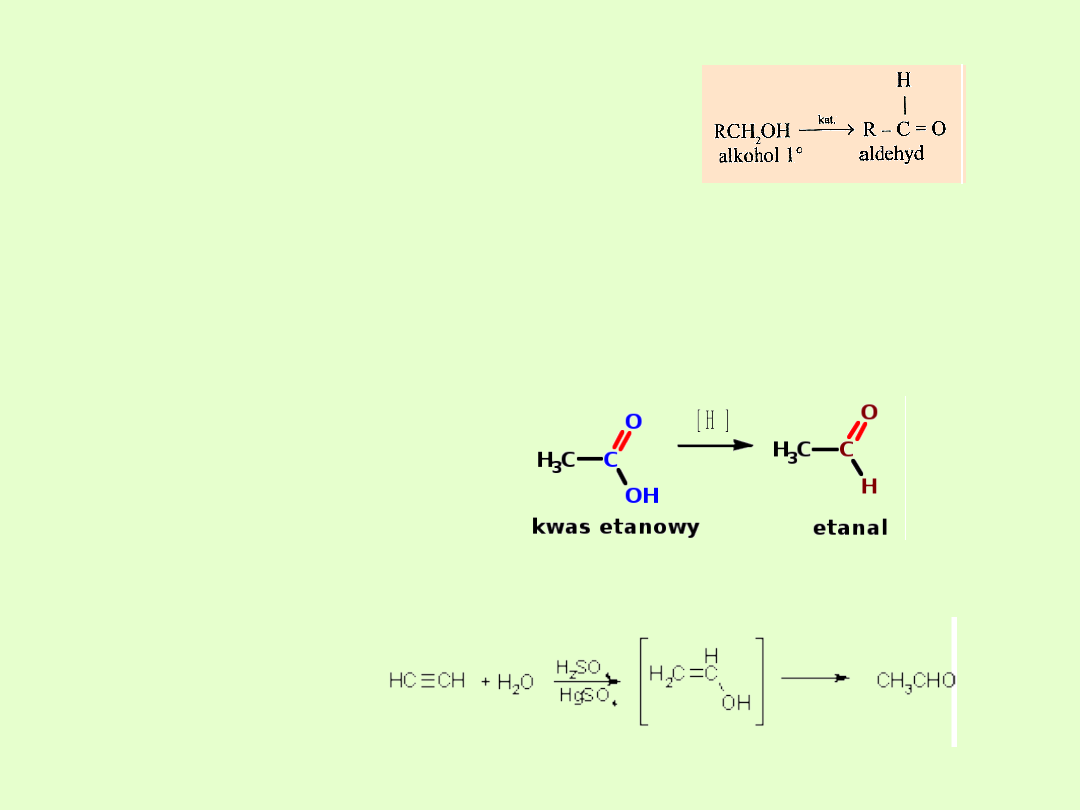
Otrzymywanie aldehydów
A) Utlenianie alkoholi I-rzędowych
O
7H
2Cr
3RCHO
8H
O
Cr
OH
CH
3R
2
3
2
7
2
2
B) Odwodornienie alkoholi I -
rzędowych
2
Pd
T
2
H
RCOH
OH
CH
R
C) Redukcja chlorków kwasowych
Specjalne metody otrzymywania metanalu i etanalu ( metoda
przemysłowa)
O
H
HCHO
O
CH
2
450C
p
2
4
rCHO)
RCHO(lub_A
ArCOCl)
RCOCl(lub_
kat
D) Redukcja kwasów
karboksylowych
[H] – oznacza czynnik redukujący
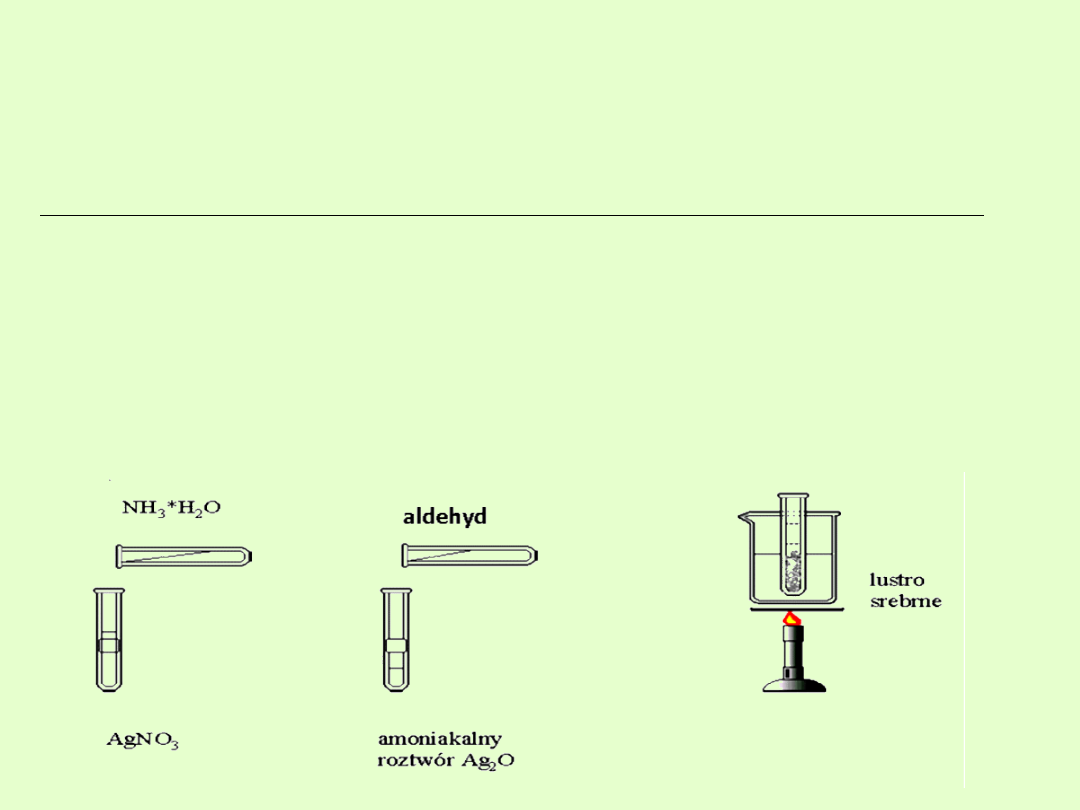
Właściwości chemiczne
A. Właściwości redukujące (reakcje utleniania do kwasów
karboksylowych)
Aldehydy bardzo łatwo ulegają utlenieniu do kwasów karboksylowych.
Reakcje rozpoznawcze:
Próba Tollensa
(próba lustra srebrowego)
Polega na działaniu na aldehyd amoniakalnym roztworem tlenku srebra.
Do jego sporządzenia używa się azotanu (V) srebra, wodorotlenku sodu
oraz amoniaku (tworzy się złożony związek kompleksowy).
W wyniku procesu redoks powstaje odpowiedni kwas oraz metaliczne
srebro, które pokrywa cienką warstwą ścianki naczynia, stąd reakcję
tą nazywa się próbą lustra srebrnego.
2 [Ag(NH
3
)
2
]OH + CH
3
CHO ---> CH
3
COOH + 2 Ag + 4 NH
3
+ H
2
O
+ Ag2O
kwas octowy
/kwas karboksylowy/
etanal
/aldehyd/
+ 2 Ag
C
H
3
C
O
H
NH3
C
H
3
C
O
OH
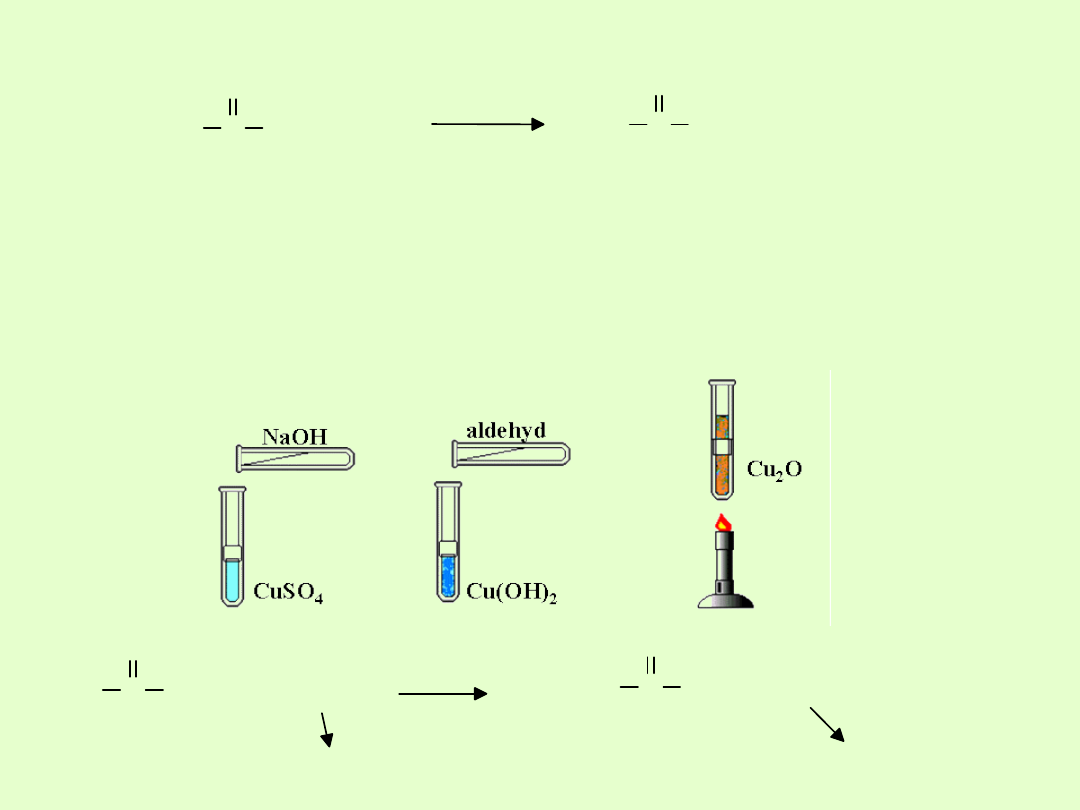
Próba Trommera
Polega na ogrzewaniu aldehydu z roztworem wodorotlenku miedzi
(II) w środowisku zasadowym. Przed przeprowadzeniem reakcji ten
ostatni należy otrzymać „na świeżo”, np. z chlorku miedzi i
wodorotlenku sodu – wytrąca się wówczas niebieski, galaretowaty
osad.
+ 2 Cu(OH)2
+ Cu2O + 2 H2O
granatowy osad
ceglasty osad
kwas octowy
/kwas karboksylowy/
etanal
/aldehyd/
C
H
3
C
O
H
C
H
3
C
O
OH
T.
B. Reakcja uwodornienia - reakcja redukcji do alkoholi.
kat.
p. T.
etanal
/aldehyd/
etanol
/alkohol I-rzędowy/
C
H
3
C
H
O
+ H2
C
H
3
CH
2
OH
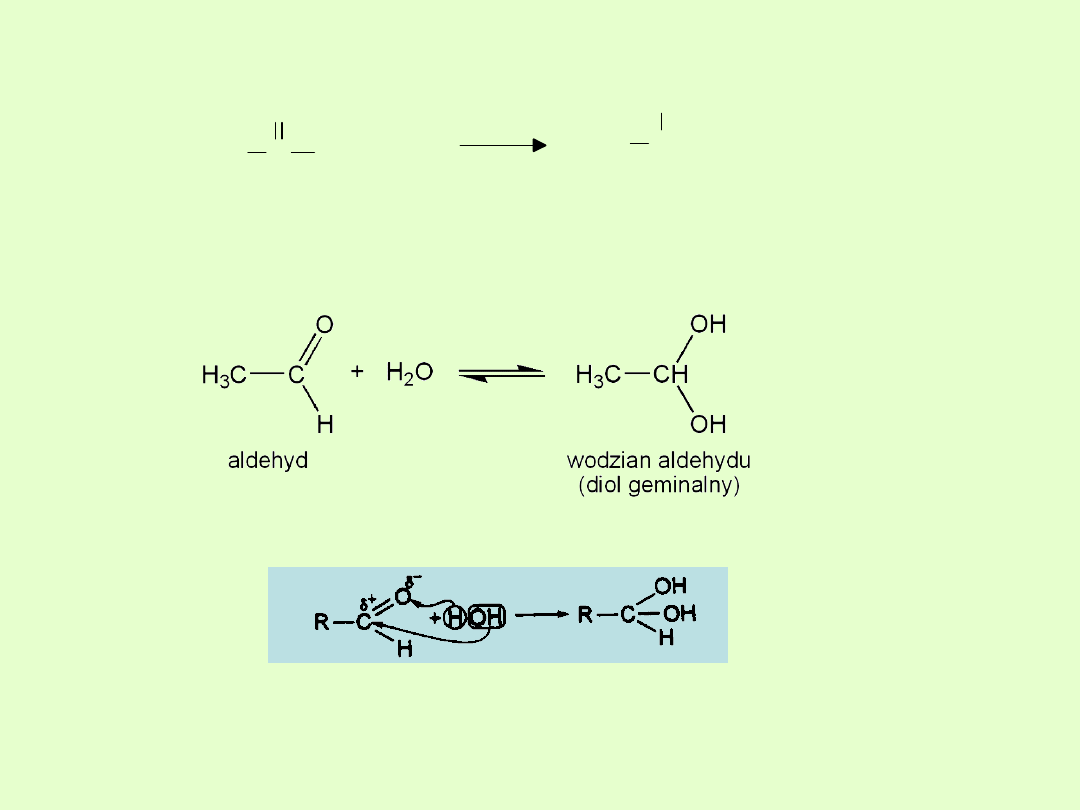
C. Reakcja przyłączania wody
Przyłączają wodę tworząc nietrwałe wodziany.
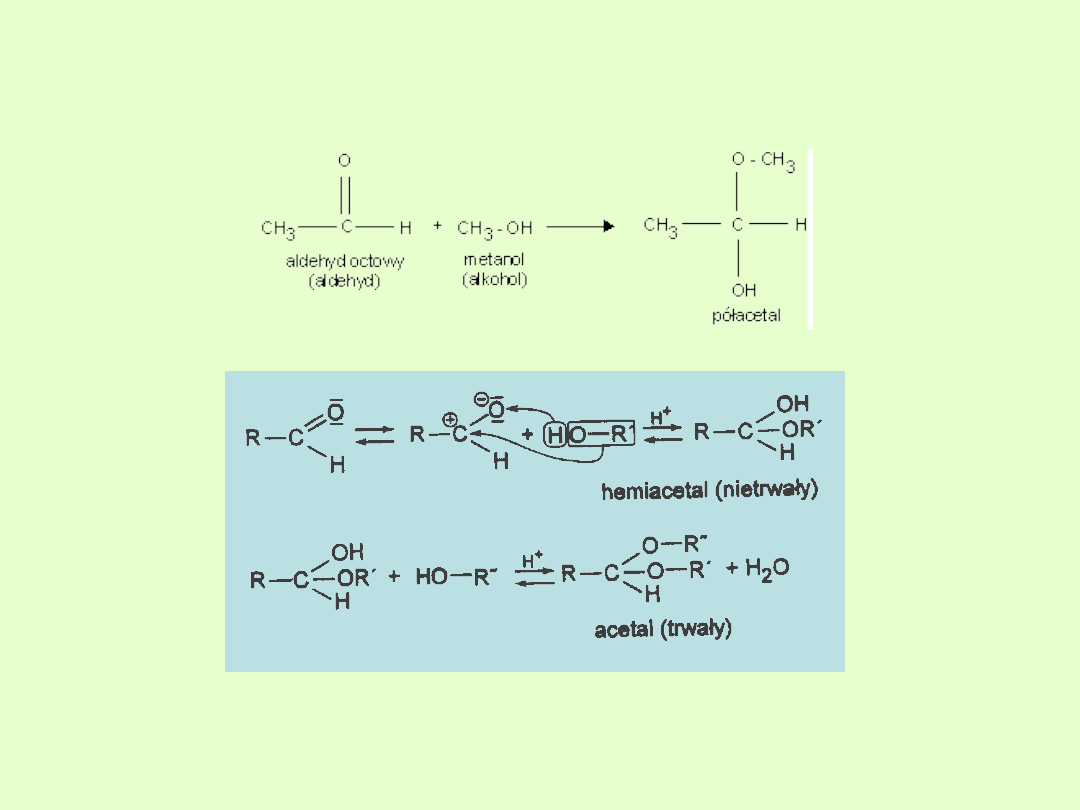
D. Reakcja z alkoholem
Reakcja z alkoholami prowadzi do powstania półacetali i acetali.
E. Polimeryzacja aldehydów
Ulegają jej najprostsze aldehydy (np. aldehyd mrówkowy daje
poliformaldehyd; przez ogrzanie poliformaldehydu możemy ponownie
otrzymać aldehyd mrówkowy )
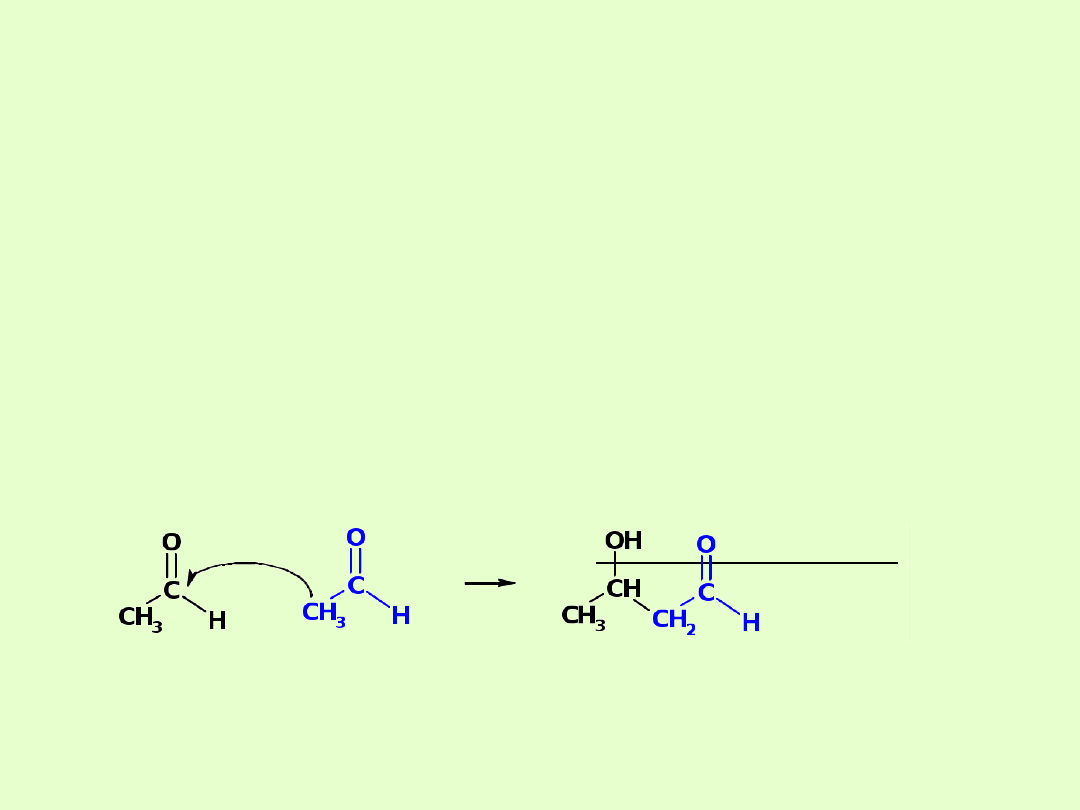
F. Kondensacja aldolowa
Jest to reakcja chemiczna powstawania aldolu, czyli aldehydu z grupą
hydroksylową (aldehydoalkoholu) z dwóch aldehydów, z których jeden
musi posiadać przynajmniej jeden atom wodoru przy atomie węgla α
( atom bezpośrednio związany z grupą CHO). Powstające aldole to tzw. β-
aldole (albo 3-aldole), bo grupa hydroksylowa znajduje się przy trzecim
atomie węgla, licząc od grupy aldehydowej -CHO. Produkt reakcji
najczęściej łatwo ulega dehydratacji z wytworzeniem wiązania
podwójnego. W szczególnym wypadku dwa substraty mogą stanowić ten
sam związek - reakcję nazywa się wtedy dimeryzacją aldolową.
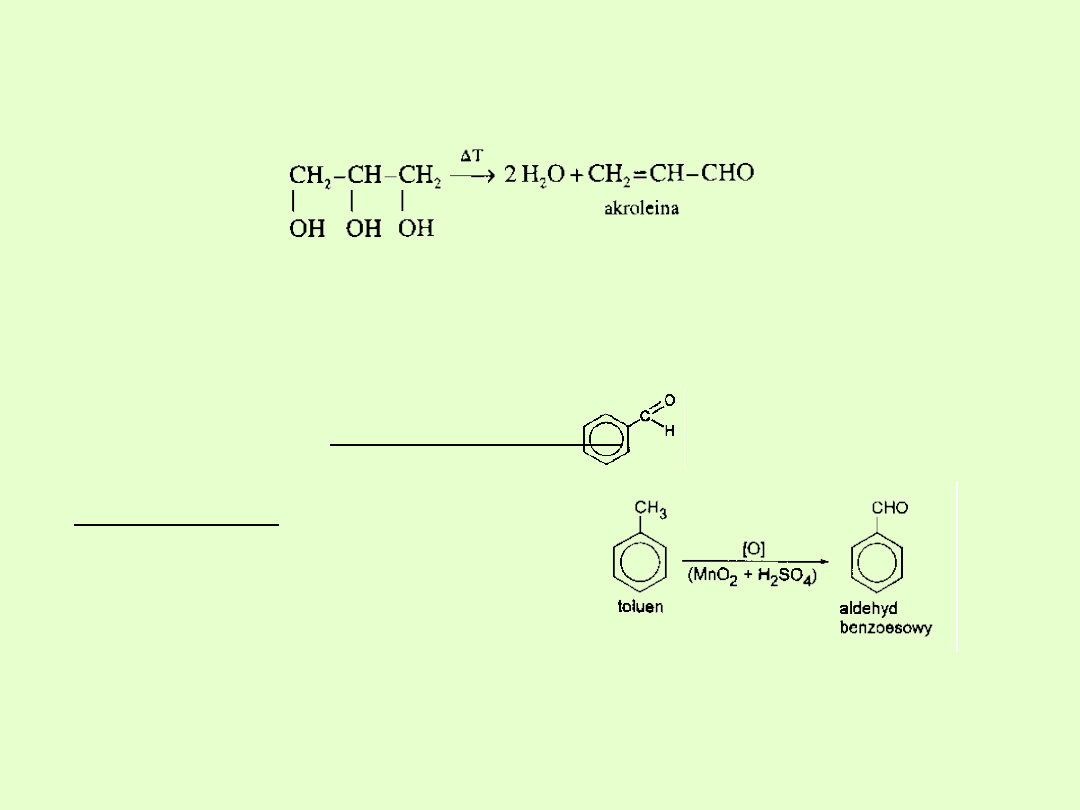
Aldehydy nienasycone
Przedstawicielem tego szeregu homologicznego jest akroleina
(aldehyd akrylowy, propenal, którą otrzymuje się przez
odwodornienie gliceryny:
Aldehydy aromatyczne
Do aldehydów aromatycznych należą związki, które zawierają grupę –
CHO w pierścieniu aromatycznym.
Najprostszy z nich to aldehyd benzoesowy:
Otrzymywanie:
Działanie słabych środków
utleniających na toluen
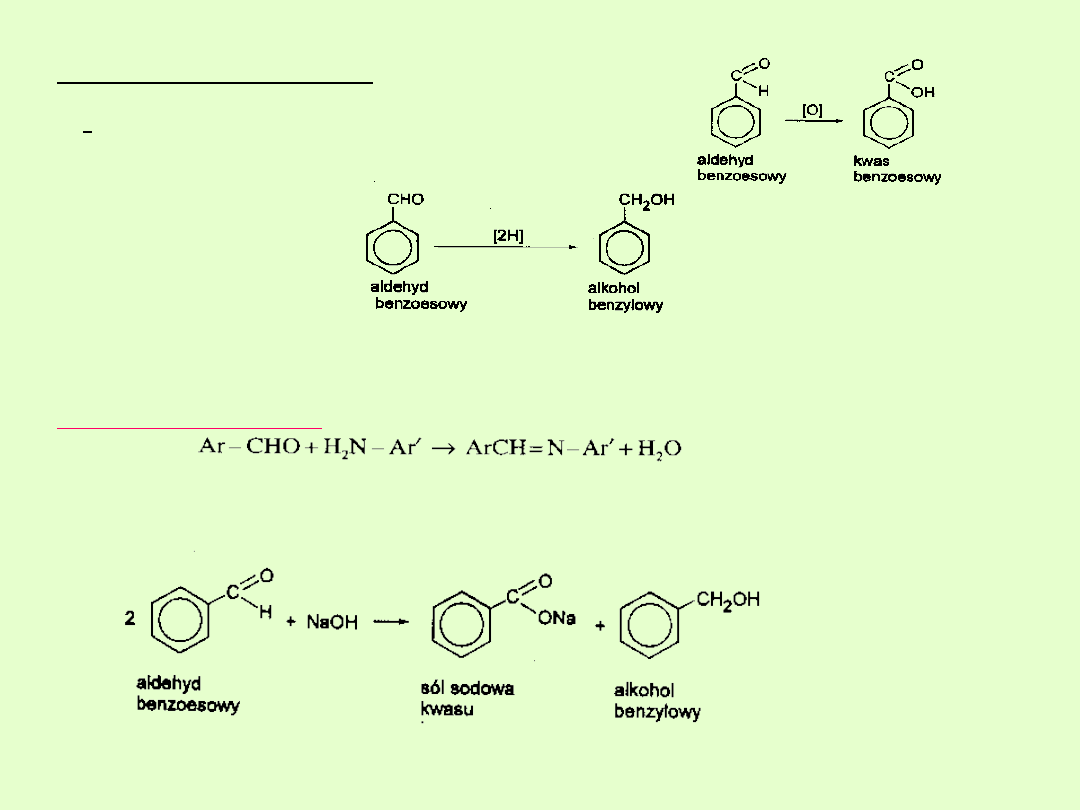
Właściwości chemiczne
1. Reakcje utleniania
( łatwiej zachodzą niż dla aldehydów
alifatycznych).
2. Reakcje redukcji
3. Reakcje z aminami
Produkty reakcji aldehydów z aminami I rzędowymi zwane są
zasadami Schiffa.
Reakcja Canizzaro ( patrz slajd „Dla dociekliwych”)
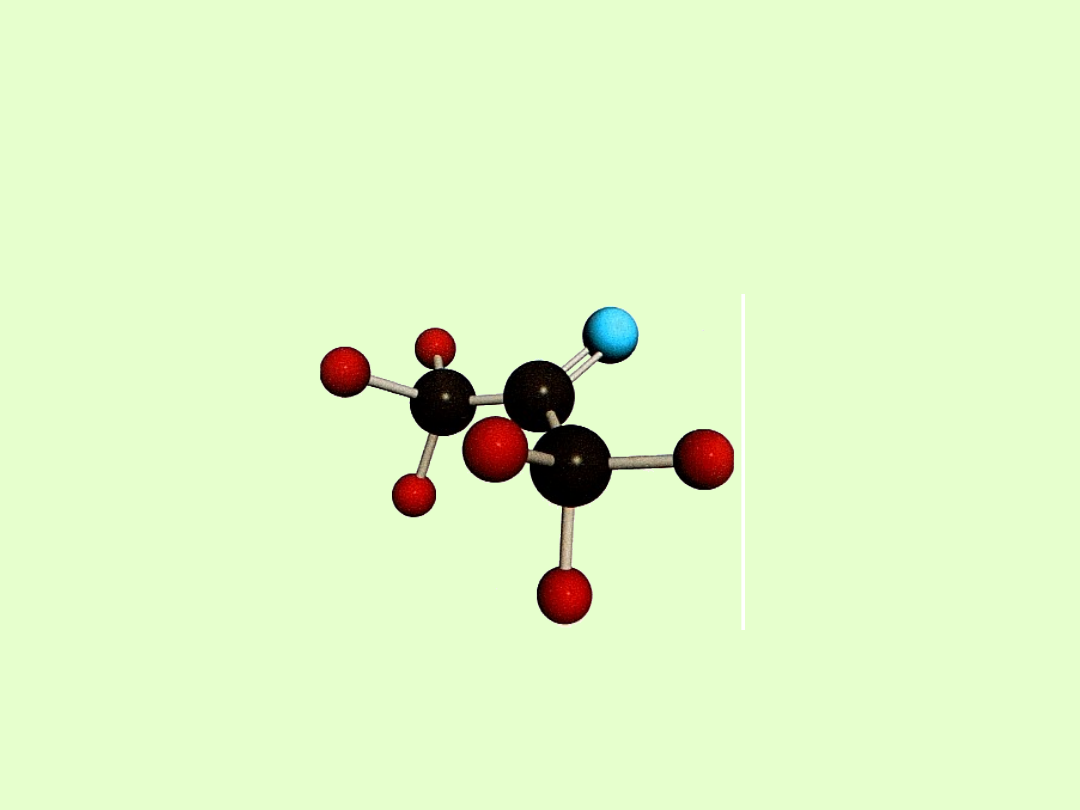
KETONY
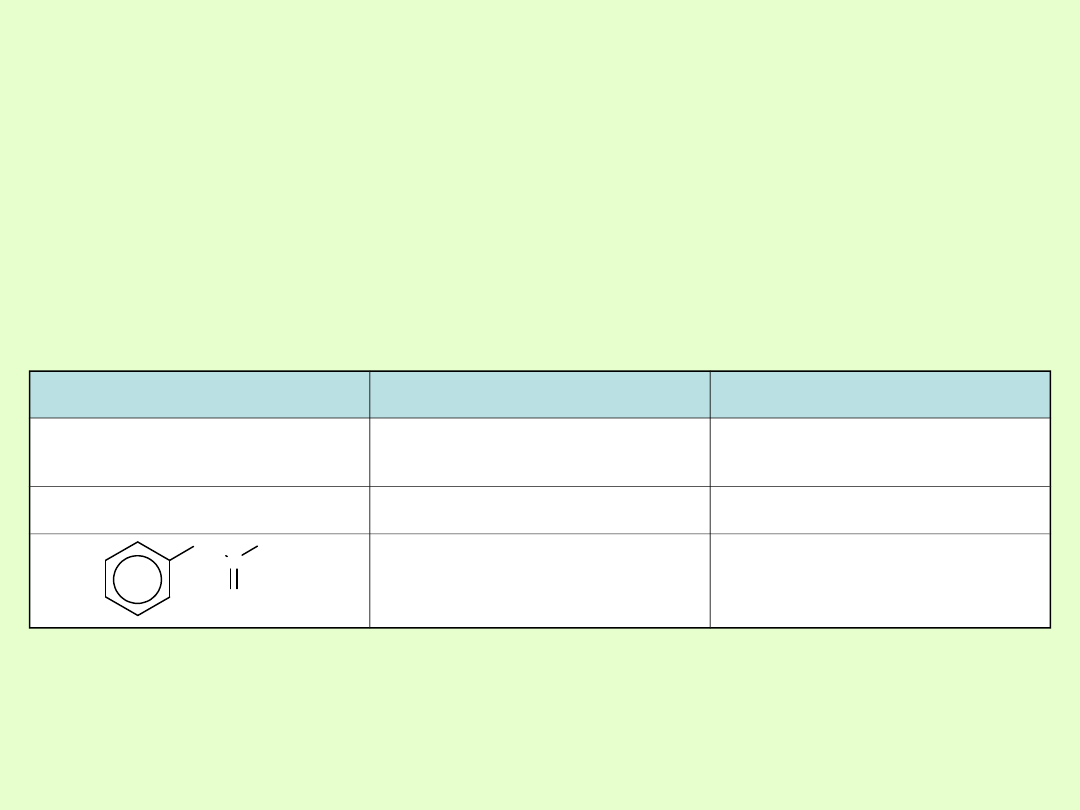
Nazewnictwo
W nazwie systematycznej przyjmuje się nazwę najdłuższego łańcucha
węglowodorowego zawierającego grupę karbonylową i dodaje
końcówkę -
on
oraz określa położenie grupy karbonylowej.
Zwyczajowe nazwy prostych ketonów tworzy się dodając do wyrazu
keton nazwy obu podstawników połączonych z grupą karbonylową, np.
keton dimetylowy CH
3
COCH
3
.
Ketony, w których grupa karbonylowa związana jest bezpośrednio z
pierścieniem benzenowym nazywane są alkilofenonami
Wzór
Nazwa systematyczna
Nazwa zwyczajowa
CH
3
COCH
3
propanon
keton dimetylowy
(aceton)
CH
3
CH
2
CH
2
COCH
3
pentan-2-on
keton metylowopropylowy
1-fenylopropan-2-on
benzylometyloketon
CH
3
C
O
CH
2
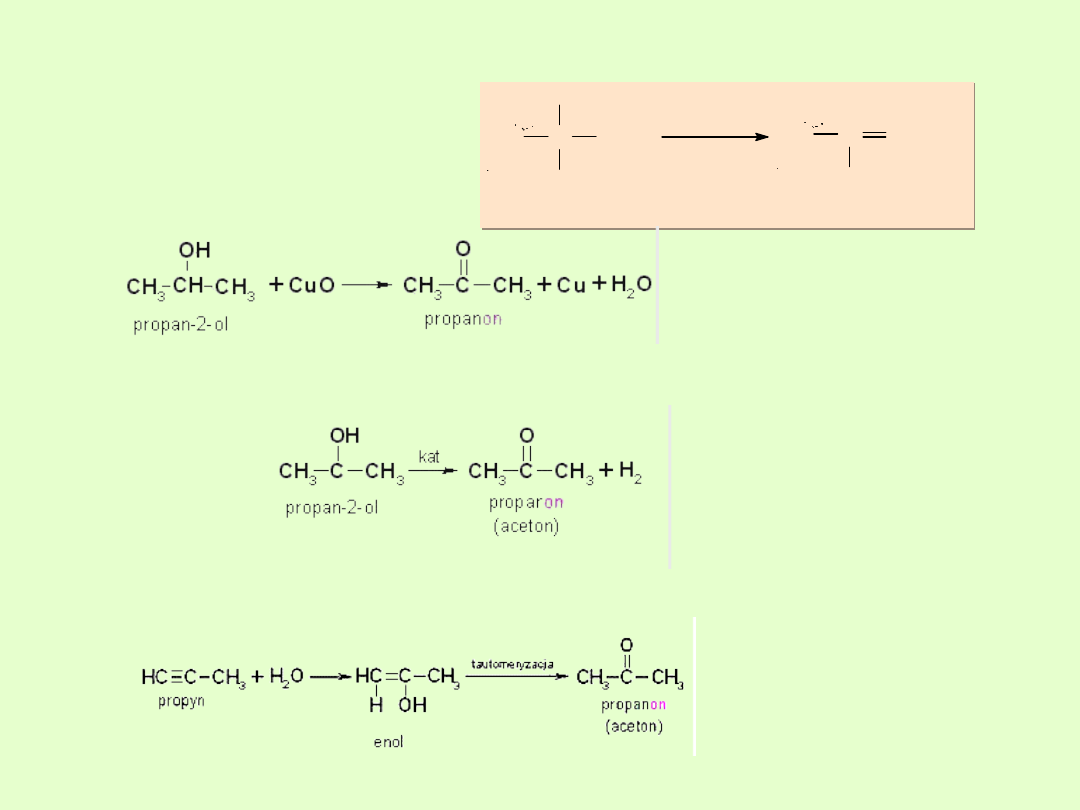
Otrzymywanie ketonów
A. Utlenianie alkoholi II rzędowych
B. Odwodornienie alkoholi II rzędowych
C. Addycja wody do alkinów ( wyjątek acetylen)
Rys. 2b.
alkohol II-rzedowy
utlenianie
C
OH
H
keton
R
1
R
2
R
2
C
O
R
1
Rys. 2b.
alkohol II-rzedowy
utlenianie
C
OH
H
keton
R
1
R
2
R
2
C
O
R
1
A. Utlenianie
Ketony są odporne na działanie łagodnych utleniaczy. Nie ulegają one
próbie Trommera ani próbie Tollensa.
Dopiero pod wpływem silnych utleniaczy w cząsteczkach ketonów
następuje rozerwanie wiązania węgiel – węgiel przy grupie
karbonylowej i powstanie mieszaniny kwasów karboksylowych o
krótszych łańcuchach.
dimetyloketon
propan-2-
ol
Rys. 5a.
Ni lub Pt
H2
O
CH
OH
C
3
H
C
CH
3
CH
3
CH
3
B. Reakcja redukcji
do alkoholi II
rzędowych
Właściwości chemiczne
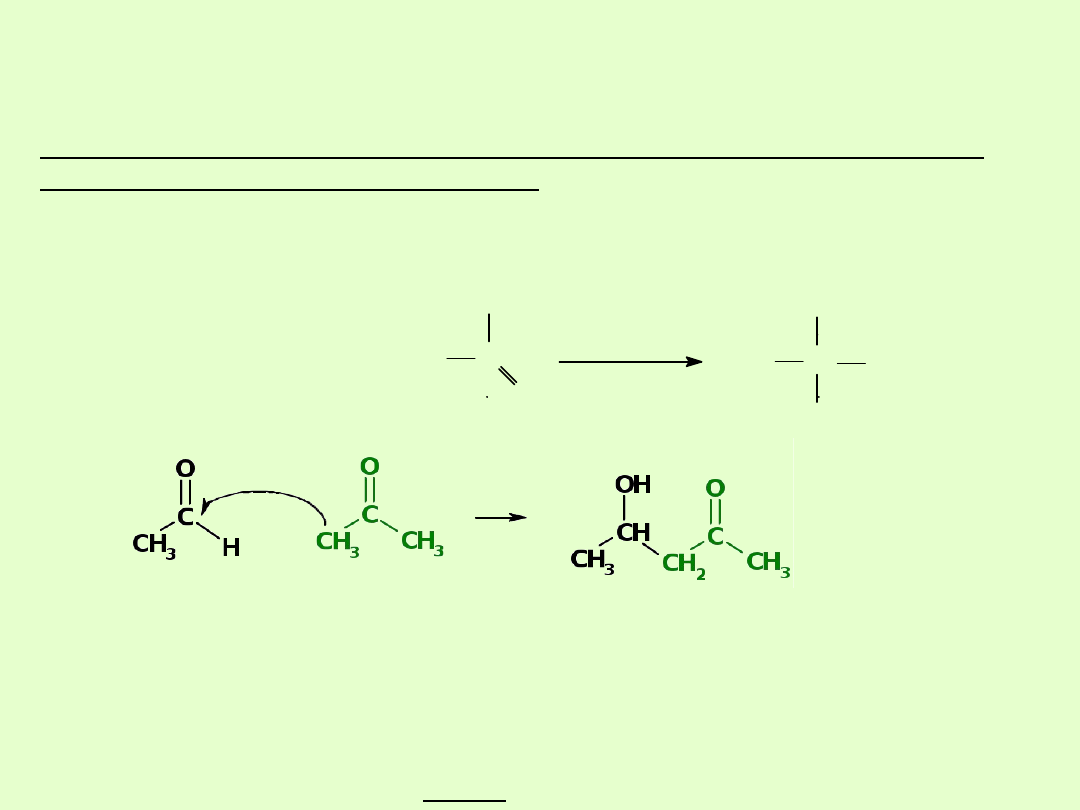
C. Kondensacja
aldolowa
Reakcje, w których atakowana jest grupa karbonylowa ketonów,
praktycznie nie zachodzą.
D. Reakcja z alkoholami
Ketony, w odróżnieniu od aldehydów dość trudno reagują z
alkoholami.
W wyniku reakcji tworzą się ketale

Właściwości fizyczne i zastosowanie aldehydów i ketonów
Aldehydy są zazwyczaj cieczami słabo rozpuszczalnymi w wodzie z
wyjątkiem aldehydu mrówkowego (gaz) i octowego występującego jako
lotna ciecz.
Obecność ujemnego ładunku cząsteczkowego na atomie tlenu i obecność
wolnych par elektronowych pozwala wytworzyć cząsteczkom wiązania
wodorowe.
Ketony występują głownie jako ciecze, rzadziej jako niskotopliwe ciała
stałe.
Najpopularniejszym ketonem jest aceton stosowany powszechnie jako
rozpuszczalnik; podobne zastosowanie mają wszystkie ketony
powszechnie stosowane jako rozpuszczalniki.
Etanal znalazł zastosowanie m.in. do produkcji kwasu octowego,
alkoholu etylowego, chloroformu i wielu tworzyw sztucznych.
W procesie polikondensacji fenolu z formaldehydem powstają żywice
fenolowo- formaldehydowe stosowane do wyrobu lakierów, klejów ,
laminatów, tworzyw sztucznych.
Formalina (40% roztwór wodny metanalu) ma silne właściwości
bakteriobójcze działa denaturująco na substancje białkowe. To
decyduje ,że jest stosowany do przechowywania preparatów
anatomicznych.
Aldehyd benzoesowy stosuje się przy wyrobach cukierniczych jako
składnik sztucznego olejku migdałowego
Aldehydy i ketony pochodzenia naturalnego:
benzaldehyd (migdały), aldehyd cynamonowy (cynamon), kamfora, karwon
(mięta zielona), wanilina (nasiona wanilii).
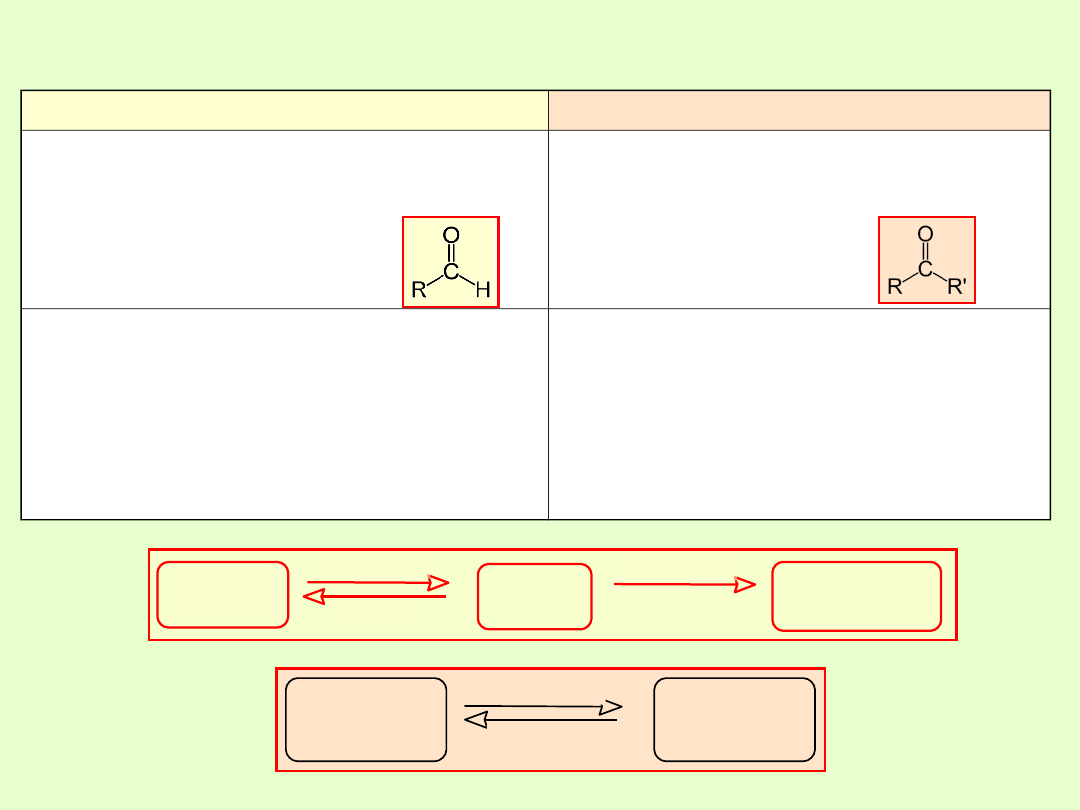
ALDEHYDY
KETONY
Grupa C=O występuje na końcu łańcucha
węglowego cząsteczki, atom węgla w grupie
aldehydowej jest pierwszorzędowy,
(łączy się z jednym atomem
węgla grupy węglowodorowej)
Grupa C=O występuje wewnątrz łańcucha
węglowego cząsteczki, atom
węgla grupy karbonylowej
jest drugorzędowy
Nazwy systematyczne aldehydów tworzy się
dodając końcówkę -al do nazwy
macierzystego węglowodoru.
Nazwy zwyczajowe wywodzą się od
odpowiednich nazw kwasów
karboksylowych.
Nazwy systematyczne ketonów tworzy się
dodając końcówkę -on do nazwy
macierzystego węglowodoru.
Nazwy zwyczajowe wywodzą się od
odpowiednich grup węglowodorowych.
alkohol
I-rzędowy
aldehyd
kwas
karboksylowy
utlenianie
redukcja
utlenianie
alkohol
II-rzędowy
keton
utlenianie
redukcja
Podsumowanie

Redukcja do alkoholi I-rzędowych
Redukcja do alkoholi II-rzędowych
Reakcje addycji (alkohole, woda)
Reakcje addycji (alkohole, woda)
Próba Tollensa (lustro srebra)
Próba Trommera
Bardzo łatwo ulegają utlenieniu
( właściwości redukujące)
Modyfikacjami tej próby są
próba
Fehlinga
i
próba Benedicta
Brak
Brak
Dopiero pod wpływem silnych
utleniaczy w cząsteczkach ketonów
następuje rozerwanie wiązania węgiel
– węgiel przy grupie karbonylowej i
powstanie mieszaniny kwasów
karboksylowych o krótszych
łańcuchach.
Kondensacja aldolowa
Dla aldehydów o małych cząsteczkach
–
polimeryzacja, polikondensacja.
Kondensacja aldolowa
Ketony ulegają kondensacji aldolowej
znacznie trudniej
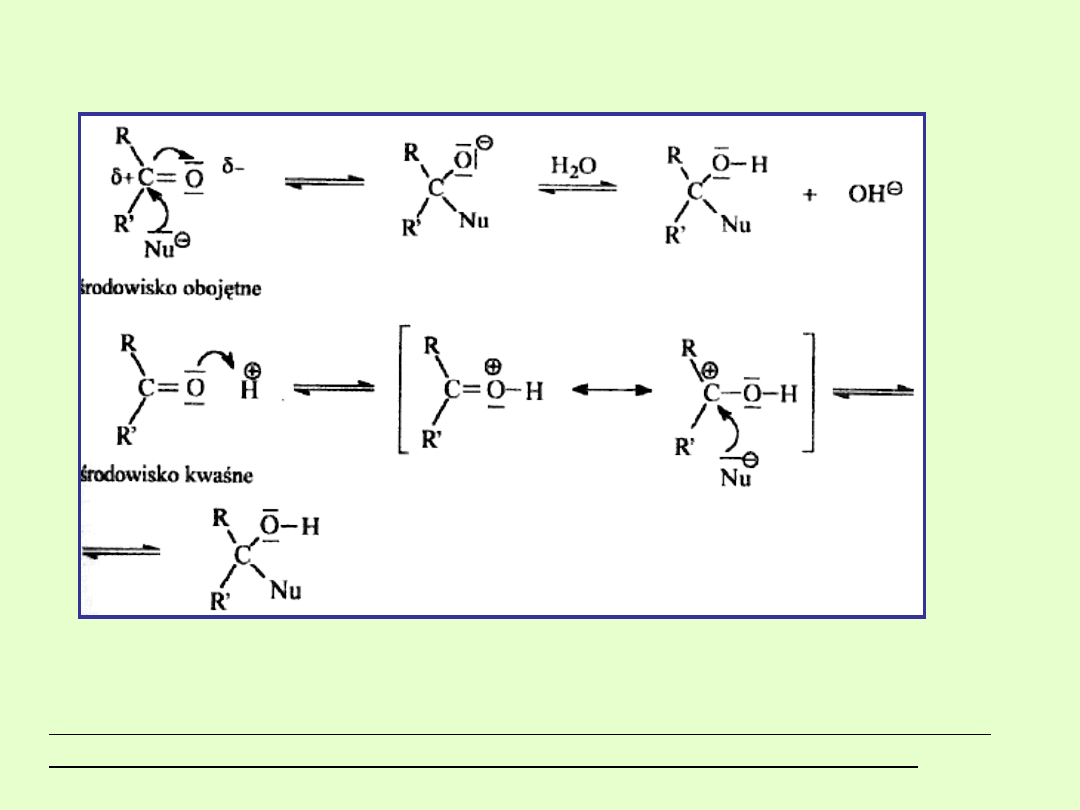
Najważniejszą reakcją grupy karbonylowej jest
reakcja addycji
nukleofilowej.
Przyłączenie nukleofila do karbonylowego atomu węgla powoduje
przejście z płaskiego układu trygonalnego do układu tetraedrycznego.
Aldehydy są bardziej reaktywne od ketonów w analogicznej reakcji ze
względu na mniejszą zawadę przestrzenną reaktywnego węgla.
Aldehydy i ketony ulegają ciekawym reakcjom wyrażającym ich
charakter redukująco - utleniający równocześnie.
Są to
reakcja Cannizzaro
tylko dla aldehydów nie zawierających
wodoru w pozycji α
+ 3 I
+ 4NH OH
2
4
CH I + CH COONH + 3 NH I + 3 H O
3
3
4
4
2
propanon
octan amonu
CH
3
CH
3
C
O
Rys. 5b.
W reakcji z jodem powstaje charakterystyczny żółty osad trijodometanu,
zwany inaczej jodoformem, dlatego reakcja ta nazywana jest
próbą
jodoformową
. Służy ona do wykrywania grupy -COCH
3
.
Wyjątkiem wśród aldehydów jest acetaldehyd – obecność grupy metylowej przy
grupie karbonylowej.
Dla dociekliwych
Rys. 4d.
metan
al
metan
ol
+
2
O
H
C
ONa
CH
OH
3
O
C
H
H
stez. NaOH
mrówczan sodu
i reakcja kondensacji aldolowej której ulegają aldehydy i ketony.
Ketony, które zawierają grupę metylową związaną z grupą -C=O,
ulegają charakterystycznej reakcji z fluorowcami w roztworze
zasadowym.
Reakcję można przeprowadzić z chlorem, bromem lub jodem.
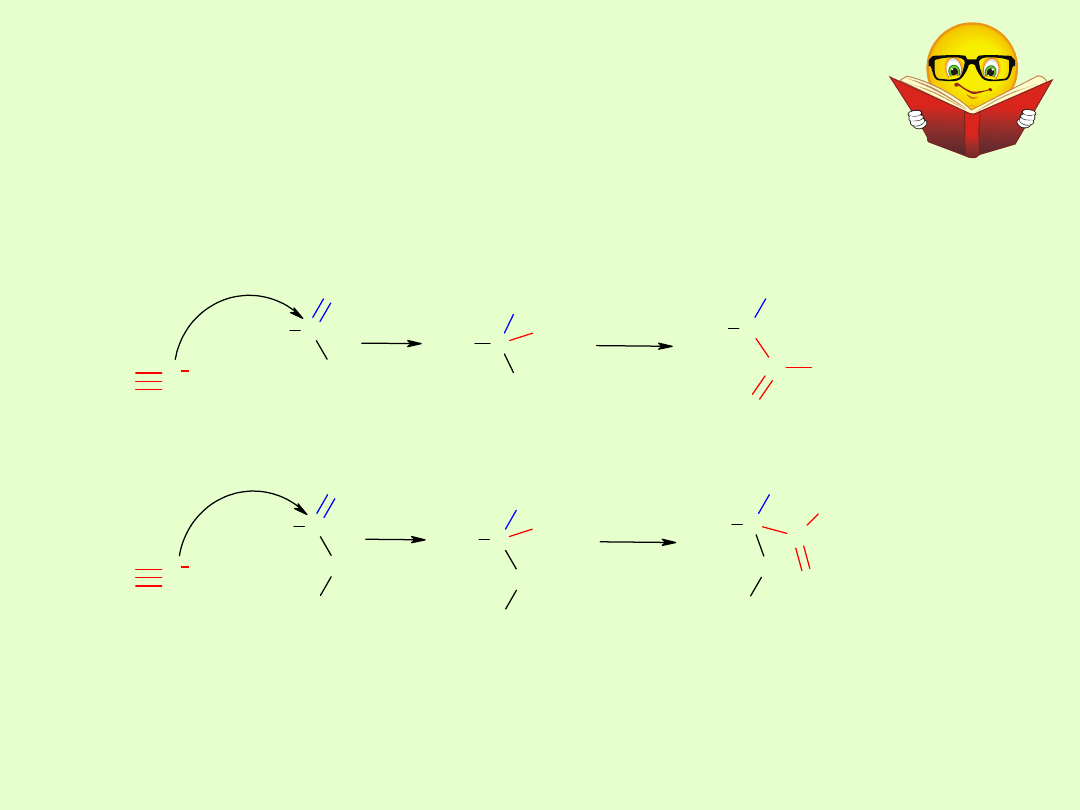
Addycja cyjanowodoru
Reakcję tworzenia cyjanohydryn przeprowadza się w obecności
kwasu nieorganicznego dodawanego do mieszaniny związku
karbonylowego i wodnego roztworu NaCN. Łatwo ulegają hydrolizie
do -hydroksykwasów.
N
C
CH
3
C
H
O
H
OH
C
CH
3
CN
OH
CH
CH
3
O
OH
C
+
H
2
O/H
+
H
+
N
C
CH
3
C
CH
2
O
CH
3
OH
C
CH
3
CN
CH
2
CH
3
OH
C
CH
3
O
OH
C
CH
2
CH
3
+
H
2
O/H
+
H
+
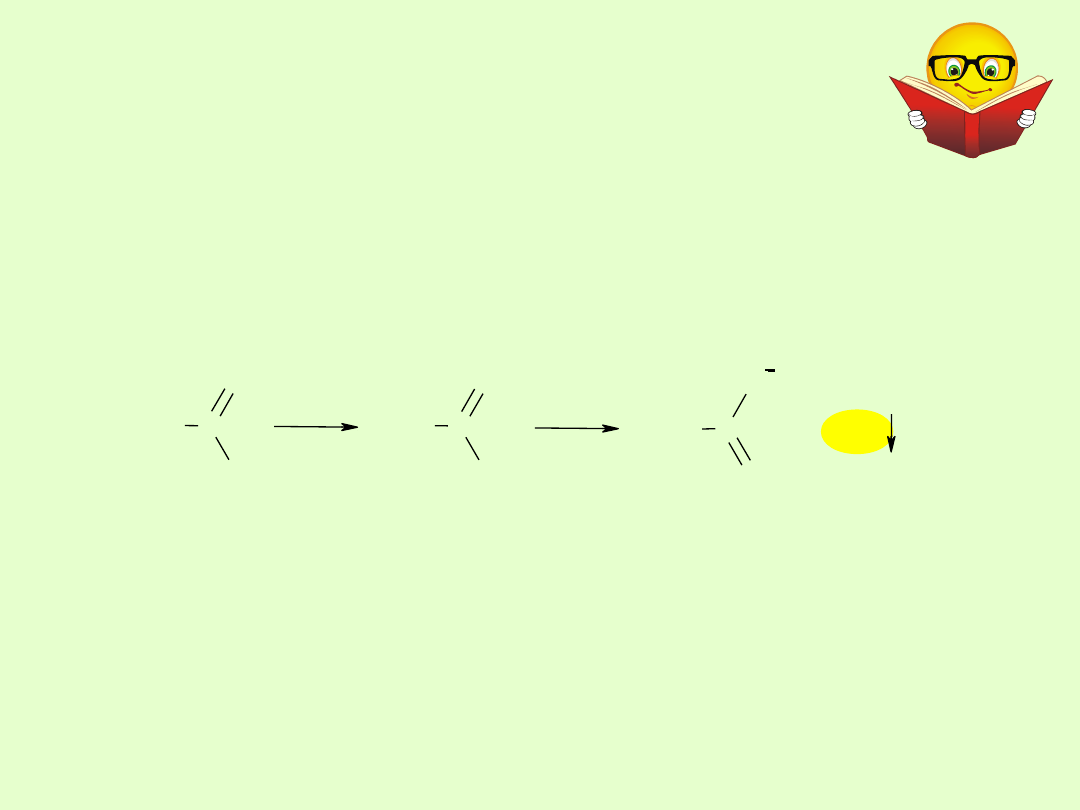
Ketony są odporne na utlenienie. Wyjątek stanowią
metyloketony, które łatwo można utlenić jonami OX
–
X=Cl, Br,
J.
Produktami reakcji są kwas karboksylowy krótszy o jeden atom
węgla od substratu oraz haloform.(CHX
3
).
CH
3
C
CI
3
O
CH
3
O
C
O
CHI
3
CH
3
CH
3
C
O
I
2
+
OH
–
OH
–

Bibliografia
„Repetytorium od A do Z” Klimaszewska
„Wstęp do chemii organicznej” Kupryszewski
„Chemia 2”– podręcznik ( zakres rozszerzony) S. Hejwowska, R.
Marcinkowski,J. Staluszka
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
więcej podobnych podstron