wykład 11 –
Aldehydy i ketony
11:
11:
ZWIĄZKI
ZWIĄZKI
KARBONYLOWE:
KARBONYLOWE:
ALDEHYDY I KETONY
ALDEHYDY I KETONY
1
R
C
H
O
R
1
C
R
2
O
Chemia organiczna – wykłady dla studentów chemii – J.
Wilamowski 2010
2
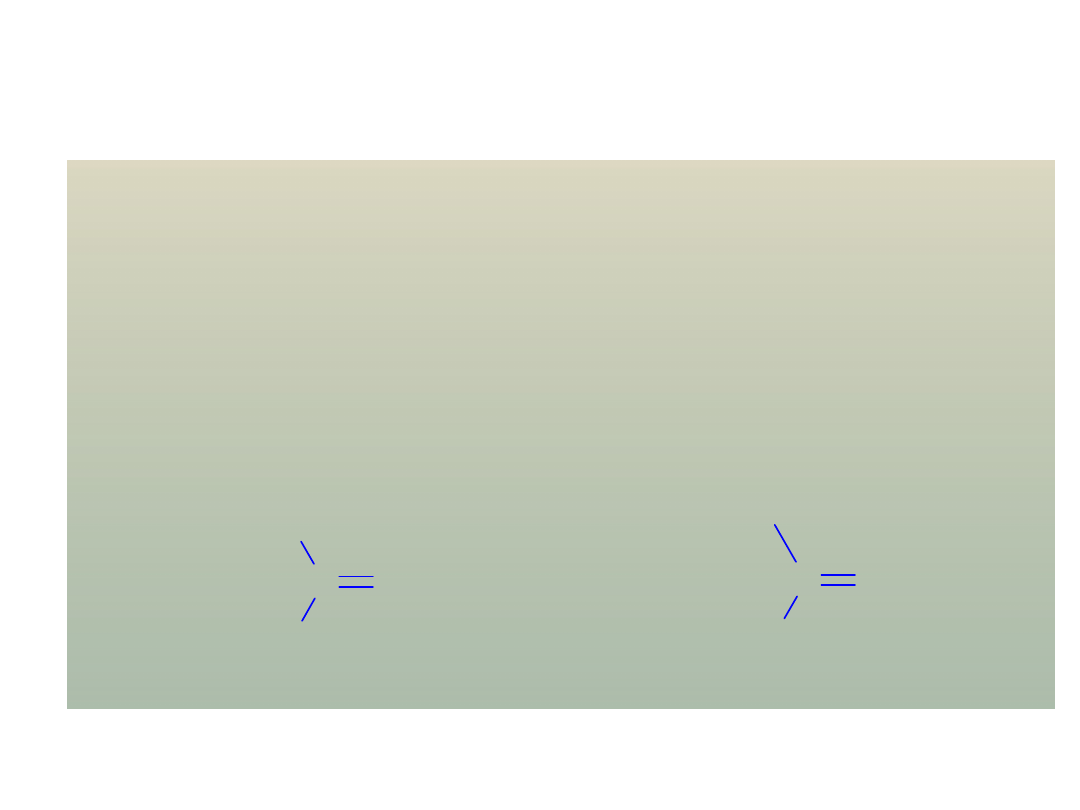
ROZPOZNAWANIE GRUPY FUNKCYJNEJ
grupa
karbonylowa
C O
l
l
aldehydy
R
C
H
O
l
l
wodór,
alkil lub
aryl
R
CHO
grupa
formylowa
ketony
R
1
C
R
2
O
l
l
alkil lub aryl
R
1
CO
R
2
wykład 11 –
Aldehydy i ketony
3
PRZYKŁADY
ALDEHYDÓW
H
C
O
H
formaldehyd
aldehyd mrówkowy
metanal
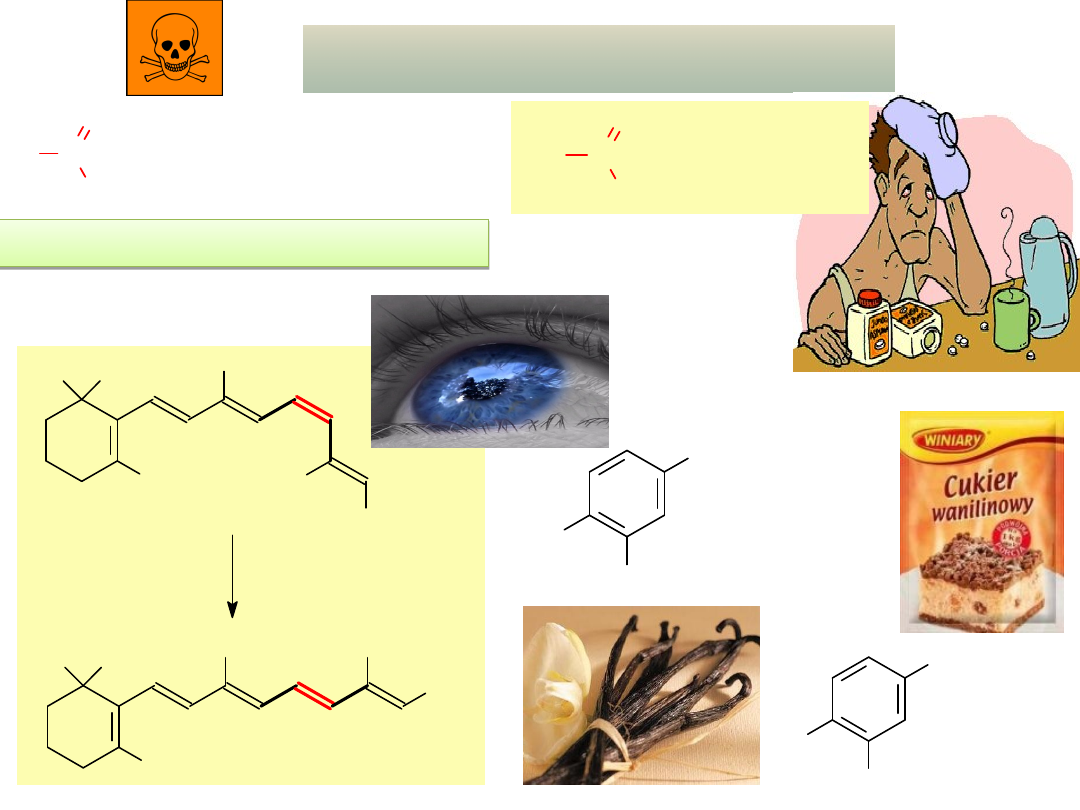
CHO
HO
OCH
3
wanilina
(w wanilii)
Ok. 40 % roztwór to formalina!
Ok. 40 % roztwór to formalina!
CH
3
C
O
H
acetaldehyd
aldehyd octowy
etanal
H
3
C
CH
3
CH
3
CH
3
H
3
C
CHO
cis
-retinal
światło
(w rodopsynie)
H
3
C
CH
3
CH
3
CH
3
CH
3
CHO
trans
-retinal
CHO
HO
OCH
2
CH
3
etylowanilina
(produkt
syntetyczny)

4
PRZYKŁADY
KETONÓW
CH
CH
3
CH
3
CH
3
O
TUJ ON
C O
H
3
C
H
3
C
aceton
propanon
Popularny rozpuszczalnik,
Dawniej – zmywacz do paznokci
Popularny rozpuszczalnik,
Dawniej – zmywacz do paznokci
C O
HOCH
2
HOCH
2
dihydroksyaceton
(w samoopalaczach)
O
CH
3
MUSKON
Piołun (Artemisia absinthium)
5
CUKRY PROSTE TO
POLIHYDROKSYLOWE POCHODNE
ALDEHYDÓW LUB KETONÓW !
D-FRUKTOZA
w projekcji Fischera
(przykład
keto
heksozy)
C O
CH
2
OH
HO
H
H
OH
H
OH
CH
2
OH
C
H
OH
H
O
CH
2
OH
HO
H
H
OH
H
OH
D-GLUKOZA
w projekcji Fischera
(przykład
aldo
heksozy)
C
H
OH
H
O
CH
2
OH
H
OH
H
OH
D-RYBOZA
w projekcji Fischera
(przykład
aldo
pentozy)
C
H
OH
H
O
CH
2
OH
aldehyd D-glicerynowy
kluczowy związek
transformacji biochemicznych
RN
A
RN
A
BI
OCHEMIA
to chemia
związków
karbonylowych !!!
BI
OCHEMIA
to chemia
związków
karbonylowych !!!
UWAGA:
Cukry występują głównie
w formach cyklicznych,
tzw. hemiacetalowych
(szczegóły na wykładzie 9)
UWAGA:
Cukry występują głównie
w formach cyklicznych,
tzw. hemiacetalowych
(szczegóły na wykładzie 9)
wykład 11 –
Aldehydy i ketony
6
NOMENKLATURA ALDEHYDÓW
Końcówka:
-al
– gdy grupa -CHO należy do łąńcucha głównego
-karboaldehyd
– gdy grupa –CHO jest dołączona do
pierścienia
Przedrostek:
formylo-
gdy –CHO jest podstawnikiem, a nie główną grupą
funkcyjną
a)
systematycznie: 2-bromobutan
al
c)
but-2-en
al
(aldehyd krotonowy)
d)
2-etylobutano
dial
(aldehyd etylobursztynowy)
CH CH CHO
CH
3
4
3
2
1
e)
CHO
cyklopentano
karboaldehyd
OH
CHO
g)
aldehyd
2-hydroksy
benzoesowy
(o-hydroksy
benzaldehyd
, aldehyd salicylowy)
h)
CHO
OHC
benzeno-1,4-
dikarboaldehyd
(aldehyd tereftalowy)
i)
COOH
CHO
kwas
3-
formylo
benzoesowy
CH CH
2
CHO
CH
2
CHO
CH
3
1
2
3
4
CH
3
CH
2
CH C
O
H
Br
l
l
1
2
3
4
CH
3
CH
2
CH C
O
H
Br
l
l
zwyczajowo:
aldehyd
-
bromo
masłowy
7
NOMENKLATURA KETONÓW
- Gdy C=O jest główną grupą funkcyjną: końcówka:
-on
- Gdy C=O jest podstawnikiem:
okso-
- Nazwy zwyczajowe: „keton …owo- …owy” (nazwy grup połączonych
z C=O)
b)
butan-2-
on
(keton etylowo-metylowy)
a)
CH
2
C
CH
2
O
1,3-difenylopropan-2-
on
(keton dibenzylowy; 1,3-difenyloaceton)
c)
heks-5-en-3-
on
(keton allilowo-etylowy)
d)
C
O
CH
3
1-fenyloetan
on
acetofenon
(keton fenylowo-metylowy)
e)
3-hydroksycykloheksan
on
kwas 4-
okso
pentanowy
f)
1
2
3
CH
3
CH
2
C
CH
3
O
1
2
3
4
CH CH
2
C
CH
2
O
CH
2
CH
3
5
4
3
2
1
6
O
OH
1
2
3
C
CH
2
C
CH
3
O
CH
3
O
g)
grupa
acetylowa
pentano-2,4-
dion
(
acetylo
aceton)
h)
C
O
CH
2
COOCH
3
grupa benzoilowa
3-fenylo-3-
okso
propanian metylu
(
benzoilo
octan metylu)
O
O
CH
3
i)
COOH
O
5
4
3
2
1
1
2
3
4
2-metylo-1,4-nafto
chinon
(syntetyczna witamina K
3
)
wykład 11 –
Aldehydy i ketony
C
O
R
1
R
2
l
l
duży
moment
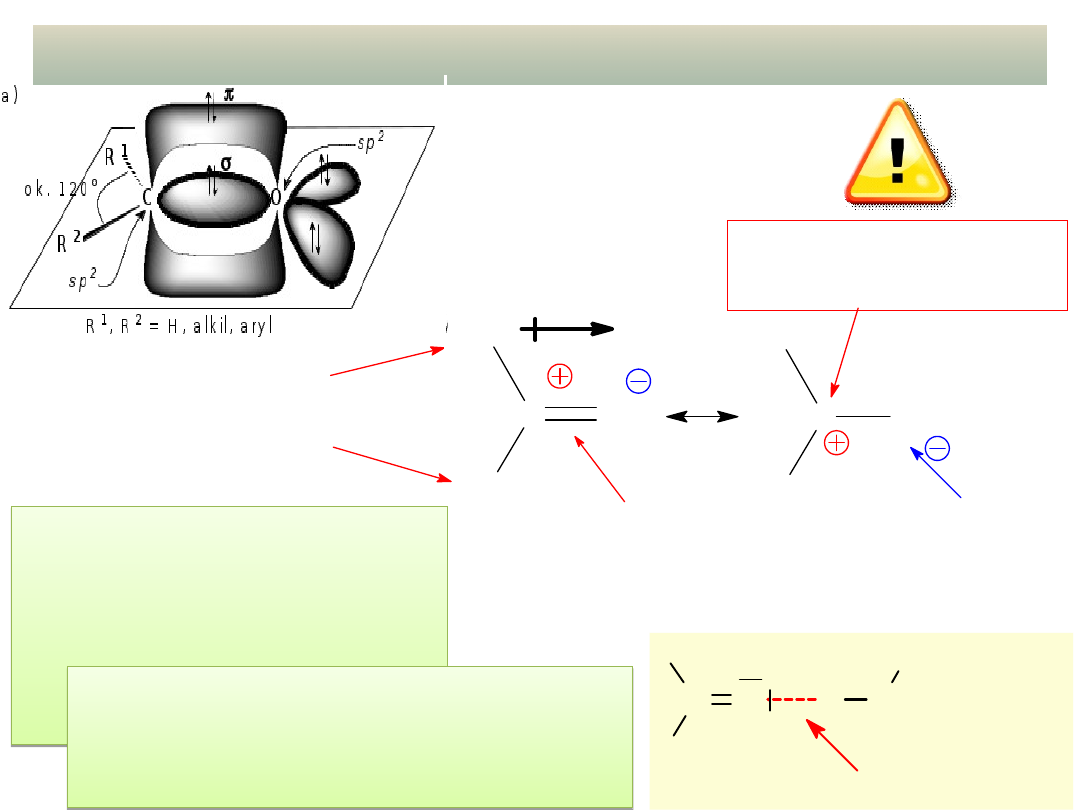
dipolowy
grupy alkilowe i arylowe
praktycznie nie odrywają się
silnie spolaryzowane
wiązanie
atom elektrofilowy
(miejsce ataku nukleofila)
atom nukleofilowy
C
O
R
1
R
2
l
l
l
8
STRUKTURA GRUPY C=O A JEJ
REAKTYWNOŚĆ
Nie tworzą
międzycząsteczkowych
wiązań wodorowych, ale są
polarne, wkonsekwencji mają
umiarkowane
temp. wrzenia (zwykle są
cieczami).
Nie tworzą
międzycząsteczkowych
wiązań wodorowych, ale są
polarne, wkonsekwencji mają
umiarkowane
temp. wrzenia (zwykle są
cieczami).
Tworzą wiązania wodorowe z
cząsteczkami wody,
małocząsteczkowe aldehydy i ketony
są w niej rozpuszczalne:
Tworzą wiązania wodorowe z
cząsteczkami wody,
małocząsteczkowe aldehydy i ketony
są w niej rozpuszczalne:
C O
R
R
H O
H
wiązanie wodorowe
wykład 11 –
Aldehydy i ketony
9
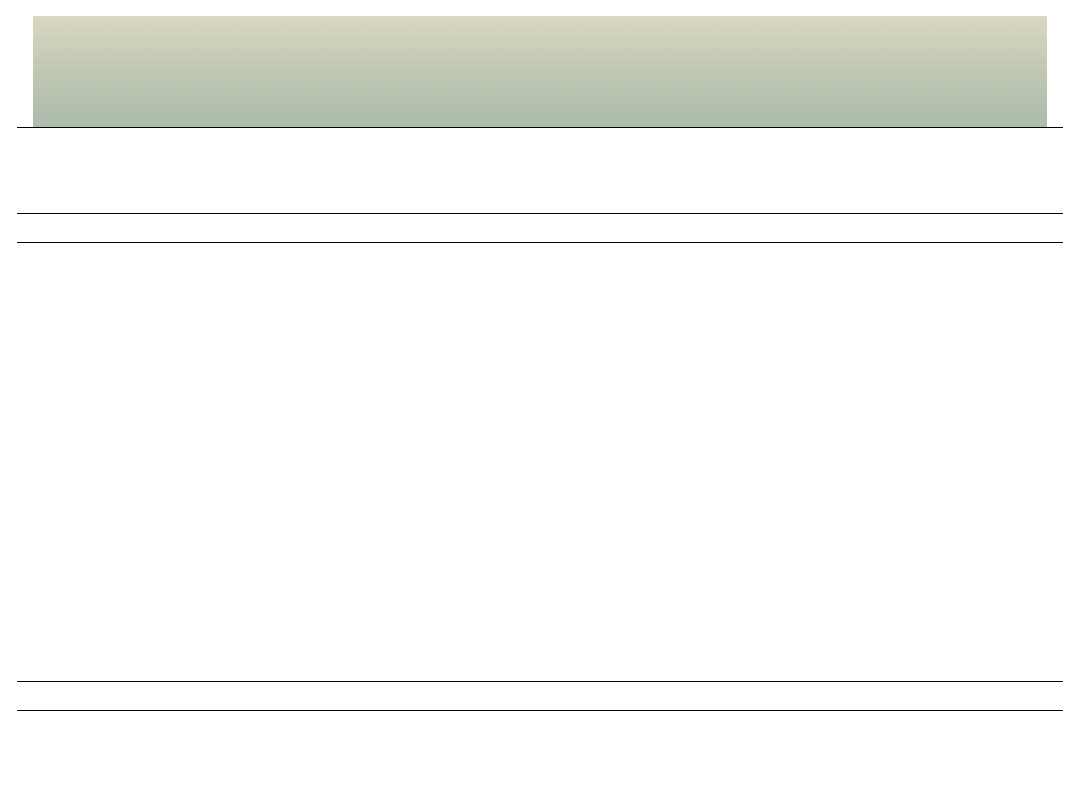
NAZWY I WŁAŚCIWOŚCI PROSTYCH
ALDEHYDÓW
I KETONÓW;
Obowiązuje znajomość nazw
zwyczajowych!
wzór
nazwa
systematyczna
nazwa
zwyczajowa
temp. wrz.
[
o
C] (1013
hPa)
rozpuszczal.
[g/100g H
2
O]
ALDEHYDY
H-
CHO
metan
al
aldehyd
mrówkowy
(formaldehyd)
-20
CH
3
-
CHO
etan
al
aldehyd octowy
(acetaldehyd)
21
CH
3
CH
2
-
CHO
propan
al
aldehyd
propionowy
48
20
CH
3
CH
2
CH
2
-
CHO
butan
al
aldehyd masłowy
75
3,7
CH
3
(CH
2
)
3
-
CHO
pentan
al
aldehyd
walerianowy
103,5
0,14
CH
2
=CH-
CHO
propen
al
akroleina
52,5
27
OHC-CHO
etano
dial
glioksal
50,5
C
6
H
5
-
CHO
benzeno
karbo-
aldehyd
aldehyd
benzoesowy
(benzaldehyd)
179
0,30
KETONY
CH
3
CO
CH
3
propan-2-
on
aceton
56
CH
3
CH
2
CO
CH
2
CH
3
pentan-2-
on
keton dietylowy
102
5,4
C
6
H
5
CO
CH
3
1-fenyloetan
on
acetofenon
(keton fenylowo-
metylowy)
202
(t. topn. 19
o
C)
0,55
wykład 11 –
Aldehydy i ketony
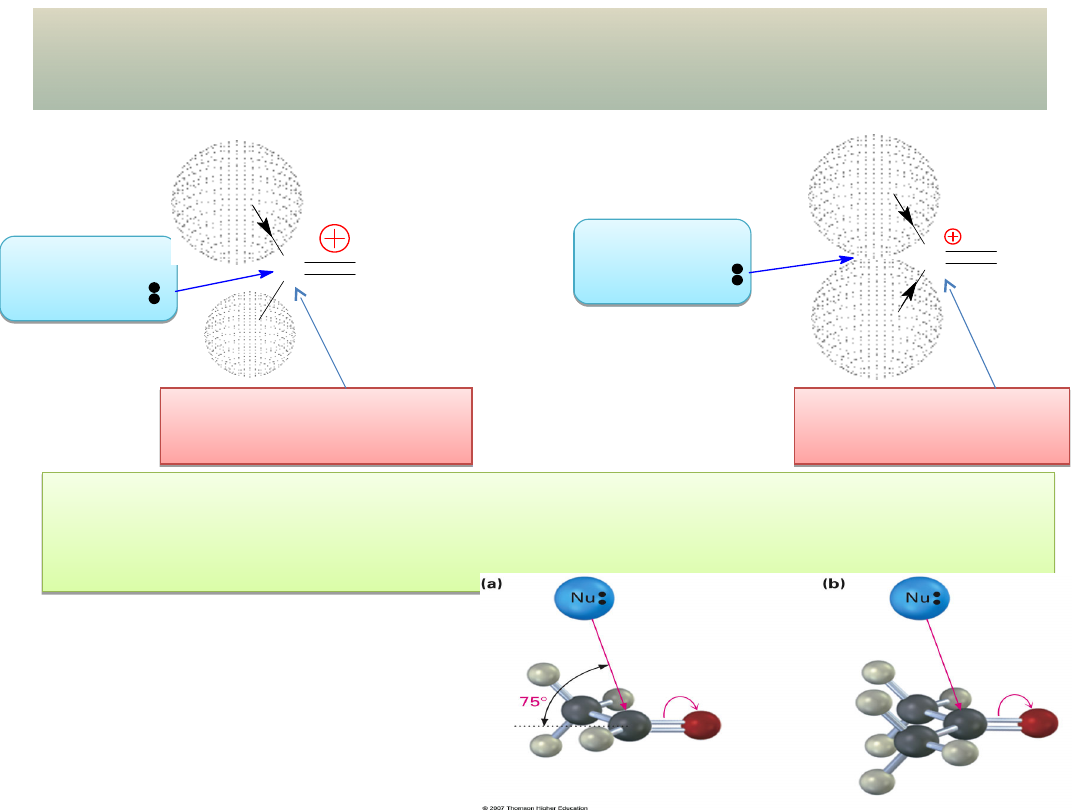
aldehyd
keton
łatwy
dostęp
trudny
dostęp Nu
C
O
R
1
H
l
l
C
O
R
1
R
2
l
l
Nu
10
PORÓWNANIE REAKTYWNOŚCI ALDEHYDÓW
I KETONÓW
Bardziej elektrofilowy
atom węgla
Bardziej elektrofilowy
atom węgla
Mniej elektrofilowy
atom węgla
Mniej elektrofilowy
atom węgla
ALDEHYDY ŁATWIEJ NIŻ KETONY ULEGAJĄ REAKCJI ADDYCJI
NUKLEOFILOWEJ! – przyczyną są zarówno względy
ELEKTRONOWE, jak i STERYCZNE
ALDEHYDY ŁATWIEJ NIŻ KETONY ULEGAJĄ REAKCJI ADDYCJI
NUKLEOFILOWEJ! – przyczyną są zarówno względy
ELEKTRONOWE, jak i STERYCZNE
Trajektoria ataku nukleofila na C=O:
- Dlaczego taki kąt?
- Jak było w reakcjach S
N
2?
- Jaka jest geometria orbitali antywiążących
*?
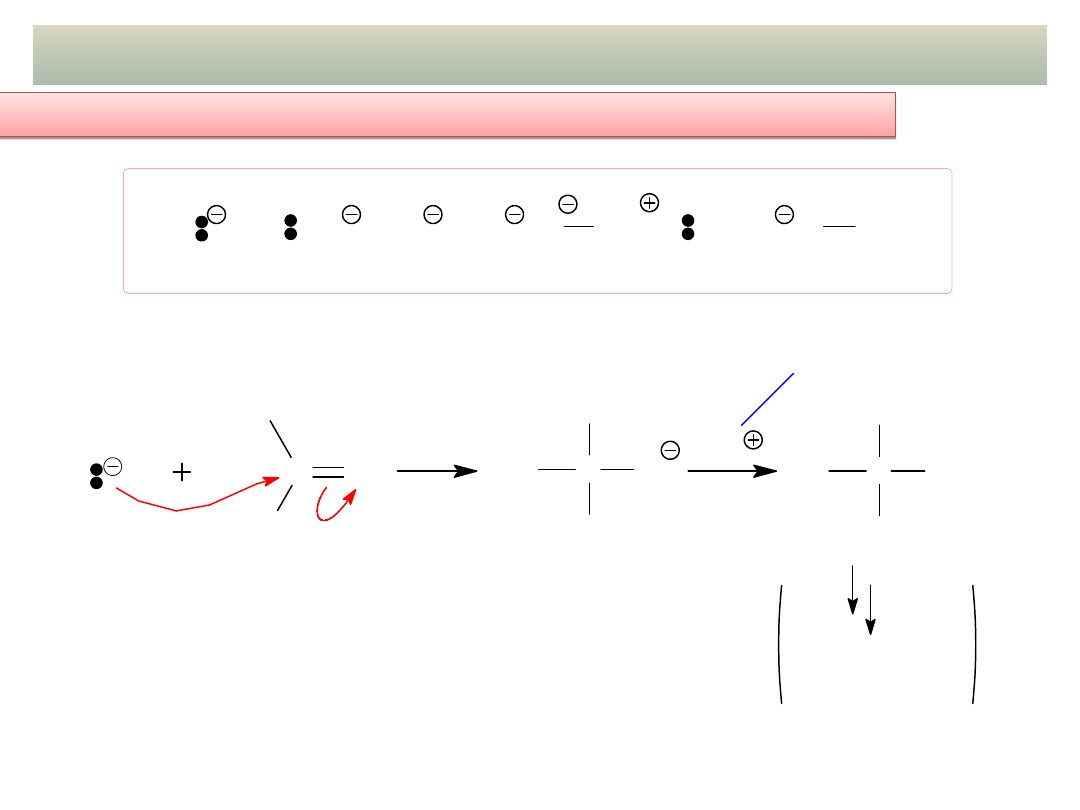
11
ADDYCJA NUKLEOFILOWA DO GRUPY C=O
a) Schemat ogólny mechanizmu addycji mocnych nukleofili:
a) Schemat ogólny mechanizmu addycji
mocnych
nukleofili:
wykład 11 –
Aldehydy i ketony
dalsze
reakcje
R
1
C
Nu
R
2
OH
l
l
Nu
R
1
C
Nu
R
2
Ol
l
l
+H
R
1
C
R
2
Ol
l
CN ,
, SO
3
H ,
Nu
R MgX
R NH
2
l
BH
4
,
AlH
4
,
=
np. z rozpuszczalnika
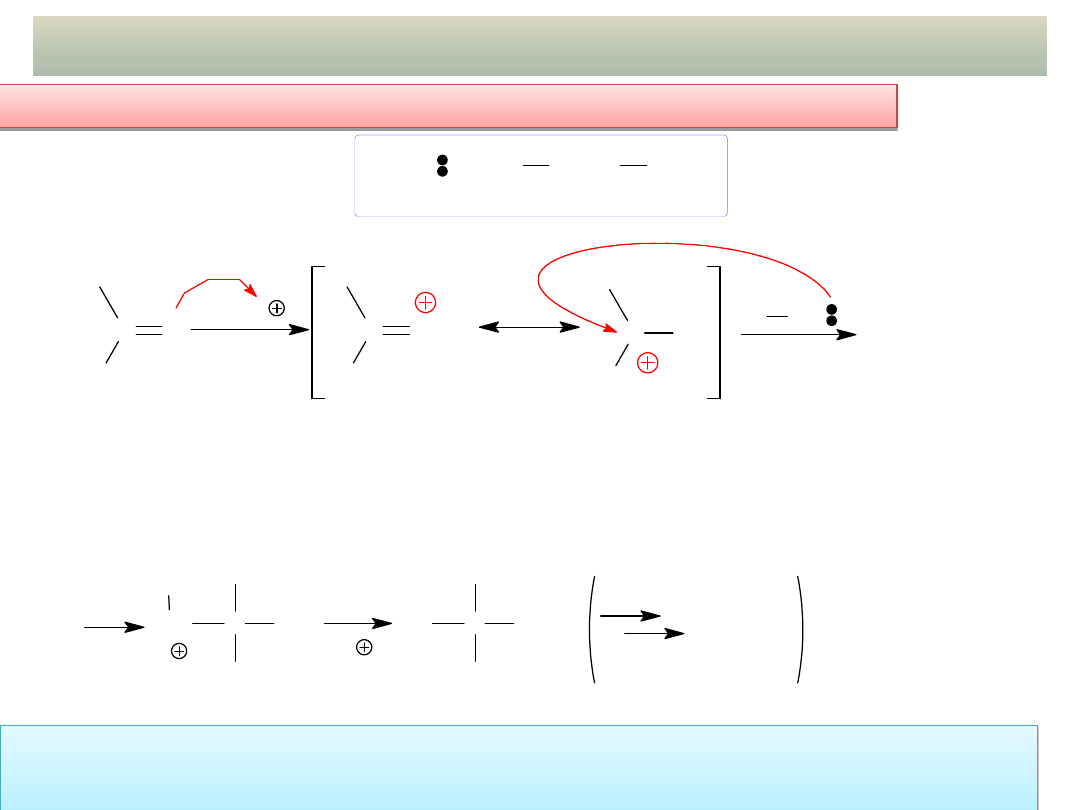
12
ADDYCJA NUKLEOFILOWA DO GRUPY C=O cd.
b) Schemat ogólny mechanizmu addycji słabych nukleofili::
b) Schemat ogólny mechanizmu addycji
słabych
nukleofili::
W przypadku słabych nukleofili wymagana jest KATALIZA
KWASOWA:
protonowanie atomu tlenu zwiększa elektrofilowość atomu węgla
grupy C=O!
W przypadku słabych nukleofili wymagana jest KATALIZA
KWASOWA:
protonowanie atomu tlenu zwiększa elektrofilowość atomu węgla
grupy C=O!
kat. H
protonowany aldehyd lub keton
zwiększona elektrofilowość atomu węgla
R NH
2
l
H-Nu
R OH
l
l ,
=
R
1
C
R
2
Ol
l
R
1
C
R
2
OH
l
l
l
R
1
C
R
2
OH
H Nu
-H
dalsze
reakcje
R
1
C
Nu
R
2
OH
H
l
l
R
1
C
Nu
R
2
OH
l
l
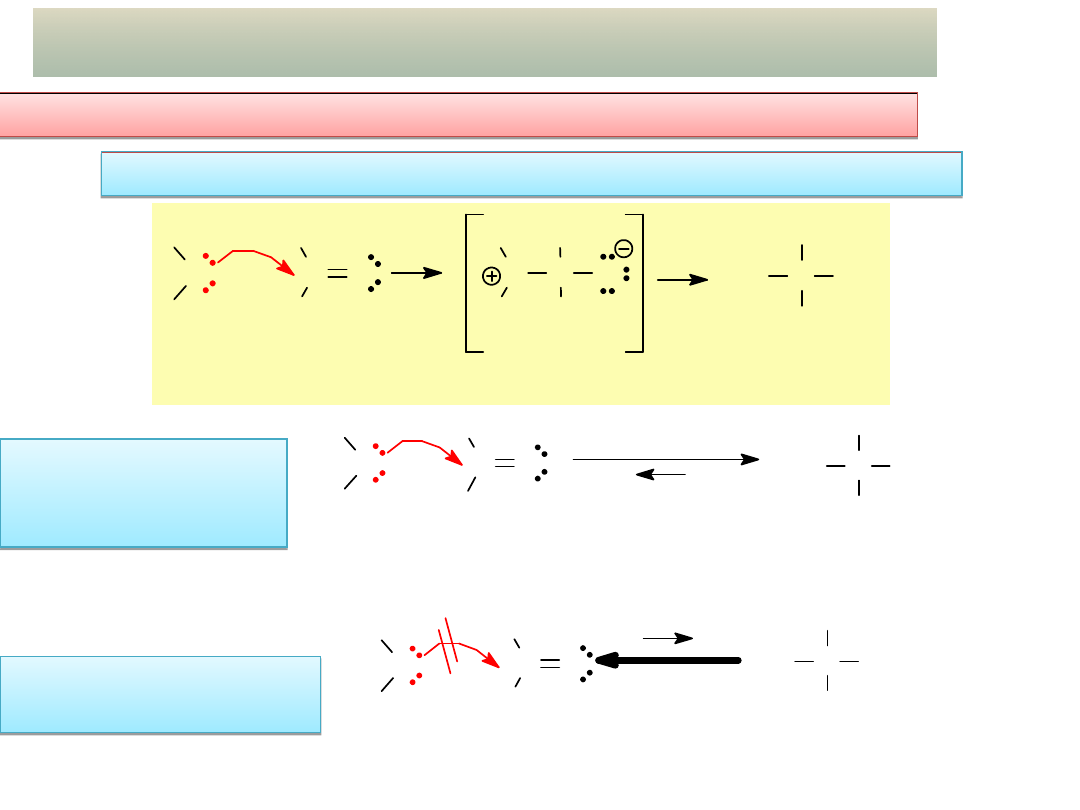
13
H
C
H
O
H
O
H
H
C
H
O
O
H
H
HO C OH
H
H
słaby
nukleofil
wodzian
formaldehydu
formaldehyd
wykład 11 –
Aldehydy i ketony
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ
- Addycja wody– tworzenie „wodzianów” (dioli geminalnych):
- Addycja wody– tworzenie „wodzianów” (dioli geminalnych):
Efektywne wyłącznie wyjątkowych przypadkach!!!!
Efektywne wyłącznie wyjątkowych przypadkach!!!!
H
3
C
C
H
3
C
O
H
O
H
słaby
nukleofil
aceton
nietrwały diol geminalny
praktycznie nie powstaje!!!
CH
3
C
CH
3
HO
OH
ZAZWYCZAJ
JEDNAK:
ZAZWYCZAJ
JEDNAK:
Przykład innego
trwałego
wodzianu:
Przykład innego
trwałego
wodzianu:
H
C
Cl
3
C
O
H
O
H
HO C OH
H
CCl
3
wodzian chloralu
aldehyd trichlorooctowy
(chloral)
14
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ
- Addycja cyjanowodoru – tworzenie cyjanohydryn:
- Addycja cyjanowodoru – tworzenie cyjanohydryn:
- Addycja wodorosiarczanu(IV) sodu – tworzenie tzw. połączeń bisulfitowych:
- Addycja wodorosiarczanu(IV) sodu – tworzenie tzw. połączeń bisulfitowych:
(metoda oczyszczania aldehydów)
C
O
H
Na
CN
aldehyd
benzoesowy
C
Na O
CN
H
H
CN
-NaCN
H
2
O, H
-NH
3
CH
COOH
OH
C
H
O
CN
H
cyjano
hydryna
aldehydu benzoesowego
kwas migdałowy
atak nukleofila
C N
CH
3
CH
2
C
O
H
Na
HSO
3
CH
3
CH
2
C
O Na
SO
3
H
H
CH
3
CH
2
C
O
H
SO
3
Na
H
(krystaliczny, jonowy
związek)
propanal
CH
3
CH
2
C
O
H
H
2
O, H
(zregenerowany aldehyd)
atak nukleofila
S O
O
OH
wykład 11 –
Aldehydy i ketony
15
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Przeniesienie anionu wodorkowego - redukcja grupy C=O do O-H:
- Przeniesienie anionu wodorkowego - redukcja grupy C=O do O-H:
Standardowo stosowane reduktory to:
- tetrahydroglinian litu LiAlH
4
– bardzo reaktywny (redukuje też estry, zw. nitrowe itp.)
- tetrahydroboran sodu NaBH
4
– mniej reaktywny, bardziej selektywny
Standardowo stosowane reduktory to:
- tetrahydroglinian litu LiAlH
4
– bardzo reaktywny (redukuje też estry, zw. nitrowe itp.)
- tetrahydroboran sodu NaBH
4
– mniej reaktywny, bardziej selektywny
Aldehydy redukują się do alkoholi 1
o
, a
ketony do alkoholi 2
o
.
Aldehydy redukują się do alkoholi 1
o
, a
ketony do alkoholi 2
o
.
C
O
H
H
Al
H
H
H
Li
C
OAlH
3
Li
H
H
aldehyd
benzoesowy
H
2
O
CH
2
OH
alkohol benzylowy
(może redukować kolejne
trzy cząsteczki aldehydu)
O
H
BH
3
Na
cykloheksanon
OBH
3
Na
H
(może redukować kolejne
trzy cząsteczki ketonu)
H
2
O
OH
cykloheksanol
wykład 11 –
Aldehydy i ketony
16
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
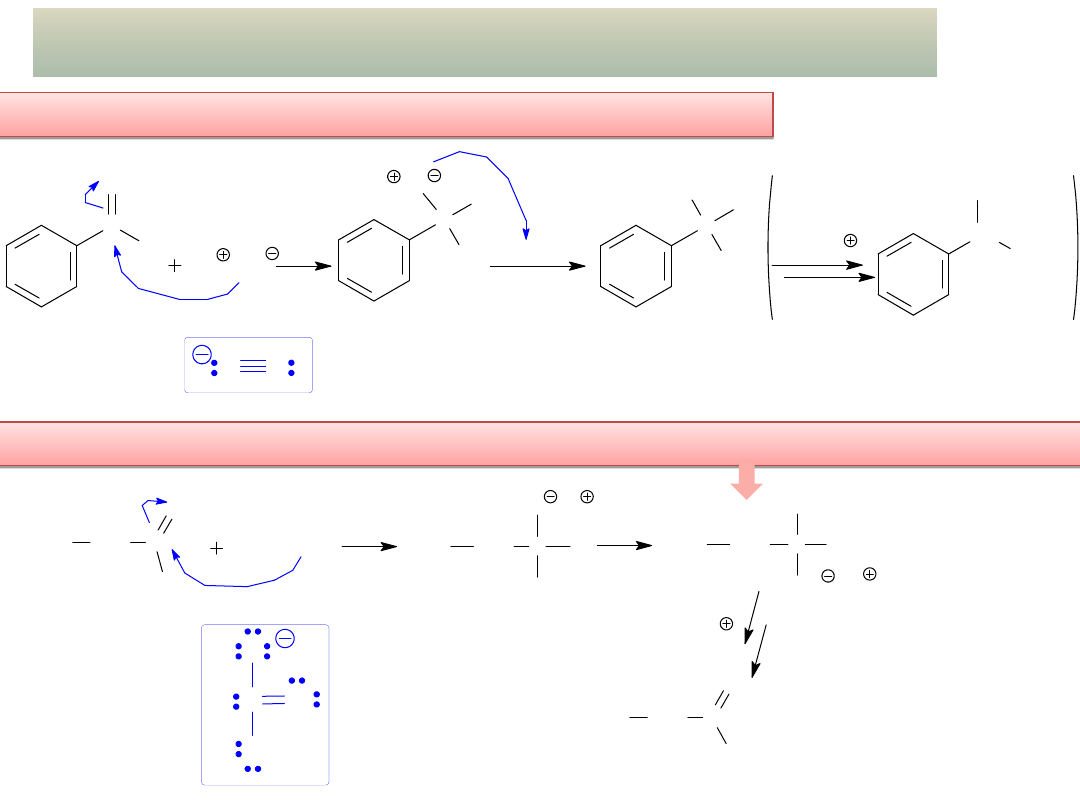
- Addycja związków Grignarda –
użyteczna metoda otrzymywania
alkoholi
o wydłużonym łańcuchu węglowym
- Addycja związków Grignarda –
użyteczna metoda otrzymywania
alkoholi
o wydłużonym łańcuchu węglowym
KETON + zw. Grignarda =
alkohol 3
o
KETON + zw. Grignarda =
alkohol 3
o
ALDEHYD + zw. Grignarda =
alkohol 2
o
ALDEHYD + zw. Grignarda =
alkohol 2
o
CH C
O
H
H
3
C
H
3
C
MgBr
H
3
O
CH CH
H
3
C
H
3
C
OH
CH C
H
3
C
H
3
C
O
H
MgBr
1-fenylo-2-metylopropan-1-ol
(alkohol 2
o
)
2-metylopropanal
(aldehyd)
bromek
fenylomagnezu
NUKLEOFIL
C
CH
3
O
CH
3
MgI
H
2
O
C
OH
CH
3
CH
3
C
O MgI
CH
3
CH
3
acetofenon
(keton)
2-fenylopropan-2-ol
(alkohol 3
o
)
jodek
metylomagnezu
Mg(OH)I
NUKLEOFIL
wykład 11 –
Aldehydy i ketony
17
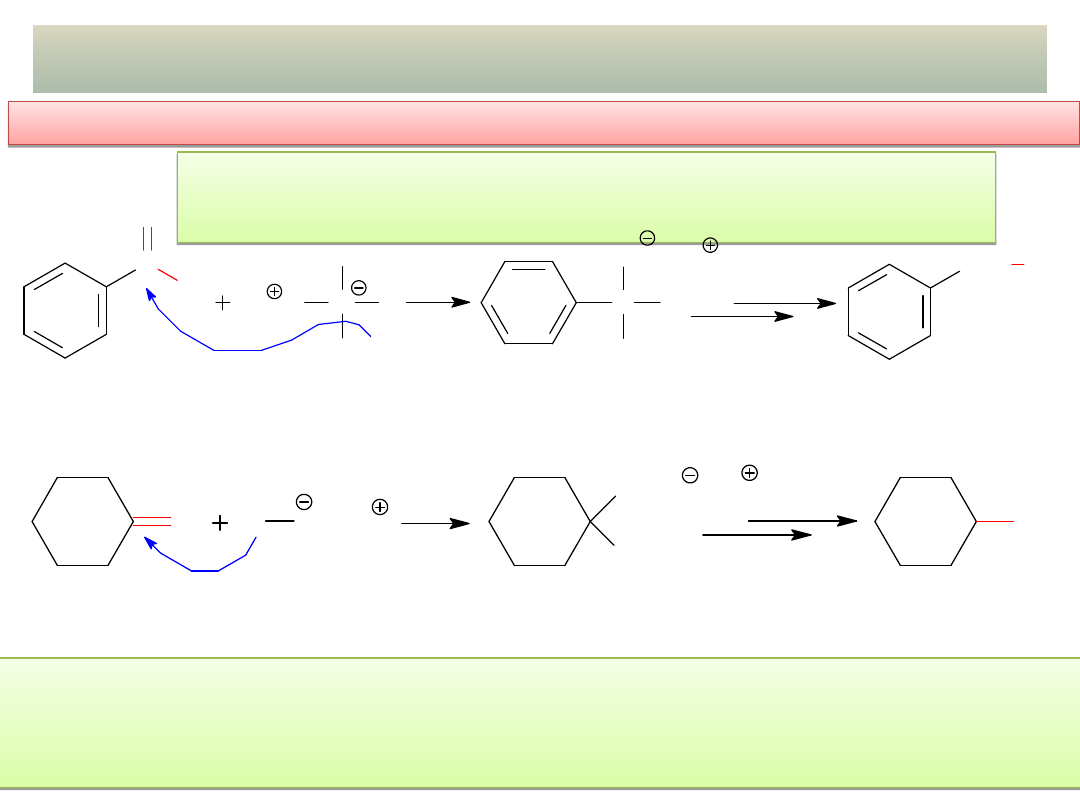
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Addycja związków Grignarda –
cd.
- Addycja związków Grignarda –
cd.
C
O
H
H
MgCl
metanal
(aldehyd
mrówkowy)
CH
2
O MgCl H
3
O
CH
2
OH
cyklopentylometanol
(alkohol 1
o
)
chlorek
cyklopentylomagnezu
FORMALDEHYD (metanal) + zw. Grignarda =
alkohol 1
o
FORMALDEHYD (metanal) + zw. Grignarda =
alkohol 1
o
(dlaczego hydrolizę soli alkoholi 3
o
prowadzono w środowisku obojętnym, a nie kwaśnym?)
PROBLEM:
Zaproponuj metody otrzymywania poniższych alkoholi z wykorzystaniem związków Grignarda:
OH
OH
OH
(dwie możliwości!)
wykład 11 –
Aldehydy i ketony
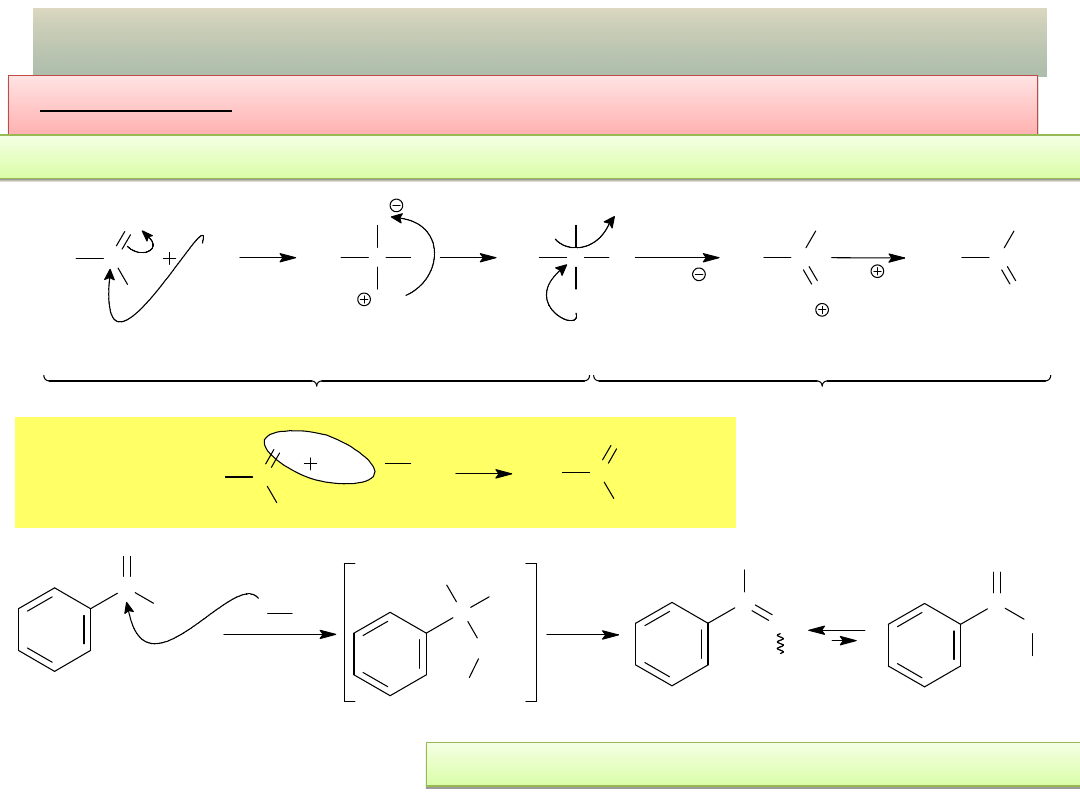
18
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Kondensacja z nukleofilami azotowymi (amoniak i aminy
pierwszorzędowe):
- Kondensacja z nukleofilami azotowymi (amoniak i aminy
pierwszorzędowe):
Powstające przejściowo aminole są nietrwałe i odszczepiają cząsteczkę wody.
Powstające przejściowo aminole są nietrwałe i odszczepiają cząsteczkę wody.
wykład 11 –
Aldehydy i ketony
a)
CH
3
C
O
H
NH
3
l
l l
CH
3
C
O
NH
3
H
l l
l
OH
C
CH
3
H
NH
2
l
l
l
etanal
CH
3
C
H
NH
2
-H
CH
3
C
H
NH
etanoimina
(produkt
kondensacji)
aminol
(produkt addycji)
addycja nukleofilowa
eliminacja wody
b)
sumarycznie:
CH
3
C
O
H
H
2
N H
CH
3
C
NH
H
C
O
CH
3
H
2
N CH
3
acetofenon
C
HO
NH
CH
3
CH
3
-H
2
O
C
CH
3
N
CH
3
aminol
N-metylo-1-fenyloetanoimina
+ H
2
O
- OH
l
l
l
C
CH
2
NH
CH
3
imina
enamina
Równowaga tautomeryczna iminowo-enaminowa
Równowaga tautomeryczna iminowo-enaminowa
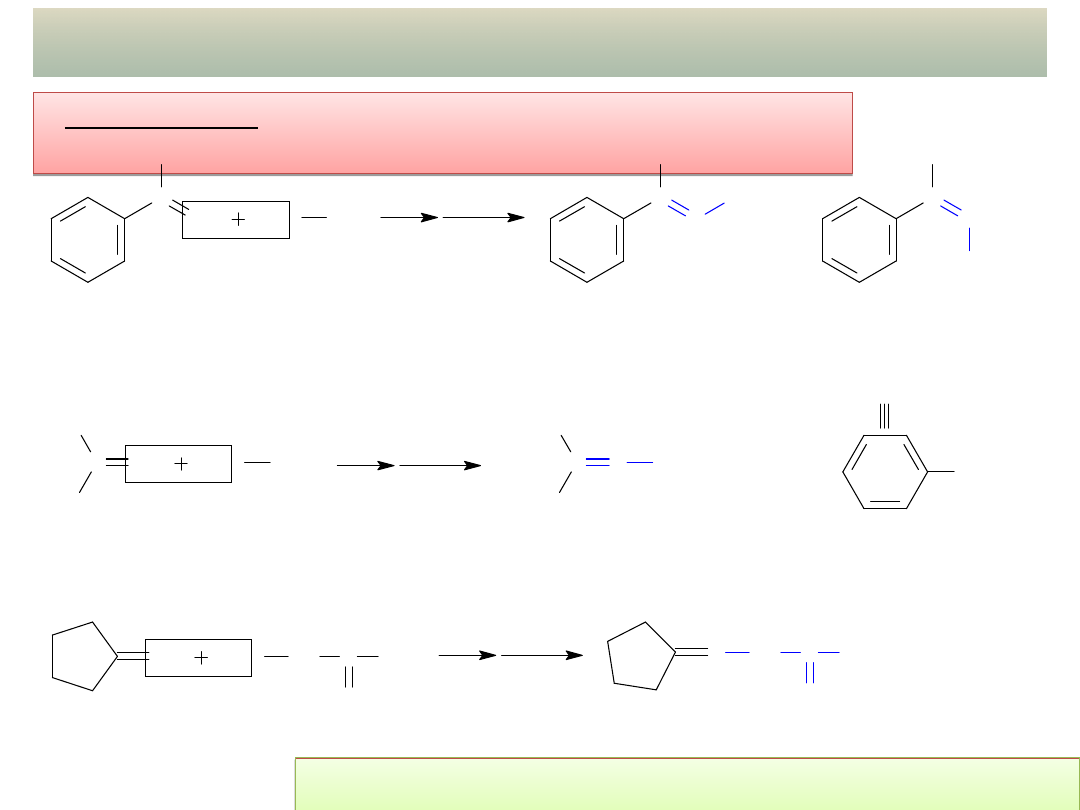
19
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Kondensacja z innymi pochodnymi amoniaku z
grupą –NH
2
:
- Kondensacja z innymi pochodnymi amoniaku z
grupą –NH
2
:
Jakie jest optymalne pH dla przedstawionych
reakcji? DLACZEGO???
Jakie jest optymalne pH dla przedstawionych
reakcji? DLACZEGO???
a)
C
H
O
H
2
N OH
hydroksyloamina
C
H
N
OH
(E)-
oksym
aldehydu
benzoesowego
b)
H
2
N NH
2
hydrazyna
aldehyd
benzoesowy
benzofenon
C
N NH
2
Ph
Ph
hydrazon
benzofenonu
c)
O
H
2
N NH C NH
2
O
semikarbazyd
N NH C NH
2
O
semikarbazon
cyklopentanonu
cyklopentanon
C
O
Ph
Ph
(Ph- : grupa fenylowa, C
6
H
5
-)
-H
2
O
-H
2
O
-H
2
O
(Z)-
oksym
aldehydu
benzoesowego
C
H
N
OH
+
wykład 11 –
Aldehydy i ketony

20
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
Mechanizm kondensacji związków karbonylowych z pochodnymi
amoniaku w środowisku kwaśnym:
Mechanizm kondensacji związków karbonylowych z pochodnymi
amoniaku w środowisku kwaśnym:
(na tablicy np. benzofenon z hydrazyną)
DLACZEGO:
a) dodatek kwasu przyspiesza tę reakcję (dwie przyczyny!)
b) dlaczego nadmiar kwasu całkowicie hamuje przebieg reakcji?
wykład 12 – Aldehydy i ketony
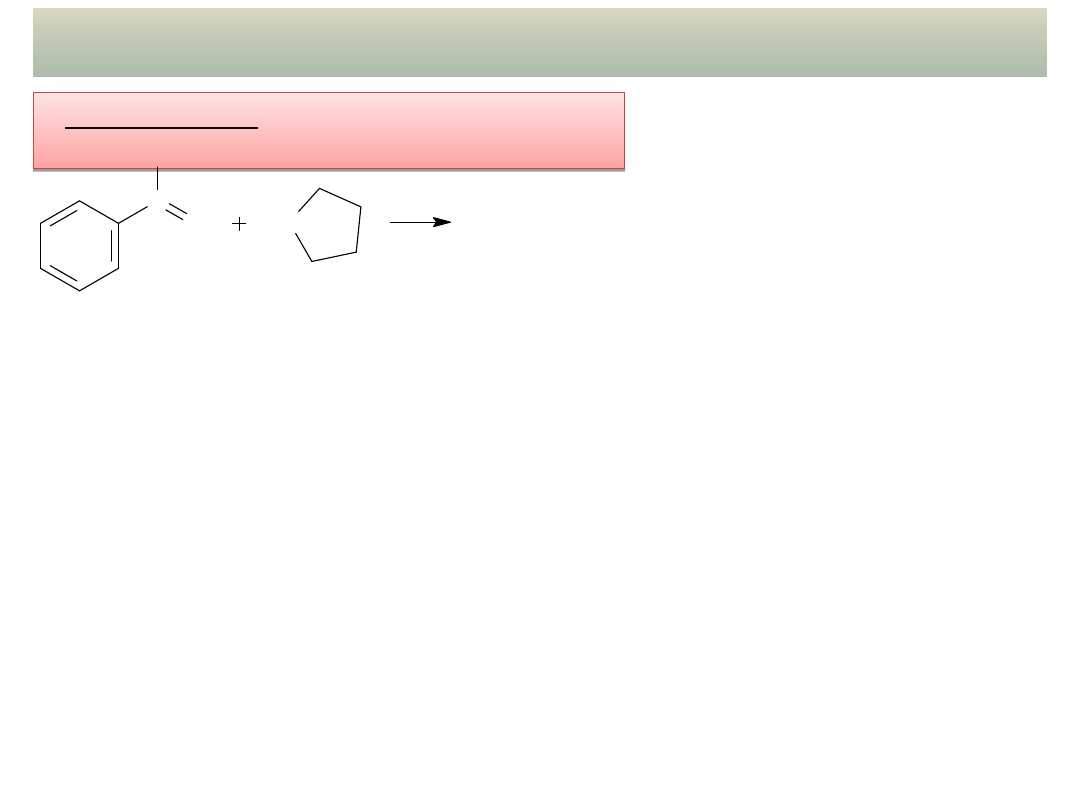
21
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Kondensacja z aminami
drugorzędowymi:
- Kondensacja z aminami
drugorzędowymi:
wykład 11 –
Aldehydy i ketony
(jak nazywa się typ związku powstający
w wyniku tej reakcji???)
C
CH
3
O
HN
pirolidyna
acetofenon
???
kat. H
+
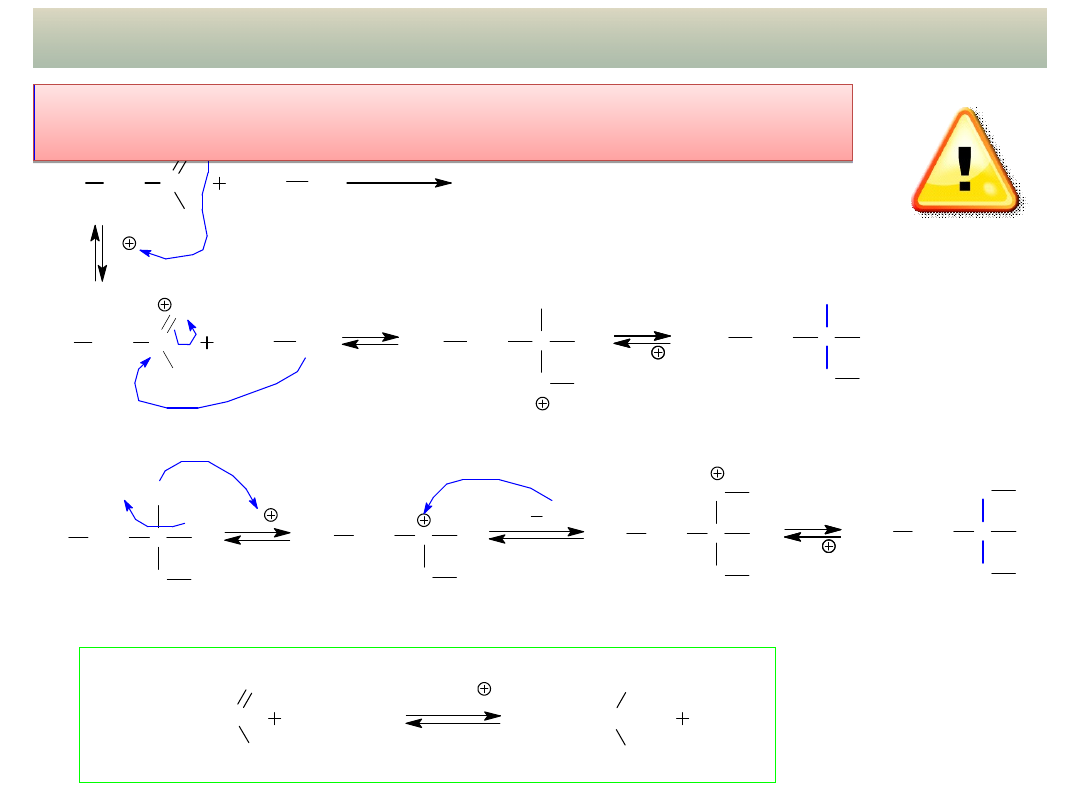
CH
3
CH
2
C
O
H
l
l
CH
3
OH
l
l
pH = 7
brak reakcji
H
pH < 2
CH
3
CH
2
C
OH
H
l
CH
3
OH
l
l
CH
2
C
OH
HO
H
CH
3
CH
3
l
l
l
-H
hemiacetal
(geminalny
hydroksyeter)
l
l
l
lO CH
3
CH
2
C
H
CH
3
OH
H
l
lO CH
3
CH
2
C
H
CH
3
-H
CH
3
OH
l
l
l
lO CH
3
CH
2
C
H
CH
3
HO CH
3
l
-H
-H
acetal
(geminalny dieter)
1,1-dimetoksypropan
sumarycznie:
CH
3
CH
2
C
O
H
2 CH
3
OH
kat. H
CH
3
CH
2
CH
OCH
3
OCH
3
H
2
O
l
l
l
lO
CH
3
CH
2
C
H
CH
3
OH
l
l
l
CH
2
C
H
CH
3
O
CH
3
O
CH
3
l
-H
2
Ol
l
22
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Addycja alkoholi – tworzenie HEMIACETALI i
ACETALI:
- Addycja alkoholi – tworzenie
HEMIACETALI i
ACETALI:
wykład 11 –
Aldehydy i ketony
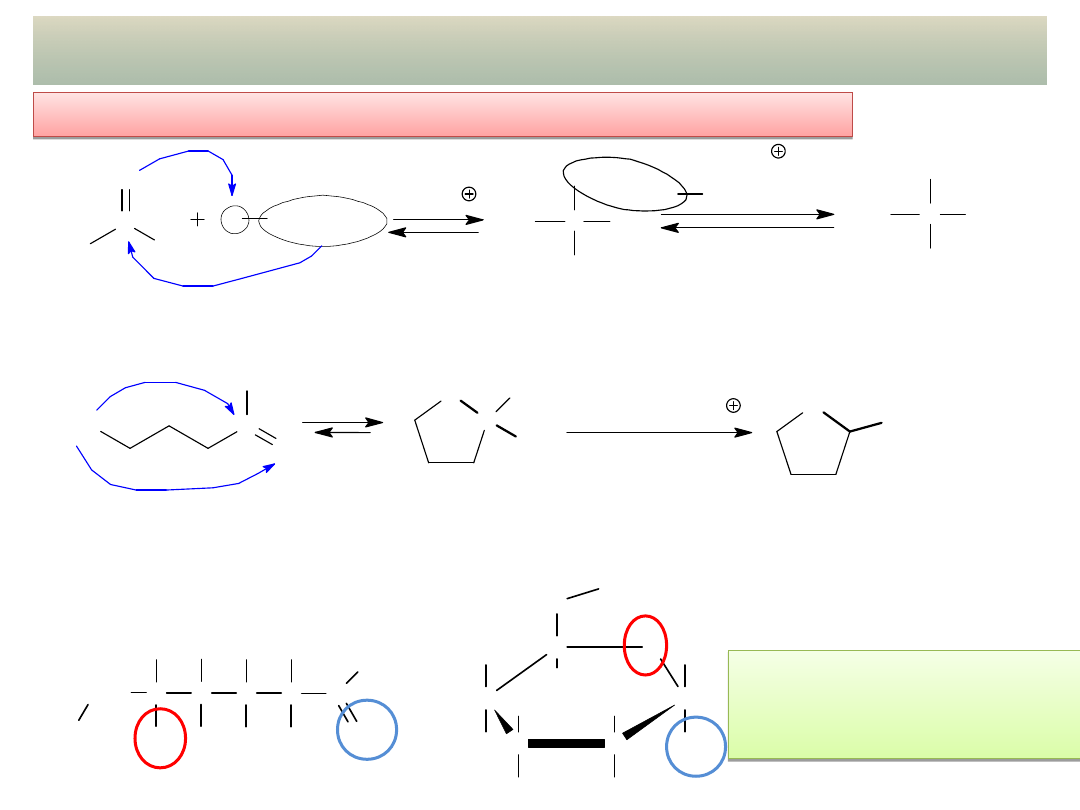
23
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Acetale i hemiacetale – cd.
- Acetale i hemiacetale – cd.
C
C
C
C
C
CH
2
O
H
O
H
OH
OH
H
H
OH
H
OH
H
C
O
C
C
C
C
OH
H
H
H
O
H
OH
H
OH
H
C
H
2
OH
c)
Glukopiranoza –
hemiacetal glukozy,
Forma cykliczna cukru
Glukopiranoza –
hemiacetal glukozy,
Forma cykliczna cukru
a)
CH
3
C
CH
3
O
H
OCH
2
CH
3
kat. H
OH
C
CH
3
OCH
2
CH
3
CH
3
hemiacetal
H
OCH
2
CH
3
-H
2
O
OCH
2
CH
3
C
CH
3
OCH
2
CH
3
CH
3
2,2-dietoksypropan
acetal
b)
H
O
C
H
O
C
O
H
OH
hemiacetal
wewnątrzcząsteczkowy
O
OCH
3
CH
2
acetal
wewnątrzcząsteczkowy
CH
3
CH
2
OH, H
aceton
etanol
4-hydroksybutanal
(aldehyd
-hydroksymasłowy)
2-etoksytetrahydrofuran
kat. H
wykład 11 –
Aldehydy i ketony
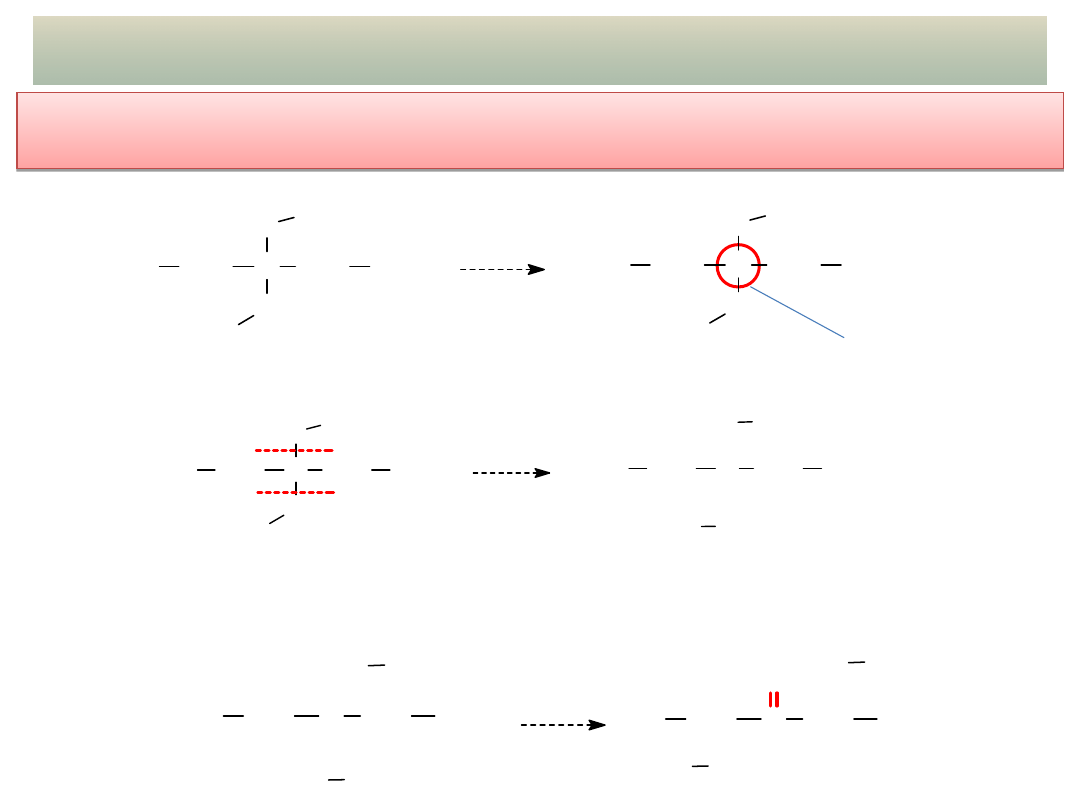
24
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Acetale i hemiacetale – cd. – ROZPOZNAWANIE i PROJEKTOWANIE
SYNTEZY
- Acetale i hemiacetale – cd. – ROZPOZNAWANIE i PROJEKTOWANIE
SYNTEZY
wykład 11 –
Aldehydy i ketony
- Wskazać acetalowy lub hemiacetalowy atom węgla:
CH
2
CH
2
C CH
2
CH
3
O
O
CH
3
CH
3
CH
2
CH
2
C CH
2
CH
3
O
O
CH
3
CH
3
acetalowy
- Rozciąć wirtualnie wiązania C-O (przy acetalowym atomie węgla):
CH
2
CH
2
C
CH
2
CH
3
O
O
CH
3
CH
3
CH
2
CH
2
C
CH
2
CH
3
O CH
3
O
CH
3
- Dopisać atomy wodoru do atomów tlenu,
a do acetalowego atomu węgla - karbonylowy atom tlenu
CH
2
CH
2
C
CH
2
CH
3
O
H
O CH
3
O
H
CH
3
CH
2
CH
2
C
CH
2
CH
3
O CH
3
O
CH
3
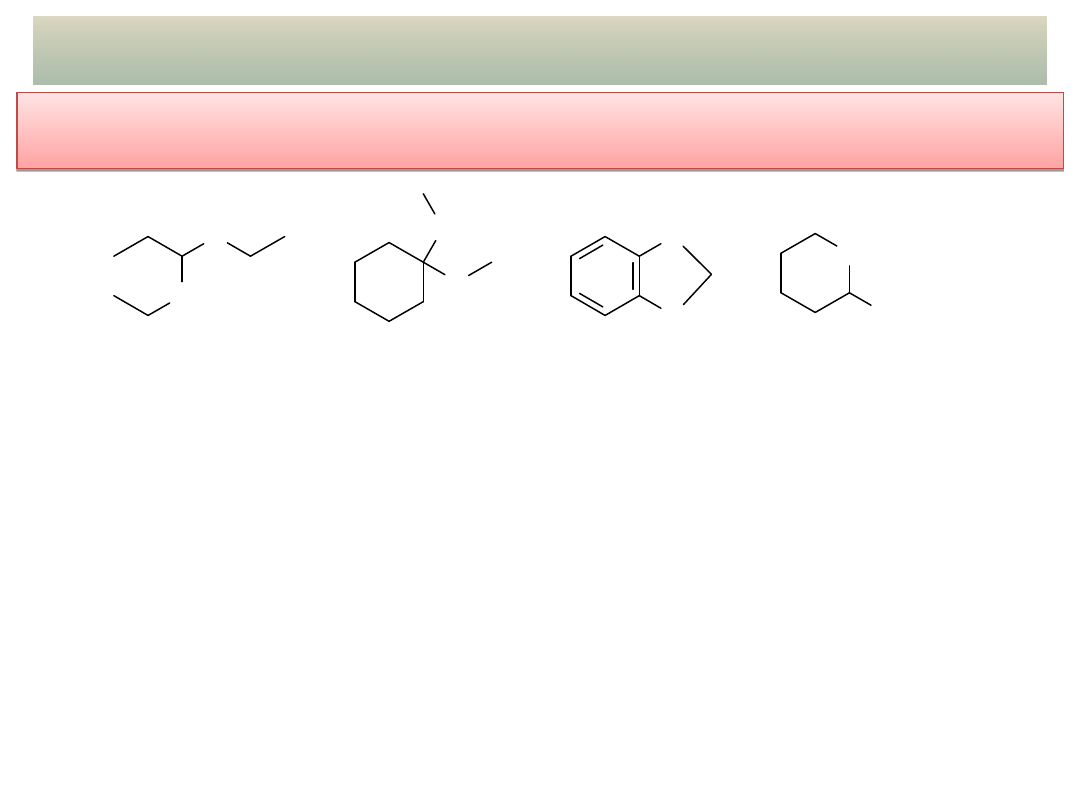
25
PRZYKŁADY ADDYCJI NUKLEOFILOWEJ – cd.
- Acetale i hemiacetale – cd. – ROZPOZNAWANIE i PROJEKTOWANIE
SYNTEZY
- Acetale i hemiacetale – cd. – ROZPOZNAWANIE i PROJEKTOWANIE
SYNTEZY
wykład 11 –
Aldehydy i ketony
Z jakich substratów można otrzymać poniższe związki:
O
O
O
O
O
O
O
OH
Które z tych związków ulegają jakiejkolwiek reakcji z:
a) 10% roztworem HCl
b) 10% roztworem NaOH
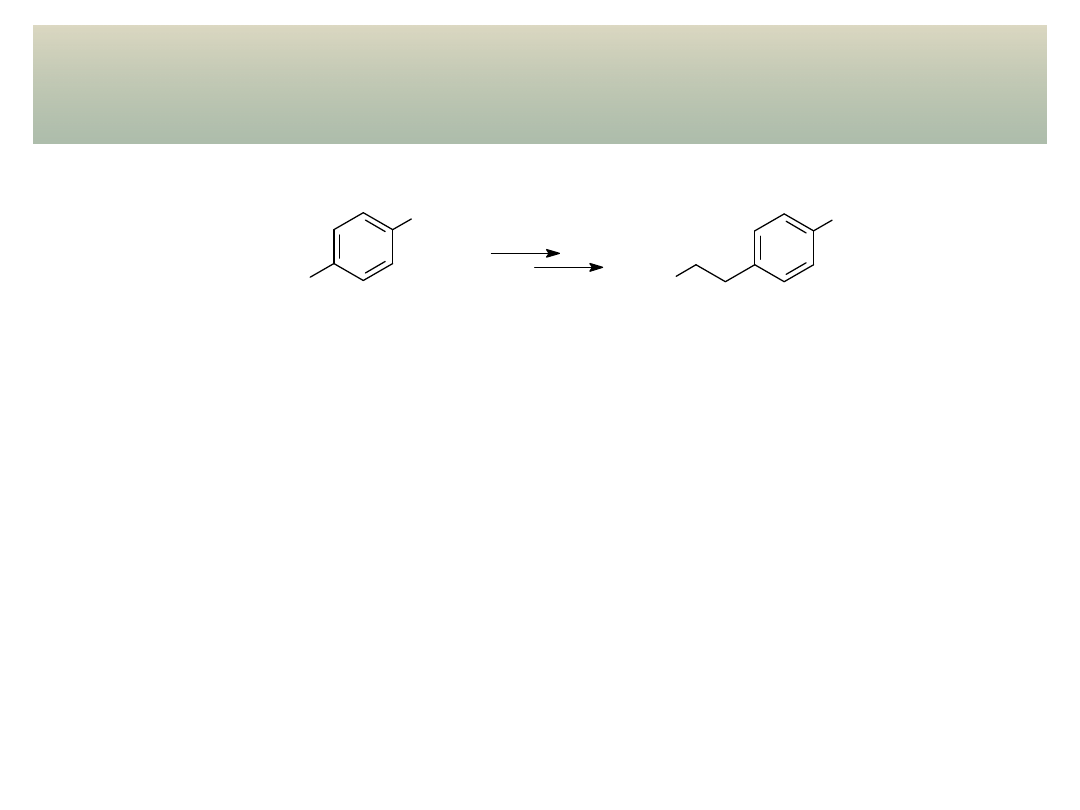
26
Planowanie syntez z udziałem aldehydów i
ketonów.
Acetale jako grupa zabezpieczająca.
wykład 11 – Aldehydy i ketony
Problem: Jak dokonać podanej poniżej transformacji wykorzystując związki Grignarda?
Br
CHO
CHO
HO
Chemia organiczna – wykłady dla studentów chemii – J.
Wilamowski 2010
27
TAUTOMERIA KETO-ENOLOWA
Formy enolowe aldehydów i ketonów (tautomeria keto-
enolowa:)
Formy enolowe aldehydów i ketonów (tautomeria keto-
enolowa:)
CH
3
CH
2
C
O
H
CH
3
CH C
OH
H
forma "ketonowa"
propanalu
forma enolowa
CH
C
OH
CH
3
CH
2
C
C
H
3
O
H
CH
2
C
OH
CH
2
trwalszy z enoli
mniej trwały enol
forma ketonowa
1-fenylopropan-2-onu
(fenyloacetonu)
O
C
CH
C
O
CH
3
H
3
C
H
trwała forma enolowa
pentano-2,4-dionu
CH
3
C
H
2
C
O
H
H
CH
3
C
H
C
O
H
H
forma "ketonowa"
propanalu
forma enolowa
C
H
C
O
H
CH
3
C
H
2
C
C
H
3
O
H
CH
2
C
O
H
C
H
2
trwalszy z enoli
mniej trwały enol
forma ketonowa
1-fenylopropan-2-onu
(fenyloacetonu)
O
C
CH
C
O
CH
3
H
3
C
H
trwała forma enolowa
pentano-2,4-dionu
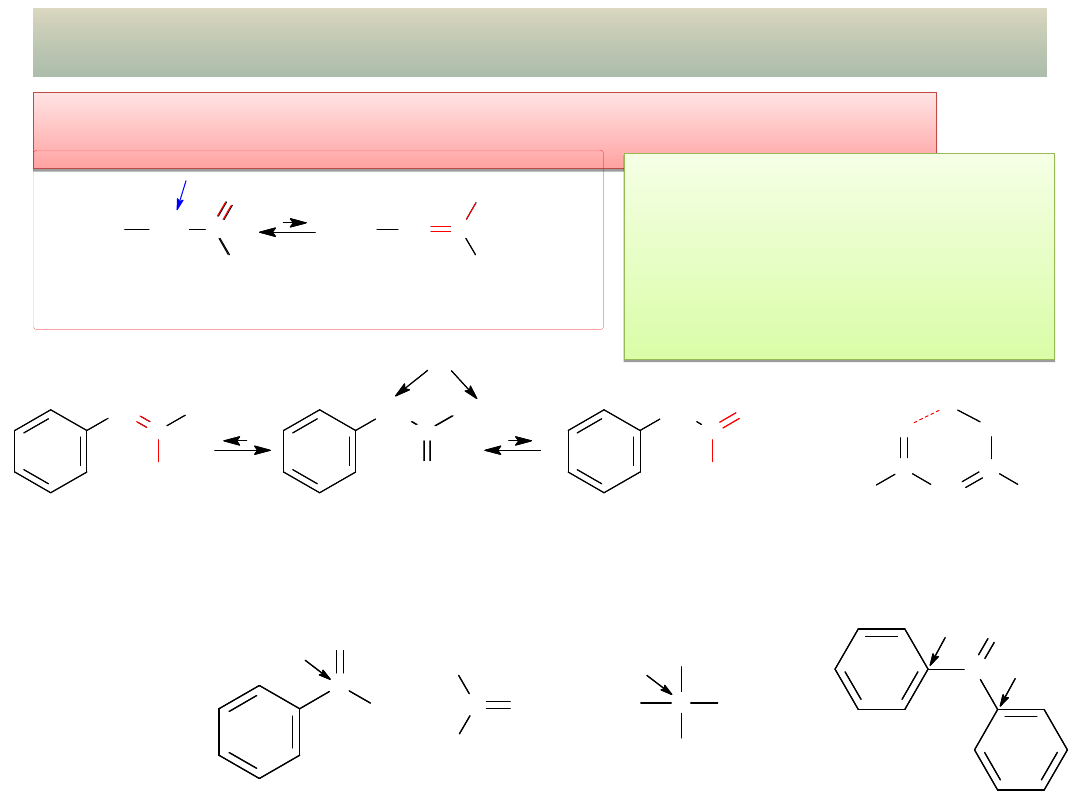
TAUTOMERY – izomery
pozostające
W równowadze, a różniące się
jedynie położeniem atomu
wodoru
i wiązań podwójnych
TAUTOMERY – izomery
pozostające
W równowadze, a różniące się
jedynie położeniem atomu
wodoru
i wiązań podwójnych
związki
nieenolizujące
(brak H
C
O
H
C O
H
H
CH
3
C
CH
3
CH
3
CHO
C
O
C
O
H
C O
H
H
CH
3
C
CH
3
CH
3
CHO
C
O
wykład 11 –
Aldehydy i ketony
28
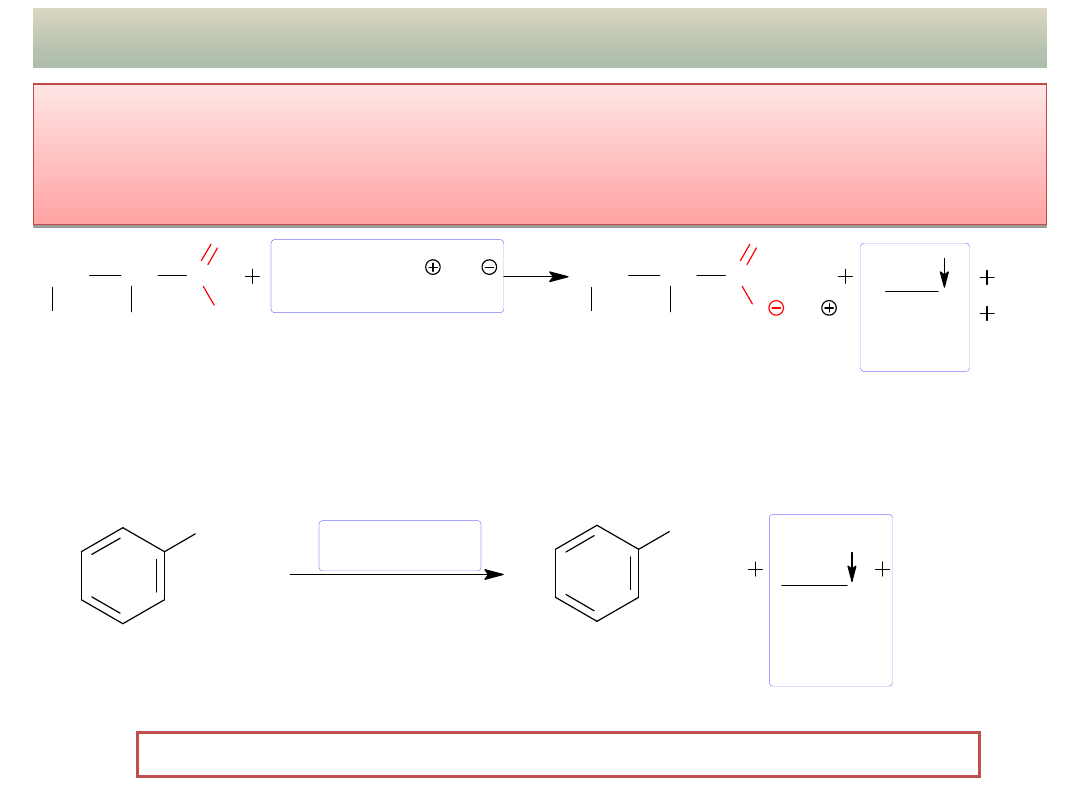
INNE REAKCJE: Utlenianie aldehydów
Aldehydy utleniają się nawet pod wpływem bardzo łagodnych
utleniaczy,
typowe reakcje charakterystyczne (prawie) tylko dla aldehydów
to:
Aldehydy utleniają się nawet pod wpływem bardzo łagodnych
utleniaczy,
typowe reakcje charakterystyczne (prawie) tylko dla aldehydów
to:
wykład 11 –
Aldehydy i ketony
a) próba Tollensa
CH
2
CH
C
O
H
OH
OH
2,3-dihydroksypropanal
aldehyd glicerynowy
CH
2
CH
C
O
O NH
4
OH
OH
sól amonowa kwasu
2,3-dihydroksypropanowego
3 NH
3
b) próba z odczynnikiem Fehlinga
CHO
COOH
lustro
srebrowe
ceglasto-
czerwony
osad
2 "Cu(OH)
2
"
aldehyd benzoesowy
kwas benzoesowy
(w alkalicznym środowisku
w postaci soli)
2 H
2
O
(jako kompleks
winianowy)
2 Ag
Cu
2
O
2 [Ag(NH
3
)
2
] OH
H
2
O
Aldehydy aromatyczne bardzo powoli ulegają tym reakcjom!
29
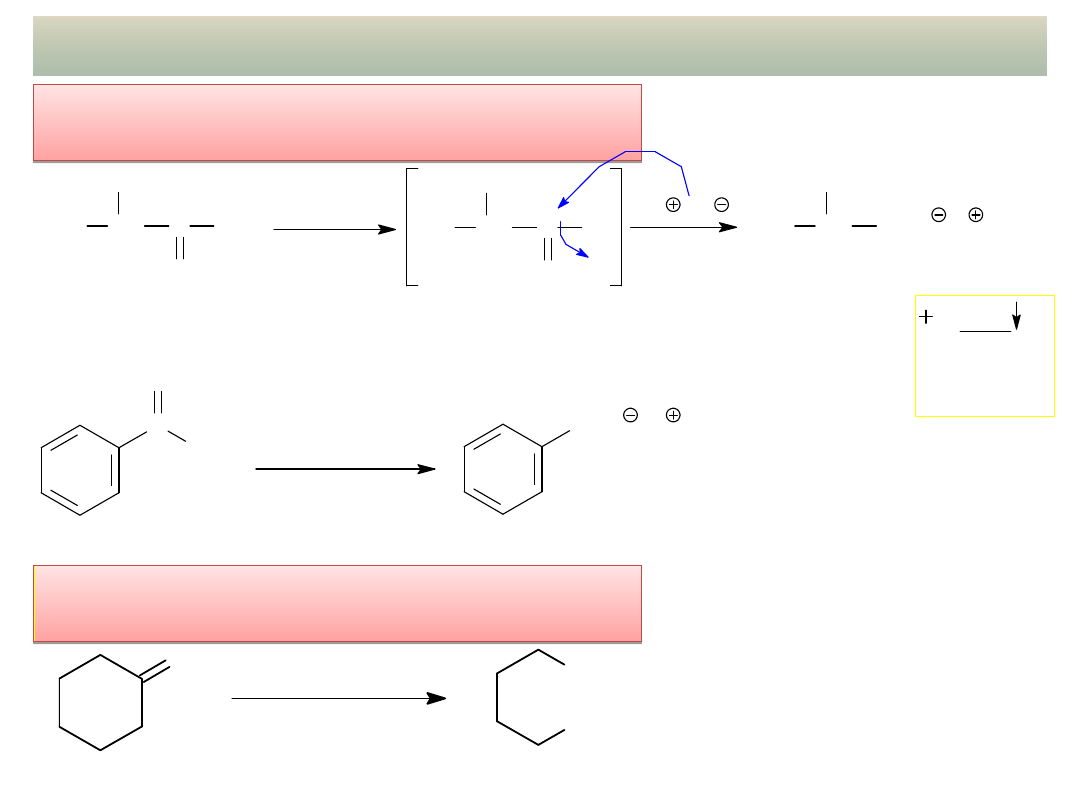
INNE REAKCJE: Utlenianie ketonów
Reakcja haloformowa ketonów
metylowych:
Reakcja haloformowa ketonów
metylowych:
a) CH
3
CH C
O
CH
3
CH
3
3-metylobutan-2-on
I
2
, NaOH
CH
3
CH C
O
CI
3
CH
3
Na OH
CH
3
CH COO Na
CH
3
2-metylopropanian sodu
jodoform
CHI
3
(żólty osad)
b)
C
O
CH
3
NaClO, NaOH
COO Na
acetofenon
benzoesan sodu
- CHCl
3
(chloroform)
wykład 12 – Aldehydy i ketony
Oksydatywne rozszczepienie
ketonów:
Oksydatywne rozszczepienie
ketonów:
O
stężony HNO
3
(mocny utleniacz)
COOH
COOH
kwas adypinowy
30
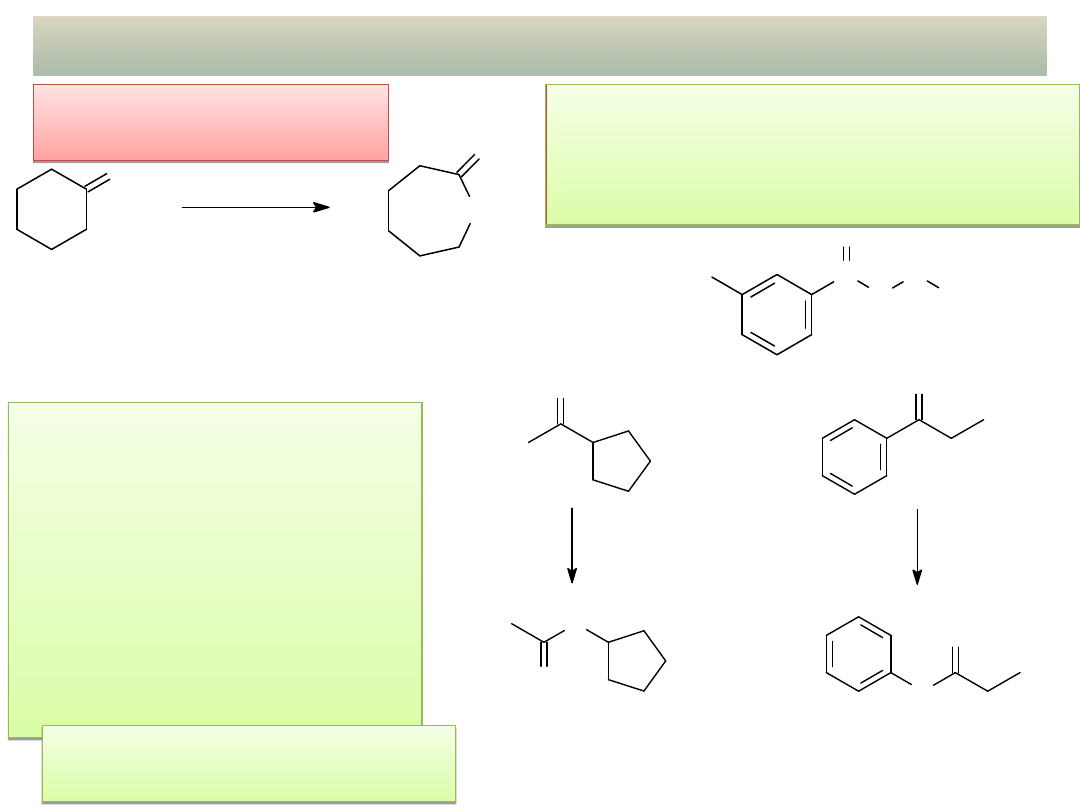
INNE REAKCJE: Utlenianie ketonów cd.
Reakcja Bayera-
Willigera:
Reakcja Bayera-
Willigera:
wykład 11 – Aldehydy i ketony
Utlenianie ketonów do estrów
pod wpływem utleniaczy
nadtlenkowych („wbudowanie” at.
tlenu przy grupie karbonylowej)
Utlenianie ketonów do estrów
pod wpływem utleniaczy
nadtlenkowych („wbudowanie” at.
tlenu przy grupie karbonylowej)
O
m-CPBA
m-CPBA:
O
O
Cl
C
O
O
O
H
- ArCOOH
ester wewnątrzcząsteczkowy
(lakton)
Reakcja Bayera-Willigera
jest regioselektywna:
w przypadku ketonów
niesymetrycznych atom
tlenu „wbudowuje” się po
stronie grupy karbonylowej
połączonej z grupą alkilową
o wyższej rzędowości lub po
stronie podstawnika
arylowego.
Reakcja Bayera-Willigera
jest regioselektywna:
w przypadku ketonów
niesymetrycznych atom
tlenu „wbudowuje” się po
stronie grupy karbonylowej
połączonej z grupą alkilową
o wyższej rzędowości lub po
stronie podstawnika
arylowego.
O
- CF
3
COOH
+ CF
3
CO
2
O
H
O
O
O
O
O
- PhCOOH
+ PhCO
2
O
H
propionian fenylu
octan cyklopentylu
(estry)
(PhCOOCH
2
CH
3
praktycznie nie powstaje)
Więcej: Clayden, t. 3 ,
rozdz. 8.
Więcej: Clayden, t. 3 ,
rozdz. 8.
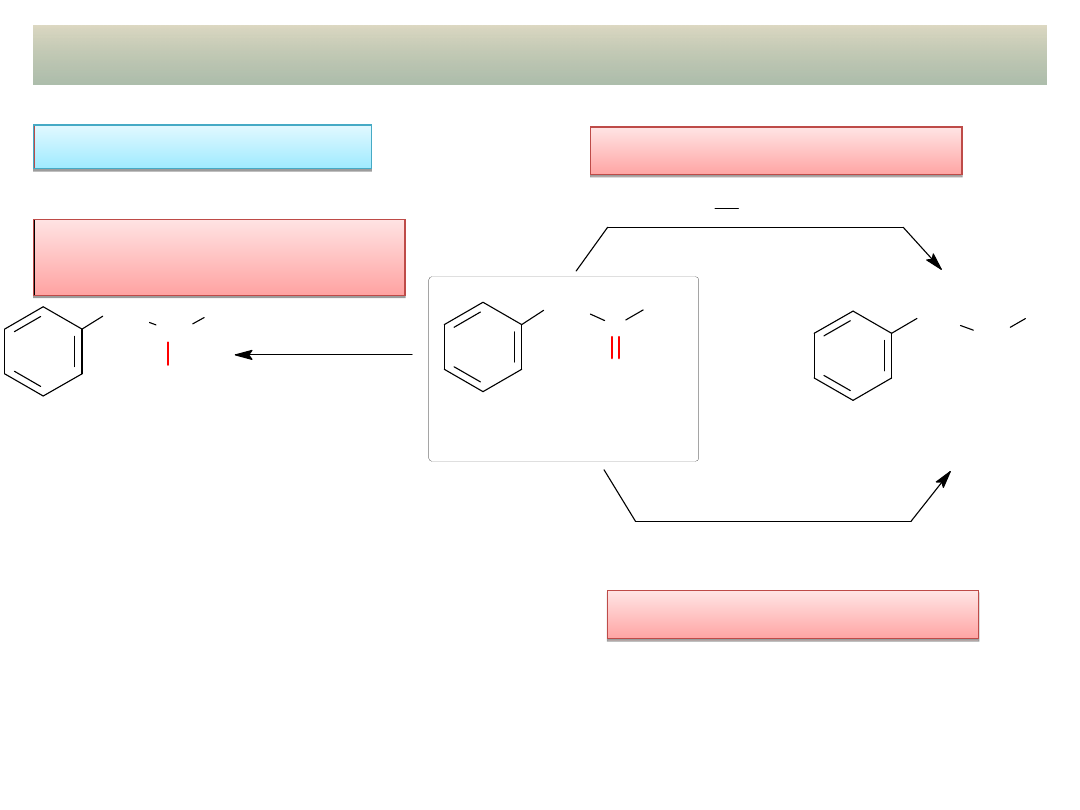
H
2
N NH
2
, KOH
redukcja Wolffa-Kiżniera
Zn (Hg), HCl
redukcja Clemmensena
CH
2
CH
2
CH
3
1-fenylopropan-2-on
(fenyloaceton)
propylobenzen
(1-fenylopropan)
CH
2
C
CH
3
O
CH
OH
CH
2
CH
3
LiAlH
4
lub NaBH
4
lub H
2
/ Pt
31
REDUKCJA ALDEHYDÓW I KETONÓW
Redukcja C=O do CH-
OH
Redukcja C=O do CH-
OH
Redukcja C=O do CH
2
Redukcja C=O do CH
2
Redukcja C=O do CH
2
Redukcja C=O do CH
2
W LABORATORIUM:
W LABORATORIUM:
wykład 11 –
Aldehydy i ketony
PROBLEM:
Wykorzystując m.in. reakcje acylowania F-C oraz reakcje redukcji związków karbonylowych
zaproponuj 2 – 3 etapowe metody syntezy:
a) m-(n-butylo)aniliny
b) 1-(m-nitrofenylo)butanu
c) 1-fenyloprop-1-enu
Dlaczego reakcje alkilowania Friedela-Craftsa byłyby nieefektywne w tych syntezach?
32
REDUKCJA GRUPY KARBONYLOWEJ
W ORGANIZMACH ŻYWYCH
Zredukowany dinukleotyd nikotynoamidoadeninowy (NADH)
Zredukowany dinukleotyd nikotynoamidoadeninowy (NADH)
Forma utleniona dinukleotydu nikotynoamidoadeninowego (NAD
+
)
Forma utleniona dinukleotydu nikotynoamidoadeninowego (NAD
+
)
amid kwasu
nikotynowego
adenina
Anion mleczanowy
(hydroksyester)
Anion mleczanowy
(
hydroksy
ester)
Anion pirogronianowy
(ketoester)
Anion pirogronianowy
(
keto
ester)
REDUKCJA
REDUKCJA
wykład 11 –
Aldehydy i ketony
33
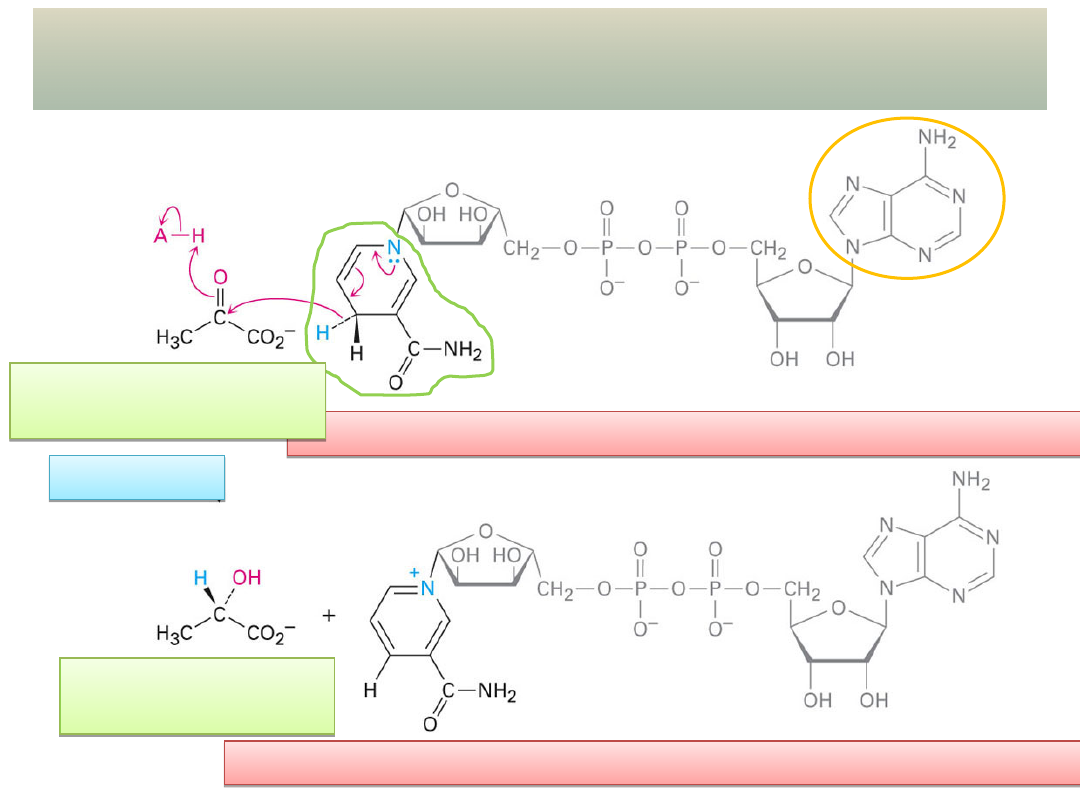
AMINOWANIE REDUKCYJNE
ALDEHYDÓW
i KETONÓW
W LABORATORIUM:
W LABORATORIUM:
W ORGANIZMACH
ŻYWYCH:
W ORGANIZMACH
ŻYWYCH:
-H
2
O
imina
CH
2
C
O
COO
-
CH
2
COO
-
H
2
N-H
+
reduktor:
NADH
umowne źródło
amoniaku
kondensacja
CH
2
C
NH
COO
-
CH
2
COO
-
- NAD
+
CH
2
CH
CH
2
COO
-
NH
2
COO
-
anion kwasu
-ketoglutarowego
anion kwasu glutaminowego
(jednego z -aminokwasów)
wykład 11 –
Aldehydy i ketony
-H
2
O
N-metylo-1-fenyloetanoamina
imina
C
O
CH
3
H
2
N CH
3
+
reduktor - np.:
H
2
/Pt lub NaBH
3
CN
C
H
CH
3
N
H
CH
3
C
CH
3
N CH
3
acetofenon
metanoamina
H
2
/Pt
kondensacja
redukcja
34
Dysproporcjonowanie aldehydów bez
wodorów
pod wpływem zasad: reakcja Cannizzaro
wykład 11 –
Aldehydy i ketony
Aldehydy bez wodorów pod wpływem zasady ulegają
dysproporcjonowaniu:
Aldehydy bez wodorów pod wpływem zasady ulegają
dysproporcjonowaniu:
2
C
O
H
NaOH
COO Na
CH
2
OH
aldehyd
benzoesowy
benzoesan sodu
(produkt utlenienia)
alkohol benzylowy
(produkt redukcji))
reakcja
Cannizzaro
+ OH
Ph
C
O
H
OH
+ OH
- H
2
O
Ph
C
O
H
O
+ Ph
C
O
H
Ph
C
O
O
+
Ph
C
O
H
H
+ Na
- OH
+ H
2
O
Wiedząc, że dialdehydy mogą ulegać reakcji Cannizzaro
w sposób wewnątrzcząsteczkowy,
zaproponuj produkty, które powstaną z:
CHO
CHO
A)
B)
O
H
O
H

35
UWAGA
W materiałach nie uwzględniono m. in. reakcji
Wittiga oraz addycji 1,4 do układów sprzężonych,
które przedstawiono w podręczniku McMurry’ego i
zostaną
omówione na wykładach prof. Młynarskiego.
Zagadnienia te należy traktować jako
obowiązkowe
i niezbędne do poprawnego rozwiązania
dostarczonych
zadań!
wykład 11 –
Aldehydy i ketony
36
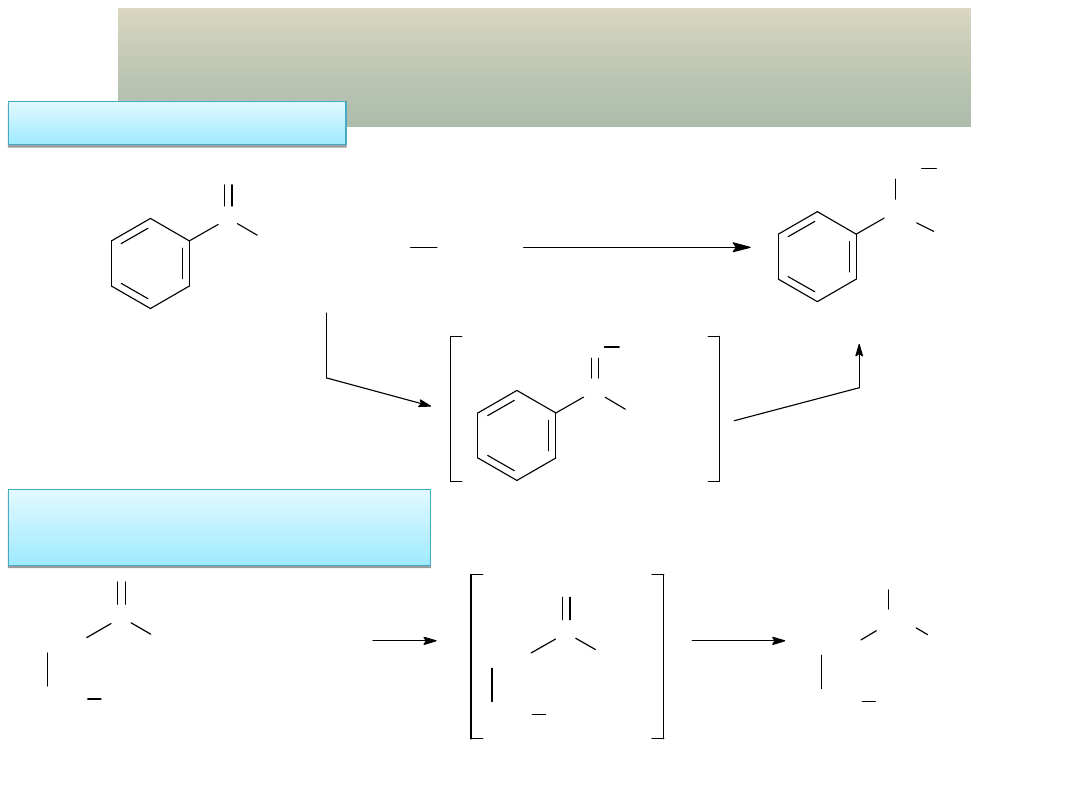
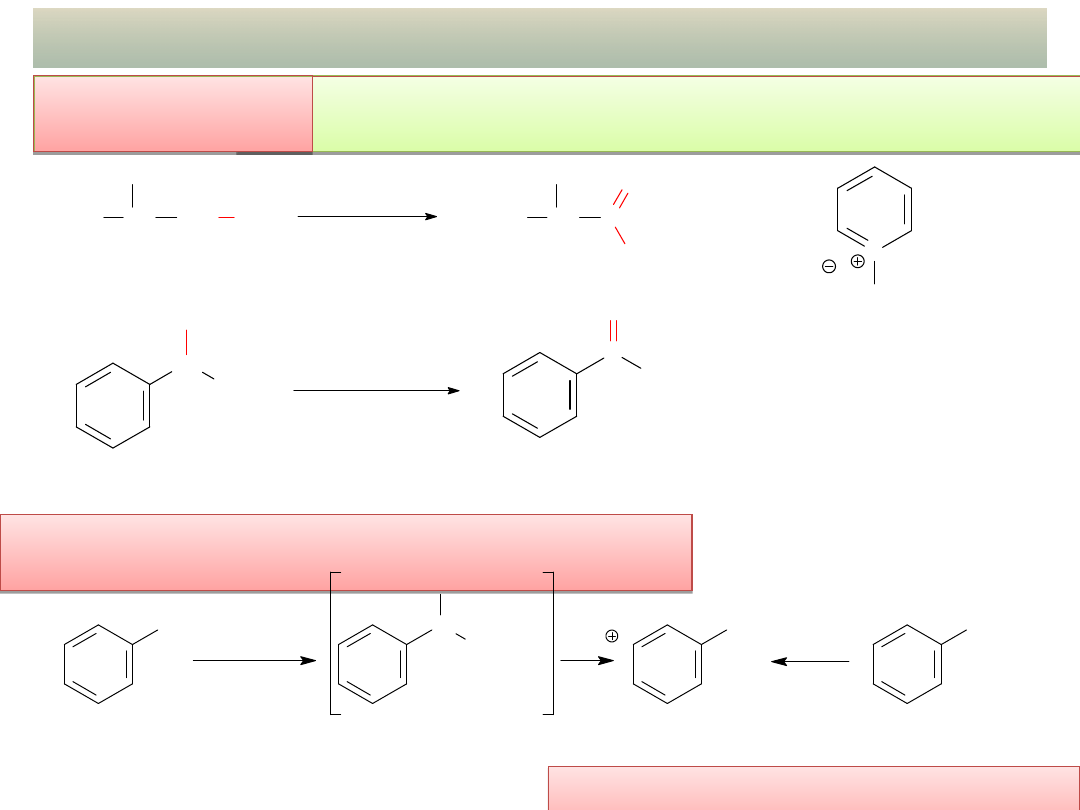
OTRZYMYWANIE ALDEHYDÓW I KETONÓW
Utlenianie metyloarenów w bezwodniku
octowym:
Utlenianie metyloarenów w bezwodniku
octowym:
UWAGA 1: Aby otrzymać aldehyd w reakcji utleniania alkoholu 1
o
należy użyć selektywnego utleniacza! (dlaczego?)
UWAGA 1: Aby otrzymać aldehyd w reakcji utleniania alkoholu 1
o
należy użyć selektywnego utleniacza! (dlaczego?)
wykład 11 – Aldehydy i ketony
Utlenianie
alkoholi:
Utlenianie
alkoholi:
a) CH
3
CH
CH
2
OH
CH
3
2-metylopropan-1-ol
(
alkohol 1
o
)
PCC
CH
3
CH
C
CH
3
O
H
2-metylopropanal
b)
CH
OH
CH
3
K
2
Cr
2
O
7
/ H
2
SO
4
C
O
CH
3
1-fenyloetanol
(
alkohol 2
o
)
acetofenon
N
H
ClCrO
3
chlorochromian
pirydyny (
PCC
)
łagodne
utlenianie
utlenianie
CHO
CH
3
CrO
3
(CH
3
CO)
2
O
CH
OCOCH
3
OCOCH
3
H
3
O
c)
H
2
O
CHCl
2
toluen
aldehyd benzoesowy
dichlorometylobenzen
(chlorek benzylidenu)
Hydroliza dihalogenków
geminalnych
Hydroliza dihalogenków
geminalnych
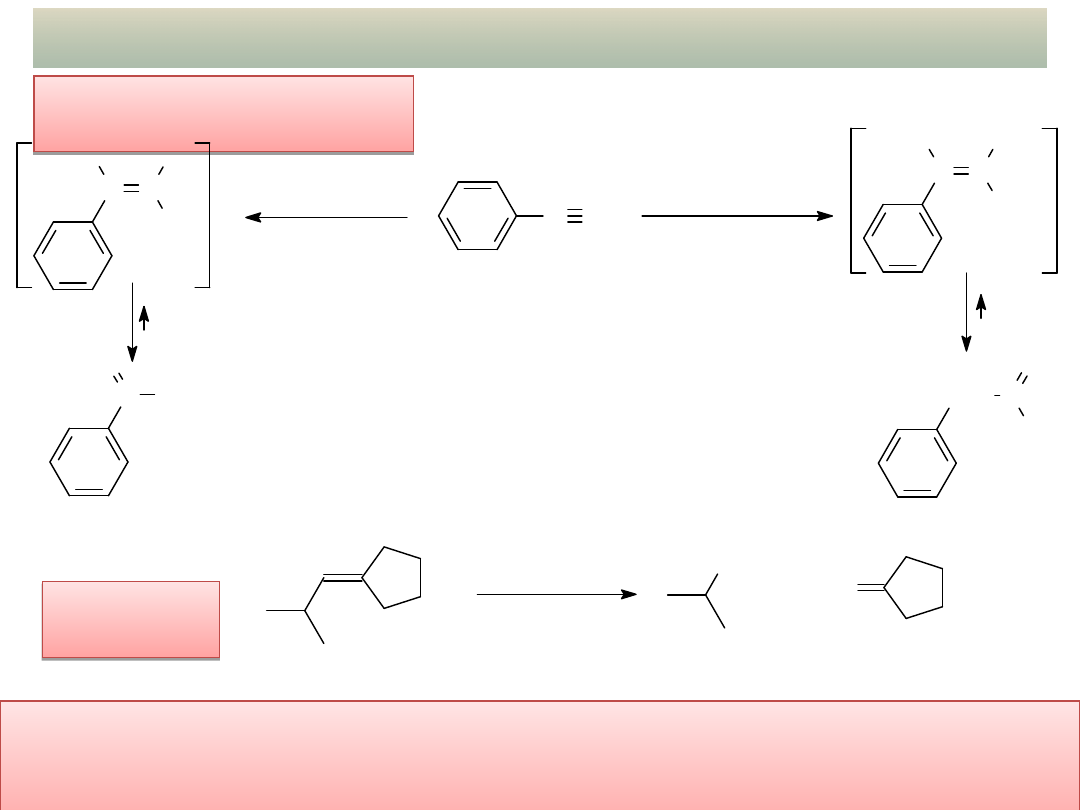
37
OTRZYMYWANIE ALDEHYDÓW I KETONÓW
Ozonoliza
alkenów:
Ozonoliza
alkenów:
wykład 11– Aldehydy i ketony
Addycja wody do
alkinów:
Addycja wody do
alkinów:
Selektywna redukcja pochodnych kwasów karboksylowych do
aldehydów
oraz reakcje pochodnych kwasów ze związkami metaloorganicznymi
prowadzące do ketonów zostaną omówione w dalszej części kursu!
Selektywna redukcja pochodnych kwasów karboksylowych do
aldehydów
oraz reakcje pochodnych kwasów ze związkami metaloorganicznymi
prowadzące do ketonów zostaną omówione w dalszej części kursu!
1. O
3
2. Zn/H
2
O
O
CHO
+
aldehyd izomasłowy cyklopentanon
(2-metylopropylideno)cyklopentan
C CH
1. (BH
3
)
2
2. H
2
O
2
, NaOH
+ H
2
O,
kat. Hg
++
, H
2
SO
4
C CH
3
O
CH
2
C
O
H
C C
HO
H
H
C C
H
OH
H
addycja wody
zgodna z regułą
Markownikowa
addycja wody
niezgodna z regułą
Markownikowa
acetofenon
aldehyd fenylooctowy
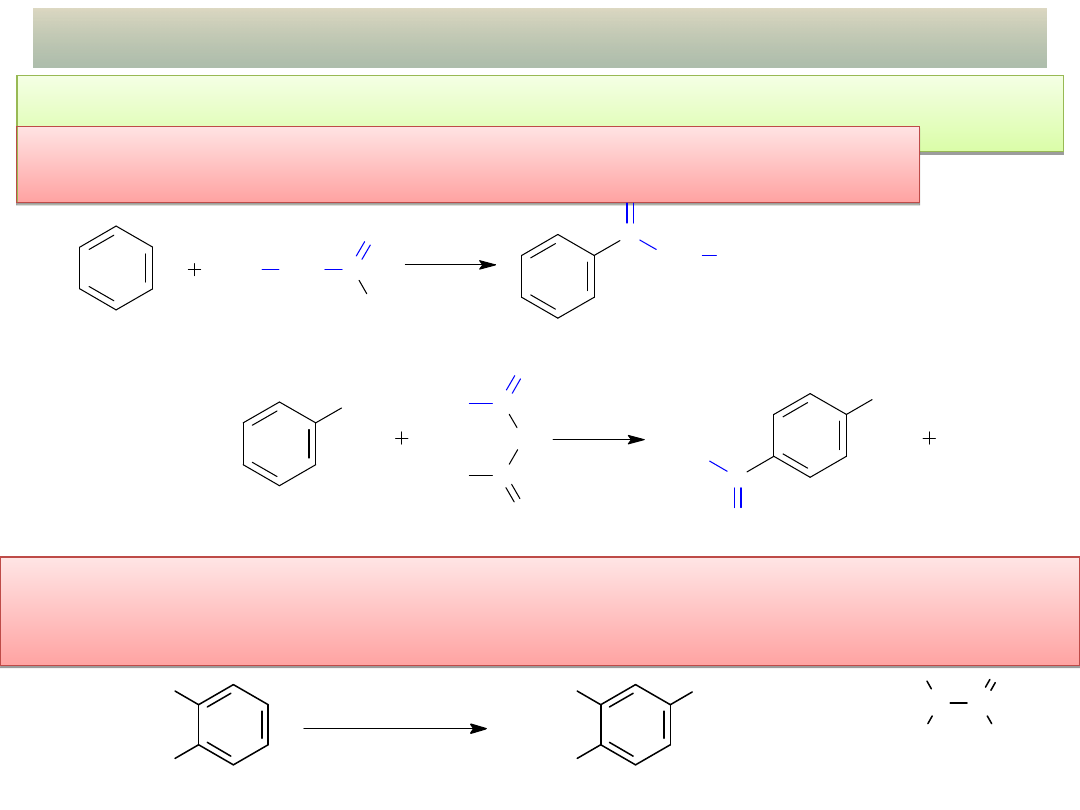
38
OTRZYMYWANIE AROMATYCZNYCH ALD. I
KET.
UWAGA 2: Reakcji acylowania Friedela-Craftsa nie ulegają dezaktywowane
pierścienie aromatyczne !
UWAGA 2: Reakcji acylowania Friedela-Craftsa nie ulegają dezaktywowane
pierścienie aromatyczne !
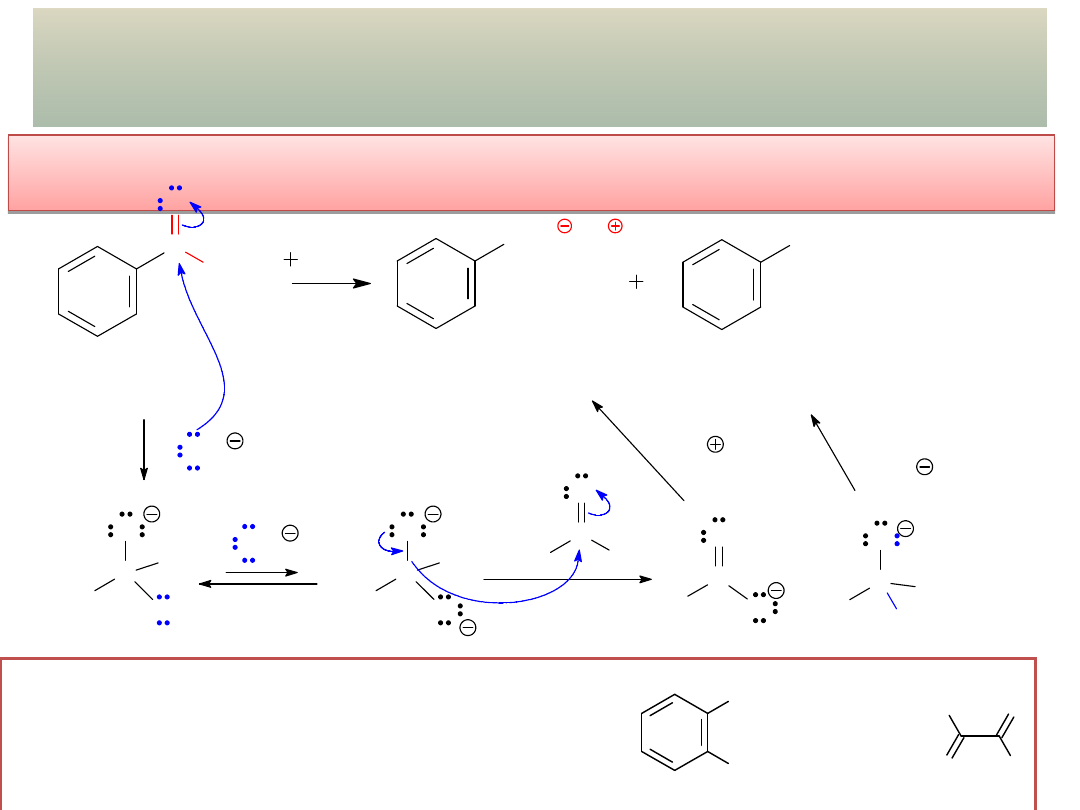
Acylowanie Friedela-Craftsa arenów chlorkami lub
bezwodnikami kwasowymi:
Acylowanie Friedela-Craftsa arenów chlorkami lub
bezwodnikami kwasowymi:
Chlorek formylu (HCOCl) istnieje tylko w temp. < -100
o
C i nie nadaje
się do acylowania arenów. Formylowanie wymaga złozonych
procedur i ulegają mu tylko silnie aktywowane pierścienie!
Chlorek formylu (HCOCl) istnieje tylko w temp. < -100
o
C i nie nadaje
się do acylowania arenów. Formylowanie wymaga złozonych
procedur i ulegają mu tylko silnie aktywowane pierścienie!
wykład 11 – Aldehydy i ketony
CH
3
O
CH
3
O
1. DMF, POCl
3
2. H
2
O
N C
O
H
H
3
C
H
3
C
DMF
(dimetyloformamid)
CH
3
O
CH
3
O
CHO
formylowanie
Vilsmeyera-Haacka
a)
CH
3
CH
2
C
O
Cl
AlCl
3
-HCl
C
O
CH
2
CH
3
chlorek kwasu propanowego
1-fenylopropan-1-on
(propiofenon)
b)
CH
3
CH
3
C
O
C
CH
3
O
O
AlCl
3
CH
3
C
CH
3
O
4-metyloacetofenon
CH
3
COOH
benzen
toluen
bezwodnik octowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
aldehydy i ketony zadania
13 Aldehydy i ketony kondensacja aldolowa
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
Aldehydy i ketony
wyk 8 aldehydy,ketony cd
6 aldehydy,ketony
Aldehydy i ketonywisła
Aldehydy i ketony
aldehydy, ketony, hemiacetale
więcej podobnych podstron