wykład:
Aldehydy i Ketony
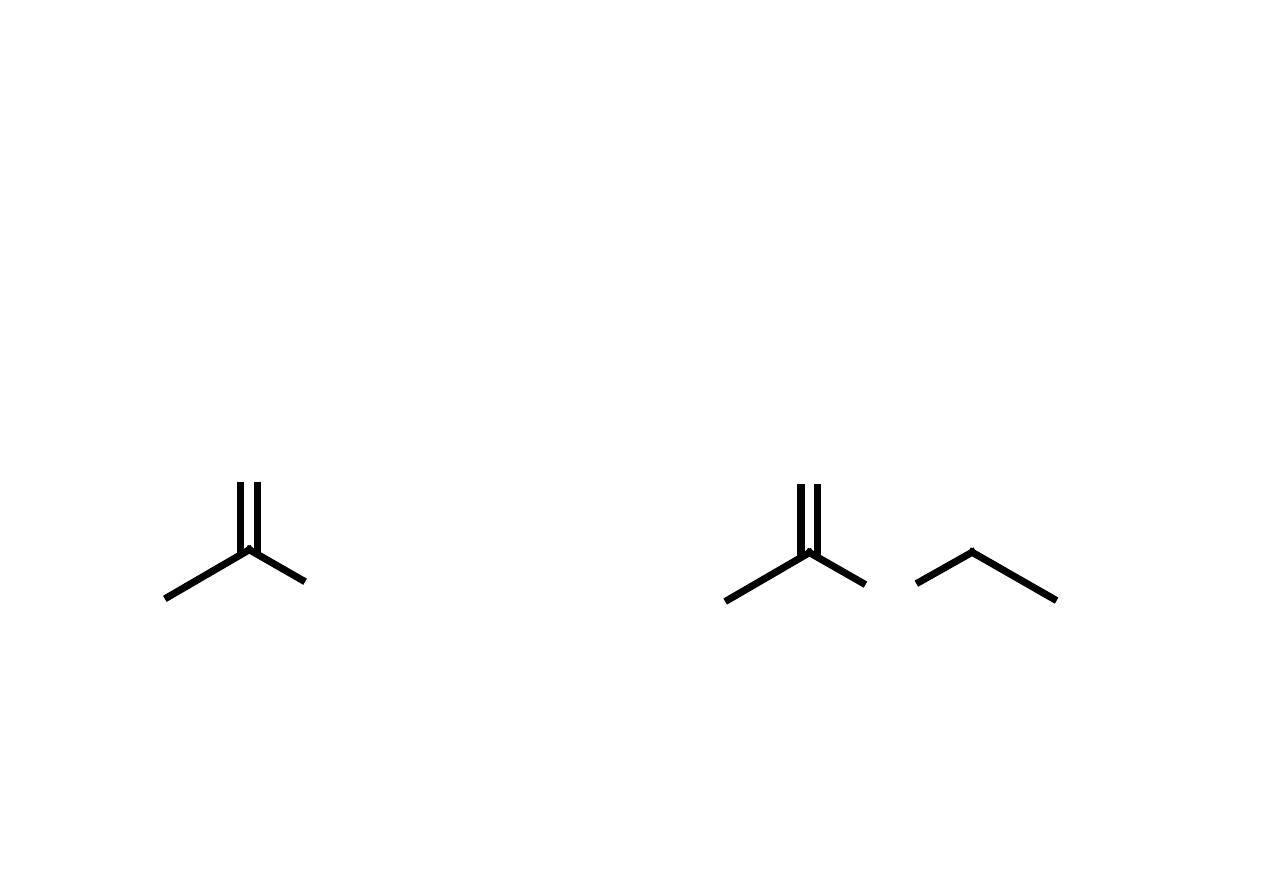
H
O
O
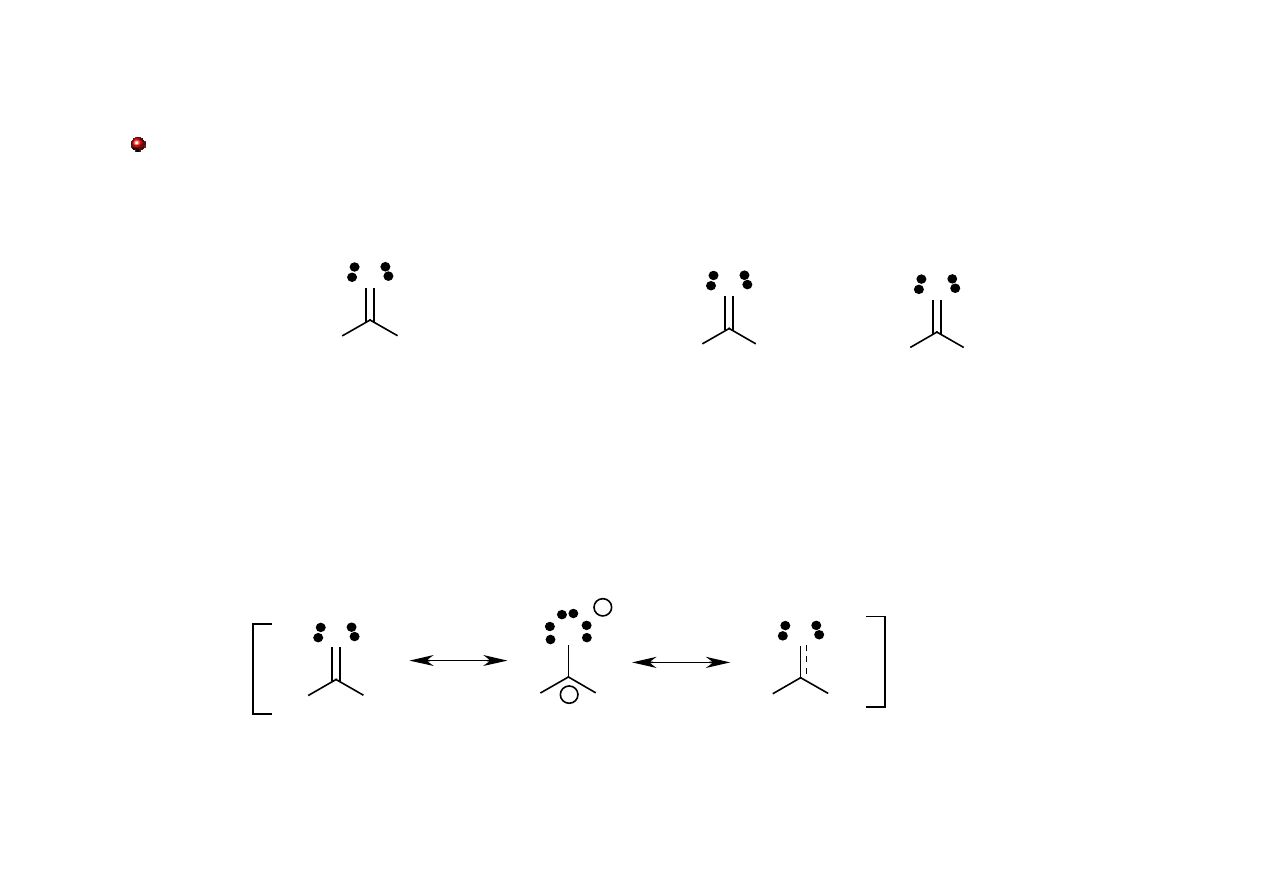
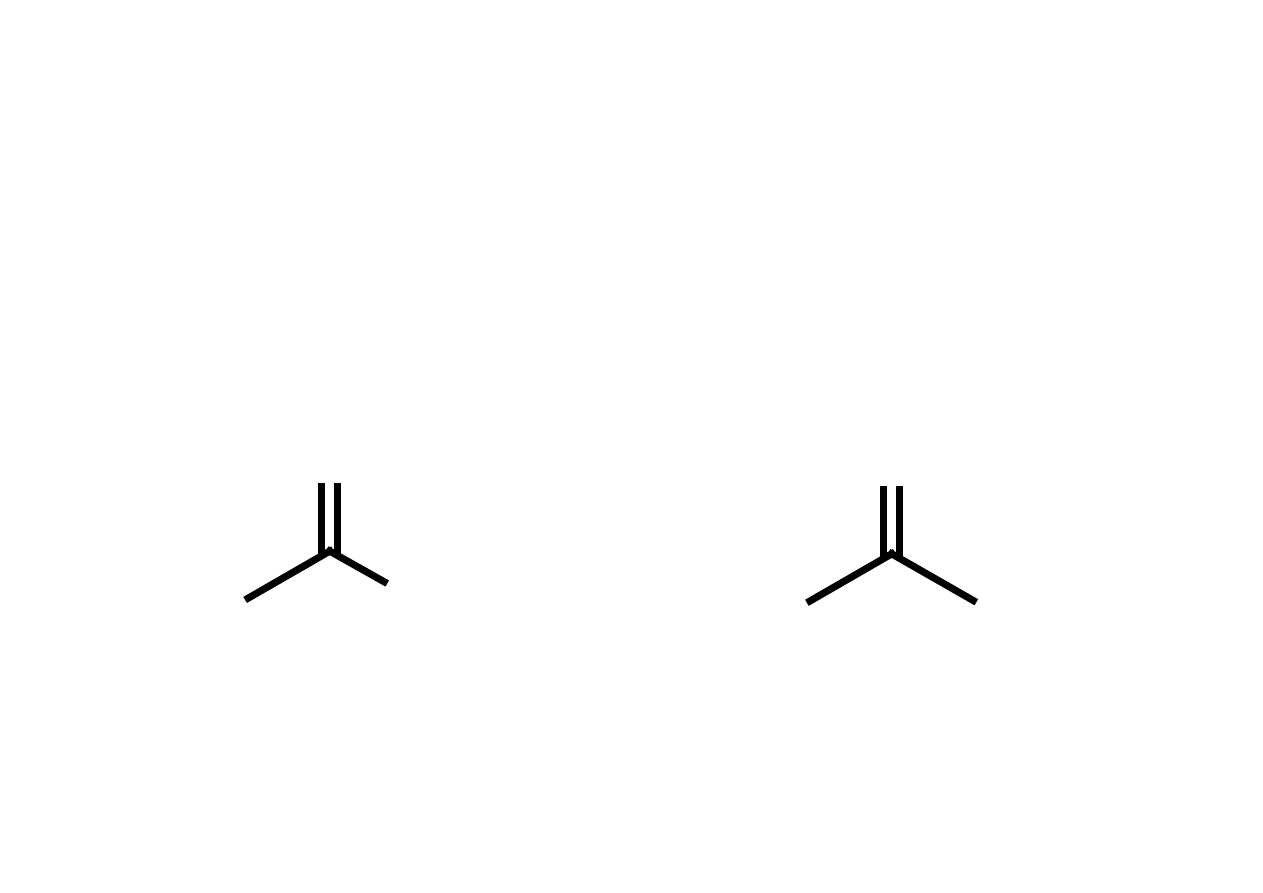
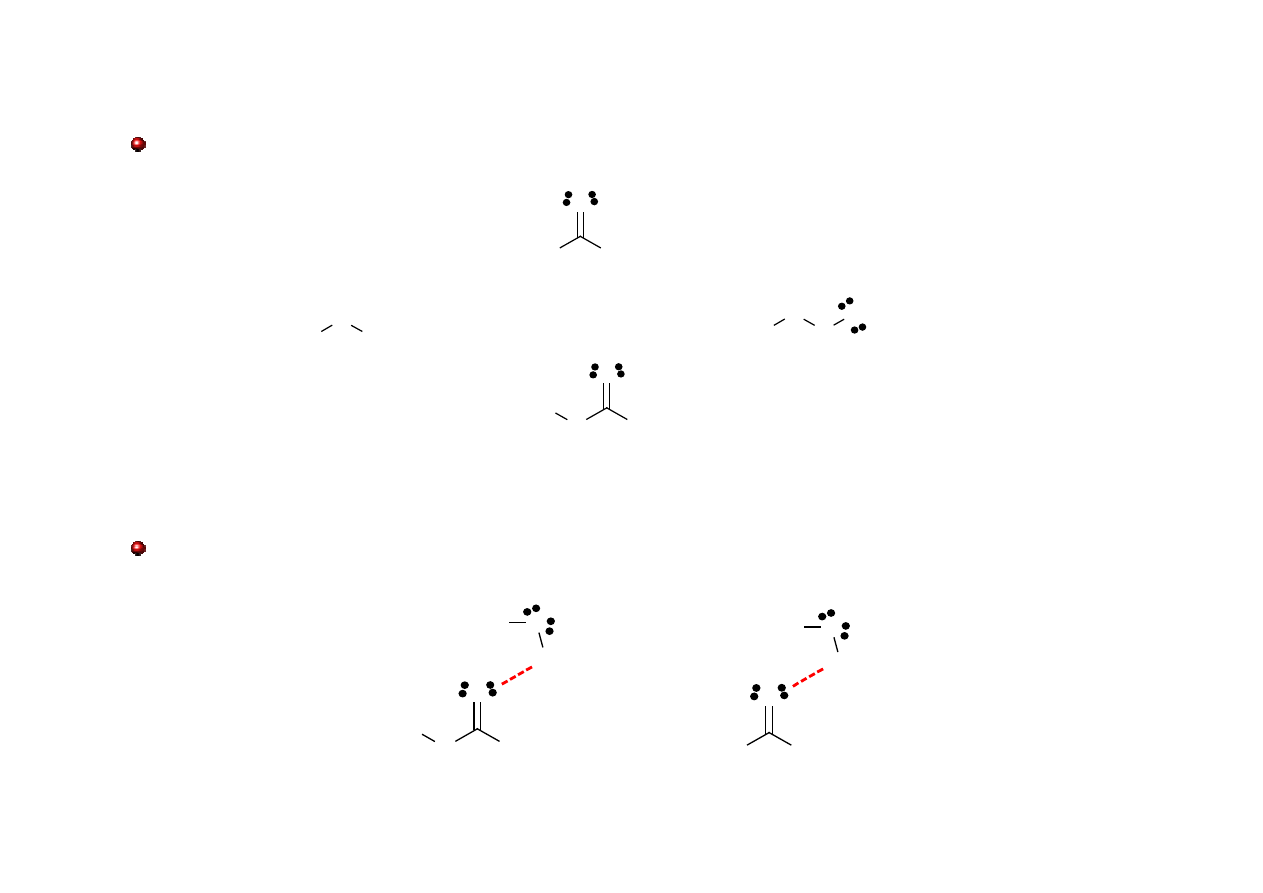
Grupa karbonylowa
Grupa karbonylowa - grupa funkcyjna występująca w wielu typach związków
organicznych, składająca się z atomu węgla połączonego wiązaniem podwójnym z atomem
tlenu.
A
B
O
A
B
O
A
B
O
+
_
A
B
O
R
H
O
R
R
O
sp
2
δ+
δ-
A = atom wę gla lub wodoru B = atom wodoru aldehyd
A = B = atom wę gla keton
σ π
keton
aldehyd
Aldehydy i ketony: właściwości fizykochemiczne
Związki polarne (temperatury wrzenia wyższe niż dla węglowodorowych analogów ale
niższe niż dla alkoholi).
Aldehydy i ketony (do czterech atomów węgla) są całkowicie lub częściowo
rozpuszczalne w wodzie. Dobrze rozpuszczają się w większości rozpuszczalników
organicznych.
C
H
3
C
H
2
CH
3
C
H
3
CH
3
O
C
H
3
C
H
2
C
H
2
OH
C
H
2
C
H
3
H
O
propan
tw -42
o
C
n
-propanol
tw 97
o
C
aceton
tw 56
o
C
propanal
tw 49
o
C
C
H
3
CH
3
O
C
H
2
C
H
3
H
O
H O
H
H O
H
Aldehydy: nazewnictwo
Nazwy aldehydów łańcuchowych tworzy się przez dodanie przyrostka –al do nazwy
węglowodoru zawierającego tę samą (co aldehyd) liczbę atomów węgla.
Grupa aldehydowa ma pierwszeństwo w nazwie przed grupami: C=C, C≡C, OH.
Numeracja dotycząca wiązań podwójnych i podstawników podlega ogólnym regułom.
H
O
H
O
H
O
H
O
H
O
H
O
H
metanal
etanal
propanal
pentanal
3-metyloheksanal
heks-5-enal
!
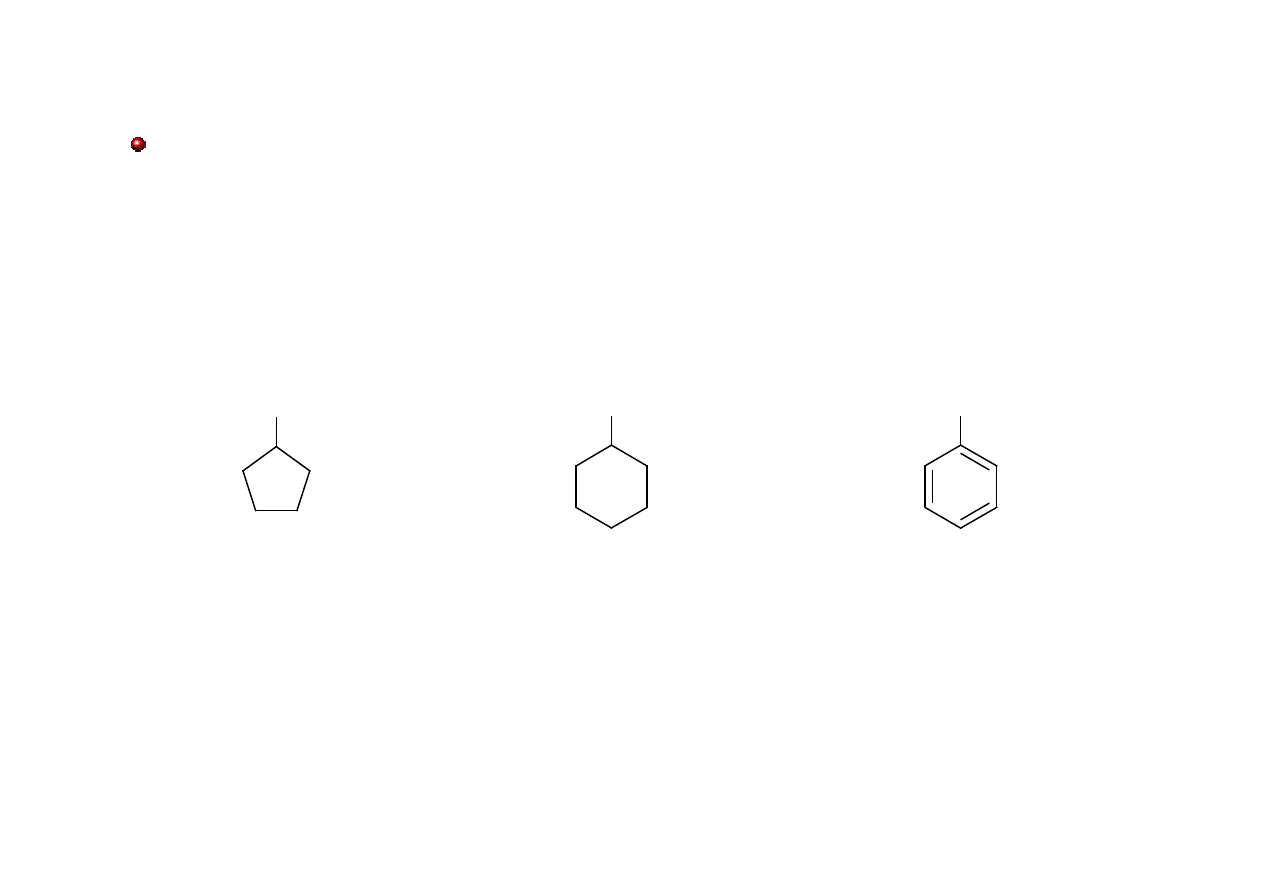
Aldehydy: nazewnictwo
Nazwę aldehydu, w którym grupa aldehydowa jest połączona bezpośrednio z
pierścieniem (alifatycznym lub aromatycznym) tworzy się dodając przyrostek karboaldehyd
do nazwy układu cyklicznego.
CHO
CHO
CHO
cykloheksanokarboaldehyd
cyklopentanokarboaldehyd
benzenokarboaldehyd
Aldehydy: nazewnictwo
Oprócz nazw systematycznych stosowane są nazwy zwyczajowe aldehydów. Tworzy się
je przez zastąpienie słowa kwas w nazwie zwyczajowej danego kwasu karboksylowego
słowem aldehyd lub przez zamianę końcówki w nazwie grupy acylowej (-oil lub -yl) na
przyrostek aldehyd.
H
O
H
O
H
O
H
O
H
O
H
O
H
H
O
aldehyd mrówkowy
(formaldehyd)
aldehyd octowy
(acetaldehyd)
aldehyd propionowy
(propionoaldehyd)
aldehyd masłowy
(butyroaldehyd)
aldehyd izomasłowy
(izobutyroaldehyd)
aldehyd benzoesowy
(benzaldehyd)
aldehyd cynamonowy
(cynamal, fenyloakroleina)
!
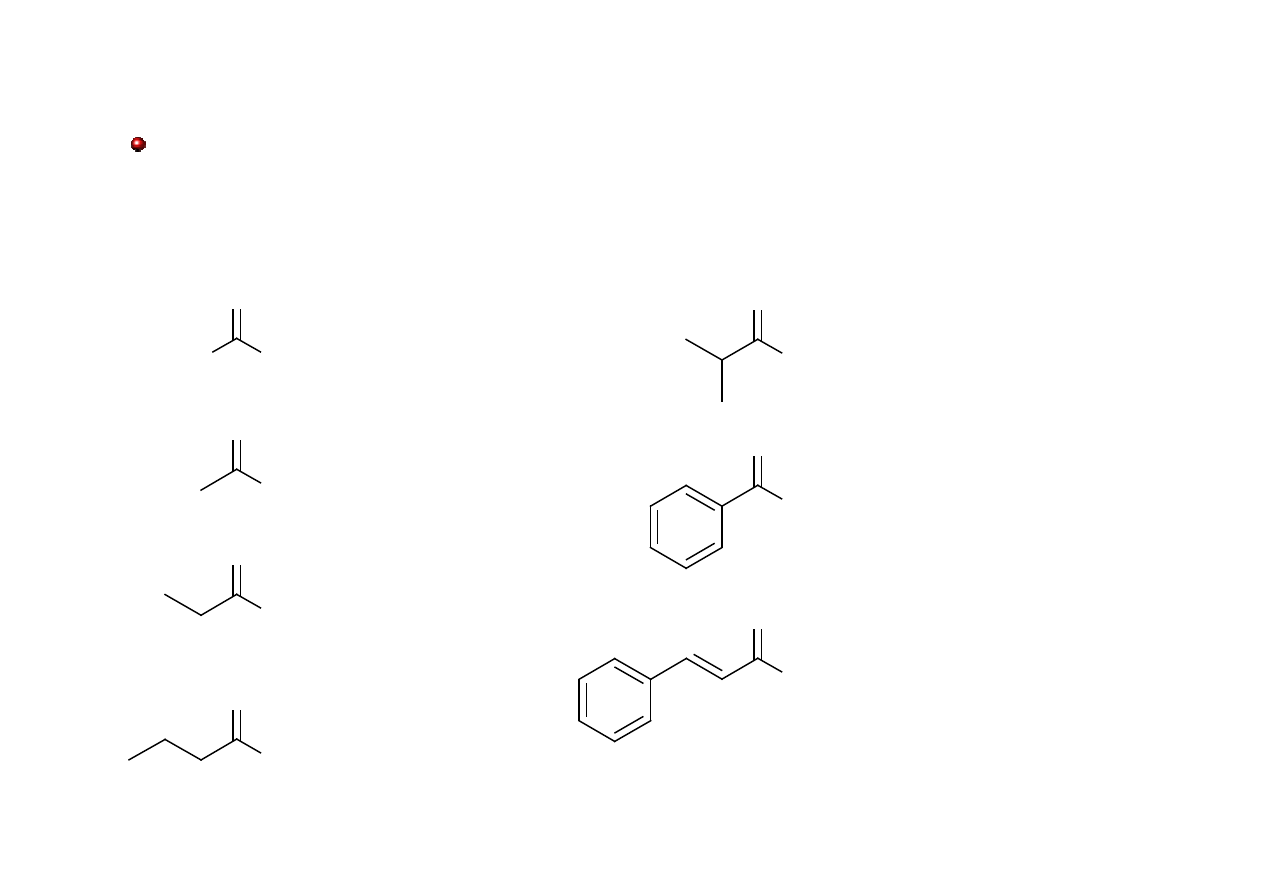
Ketony: nazewnictwo
Nazwy aldehydów łańcuchowych tworzy się przez dodanie przyrostka –on do nazwy
węglowodoru (łańcuchowego lub pierścieniowego) zawierającego tę samą (co keton) liczbę
atomów węgla.
Grupa karbonylowa ma pierwszeństwo w nazwie przed grupami: C=C, C≡C, OH.
Numeracja dotycząca wiązań podwójnych i podstawników podlega ogólnym regułom.
O
O
O
O
O
O
OH
6-hydroksyhept-2-on
4-metyloheptan-2-on
hept-6-en-2-on
heptan-2-on
heptan-3-on
heptan-4-on
!
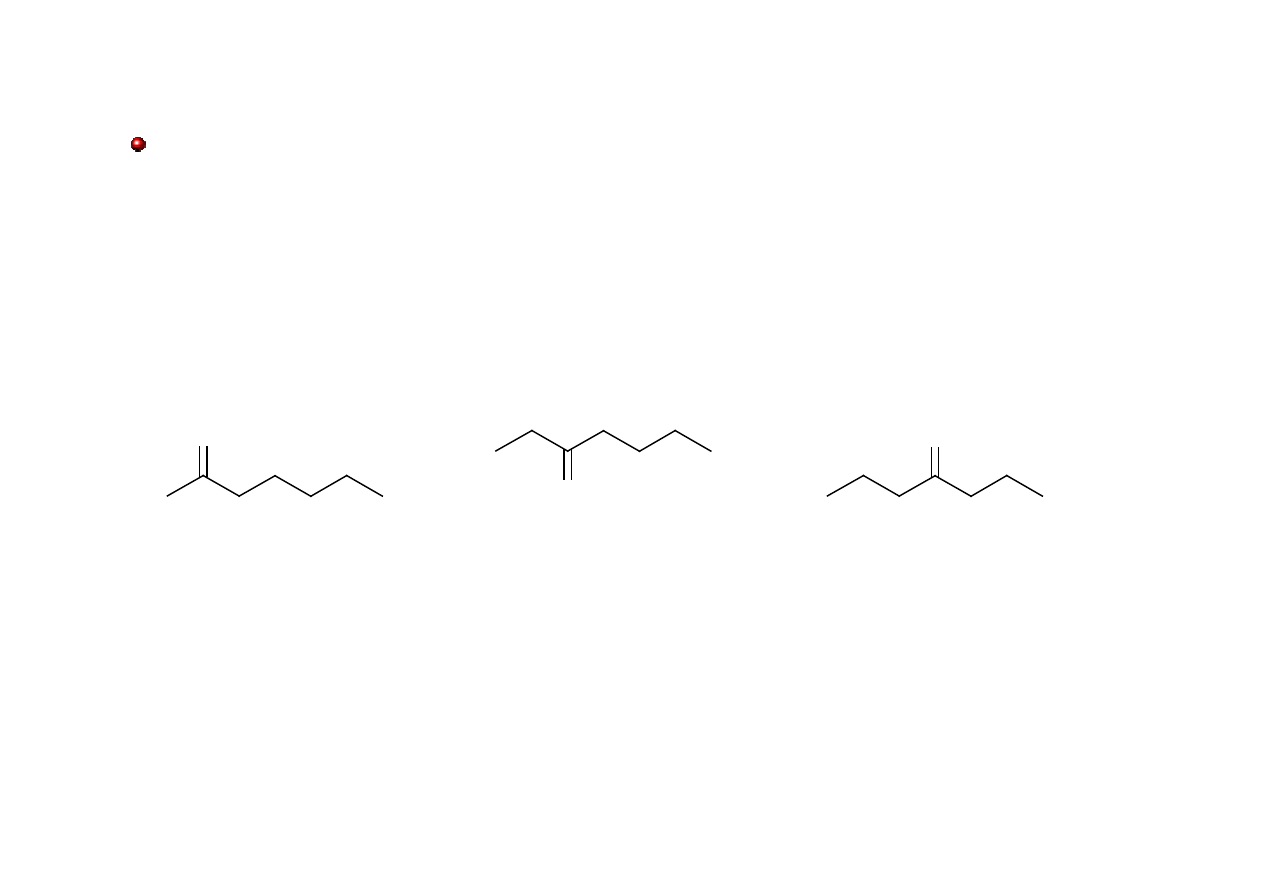
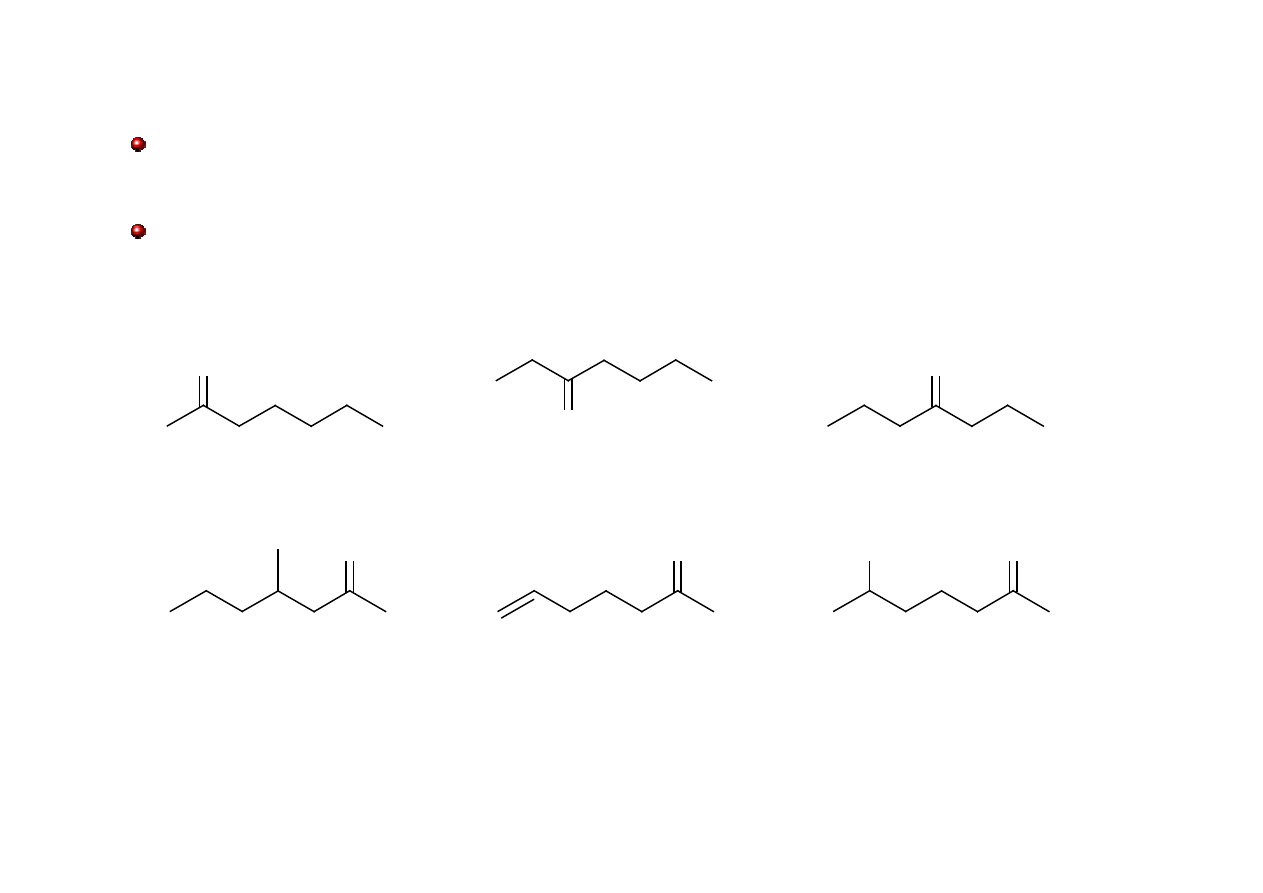
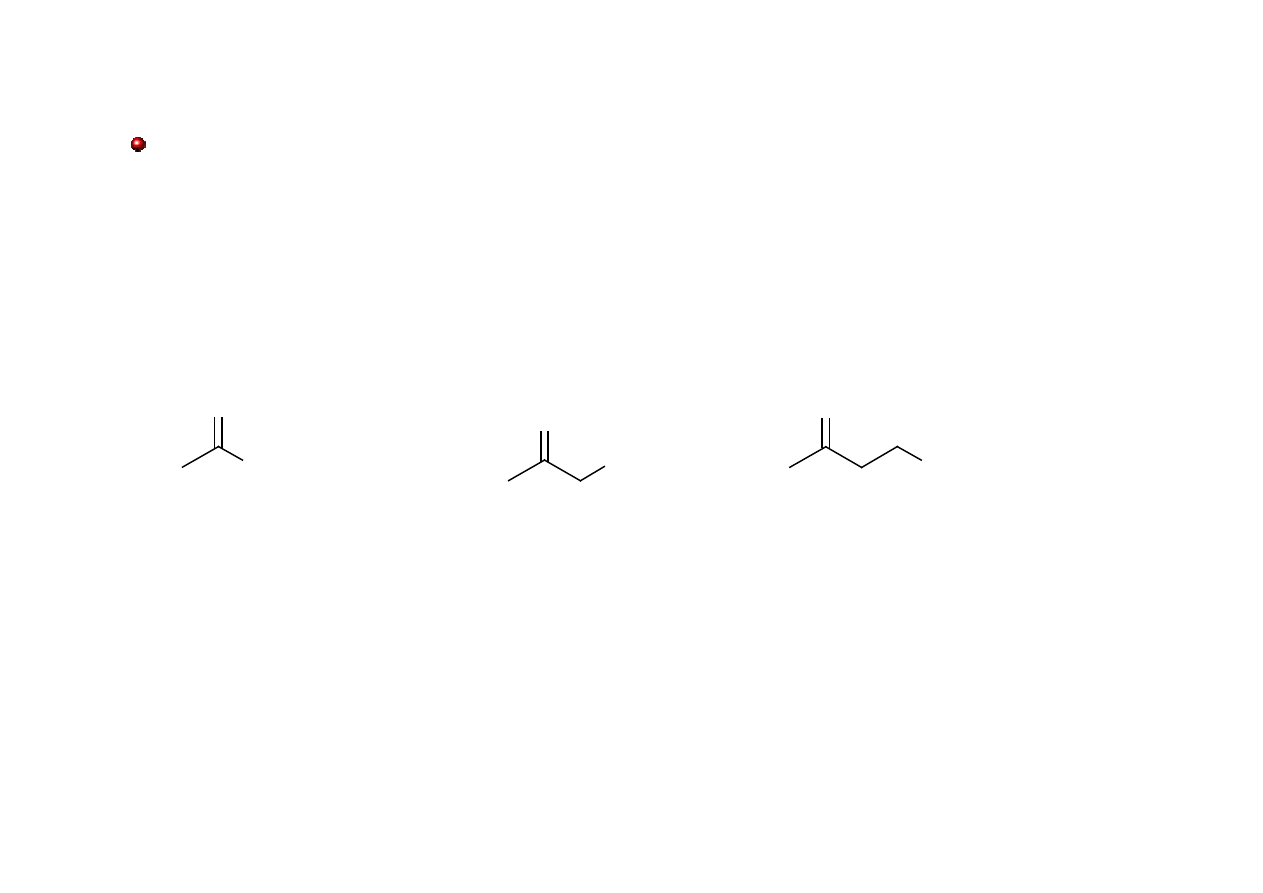
Ketony: nazewnictwo
Grupowo-funkcyjne nazwy ketonów acyklicznych tworzy się wymieniając nazwy grup (w
formie przymiotnikowej i alfabetycznie) po słowie keton. Nazwy obu grup rozdziela się
kreską.
O
O
O
keton metylowo-pentylowy
keton butylowo-etylowy
keton dipropylowy
Ketony: nazewnictwo
Atom tlenu grupy ketonowej =O jako podstawnik nosi nazwę okso i można jej używać w
tworzeniu nazw podstawnikowych.
O
CO
2
H
O
CO
2
H
O
CO
2
H
kwas 2-oksopropanowy
kwas pirogronowy
kwas 4-oksowalerianowy
kwas lewulinowy
kwas 3-oksomasłowy
kwas acetylooctowy
Ketony: nazewnictwo
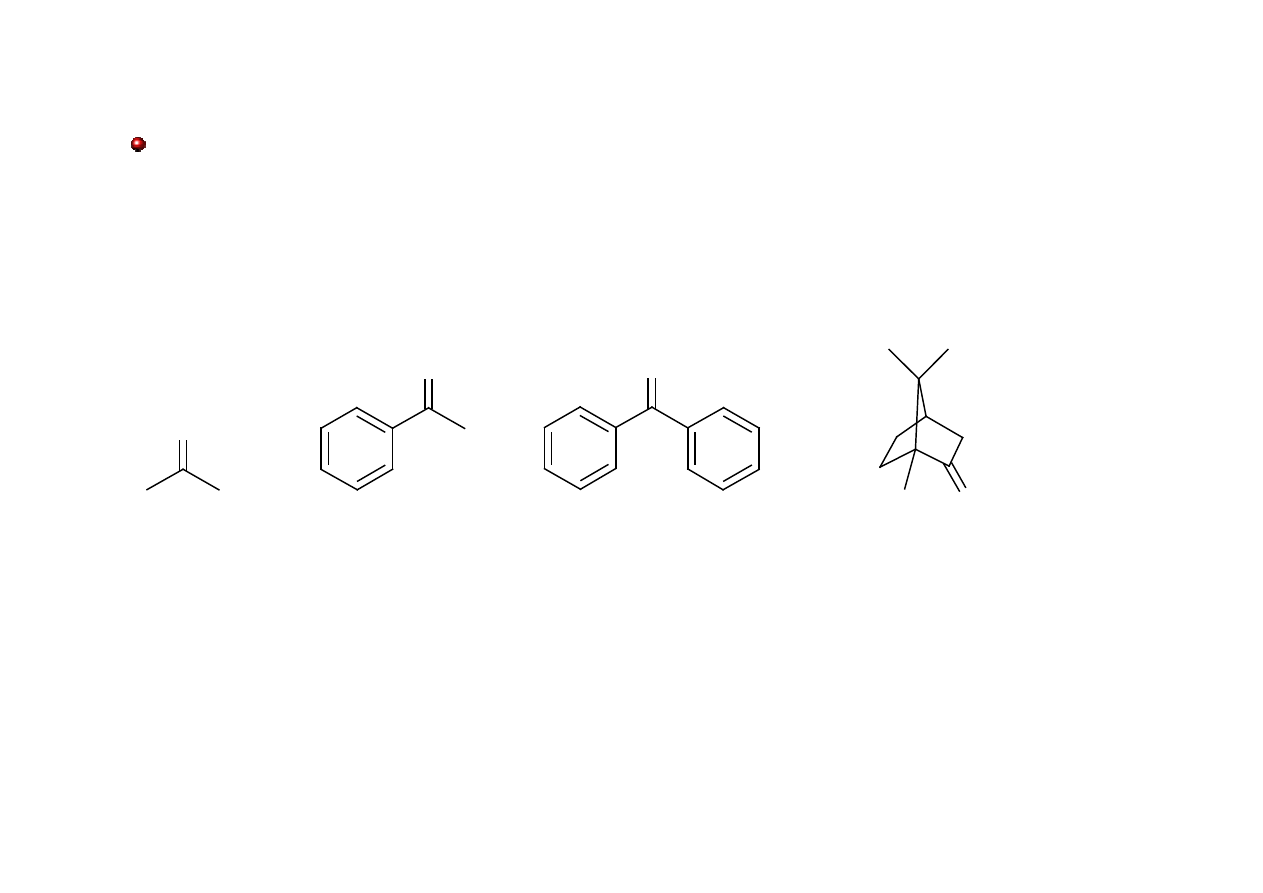
Oprócz nazw systematycznych stosowane są nazwy zwyczajowe ketonów.
O
O
O
O
aceton
acetofenon
benzofenon
kamfora
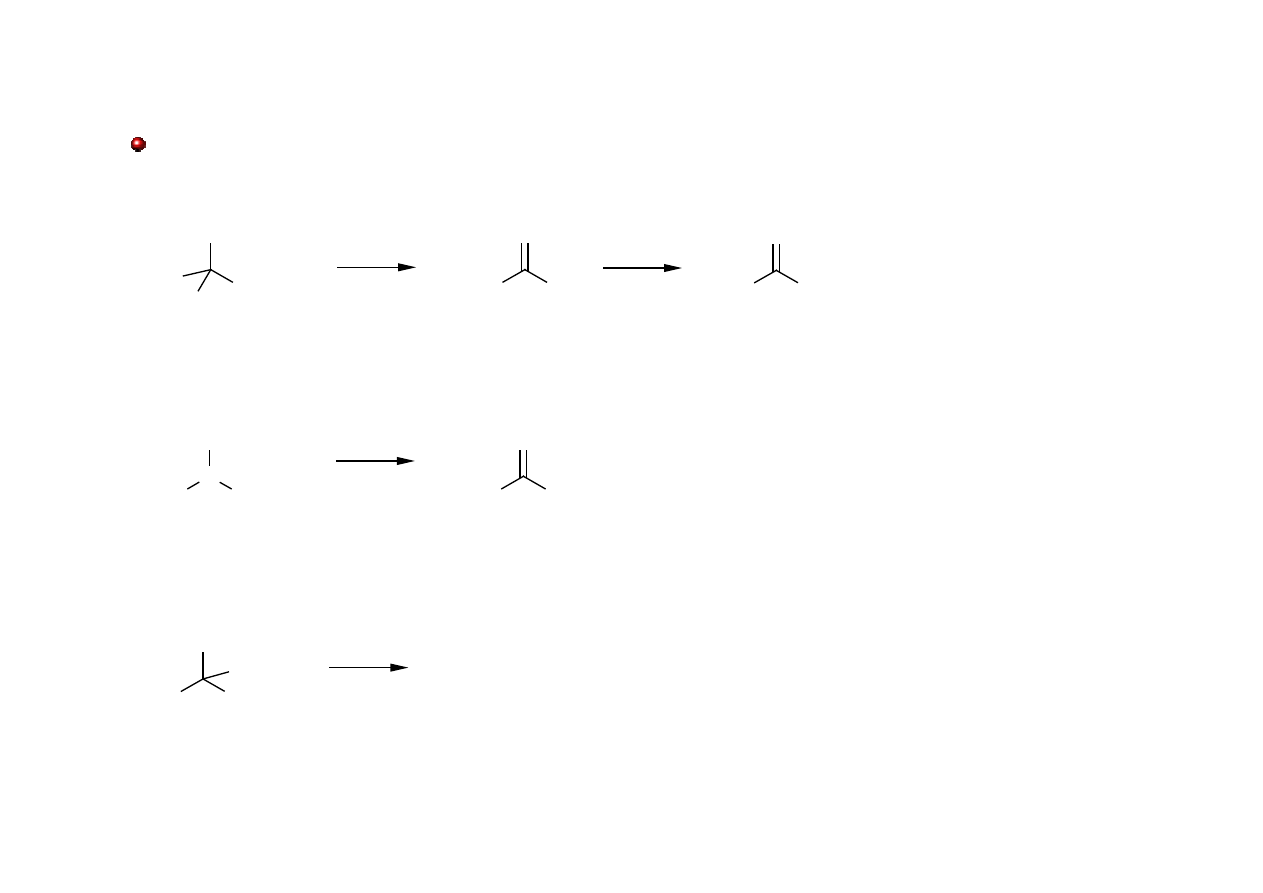
Aldehydy i Ketony: otrzymywanie
Utlenianie alkoholi
C
H
3
H
OH
H
C
H
3
C
H CH
3
OH
C
H
3
OH
CH
3
CH
3
C
H
3
H
O
C
H
3
CH
3
O
C
H
3
OH
O
alkohol
etylowy
alkohol
izopropylowy
alkohol
tert
-butylowy
1
o
2
o
3
o
[O]
[O]
[O]
[O]
aceton
aldehyd
octowy
kwas
octowy
X
!
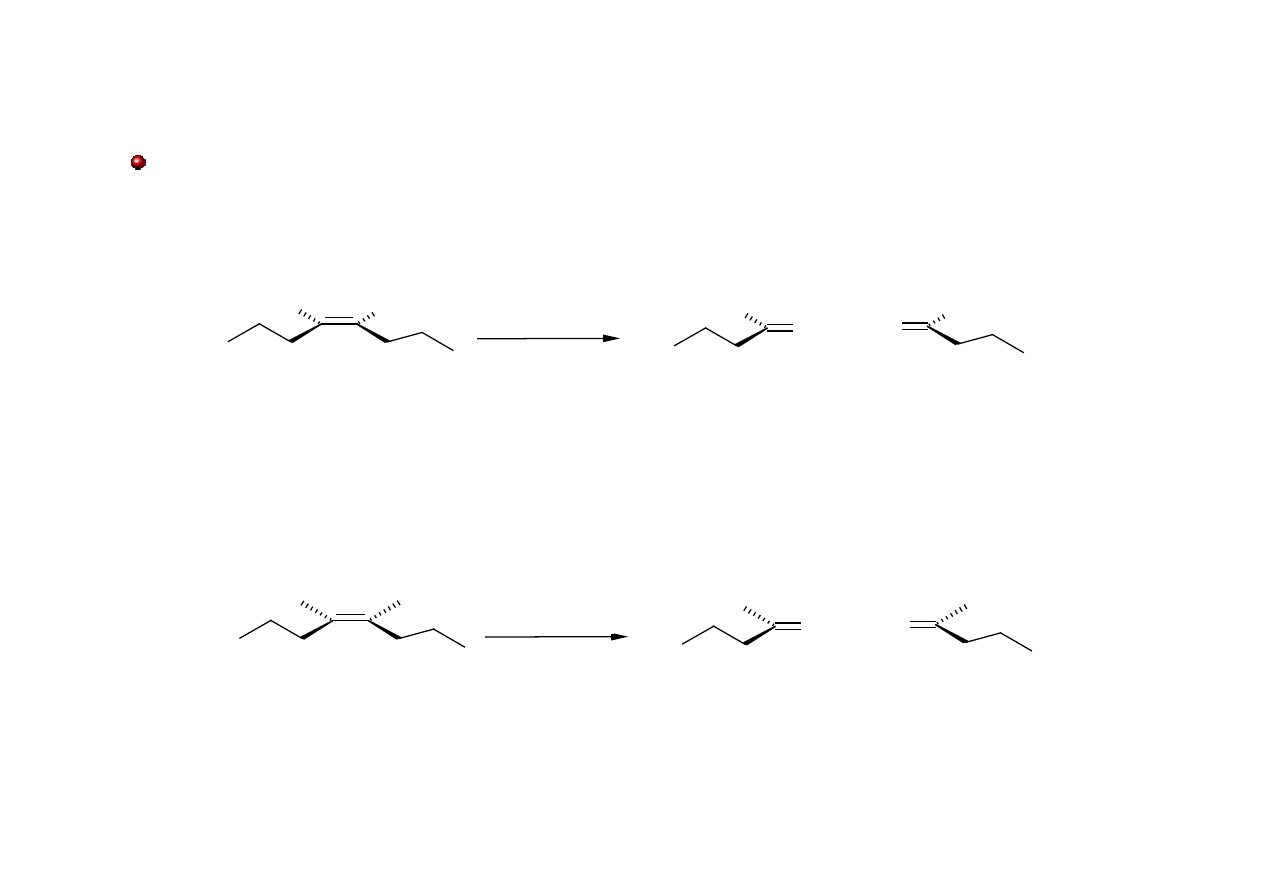
Aldehydy i Ketony: otrzymywanie
Ozonoliza – reakcja rozpadu symetrycznych alkenów na dwie części pod wpływem ozonu
(O
3
).
H
H
O
3
, CH
2
Cl
2
-78
o
C
H
O
H
O
O
3
, CH
2
Cl
2
-78
o
C
O
O
(Z)-okt-4-en
butanal
(aldehyd butylowy)
Zn, AcOH
aq.
+
(Z)-4,5-dimetylookt-4-en
pentan-2-on
(keton metylowo-propylowy)
Zn, AcOH
aq.
+
!
H
B
H
H
C
H
H
BH
2
R
H
BH
2
R
H
CH
CH
H
BH
2
R
H
H
B
R
H
H
H
R
H
R
H
H
OH
R
H
O
H
H
B
H
H
H
B
Et
Et
Et
H
Et
Et
Et
H
H
OH
O
+
δ+
δ-
2
heksanal
heksyn
+
3
heksan-3-on
heks-3-yn
H
2
O
2
NaOH
aq.
H
2
O
2
NaOH
aq.
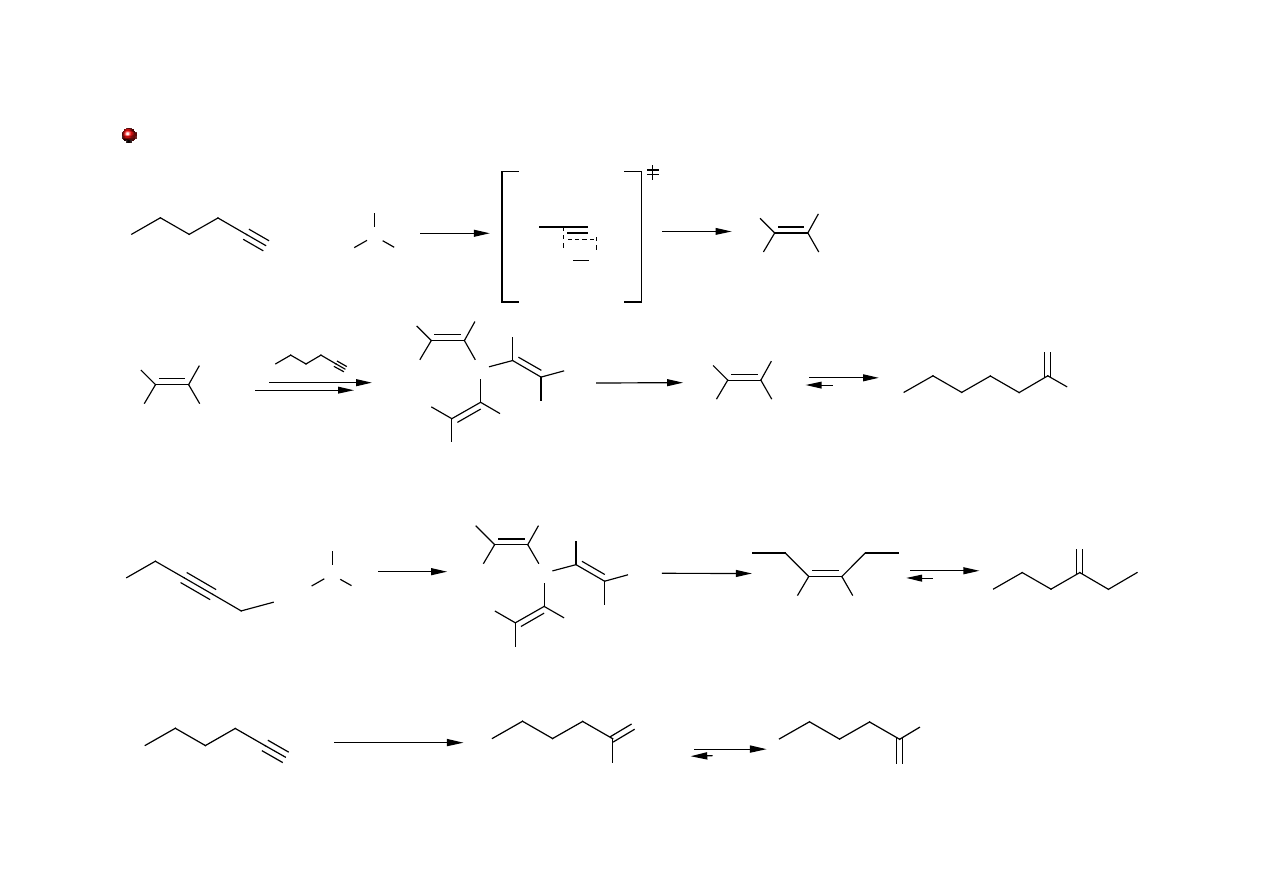
Aldehydy i Ketony: otrzymywanie
BH
3
ulega addycji do alkinów z utworzeniem boranów winylowych, które po utlenieniu dają
ketony lub aldehydy.
CH
CH
2
OH
CH
3
O
heksyn
heksan-2-on
enol
H
3
O
+
, Hg
2+
O
OMe
O
H
Al
H
H
Al
DIBAL-H
CH
2
Cl
2
-20
o
C
heksanal
ester metylowy
kwasu kapronowego
(DIBAL-H)
2
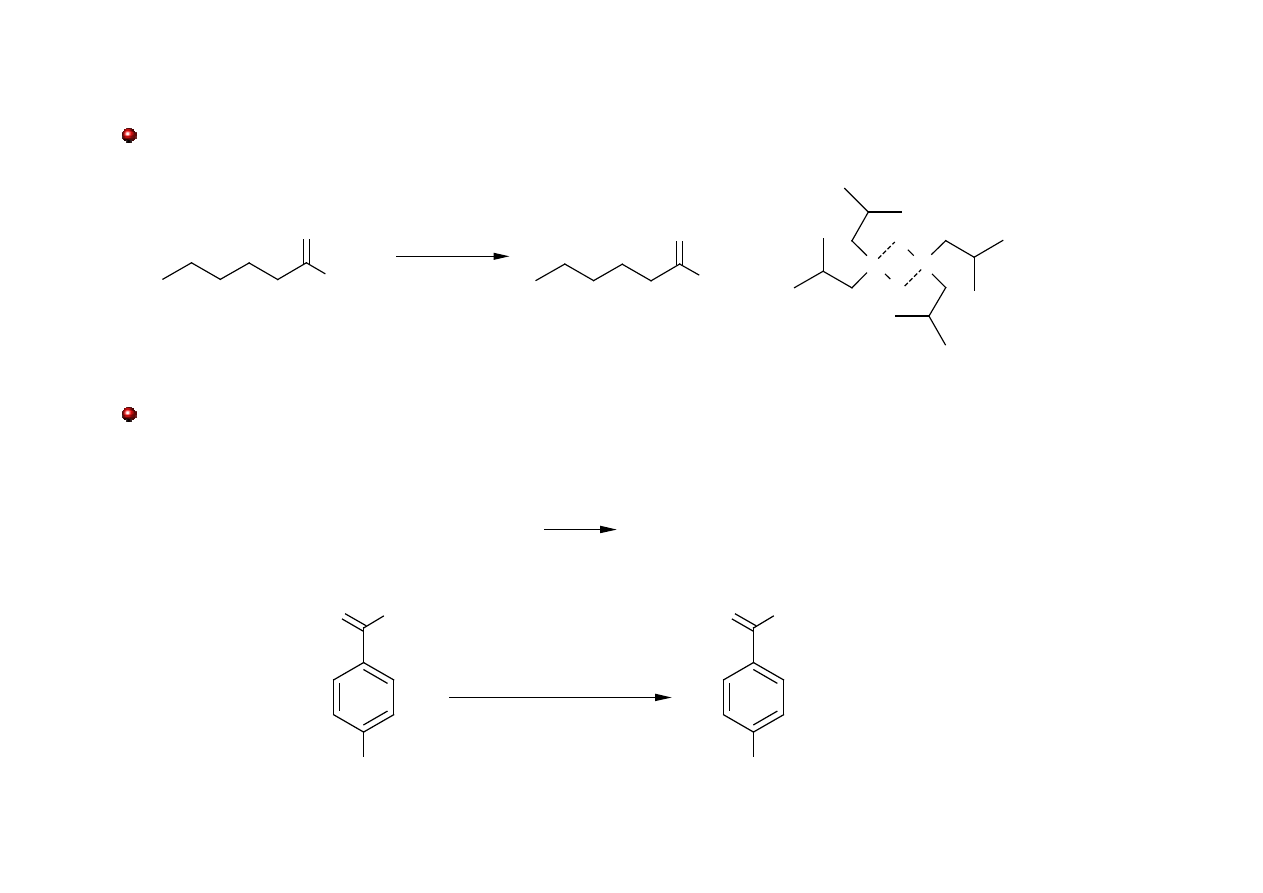
Aldehydy: otrzymywanie: wodorki metali M-H
Estry kwasów karboksylowych można selektywnie zredukować do aldehydów
O
Cl
NO
2
O
H
NO
2
1) LiAlH[OC(CH
3
)
3
]
3
2) H
3
O
+
chlorek p-nitrobenzoilu
aldehyd p-nitrobenzoesowy
~80%
2LiAlH
4
+ 6(CH
3
)
3
COH 2LiAlH[OC(CH
3
)
3
]
3
+
3H
2
Chlorki kwasowe można zredukować do aldehydów stosując tri-tert-butyloksyhydroglinian litu.
Stara, często cytowana metoda to redukcja Rosenmunda (H
2
, Pd zatruty S).
!
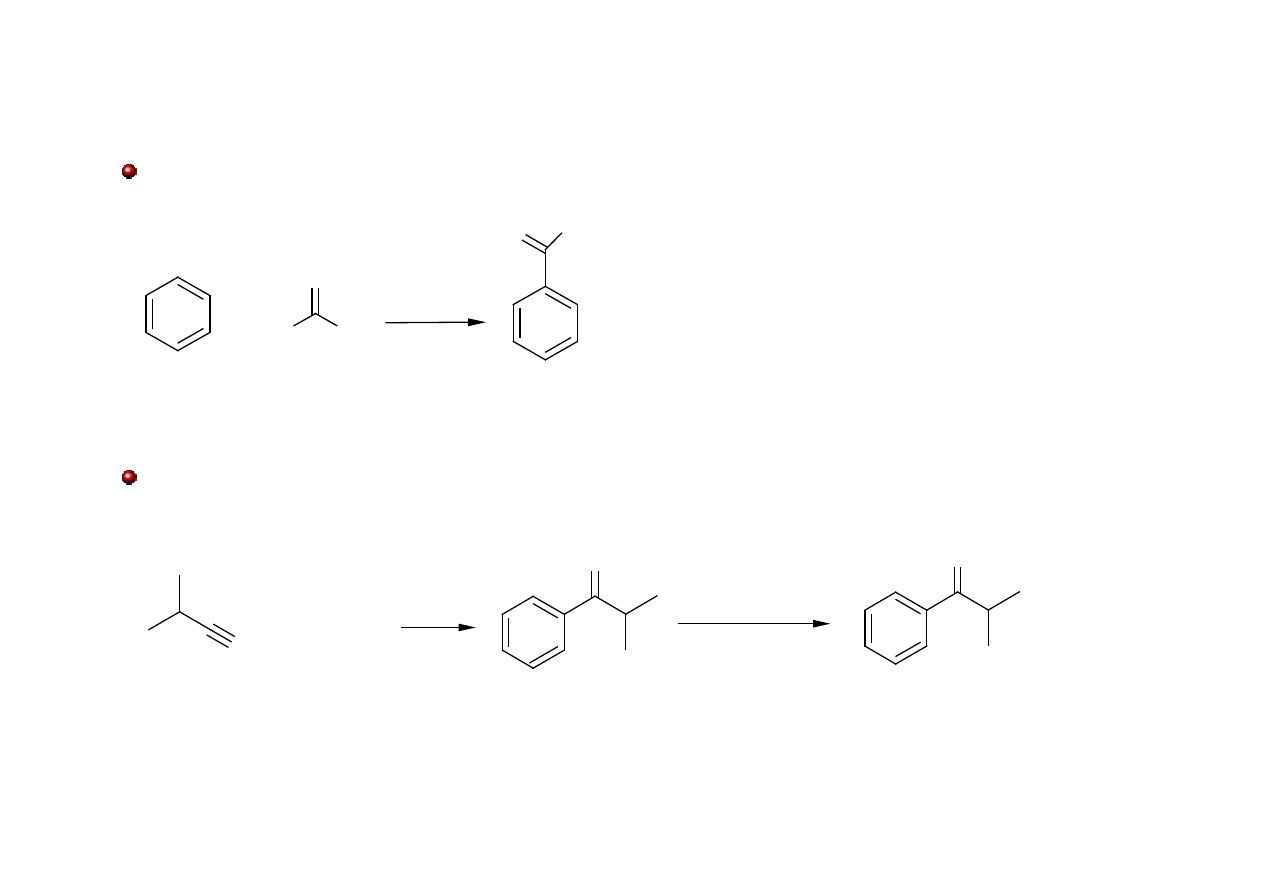
Ketony: otrzymywanie
Reakcja acylowania Friedela-Craftsa
N
O
NMgBr
+ PhMgBr
izobutyronitryl
1-fenylo-2-metylopropan-1-on
H
3
O
+
-Mg(OH)Br
Reakcja odczynników Grignarda z nitrylami
O
R
R
Cl
O
+
AlCl
3
!
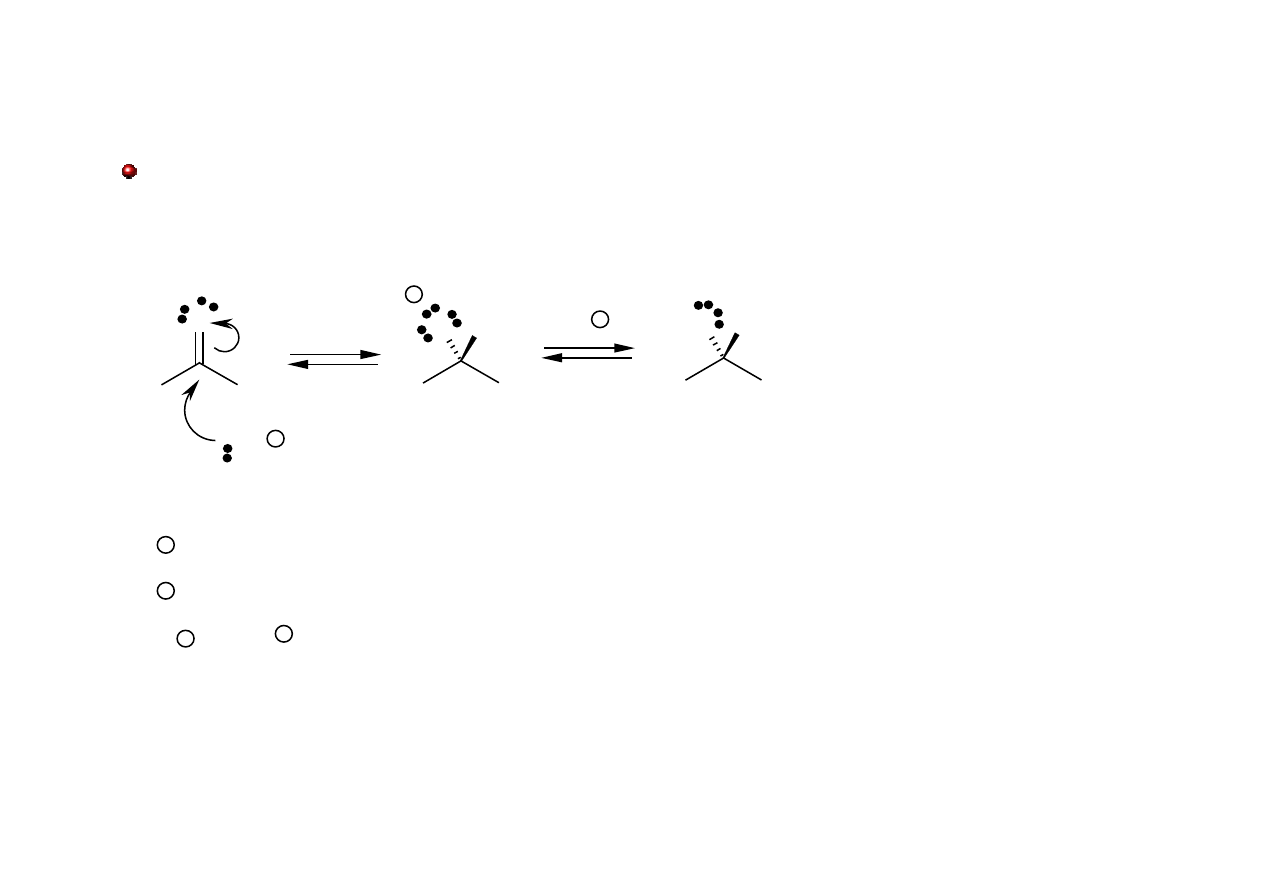
Reakcje związków karbonylowych
Addycja nukleofilowa (silne nukleofile)
O
+
_
Nu
O
_
Nu
O
H
_
_
_
_
δ-
δ+
Nu
H
H [LiAlH
4
, LiAlH(OC(CH
3
)
3
)
3
, DIBAL-H, NaBH
4
]
R [RMgX, RLi]
CN
ROH RSH
HSO
3
!
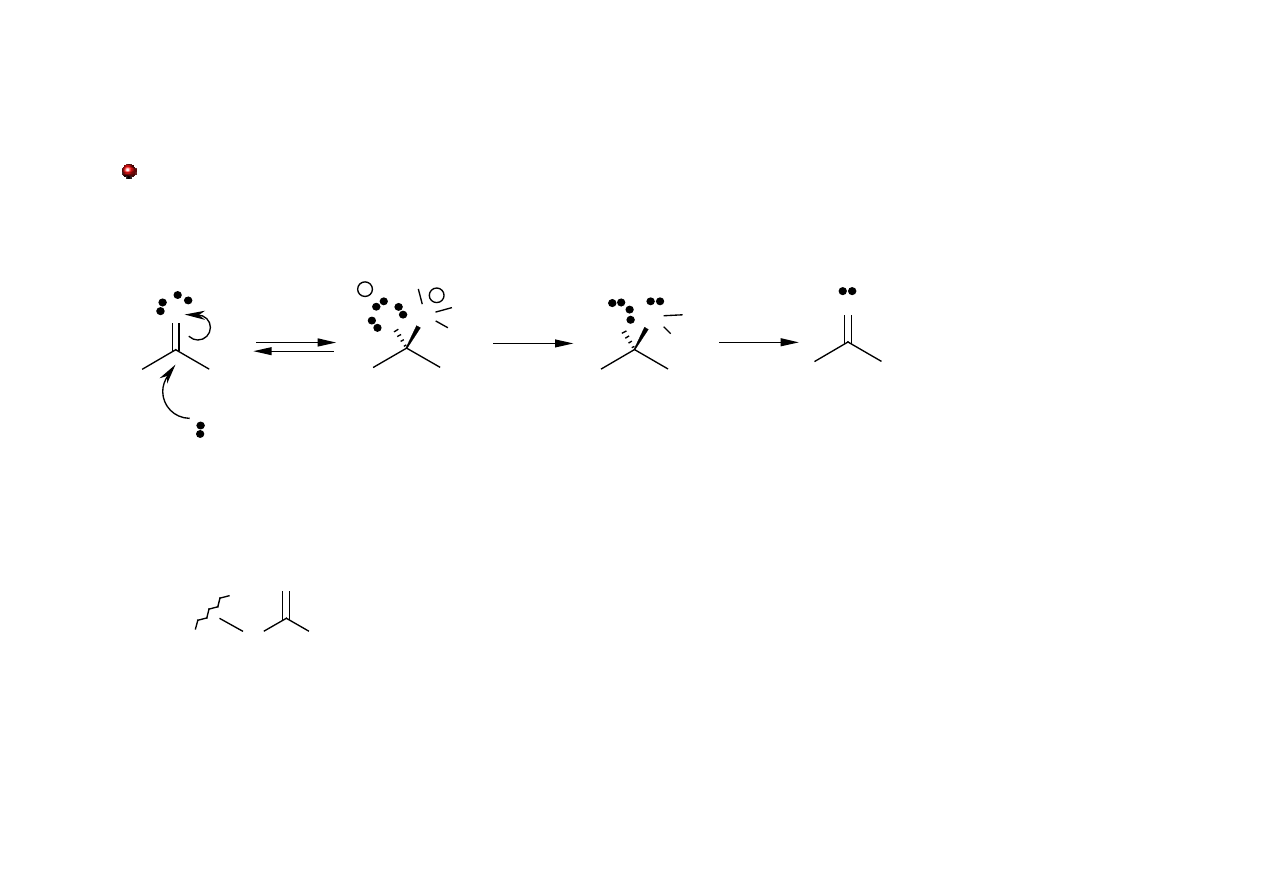
Reakcje związków karbonylowych
Addycja nukleofilowa z następczą eliminacją cząsteczki wody
O
N
O
H
H
R
_
N
O
H
R
H
+
NR
N
H
O
NH
2
δ-
δ+
NH
2
R
-H
2
O
R = OH oksym
R = NHPh fenylohydrazon
R =
semikarbazon
imina
(zasada Schiffa)
!
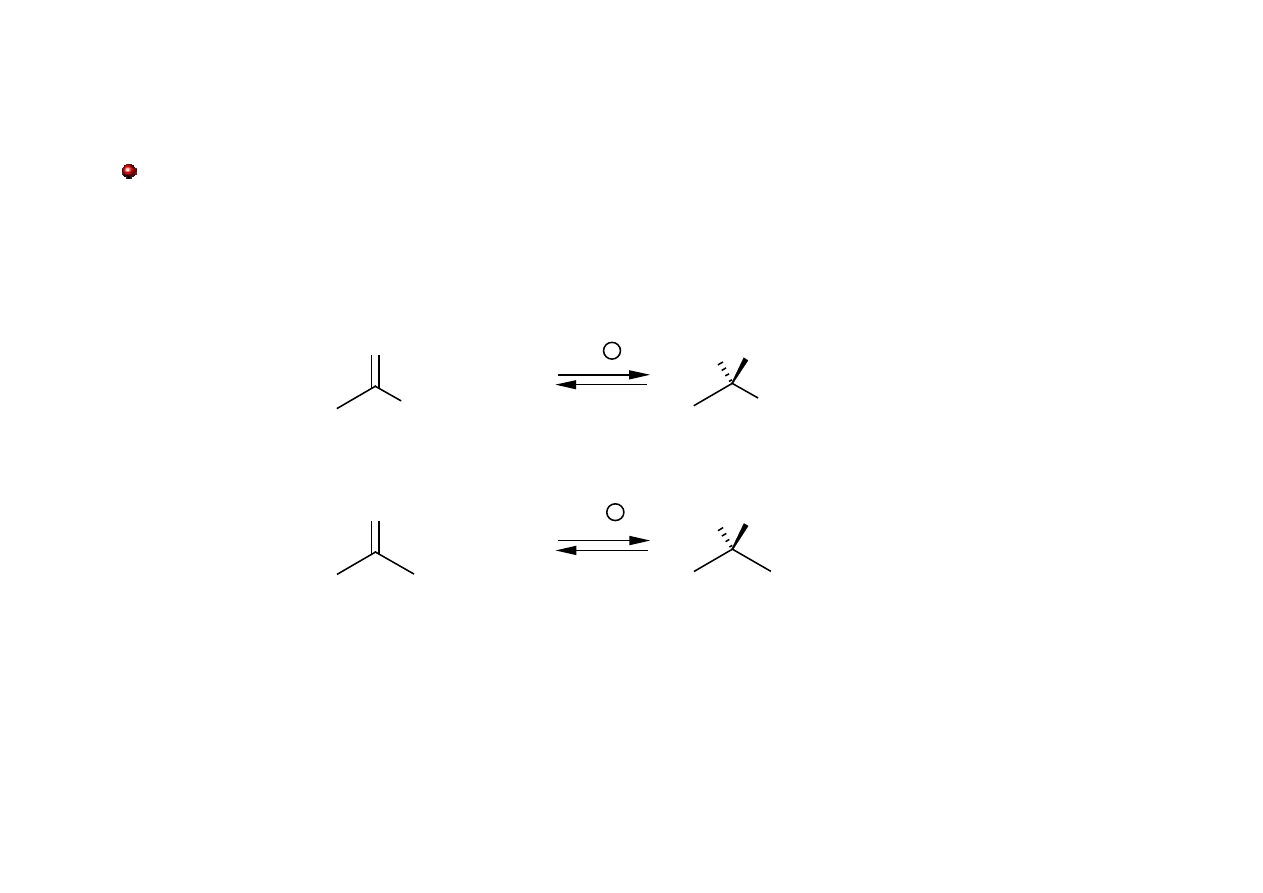
Hemiacetale i Hemiketale
Hemiacetale i hemiketale powstają w wyniku działania alkoholu na aldehyd lub keton,
odpowiednio. Posiadają one grupę hydroksylową i grupę alkoksylową przy tym samym atomie
węgla.
H
O
H
OR
O
H
O
OR
O
H
+
+
+ ROH
+ ROH
aldehyd
keton
hemiacetal
hemiketal
H
H
!
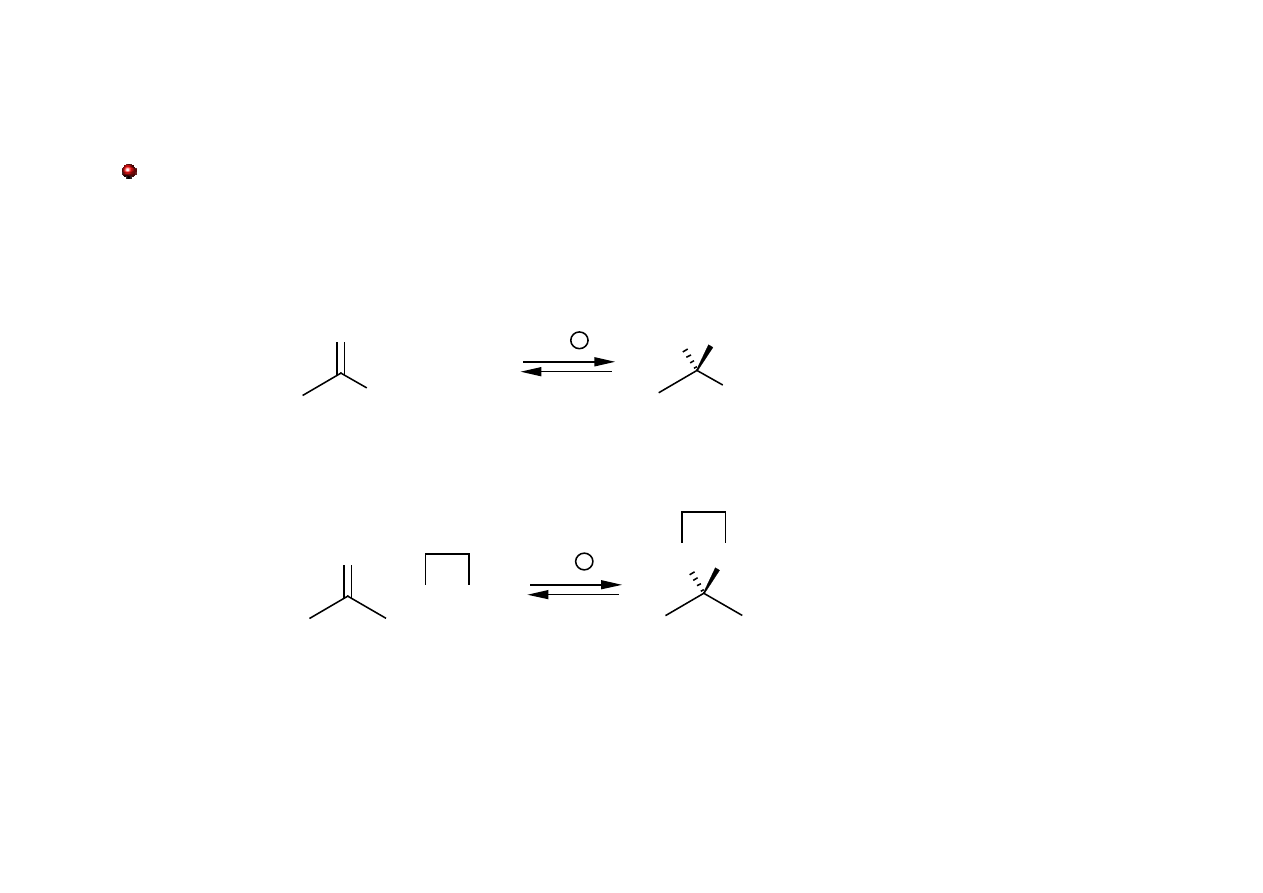
Acetale i Ketale
Acetale powstają w wyniku przyłączenia dwóch cząsteczek alkoholu do cząsteczki
aldehydu. Trwałe ketale tworzą się w reakcji ketonu z alkoholami dwuwodorotlenowymi.
H
O
H
OR
OR
O
O
O
OH
OH
+
+
+ 2ROH
aldehyd
keton
acetal
ketal
+ H
2
O
+
+ H
2
O
H
H
!
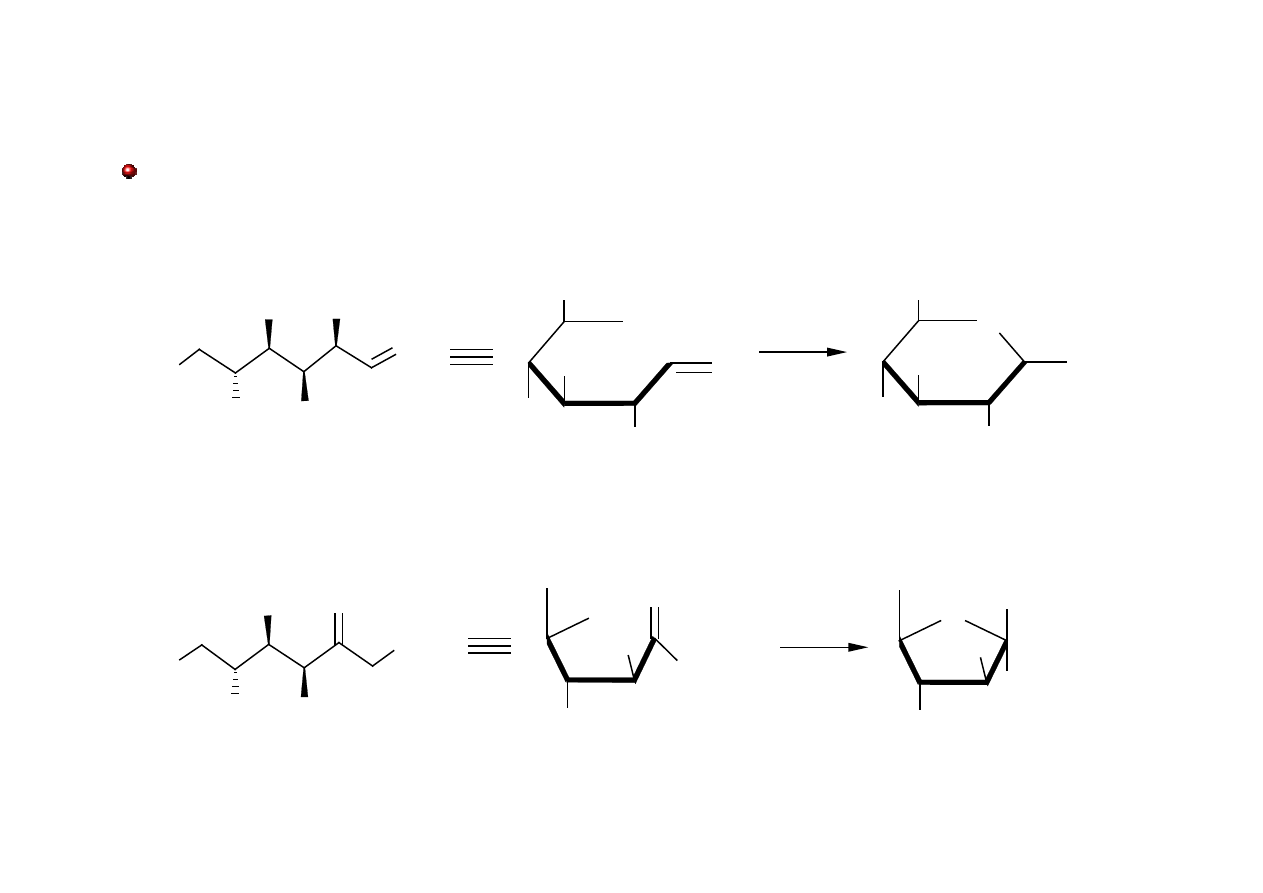
Acetale i Ketale
Wewnątrzcząsteczkowa addycja grupy hydroksylowej do grupy aldehydowej lub ketonowej
umożliwia tworzenie się pierścieni heterocyklicznych w cukrach.
O
CH
2
OH
OH
OH
OH
OH
OH
CH
2
OH
OH
OH
OH
O
O
H
O
OH
OH
OH
OH
D-glukoza
D-glukopiranoza
O
H
OH
O
OH
OH
OH
OH
CH
2
OH
OH
O
H
CH
2
OH
O
O
CH
2
OH
OH
O
H
OH
CH
2
OH
D-fruktoza
D-fruktofuranoza
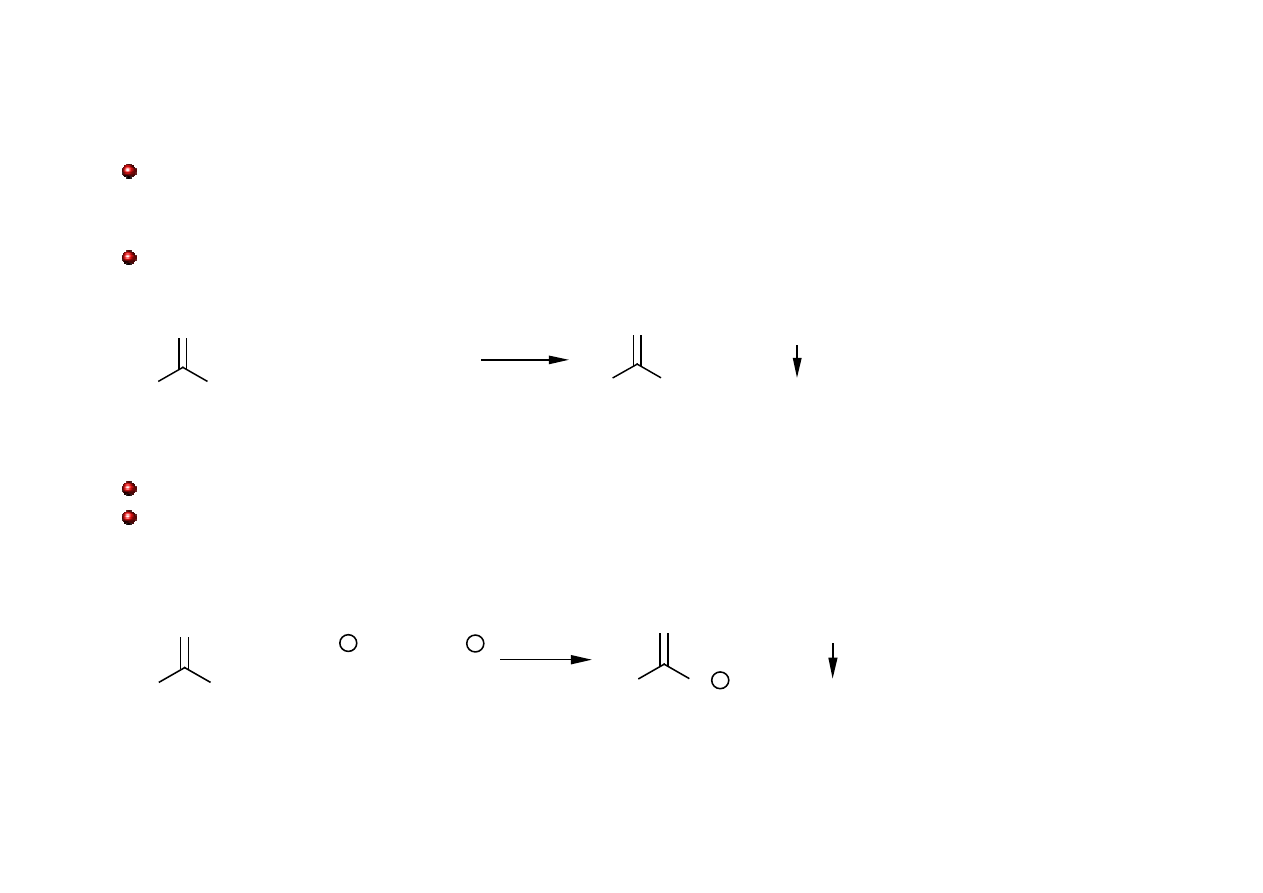
Odróżnienie ketonów od aldehydów
Aldehydy są utleniane przez słabe utleniacze, takie jak Ag
+
i Cu
2+
. Ketony nie ulegają
utlenieniu w takich warunkach.
Odczynnik Tollensa (amoniakalny roztwór AgNO
3
)
Odczynnik Fehlinga (CuSO
4
w alkalicznym roztworze winianu sodu)
Odczynnik Benedicta (CuSO
4
w alkalicznym roztworze cytrynianu sodu)
R
O
H
R
O
ONH
4
+ 2[Ag(NH
3
)
2
]OH
+ 2Ag + H
2
O + 3NH
3
R
O
H
R
O
O
_
+
_
+ 2Cu + 5HO
+ Cu
2
O + 3H
2
O
2
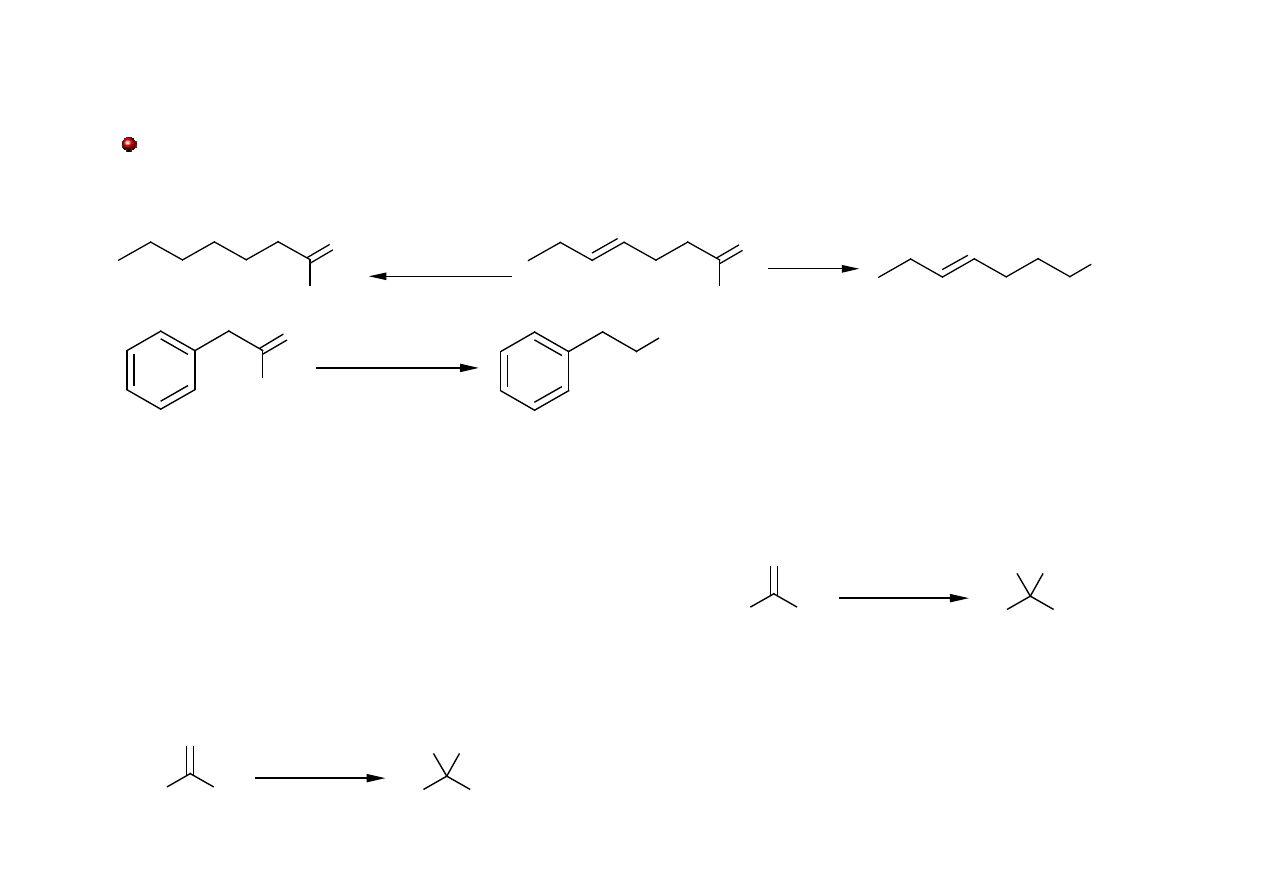
Redukcja aldehydów i ketonów: H-
LiAlH
4
i NaBH
4
redukują aldehydy i ketony do odpowiednich alkoholi. Wiązania podwójne
pozostają nienaruszone. NaBH(OAc)
3
redukuje tylko aldehydy.
• Redukcja Wolfa-Kiżnera -reakcja redukcji, której ulegają ketony i aldehydy w środowisku
zasadowym, w wyniku której powstają odpowiednie alkany.
• Redukcja Clemmensena – amalgamat rtęci
H
O
OH
NaBH(OAc)
3
90%
H
O
OH
NaBH
4
H
O
H
2
, Ni 25
o
C
R
R'
O
R
R'
H
H
NH
2
-NH
2
KOH
R
R'
O
R
R'
H
H
Zn(Hg)
HCl
!
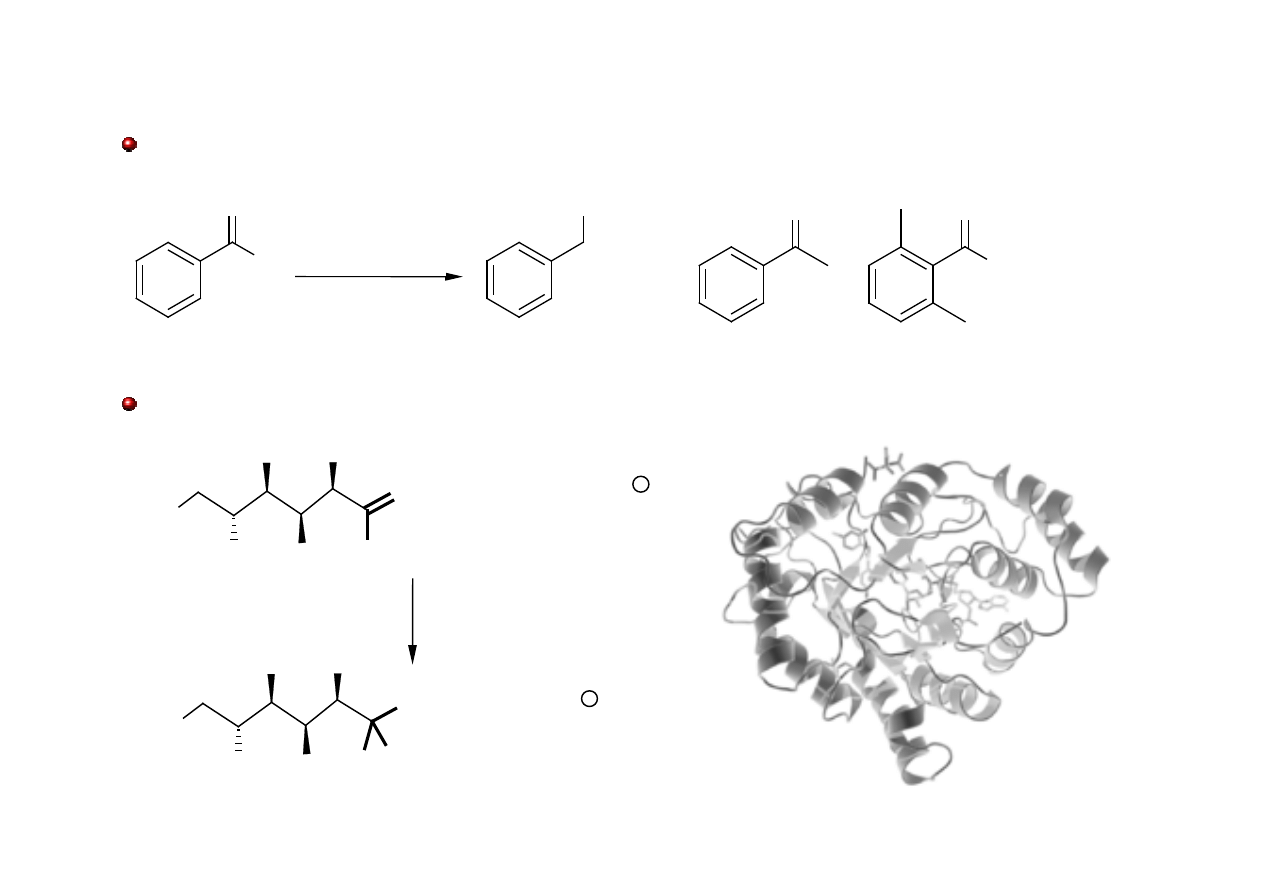
Enzymatyczna redukcja aldehydów i ketonów
Pałeczki okrężnicy, znanej pod łacińską nazwą Escherichia coli lub jej skrótem E. coli.
szczepu JM109 redukują niektóre aldehydy do alkoholi.
Reduktaza aldehydowa – katalizuje redukcję glukozy do sorbitolu
Molecules 2006, 11, 365-369
H
O
O
H
O
OH
E. coli
JM109
~100%
brak reakcji
O
H
O
OH
OH
OH
OH
H
O
H
OH
OH
OH
OH
OH
H H
+
+ NADPH + H
+
+ NADP
D-glukoza
D-sorbitol
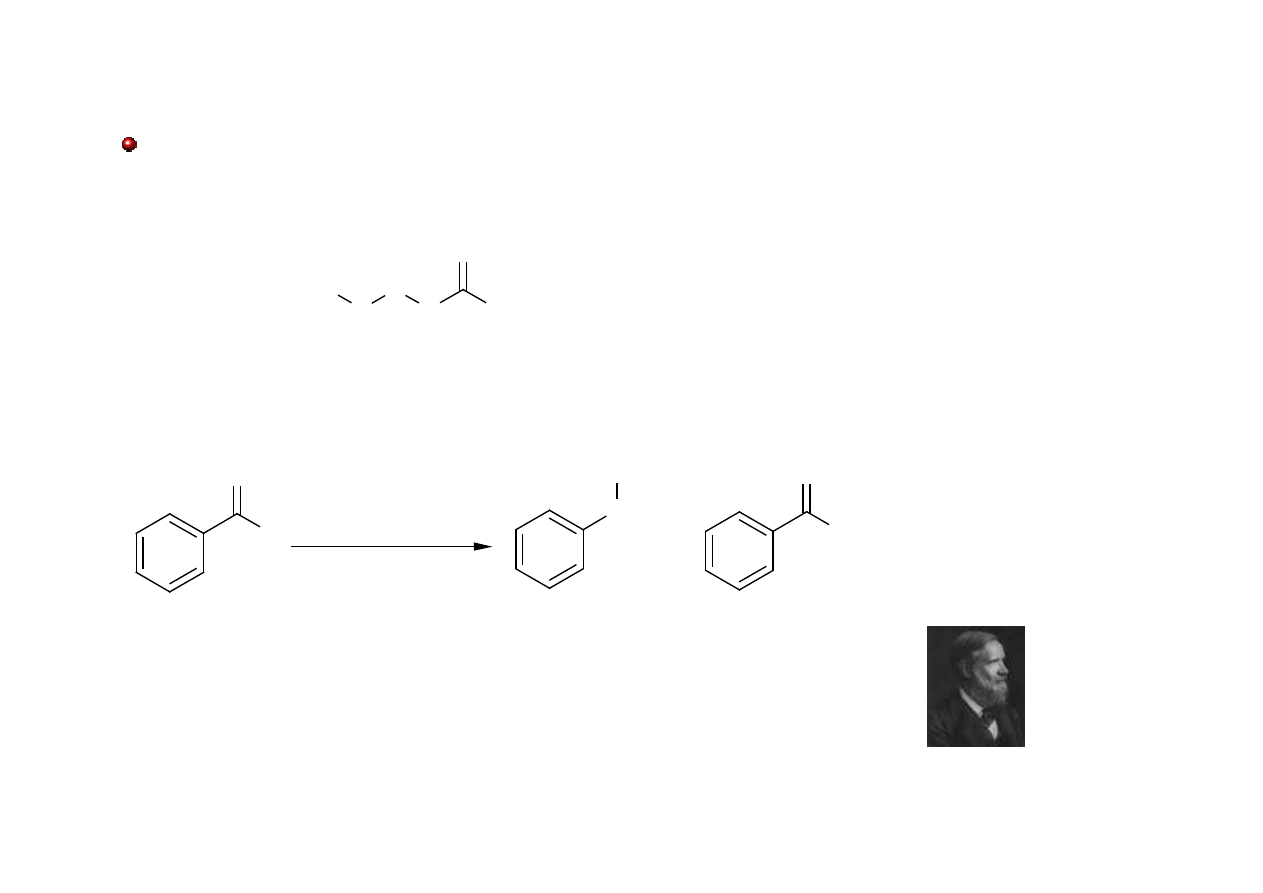
Aldehydy: red-ox
Reakcja Cannizzaro – reakcja dysproporcjonowania aldehydu do alkoholu i soli kwasu
karboksylowego. Aldehydy posiadające atomy wodoru w pozycji
α
nie reagują w ten sposób.
!
Stanislao Cannizzaro
, chemik włoski, 1826-1910
H
O
CH
2
OH
ONa
O
C
H
2
H
O
C
H
2
C
H
2
C
H
3
+
aldehyd
benzoesowy
alkohol
benzoesowy
benzoesan
sodu
α
α
β
γ
δ
NaOH stę żony
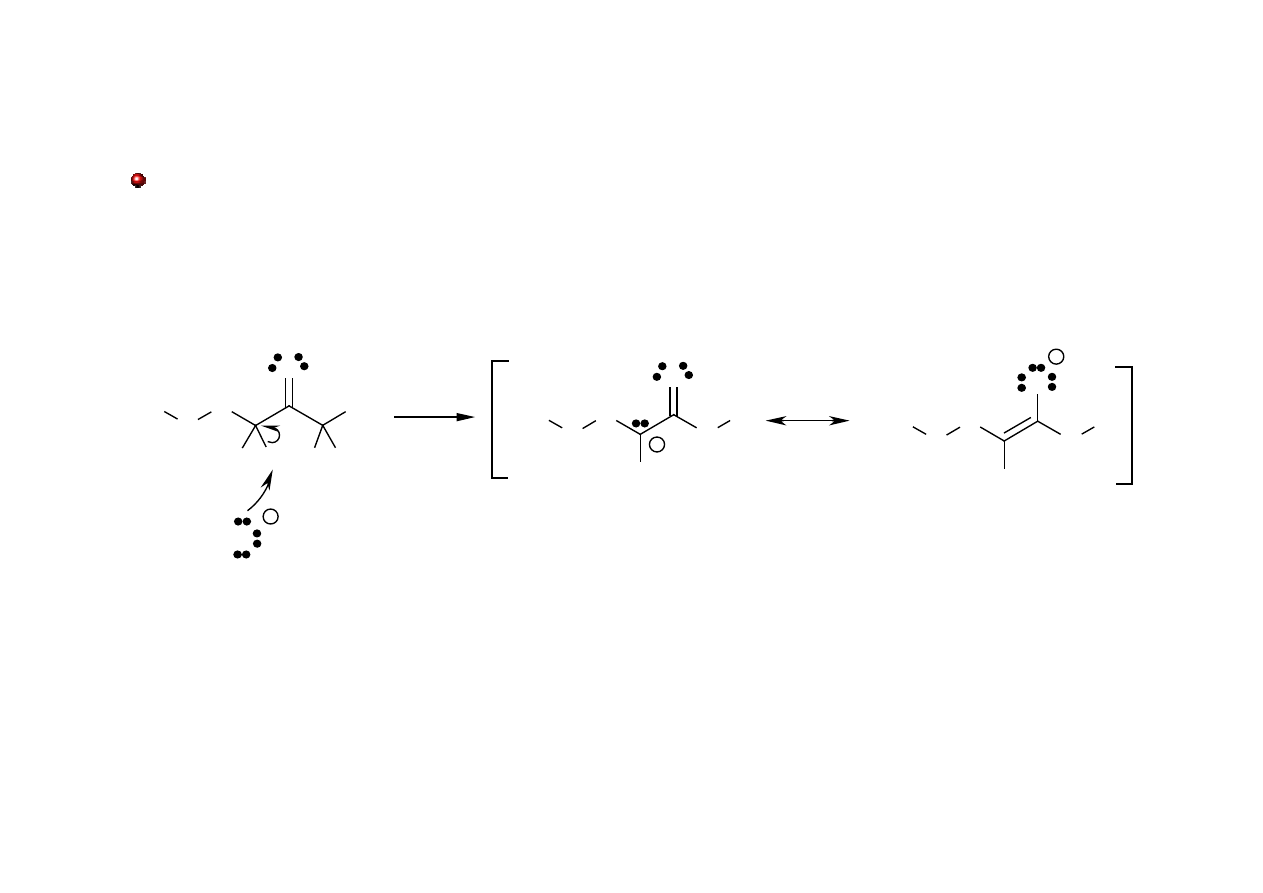
Aldehydy i ketony: pozycja
α
α
α
α
Atomy wodoru w pozycji a do grupy karbonylowej są „kwaśne” i mogą być oderwane przez
zasadę.
!
O
C
H
2
C
H
2
C
H
3
H
H
R
H H
C
H
2
O
C
H
2
C
H
2
C
H
3
R
H
_
_
C
H
2
O
C
H
2
C
H
2
C
H
3
R
H
_
α
α
EtO
anion enolanowy
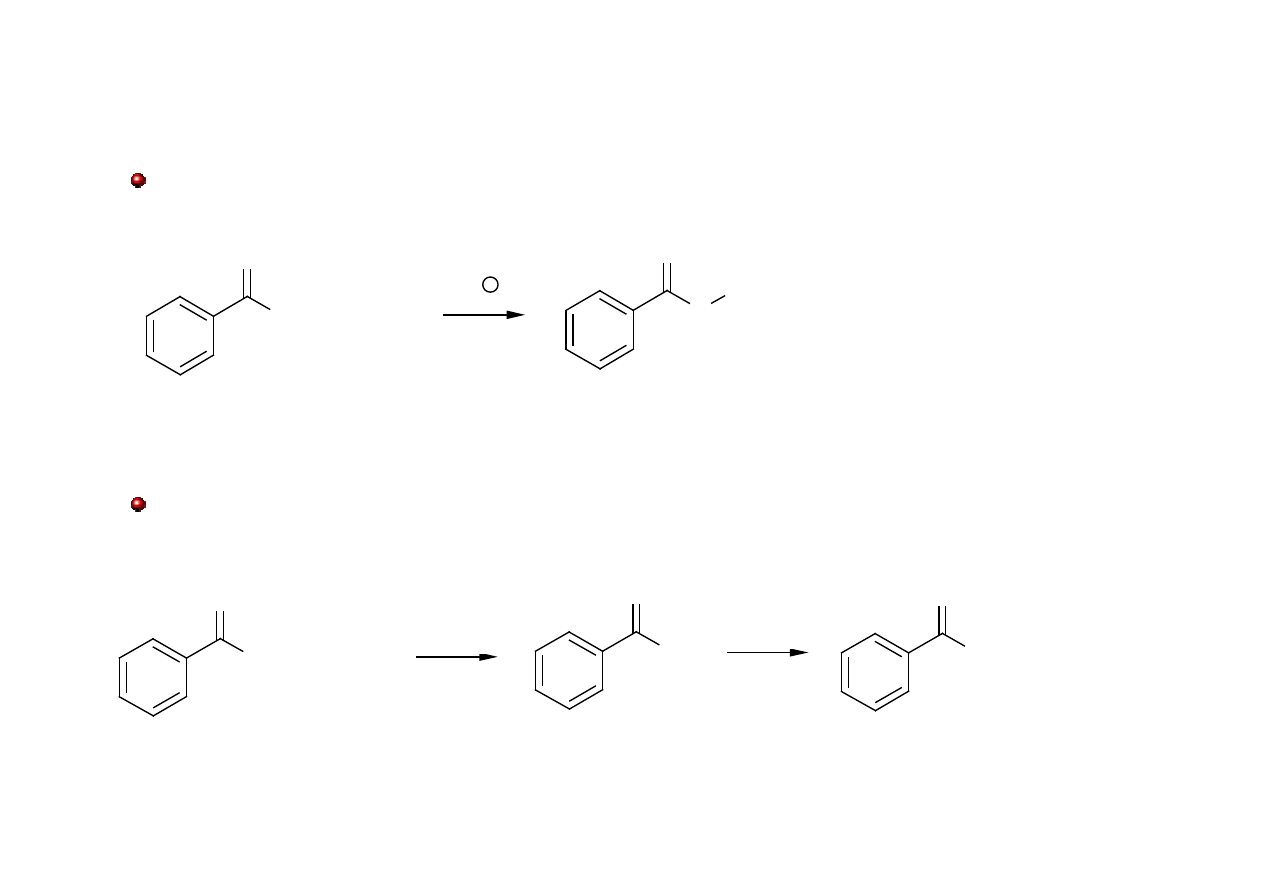
Halogenowanie w pozycji
α
α
α
α
Środowisko kwaśne
!
O
CH
3
O
C
H
2
X
+
H
+ HX
X = Cl, Br, I
+ X
2
Środowisko zasadowe (reakcja haloformowa)
O
CH
3
O
CX
3
O
ONa
X = Cl, Br, I
+ 3X
2
NaOH
NaOH
+ CHX
3
haloform
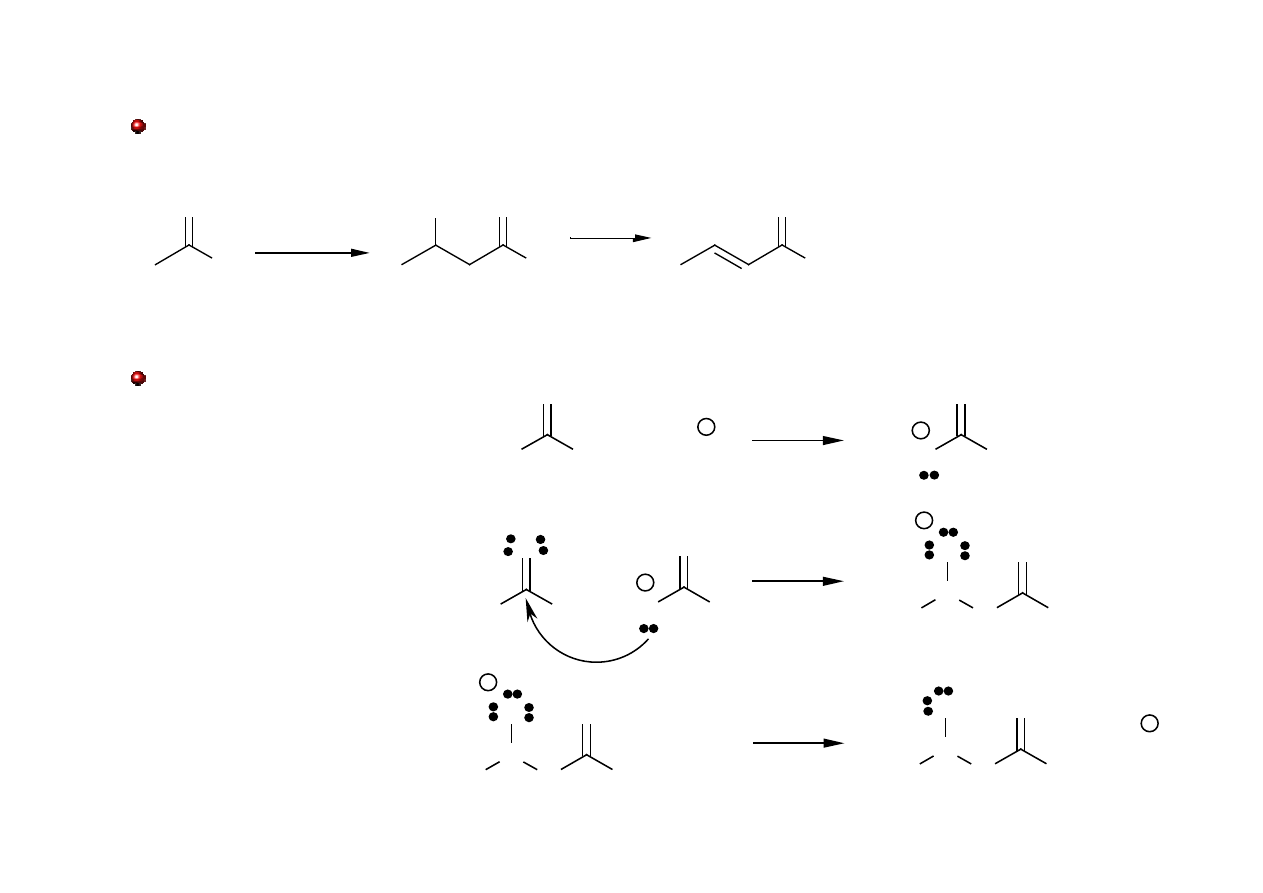
Kondensacja aldolowa
reakcja chemiczna
powstawania aldolu, czyli aldehydu
z grupą hydroksylową
(
aldehydoalkoholu) z dwóch aldehydów.
!
O
H
NaOH
aq.
O
H
OH
O
H
2
3-hydroksybutanal
temp.
α
,
β
-nienasycony aldehyd
Mechanizm kondensacji aldolowej:
_
C
H
3
C
H C
H
2
H
O
O
C
H
3
O
H
H
2
C
O
H
_
_
C
H
3
C
H C
H
2
H
O
O
_
+ HO
H
2
C
O
H
_
C
H
3
O
H
_
+ HO
C
H
3
C
H C
H
2
H
O
OH
+
+ H
2
O
+ H
2
O
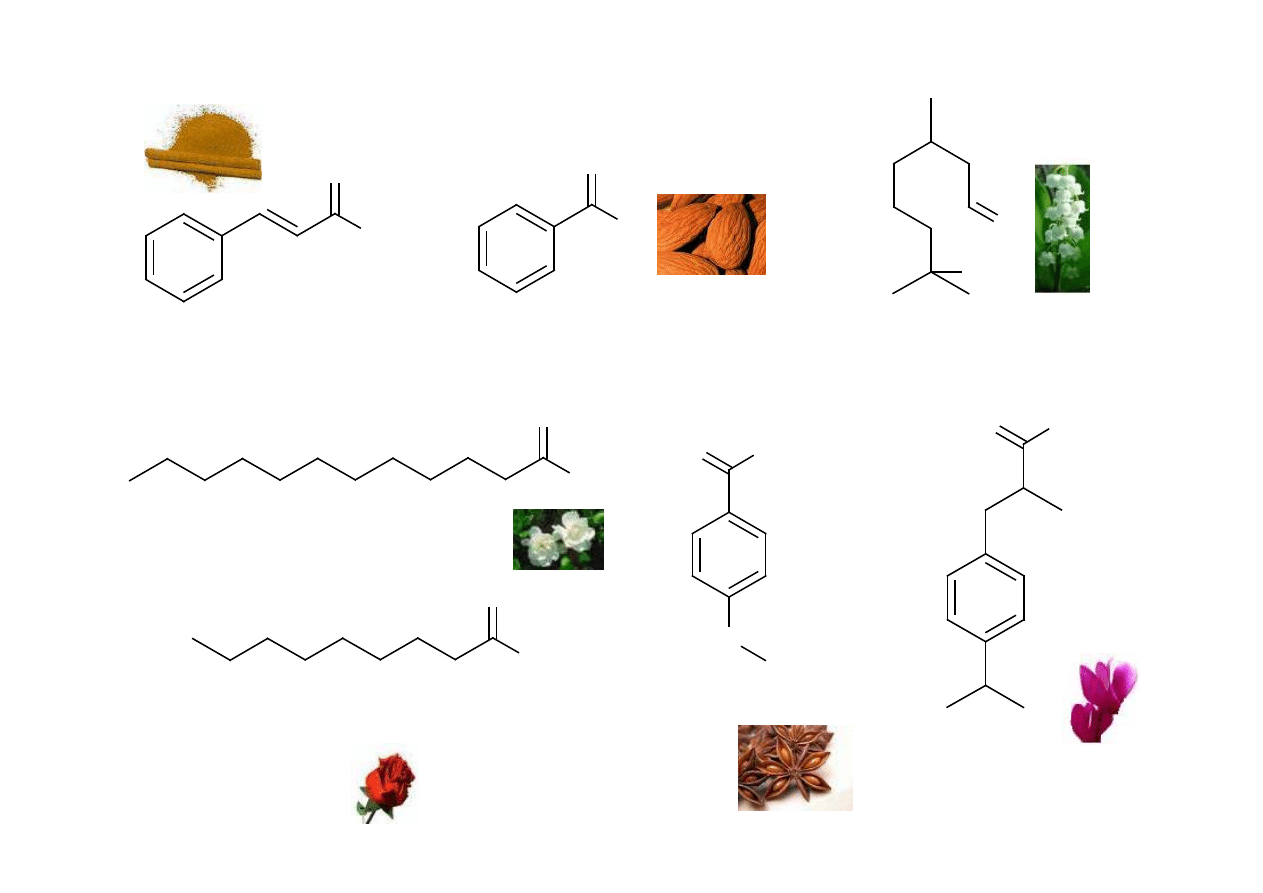
Aldehydy: kosmetyka
O
H
aldehyd laurynowy
(tuberoza, gardenia, fiołek)
OH
O
7-hydroksy-3,7-dimetylooktan-1-al
(lipowo-konwaliowy)
O
H
aldehyd cynamonowy
(cynamonowy)
H
O
aldehyd benzoesowy
(gorzkie migdały)
O
H
Cyklamal
(fiołki alpejskie)
O
H
O
aldehyd anyżowy
(anyż)
O
H
aldehyd pelargonowy
(różany)
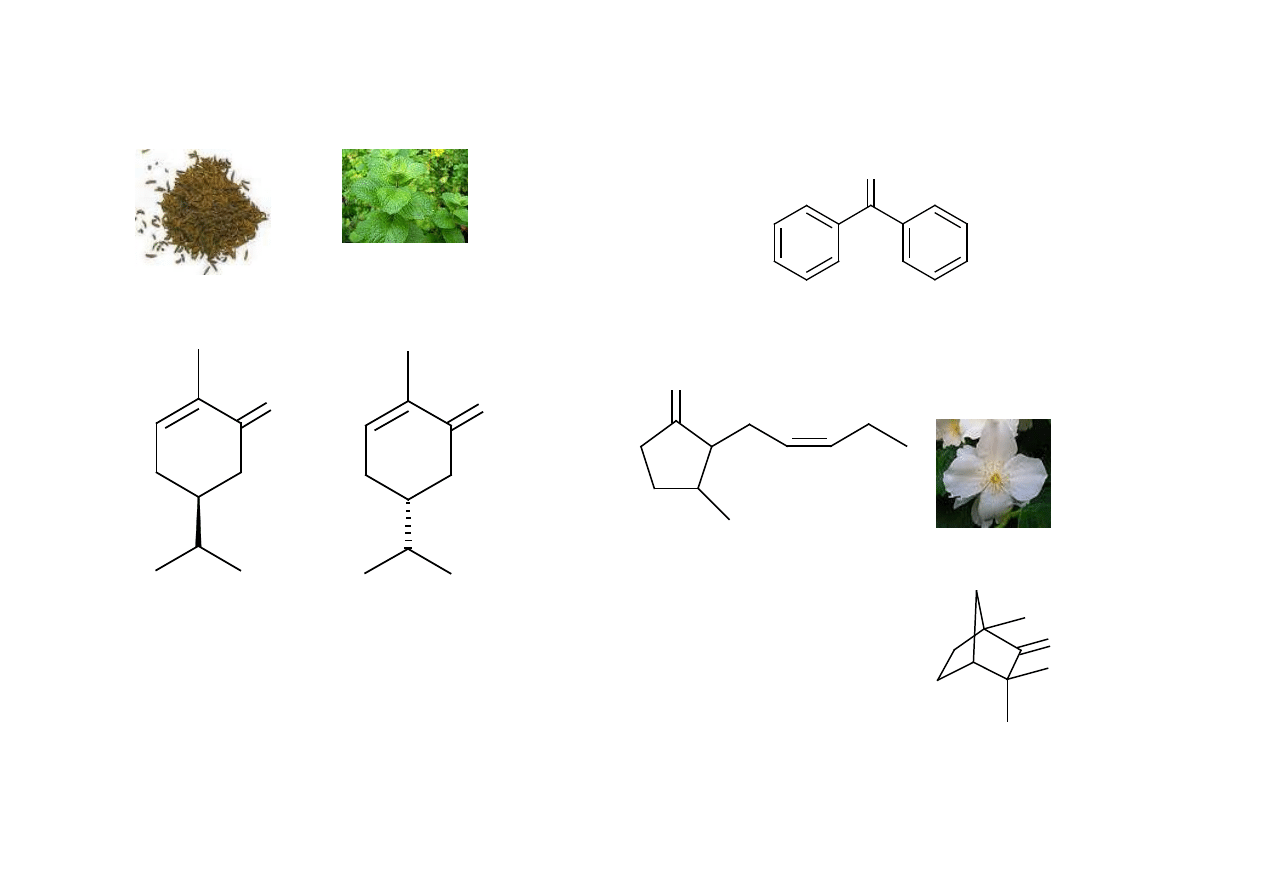
Ketony: kosmetyka
O
Jasmon
(jaś minowy)
O
keton difenylowy
(różowo-geraniowy)
(Carum carvi)
O
(R)-(–)-karwon
O
Składnik olejku mięty kędzierzawej
Zastosowanie: składnik perfum,
Mydeł, past do zębów
(Mentha crispata L.)
(S)-(+)-karwon
O
Fenchon
(kamforowy)
Następny wykład:
Kwasy i Estry
OH
O
O
O
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
aldehydy i ketony zadania
13 Aldehydy i ketony kondensacja aldolowa
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
Aldehydy i ketony
wyk 8 aldehydy,ketony cd
6 aldehydy,ketony
Aldehydy i ketonywisła
Aldehydy i ketony
aldehydy, ketony, hemiacetale
Aldehydy i ketony 2 id 54913 Nieznany
więcej podobnych podstron