P 5. Aldehydy i ketony
Aldehydy i ketony, to związki chemiczne, które powstają w wyniku utlenienia alkoholi. O ile jednak aldehydy są etapem pośrednim do kwasów karboksylowych, o tyle ketony stanowią niejako tor boczny produktów utlenienia alkoholi, gdyż utlenienie ketonów prowadzi do destrukcji cząsteczki, bez jednoznacznego, przewidywalnego produktu. Związki te posiadają grupy funkcyjne, w których znajduje się węgiel, tak więc węglowodorem wyjściowym dla ich otrzymania jest taki, w którym ilość atomów węgla jest równa sumie atomów węgla w rodniku plus jeden (ten z grupy funkcyjnej).
Aldehydy to związki organiczne, których cząsteczki składają się z rodnika węglowodorowego i charakterystycznej grupy aldehydowej -CHO, stosuje się właśnie taką kolejność zapisu atomów występujących w grupie, gdyż odwrotny, mógłby spowodować błędne skojarzenie z grupą hydroksylową. Wzór ogólny aldehydów R-CHO, w cząsteczce takich związków występuje fragment płaski cząsteczki, którym jest właśnie grupa aldehydowa. Tworzący ją atom węgla ma trzy wiązania sigma a więc wykazuje hybrydyzację sp2, którą cechuje uporządkowanie atomów w jednej płaszczyźnie zaś kąt między wiązaniami wynosi około 1200. Aldehydy, pochodne alkanów określa się ogólną nazwą alkanale, gdyż ich nazwy cechuje charakterystyczna końcówka -al., dodana do nazwy odpowiedniego węglowodoru (alkanu).
Otrzymywanie Zasadniczo wymienia się dwa sposoby otrzymywania aldehydów
Przez utlenianie alkoholi I-szo rzędowych za pomocą czarnego tlenku miedzi otrzymanego w wyniku prażenia siatki miedziowej. CH3OH + CuO → HCHO + Cu + H2O
Hydratację 1 - alkinów w obecności katalizatora rtęciowego (HgSO4), najbardziej znana jest tzw. synteza Kuczerowa, polegająca na katalitycznym uwodnieniu acetylenu: C2H2 + H2O

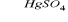
CH3CHO
Właściwości fizyczne - alkanale tworzą szereg homologiczny, w którym pierwszy metanal zwany również zwyczajowo aldehydem mrówkowym jest gazem, następne są już cieczami. Grupa tych połączeń jest omawiana właśnie na przykładzie metanalu. Jak już wspomniano jest gazem rozpuszczalnym w wodzie i dlatego powszechnie stosuje się właśnie jego roztwór wodny (około 40%) zwany formaliną. Ze względu na swe właściwości bakteriobójcze (powoduje denaturację białka) jest znany głównie z tego, że stosuje się go do konserwacji preparatów organicznych. Metanal posiada charakterystyczny zapach, jest toksyczny dlatego powszechnie ogranicza się jego stosowanie w różnego rodzaju wyrobach takich jak np. bardzo szeroko stosowane kiedyś do produkcji mebli żywice syntetyczne na bazie fenolu i metanalu.
Właściwości chemiczne Podkreśla się zasadniczo dwie cechy aldehydów, mianowicie to że mają właściwości redukujące oraz wykazują zdolność do polimeryzacji
Właściwości redukujące wykazywane są w dwóch, charakterystycznych dla grup aldehydowych, próbach tzw. Trommera i Tollensa
Próba Trommera polega na redukcji, w środowiska zasadowym, tlenku miedzi(II) otrzymanego w wyniku rozkładu termicznego wodorotlenku miedzi(II), do tlenku miedzi(I) o charakterystycznej barwie czerwonej. Aldehydy utleniają się wówczas do kwasów karboksylowych: HCHO + 2CuO →HCOOH + Cu2O
Próba Tollensa - zwana również próbą lustra srebrowego, polega na redukcji tlenku srebra, w roztworze amoniakalnym, do srebra metalicznego tworzącego na ściankach probówki lustro. Na roztwór azotanu(V) srebra działa się wodorotlenkiem amonu, w tych warunkach powstaje trwały osad tlenku srebra, który w wyniku łagodnego ogrzewania redukuje się do monomolekularnej, szczelnie przylegającej do ścianek probówki, warstewki metalicznego srebra.
HCHO + Ag2O → HCOOH + 2Ag
Uwaga Jak już wspomniano wcześniej obydwie próby pozwalają identyfikować związki złożone, np. cukry, które w swych cząsteczkach zawierają grupę aldehydową.
Aldehydy można również poddać hydrogenizacji i wówczas w wyniku redukcji aldehydów powstają alkohole: CH3CHO + H2 → CH3CH2OH
Aldehydy ulegają trimeryzacji, zjawisko to zachodzi nawet samorzutnie w butelce z formaliną, pod wpływem ogrzewania proces ten ulega cofnięciu:
3 HCHO ↔ H2C
/ \
O O
| |
H2C CH2
\ /
O
Analogiczny trimer aldehydu octowego stosowany był kiedyś jako bardzo popularne paliwko turystyczne. Aldehyd mrówkowy daje również bardzo znane kiedyś tworzywo polikondensacyjne o nazwie bakelit. Jako, że tworzywo to powstaje w wyniku polikondensacji metanalu i fenolu, dwóch niezwykle toksycznych substancji, obecnie ma jedynie znaczenie historyczne.
Ketony - są produktami utlenienia alkoholi II - rzędowych tlenkiem miedzi(II) otrzymanym w wyniku prażenia siatki miedzianej. Tlenek miedzi redukuje się do miedzi metalicznej: CH3CH(OH)CH3 + CuO → (CH3)2CO + H2O + Cu
Nazwy ketonów tworzy się dodając do nazwy węglowodoru o identycznej ilości atomów węgla końcówki -on. Można również utworzyć nazwę podając grupy połączone z grupą karbonylową =CO. Tak więc otrzymany powyżej keton to propanon lub dimetyloketon, znany jednak bardziej pod nazwą zwyczajową aceton Zasadniczo w kursie chemii liceum mówi się zasadniczo tylko o tym ketonie. Świadczy to również o tym, że ketony traktuje się jako swego rodzaju ślepy tor w sposobie realizacji tematyki chemii organicznej w kolejności: alkany - alkanole - alkanale - kwasy karboksylowe. Ketony nie wykazują wyników dodatnich reakcji Trommera i Tollensa. Podaje się jednak niezwykły sposób otrzymania acetonu, mianowicie przez rozkład termiczny octanu wapnia:
(CH3COO)2Ca ![]()
(CH3)2CO + CaCO3
Aceton znany jest głównie ze swego zastosowania jako rozpuszczalnik organiczny wielu wyrobów lakierowych. Poniżej podano przykłady zadań, których w testach jest niewiele i zasadniczo występują niejako przy okazji, oto kilka przykładów wyjętych z testów maturalnych.
Zadania z testów maturalnych
Poniżej podano schemat prowadzonych przemian. Podaj nazwy i wzory ukrytych pod symbolami literowymi związków oraz hybrydyzację atomów węgla w związku C CaC2
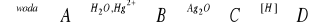
Metameria to rodzaj izomerii spowodowany obecnością różnych grup funkcyjnych. Przykładem takiej izomerii są propanal i propanon, podaj wory strukturalne tych związków, zaznacz i nazwij ich grupy funkcyjne. Za pomocą jakich reakcji można rozróżnić te związki.
Poniżej przedstawiono ciąg przemian:
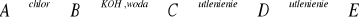
Podaj wzory i nazwy związków A - E wiedząc, że w wyjściowym związku A, którego gęstość wynosi 1,339 g/dm3, stosunek masowy C:H=4:1.
Podaj równania reakcji zachodzących przy otrzymywaniu poszczególnych produktów: koks → karbid → acetylen → aldehyd octowy → kwas octowy
Zaproponuj ciąg przemian prowadzących do powstania etanalu przyjmując Jako substraty wyjściowe wapno palone, koks i inne dowolne odczynniki.
Posługując się wzorami półstrukturalnymi substancji ułóż równania reakcji przebiegających według schematu;
A/ etanol → eten B/ etan→ eten C/eten→dichloroetan D/dichloroetan → etanodiol E/ etanodiol ![]()
7) Podaj nazwy związków ze schematu oraz określ do jakich grup związków należą: ![]()
Zad.1
Równania kolejnych równań:
1) CaC2 + 2H2O → Ca(OH)2 + C2H2 (A) acetylen
2) C2H2 + H2O ![]()
CH3CHO (B) synteza Kuczerowa - etanal
3) CH3CHO + Ag2O → CH3COOH (C)+ 2Ag kwas octowy
4) CH3COOH + [H] → CH3CHO + H2O (D)
Zad.2
Propanon CH3 - C - CH3 grupa karbonylowa czyli ketonowa
||
O
Propanal CH3-CH2- C = O grupa aldehydowa
|
H
Takie związki dają pozytywny wynik próby Trommera i Tollensa
Zad. 3
Ustalamy wzór wyjściowego węglowodoru:
Masa molowa z gęstości i objętości molowej: M = d•22,4 = 1,337 g/dm3•22,4 dm3 = 30 g, uwzględniając stosunek wagowy węgla do wodoru równy 4:1 i zwielokrotniając go do masy molowej otrzymujemy C : H = 24 : 6, czyli stosunek molowy odpowiada: C2H6
C2H6 + Cl2→ C2H5Cl + HCl
C2H5Cl + KOH ![]()
C2H5OH + KCl
C2H5OH + CuO → CH3CHO + H2O + Cu
CH3CHO + 2CuO → CH3COOH + Cu2O
Zad. 4
Koks → karbid 3C + CaO → CaC2 + CO
Karbid → acetylen CaC2 + 2H2O → Ca(OH)2 + C2H2
Acetylen → aldehyd octowy C2H2 + H2O ![]()
CH3CHO
Aldehyd octowy → kwas octowy CH3CHO + 2CuO → CH3COOH + Cu2O
Zad.5
Ciąg przemian identyczny z tym, który podano w zadaniu 4.
Zad.6
Etanol → eten CH3CH2OH ![]()
CH2=CH2 + H2O
Etan → eten CH3-CH3 + 2Cl2 → CH2Cl-CH2Cl
CH2Cl - CH2Cl + Zn → ZnCl2 + CH2=CH2
Eten → dichloroetan CH2=CH2 + Cl2→ CH2Cl-CH2Cl
Dichloroetan → etanodiol CH2Cl-CH2Cl + 2NaOH → CH2(OH)-CH2(OH) + 2NaCl
Etanodiol ![]()
CH2(OH)-CH2(OH) +4[O] → (COOH)2 + 2H2O kwas szczawiowy
Zad.7
Związek A to acetylen należący do alkinów
Związek B - katalizator i substrat woda wskazują, że przeprowadzono syntezę Kuczerowa w wyniku której powstał aldehyd - etanal
Związek C - substrat - tlenek srebra wskazuje na przeprowadzenie próby Tollensa więc ostatecznym produktem jest kwas etanowy znany również pod nazwą zwyczajową kwas octowy.
2
Wyszukiwarka
Podobne podstrony:
Powstórka z chemii alkohole, aldehydy, ketony
ISE powtorka z chemii, ISE zwiazki organiczne zawierajace azot, P 8 Związki organiczne zawierając az
ISE powtorka z chemii, ISE p 1 analiza elementarna, P
ISE powtorka z chemii, ISE ZADANIA Przeliczanie stezen roztworow, Przeliczanie stężeń roztworów
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
ISE powtorka z chemii, ISE wlasnosci chemiczne pierwiastkow calosc, Właściwości chemiczne pierwiastk
ISE powtorka z chemii, ISE alkohole i fenole, P
ISE powtorka z chemii, ISE a.a. slowo wstepne, Słowo wstępne
ISE powtorka z chemii, ISE fluorowce, M Fluorowce
ISE powtorka z chemii, ISE otrzymywanie i wlasciwosci najwazniejszych kwasow, O
ISE powtorka z chemii, ISE analiza chem i rozpuszczalnosc, Propozycje na stroną Internetową CEŚ
ISE powtorka z chemii, ISE metale i elektrochemia, Propozycje tematyki do strony internetowej CEŚ
Pyt trening--aldehydy i ketony--1, ZADANIA TRENINGOWE Z CHEMII ORGANICZNEJ
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
więcej podobnych podstron