P4 Alkohole i fenole
Alkohole i fenole to związki chemiczne, które w cząsteczkach zawierają tlen tworzący grupę wodorotlenową, zwaną również często, od nazwy łacińskiej, grupą hydroksylową OH-. Jeżeli grupa ta jest połączona z węglem alifatycznym mówimy o alkoholach, gdy zaś taka grupa znajdzie się przy węglu aromatycznym o fenolach.
Wzór ogólny alkoholu ma postać R-OH, gdzie R jest rodnikiem alifatycznym. Alkohole dzieli się ze względu na rodzaj rodnika (nasycony lub nienasycony) oraz ilość grup hydroksylowych. Najwięcej uwagi poświęca się alkoholom, które są monohydroksylowymi pochodnymi alkanów i dlatego grupę tych związków określa się ogólną nazwą alkanole. Nazwę alkoholu tworzy się dodając do nazwy węglowodoru, o takiej samej ilości atomów węgla, końcówki -ol, przykładowo CH3OH to metanol, lub też nazywa się je w sposób opisowy np. alkohol metylowy. Jeżeli istnieje możliwość różnorodnego podstawienia grupy wodorotlenowej możliwa jest, wynikająca z tego izomeria, która z kolei wymaga odpowiedniego nazewnictwa. Przykładowo propanol może występować w dwóch formach, które można zapisać wzorami półstrukturalnymi: CH3-CH2-CH2-OH lub CH3CH(OH)CH3. Nazwy takich związków tworzy się podobnie jak przy węglowodorach nienasyconych, czyli do nazwy odpowiedniego węglowodoru dodaje się, po myślniku, lokant atomu węgla z grupą hydroksylową i końcówkę -ol. Nazwy dwóch możliwych izomerów propanolu to kolejno: propan -1- ol drugiego zaś propan -2-ol. Ważnym elementem strukturalnym alkoholi jest również określenie ich rzędowości. W tym celu określa się ilość rodników, które są połączone z atomem węgla, przy którym znajduje się grupa hydroksylowa. Wracając do izomerów propanolu, to pierwszy z nich jest alkoholem I-rzędowym, a drugi jest alkoholem II-rzędowym. Alkohol III-rzędowy musi mieć co najmniej cztery atomy węgla, ten z grupą hydroksylową oraz połączone z nim trzy atomy węgla i będzie miał następującą strukturę: (CH3)3C-OH, zaś jego nazwa uwzględnia fakt, że łańcuch węglowy ma trzy atomy węgla oraz połączoną z drugim atomem węgla grupę metylową oraz hydroksylową. Systematyczna nazwa takiego alkoholu to 2-metylopropan-2-ol. Alkanole tworzą szereg homologiczny o ogólnym wzorze CnH2n+1OH i dlatego można mówić o liniowej zmianie właściwości fizycznych. Pierwsze osiem alkoholi to ciecze a następne są ciałami stałymi. Pierwsze dwa alkohole z szeregu rozpuszczają się w dowolnym stosunku w wodzie, propanol w sposób ograniczony a dalsze są nierozpuszczalne. Pierwsze w szeregu cechuje charakterystyczny, łagodny zapach, który od czwartego homologu staje się ostry, nieprzyjemny. Rozpuszczalność w wodzie pierwszych homologów wynika z faktu, że obecny w cząsteczce atom tlenu nadaje im wystarczającą polarność, która maleje w miarę przedłużania łańcucha węglowodorowego. Właściwości chemiczne alkanoli omawia się na przykładzie pierwszych dwóch członów szeregu homologicznego.
Otrzymywanie alkoholi.
Substytucja fluorowca w fluorowcopochodnej alkanu grupą -OH w środowisku wodnym zgodnie z równaniem reakcji: CH3Cl + NaOH
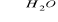
CH3OH + NaClHydratacja alkenów w obecności kaolinu: CH2=CH2 + H2O
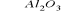
CH3CH2OHHydroliza estrów: CH3COOC2H5 + OH- → CH3COO- +C2H5OH
Fermentacja alkoholowa węglowodanów: C6H12O6
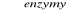
2CO2 + 2C2H5OH
Właściwości fizyczne omówiono wcześniej, jeżeli chodzi o właściwości chemiczne:
Alkohole spalają się na powietrzu blado niebieskim płomieniem, spalanie takie ma charakter spalania całkowitego. W wyniku łagodnego utleniania pod wpływem świeżo otrzymanego tlenku miedzi (II) alkohole I-rzędowe utleniają się do aldehydów, II-rzędowe do ketonów zaś III-rzędowe ulegają destrukcji. Tlenek miedzi(II) niezbędny do utlenienia alkoholu otrzymuje się przez prażenia siatki miedziowej, gdyż wtedy dzięki rozwiniętej powierzchni drucików miedzianych otrzymuje się więcej tlenku miedzi(II).
Alkohol -I-rzędowy: CH3CH2OH +CuO→CH3CHO + H2O + Cu
Alkohol -II-rzędowy: (CH3)2CHOH + CuO → (CH3)2CO + H2O + Cu Charakterystyczne dla tego sposobu utleniania, to znaczy za pomocą tlenku miedzi(II) jest to, że redukuje się do metalicznej miedzi, podczas gdy w trakcie próby Trommera tlenek miedzi(II) redukuje się do czerwonego tlenku miedzi(I). Alkohole nie dysocjują tak więc błędne jest stwierdzenie o kwasowości tych związków, można jedynie mówić o podobieństwie w zachowaniu się. Tak jest w przypadku reakcji alkoholi z litowcami, podobnie jak kwasy reagując z metalami dając wodór i alkoholan, który pod względem budowy można przyrównać do soli. Oto przykład:
2CH3OH + 2Na → 2CH3ONa + H2
nazwa powstałego połączenia to metanolan sodu, w roztworze wodnym następuje jego hydroliza w wyniku której znacząco wzrasta stężenie jonów wodorotlenowych:
CH3ONa + H2O → CH3OH + Na+ + OH-
Alkohole reagują z kwasami dając estry, reagować mogą zarówno z kwasami organicznymi jak i nieorganicznymi:
CH3OH + HCl → CH3Cl + H2O
Widzimy więc, że połączenie które wcześniej określiliśmy jako produkt chlorowcowania metanu może być również traktowany jako ester, którego hydroliza zasadowa prowadzi do utworzenia alkoholu (patrz metody otrzymywania alkoholi !) Przykład estryfikacji z kwasem organicznym:
CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O
powstały ester to octan etylu (Więcej o reakcji estryfikacji i estrach przy okazji omawiania kwasów karboksylowych).
Jako charakterystyczną można uznać również reakcję dehydratacji alkoholi, która prowadzi do alkenów: C2H5OH![]()
C2H4 + H2O
Alkohole diwodorotlenowe (glikole) Zachodzi tutaj przypadek, kiedy pierwszy zawiązek szeregu homologicznego (alkanodiole) - etanodiol (glikol) nasi nazwę zwyczajową, którą stosuje się również do określenia całej grupy związków chemicznych. Związki te opisuje się na przykładzie wspomnianego już wcześniej glikolu etylenowego, etanodiolu czy też prościej glikolu.
Wymienia się dwa sposobu otrzymania tego związku:
Addycja chloru do etenu i następnie substytucja atomów chloru grupą wodorotlenową przez reakcję z wodorotlenkiem sodu w środowisku wodnym. Równania reakcji : CH2=CH2+Cl2→CH2Cl-CH2Cl;
CH2Cl-CH2Cl+2NaOH![]()
2NaCl+CH2OH-CH2OH
Utlenienie etenu do tlenku etylenu, który następnie poddaje się hydratacji:
CH2=CH2 + [O] → CH2-CH2 - tlenek etylenu
\ /
O
CH2-CH2 + H2O → CH2-CH2 - glikol etylenowy (etanodiol)
\ / | |
O OH OH
Właściwości fizyczne: Glikol jest bezbarwną oleistą cieczą o smaku słodkim (wskazuje na to człon nazwy „gliko” od greckiego glikos - słodki). Dwa atomy tlenu w cząsteczce nadają mu wystarczającą polarność do tego by mógł się dobrze rozpuszczać w wodzie. Jego najbardziej charakterystyczną cechą jest bardzo niska temperatura zamarzania, dlatego stosuje się go jako składnik tzw. borygo, cieczy o niskiej temperaturze zamarzania stosowany do układów chłodzenia silników samochodowych.
Właściwości chemiczne Jak wszystkie alkohole nie dysocjuje, reaguje z metalami dając glikolany lecz w odróżnieniu od alkanoli może reagować z tlenkami metali. Najbardziej charakterystyczna jest reakcja glikolu z tlenkiem wapnia:
H2C-OH H2C-O \
| + CaO → | ![]()
Ca + H2O - glikolan wapnia
H2C-OH H2C-O /
Glikol, podobnie jak inne alkohole, reaguje z kwasami dając estry.
Gliceryna (propanotriol) jest przykładem alkoholu wielowodorotlenowego o trzech grupach wodorotlenowych w cząsteczce, zapisuje się go w postaci wzoru półstrukturalnego C3H5(OH)3
Wzór strukturalny H
|
H - C- O -H
|
H - C - O-H
|
H - C - O-H
|
H
Jest cieczą oleistą, rozpuszczalną w wodzie o słodkim smaku. Jest stałym składnikiem tłuszczów, które z tego powodu nazywane są glicerydami (konkretnie są to estry wyższych kwasów tłuszczowych i gliceryny), gdyż podobnie jak wszystkie alkohole ulega reakcji estryfikacji. Daje charakterystyczną reakcję (charakterystyczną dla alkoholi wielowodorotlenowych, w tym również cukrów, które do takiej grupy można zaliczyć). Reaguje z koloidalnym osadem wodorotlenku miedzi(II) powodując jego roztworzenie z utworzeniem odpowiedniej soli miedzi(II) o intensywnym lazurowym zabarwieniu (Patrz próba Trommera z cukrami). Nazwa tego związku to glicerynian miedzi(II)
H H
| |
H -C- O -H H-C-O \
| | Cu
H -C - O-H + Cu(OH)2 → H-C-O / + 2H2O
| |
H - C - O-H H-C-OH
| |
H H
Fenole zgodnie z wcześniejszą informacją, to związki w których grupa wodorotlenowa jest połączona z węglem aromatycznym. Najprostszym połączeniem tego typu jest hydroksybenzen znany pod nazwą zwyczajową fenol, taka jak nazwa całej grupy połączeń tego typu. Fenol jest ciałem stałym krystalicznym o charakterystycznym, nieprzyjemnym zapachu. Ma właściwości parzące i bakteriobójcze, dlatego jego roztwór wodny stosowano jako środek dezynfekujący. W związku ze specyfiką grupy fenylowej, a konkretnie jej elektroujemnością, fenol dysocjuje wykazując właściwości typowe dla słabych kwasów: C6H5OH ↔ C6H5O- + H+
reaguje z metalami, tlenkami oraz wodorotlenkami:
C6H5OH + NaOH → C6H5ONa + H2O - powstał fenolan sodu.
Fenol jako kwas jest słabszy od kwasu węglowego, dlatego dwutlenek węgla wypiera fenol z roztworu fenolanu sodu: C6H5ONa + CO2 + H2O → C6H5OH(↓) + NaHCO3. Wydzielający się fenol, jako słabo rozpuszczalny, tworzy w wyniku tej reakcji charakterystyczną emulsję.
Istnieje grupa połączeń o nawie alkohole aromatyczne, głównie mówi się jednak o konkretnym związku tego typu, o fenylometanolu lub inaczej alkoholu benzylowym C6H5CH2OH. Ten związek wykazuje cechy alkoholi, czyli głównie to, że nie ulega dysocjacji, gdyż grupa hydroksylowa połączona jest z węglem alifatycznym (hybrydyzacja sp3) a to wyklucza wpływ elektroujemności pierścienia aromatycznego na tak przyłączoną grupę OH-.
Do ważniejszych fenoli zalicza się dihydroksybenzeny: o-dihydroksybenzen (pirokatechina), m-dihydroksybenzen (rezorcyna) oraz p - dihydroksybenzen (hydrochinon). Z trójhydroksybenzenów należy przytoczyć ten najpopularniejszy, jest nim 1,2,3- trihydrokybenzen o nazwie zwyczajowej pirogalol. Można również wspomnieć o analogu fenolu - hydroksynaftolu, który może występować w dwóch odmianach izomerycznych 1-naftolu (zwany również α - naftolem) oraz 2 - naftolu ( zwany β- naftolem)
Przykłady zadań z testów maturalnych
25 cm3 95% roztworu alkoholu etylowego o gęstości d=0,78 g/cm3 poddano utlenieniu przy użyciu CuO. Zakładając 100% wydajność reakcji oblicz ile gramów aldehydu otrzymano.
Napisz równania reakcji, których schematy podano poniżej: eten → etanol; eten → chloroetan → etanol; etanal → etanol
Napisz równania reakcji otrzymywania kwasy benzenosulfonowego z benzenu, oraz równania reakcji, które uzasadniają kwasowy charakter tego związku oraz fenolu
Napisz równania reakcji następujących przemian: karbid → acetylen → etan → chloroetan → etanol → eten
Jaki odczyn wykazują wodne roztwory jednofunkcyjnych związków organicznych: etanol, fenol, kwas octowy, octan sodu, etyloamina. Odpowiedź uzasadnij w oparciu o odpowiednie równania reakcji.
Posługując się wzorami strukturalnymi oraz półstrukturalnymi ułóż równania reakcji za pomocą których można dokonać następujących przemian:
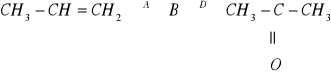
Dokończ równania reakcji lub zaznacz, że reakcja nie zachodzi
HCHO + H2 →
CH3OH + NaOH →
C3H7Cl + KOH →
Zapisz równania reakcji opisane schematem
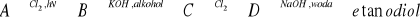
Rozwiązania przykładowych zadań z testów maturalnych
Zad. 1
Równanie reakcji utlenienia alkoholu
C2H5OH + CuO → CH3CHO + Cu + H2O
Obliczmy ilość etanolu zawartą w 25cm3 roztworu o gęstości d = 0,78 g/cm3 => 19,5 g roztworu o zawartości 95% co daje 18,53 g etanolu
Z równania reakcji wynika, że 1 mol czyli 46 g etanolu daje 1 mol, czyli 44 g aldehydu
18,53 g etanolu daje x g aldehydu
x = 17,72 g etanalu
Zad. 2
eten→ etanol C2H4 + H2O
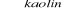
C2H5OHeten → chloroetan C2H4 + HCl → C2H5Cl
chloroetan → etanol C2H5Cl + NaOH
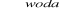
C2H5OH + NaCletanal → etanol CH3CHO + H2 → CH3CH2OH
Zad. 3
Równanie reakcji otrzymywania kwasu benzenosulfonowego to tzw. reakcja sulfonowania, czyli reakcja benzenu z kwasem siarkowym(VI):
C6H6 + H2SO4 → C6H5SO3H + H2O,
kwas benzenosulfonowy dysocjuje z odszczepieniem jonu wodorowego z grupy sulfonowej: C6H5SO3H ↔ C6H5SO3- + H+
czyli w sposób typowy dla kwasów, podobnie dysocjacji ulega fenol:
C6H5OH ↔ C6H5O- + H+
Zad. 4
Kolejne równania reakcji:
1) karbid → acetylen CaC2 + 2H2O → Ca(OH)2 + C2H2(↑)
2) acetylen → etan C2H2 + 2H2 → C2H6 reakcja addycji
3) etan → chloroetan C2H6 + Cl2 → C2H5Cl + HCl reakcja substytucji
4) chloroetan → etanol C2H5Cl + NaOH ![]()
C2H5OH + NaCl substytucja
5) etanol → eten C2H5OH ![]()
C2H4 + H2O dehydratacja
Zad. 5
etanol - odczyn obojętny ponieważ alkohole nie dysocjują
fenol - dysocjuje według równania C6H5OH ↔ C6H5O- + H+
kwas octowy - odczyn kwaśny gdyż dysocjacje: CH3COOH ↔ CH3COO- + H+
octan sodu - jako sól słabego kwasu i mocnej zasady w roztworze wodnym ulega hydrolizie kwasowej dając roztwór wodny o odczynie silnie zasadowym. Równanie reakcji hydrolizy: CH3COO- + H2O ↔ CH3COOH + OH-
Etyloamina, wykazuje odczyn zasadowy: C2H5NH2 +H2O↔C2H5NH3+ + OH-
Zad.6
Z alkenu do ketonu należy przejść przez alkohol i to drugorzędowy, taki właśnie, zgodnie z regułą Markownikowa, otrzyma się w wyniku uwodnienia propenu
CH3-CH=CH2 + H2O
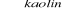
CH3-CH(OH)-CH3 związek A to izopropanolCH3-CH(OH)-CH3 + CuO → CH3-C-CH3+ Cu + H2O propanon
||
O
Zad.7
1) HCHO + H2 →CH3OH reakcja hydrogenizacji, uwodornienia lub redukcji
CH3OH + NaOH - nie zachodzi, alkohole nie wykazują właściwości kwasowych
C3H7Cl + KOH → C3H7OH + KCl - w środowisku wodnym - substytucja
C3H7Cl + KOH → C3H6 + KCl + H2O- w środowisku alkoholowym - eliminacja
Zad. 8
Jako, że produktem będzie etanodiol, więc wychodzimy od etanu
C2H6 + Cl2→ C2H5Cl + HCl substytucja
C2H5Cl + KOH
C2H4 + KCl + H2O eliminacja do alkenuC2H4 + Cl2 → C2H4Cl2 addycja
C2H4Cl2 + 2NaOH
C2H4(OH)2 + 2NaCl substytucja
1
2
Wyszukiwarka
Podobne podstrony:
ISE powtorka z chemii, ISE zwiazki organiczne zawierajace azot, P 8 Związki organiczne zawierając az
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
ISE powtorka z chemii, ISE p 1 analiza elementarna, P
ISE powtorka z chemii, ISE ZADANIA Przeliczanie stezen roztworow, Przeliczanie stężeń roztworów
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
ISE powtorka z chemii, ISE wlasnosci chemiczne pierwiastkow calosc, Właściwości chemiczne pierwiastk
ISE powtorka z chemii, ISE a.a. slowo wstepne, Słowo wstępne
ISE powtorka z chemii, ISE fluorowce, M Fluorowce
ISE powtorka z chemii, ISE otrzymywanie i wlasciwosci najwazniejszych kwasow, O
ISE powtorka z chemii, ISE analiza chem i rozpuszczalnosc, Propozycje na stroną Internetową CEŚ
ISE powtorka z chemii, ISE metale i elektrochemia, Propozycje tematyki do strony internetowej CEŚ
Alkohole i fenole 3 id 58102 Nieznany
instrukcja węglowodory, alkohole i fenole
test alkohole i fenole chem, chemia gimnazjum
Praca powtórzeniowa z chemii 3
alkohole i fenole 2 id 58101 Nieznany (2)
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
Alkohole i fenole - test, Napisz brakujące nazwy następujących związków:
alkohole i fenole, Chemia- liceum
więcej podobnych podstron