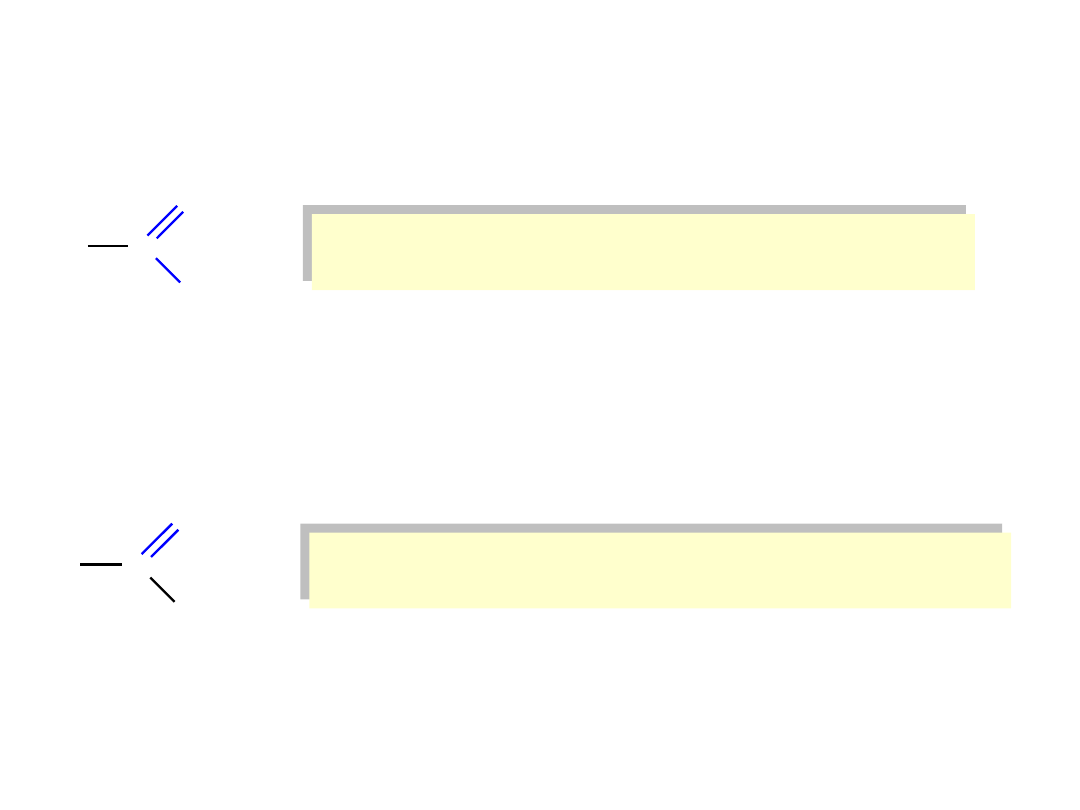
Aldehydy i ketony
R
C
H
O
Aldehydy mają co najmniej jeden atom wodoru połączony
z karbonylowym atomem węgla.
R
C
R
1
O
W ketonach karbonylowy atom węgla jest połączony z dwoma
innymi atomami węgla.
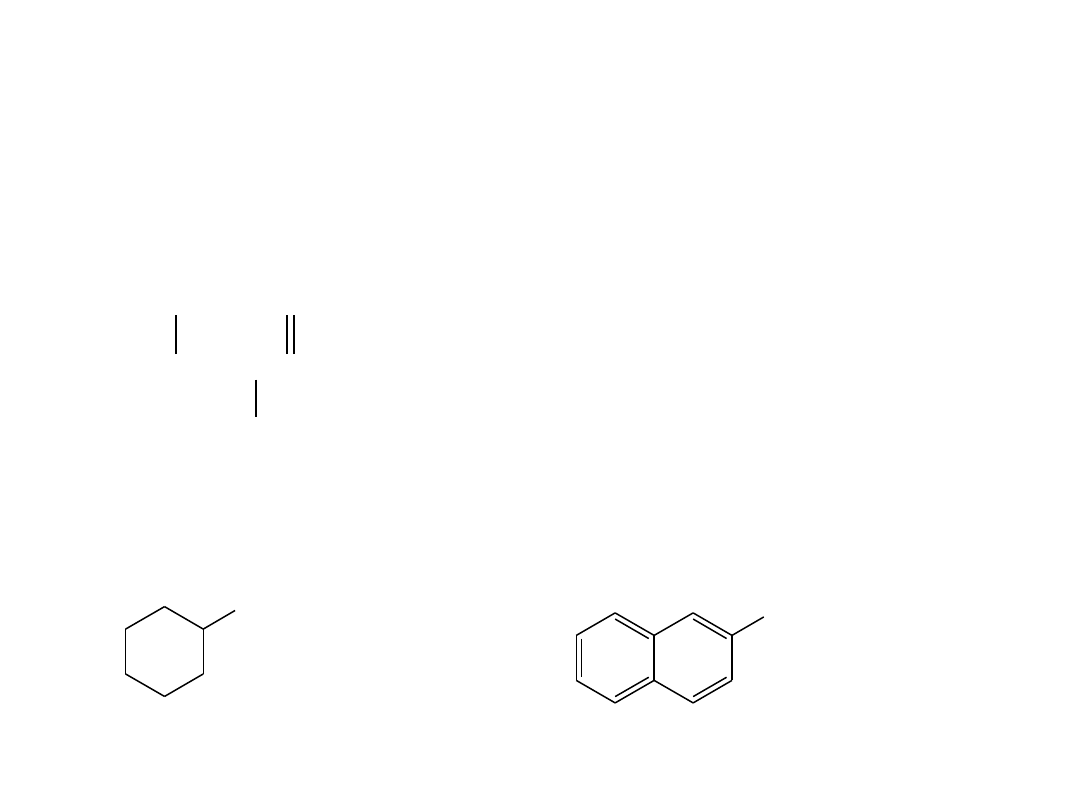
Nazewnictwo aldehydów
• Nazwę aldehydu tworzy się od nazwy odpowiedniego alkanu, do której dodaje się
przyrostek
–al
. Łańcuch macierzysty musi zawierać grupę
-CHO
i atom węgla tej
grupy numeruje się jako C1.
CH
3
CHCH
2
CHCH
CH
3
CH
2
CH
3
O
1
2
3
4
5
2-etylo-4-metylopentan
al
• W przypadku aldehydów bardziej złożonych, w których grupa
–CHO
jest
dołączona do pierścienia, stosuje się przyrostek
-karboaldehyd
CHO
cykloheksano
karboaldehyd
CHO
1
2
2-naftaleno
karboaldehyd
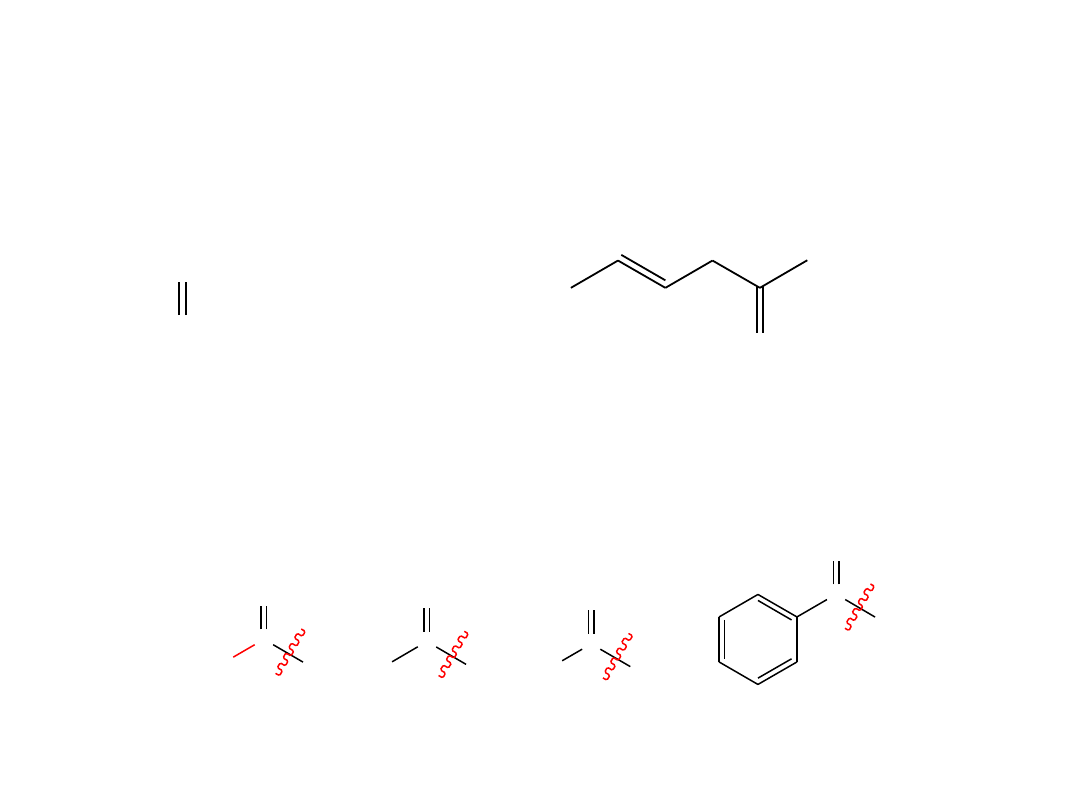
Nazewnictwo ketonów
• Nazwę ketonu tworzy się od nazwy odpowiedniego alkanu, do której dodaje się
przyrostek
–on
. Najdłuższy łańcuch, w którym znajduje się grupa ketonowa, jest
łańcuchem macierzystym, a numerowanie rozpoczyna się od końca najbliższego
karbonylowego atomu węgla.
CH
3
CH
2
CCH
2
CH
2
CH
3
O
1
2
3 4
5
6
3-heksanon
6
5
4
3
2
O
5
1
4-heksen-2-on
• Gdy uznamy grupę
RCO-
za podstawnik, wówczas stosuje się określenie acyl,
a nazwa związku kończy się przyrostkiem
–yl
lub
–il.
N aprzykład grupa
CH
3
CO-
jest nazywana
grupą acetylową
,
CHO-
jest
grupą formylową
, a
C
6
H
5
CO-
to
grupa benzoilowa
.
R
C
O
CH
3
C
O
H
C
O
C
O
grupa acylowa
grupa acetylowa
grupa formylowa
grupa benzoilowa
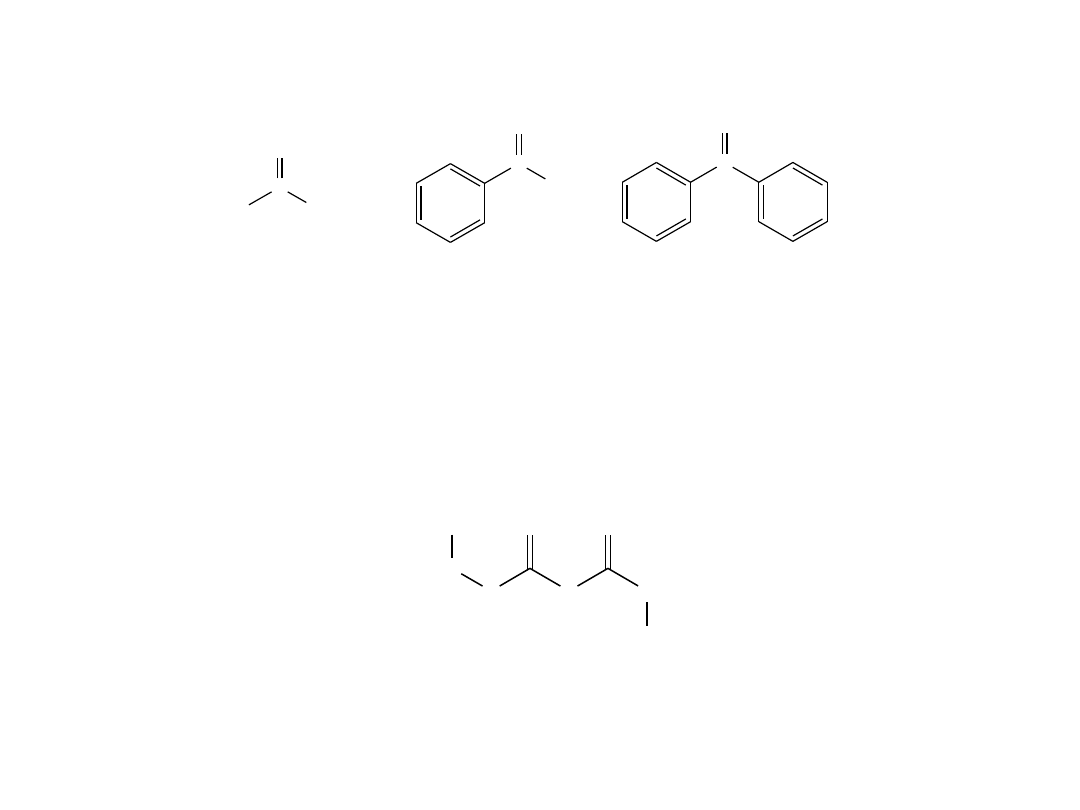
• Kilka ketonów zachowało swoje nazwy zwyczajowe, co zostało zaakceptowane
przez IUPAC:
CH
3
C
O
CH
3
C
O
CH
3
C
O
aceton
acetofenon
benzofenon
• Jeśli obecne są inne grupy funkcyjne, a podwójnie związany atom tlenu uważany
jest za podstawnik, to stosuje się przedrostek
okso
-:
O
O
CH
3
6
H
2
C
5
C
H
2
4
3
C
H
2
2
1
O
CH
3
3-oksoheksanian metylu
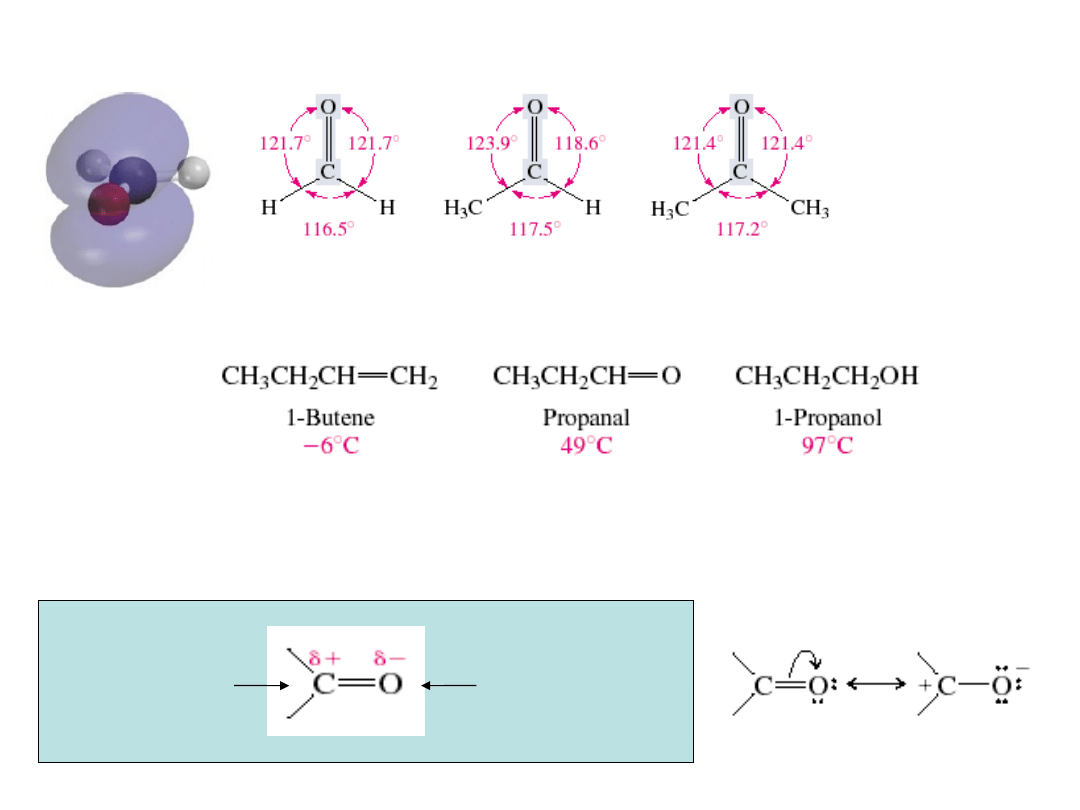
Struktura i wiązania w aldehydach i ketonach
formaldehyd acetaldehyd aceton
T. wrz.
rozp. w wodzie
g/100 ml
zaniedbywalna
20
miesza się we wszystkich
proporcjach
kierunek
taku nukleofila
może reagować
z protonem
Względna reaktywność aldehydów i ketonów
0.14
2.5 x 10
-5
propanon
19
4.1 x 10
-3
2,2-dimetylopropanal
50
1.8 x 10
-2
etanal
Hydrat
99.96
41
metanal
Karbonyl
% Hydrat
K / M
-1
Karbonyl
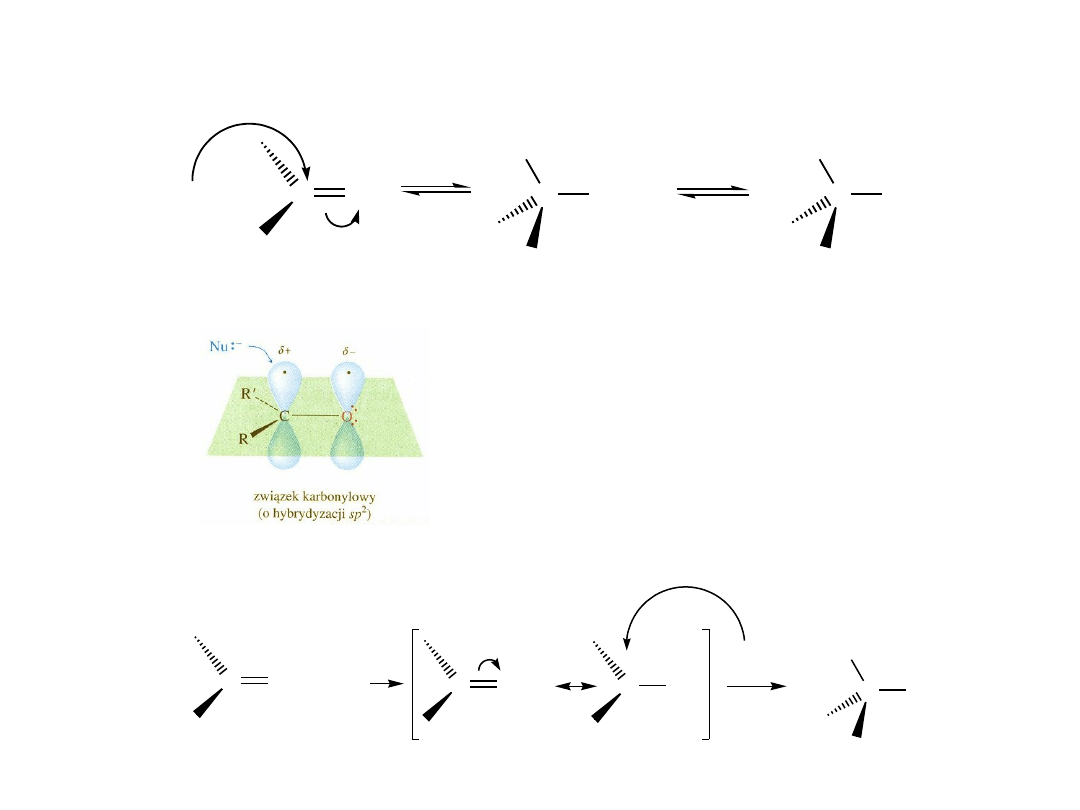
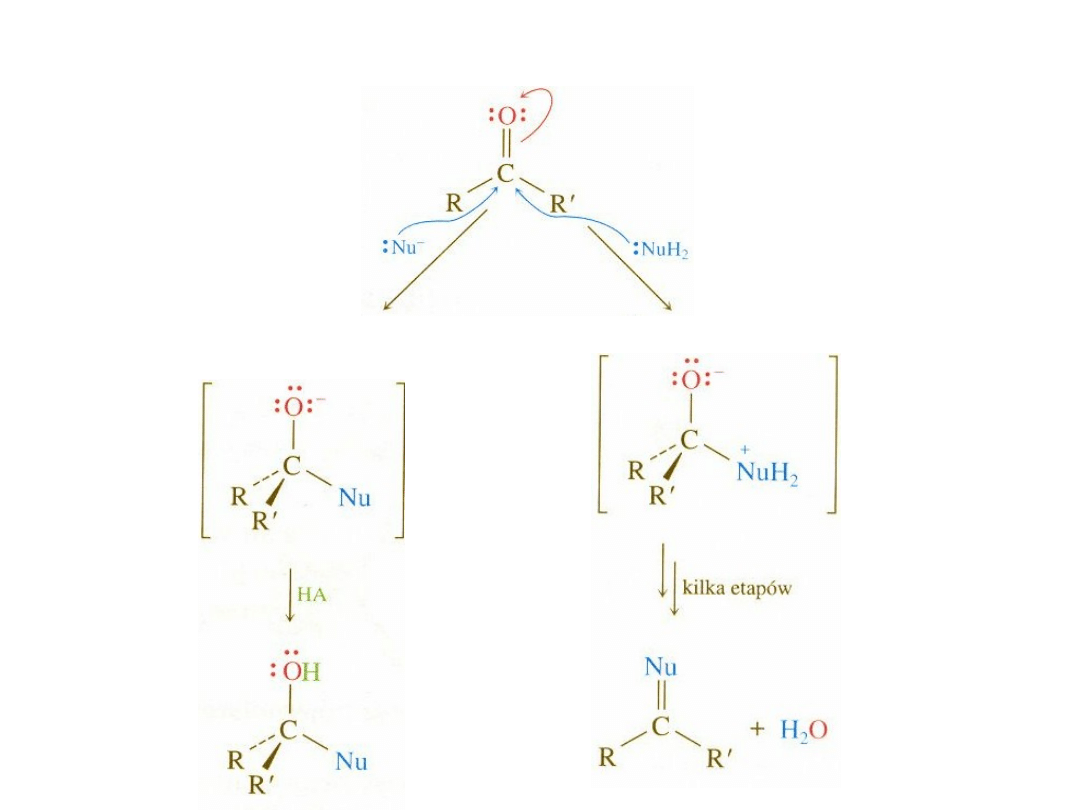
Addycja nukleofilowa do grupy karbonylowej
C
O
Nu:
-
C
O
-
Nu
H
2
O
C
OH
Nu
trygonalny
reagent
tetraedryczny
produkt pośredni
tetraedryczny
produkt
Nu:
-
C
O + H
+
C
OH
+
C
OH
+
C
OH
Nu
Nukleofile naładowane ujemnie:
HO
-
; H
-
; R
3
C
-
; RO
-
; NC
-
Nukleofile obojętne:
HOH; ROH; NH
3
; RNH
2
Nukleofile można podzielić na takie, które przyłączają się do grupy karbonylowej
w sposób odwracalny i na takie, które ulegają przyłączeniu nieodwracalnemu
Nukleofile przyłączające się w sposób odwracalny są jednocześnie grupami dobrze
odchodzącymi – są sprzężonymi zasadami stosunkowo mocnych kwasów.
Nukleofile przyłączające się w sposób nieodwracalny są słabymi grupami
odchodzącymi – sprzężonymi zasadami słabych kwasów.
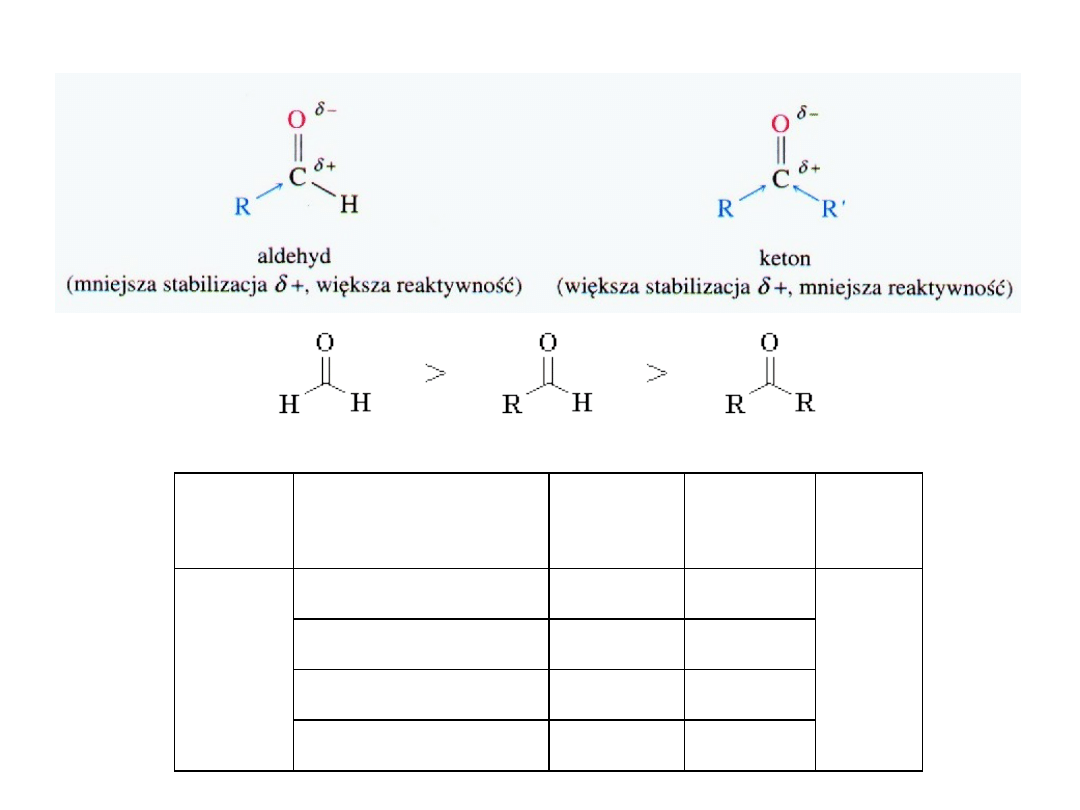
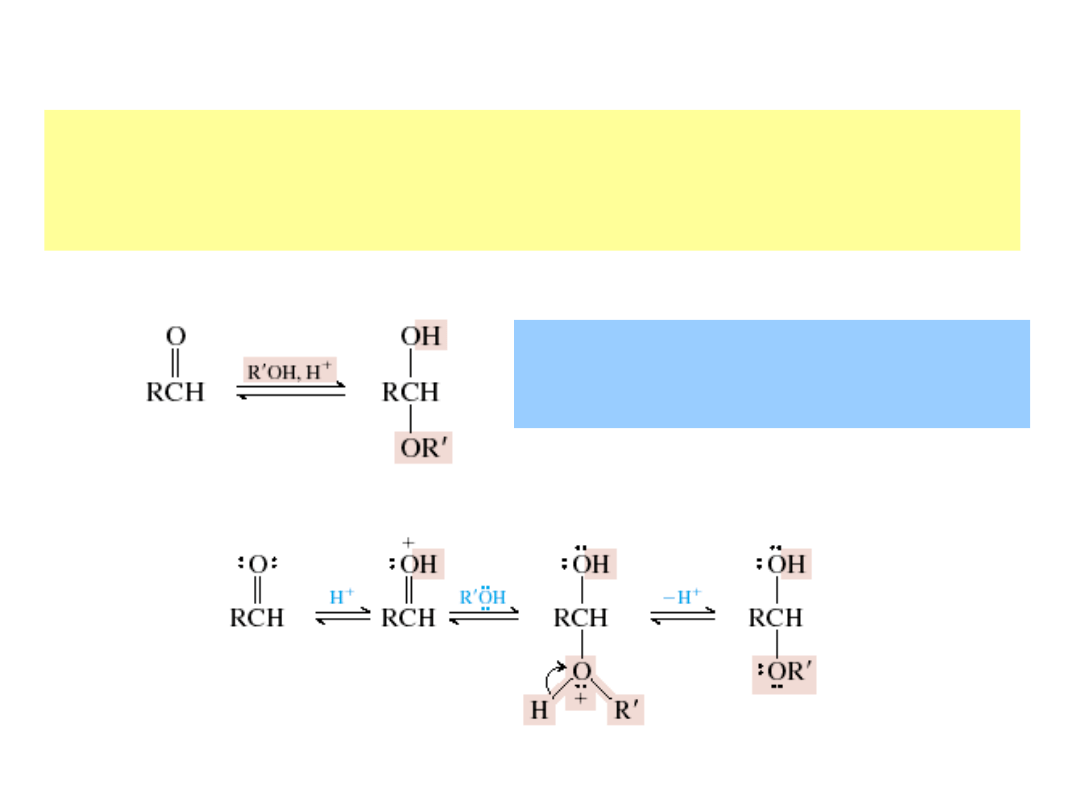
aldehyd
hemiacetal
Hemiacetal zawiera dwie grupy funkcyjne –
alkoholową i eterową przy tym samym
atomie węgla.
aldehyd
protonowany
aldehyd
protonowany
hemiacetal
hemiacetal
Addycja alkoholi: powstawanie hemiacetali i acetali
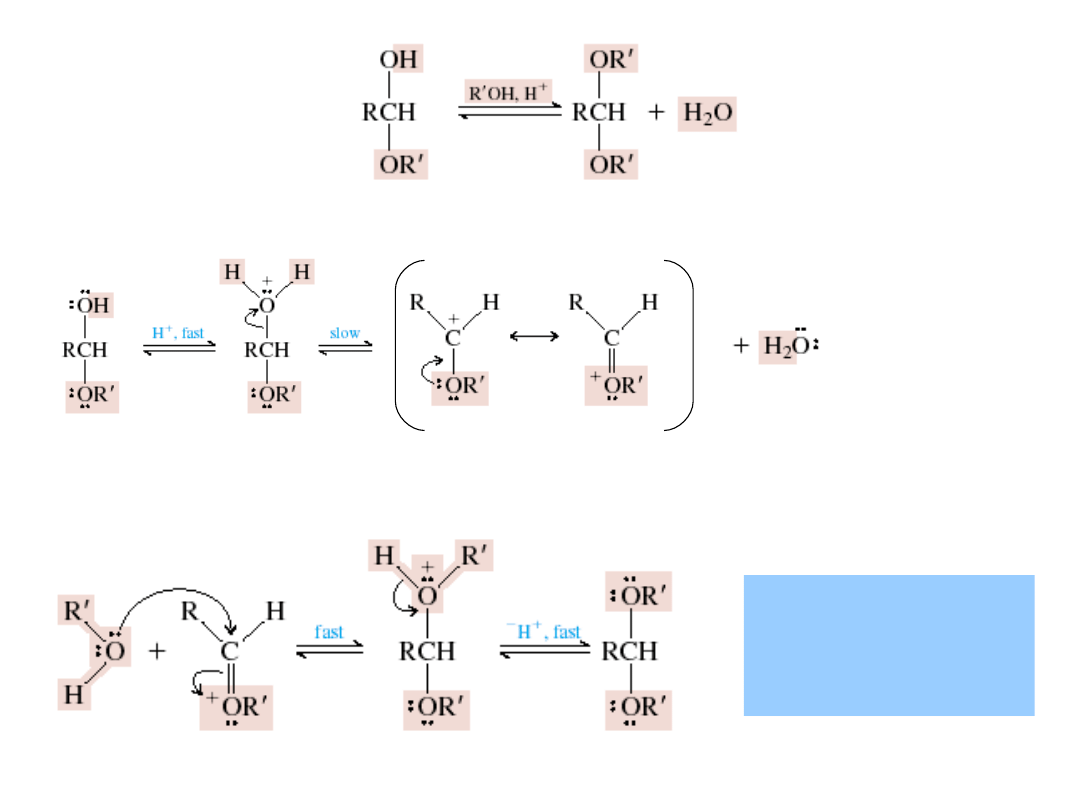
hemiacetal
acetal
karbokation stabilizowany
rezonansowo
alkohol
acetal
Acetal ma dwie eterowe
grupy funkcyjne –
związane z tym samym
atomem węgla.
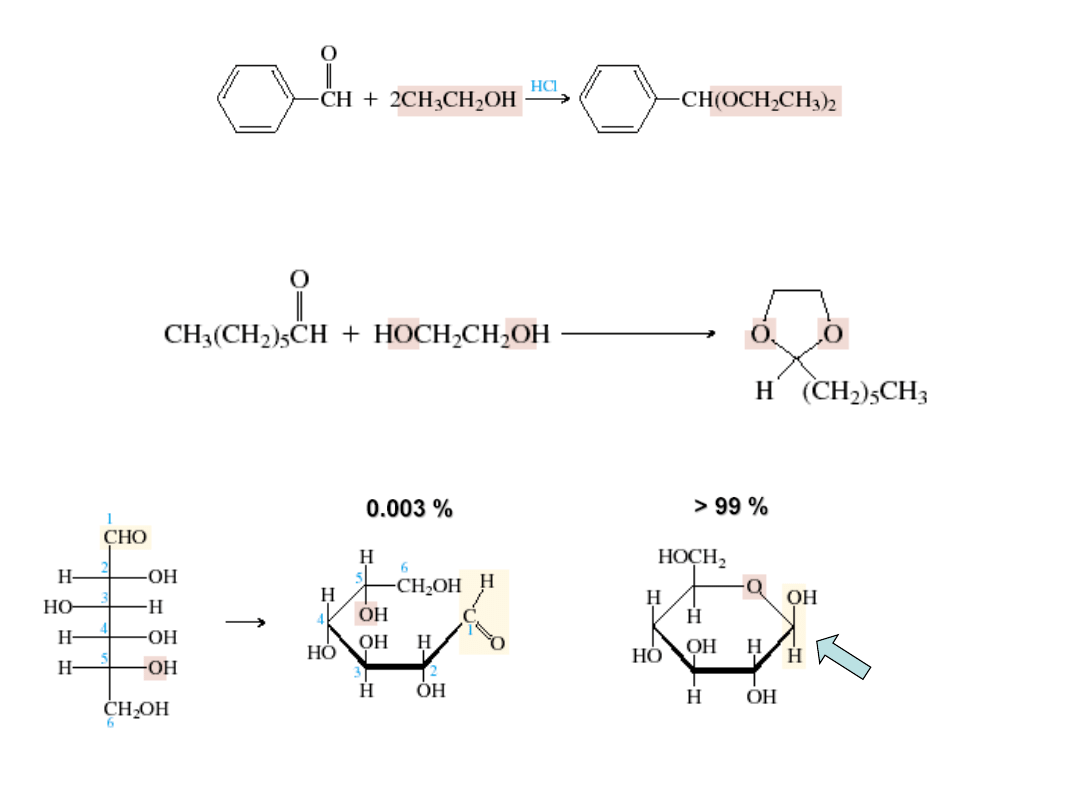
benzaldehyd
etanol
acetal dietylowy
benzaldehydu
hemiacetalowy
węgiel
Β-D-glukopiranoza
glukoza
kwas
p-toluenosulfonowy
forma aldehydowa
glukozy
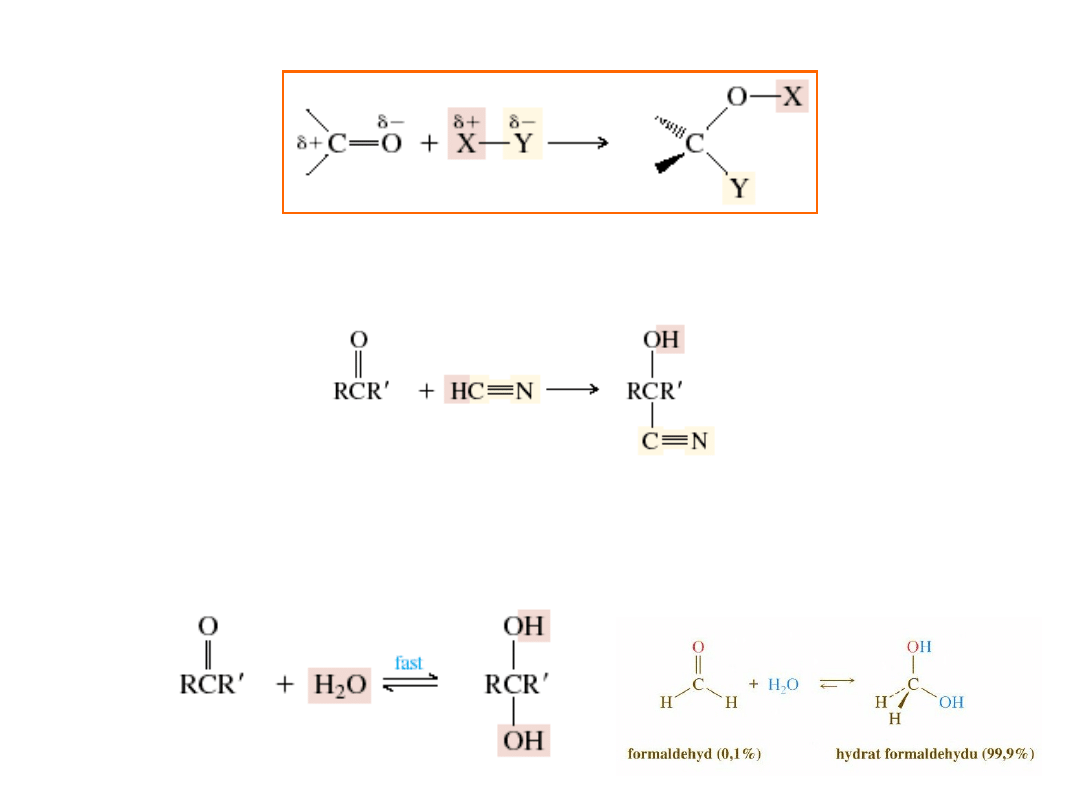
aldehyd
lub keton
kwas
cyjanowy
cyjanohydryna
aldehyd
lub keton
diol geminaly
• Addycja wody; hydratacja aldehydów i ketonów
• Addycja cyjanowodoru; cyjanohydryny
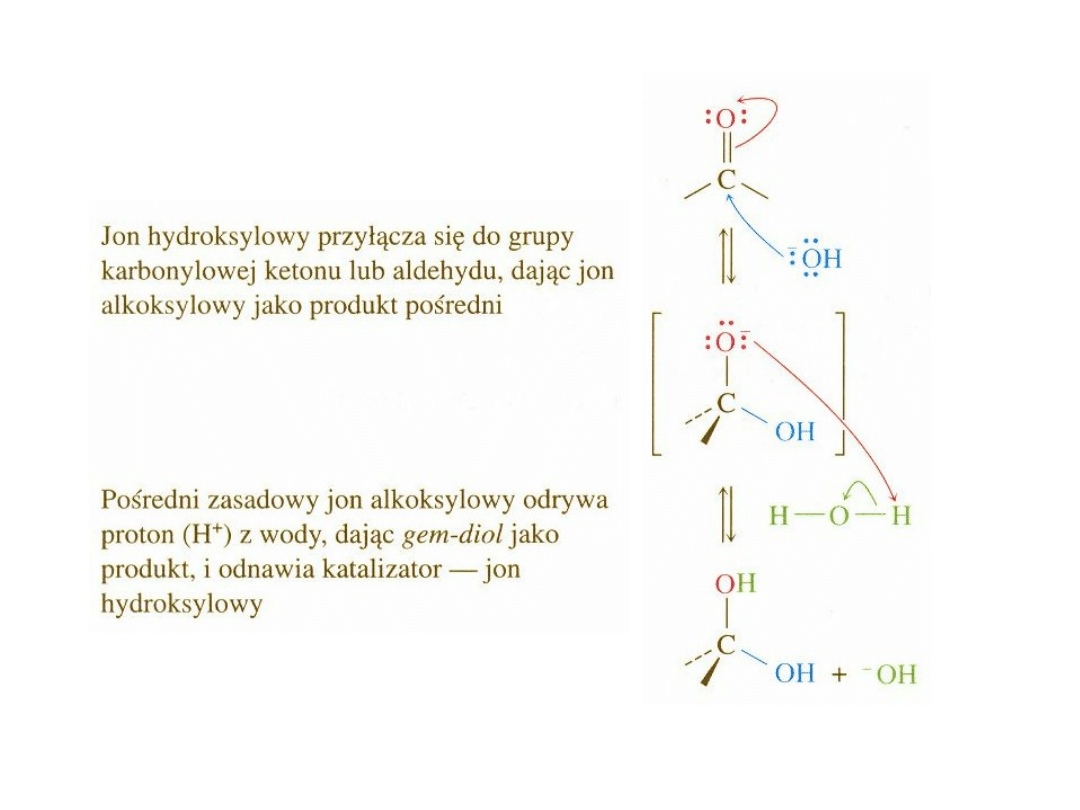
Kataliza zasadowa
Addycja nukleofili azotowych
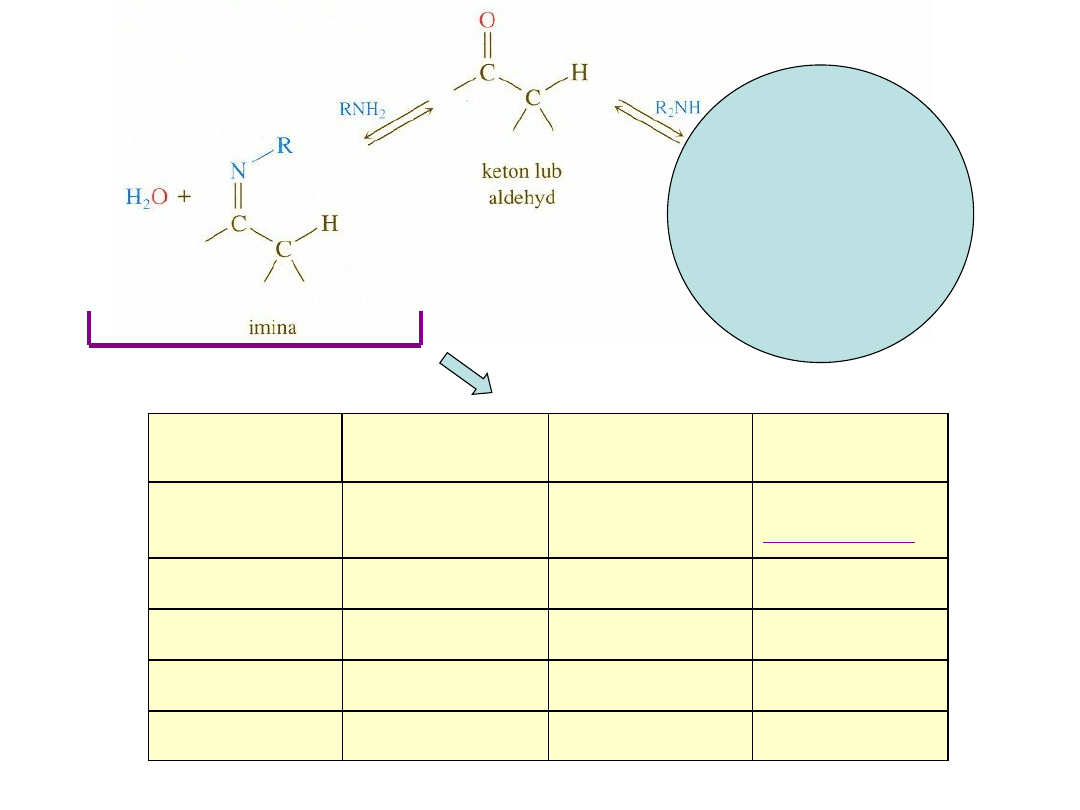
semikarbazon
>C=NNHCONH
2
semikarbazyd
NH
2
NHCONH
2
fenylohydrazon
>C=NNHC
6
H
5
fenylohydrazyna
NH
2
HNC
6
H
5
hydrazon
>C=NNH
2
hydrazyna
NH
2
NH
2
oksym
>C=NOH
hydroksyloamina
NH
2
OH
imina
Zasada Schiffa
>C=NR lub
>C=NAr
amina
pierwszorzędowa
RNH
2
lub
ArNH
2
Nazwa
Wzór pochodnej
karbonylowej
Nazwa
Wzór pochodnej
aminowej
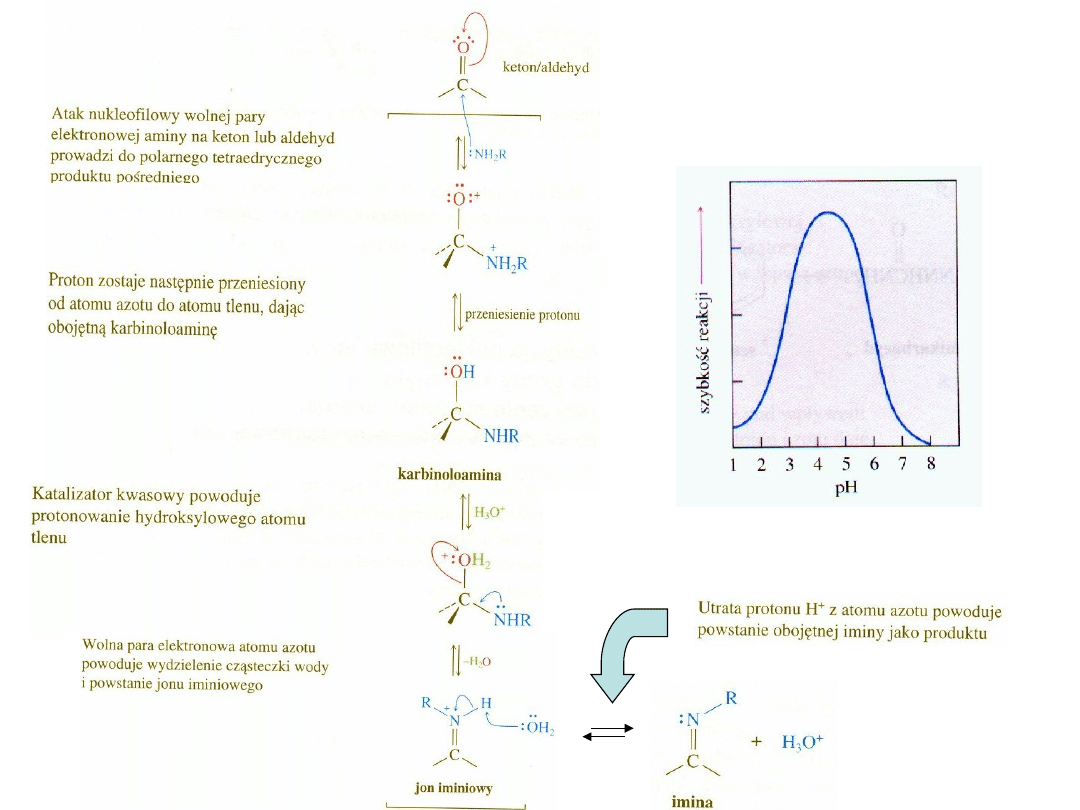
Mechanizm tworzenia iminy
Redukcja związków karbonylowych
C
O
C
H
2
O
H
-
AlH
3
Li
+
O-
AlH
3
H
H
+
C
OH
H
δ −
δ −
δ +
alkoholan
glinu
alkohol
O
H
OH
LiAlH
4
H
2
O
cykloheksanon
cykloheksanol
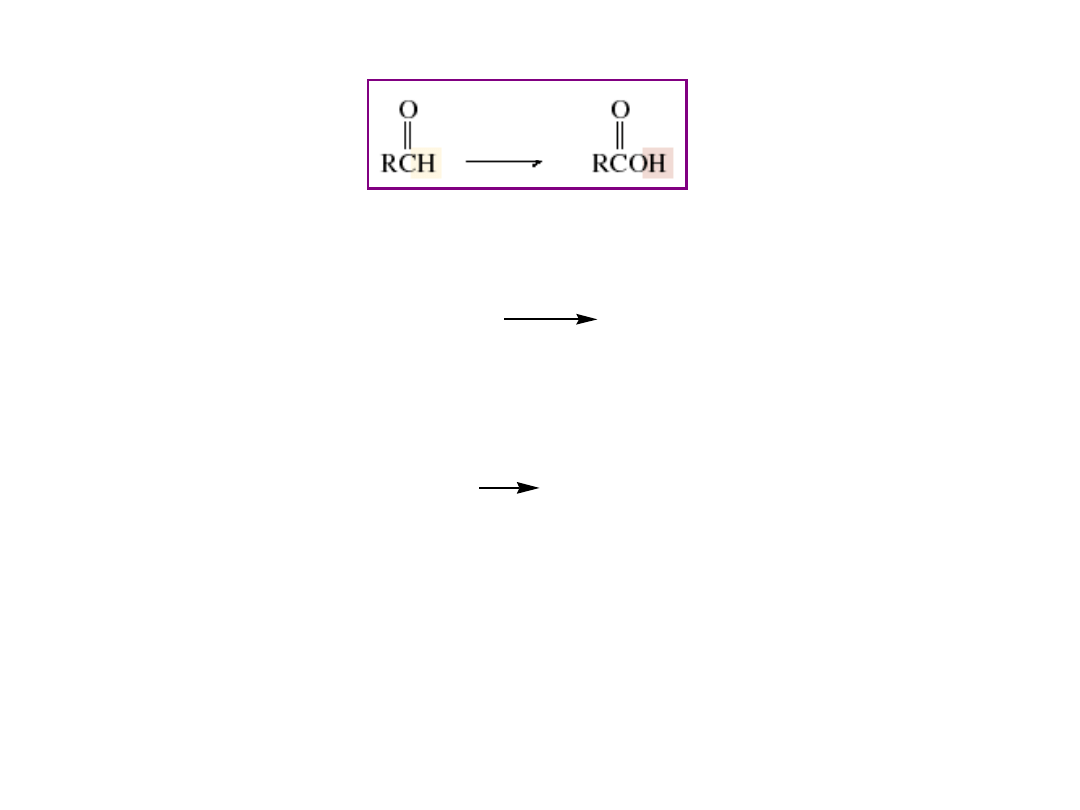
Utlenienie związków karbonylowych
czynnik
utleniający
aldehyd
kwas karboksylowy
CH
3
(CH
2
)
3
CH=O
CH
3
(CH
2
)
3
CO
2
H
CrO
3
, H
+
Próba Tollensa lustra srebrnego
aldehyd
jon kompleksu
srebro-amoniak
anion
kwasu
lustro
srebrne
R
CHO
+ 2Ag(NH
3
)
2
+
+ 3OH
-
R
COO
-
+
2Ag
+ 4NH
3
+ 2H
2
O
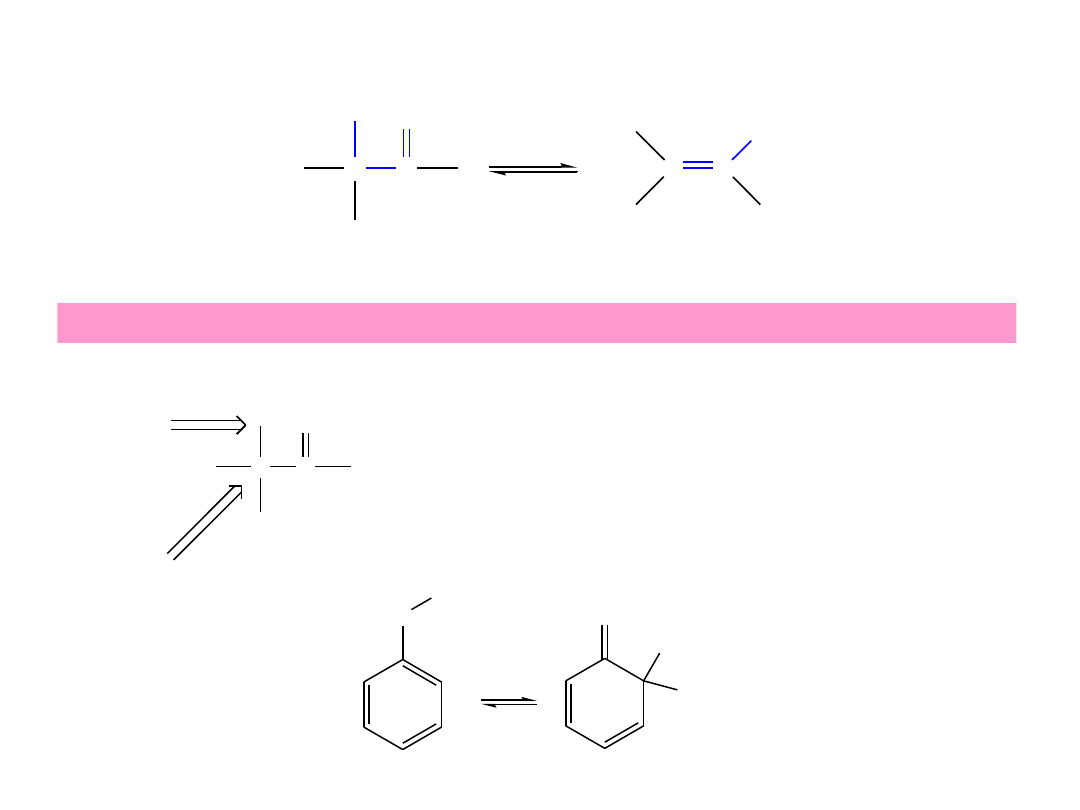
Tautomeria keto-enolowa
C
C
H
O
C
C
OH
forma ketonowa
forma enolowa
Tautomery
to izomery strukturalne różniące się położeniem protonu i podwójnego wiazania
C
C
H
O
wodór α
węgiel α
W prostych aldehydach i ketonach przeważa forma ketonowa.
Związki karbonylowe nie zawierające wodorów α nie mogą
tworzyć form enolowych.
O
H
O
H
H
enolowa forma fenolu
ketonowa forma fenolu
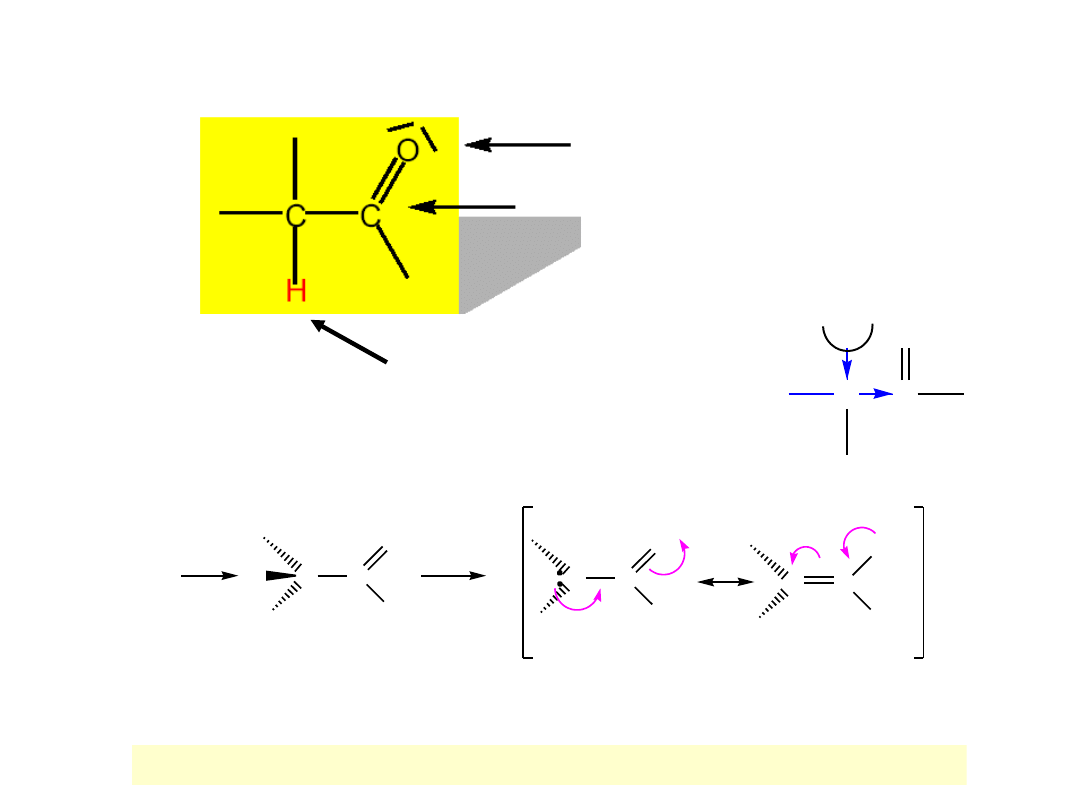
Kwasowośc α-wodorów; anion enolanowy
Podatny na atak elektrofila
Podatny na atak nukleofila
wodór kwasowy
C
C
H
O
δ
−
δ
+
Anion enolanowy powstaje przez oderwanie wodoru α od aldehydu lub ketonu.
C
C
H
O
R
zasada
C
C
O
R
C
C
O
-
R
-
anion enolanowy
stabilizowany rezonasowo
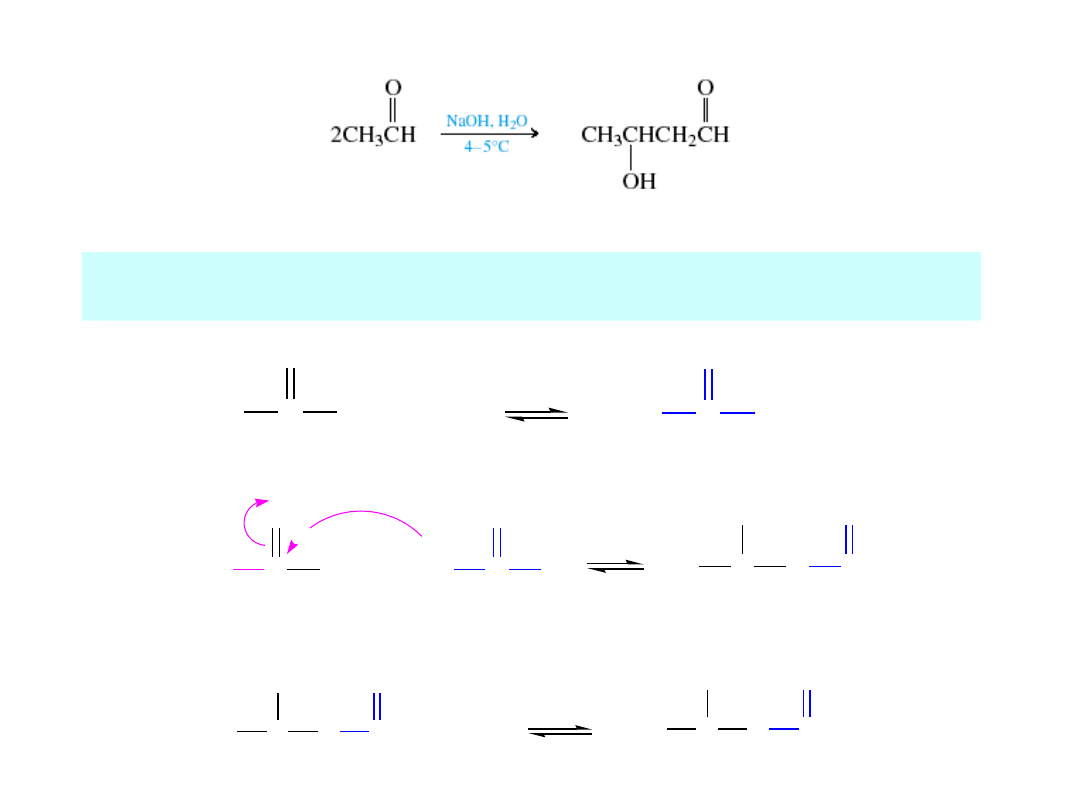
Kondensacja aldolowa
acetaldehyd
3-hydroksybutanal
Anion enolanowy przyłącza się do grupy karbonylowej adehydu lub ketonu w reakcji
kondensacji aldolowej
.
Aldol
jest
3-hydroksyaldehydem
lub
3-hydroksyketonem
.
H
3
C
C
O
H
+ OH
-
H
2
C
C
O
H
-
+ H
2
O
anion enolanowy
nukleofil
jon alkoksylowy
H
3
C
C
H
O
H
2
C
CH
O
-
+ HOH
H
3
C
C
H
OH
H
2
C
CH
O
+ OH-
aldol
H
3
C
C
O
H
H
2
C
C
O
H
-
+
H
3
C
C
H
O
H
2
C
CH
O
-
Mechanizm
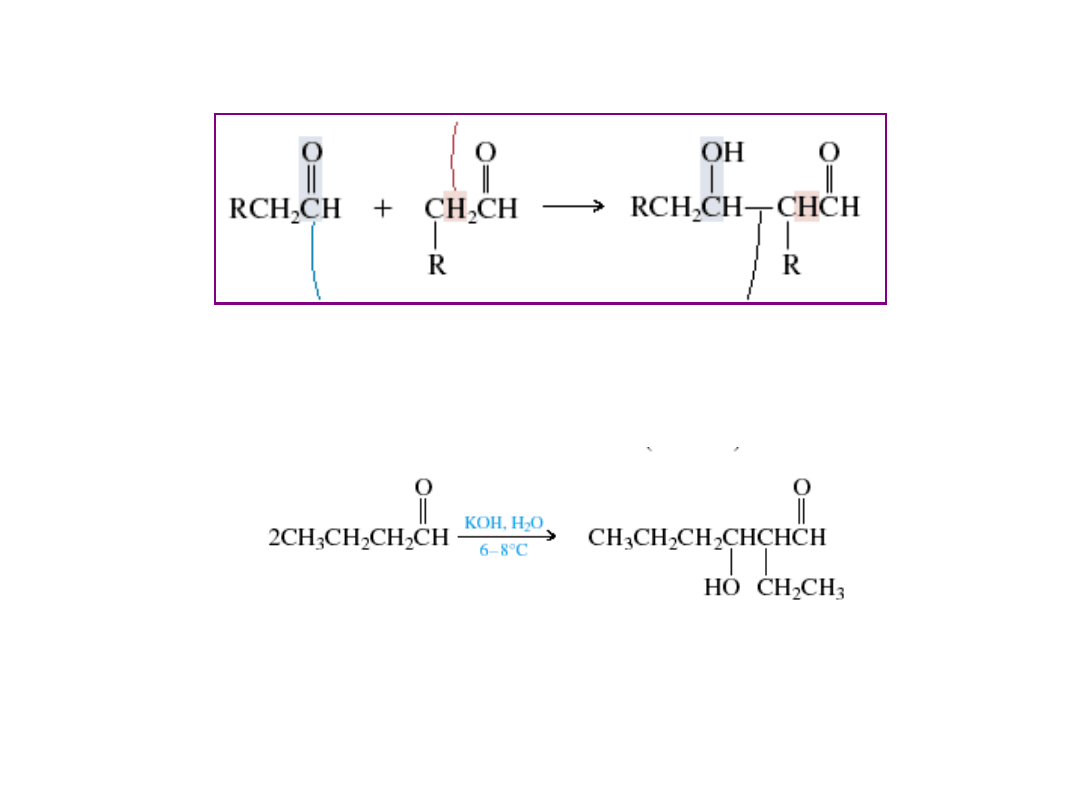
Grupa karbonylowa
do której przyłącza się
enol
Jeden z tych protonów
jest odrywany przez zasadę
tworząc enol
To jest wiązanie węgiel-węgiel
tworzące się w trakcie reakcji
zasada
butanal
2-etylo-3-hydroksyheksanal
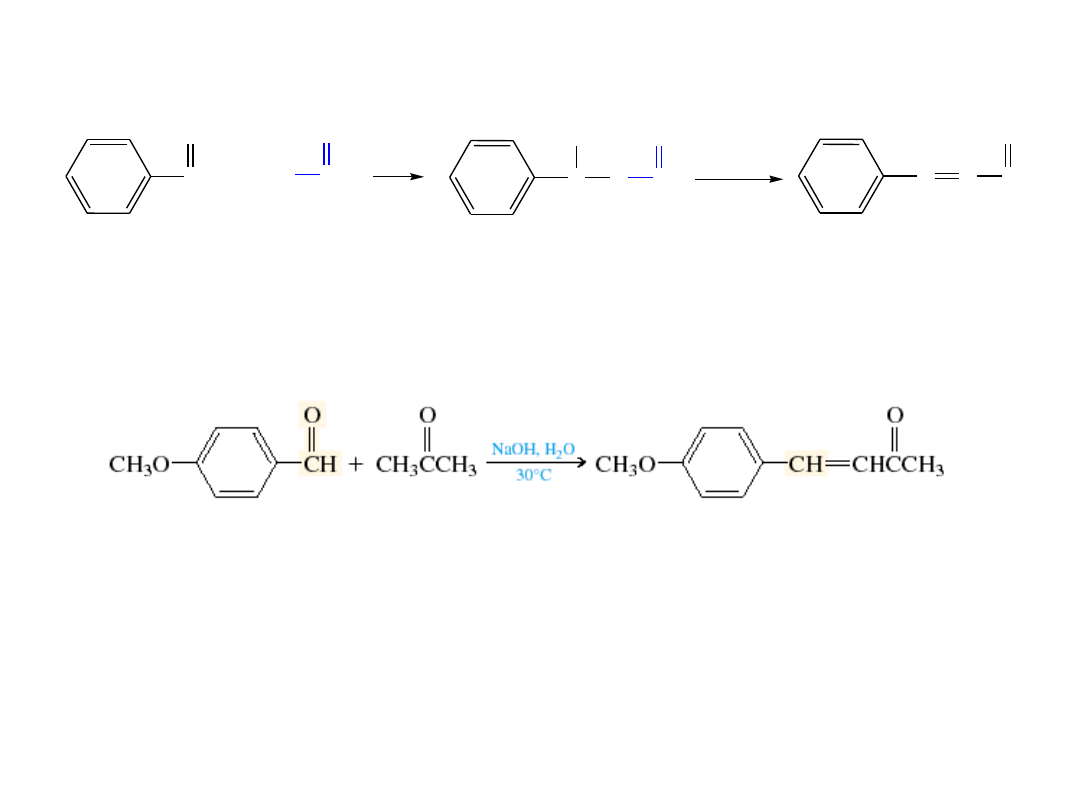
Mieszana kondensacja aldolowa
CH
O
H
3
C
CH
O
OH-
C
H
OH
H
2
C
CH
O
ogrzewanie
C
H
C
H
CH
O
+
-H
2
O
mieszany aldol
aldehyd cynamonowy
p-metoksybenzaldehyd
aceton
benzaldehyd
acetaldehyd
p-metoksyfenylo-3-buten-2-on
Wyszukiwarka
Podobne podstrony:
Aldehydy i ketony 3 id 54914 Nieznany
aldehydy i ketony id 54912 Nieznany (2)
aldehydy ciekawe id 54911 Nieznany (2)
aldehydy i ketony addycja nukleofilowa
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
więcej podobnych podstron