
BIOTRANSFORMACJA
BIOTRANSFORMACJA
LEKÓW: REAKCJE II FAZY
LEKÓW: REAKCJE II FAZY
MECHANIZMY OPORNOŚCI
MECHANIZMY OPORNOŚCI
WIELOLEKOWEJ
WIELOLEKOWEJ
Jarosław Paluszczak

BIOTRANSFORMACJE
BIOTRANSFORMACJE
• I faza metabolizmu – funkcjonalizacja-
wprowadzanie polarnych grup
funkcyjnych; hydroliza, redukcja
• II faza metabolizmu – koniugacja-
sprzęganie z endogennymi substratami
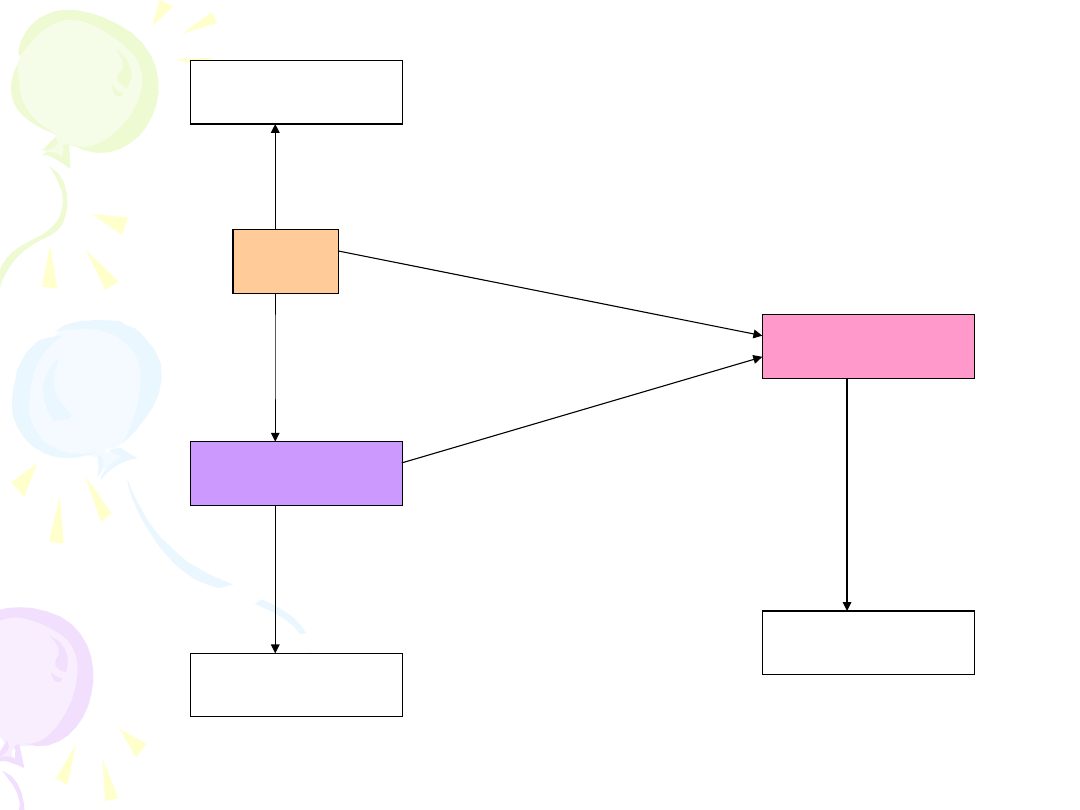
LEK
WYDALANIE
METABOLI
T
WYDALANIE
METABOLI
T
WYDALANIE
CYT
P450
ENZYMY II
FAZY

II faza metabolizmu leków:
II faza metabolizmu leków:
• Glukuronidacja
• Acetylacja
• Sulfatacja
• Metylacja
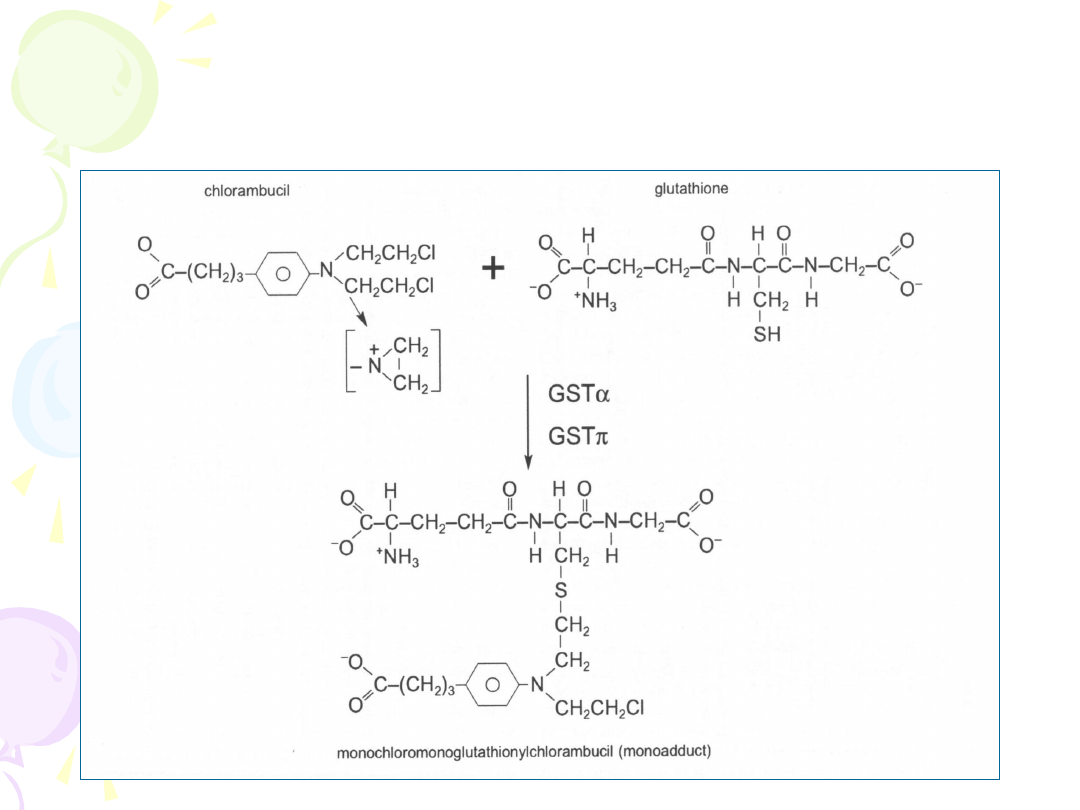
• Sprzęganie z glutationem
• Sprzęganie z aminokwasami

DWUETAPOWOŚĆ REAKCJI II
DWUETAPOWOŚĆ REAKCJI II
FAZY
FAZY
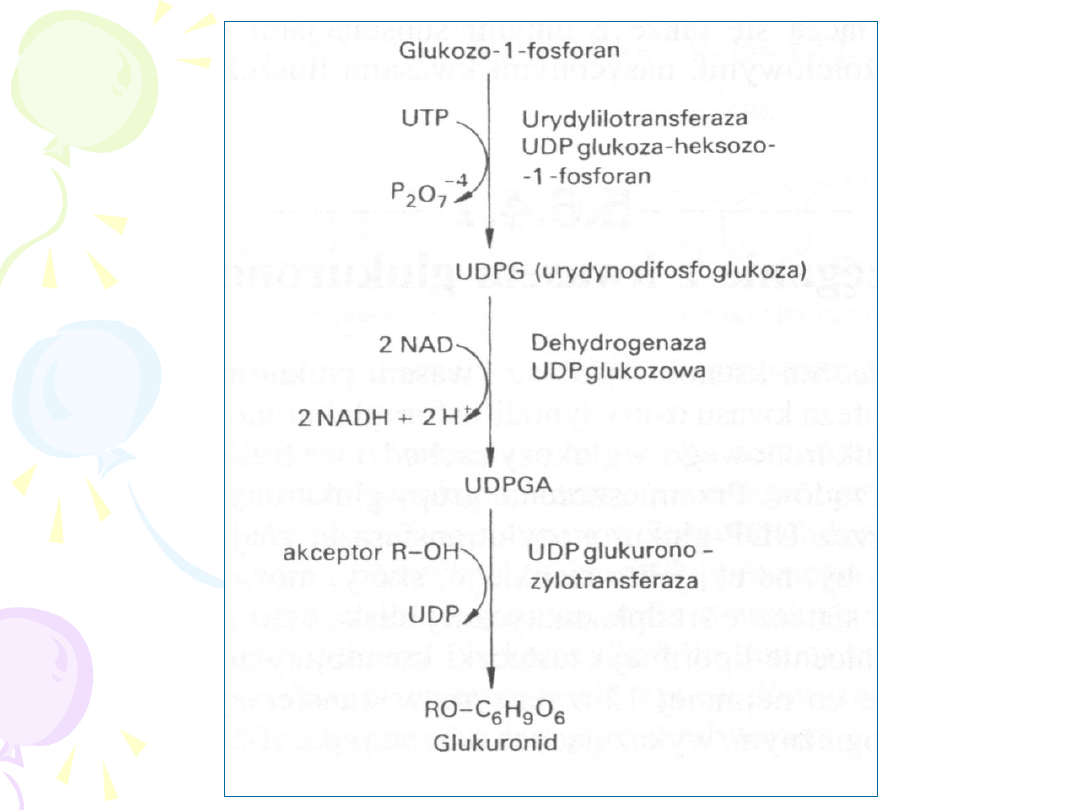
I ETAP
– aktywacja związku endogennego:
glukuronian
UDP-glukuronian
kwas octowy
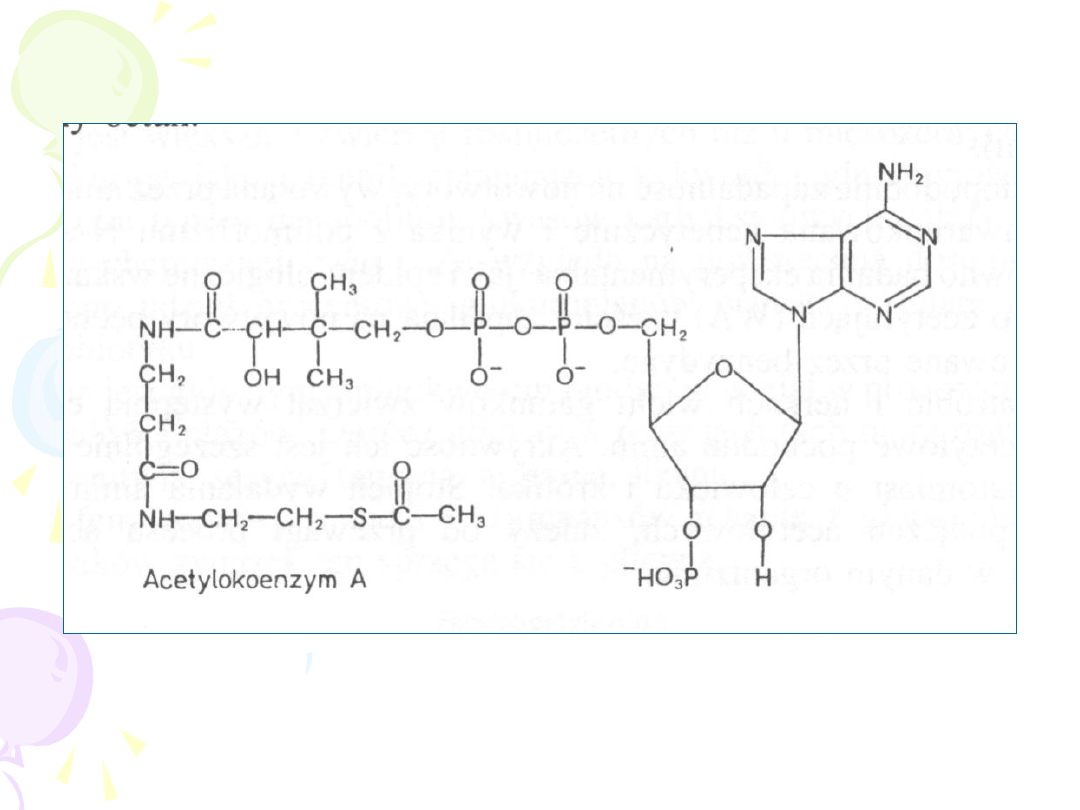
acetylo-CoA
siarczan PAPS
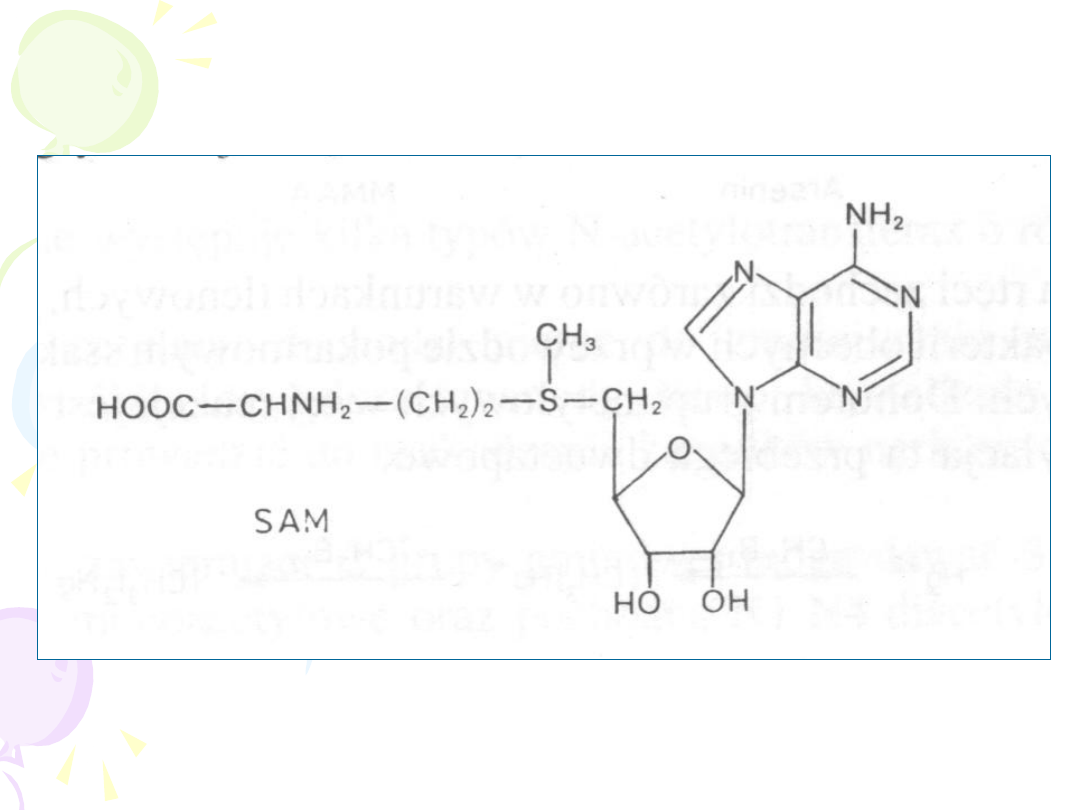
metionina SAM
WYJĄTEK: lek acylo-CoA
II ETAP
– przeniesienie aktywnej grupy na
substrat – lek (wyjątek: sprzeganie z glicyną)

GLUKURONIDACJA
GLUKURONIDACJA
• ZACHODZI W MIKROSOMACH
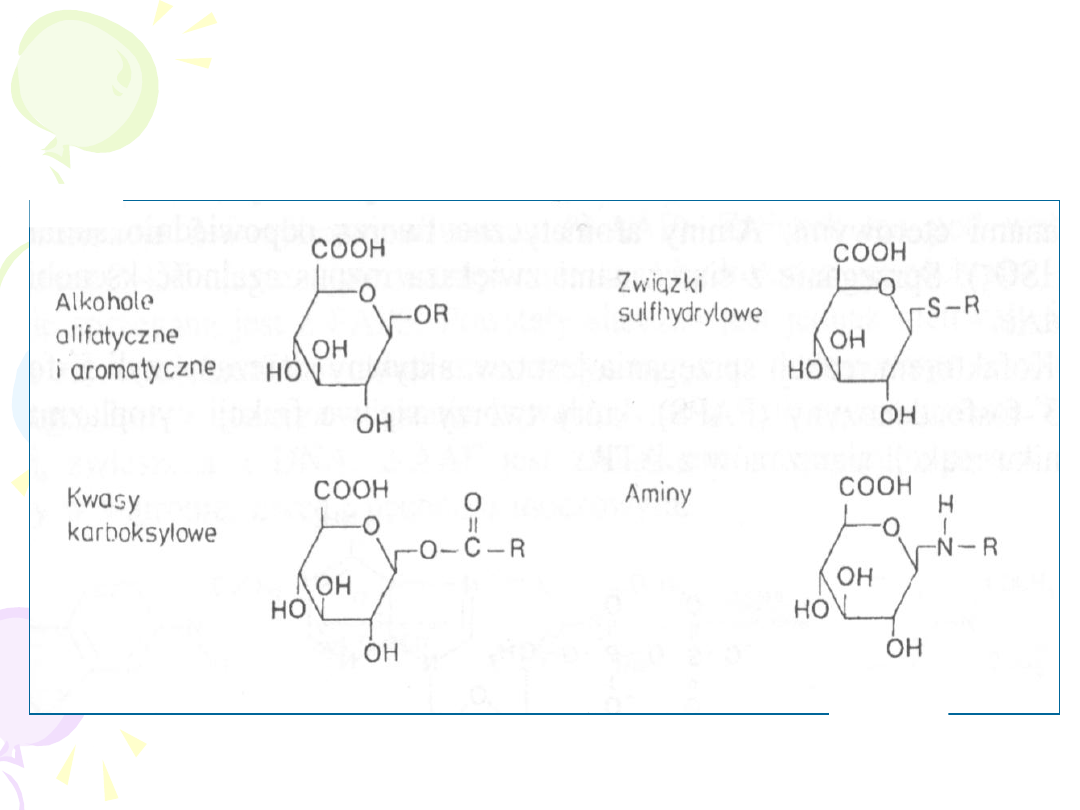
• REAKCJI ULEGAJĄ:
– ALKOHOLE
– FENOLE
– KWASY KARBOKSYLOWE
– AMINY
– AMIDY
– SULFONAMIDY
– TIOLE
O- GLUKURONIDACJA
N- GLUKURONIDACJA
S- GLUKURONIDACJA
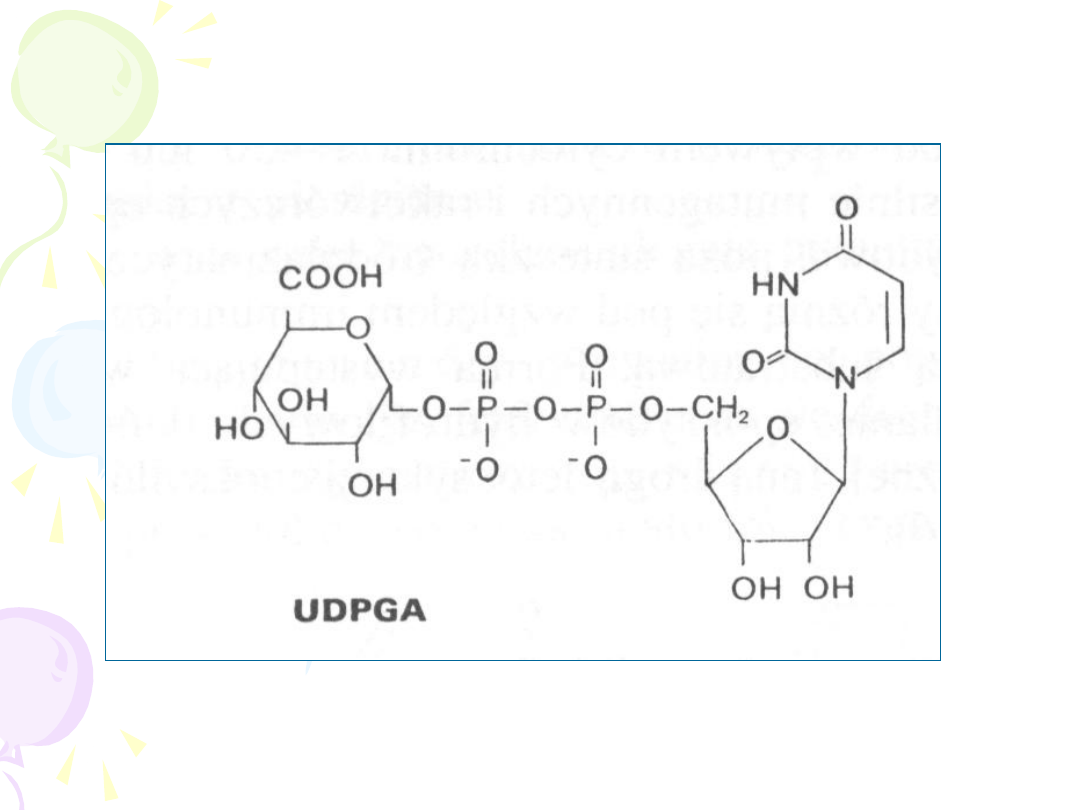
PRODUKTY REAKCJI SPRZĘGANIA Z
GLUKURONIANEM

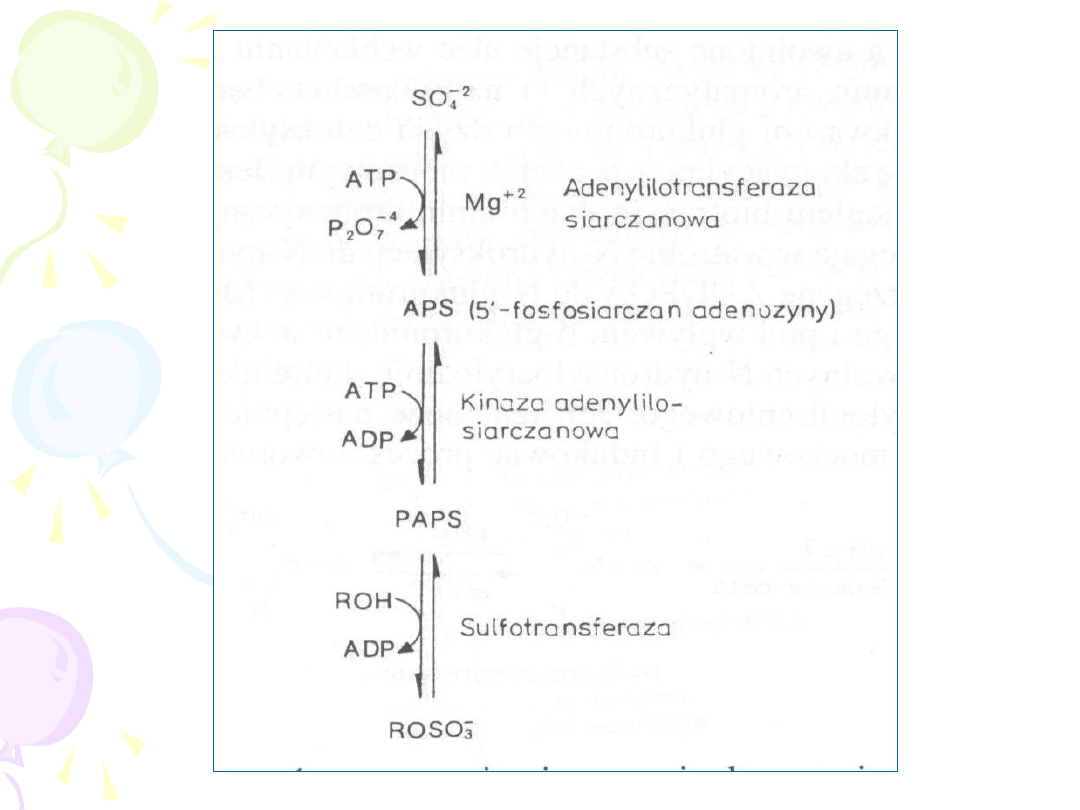
SULFATACJA
SULFATACJA
• ZACHODZI W CYTOPLAZMIE
• REAKCJI ULEGAJĄ:
– FENOLE
– ALKOHOLE
– ARYLOAMINY
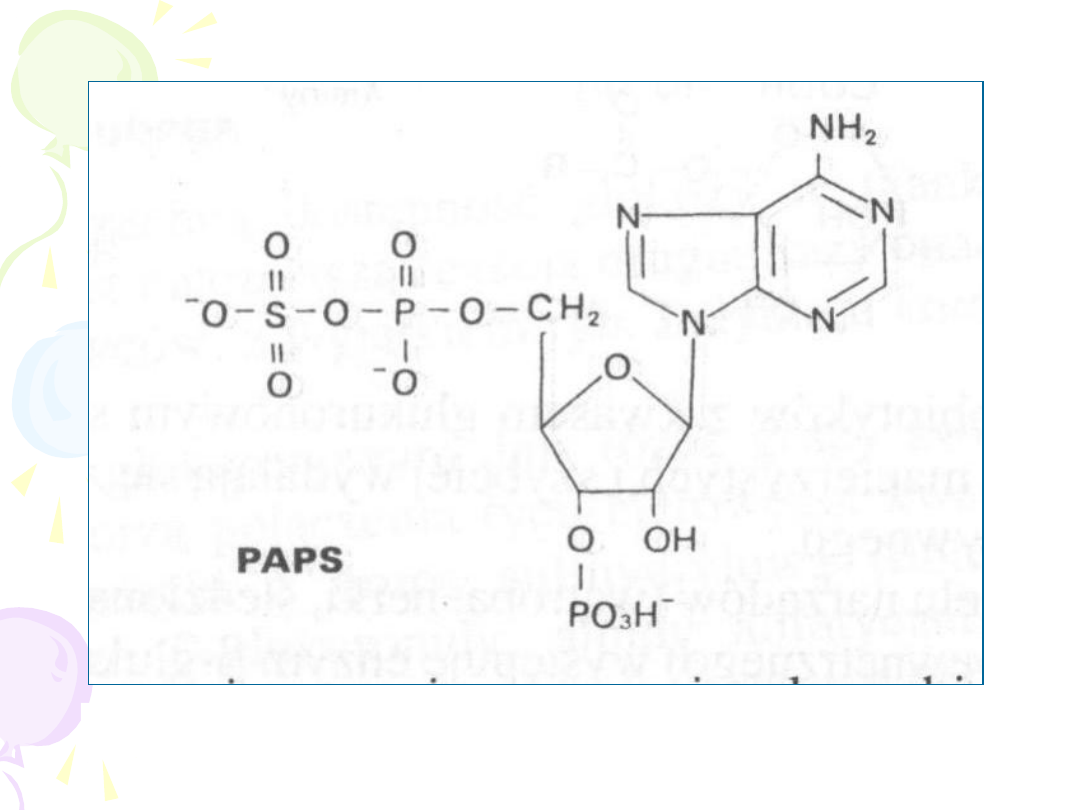
3’-FOSFOADENOZYNO-5’-FOSFOSIARCZAN

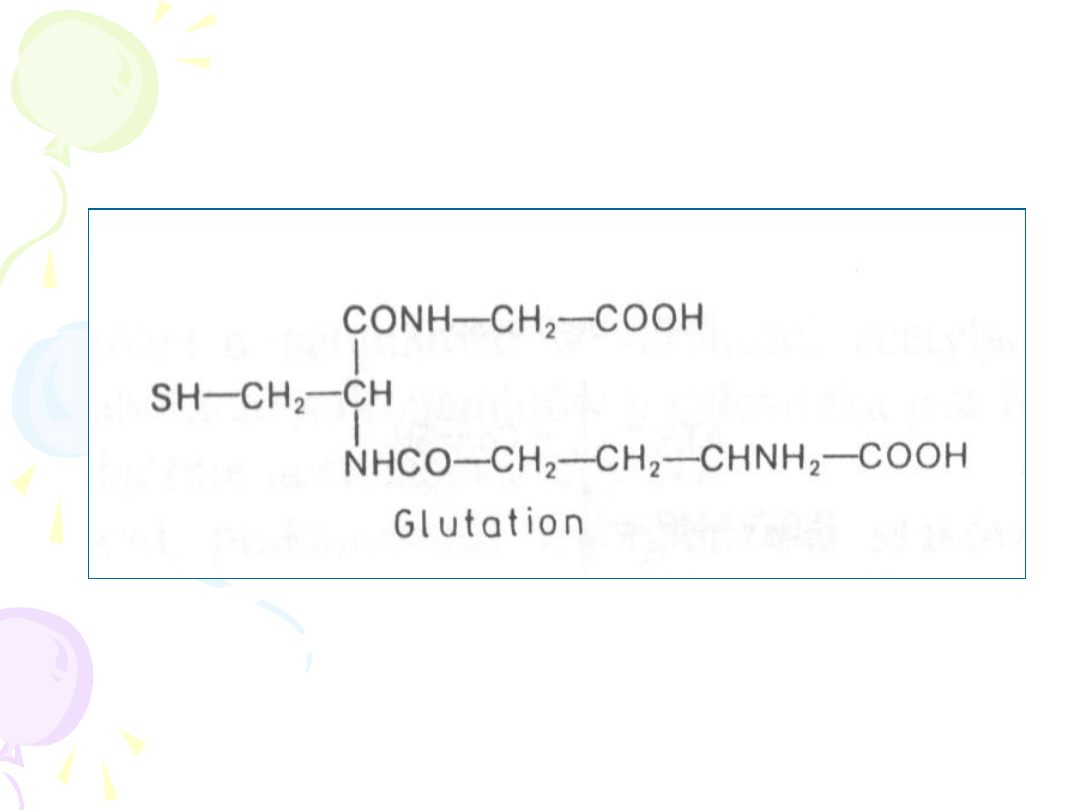
SPRZĘGANIE Z
SPRZĘGANIE Z
GLUTATIONEM
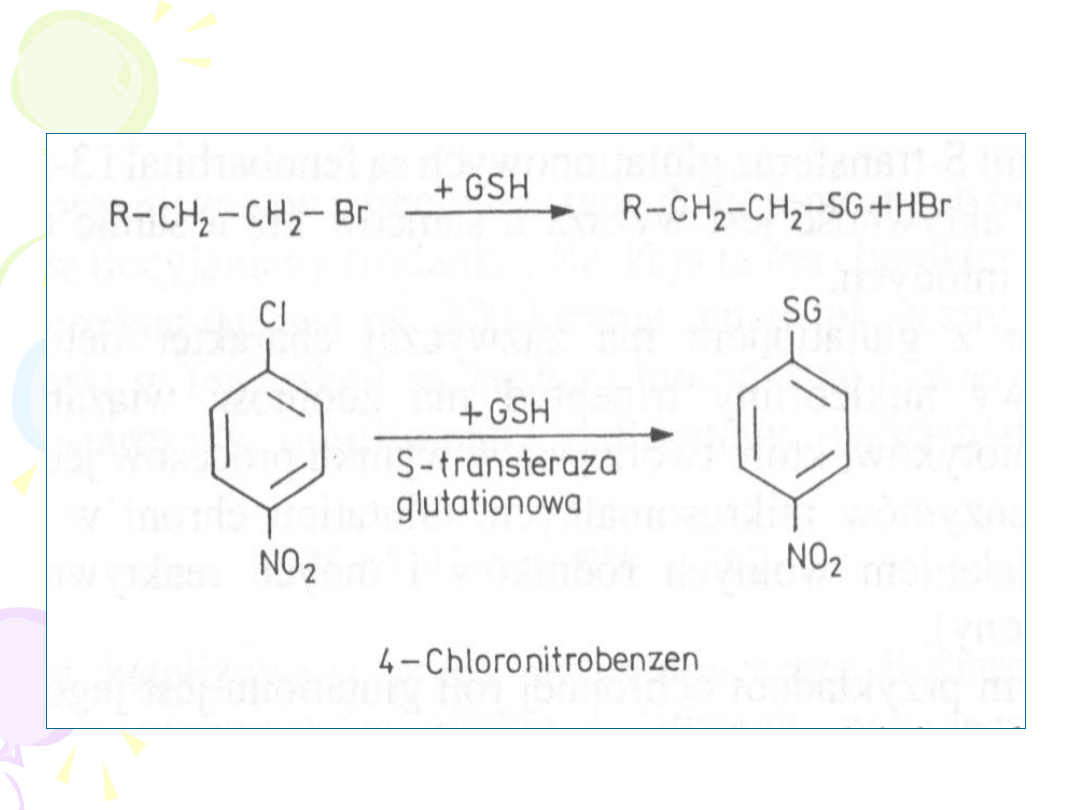
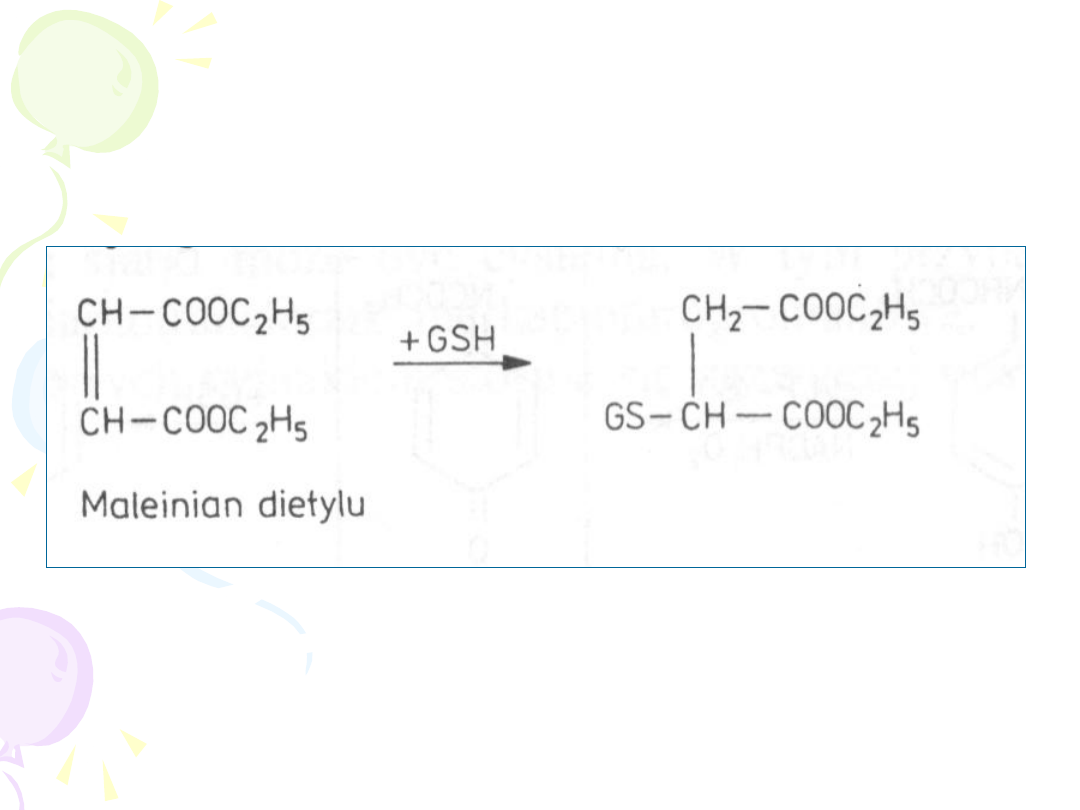
GLUTATIONEM
• Reakcji ulegają związki o charakterze
elektrofilowym
(epoksydy, halogenowe
węglowodory alifatyczne i aromatyczne,
alifatyczne i aromatyczne związki nitrowe,
alkeny)
• Brak etapu aktywacji
• Koniugaty glutationu wskutek odłączenia
reszt kwasu glutaminowego i glicyny oraz
reakcji N-acetylacji cysteiny są
przekształcane do kwasów merkapturowych
wydalanych z żółcią lub moczem
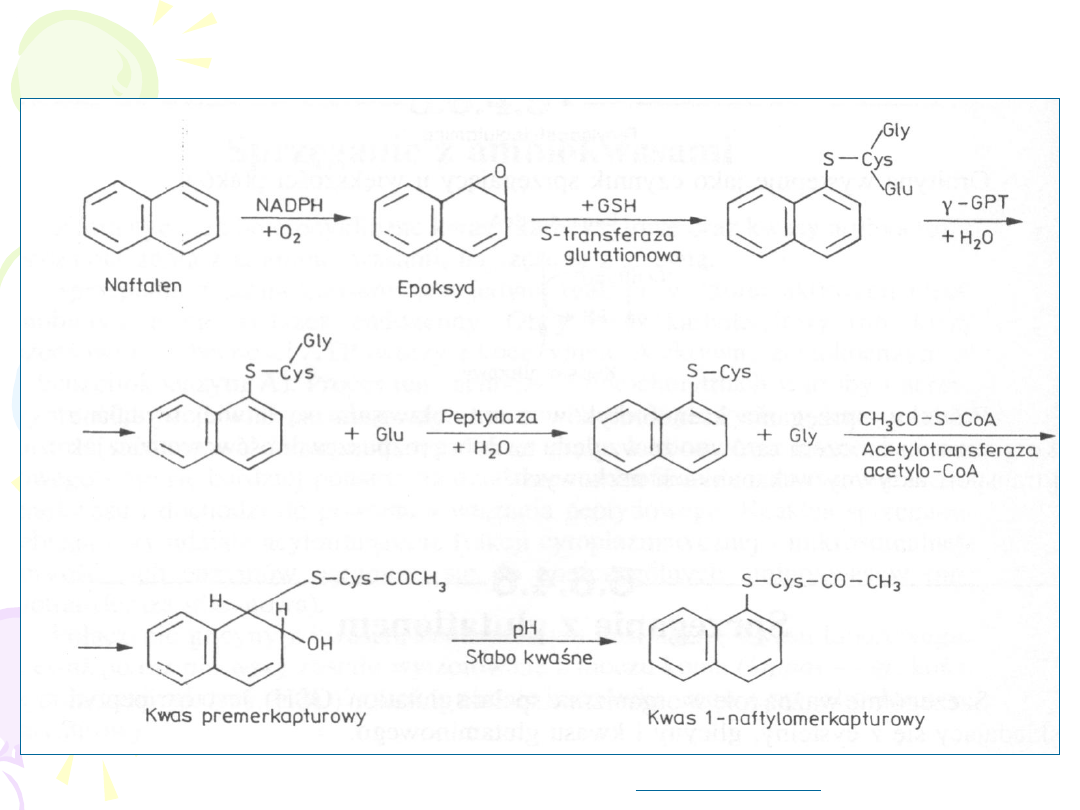
S-podstawiona N-
acetylocysteina
METABOLIZM NAFTALENU

METYLACJA
METYLACJA
• POWSTAJE PRODUKT O
ZMNIEJSZONEJ POLARNOŚCI
• REAKCJI ULEGAJĄ:
– ALKOHOLE i FENOLE
– AMINY ALIFATYCZNE I
AROMATYCZNE
– TIOLE

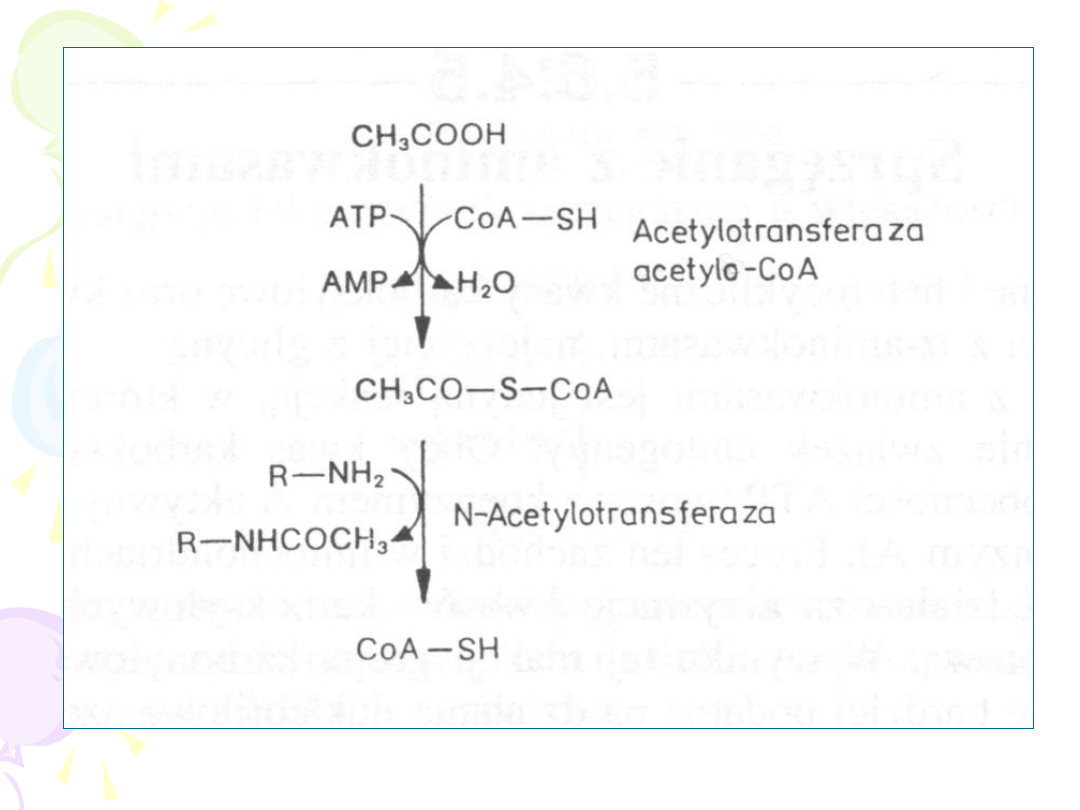
ACETYLACJA
ACETYLACJA
–
–
sprzęganie z „aktywnym
sprzęganie z „aktywnym
octanem”
octanem”
Reakcji ulegają:
• Aminy aromatyczne
• Sulfonamidy
• Aminy alifatyczne

Status acetylatora
Status acetylatora
• Wolni acetylatorzy – osoby o niskiej
aktywności acetylotransferaz,
spowolniony metabolizm niektórych
leków – redukcja dawek
• Szybcy acetylatorzy – ew. wzrost
dawki leku

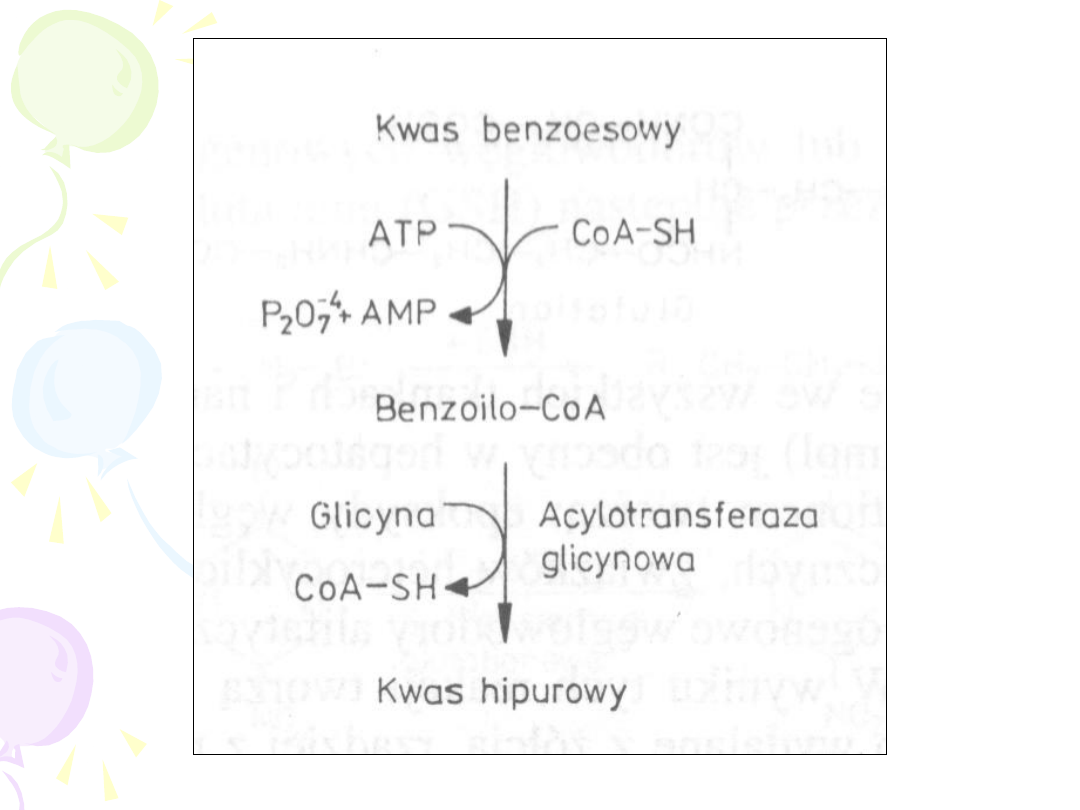
SPRZĘGANIE Z AMINOKWASAMI
SPRZĘGANIE Z AMINOKWASAMI
• U człowieka najczęściej dochodzi do
sprzęgania z glicyną
• Aktywacji ulega lek ! (wyjątek)
• Reakcji ulegają aromatyczne i
heterocykliczne kwasy karboksylowe
oraz kwasy arylooctowe
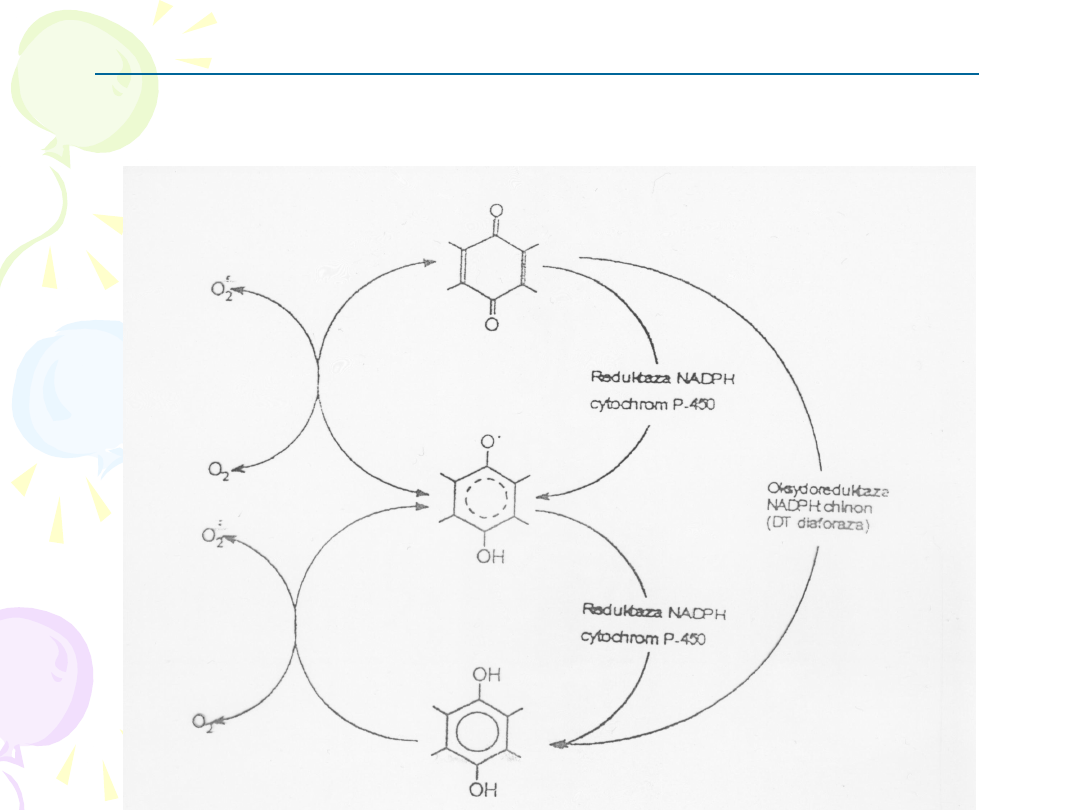
OKSYDOREDUKTAZA NADPH: CHINON
(DT- DIAFORAZA)

Przyczyny indywidualnych różnic w
Przyczyny indywidualnych różnic w
skuteczności farmakoterapii
skuteczności farmakoterapii
• WARIANTY GENETYCZNE
– Miejsca uchwytu leków
– Białka transportujące leki
– Enzymy metabolizujące leki
• CZYNNIKI ŚRODOWISKOWE
– Pobudzenie (indukcja enzymatyczna)
– Zahamowanie (inhibicja enzymatyczna)
– Dieta, używki
• CZYNNIKI FIZJOLOGICZNE
– Wiek
– Płeć
– Funkcja wątroby i nerek
– Choroby

TYPY OPORNOŚCI
TYPY OPORNOŚCI
WIELOLEKOWEJ:
WIELOLEKOWEJ:
• WRODZONA – mechanizm obecny
jeszcze przed zastosowaniem leku
• NABYTA – indukowana pod
wpływem stosowanych leków
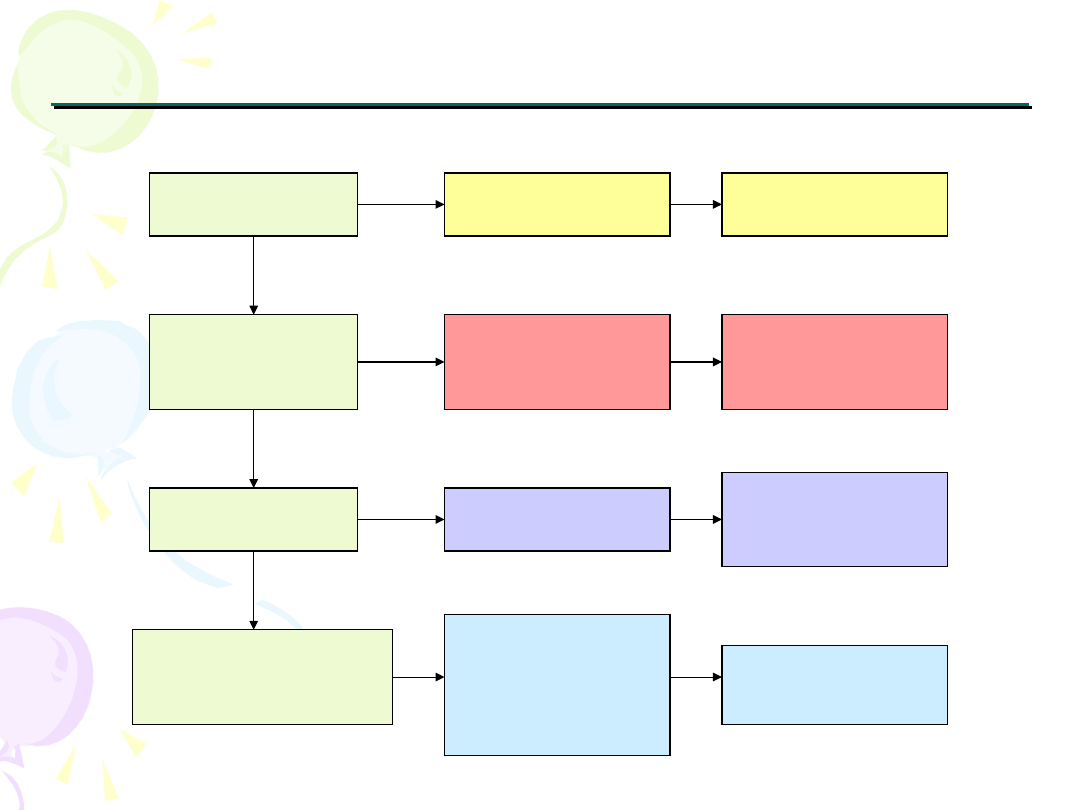
Mechanizmy oporności wielolekowej
Mechanizmy oporności wielolekowej
Wchłanianie leku
przez komórkę
Metabolizm
komórkowy / brak
metabolizmu
Uszkodzenie celu
komórkowego
Zatrzymanie podziałów
komórkowych / śmierć
komórki
Obniżenie
kumulacji leku w
komórce
Aktywacja ekspresji
transporterów ABC
Detoksykacja leku /
Niemożność
aktywacji leku
Aktywacja GST oraz
metalotionein
Zmiany celu
komórkowego
Mutacje i
amplifikacje genów,
wzmożona naprawa
DNA
Wyłączenie szlaków
hamujących
proliferację i
indukujących
apoptozę
Mutacje genu p53,
aktywacja Bcl-2

1. AKTYWNY TRANSPORT
1. AKTYWNY TRANSPORT
LEKU POZA KOMÓRKĘ
LEKU POZA KOMÓRKĘ
• Transportery z rodziny ABC –
integralne błonowe pompy
usuwające leki poza obręb komórki
- glikoproteina P – P-gp
- białka MRP
- MXR

STRUKTURA BIAŁKA P-gp (MDR1)
12 domen transbłonowych, 2 miejsca wiązania ATP
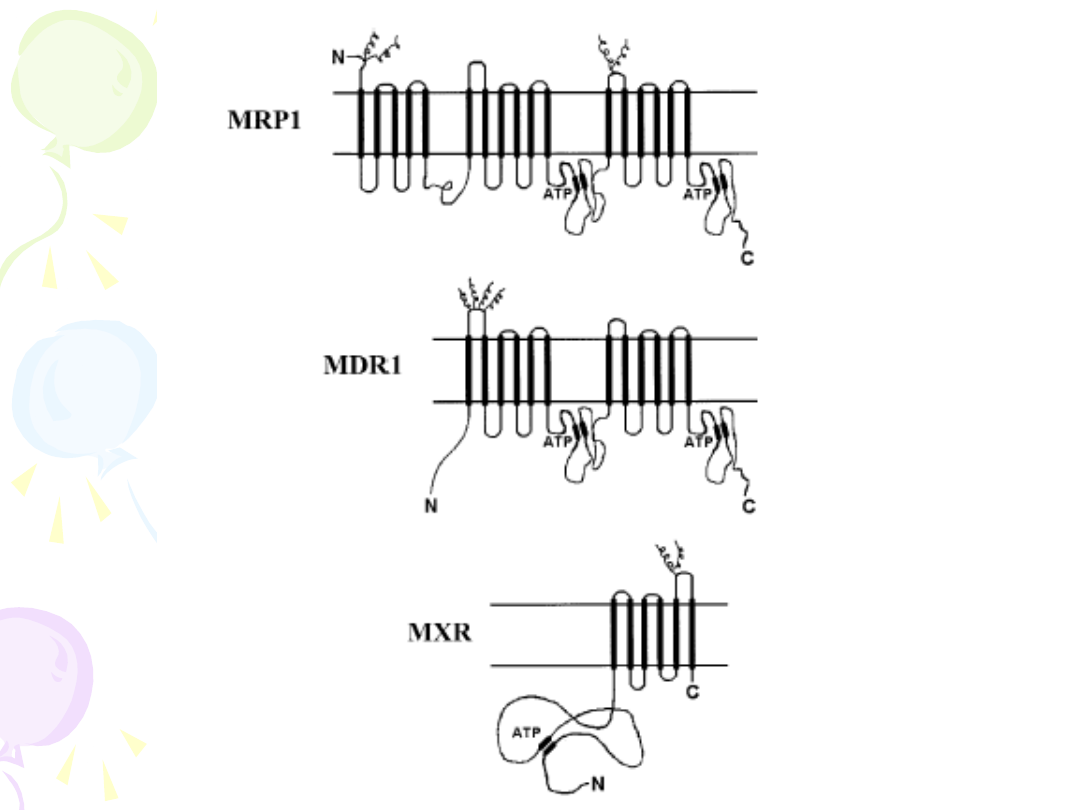
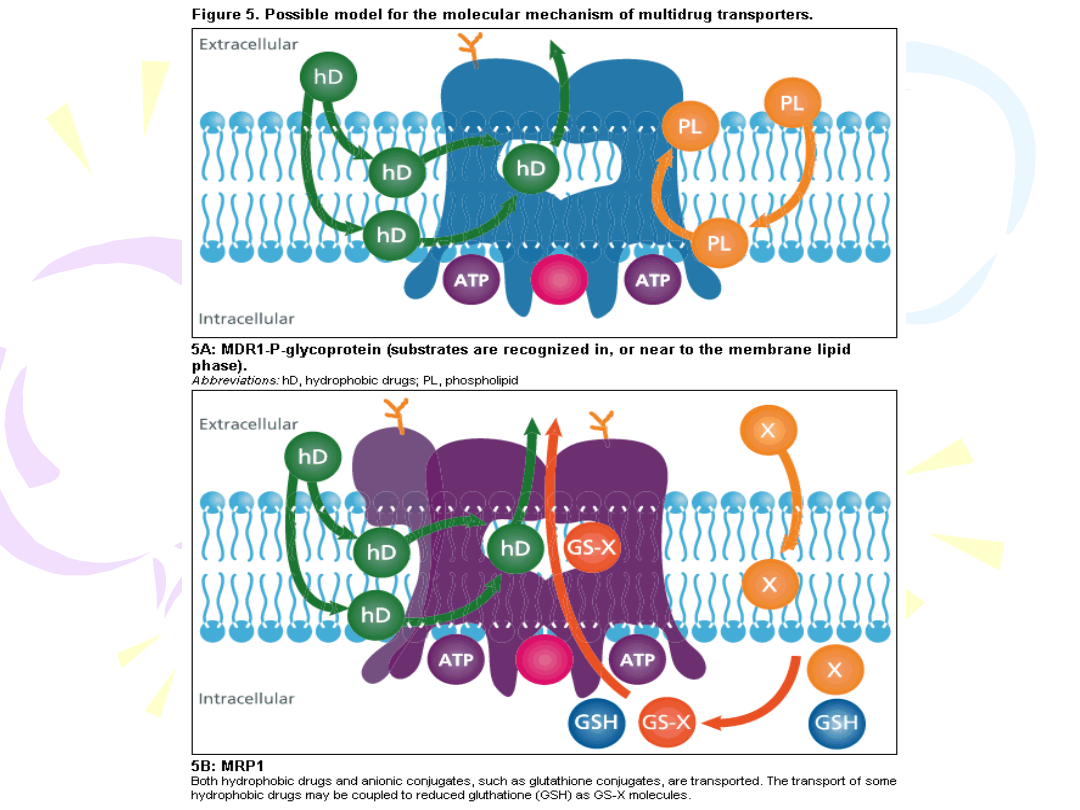
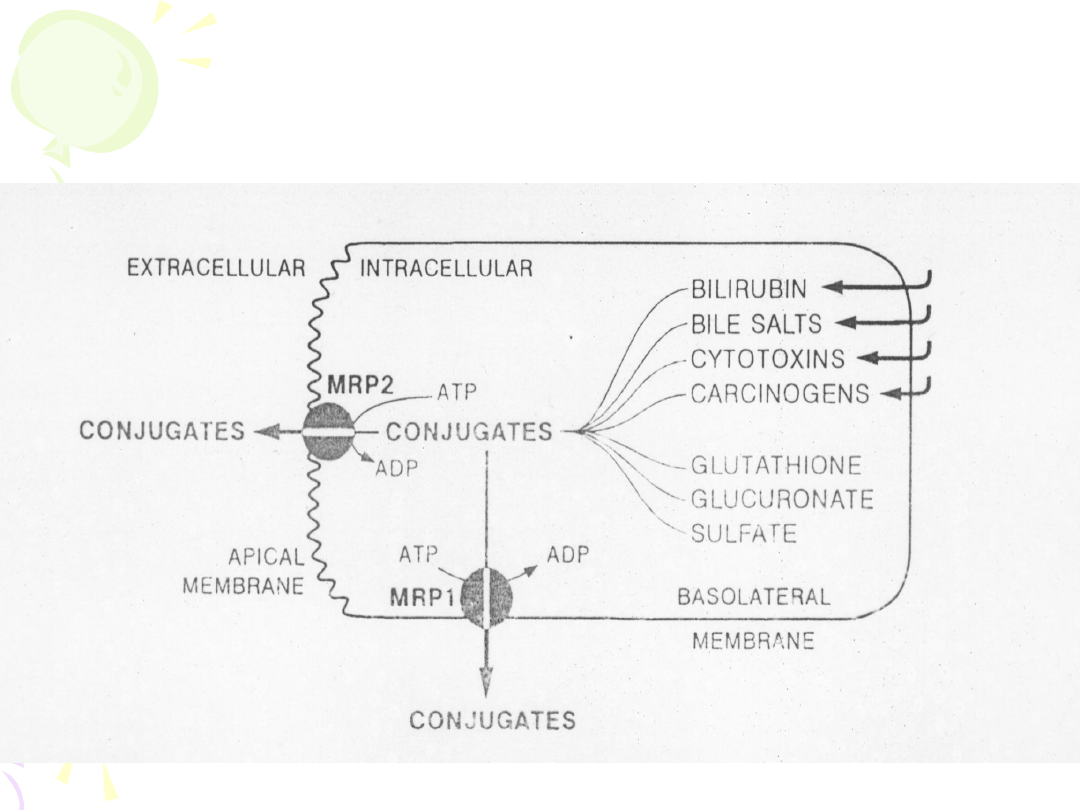
FUNKCJE BIAŁEK MRP
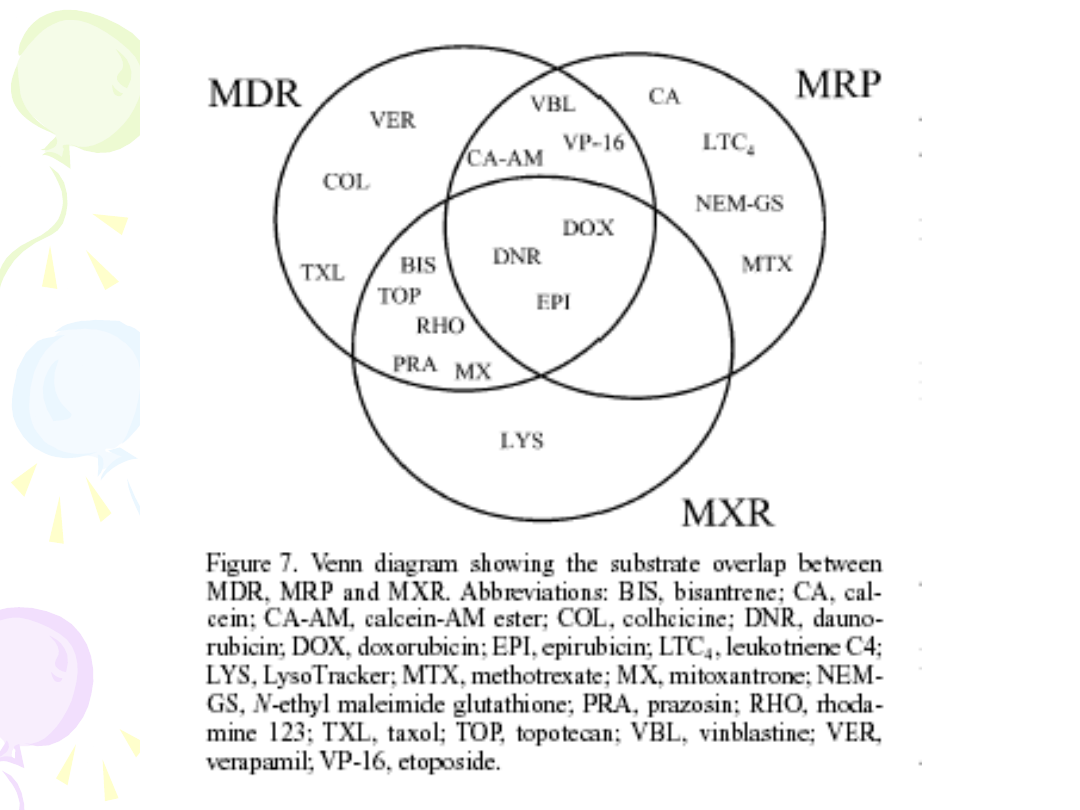

INHIBITORY P-gp
INHIBITORY P-gp
• I generacja -
werapamil
-cyklosporyna A
• II generacja -
valspodar
- biricodar
• III generacja:
zosuquidar
–
inhibitor
niekompetycyjny
inhibitory
kompetycyj
ne
ZOSUQUIDAR

2. ZMIANA KOMÓRKOWEGO
2. ZMIANA KOMÓRKOWEGO
METABOLIZMU LEKU
METABOLIZMU LEKU
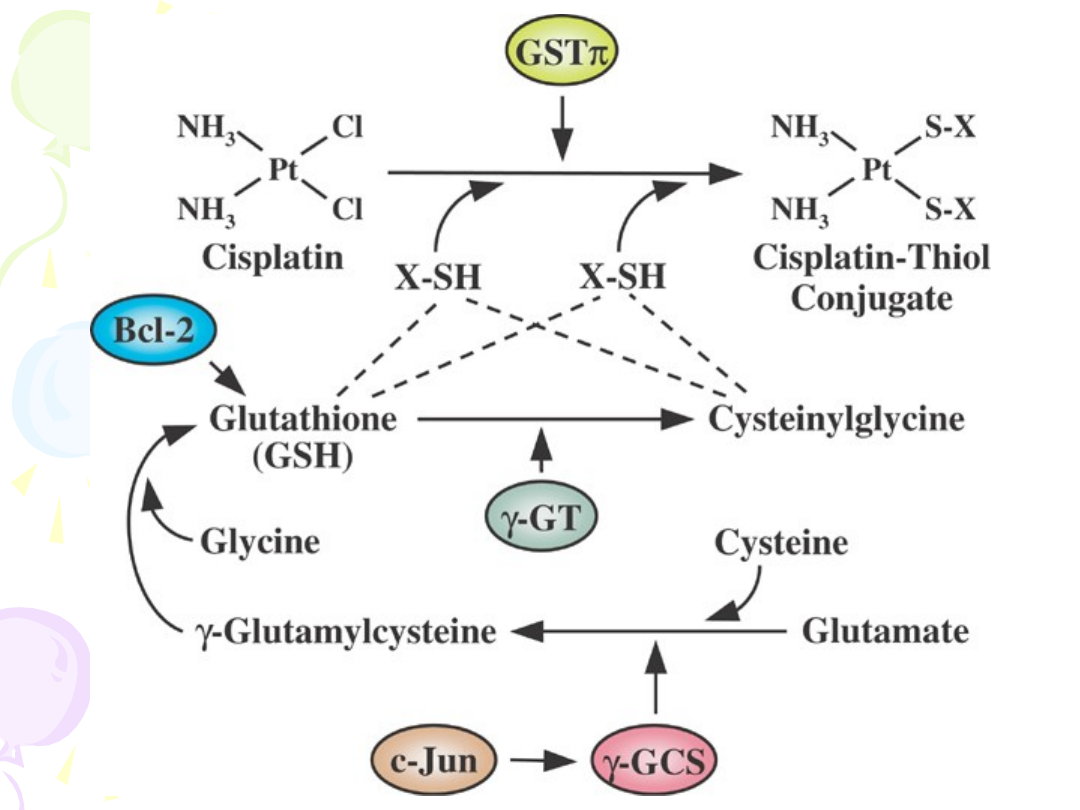
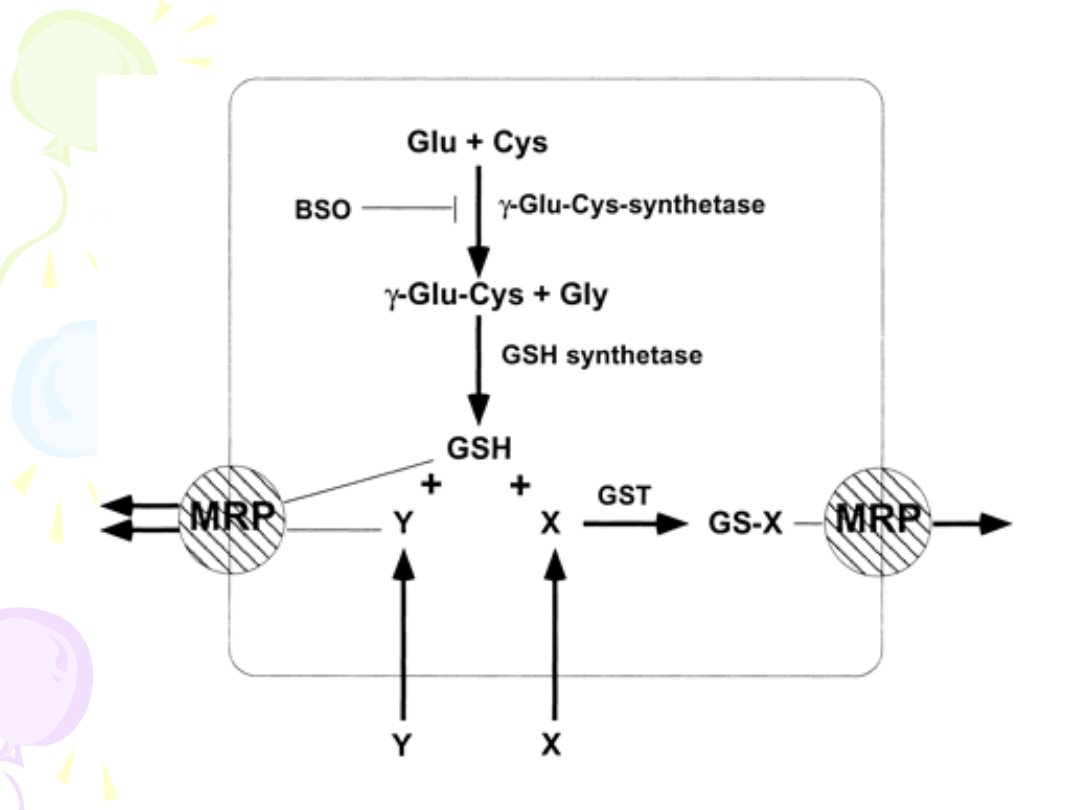
• Nadekspresja GST – wzmożona
dezaktywacja leku
• Wzrost aktywności syntazy
-glutamylocysteiny
• Metalotioneiny – chelatowanie leków
alkilujących (poch. cisplatyny)
S-TRANSFERAZY GLUTATIONOWE
S-TRANSFERAZY GLUTATIONOWE
X
X
GST
GS-X
DNA
naprawa
metalotioneiny
ATP
ADP
MECHANIZMY OPORNOŚCI NA
CISPLATYNĘ

3. MODYFIKACJA
3. MODYFIKACJA
MOLEKULARNEGO CELU
MOLEKULARNEGO CELU
• Amplifikacja genu – efekt
ilościowy,
np. amplifikacja genu reduktazy
dihydrofolianowej – oporność na
metotreksat
• Mutacja genu – efekt jakościowy, lek
nie rozpoznaje zmienionej cząsteczki
– brak reakcji, np. mutacje
topoizomeraz – oporność na
irinotekan

4. ZMIANA ZDOLNOŚCI
4. ZMIANA ZDOLNOŚCI
NAPRAWY USZKODZEŃ
NAPRAWY USZKODZEŃ
• Wzmożona naprawa DNA przez
0-6-alkilotransferazę – brak
efektu cytotoksycznego – oporność na
leki
alkilujące DNA: karmustynę,
dakarbazynę

5. DYSFUNKCJA PROCESU
5. DYSFUNKCJA PROCESU
APOPTOZY
APOPTOZY
• Inaktywujące mutacje czynników
indukujących apoptozę, np. p53
• Aktywujące mutacje czynników
hamujących apoptozę, np. Bcl-2
SKUTEK: brak efektu
cytotoksycznego, niemożność
wywołania śmierci komórki
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
Wyszukiwarka
Podobne podstrony:
(3) Zaburzenia biotransformacji leków w organizmie
Metabolizm i biotransformacja leków, Kosmetologia, Notatki i wyłady, Farmakologia
Podawanie lekow dotkankowo
Losy leków w organizmie
stosowanie lekow droga wziewna
Szkol Sposoby podawania leków w stanach nagłych
(2,3) Działania nieporządane, toksytczne leków Metabolizm, czynniki wpływające na działanie substanc
Wziewne stosowanie leków
4 Podstawowe pojęcia i zagadnienia związane z działaniem leków
więcej podobnych podstron