S SO
4
2-
S
2-
Fe Fe
2+
Fe
3+
Mn Mn
2+
Mn
4+
Mn
7+
N N
3+
FeS
2
SO
4
2-
(utlenianie)
SO
4
2-
S
2-
(redukcja)
utlenianie redukcja
przyłączanie tlenu
oddanie tlenu
oddanie wodoru przyłączanie wodoru
oddanie elektronów przyłączanie elektronów
REDUKCJA
UTLENIANIE
-e
Fe
2+
Fe
3+
+e
-1 0 1
Wstęp do elektrochemii

Utlenianie (dezelektronacja)
proces polegający na utracie elektronów przez obojętne
atomy, cząsteczki lub jony, w którym następuje podwyższenie
stopnia utlenienia reduktora
Redukcja (elektronacja)
proces polegający na pobieraniu elektronów przez atomy lub
jony, w którym następuje obniżenie stopnia utlenienia
utleniacza
Utleniacz (dezelektronator)
substancja ulegająca redukcji, pobierającą elektrony od
substancji utlenionej i obniżającą swój stopień utlenienia
Reduktor (elektronator
)
substancja ulegającą utlenieniu, oddającą elektrony
substancji redukowanej i podwyższającą swój stopień
utlenienia
stopnie utlenienia
pierwiastka wchodzącego w skład określonego
związku
liczba dodatnich lub ujemnych ładunków
elementarnych, jakie zyskałby atom, gdyby wszystkie
wiązania w cząsteczce były jonowe
FeS, H
2
CO
3
, H
2
O

4. suma stopnia utleniania wszystkich atomów
wchodzących w skład cząsteczki obojętnej =
0
5. fluor we wszystkich swych połączeniach występuje
na
-1
stopniu utlenienia
6. wodór przyjmuje w swych związkach stopień utlenianie
równy
+1
, z wyjątkiem wodorków litowców i berylowców, gdzie
stopień utlenienia wynosi
–1
7. stopień utlenienia
litowców =
+1,
berylowców =
+2,
(metale przyjmują dodatnie stopnie
utlenienia)
1. stopień utlenienia pierwiastka w stanie wolnym =
0
2. stopień utlenienia pierwiastka w postaci jonu
prostego równa się jego elektrowartościowości
(wartościowości jonu)
3. suma stopnia utlenienia wszystkich atomów
wchodzących w skład jonu złożonego równa jest
ładunkowi jonu
8. tlen w połączeniach ma stopień utlenienia
–2
wyjątki: luorek tlenu OF
2
-
O
2+,
ponadtlenki np.
KO
2
–
O
-1/2
nadtlenki np. H
2
O
2
, Na
2
O
2
, BaO
2
-
O
-1
9. H
2
O
2
w reakcjach chemicznych:
utleniacz lub reduktor
do substancji ulegających
redukcji
czyli
utleniaczy
należą
1. pierwiastki najbardziej elektroujemne
(np. F
2
, Cl
2
, Br
2
, J
2
, O
2
)
2. jony metali na wyższym stopniu utlenienia, jony
metali szlachetnych i jon wodorowy
(np. Fe
3+
, Cu
2+
, Ag
+
, H
+
)
3. związki chemiczne, w których pewne pierwiastki
występują na najwyższych stopniach utlenienia
(np. KClO
4
)
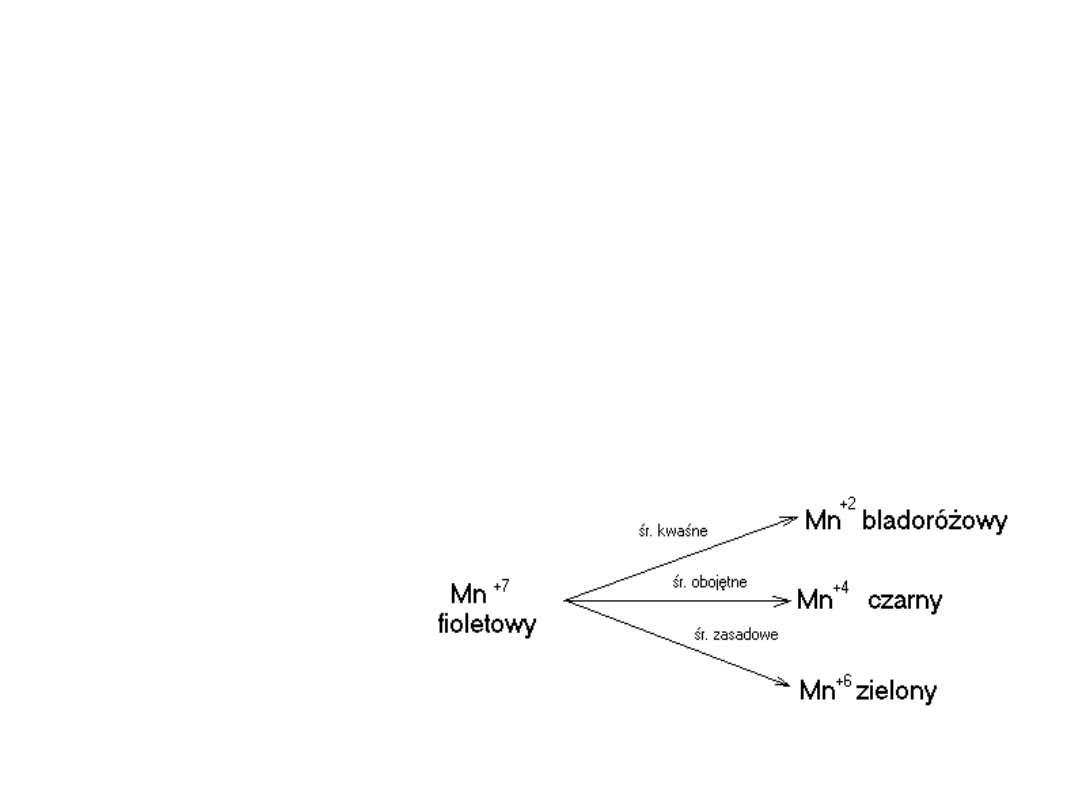
KMnO
4
w zależności
od środowiska może
ulegać redukcji do
różnych stopni
utlenienia
zmiana zabarwienia
roztworu

do substancji ulegających
utlenieniu
, czyli
reduktorów
należą
1. pierwiastki najbardziej elektrododatnie
(np. Na, K, Mg, Ca, Al)
2. niemetale
(np. C, N, S, H)
3. jony metali i niemetali na niższym stopniu
utlenienia
(np. Fe
2+
, Sn
2+
, S
2-
)
4. związki chemiczne, które posiadają atomy
metali i niemetali na niższym stopniu
utlenienia
(np. SbCl
2
, FeCl
2
, CO, NaNO
2
, aldehydy)
5. jony ujemne fluorowców, dla których rosną
zdolności redukcyjne wraz ze wzrostem mas
atomowych
(np. Cl
-
, Br
-
, J
-
)

Fe + S = FeS
Fe
0
– 2e
Fe
+2
1
S
0
+ 2e
S
-2
1
2
10FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
=
= 5Fe
2
(SO
4
)
3
+ K
2
SO
4
+ 2MnSO
4
+8H
2
O
Fe
+2
– 1e
Fe
+3
5 10
Mn
+7
+ 5e
Mn
+2
1 2
5
reakcje utleniania i redukcji
(redox)
przemiana, w czasie której jedna substancja
ulega redukcji, a druga utlenianiu
CuO + H
2
Cu + H
2
O
reakcje dysproporcjonowania
ten sam atom
w jednej cząsteczce (jonie)
ulega
utlenieniu
, a w drugiej cząsteczce
(jonie) ulega
redukcji
Hg
2
Cl
2
HgCl
2
+ Hg
KClO
3
KClO
4
+ KCl
Cl
+5
– 2e
Cl
+7
3
Cl
+5
+6e
Cl
-1
1
6
4KClO
3
3KClO
4
+ KCl
Hg
+1
– 1e
Hg
+2
1
Hg
+1
+ 1e
Hg
0
1
1

ogniwo galwaniczne (elektryczne)
układ elektrod, z których każda
zanurzona jest w roztworze elektrolitu
i stanowi półogniwo
(-)ELEKTRODA 1 ELEKTROLIT 1ELEKTROLIT 2
ELEKTRODA 2(+)
(-) ZnZnSO
4 aq
CuSO
4 aq
Cu
(+)
ogniwo galwaniczne
M M
+n
+ ne
Zn – 2e = Zn
2+
Cu
2+
+ 2e = Cu
ogniwo Daniela
ogniwo Volty
(-) ZnH
2
SO
4 aq
Cu (+)
Alessandro Giuseppe
Antonio Anastasio
Volta (1745-1827)

siła elektromotoryczna ogniwa
SEM lub E
SEM
różnica potencjałów elektrody dodatniej (o
wyższej wartości potencjału E
MeI
) i ujemnej
(E
MeII
) dla ogniwa otwartego, czyli takiego, w
którym obwód elektryczny nie jest zamknięty, a
opór miedzy biegunami ogniwa jest
nieskończenie wielki
SEM = E
Me(I)
- E
Me(II)
= E
równania Nernsta
z
Me
Me
Me
a
nF
RT
E
E
ln
0
roztworów rozcieńczonych aktywność jest równa
stężeniu
a
Me
z
+
= C
Me
z+

Jaką wartość ma siła elektromotoryczna ogniwa Daniela
w przypadku gdy roztwory soli mają stężenie
c
Cu2+
= c
Zn2+
= 1mol/dm
3
E
ogn.
= E
Cu
- E
Zn
= E
o
Cu
+ 0,059/2lgc
Cu2+
- E
o
Zn
- 0,059/2lgc
Zn2+
E
ogn.
=
E
o
ogn.
= E
o
Cu
- E
o
Zn
= +0,34V - (-0,76V) = 1,10 V
E
o
Cu
= +0,34V
E
o
Zn
= -0,76V
elektroda wodorowa - elektroda
standardowa
z
Me
Me
Me
c
nF
RT
E
E
ln
0
E = E
Me(1)
- E
Me(2)

standardowa elektroda wodorowa
standardowa elektroda wodorowa składa się z
płytki platynowej pokrytej warstewką czerni
platynowej (absorbuje ona gazowy wodór)
opłukiwanej wodorem gazowym pod
ciśnieniem 1013 hPa
potencjał elektrody wodorowej przyjęto
umownie jako równy
zero
, w każdej
temperaturze
ponieważ potencjał
normalnej elektrody
wodorowej
równa się
0
to zmierzona wartość
SEM jest normalnym względnym
potencjałem
danej elektrody
Warunki standardowe
25
o
C 298K
1013hPa
1mol/dm
3
szereg napięciowy
metali
K Na Mg Al Zn Cr Cd Ni Fe H Bi As Cu
Hg Ag Pt Au
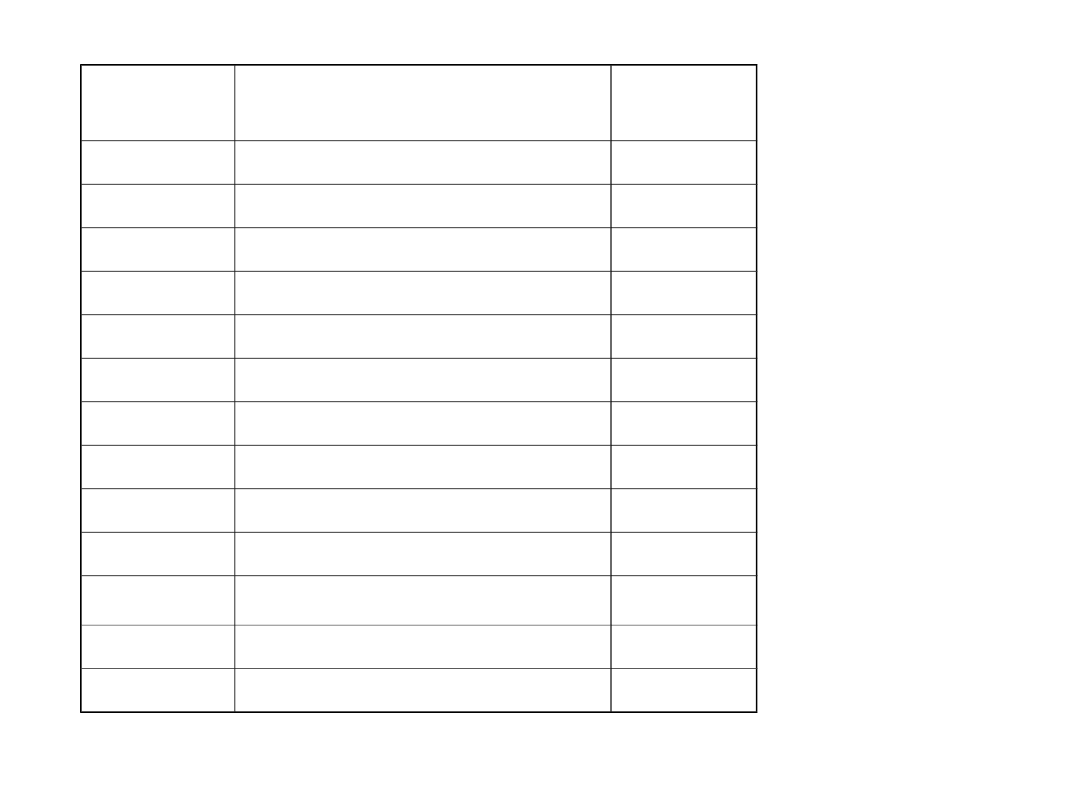
Półogni
wo
Reakcja elektrodowa
E
0
[V]
Li I Li
+
Li
+
+ e
-
=Li
-3,01
K I K
+
K
+
+ e
-
= K
-2,93
Ba l Ba
2+
Ba
2+
+ 2e
-
= Ba
-2,92
Ca l Ca
2+
Ca
2+
+ 2e
-
= Ca
-2,84
Na l Na
+
Na
+
+ e
-
= Na
-2,71
Al l Al
3+
Al
3+
+ 3e
-
= Al
-1,66
Mg l Mg
2+
Mg
2+
+ 2e
-
= Mg
-2,38
Zn l Zn
2+
Zn
2+
+ 2e
-
= Zn
-0,76
Sn l Sn
2+
Sn
2+
+ 2e
-
= Sn
-0,14
Fe l Fe
3+
Fe
3+
+ 3e
-
= Fe
-0,04
H
2
l H
+
2H
+
+ 2e
-
= H
2
0,00
Cu l Cu
2+
Cu
2+
+ 2e
-
= Cu
+0,34
Ag l Ag
+
Ag
+
+ e
-
= Ag
+0,80
wartości standardowych potencjałów metali
Document Outline
Wyszukiwarka
Podobne podstrony:
wnioski[1], UTP, Semestr I, Labolatorium wstęp do elektrotechniki
wde - pytania wykład, wstęp do elektroniki - wykład zaliczenie
Strona tytułowa sprawozdanie, UTP Elektrotechnika, 1 sesmetr, Wstęp do elektrotechniki, Laborki
oscyloskopy-dane technicze[1], UTP, Semestr I, Labolatorium wstęp do elektrotechniki
Kolokwium nr 1C2 cwiczenia, Wstęp do elektrotechniki
(6) WYTWARZ ROZDZ PRZES EN EL, UTP, Semestr I, Wstęp do elektrotechniki
Wyklad WdE3, Wstęp do elektrotechniki
Protokol Cwiczenie 4, UTP Elektrotechnika, 1 sesmetr, Wstęp do elektrotechniki, Laborki
Protokol Cwiczenie 2, UTP Elektrotechnika, 1 sesmetr, Wstęp do elektrotechniki, Laborki
Sprawozdanie 1b, UTP, Semestr I, Labolatorium wstęp do elektrotechniki
(7) ZASADY BEZPIECZNEJ OBSĹUGI, UTP, Semestr I, Wstęp do elektrotechniki
POLE ELEKTRYCZNE, edu, Wstęp do Elektrotechniki
Oscyloskop-pomiary, UTP, Semestr I, Labolatorium wstęp do elektrotechniki
wstep do elektroniki 4 poprawione wykresy (1) (1)
dziad I rzad, UTP, Semestr I, Wstęp do elektrotechniki
podstpom, UTP, Semestr I, Labolatorium wstęp do elektrotechniki
rozdzia 16, UTP, Semestr I, Labolatorium wstęp do elektrotechniki
Protokol Cwiczenie 5, UTP Elektrotechnika, 1 sesmetr, Wstęp do elektrotechniki, Laborki
więcej podobnych podstron