
ELEKTROCHEMIA
Półogniwa
-
Potencjały
elektrodowe metali.
Szereg napięciowy metali.
Ogniwa galwaniczne.
Elektroliza
Akumulatory
Korozja
1

Utlenianie i redukcja
Utlenianie
(dezelektronacja) – proces, w którym
cząsteczki, jony lub atomy tracą elektrony.
Redukcja
(elektronacja) – proces odwrotny, czyli
przyłączanie
elektronów.
Zawsze
procesy
te
przebiegają równolegle:
utl
1
+ ne red
1
redukcja
red
2
utl
2
+ ne
utlenienie
Utl
1
+ red
2
red
1
+ utl
2
Na przykład: reakcja 2Na + Cl
2
2NaCl
połówkowa reakcja utleniania
połówkowa reakcja redukcji
2Na
– 2e 2Na
+
Cl
2
+ 2e 2Cl
-
utlenia
cz
redukt
or
Bilansowanie reakcji redoks – dobór
współczynników reakcji
utl – utleniacz
red
- reduktor
2
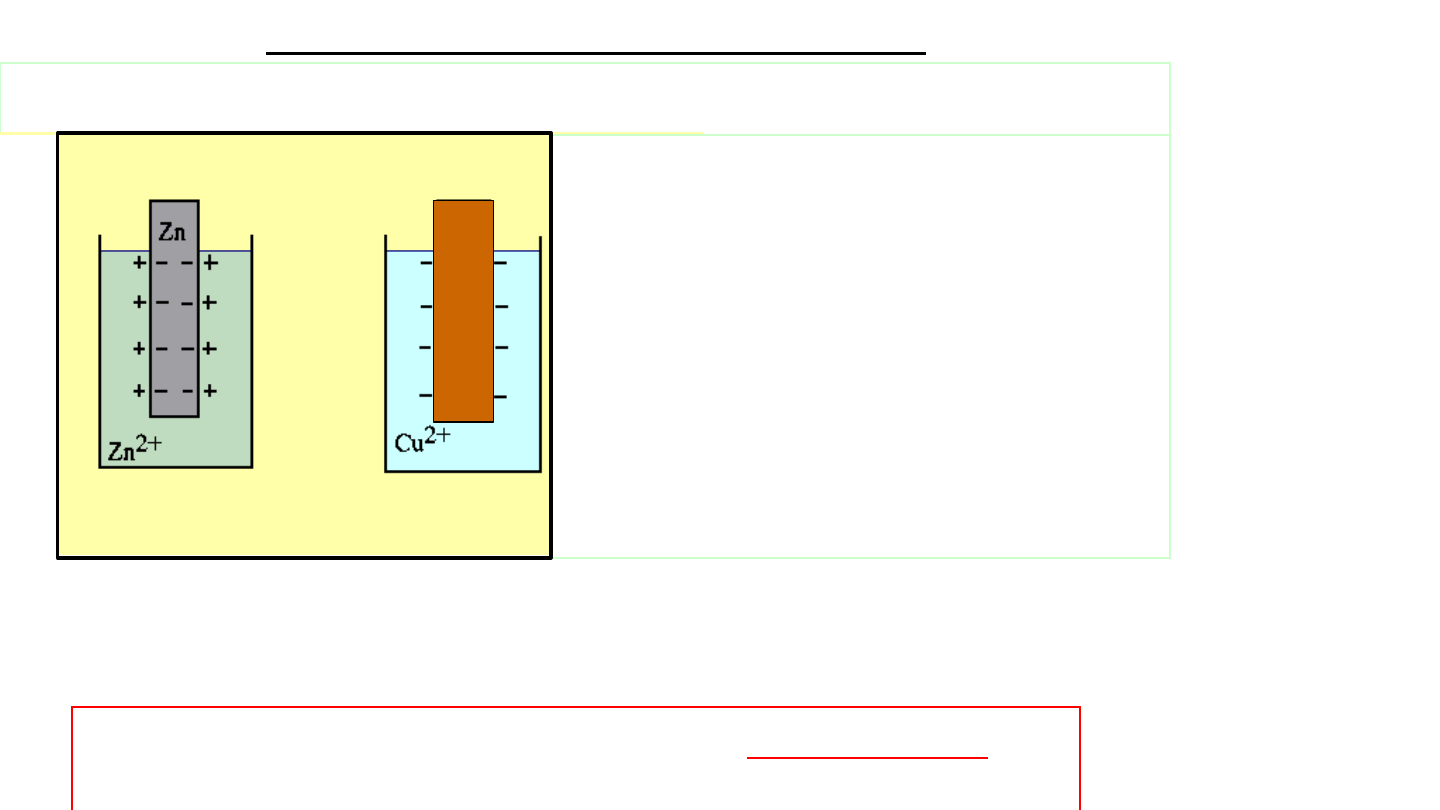
Półogniwo metaliczne
Metale zanurzone do roztworów ich jonów wykazują tendencję do
przechodzenia do roztworu (do rozpuszczania się), podobnie jak
ciecze dążą do przejścia w stan gazowy.
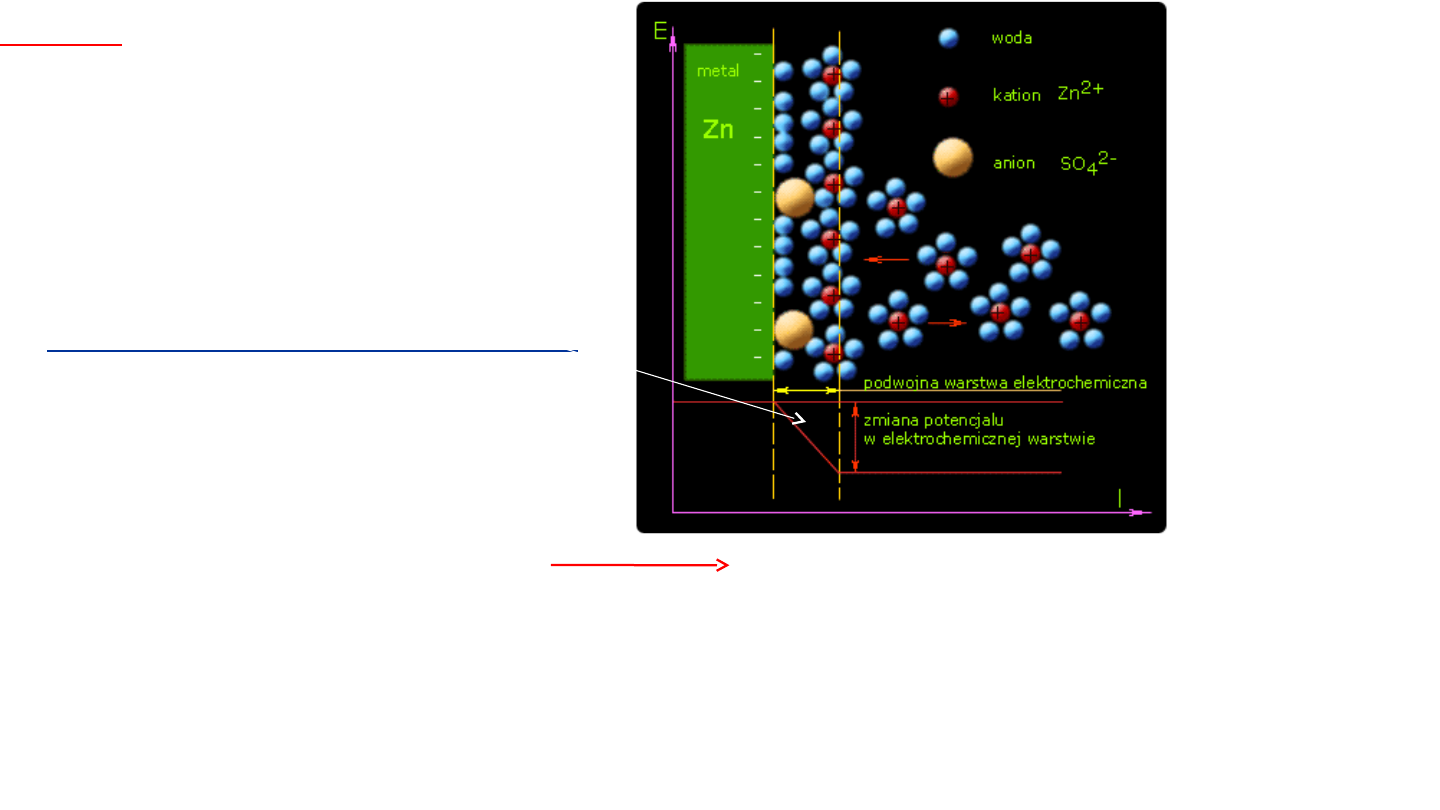
3
Na granicy faz metal-roztwór tworzy się
podwójna
warstwa elektryczna
.
Elektroda + elektrolit
półogniwo
(metaliczne)
Me
0
Me
n+
+ ne
Cu
+
+
+
+
+
+
+
+
-
-
-
-
-
-
-
-
Jeżeli np. do roztworu soli cynku
(miedzi) zanurzymy płytkę
cynkową (miedzianą), zwaną
elektrodą
,
to
będzie
ona
wysyłać jony Zn
2+
(Cu
2+
), a sama
będzie się ładować ujemnie:
Zn
0
Zn
2+
+ 2e; Cu
0
Cu
2+
+
2e
Emitowane jony Zn
2+
(Cu
2+
)
będą przyciągane przez ładunki
ujemne
pozostałe
na
elektrodzie:
Zn
2+
+ 2e
Zn
0
; Cu
2+
+
2e
Cu
0
i ustali się równowaga pomiędzy wartością ładunków dodatnich i
ujemnych
Ogólnie:
Zn
0
Zn
2+
+ 2e i Cu
0
Cu
2+
+ 2e
podwójna warstwa elektryczna
Półogniwo niemetaliczne
Jeżeli w roztworze jodku zanurzyć płytkę niemetalową
jodu, to zjawisko powstawania podwójnej warstwy
elektrycznej będzie miało inny charakter niż w
przypadku płytki cynkowej:
4
2I
-
I
2
0
+ 2e
oraz
I
2
0
+ 2e 2I
-
2I
-
- 2e
I
2
0
Płytka jodowa ładuje się dodatnio, odwrotnie
niż cynkowa.
Np. KI K
+
+ I
-
w roztworze
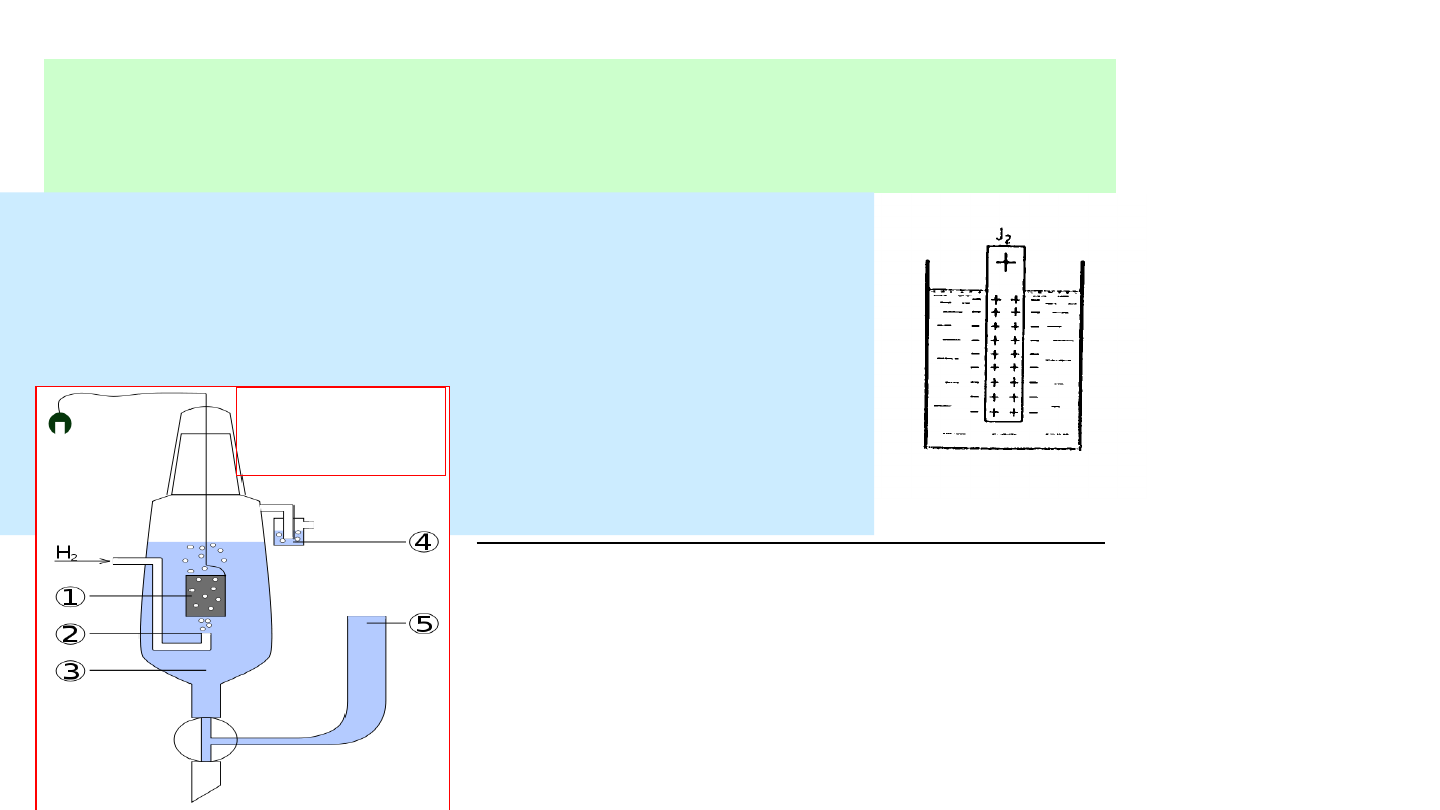
Elektrody (półogniwo) gazowe –
blaszka platynowa zanurzona w
roztworze
zawierającym
jony
substancji gazowej (Cl
2
, H
2
) i
omywana gazem pod ciśnieniem
normalnym:
Pt/X,X
-
X
n-
X + ne
H
2
↔2H
+
+
2e
3. Reakcję połówkową, której
wynikiem jest powstanie tego
potencjału nazywamy reakcją
potencjałotwórczą (reakcją
elektrodową).
5
4. Różnicy potencjałów między elektrodą i roztworem nie
można ani zmierzyć, ani obliczyć teoretycznie.
Można
zmierzyć różnicę potencjałów między elektrodami
dwóch półogniw tworzących ogniwo. Nosi ona nazwę
SIŁY ELEKTROMOTORYCZNEJ OGNIWA - SEM.
Wnioski:
2. Dwa przeciwne sobie procesy w
półogniwie są przyczyną tworzenia
się na powierzchni metalu lub
niemetalu
podwójnej warstwy elektrycznej.
Bezwzględny
potencjał
półogniwa
(E),
który zależy od: rodzaju elektrody oraz
rodzaju elektrolitu i jego stężenia.
1. Układ złożony z bezpośrednio
stykających się przewodników
jonowego i elektronowego to
półogniwo
Me
0
Me
n+
+
ne

Potencjał standardowy jest wielkością
charakterystyczną dla danego metalu
(niemetalu).
z - liczba elektronów biorących udział w reakcji, F - stała
Faradaya
(96500 C), c - stężenie, R - stała gazowa, T - temperatura.
6
Ilościowo potencjał takiej elektrody (tzw. pierwszego
rodzaju) określa
wzór Nernsta
:
E - potencjał
półogniwa,
E
0
- potencjał
standardowy,
Potencjał standardowy elektrody E
0
Me/Me
z+
to potencjał
elektrody, zbudowanej z metalu zanurzonego w roztworze,
w którym stężenie jonów potencjałotwórczych wynosi 1
mol/dm
3
i wszystkie gazy są pod ciśnieniem 1000 hPa, w
temperaturze 25
0
C (298 K), mierzony w stosunku
do
standardowej elektrody wodorowej
.
n
Me
c
zF
RT
E
E
ln
0
Potencjał
standardowej
elektrody
wodorowej
wynosi 0 V.
Wówczas SEM takiego ogniwa jest liczbowo równa
potencjałowi drugiego półogniwa
.
7
H
2
H
2
Otwory
wylotow
e
H
+
H
2
- 2e 2 H
+
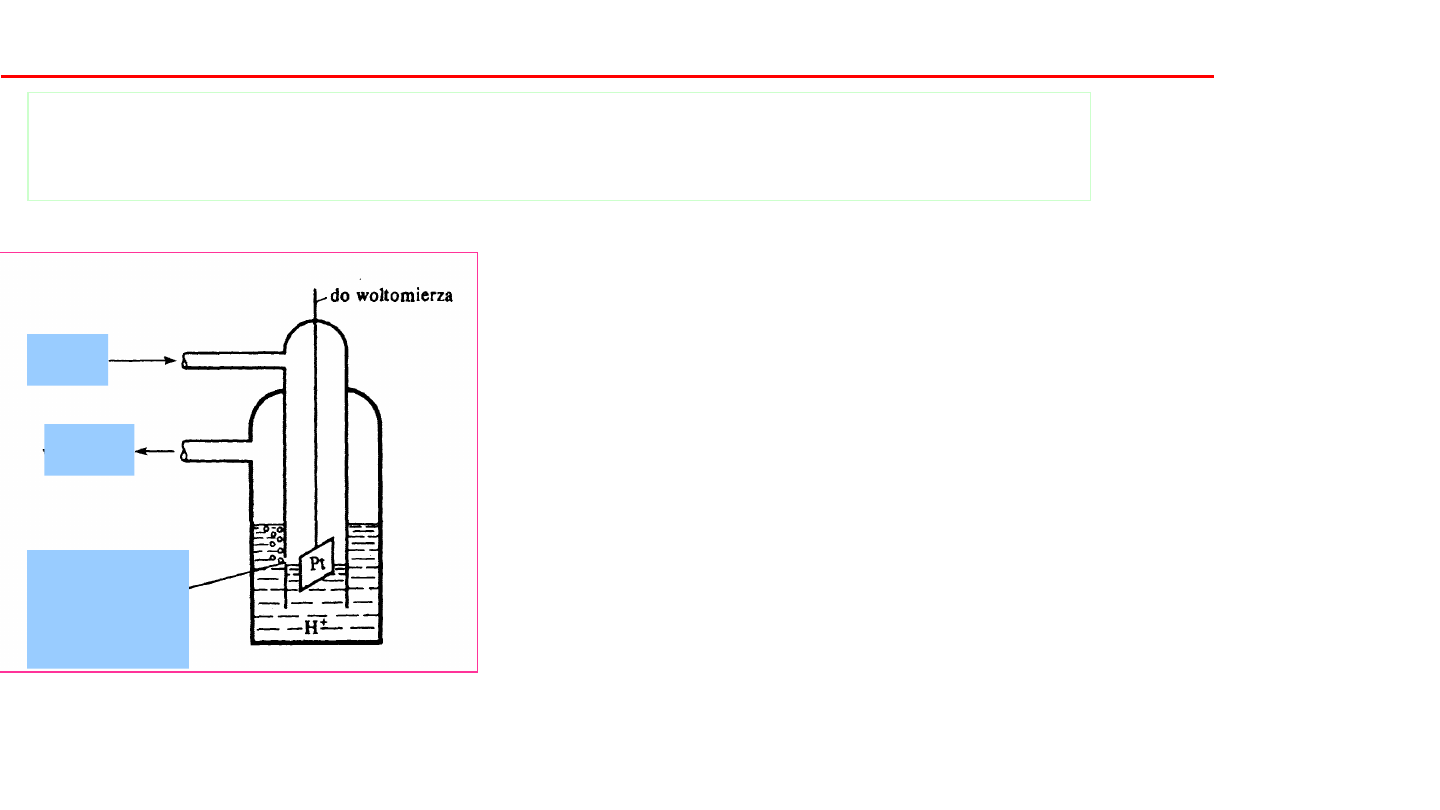
Elektroda wzorcowa - normalna
elektroda wodorowa:
•platyna pokryta czernią
platynową
•zanurzona w roztworze kwasu
o stężeniu jonów H
+
= 1
mol/dm
3
•omywana wodorem pod
ciśnieniem 101,3 kPa
•temperatura 298 K
•Potencjał normalnej elektrody
wodorowej:
E
PtH2\H
= 0
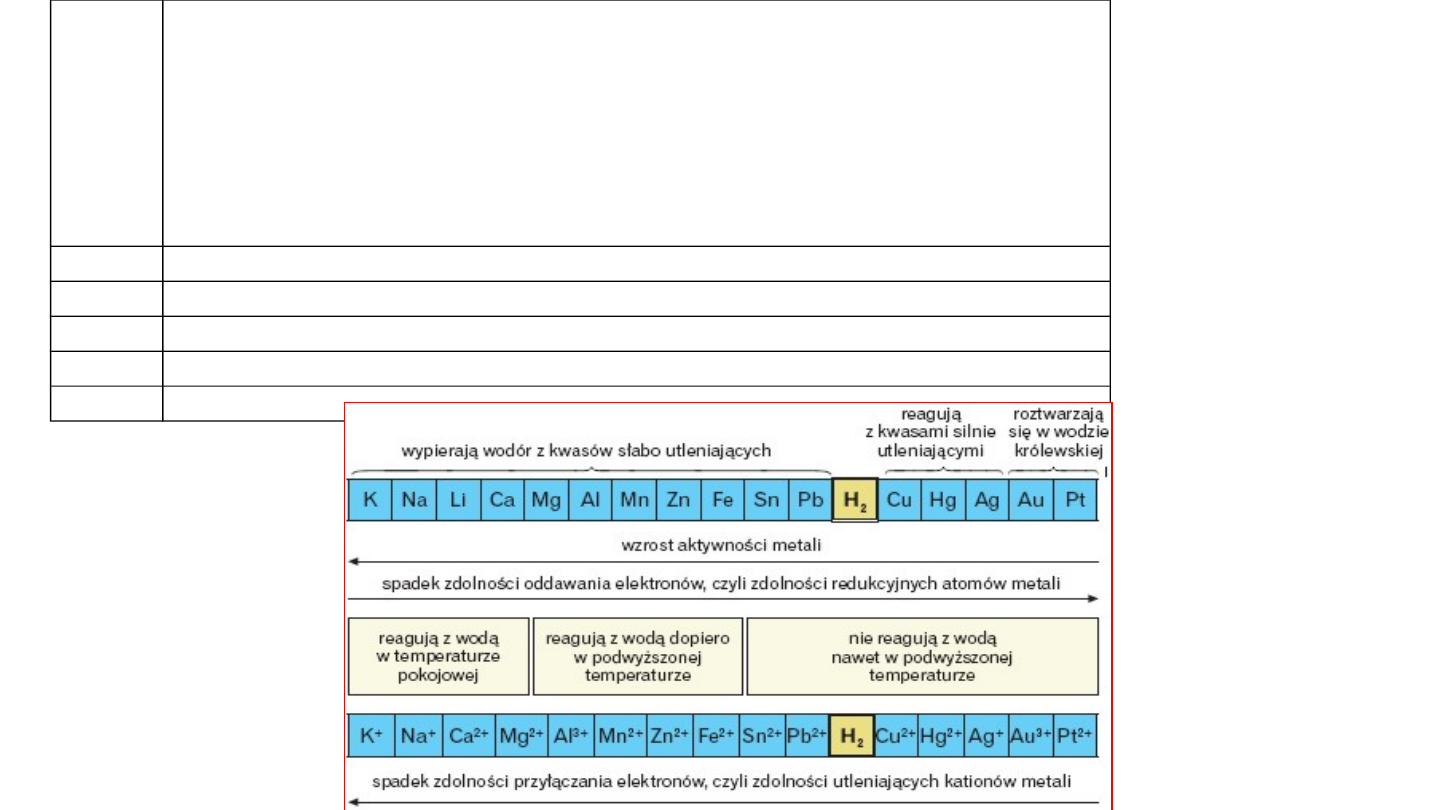
Jak się wyznacza potencjał standardowy półogniwa?
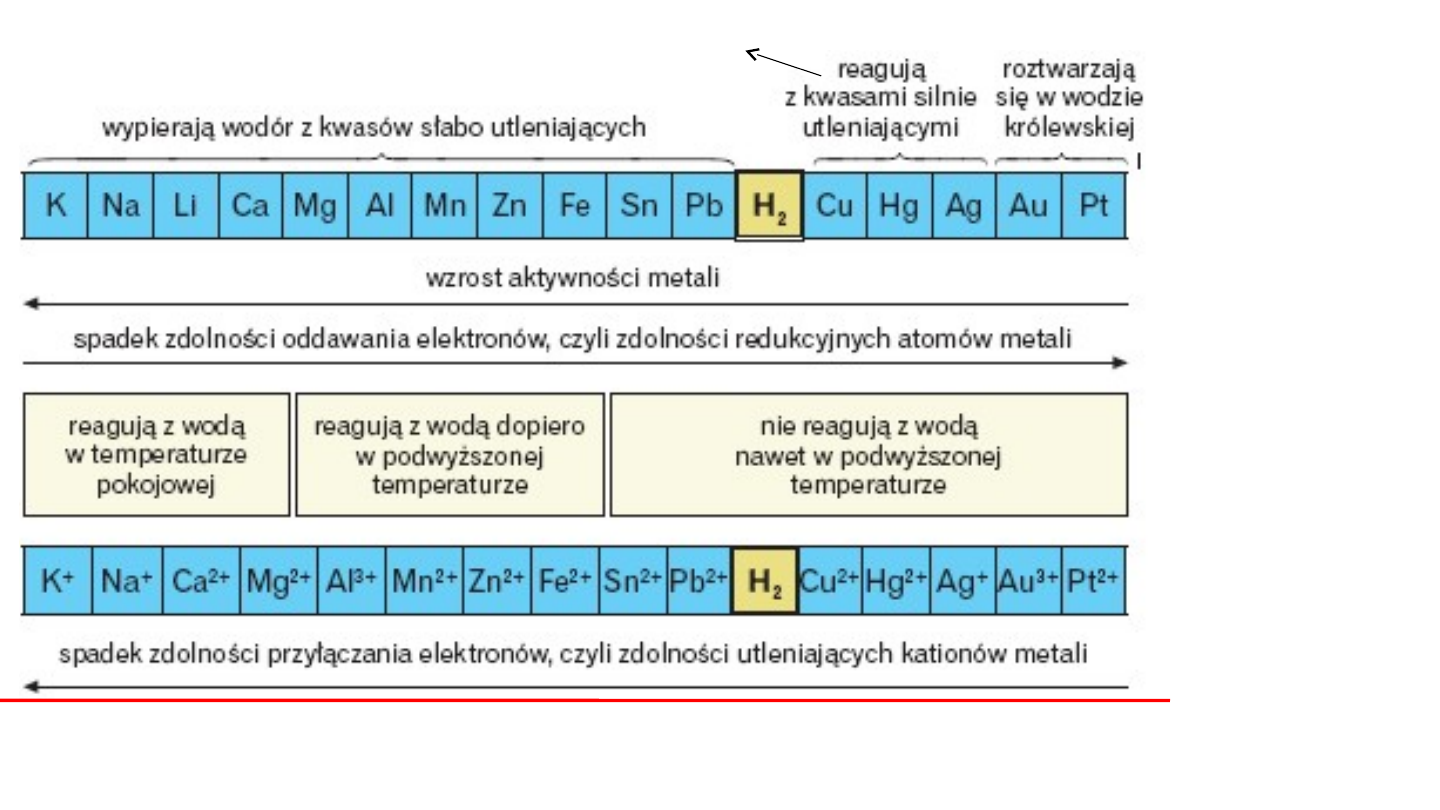
Zestawienie reakcji potencjałotwórczych
półogniw metalowych
w porządku rosnących potencjałów
standardowych nosi nazwę
SZEREGU
NAPIĘCIOWEGO METALI
(szereg elektrochemiczny).
8
Reakcja
połówkowa
E
0
, V
Reakcja
połówkowa
E
0
, V
Li
+
+ e = Li
K
+
+ e = K
Na
+
+ e = Na
Mg
2+
+ 2e = Mg
Al
3+
+ 3e = Al.
Zn
2+
+ 2e = Zn
Fe
2+
+ 2e = Fe
Cd
2+
+ 2e = Cd.
Co
2+
+ 2e = Co
-3,03
-2,92
-2,71
-2,37
-1,66
-0,76
-0,44
-0,40
-0,28
Ni
2+
+ 2e = Ni
Pb
2+
+ 2e = Pb
2H
+
+ 2e = H
2
Cu
2+
+ 2e = Cu
Ag
+
+ e = Ag.
Hg
2+
+ 2e = Hg
Pt
2+
+ 2e = Pt
Au
3+
+ 3e = Au
-0,23
-0,13
0,00
+0,34
+0,80
+0,87
+1,2
+1,42
9
3Cu + 8HNO
3
3Cu(NO
3
)
2
+ 4H
2
O
+ 2NO
Zn + H
2
SO
4
ZnSO
4
+ H
2
Jeżeli do roztworu soli metalu o wyższym potencjale normalnym
zanurzymy metal o niższym potencjale to metal ten wyprze z
roztworu soli metal o wyższym potencjale normalnym sam
przechodząc do roztworu: np.:
CuSO
4
+ Fe FeSO
4
+ Cu
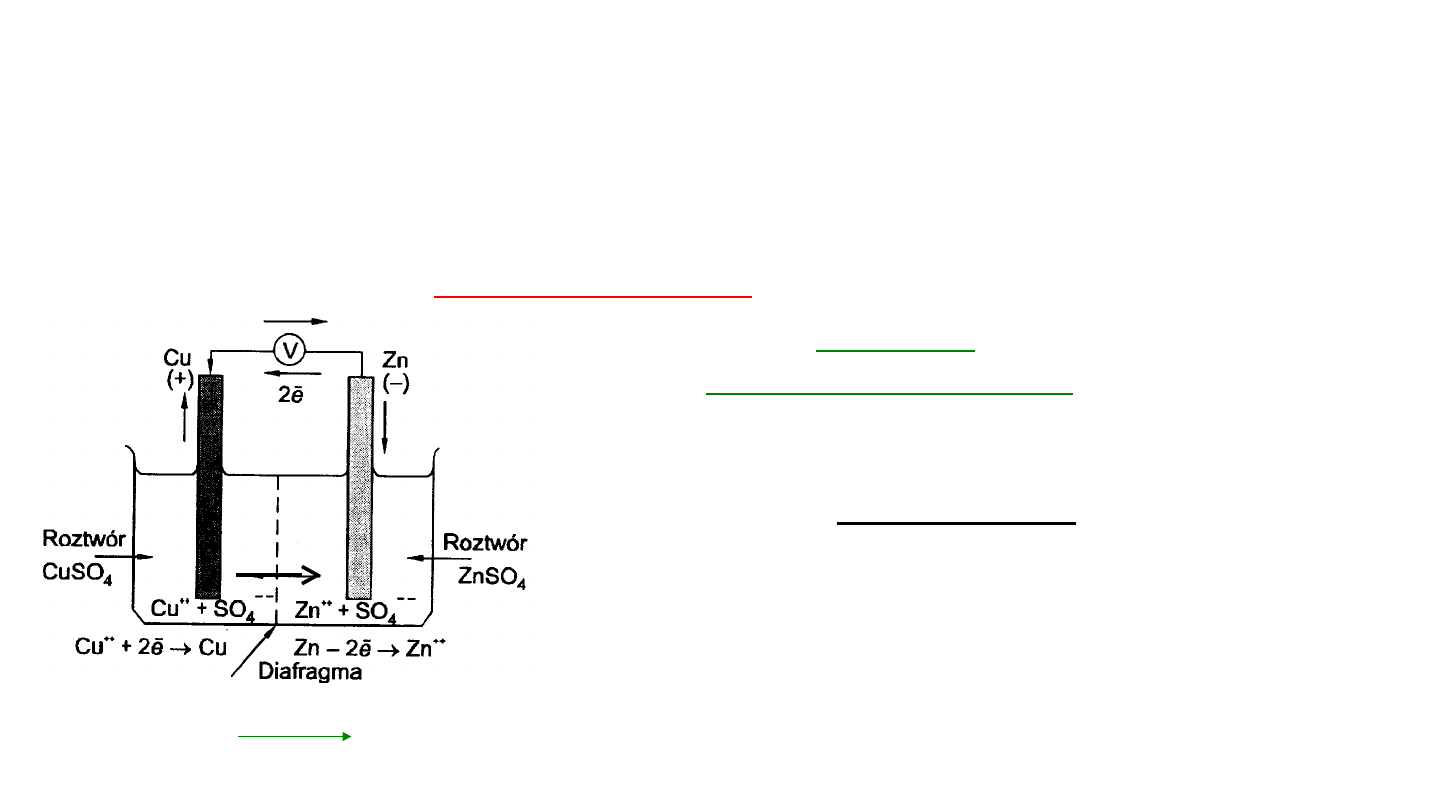
Ruch elektronów odbywa się od elektrody ujemnej
(anody - proces utleniania) w kierunku elektrody
dodatniej o wyższym potencjale (katody - proces
redukcji).
10
Reakcje
potencjałotwórcze:
(A
-) reakcja
dezelektronacji -
utlenienia
Zn
0
Zn
2+
+ 2e
(K+) reakcja
elektronacji - redukcji
Cu
2+
+ 2e
Cu
0
Sumarycznie:
Zn
0
+ Cu
2+
Zn
2+
+ Cu
0
Diafragma lub klucz
elektrolityczny
CuSO
4
(aq.) / Cu (+) (-) Zn/ZnSO
4
(aq.)
SO
4
SO
4
2
-
Ogniwo Daniela
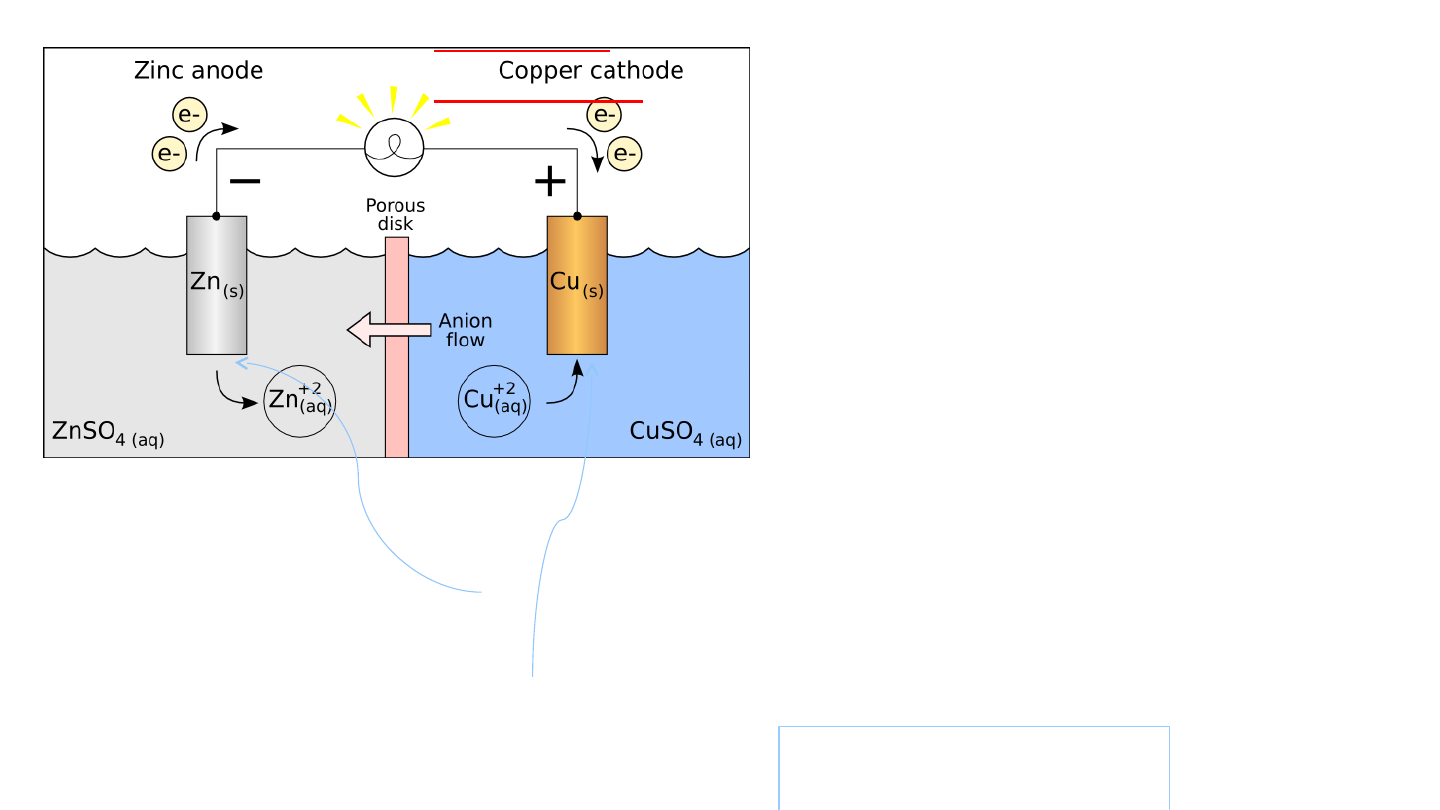
Ogniwo
Daniella
Okazuje się, że obserwowane efekty są wynikiem reakcji
utlenienia i redukcji jakie zachodzą w naczyniach.
Elektrony są oddawane elektrodzie w wyniku połówkowej
reakcji utlenienia:
Zn → Zn
2+
(aq)
+ 2e
a pobierane są z drugiej elektrody w toku połówkowej
reakcji redukcji
:
Cu
2+
(aq)
+ 2e → Cu
(s)
Sumaryczna reakcja biegnąca w ogniwie jest następująca.
Zn
(s)
+ Cu
2+
(aq)
→ Zn
2+
(aq)
+ Cu
(s)
Otóż
w
tak
zbudowanym układzie
zaobserwujemy
przepływ
prądu
elektrycznego
przez
włączony
w
obwód
miernik
prądu
elektrycznego
(wskazówka
miernika
wychyla
się),
rozpuszczanie
się
elektrody cynkowej
i
osadzanie
Cu
na
elektrodzie miedzianej.
ZAPIS
SCHEMATYCZNY:
Zn | ZnSO
4
|| CuSO
4
|
Cu
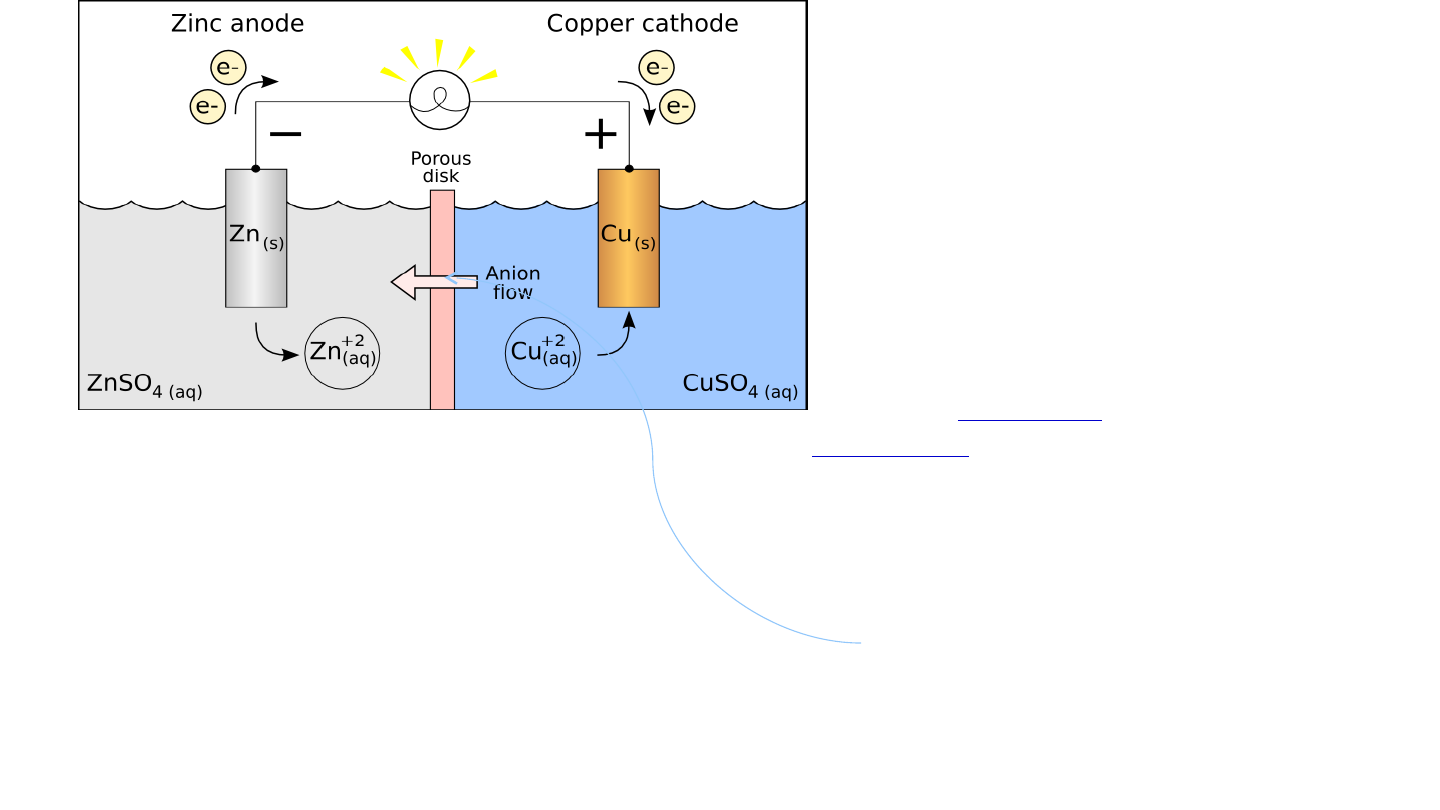
12
• Uniemożliwienie mieszania się roztworów elektrolitów
,
przede wszystkim utrudnia dotarcie jonu Cu
2+
do cynku
metalicznego,
gdzie
bezpośrednia
wymiana
elektronu
spowodowałaby zakłócenie pracy ogniwa w wyniku reakcji :
Cu
2+
(aq)
+ 2e →
Cu
(s)
.
• Umożliwienie dyfuzji jonów SO
4
2-
z jednej części
katodowej do anodowej i wyrównanie ładunków w
roztworach.
W przeciwnym razie roztwór w części anodowej
stałby się dodatnio naładowany (ponieważ gromadziłyby się
jony Zn
2+
), a część katodowa byłaby naładowana ujemnie (w
wyniku zużycia Cu
2+
).
SO
4
2-
W ogniwie tym
oba półogniwa są
połączone
kluczem
elektrolitycznym
,
najczęściej
wykonanym
z
roztworu
z
nasyconego KCl
w
agar-agarze
lub
porowatą
przegrodą
Jaka jest rola tej przegrody?
13
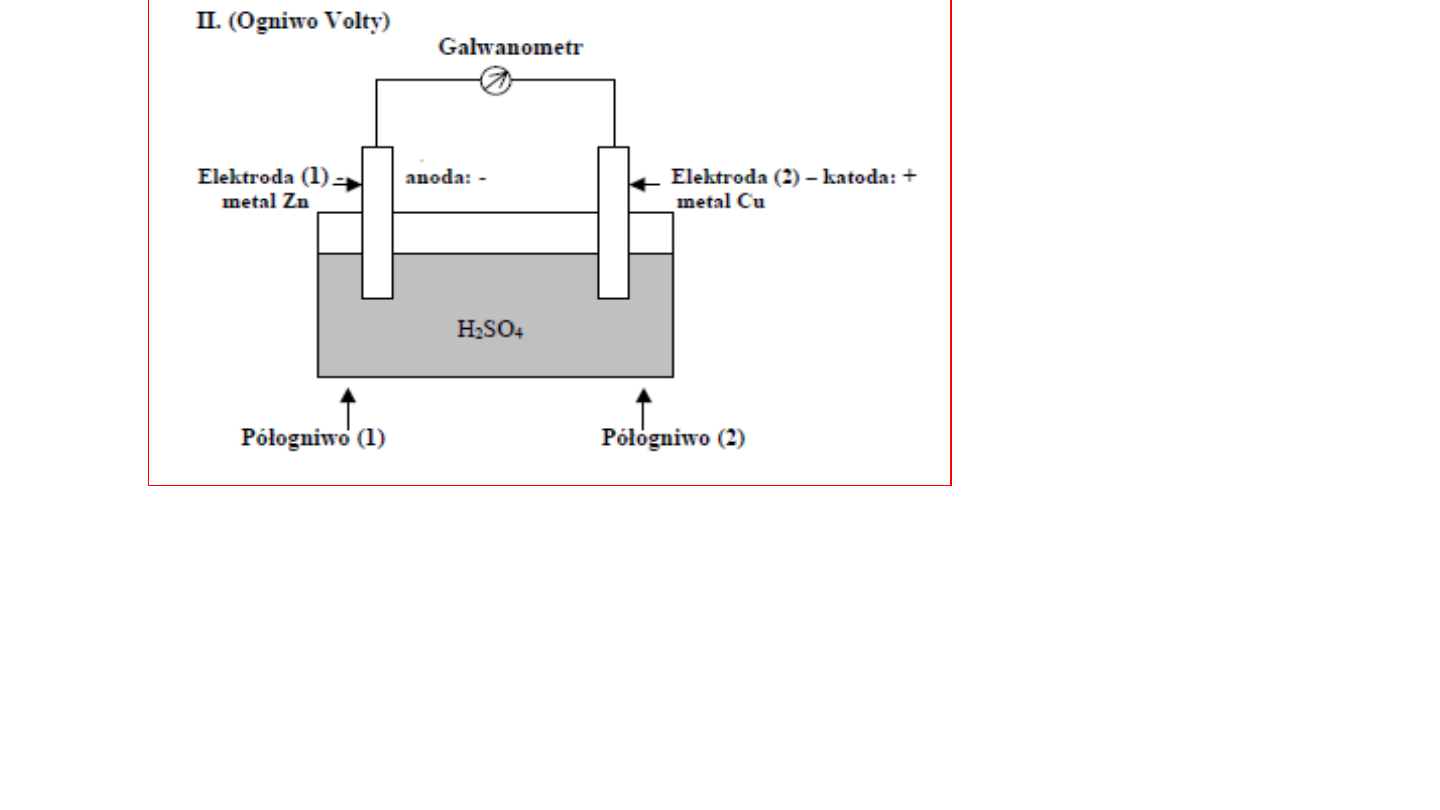
Półogniwo (1):
na granicy faz metal Zn | H
2
SO
4
elektroda-Zn rozpuszcza
się:
Zn - 2e = Zn
+2
Półogniwo (2):
na granicy faz metal Cu |H
2
SO
4
na elektrodzie Cu wydzielają
się jony 2H
+
:
2H
+
+ 2e = H
2
SUMARYCZNIE:
Zn + H
2
SO
4
= ZnSO
4
+ H
2
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)
Różnica potencjałów obu półogniw nazywa się
siłą elektromotoryczną (SEM) ogniwa.
14
E
1
i E
2
potencjały anody i katody
SEM = E
1
- E
2
[V]
D
la
o
g
n
iw
a
D
a
n
ie
la
:
Ogniwa galwaniczne można zestawiać z różnych
półogniw, a otrzymana SEM jest tym większa im
większa jest różnica pomiędzy ich potencjałami.
(-) Fe
Fe
2+
Cu
2+
Cu
(+)
Fe
Cu
(-) Cu Cu
2+
Ag
+
Ag (+) Cu
Ag
(-) Zn Zn
2+
Cd
2+
Cd (+) Zn
Cd
Kierunek
przepływu
elektronó
w
Na podstawie szeregu napięciowego metali można przewidzieć
jaka jest siła elektromotoryczna ogniwa,
2
Zn
0
/Zn
2
Zn
2
2
Cu
0
/Cu
2
Cu
1
lnc
nF
RT
E
E
;
lnc
nF
RT
E
E
2
2
2
2
Zn
Cu
/Zn
Zn
0
/Cu
Cu
0
c
c
ln
nF
RT
E
E
SEM

Ogniwa stężeniowe
Zbudowane
są
z
dwóch
jednakowych
elektrod,
zanurzonych w roztworze ich jonów o
różnych
stężeniach.
(-) Ag / AgNO
3
(c
1
) AgNO
3
(c
2
) / Ag (+)
gdy c
1
< c
2
to:
(-) Ag
0
Ag
+
+ e (c
1
)
oraz
(+) Ag
+
+ e Ag
0
(c
2
)
15
Ogniwo pracuje do momentu wyrównania się stężeń
elektrolitów w obu półogniwach.
Elektroda w roztworze o większym stężeniu ma potencjał
dodatni, a ujemny w roztworze o mniejszym stężeniu.
SEM ogniwa wyniesie:
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)
1
2
c
c
ln
nF
RT
SEM
n
Me
0
lnc
zF
RT
E
E
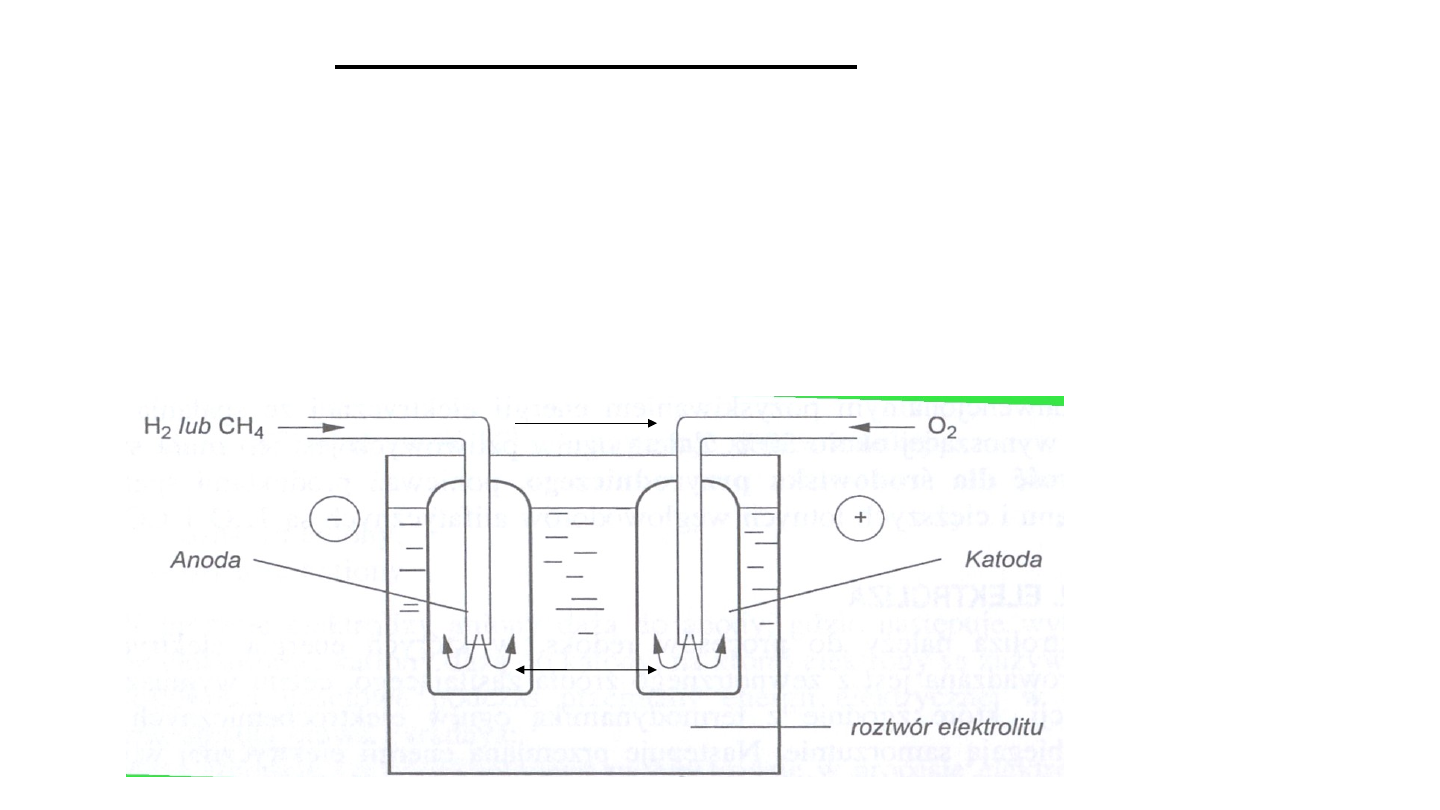
Ogniwa paliwowe
Zamieniają bezpośrednio energię silnie egzotermicznych
reakcji chemicznych na energię elektryczną.
Dwie grupy:
1. reakcje syntezy wody z wodoru i tlenu: 2H
2
+ O
2
2H
2
O
2. spalania gazowych węglowodorów CH
4
+ 2O
2
CO
2
+
2H
2
O.
Do anody doprowadzane są wodór lub metan, natomiast do
katody tlen lub powietrze.
Anoda i katoda zawierają przesłony nasycone katalizatorem
platynowym.
- kwaśny lub
zasadowy
Utlenienie wodoru
do wody lub
metanu do CO
2
i
H
2
O
e
Redukcja
tlenu do
wody (OH
-
)
jon
y
16
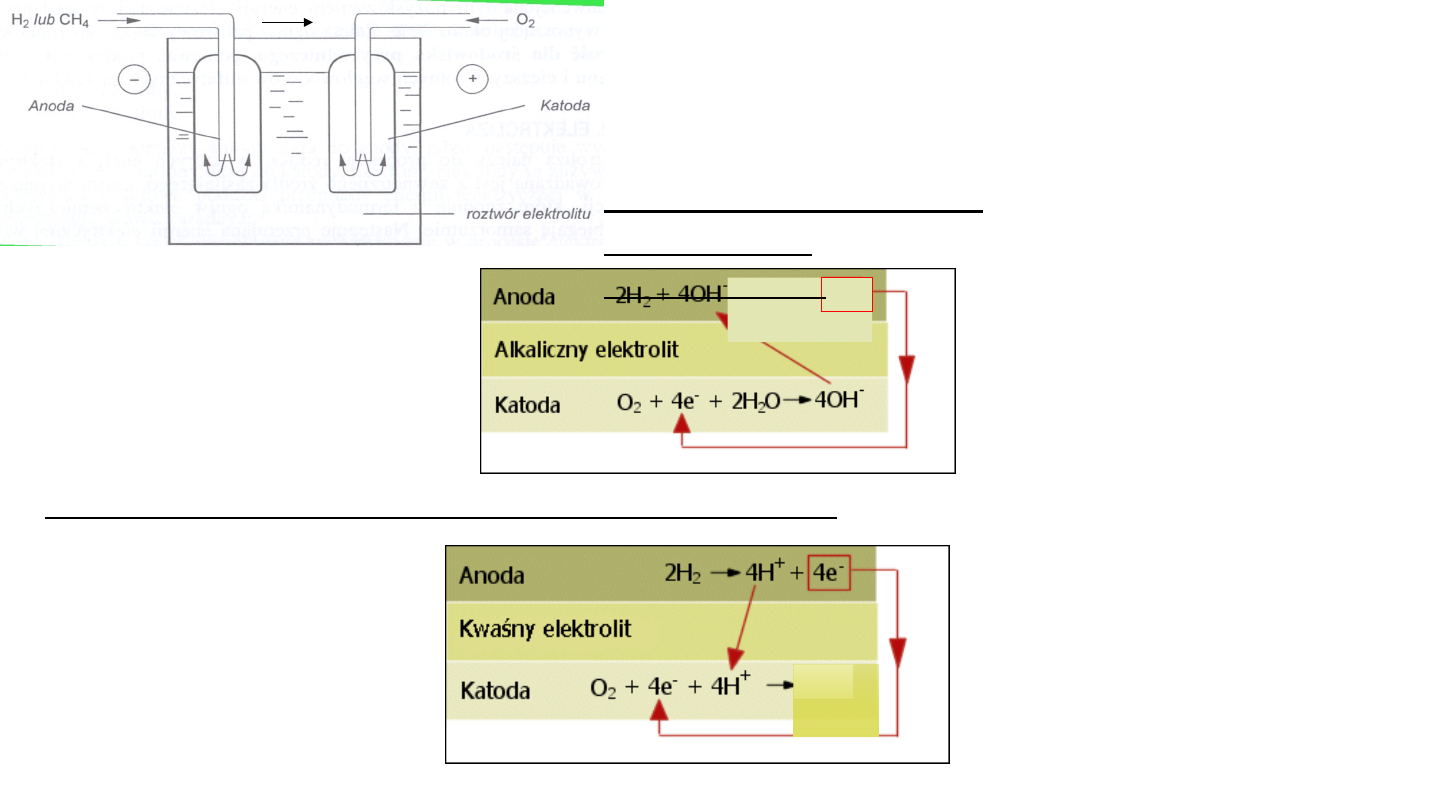
Ogniwa paliwowe oparte na wodorze pracują w temp.470K i pod
ciśnieniem 3 MPa.
W ogniwie
zachodzą
cząstkowe
reakcje redoks:
Spalanie wodoru w środowisku kwaśnym:
Utlenienie
Redukcja
Reakcja sumaryczna: 2H
2
+ O
2
2H
2
O
2H
2
O
Reakcja sumaryczna: 2H
2
+ O
2
2H
2
O
Utlenienie
KOH
Redukcja
4
4H
2
O +
4e
-
Spalanie wodoru w
środowisku
zasadowym:
e
17
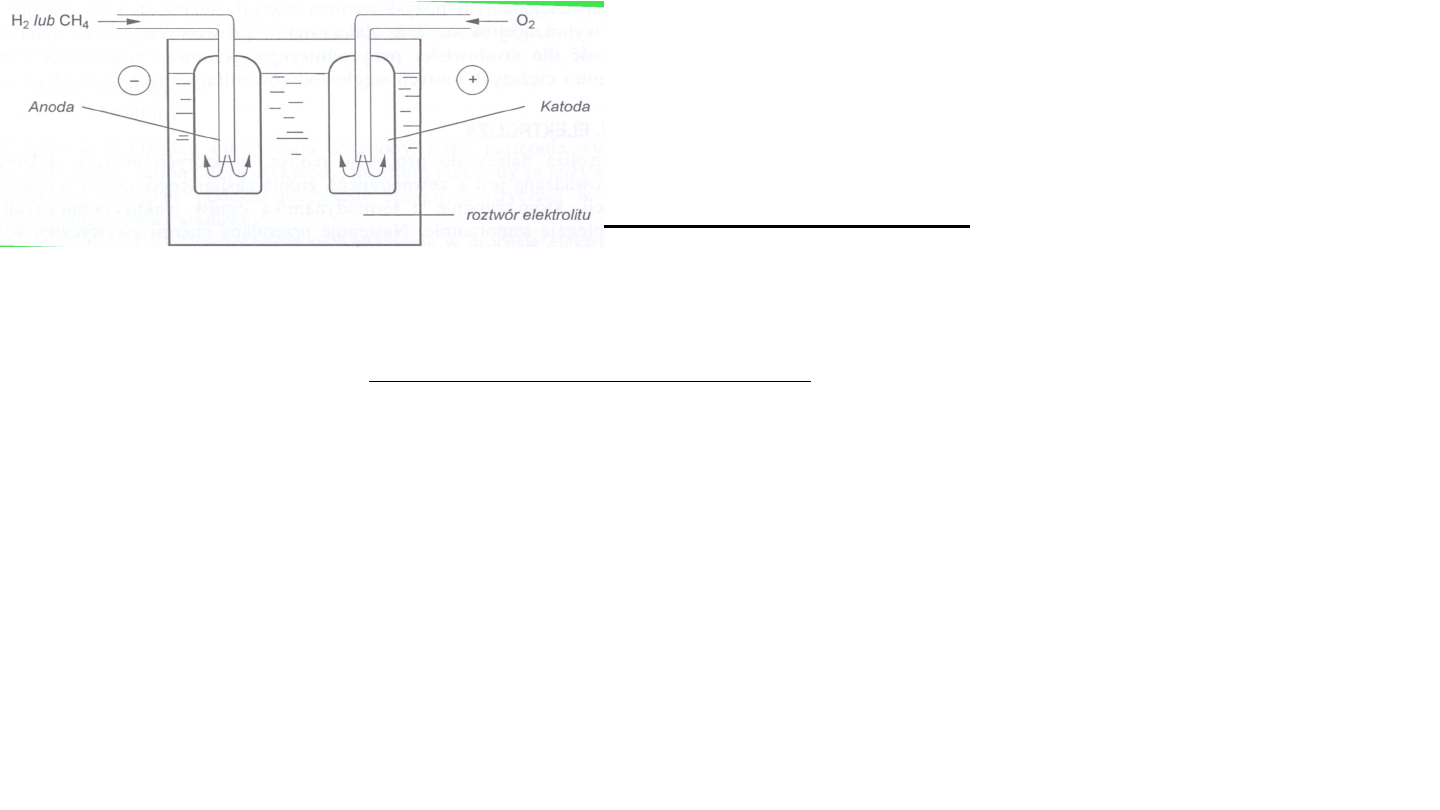
Utlenienie na anodzie: CH
4
+ 10H
2
O CO
2
+
8H
3
O
+
+ 8e
Redukcja na katodzie: 2O
2
+ 8H
3
O
+
+8e
12H
2
O
Reakcja sumaryczna: CH
4
+ 2O
2
CO
2
+ 2H
2
O
Ogniwa paliwowe oparte na węglowodorach mają
większe perspektywiczne znaczenie praktyczne.
Spalanie metanu
Sprawność ogniw paliwowych w pozyskiwaniu
energii elektrycznej wynosi ok.70%, a więc jest
wyższa niż ze spalania węgla (ok.30%)
18

19
Zadanie 1
ZADANI
A

Zad.2
: Zaprojektuj dwa ogniwa galwaniczne o jednej
takiej samej elektrodzie (będzie nią elektroda niklowa),
przy czym w pierwszym ogniwie byłaby ona elektrodą
dodatnią, a w drugim ujemną
20
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)
2. (-)Ni/Ni
2+
//Cu
2+
/Cu(+)
tutaj elektroda niklowa pełni
rolę anody, bo ma niższy potencjał (-0,22V), miedź ma
potencjał wyższy, więc jest katodą (+0,34V)
1. (-)Zn/Zn
2+
//Ni
2+
/Ni(+)
tutaj sytuacja odwrotna -
elektroda niklowa ma wyższy potencjał niż cynkowa,
więc jest katodą.
Zad.3
: Zapisz schemat i oblicz SEM ogniwa zbudowanego
z płytki kadmowej zanurzonej do roztworu chlorku
kadmu(II) oraz płytki złotej zanurzonej do roztworu
chlorku złota(III), jeżeli stężenia soli obu metali są
jednomolowe, a warunki standardowe.
Na podstawie szeregu napięciowego metali zapisujemy
schemat powstałego ogniwa.
Potencjał półogniwa Cd|Cd
2+
=-0,40V, Au|Au
3+
=+1,42V,
więc półogniwo kadmowe stanowi anodę, a złotowe
katodę.
(-)
Cd|Cd
2+
||Au
3+
|Au(+)
21
= 0
ponieważ stężenia soli obu metali są jednomolowe
SEM=E
0
(katody)-E
0
(anody) = +1,42V - (-
0,40V)=+1,82V
SEM ogniwa wynosi 1,82V.
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)
2
3
2
3
Cd
Au
/Cd
Cd
0
/Au
Au
0
c
c
ln
nF
RT
E
E
SEM
Zad.4:
Ogniwo galwaniczne składa się z półogniw I rodzaju –
miedziowego i magnezowego.
• Podać schemat tego ogniwa.
• Zaznaczyć katodę i anodę.
• Zapisać równania reakcji połówkowych zachodzących na katodzie i
anodzie.
• Obliczyć siłę elektromotoryczną ogniwa w temp. 298 K jeśli stężenie
jonów miedzi wynosi 10
-4
mol/dm
3
a magnezu 1mol/dm
3
.
• Jakich zmian dokonać w ogniwie, aby jego SEM wzrosła do wartości
2,70 V?
(E
0
Mg/Mg2+
= -2,36 V), E
0
Cu/Cu2+
= 0,34 V)
Odpowiedź
:.
(-) Mg/Mg
2+
//Cu
2+
/Cu (+);
Mg – anoda, Cu – katoda;
Mg – 2e → Mg
2+
;
Cu
2+
+ 2e → Cu;
Czyli: wyrównać stężenie jonów Cu
2+
i Mg
2+
np. do 1
mol/dm
3
22
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)
2,582V
1
10
ln
2F
298
R
2,36
0,34
c
c
ln
nF
RT
E
E
SEM
4
Mg
Cu
/Mg
Mg
0
/Cu
Cu
0
2
2
2
2
2,7V
1
1
ln
2F
298
R
2,70
c
c
ln
nF
RT
E
E
SEM
2
2
2
2
Mg
Cu
/Mg
Mg
0
/Cu
Cu
0

23
Zadanie 5
Elektroda w roztworze o większym stężeniu ma
potencjał dodatni, a ujemny w
roztworze
o
mniejszym stężeniu.
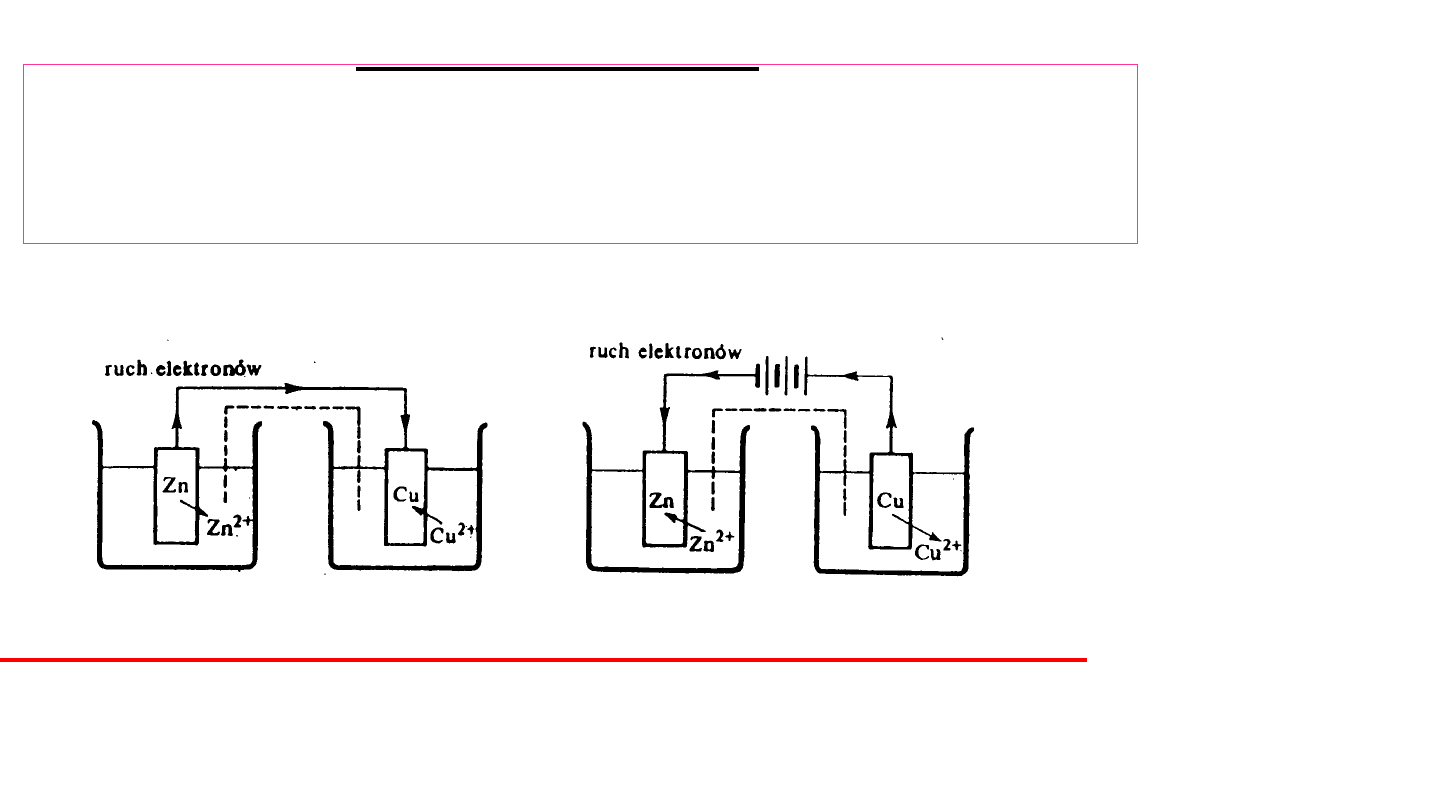
Elektroliza
Procesem
elektrolizy
określa się zespół przemian na
granicach faz przewodnik metaliczny - przewodnik
jonowy,
zachodzących
pod
wpływem
napięcia
elektrycznego
przyłożonego
do
przewodników
metalicznych elektrolizera.
24
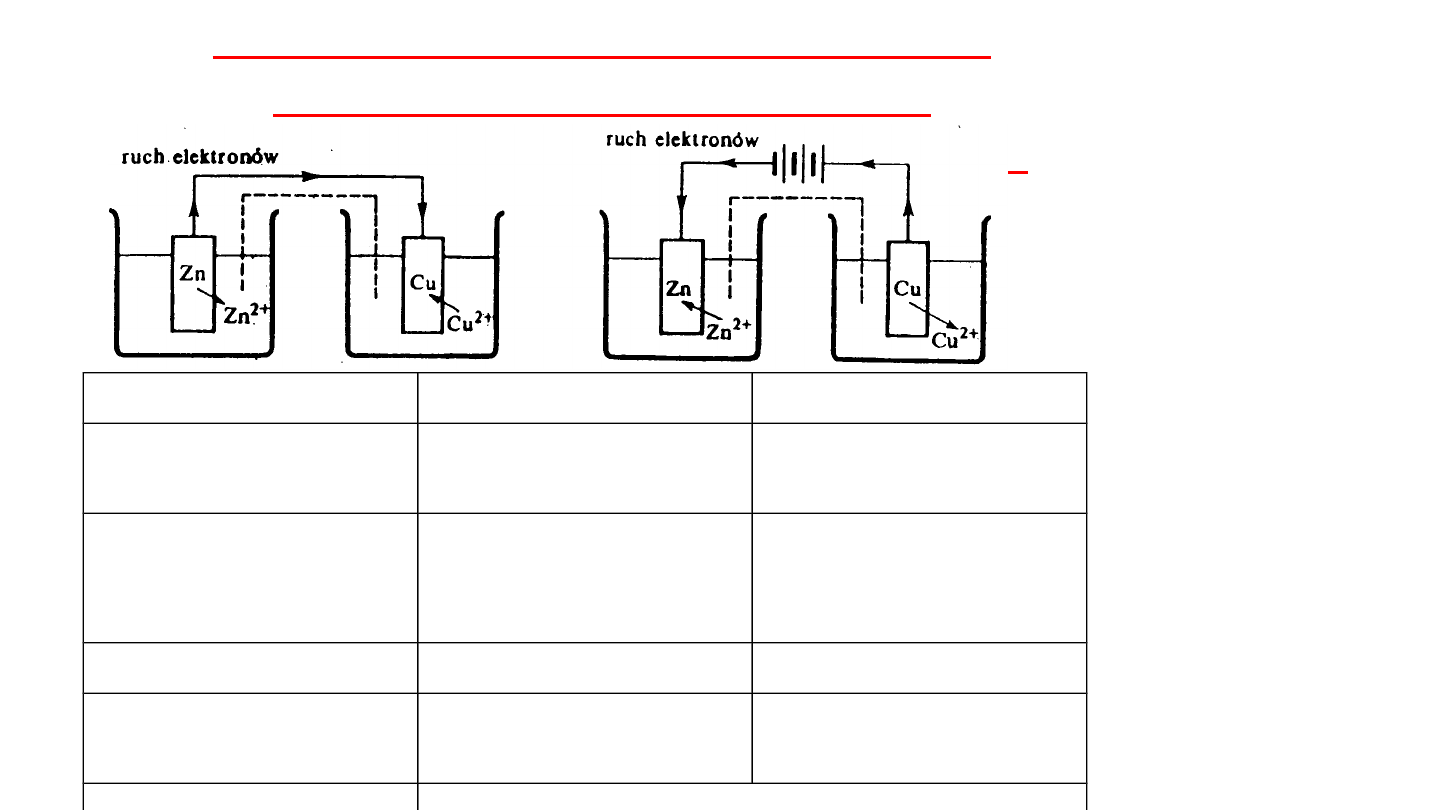
Podczas elektrolizy zachodzą procesy odwrotne
w stosunku do przemian zachodzących w czasie
pracy ogniwa galwanicznego
Ogniwo
Elektroliz
a
utlenie
nie
utlenie
nie
redukcj
a
redukcj
a
A
(-)
A
(+)
K
(+)
K
(-)
W obwodach prądu stałego
anoda
to ta z elektrod, która
przyjmuje
ładunek ujemny lub wysyła dodatni
, zaś
katoda
to elektroda
wysyłająca ładunek ujemny lub przyjmująca dodatni
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)
25
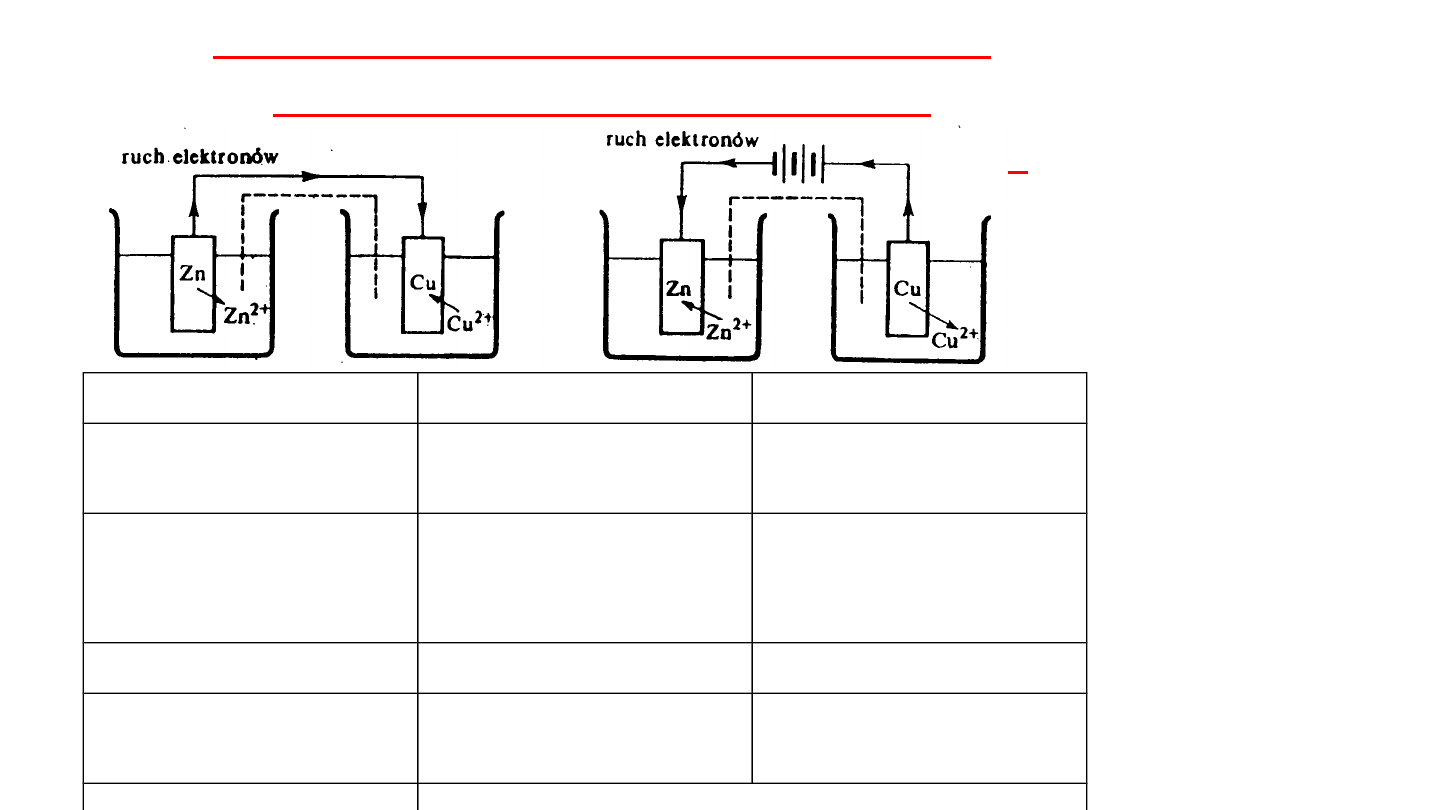
Różnice pomiędzy procesami
zachodzącymi w ogniwie
galwanicznym i i elektrolizerze
Elektrolizer
Ogniwo
Proces
Wymuszony
przepływem prądu
Od katody do
anody
Kierunek
przepływu
elektronów
Od anody do
katody
Od katody do
anody
Elektroda ujemna
Katoda
Anoda
Elektroda
dodatnia
Anoda
Katoda
Utlenianie
Zawsze zachodzi na anodzie
Redukcja
Zawsze zachodzi na katodzie
Elektroliz
a
Ogniwo
26
Różnice pomiędzy procesami
zachodzącymi w ogniwie
galwanicznym i i elektrolizerze
Elektrolizer
Ogniwo
Proces
Wymuszony
przepływem prądu
Od katody do
anody
Kierunek
przepływu
elektronów
Od anody do
katody
Od katody do
anody
Elektroda ujemna
Katoda
Anoda
Elektroda
dodatnia
Anoda
Katoda
Utlenianie
Zawsze zachodzi na anodzie
Redukcja
Zawsze zachodzi na katodzie
Elektroliz
a
Ogniwo
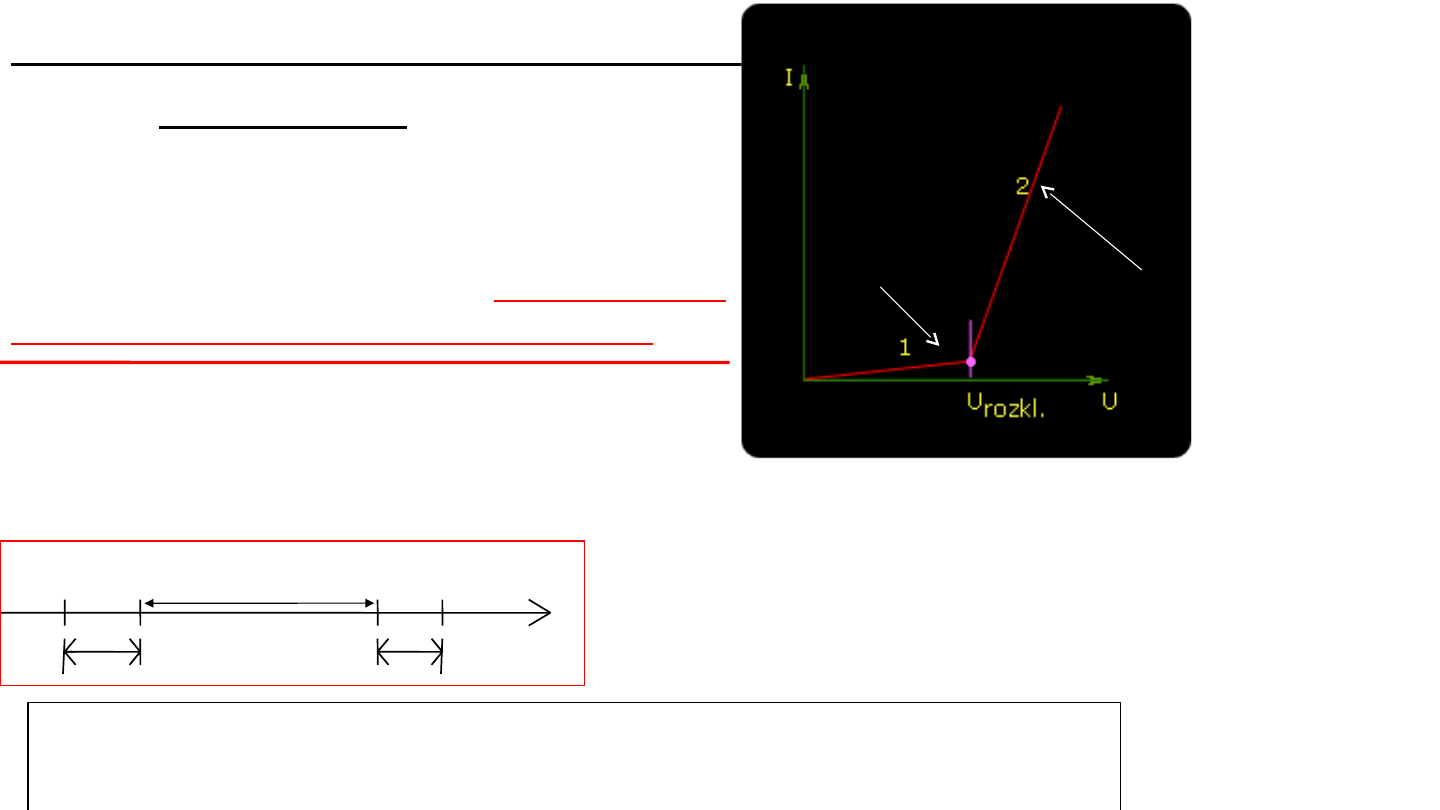
Proces
elektrolizy
przebiega tylko
wówczas, gdy do elektrod przyłożone
jest zewnętrzne napięcie wyższe od
pewnej wartości charakterystycznej
dla danego układu:
przewodnik
metaliczny - przewodnik jonowy
:
NAPIĘCIE ROZKŁADOWE –
U
rozkł.
NAPIĘCIE ROZKŁADOWE
Napięcie
przyłożone
do
faz
metalicznych elektrolizera wywołuje
zmiany
potencjałów
obu
elektrod
w
porównaniu
z
potencjałem
odpowiednich półogniw i :
Potencjał rozkładowy anody jest
wyższy, a potencjał rozkładowy
katody - niższy od potencjału
elektrodowego.
A
więc
potencjał
wydzielania
poszczególnych
elektrod wyniesie:
U
k
w
=
E
k
e
-
k
; U
a
w
=
E
a
e
+
a
Ta
różnica
zwana
jest
nadnapięciem (
a
i
k
)
(SEM)
potencjał
U
E
E
U
k
k
a
a
w
e
e
w
h
h
k
a
27
Brak
reakcji
elektrodow
ej
Reakcje
elektrodo
we
e
k
E
e
a
E
NAPIĘCIE ROZKŁADOWE
Jeżeli roztwór poddawany elektrolizie zawiera
kilka kationów Me
1
, Me
2
, ... , i kilka anionów A
1
,
A
2
, ... , to w pierwszej kolejności rozładowaniu
ulegają:
na katodzie - kation o najwyższym potencjale
wydzielania;
na anodzie - anion o najniższym potencjale
wydzielania.
potencjały
wydzielania
Me
Me
Me
1
2
3
A
1
A
2
A
3
na anodzie wydzieli się
na katodzie wydzieli się
28

29
Proces elektrolizy zachodzi w:
stopionych solach
i
roztworach wodnych
:
• kwasów,
• zasad i
• soli
.
Elektroliza stopionego chlorku sodowego NaCl
Ciekły stopiony NaCl zawiera podobnie jak kryształ jony Na
+
i Cl
-
,
dlatego po przyłożeniu napięcia do elektrod zachodzą na nich
następujące reakcje:
• reakcja katodowa
Na
+
+ e → Na
, jon ten przechodzi w obojętny atom.
• reakcja anodowa
2Cl
-
→ Cl
2
+ 2e
, co jony przechodzą w obojętne
atomy łączące się w gazowe dwuatomowe cząsteczki chloru
uchodzące ze stopu
Sumaryczny przebieg reakcji jest następujący
2Na
+
+ 2Cl
-
→ 2Na + Cl
2
W wyniku elektrolizy ze stopionego chlorku sodu otrzymujemy przez
elektrolityczny rozkład metaliczny sód przy katodzie i gazowy chlor
wydzielony przy anodzie.
Otrzymywanie glinu: prowadzi się elektrolizę
Al
2
O
3
w stopionym
kriolicie (3NaFAlF
3
) z uwagi na bardzo wysoką temp. topnienia Al
2
O
3
(ponad 2000
o
C):
K (-) Al
3+
+ 3e Al
0
(brak wody, czyli jonów H
+
)
A (+) 2O
2-
- 2e O
2

30
Elektroliza wodnego, rozcieńczonego
roztworu NaCl
Rozcieńczony wodny roztwór NaCl daje w wyniku
elektrolizy wodór i tlen.
Woda reaguje z
katodą
zdobywając elektrony:
2H
2
O + 2e
-
→
H
2
+
OH
-
W wyniku reakcji katodowej powstaje wydzielający się przy katodzie
wodór
.
Woda reaguje również z
anodą
tracąc elektrony:
2H
2
O →
O
2
+
4H
+
+ 4e
-
przy czym powstaje wydzielający się przy anodzie
tlen
.
Ogólna reakcja elektrolizy wodnego rozcieńczonego roztworu NaCl
ma postać
6H
2
O → 2H
2
(katoda) + O
2
(anoda) + 4H
+
+ 4OH
-
Reakcja elektrolizy rozcieńczonego roztworu NaCl polega zasadniczo
na rozkładzie wody wg reakcji:
2H
2
O → 2H
2
+ O
2
Elektroliza stężonego, wodnego roztworu NaCl
Stężony roztwór chlorku sodu w wodzie nie daje dokładnie tych
samych produktów jak w przypadku elektrolizy stopionej soli.
Na katodzie zostaje tworzy się
wodór
, a przy anodzie gazowy
chlor
.
Jony chloru
z ładunkiem ujemnym wędrują w kierunku
anody
,
oddają tam swoje
elektrony
i stają się obojętnymi cząsteczkami
Cl
2
:
2Cl
-
→ Cl
2
+ 2e
Dodatnie
jony sodu pobierają
z
katody
elektrony
i przechodzą w
obojętne atomy
, które natychmiast
reagują z wodą
według
równania: 2Na + H
2
O → 2NaOH +
H
2

31
Elektroliza
kwasów
beztlenowych
:
K (-) 2H
+
+ 2e
H
2
A (+) 2Cl
-
- 2e
Cl
2
Elektroliza kwasów tlenowych:
K (-) 4H
+
+ 4e 2
H
2
A (+) 2H
2
O - 4e 4H
+
+
O
2
lub 2SO
4
2-
+ 2H
2
O - 4e 4H
+
+
2SO
4
2-
+ O
2
Elektroliza wodnego roztworu kwasów
Podczas elektrolizy kwasów z reguły przy katodzie
wydziela się
wodór
, a przy anodzie
tlen
lub
inne
produkty
(np. Cl
2
przy HCl).
Roztwory kwasów tlenowych (H
2
SO
4
, H
3
PO
4
, HNO
3
,
H
2
CO
3
) dają zawsze tlen i wodór.
32
Elektroliza zasad
Elektroliza wodnych
roztworów zasad: Me(OH)
n
Me
n+
+ nOH
-
K (-) 2H
2
O + 2e 2OH
-
+
H
2
lub K (-) Me
n+
+ ne
Me
0
A (+) 4OH
-
- 4e 2H
2
O +
O
2
Potencjał
rozkłado
wy
H
+
Me
n+
H
+
Me
n+
Jeżeli w roztworze obecne są wodorotlenki metali lekkich
(I i II grupa układu okresowego) to na katodzie wydziela
się gazowy wodór. Granicą jest położenie glinu (Al) w
szeregu napięciowym metali.
Elektroliza soli
Elektroliza wodnych roztworów soli:
- sole metali lekkich : K (-) 2H
2
O + 2e 2OH
-
+
H
2
- sole metali ciężkich: K (-) Me
n+
+ ne
Me
0
A (+) jak w przypadku zasad

Elektroliza prowadzona na
elektrodach biorących udział w
procesach elektrodowych.
Zanieczyszczenia zawarte w miedzi surowej (anoda)
przechodzą do roztworu lub opadają na dno wanny
elektrolitycznej.
Zastosowanie: Rafinacja miedzi
–
katoda - cienka blacha miedziana;
anoda - gruby blok zanieczyszczonej miedzi
Elektrolit - wodny roztwór CuSO
4
Miedź rozpuszcza się na anodzie, a wydziela na katodzie,
a więc:
w procesie następuje oczyszczanie metalu.
Najczęściej obie elektrody są wykonane z metalu,
którego jony występują w roztworze.
Np.: Roztwór CuSO
4
i obie elektrody z miedzi metalicznej:
K (-) Cu
2+
+ 2e Cu
0
A (+) Cu
0
- 2e Cu
2+
33

Prawa Faradaya
Pierwsze w historii ilościowe badania procesu
elektrolizy podjął Michał Faraday. Rezultatem jego
prac są dwa prawa elektrolizy.
I prawo Faradaya -
Masa substancji wydzielonej na
elektrodzie jest wprost proporcjonalna do ilości
elektryczności, która przepłynęła przez elektrolit.
gdzie:m - masa substancji wydzielonej na jednej z elektrod,
[g]
I - natężenie prądu, [A]; t - czas trwania elektrolizy, [s]
Q - ilość elektryczności, [C]; k - równoważnik
elektrochemiczny, [g/C]
m = k I t m = k Q
Równoważnik elektrochemiczny (k)
definiuje się jako
ilość substancji wydzielonej na elektrodzie w wyniku
przepływu prądu o natężeniu 1 A w czasie 1 s (1
Coulomb elektryczności).
34

35
2)
„stosunek masy molowej substancji
wydzielającej się na elektrodzie do iloczynu
jej równoważnika elektrochemicznego i
liczby ładunkowej reakcji elektrodowej
(zapisanej dla jednego mola substancji o
masie molowej M) jest wielkością stałą dla
wszystkich
procesów
elektrodowych
i
wynosi 96500 C/mol”:
Oba prawa można połączyć i
przedstawić w postaci jednego
wzoru:
M – masa molowa substancji
wydzielonej na elektrodzie
z – liczba ładunkowa
F – stała Faradaya = 96 500
C/mol
F
z
k
M
t
I
F
z
M
m
F
z
M
k

36
Przykład 1
Przykład 2
F
z
M
k

37
Przykład 3
Oblicz ile miedzi wydzieli się na elektrodzie elektrolizera, jeżeli przez
elektrolizer przepłynął prąd o natężeniu 0,5 A w czasie 1 godz. 4 min.
20 sek.
Kolejność rozwiązania zadania jest następująca:
Etap 1:
Piszemy równanie połówkowe otrzymywania miedzi i
wyznaczamy stosunek molowy elektronów i produktu:
katoda: Cu
2+
(c)
+ 2e
-
Cu
(c)
Etap 2:
Wyznaczamy dostarczony ładunek na podstawie natężenia
prądu i czasu:
(ładunek (Q)= natężenie prądu (I w A)
·
czas (t w sek);
Q= 0,5 A ·
3860 s = 1930 C.
Etap 3:
Zamieniamy ładunek na liczbę moli miedzi: 1 F wydziela M
cu
/2
Liczba moli Cu = 1930 C / 193000 C = 0,01
Etap 4:
Obliczamy masę miedzi wydzielonej na elektrodzie.
Obliczenie wykonujemy w oparciu o dane z równania połówkowego.
Zgodnie z tymi danymi 2 mole elektronów pozwolą nam otrzymać 1
mol miedzi, tj. 63,55 g Cu, to odpowiednio 0,01 mola elektronów
pozwoli nam otrzymać - 0,6355 g Cu.
lub:
m = k·Q = k·I·t =
(M/z·F) ·I·t = (63,55 g/mol/2·96500C/mol)
·0,5A·3860s = 0,6366 g

38
Przykład 4
M
Ag
= 108
g/mol
M
Cu
=
63,5g/mol

39
Pewien metal tworzy chlorek o wzorze MeCl
2
. Podczas elektrolizy
roztworu tego chlorku na katodzie otrzymano 11,8g metalu, a na
anodzie 4,48 dm
3
tlenu (warunki normalne).
a) Oblicz, jaki ładunek przepłynął przez roztwór, zakładając 100%
wydajność prądową.
b) Oblicz masę molową metalu i podaj jego nazwę.
anoda:
2Cl
-
(c)
Cl
2(g)
+ 2e
-
Obliczamy ładunek m = kIt = (M
Cl2
/zF)Q → Q = m/(M
Cl2
/zF)
M
Cl2
=70 g Cl
2
22,4 dm
3
4,48dm
3
m g Cl
2
m = (4,48·70)/22,4 = 14 g chloru
Q = m/(M
Cl2
/zF) = (m·z·F)/M
Cl2
=(14·2·96500)/70 =
38600 C
katoda:
Me
2+
(c)
+ 2e
-
Me
(c)
(M
Me
/2) metalu
96500 C
38600 C
11,8 g metalu
M= (11,8·96500·2)/38600 =
59 g/mol
Kobalt
Przykład 7
40
Dane są następujące substancje:
I – kwas beztlenowy II – kwas tlenowy
III - wodorotlenek litowca IV – sól kwasu tlenowego i litowca
a) Podczas elektrolizy wodnego roztworu jednej z substancji stwierdzono
spadek jej stężenia. W doświadczeniu użyto substancji:
A. I
B. II C. III D. IV
b) Podczas elektrolizy wodnego roztworu jednej z substancji stwierdzono
wzrost pH roztworu. W doświadczeniu użyto substancji:
B. I
B.
II
C. III D. IV
c) Podczas elektrolizy wodnego roztworu jednej z substancji stwierdzono
spadek pH roztworu.
W doświadczeniu użyto substancji:
C. I B. II
C. III D. IV
d) Tzw. elektroliza wody nie zachodzi podczas prowadzenia elektrolizy
wodnego roztworu substancji:
A. I
B. II C. III D. IV
Elektroliza
kwasów
beztlenowych
:
K (-) 2H
+
+ 2e
H
2
A (+) 2Cl
-
- 2e
Cl
2
Elektroliza kwasów
tlenowych:
K (-) 4H
+
+ 4e 2
H
2
A (+) 2H
2
O - 4e 4
H
+
+
O
2
Elektroliza wodnych roztworów
zasad i soli litowców i kwasów
tlenowych
K (-) 2H
2
O + 2e 2
OH
-
+H
2
A (+) 4OH
-
- 4e 2H
2
O + O
2
Przykład 8
41
13.
Do 5 probówek o kolejnych numerach zawierających
roztwór HCl o stężeniu 2 mol/dm
3
wrzucono granulki
następujących metali: 1-Cu; 2-Mg, 3-Ag; 4-Zn; 5-Pt. W
wyniku reakcji metalu z kwasem wodór wydzielił się w
próbówkach:
(miejsce metali w szeregu napięciowym w kolejności
wzrastających potencjałów: Mg, Zn, H, Cu, Ag, Pt)
2 i 4*
1, 3 i 5
wszystkich z wyjątkiem 5
1; 2 i 4
tylko w probówce 2
Szereg napięciowy
metali
42
26.
W trakcie elektrolizy wodnego roztworu azotanu(V)
miedzi(II) prowadzonej na elektrodach
platynowych zachodzą reakcje:
(K – katoda; A – anoda; w nawiasach podano znaki
elektrod)
K(−) Cu
2+
+ 2e → Cu
A(+) 4OH
−
- 4e → O
2
+ 2H
2
O*
K(−) 2H
+
+ 2e → H
2
A(+) 4OH
−
- 4e → O
2
+ 2H
2
O
K(+) 4OH
−
- 4e → O
2
+ 2H
2
O
A(−) Cu
2+
+ 2e → Cu
K(−) 2H
+
+ 2e → H
2
A(+) Cu - 2e → Cu
2+
K(+) 2NO
3
−
- 2e → 3O
2
+ 2N
2
A(−) Cu
2+
+ 2e → Cu
Elektroliza wodnych roztworów soli:
- sole metali lekkich : K (-) 2H
2
O + 2e 2OH
-
+H
2
- sole metali ciężkich: K (-) Me
n+
+ ne Me
0
–
reszty kwasów tlenowych A (+) 4OH
-
- 4e
2H
2
O + O
2
43
27.
W ogniwie zbudowanym z elektrody kadmowej
zanurzonej do roztworu soli kadmu(II) i elektrody
srebrowej zanurzonej do roztworu soli srebra(I) będą
zachodzić procesy:
(potencjały standardowe: E
0
Cd/Cd2+
= −0,40V; E
0
Ag/Ag+
=
0,80V; A – anoda, K – katoda w nawiasach znaki
elektrod)
A(–): Cd → Cd
2+
+ 2e (utlenianie)
K(+): Ag
+
+ e → Ag (redukcja)*
A(–): Cd
2+
+ 2e → Cd (redukcja)
K(+): Ag → Ag
+
+ e (utlenianie)
A(–): Cd → Cd
2+
+ 2e (redukcja)
K(+): Ag
+
+ e → Ag (utlenianie)
A(–): Ag → Ag
+
+ e (utlenianie)
K(+): Cd
2+
+ 2e → Cd (redukcja)
A(–): Ag → Ag
+
+ e (redukcja)
K(+): Cd
2+
+ 2e → Cd (utlenianie)
Z położenia metali w szeregu napięciowym:
Metale o niższym potencjale normalnym wypierają z
roztworów metale o wyższym potencjale:
Cd+ 2Ag
+
→ Cd
2+
+ 2Ag
Większy potencjał
KATODA (+)
Mniejszy potencjał
ANODA (-)

Proszę przygotować samodzielnie
następujące tematy:
Akumulatory
Akumulator kwasowy: ołowiowy
Plantego;
akumulator zasadowy: żelazowo-
niklowy Edisona.
Korozja
1. Korozja chemiczna - szczególnie żelaza
2. Korozja elektrochemiczna
Stopów żelaza - różnorodne stale
Konstrukcji stalowych połączonych lub
powleczonych elementami metalowymi, np.
cynkowymi lub miedzianymi;
3. Ochrona metali przed korozją
niemetaliczne i metaliczne powłoki ochronne
(smary, farby, chromowanie, cynkowanie);
ochronę
elektrochemiczną
:
katodowa,
protektorowa
;
stosowanie inhibitorów
.
44

Akumulatory
Procesy
elektrodowe,
przebiegające
w
procesie
elektrolizy są procesami odwrotnymi do procesów
przebiegających w ogniwach galwanicznych. Pozwala to
skonstruować takie elektrochemiczne układy, które
pracując jako ogniwa dawałyby prąd elektryczny, a po
zużyciu
materiałów
można
by
je
regenerować
przeprowadzając proces elektrolizy.
Takimi ogniwami odwracalnymi są
AKUMULATORY
.
Najszersze zastosowanie znalazły:
akumulator ołowiowy Plantego;
akumulator żelazowo-niklowy Edisona.
Akumulator ołowiowy - kwasowy.
(-) Pb H
2
SO
4(aq)
PbO
2
, Pb
(+)
Elektrolit: 25%-wy roztwór kwasu siarkowego
45

Zaletami akumulatorów ołowiowych są:
prosta konstrukcja, niski koszt, wysoka sprawność energetyczna -
75% (stosunek pracy elektrycznej wykonanej podczas
rozładowania do pracy elektrycznej ładowania).
(-) Pb
0
+ SO
4
2-
= PbSO
4
+ 2e
(+) PbO
2
+ 4H
+
+ SO
4
2-
+ 2e = PbSO
4
+ 2H
2
O
a) Rozładowanie (praca) akumulatora
W miarę pracy akumulatora obie elektrody pokrywają się warstwą
siarczanu ołowiawego.
b) Ładowanie akumulatora polega na tym, że przepuszcza się
przezeń prąd stały z zewnętrznego źródła w kierunku odwrotnym niż
prąd pobierany. Reakcje przebiegają w kierunku przeciwnym.
Pb + PbO
2
+ 2H
2
SO
4
2PbSO
4
+
2H
2
O
ładowanie
rozładowan
ie
Reakcja
sumaryczna
:
46

Akumulatory zasadowe
Akumulator zasadowy : żelazowo-niklowy
(Edisona).
(-) Fe KOH
(aq)
Ni(OH)
3
(+)
Fe
0
+ 2Ni(OH)
3
Fe(OH)
2
+ 2Ni(OH)
2
Akumulator zasadowy : cynkowo-srebrowy
(Andrego).
(-) Zn KOH
(aq)
Ag
2
O Ag
(+)
Zn + Ag
2
O + 2KOH Ag + K
2
ZnO
2
+ H
2
O
Akumulatory zasadowe są droższe, ale lżejsze od
ołowiowego, ich sprawność nie przekracza 50%.
47

KOROZJA
Korozją nazywa się uszkodzenie tworzyw
stałych w skutek działania czynników
chemicznych.
Pojecie korozji dotyczy przede wszystkim metali i stopów,
choć stosuje się je także do tworzyw niemetalowych jak:
betony, materiały ceramiczne i tworzywa sztuczne.
Podziału zjawisk korozji można dokonać na podstawie:
mechanizmów korozji (chemiczna, elektrochemiczna);
środowisk korozyjnych (atmosfera, gleba, gazy, woda,
roztwory wodne, bezwodne ciecze organiczne);
charakteru zanieczyszczeń (korozja ogólna i lokalna);
rodzajów metali.
48

Związana jest z procesem utleniania tlenem (z powietrza),
chlorem, tlenkami siarki i azotu. Korozji chemicznej ulega
równomiernie cała powierzchnia metalu stykająca się z
czynnikiem korodującym – korozja ogólna.
Warunkiem koniecznym do powstawania produktów korozji
chemicznej jest obecność wody i tlenu.
Czynnikiem przyśpieszającym ten proces są jony wodorowe.
KOROZJA CHEMICZNA
Produktem korozji chemicznej żelaza jest tzw. rdza.
Rdza jest uwodnionym tlenkiem żelazowym a składzie:
Fe
2
O
3
xH
2
O często: 2Fe
2
O
3
3H
2
O
Korozja chemiczna żelaza
49

Etapy składające się na proces rdzewienia:
• pod wpływem wody powierzchnia żelaza ulega częściowemu
zjonizowaniu:
Fe(s) Fe
2+
+ 2e
• jony wodorowe wychwytują elektrony:
2H
+
+ 2e 2H
i przesuwają równowagę reakcji pierwszej w prawo.
Ponieważ wodór gazowy nie wydziela się w procesie rdzewienia, a
w warunkach beztlenowych korozja nie zachodzi, należy przyjąć,
że atomy wodoru wchodzą w reakcję z tlenem:
4H + O
2(g)
2H
2
O
Równanie ogólne rdzewienia żelaza:
4Fe
2 +
+ O
2
+ (4+2x) H
2
O 2 (Fe
2
O
3
xH
2
O)
(s)
+ 8H
+
Korozja chemiczna żelaza
50
KOROZJA ELEKTROCHEMICZNA
Większość procesów korozyjnych zachodzi w środowisku
wilgotnym i ma charakter elektrochemiczny.
Korozja elektrochemiczna polega na tworzeniu się
mikroogniwa -
ogniwa galwanicznego o schemacie:
(-) M
1
|przewodnik jonowy| M
2
(+)
gdzie: M
1
- metal roztwarzający się, a więc niszczony
M
2
- metal lub niemetal, którego obecność wywołuje
korozję
W przypadku gdy M
1
stanowi żelazo, rolę M
2
pełni węgiel, węglik
żelaza w stalach lub inne metale stanowiące powłoki
antykorozyjne.
E
M1
< E
M2
51

Korozja elektrochemiczna stali
Stale
- kryształy żelaza pozostające w bezpośrednim kontakcie z
węglem i elektrolitem tworzą
mikroogniwa
.
Mechanizm korozji elektrochemicznej stali:
kryształy żelaza :
anoda (-): Fe - 2e Fe
2+
kryształy węgla :
katoda (+):
H
+
+ e H
0
2H
0
+ 1/2 O
2
H
2
O
Równanie sumaryczne:
4Fe
2+
+ O
2(g)
+ (4 + 2x) H
2
O 2(Fe
2
O
3
xH
2
O)
(s)
+ 8H
+
jest w tym przypadku takie samo jak w korozji
chemicznej.
Szybkość procesu jest znacznie większa.
52

1. Metale o niższym potencjale od żelaza (cynk, chrom)
spełniają rolę anody w mikroogniwie i one ulegają korozji.
2. Metale o wyższym potencjale od żelaza (miedź, cyna,
nikiel) spełniają natomiast rolę katody i korozji ulega żelazo:
FeFe
2+
+2e,
podobnie jak w mikroogniwach na powierzchni stali.
W przypadku żelaza i innych metali korozja zależy od ich
potencjałów elektrochemicznych:
Dwa metale o różnym potencjale elektrochemicznym tworzą
również
mikroogniwa
Korozja elektrochemiczna konstrukcji
stalowych powleczonych innym metalem
53

OCHRONA METALI PRZED
KOROZJĄ
Do najważniejszych metod ochrony antykorozyjnej można
zaliczyć:
• niemetaliczne i metaliczne powłoki ochronne
(smary, farby,
chromowanie, cynkowanie);
• ochronę elektrochemiczną
:
katodowa, protektorowa
;
• stosowanie inhibitorów
.
Niemetaliczne powłoki ochronne
mają za zadanie izolowanie
powierzchni metalu od dostępu tlenu i wilgoci. Stosuje się farby,
lakiery, minię, smołę, emalie i inne tworzywa.
Metaliczne powłoki ochronne
spełniają podobną rolę, z tym
że powłoki o potencjale niższym (cynk) spełniają rolę anody w
mikroogniwie, jeżeli powłoka ulegnie uszkodzeniu. Powłoki z
metali o wyższym potencjale (miedź) spełniają natomiast rolę
czysto mechaniczną tak jak powłoki niemetaliczne.
54
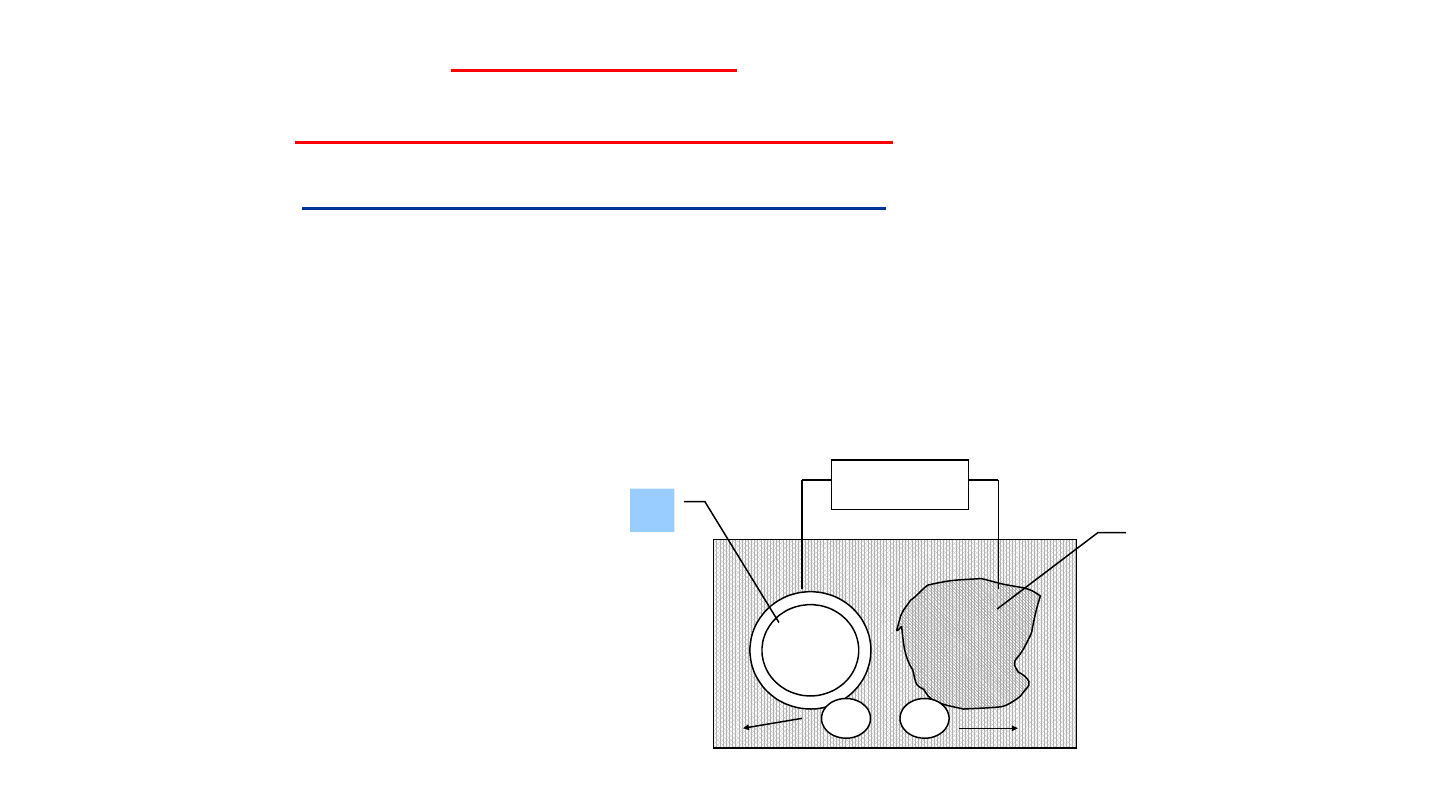
Elementy konstrukcji narażone na korozję łączy się z ujemnym
biegunem źródła prądu stałego o napięciu rzędu 1 - 2 V. Dodatni
biegun łączy się z grafitową płytą przylegającą do konstrukcji.
Elektrony doprowadzane ze źródła prądu zapobiegają utlenieniu
żelaza (korozji), czyli reakcji: FeFe
2+
+2e.
Ochrona
elektrochemiczna
Ochrona katodowa.
Schemat ochrony katodowej
rurociągu podziemnego:
1-rurociąg
2-zasilacz prądu stałego
3-anoda
(+)
(–)
+
–
Redukcj
a
Utlenieni
e
3
1
2
Metodą tą można chronić rurociągi podziemne, zbiorniki na wodę,
kadłuby statków itp..
55
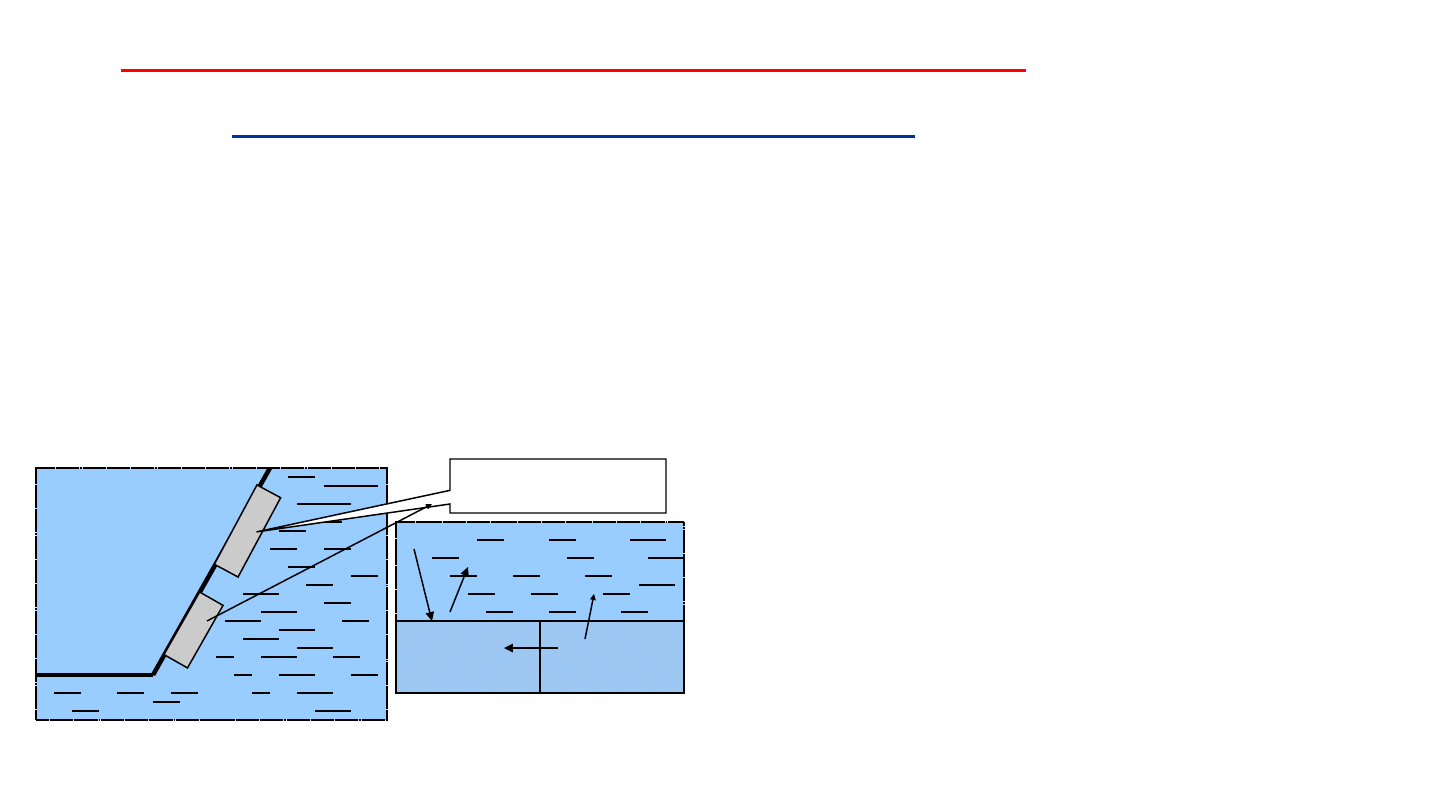
Do chronionego elementu przytwierdza się tzw. protektor - blok z
metalu o niższym od żelaza potencjale standardowym (magnez, cynk
lub glin). Protektor stanowi anodę zwartego ogniwa i sam zużywa się
przechodząc do roztworu (woda gruntowa, morska).
Na powierzchni żelaza zachodzi proces katodowej redukcji
tlenu i ewentualnie jonów H
+
. Produktem procesu anodowego
są kationy metalu protektora.
Ochrona elektrochemiczna
Ochrona protektorowa
F
e
Mg
e
Mg
2+
O
2
OH
-
Protektor z Mg
Kadłub
stalowy
Kadłub
stalowy
Protektor z Mg
Schemat ochrony
protektorowej stalowego
kadłuba (a)
i jej mechanizm (b)
(a)
(b)
56

Stosowanie inhibitorów.
Inhibitorami korozji
nazywamy substancje,
które dodane w stosunkowo niewielkich ilościach
do środowiska korozyjnego zmniejszają jego
agresywność.
Wykorzystuje się substancje silnie adsorbujące
się na powierzchni metalu i blokujące dostęp
jonów wodorowych (substancje powierzchniowo
aktywne, wielkocząsteczkowe związki tworzące
nierozpuszczalne osady z jonami metalu).
Stosuje się np.:
w kotłach parowych - centralne ogrzewanie;
w instalacjach chłodniczych - samochody.
Ciecz znajdująca się w zamkniętym obiegu stanowi
środowisko sprzyjające korozji.
57
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
Wyszukiwarka
Podobne podstrony:
BELKA DRUGORZEDNA BEZ KOLORU 2
POLACZENIA SPOINY BEZ KOLORU
POLACZENIE BELKI BEZ KOLORU
POLACZENIE SRUBY BEZ KOLORU
5 Elektrolity bez kolor
Aktywność elektryczna bez tętna(PEA), RATOWNICTWO MEDYCZNE
Elektryczny bez Elektrotechniki sem I
SLUP S1 bez koloru 2
POLACZENIE SRUBY BEZ KOLORU
5 Elektrolity bez kolor
Postępowanie w czynnościach elektrycznych bez tętna
2a bez tabelki, WYDZIAŁ ELEKTROTECHNIKI I INFORMATYKI PL
Elementy bez-oczowe w elektronice- Czyli gawrych (Âci-ga), Ściągi do szkoły, Układ Sterowania i Regu
Kody błędów pralek WHIRLPOOL z diodami LED bez wyświetlacza (PL), Elektronika(1), • Kody błędów
Ściągi z fizyki-2003 r, Moje życie bez elektryczności
więcej podobnych podstron