
ELEKTROLITY
Teoria dysocjacji
elektrolitycznej
Arrheniusa.
Iloczyn jonowy wody, pH.
Reakcje jonowe - hydroliza.
Iloczyn rozpuszczalności.
Roztwory buforowe.
Protonowa teoria kwasów i
zasad.
1

Elektrolity
Z
punktu
widzenia
zdolności
do
przewodzenia
prądu
elektrycznego
substancje można podzielić na:
• nieprzewodzące
prąd
elektryczny
(
dielektryki
)
• przewodzące
prąd
elektryczny
(
przewodniki).
Biorąc
pod
uwagę
mechanizm
przewodzenia prądu
przewodniki dzielimy
na dwie klasy:
•
substancje przewodzące prąd za pomocą
swobodnych
elektronów
(brak
zmian
chemicznych w przewodniku);
•
ELEKTROLITY
, tj. substancje, które w
roztworach lub w stanie stopionym
przewodzą
elektryczność
za
pomocą
jonów.
2

Teoria dysocjacji
elektrolitycznej Arrheniusa
Zdolność do przewodzenia prądu elektrycznego przez wodne
roztwory elektrolitów objaśnia
teoria Arrheniusa
(1887 r.)
Dysocjacja elektrolityczna
: proces, w
którym niektóre związki chemiczne
ulegają w wodzie (lub w innym
rozpuszczalniku) samorzutnemu
rozpadowi na jony.
W praktyce elektrolitami są:
• kwasy tlenowe,
•
wodorki
kwasowe
(wodorki
fluorowców i tlenowców),
• wodorotlenki i sole.
3

• kwasy
dysocjują na jon hydroniowy H
3
O+ i jon
reszty kwasowej:
HX H
+
+ X
-
HX + H
2
O
H
3
O+ + X
-
Ponieważ X- zawiera niekiedy wodór zdolny do
dysocjacji może być również kwasem (HSO
4
-,
H
2
PO
4
-)
Założenia teorii
Arrheniusa:
• zasady
dysocjują na jony hydroksylowe OH- i
kationy metaliczne (Me+):
MeOH
Me+ + OH
-
• sole
dysocjują na metaliczne kationy i aniony reszt kwasowych:
MeX
Me+ + X
-
4

Teoria
dysocjacji
Arrheniusa
nie jest dostatecznie ogólna
, nie
uwzględnia bowiem takich roztworów :
kwaśnych jak
CO
2
w H
2
O
lub zasadowych jak
NH
3
w H
2
O
,
bowiem w tych przypadkach praktycznie nie
istnieją cząsteczki H
2
CO
3
i NH
4
OH zdolne do
dysocjacji.
Uogólniona postać teorii dysocjacji
elektrolitycznej Arrheniusa
Stąd:
Substancje, które zwiększają stężenie
jonów wodorowych, są nazywane
kwasami
natomiast
te,
które
zwiększają
stężenie
jonów
wodorotlenowych
są
nazwane
zasadami.
5

1. Mechanizm procesu dysocjacji cząsteczek
o wiązaniu jonowym:
Następuje otaczanie jonów przez dipole
wody i wyrywanie z sieci krystalicznej:
NaCl Na+ + Cl-
Dysocjacji elektrolitycznej
ulegają związki o wiązaniu
jonowym i kowalencyjnym
spolaryzowanym
2. Mechanizm dysocjacji cząsteczek
biegunowych o wiązaniu
spolaryzowanym
Dipole wody rozrywają wiązanie
kowalencyjne bardzo silnie
spolaryzowane:
HCl + H
2
O H
3
O+ + Cl
-
6
Wielkość
jest podstawą podziału elektrolitów na:
•elektrolity mocne
= 0,6 - 1,0
(60% - 100%)
•elektrolity średniej mocy
0,05 < <
0,6 (5 - 60%)
•elektrolity słabe
< 0,05
( <5%)
Moc elektrolitów porównuje się dla roztworów o stężeniu
1 mol/dm3.
Efektywność procesu dysocjacji elektrolitycznej w
określonym rozpuszczalniku polarnym może
być charakteryzowana przez:
stopień dysocjacji () i stałą dysocjacji
(K
d
)
n
- całkowita liczba moli elektrolitu
.
n
n
n
n
1
1
1
0
0
%
l
u
b
n
1
- liczba moli
cząsteczek elektrolitu,
które uległy
dysocjacji;
7

Wielkość stopnia dysocjacji zależy od:
1
- rodzaju elektrolitu
2
- rodzaju rozpuszczalnika
3
- temperatury
4
- stężenia elektrolitu
Stopień dysocjacji
Rodzaj elektrolitu
Różne elektrolity charakteryzują się różnymi
wartościami stopnia dysocjacji.
Np. w danej temperaturze i dla tego samego
stężenia, HCl jest zdysocjowany w wodzie w
100%, podczas gdy HF - 8%.
Temperatura
Na ogół dysocjacja rośnie ze wzrostem
temperatury.
8
Rodzaj rozpuszczalnika
Im
większa
jest
stała
dielektryczna
rozpuszczalnika
tym
większy
jest
stopień
dysocjacji rozpuszczonego elektrolitu. Woda
posiada dużą stałą dielektryczną (D=81) i dlatego
sprzyja
to
procesowi
dysocjacji.
Np.
w
porównywalnych warunkach, HCl w wodzie jest
zdysocjowany w 100%, a w benzenie
jest
mniejsze od 1%.
Stopień dysocjacji
Stężenie
Stopień dysocjacji zawsze rośnie, gdy maleje
stężenie elektrolitu.
1M - 0,4%
0,1M - 1,3%
0,01M - 4,3%
0,001M - 15%
0,00001M-75%
Zależność stopnia dysocjacji
od stężenia roztworu kwasu
octowego:
Stopień dysocjacji w roztworach
nieskończe-nie rozcieńczonych
osiąga wartości ok.100%.
9

Rozpad
słabego elektrolitu
na jony jest
reakcją odwracalną
.
W stanie równowagi istnieją:
jony powstałe w procesie dysocjacji - cząsteczki
niezdysocjowane
CH
3
COOH H
+
+ CH
3
COO
-
H
2
S 2H
+
+ S
2-
K
[H
][C
H
C
O
O
]
[C
H
C
O
O
H]
K
[H
][S]
[H
S]
C
H
C
O
O
H
3
3
H
S
2
2
3
2
2
[H
+
]; [CH
3
COO
-
]; [S
2-
]- stężenie
jonów; mol/dm
3
[CH
3
COOH]; [H
2
S] - stężenie
cząstek niezdysocjowanych;
mol/dm3
Stała równowagi procesu dysocjacji nosi nazwę
STAŁEJ DYSOCJACJI
i jest oznaczana symbolem K
d
.
STAŁA DYSOCJACJI - jest to stosunek iloczynu stężeń jonów na
które dysocjuje elektrolit do stężenia cząstek niezdysocjowanych w
momencie równowagi (T=const.).
10

Prawo rozcieńczeń
Ostwalda
Związek między stopniem dysocjacji , stężeniem molowym
elektrolitu
c
0
oraz stałą dysocjacji
K
d
wyraża prawo rozcieńczeń
Ostwalda.
Po podstawieniu:
K
d
H
A
2
0
1
c
Uogólniona postać prawa
rozcieńczeń Ostwalda
W roztworach słabych elektrolitów, można przyjąć, że
1
1
K
c
d
H
A
2
0
wówczas
Uproszczona postać prawa
rozcieńczeń Ostwalda
)
1
(
]
[
;
]
[
]
[
0
0
0
0
c
c
c
HA
c
A
H
[HA]
]
[A
]
[H
K
HA
d
gdzie:
Słaby kwas dysocjuje:
HA
H
+
+ A
-
11

Iloczyn jonowy wody. pH
Woda
tylko w niewielkim stopniu ulega dysocjacji na jony H+ i
OH- (pomiar przewodnictwa elektrycznego).
H
2
O H+ + OH-
Wskutek hydratacji wodoru powstają jony hydroniowe:
2H
2
O
H
3
O
+
+ OH
-
Wobec bardzo małego stopnia dysocjacji H
2
O ( = 1,810
-9
)
zawartość niezdysocjowanych cząstek wody [H
2
O] jest stała i
równa 55,56 mol/dm
3
.
16
2
2
3
10
8
,
1
]
[
]
[
]
[
2
O
H
OH
O
H
d
K
O
H
Stosując prawo równowagi chemicznej do reakcji dysocjacji wody
otrzymujemy:
12

Iloczyn jonowy wody. pH
Jeżeli:
[H
+
] = [OH
-
] =
10
-7
mol/dm
3
- odczyn roztworu jest
obojętny
[H
+
] > [OH
-
]; [H
+
] >
10
-7
mol/dm
3
- odczyn r-ru
jest
kwaśny
[H
+
] < [OH
-
]; [H
+
] <
10
-7
mol/dm
3
- odczyn r-ru
jest
zasadowy
Iloczyn stężenia jonów wodorowych
i wodorotlenowych jest wielkością stałą nie tylko w wodzie,
ale również w wodnych roztworach elektrolitów.
Wartość ta jest
stała w danej temperaturze i nosi nazwę
iloczynu
jonowego wody
K
W
= [H
3
O
+
][OH
-
] = 1*10
-14
mol
2
/(dm
3
)
2
(T=298K)
[H
3
O
+
][OH
-
] = K
d.H
2
O
[H
2
O]
2
= 1,8*10
-16
(55,56)
2
= 1
10
-14
mol
2
/(dm
3
)
2
Stąd iloczyn jonowy wody wyniesie:
13
Sorensen (1909 r.) w celu uproszczenia obliczeń
wprowadził pojęcie wskaźnika pH zwanego
wykładnikiem stężenia jonów
wodorowych - pH
:
jest to ujemny logarytm ze stężenia jonów
wodorowych albo logarytm z odwrotności
stężenia jonów wodorowych.
]
[H
1
log
]
log[H
pH
Logarytmując iloczyn jonowy wody otrzymujemy
prostą zależność:
pH + pOH = 14
]
[OH
1
log
]
log[OH
pOH
Podobnie wykładnik stężenia jonów
wodorotlenowych:
Skala pH obejmuje roztwory od silnie kwaśnych pH
= 0 ([H
3
O+]=1mol/dm3) do roztworów silnie
alkalicznych o pH = 14 ([H
3
O+] = 10-14 mol/dm3).
W roztworach obojętnych pH=7 ([H
3
O+]=10-7
mol/dm3).
14
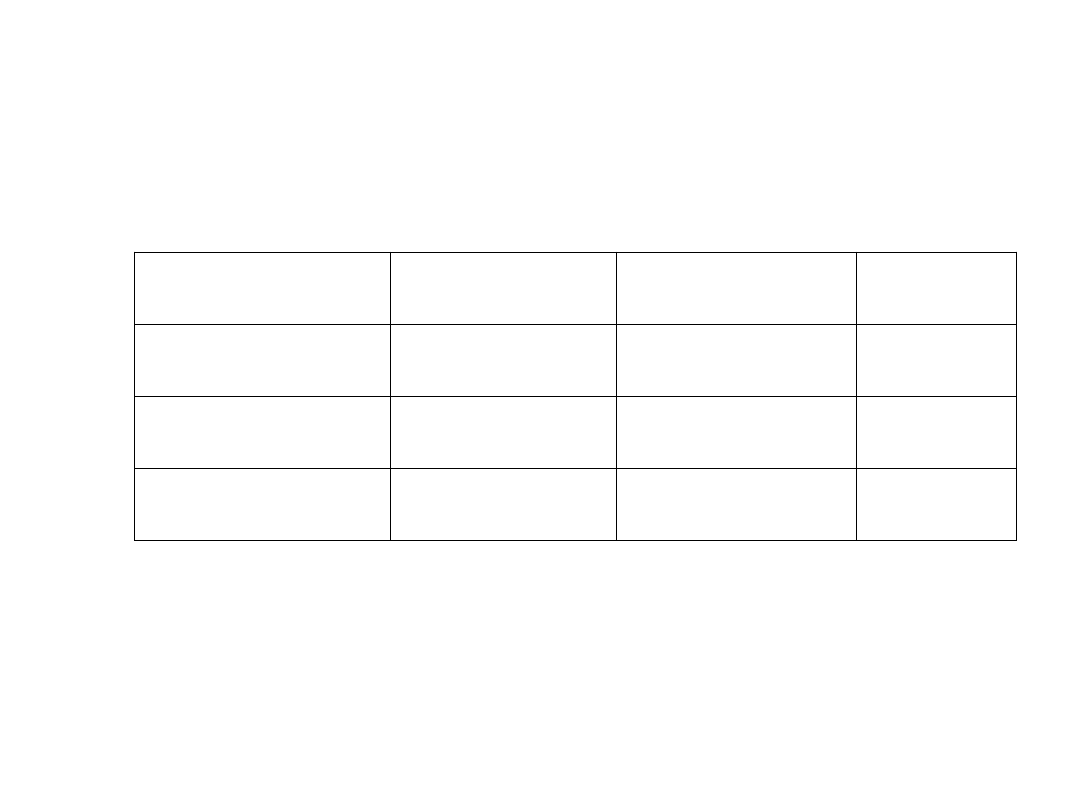
Przybliżonym sposobem ustalenia pH danego roztworu jest
zastosowanie do tego celu
wskaźników alkacymetrycznych
(indykatorów).
Są to związki organiczne, które zmieniają swoje
zabarwienie w zależności od stężenia jonów H+ czy OH.
Wskaźnik
Zmiana barwy
w zakresie pH
Roztwór kwaśny Roztwór
zasadowy
błękit tymolowy
1,2-2,8
pomarańczowe
czerwone
żółte
oranż metylowy
3,1-4,
4
pomarańczowe
czerwone
żółte
fenolftaleina
8,2-10
(
różowe)
bezbarwne
czerwono-
fioletowe
Metoda potencjometryczna pomiaru pH – pomiar SEM ogniwa,
w którym potencjał jednej elektrody jest funkcją pH.
15

REAKCJE
JONOWE
Reakcje zobojętniania.
Reakcje kwasów i zasad z solami.
Reakcje związków amfoterycznych z kwasami i z
zasadami.
Reakcje soli z solami.
Reakcje hydrolizy.
Wodny roztwór elektrolitu można rozpatrywać jako mieszaninę dwu
niezależnych od siebie części składowych: kationów i anionów, które
biorą udział w reakcjach zupełnie samodzielnie.
Warunkiem przebiegu reakcji jonowych jest tworzenie się
cząsteczki, która nie ulega dysocjacji w roztworze .
16

REAKCJE JONOWE
Reakcje między zasadami i kwasami
Są to reakcje zobojętnienia, czyli tworzenia się niezdysocjowanej
wody:
kwas + zasada = sól + woda
Reakcja polega na łączeniu się w środowisku wodnym H+ z OH-
na słabo zdysocjowaną cząsteczkę wody:
H+ + OH- = H
2
O + 56,9 kJ
W postaci jonów pozostają w wodzie jony zdysocjowanej soli:
Np.: Na+ OH- + H+ Cl- = Na+ Cl- + H
2
O
Reakcje soli z solami
W wyniku tych reakcji tworzą się słabo rozpuszczalne w wodzie
sole:
Np.: Ag NO
3
+ NaCl = AgCl + NaNO
3
jonowo: Ag+ + Cl- = AgCl
Na
2
CO
3
+ CaCl
2
= CaCO
3
+ 2NaCl
jonowo: Ca2+ + CO
3
2- = CaCO
3
17

sól +kwas = nowa sól + nowy kwas
sól + zasada = nowa sól + nowa zasada
Te reakcje podwójnej wymiany możliwe są tylko wtedy, gdy
przynajmniej jeden z produktów reakcji powstaje w formie
gazowej
lub w postaci osadu
i w tej formie usuwany jest ze środowiska
reakcji
oraz
w
formie
niezdysocjowanej
cząsteczki
i przesuwa równowagę reakcji w prawo.
Np.: Na
2
CO
3
+ 2HCl = 2NaCl + CO
2
+ H
2
O
CO
3
2- + 2H+ = CO
2
+ H
2
O
FeCl
2
+ 2NaOH = 2NaCl + Fe(OH)
2
Fe2+ + 2OH- = Fe(OH)
2
CH
3
COONa + HCl = NaCl + CH
3
COOH
CH
3
COO- + H+ = CH
3
COOH
Reakcje kwasów i zasad z solami
a)
b)
c)
18
Reakcje związków
amfoterycznych z kwasami i
zasadami
Wodorotlenki niektórych pierwiastków mogą reagować zarówno z
kwasami, jak i zasadami, tworząc z nimi łatwo rozpuszczalne sole.
Takie substancje noszą nazwę związków amfoterycznych.
W środowisku silnej zasady związki amfoteryczne
zachowują się jak słaby kwas, w środowisku silnego kwasu
natomiast zachowują się jak słaba zasada.
Zn(OH)
2
+ 2HCl ZnCl
2
+ 2H
2
O
Zn(OH)
2
+ 2H+ Zn2+ + 2H
2
O
______________________________
Zn(OH)
2
+ 2NaOH Na
2
ZnO
2
+ 2H
2
O
Zn(OH)
2
+ 2OH- ZnO
2
2- + 2H
2
O
Wodorotlenek
cynku
Wodorotlenek
glinu
19
Istota procesu polega na połączeniu się
jonów, pochodzących z dysocjacji soli,
z
jonami H+ lub OH-
(z dysocjacji wody) i
utworzeniu
niezdysocjowanych
cząsteczek
odpowiednich
słabych kwasów i słabych
zasad.
Reakcje
hydrolizy
Z jonami wody wytworzonymi w procesie jej
dysocjacji mogą wiązać się tylko aniony
słabych kwasów i kationy metali tworzących
słabe zasady.
Zatem hydrolizie ulegają tylko sole:
mocnego kwasu i słabej zasady
słabego kwasu i mocnej zasady
słabego kwasu i słabej zasady
Nie hydrolizują sole mocnych kwasów i
mocnych zasad.
20

Ogólnie:
W wyniku hydrolizy soli mocnych
kwasów i słabych zasad powstały roztwór
przybiera
odczyn kwaśny
. Z jonami wody
reaguje kation wiążący jony OH- wg schematu:
Me+ + HOH MeOH +
H+
NH
4
+ +
Cl- + HOH NH
4
OH +
H+
+ Cl-
NH
4
+ + HOH NH
4
OH +
H+
pH < 7
1. Hydroliza soli mocnego
kwasu i słabej zasady -
-
hydroliza kationowa
(np.:NH
4
Cl)
- w wyniku dysocjacji NH
4
Cl ustala się
równowaga:
NH
4
Cl NH
4
+ + Cl-
- istniejące w wodzie jony H+ i OH- łączą się z
produktami dysocjacji: NH
4
+ + OH-
NH
4
OH
NH OH
4
13%
,
HCl
92%
H+ + Cl- jony te nie łączą się ze sobą, ponieważ
21
CH
3
COO- + Na+ + HOH CH
3
COOH +
Na+ +
OH-
CH
3
COO- + HOH CH
3
COOH +
OH-
pH>7
Z uwagi na nadmiar w roztworze jonów
wodoro-tlenowych (
NaOH
= 91%) odczyn
środowiska ma charakter zasadowy.
Z wodą reaguje w tym przypadku anion wg
schematu:
A- + HOH HA +
OH-
2. Hydroliza soli słabego
kwasu i mocnej zasady-
hydroliza
anionowa
(np.:CH
3
COONa)
22

3. Hydroliza soli słabego
kwasu i słabej zasady
W tym przypadku w reakcji hydrolizy uczestniczy
kation i anion soli wiążąc jony H+ i OH-
pochodzące z dysocjacji wody:
Odczyn roztworu w wyniku hydrolizy takiej
soli może być:
kwaśny
, gdy powstająca w reakcji zasada jest
słabsza niż tworzący się kwas;
zasadowy
, gdy tworzący się kwas jest słabszy
w porównaniu z zasadą.
Np. hydroliza octanu żelaza(III):
Fe3++3CH
3
COO- +3HOH Fe(OH)
3
+3H+
+3CH
3
COO-
pH < 7
ponieważ:
5
COOH
3
CH
d
11
3
Fe(OH)
d
10
1,75
K
;
10
1,82
K
COOH
3
CH
3
Fe(OH)
d
d
K
K
23
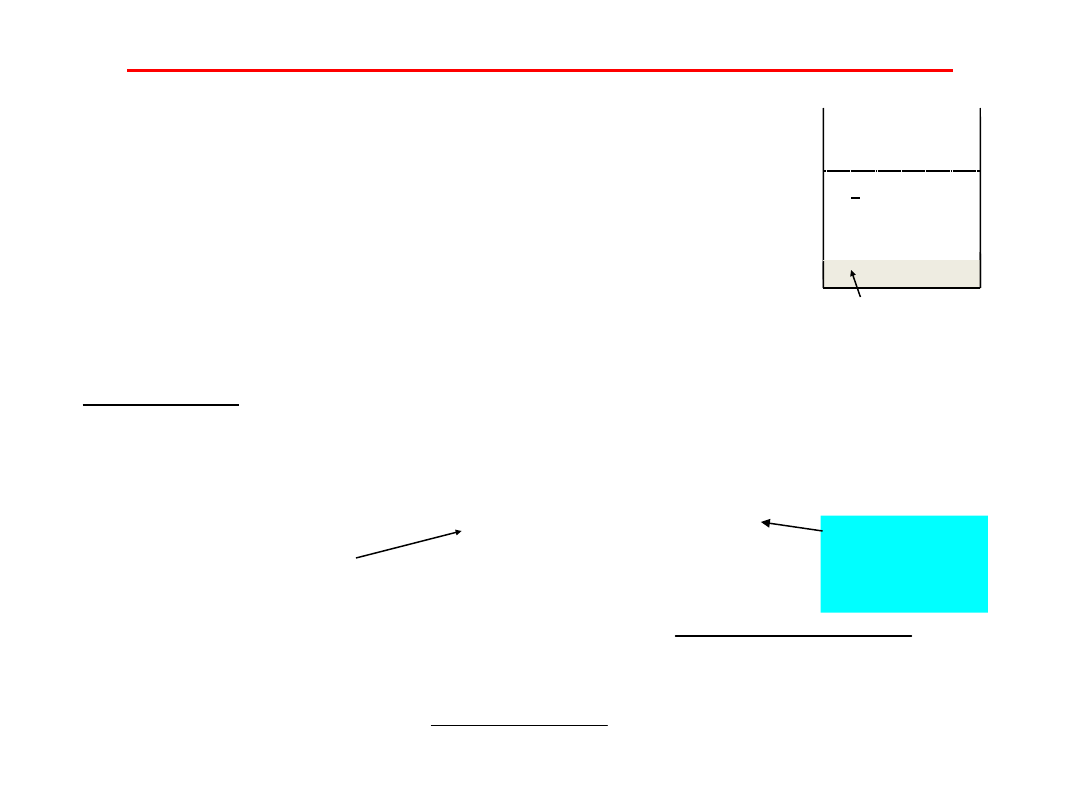
Iloczyn rozpuszczalności
Jeżeli stały trudno rozpuszczalny
elektrolit
zbudowany
z
jonów
umieści się w wodzie, to ustali się
równowaga pomiędzy jonami w
roztworze nasyconym i substancją
stałą będącą w nadmiarze:
BaSO
4
Ba2
+ SO
4
2-
BaSO
4
(s) Ba2+
(aq.)
+ SO
4
2-
(aq.)
Ogólnie:
Jeżeli cząsteczka związku A
m
B
n
tworzy w procesie
dysocjacji m kationów A i n anionów B,
A
m
B
n
mA+ +
nB-
Ciało
stałe
Roztw
ór
K
A
B
A
B
m
n
m
n
[ ] [ ]
[
]
Stała równowagi przybiera postać:
]
[BaSO
]
][SO
[Ba
K
(s)
4
2
4
2
4
BaSO
Dla BaSO
4
24

L
- iloczyn rozpuszczalności, określa liczbowe wartości
iloczynu stężeń jonów w odpowiednich potęgach w
roztworze nasyconym elektrolitu trudno rozpuszczalnego w
danej temperaturze.
Iloczyn rozpuszczalności charakteryzuje zatem równowagę
pomiędzy trudno rozpuszczalnym elektrolitem w stanie
stałym i jego jonami w roztworze nasyconym.
[A+]m.[B-]n
= K [A
m
B
n
] =
L = const.
[Ba2+][SO
4
2-]
= K
BaSO4
[BaSO
4
(s)] =
L
BaSO4
gdzie: L,L
BaSO4
- iloczyn rozpuszczalności;
Jest to wartość stała w stałej temp. i dla danego elektrolitu
Mianownik oraz stała równowagi poprzednich zalezności mają
wartość stałą, więc:
Iloczyn rozpuszczalności
25

Iloczyn rozpuszczalności
Znaczenie praktyczne
1.
Iloczyn
rozpuszczalności
charakteryzuje
rozpuszczalność
słabego elektrolitu w wodzie w danej
temperaturze.
Im większa jest jego wartość tym większa
jest rozpuszczalność danej soli. Znajomość
iloczynu
rozpuszczalności
umożliwia
obliczanie stężenia jonów w roztworze
nasyconym.
Np.: L
AgCl
=
1,610-10
L
CaCO3
=
4,810-9
L
CaSO4
=
6,310-5
Rozpuszczalność CaSO
4
jest największa, a AgCl
jest mniej rozpuszczalne
niż CaCO
3
26

2. Wytrącanie osadu
z roztworu nasyconego
następuje wtedy, gdy iloczyn stężeń jonów tego
elektrolitu osiągnął wartość większą od iloczynu
rozpuszczalności,
czyli
gdy
iloczyn
rozpuszczalności
danego
elektrolitu
został
przekroczony.
Np.: Mamy r-r AgNO
3
i dodajemy NaCl.
Początkowo osad AgCl nie wytrąca się, czyli
[Ag+][Cl
-
]<L
AgCl
= 1,610-10
Wytrącanie osadu rozpocznie się od momentu
gdy:
Iloczyn stężenia jonów zrówna się i przekroczy
iloczyn rozpuszczalności AgCl, czyli:
[Ag+][Cl
-
]L
AgCl
= 1,610-10
Iloczyn rozpuszczalności
Znaczenie praktyczne
27

3.
Rozpuszczanie osadu
zachodzi, gdy następuje
zmniejszenie
stężenia
któregokolwiek
ze
składowych jonów. Wtedy iloczyn stężeń jonów w
roztworze
staje
się
mniejszy
od
iloczynu
rozpuszczalności i równowaga pomiędzy osadem a
roztworem zostaje zachwiana.
Iloczyn rozpuszczalności
Znaczenie praktyczne
Np.: Mamy osad CaCO
3
w wodzie. Iloczyn stężenia
jonów
w
roztworze
jest
równy
iloczynowi
rozpuszczalności, czyli:
[Ca
2+
][CO
3
2-
]= L
CaCO3
= 4,810
-9
. Dodajemy roztworu
HCl. Zachodzi reakcja: CO
3
2-
+ 2H
+
= CO
2
+ H
2
O, więc
maleje stężenie jonów węglanowych, czyli cały czas:
[Ca
2+
][CO
3
2
-]< L
CaCO3
= 4,810
-9
.
Układ jednak zgodnie
z regułą przekory dąży do uzupełnienia ilości jonów
CO
3
2-
przez rozpuszczanie osadu CaCO
3
.
28
4.
Osad np.BaSO
4
jest mniej rozpuszczalny w
roztworze Na
2
SO
4
niż w czystej wodzie.
Jest to przykład
efektu wspólnego jonu
. Polega
on na zmniejszeniu rozpuszczalności soli w
obecności innej soli, która dysocjując wytwarza
taki sam jon jak sól badana.
Iloczyn rozpuszczalności
Znaczenie praktyczne
BaSO
4
Ba
2
+
SO
4
2
-
Na
2
SO
4
Dlatego siarczan barowy jest mniej rozpuszczalny
w roztworach zawierających jony Ba
2+
lub SO
4
2-
niż
w wodzie.
Przed dodaniem
Na
2
SO
4
:
[Ba
2+
]
[SO
4
2-
]=L
BaSO4
Po dodaniu
Na
2
SO
4
stężenie jonów SO
4
wzrośniei układ zgodnie z regułą
przekory będzie dążył do zniwelowania
tego zjawiska poprzez łączenie jonów
SO
4
z jonami barowymi, a więc osad
będzie się wytrącał, a iloczyn
rozpuszczalności malał.
29

Roztwory buforowe
Þ
zachowują prawie stałą wartość pH mimo
dodatku mocnych kwasów i zasad; dodatek ten
jednak musi być utrzymany w pewnych
granicach - pojemność buforu;
Þ
zachowują stałą wartość pH także przy
rozcieńczaniu i przy zagęszczaniu;
Þ
wartość pH tej mieszaniny zależy od stosunku
stężeń soli i kwasu lub soli i zasady.
Są to mieszaniny roztworów słabych kwasów
(zasad) i soli, które posiadają następujące
właściwości:
30
1. Roztwory buforowe składające się
ze
słabego kwasu i soli tego kwasu z
mocną zasadą:
Stała dysocjacji kwasu octowego:
]
3
[
]
3
][
[
COOH
CH
COO
CH
H
kw
d
K
Od czego zależy pH tego buforu?
s
3
COONa
CH
kw
3
COOH
CH
c
]
COO
[CH
c
i
c
COOH]
[CH
c
3
3
Można przyjąć, że:
kw
s
kw
d
c
c
]
[H
K
s
kw
kw
d
c
c
log
logK
pH
Stąd:
Dobierając odpowiedni stosunek stężenia kwasu i soli
możemy otrzymać roztwór buforowy o żądanej
wartości pH. Przy rozcieńczaniu takiego roztworu
stosunek C
s
/C
kw
pozostaje stały, a tym samym i
stężenie jonów wodorowych nie ulega zmianie.
Dodatek mocnego elektrolitu, jakim jest CH
3
COONa, powoduje zupełne
niemal cofnięcie dysocjacji kwasu octowego (reguła przekory).
005
,
0
3
COOH
CH
Np.:
bufor octanowy -
0,5 mola CH
3
COOH + 0,5 mola
CH
3
COONa w 1 dm3 mieszaniny:
CH
3
COONa CH
3
COO- + Na+
CH
3
COOH CH
3
COO- + H+
1
31
Dodanie
do
takiego
roztworu
buforowego
niewielkich ilości silnego kwasu praktycznie nie
zmieni pH, ponieważ jony H+ będą wiązane przez
jony
CH
3
COO-
z
utworzeniem
słabo
zdysocjowanego CH
3
COOH.
Podobnie dodanie zasady spowoduje wiązanie
jonów OH- przez CH
3
COOH.
Mechanizm buforowania
CH
3
COO- + H
3
O+ CH
3
COOH + H
2
O
CH
3
COOH + OH- CH
3
COO- + H
2
O
MeOH
HA
CH
3
COOH/CH
3
COO
-
32
2. Roztwory buforowe zawierające
słabą zasadę
i
sól tej zasady z mocnym
kwasem
a stąd:
K
O
H
c
c
d
z
a
s
s
z
a
s
[ ]
[ ]
O
HK
c
c
d
z
a
s
z
a
s
s
s
zas
zas
d
c
c
K
pH
log
log
14
Wzór na obliczanie pH
buforu zasadowego
Logarytmując to równanie i przekształcając otrzymamy:
Stałą dysocjacji wodorotlenku amonowego w obecności chlorku
amonowego można wyrazić równaniem:
Rozcieńczenie buforu również nie zmieni wartości jego pH,
ponieważ stosunek stężeń zasady i soli nie ulegnie zmianie.
NH
4
Cl NH
4
+ + Cl-
NH
4
OH NH
4
+ + OH-
OH]
[NH
]
][OH
[NH
K
4
4
zas
d
Można przyjąć, że :[NH
4
+] = C
s
oraz [NH
4
OH] = C
zas
np.
bufor amonowy:
NH
4
OH i NH
4
Cl.
1
<<1
33
Mechanizm buforowania
Dodanie kwasu lub zasady oraz rozcieńczanie
tego buforu nie zmieni jego pH.
NH
4
+ + OH- NH
3
+ H
2
O
Następuje wiązanie jonów H+ i OH- przez jony i
cząsteczki obecne w buforze.
MeOH
HA
NH
4
+/NH
3
NH
3
+ H
3
O+ NH
4
+ + H
2
O
34

Najczęściej stosowanymi roztworami buforowymi
są:
- bufor octanowy CH
3
COOH + CH
3
COONa
zakres pH=3,6 - 5,6
- bufor amoniakalny NH
3
+ NH
4
Cl:
zakres pH=8,0-10,0
- bufor fosforanowy KH
2
PO
4
+ Na
2
HPO
4
zakres pH = 4,8 - 8,0
- bufor boranowy HCl + Na
3
BO
3
zakres pH=7,7-9,2
Roztwory buforowe
Roztwory buforowe odgrywają szczególnie ważną
rolę w biochemii i w przemyśle farmaceutycznym,
gdzie
często
przeprowadza
się
procesy
chemiczne
wymagające
stałej
kwasowości
środowiska.
35

PROTONOWA TEORIA KWASÓW I
ZASAD
Kwas definiowany jest jako cząstka, która
jest donorem protonów, a zasadą jest
każda cząstka, która jest akceptorem
protonów.
W 1923 r J.N.Brönsted zaproponował powszechnie dzisiaj
stosowaną definicję kwasów i zasad.
W układzie Brönsteda "dysocjacja" kwasu HX nie jest więc prostym
rozpadem na H+ i X-, lecz raczej przeniesieniem protonu od HX do
cząsteczki rozpuszczalnika, który odgrywa rolę zasady:
HX
+ H
2
O H
3
O+ + X-
kwas 1 zasada 2 kwas 2 zasada 1
W reakcji tej HX jest kwasem, a H
2
O - zasadą.
W reakcji odwrotnej H
3
O+ jest kwasem, a X- zasadą.
36
Zgodnie z teorią protonową stosunek między
kwasem a zasadą określony jest schematem:
Kwas proton + zasada
HX H+ + X
-
Układ taki nazywany jest:
SPRZĘŻONĄ PARĄ KWAS -ZASADA.
Kwasy różnią się zdolnością do oddawania
protonu. Wybierając H
2
O jako powszechnie
stosowany
rozpuszczalnik,
można
ułożyć
uporządkowany szereg.
Sprzężony kwas
Sprzężona zasada
mocny H
2
SO
4
HSO
4
-
słaba
HCl
Cl-
H
3
O+ H
2
O
HSO
4
-
SO
4
2-
HF
F-
CH
3
COOH
CH
3
COO-
NH
4
+
NH
3
słaby H
2
O
OH- mocna
H+
+
37
zasada cząsteczkowa
NH
3
+ H+ NH
4
+
zasada kwas
zasada anionowe
CO
3
2- + H+ HCO
3
-
zasada kwas
proton
zasada
HCl H+ + Cl-
H
2
SO
4
H+ +
HSO
4
-
CH
3
COOH H+ +
CH
3
COO-
H
2
CO
3
H+ + HCO
3
-
HCO
3
-
H+ +
CO
3
2-
HSO
4
- H+ +
SO
4
2-
H
3
O+
H+ + H
2
O
NH
4
+ H+ + NH
3
Kwasy
cząsteczkow
e
Kwasy
anionowe
Kwasy
kationowe
PROTONOWA TEORIA KWASÓW I
ZASAD
38

Wnioski wypływające z teorii Bronsteda:
kwas po oddaniu protonu przechodzi
w zasadę a zasada pobierając
proton przechodzi w kwas;
im
słabsza
jest
zasada
tym
mocniejszy jest kwas tworzący z nią
parę i na odwrót;
wg teorii Brönsteda kwasami są nie
tylko kwasy cząsteczkowe ale także
anionowe i kationowe.
Woda jest rozpuszczalnikiem amfoterycznym,
może bowiem pełnić rolę zarówno:
ZASADY: HF +
H
2
O
= F- +
H
3
O+
kwas
1
zasada
2
zasada
1
kwas
2
KWASU: CN- +
H
2
O
= HCN +
OH-
zasada
1
kwas
2
kwas
1
zasada
2
PROTONOWA TEORIA KWASÓW I
ZASAD
39
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
5 Elektrolity bez kolor
7a weglowodory bez kolor
Aktywność elektryczna bez tętna(PEA), RATOWNICTWO MEDYCZNE
GEOM OBC STROP BEZ KOLOR
Elektryczny bez Elektrotechniki sem I
7a weglowodory bez kolor
GEOM OBC STROP BEZ KOLOR
Elektrochemia bez koloru
Postępowanie w czynnościach elektrycznych bez tętna
2a bez tabelki, WYDZIAŁ ELEKTROTECHNIKI I INFORMATYKI PL
Elementy bez-oczowe w elektronice- Czyli gawrych (Âci-ga), Ściągi do szkoły, Układ Sterowania i Regu
Kody błędów pralek WHIRLPOOL z diodami LED bez wyświetlacza (PL), Elektronika(1), • Kody błędów
PRZERZUTNIKI I REJESTRY kolor, PWr, Podstawy elektroniki 2
Ściągi z fizyki-2003 r, Moje życie bez elektryczności
całość01 16 bez 11 12, Elektrotechnika-materiały do szkoły, Energoelektronika
Czy mozliwe jest zycie bez elektrycznosci
więcej podobnych podstron