1
WĘGLOWODORY
Związki organiczne, których cząsteczki zbudowane są wyłącznie z
atomów
węgla
i
wodoru
.
1.
Węglowodory
łańcuchowe
nasycone -ALKANY
Szereg homologiczny - nieskończony szereg związków
chemicznych, których cząsteczki różnią się od siebie
dowolną liczbą grup atomów (np.: grup metylenowych —
CH
2
— w przypadku alkanów), przy czym związki te mają
podobną budowę, a wskutek tego podobne własności
chemiczne.
Między atomami węgla występują tylko wiązania
pojedyncze:
C
—
C
Wszystkie alkany mają ogólny wzór sumaryczny:
C
n
H
2n+2
n - całkowita liczba naturalna
Tworzą tzw.
szereg homologiczny
2
Szereg homologiczny
alkanów
H
H
2
.
E
T
A
N
H
—
C
—
C
—
H
C
H
3
—
C
H
3
(
C
2
H
6
)
H
H
H
1
.
M
E
T
A
N
H
—
C
—
H
C
H
4
H
H
H
H
3
.
P
R
O
P
A
N
H
—
C
—
C
—
C
—
H
H
H
H
C
H
3
—
C
H
2
—
C
H
3
(
C
3
H
8
)
3
Szereg homologiczny
alkanów
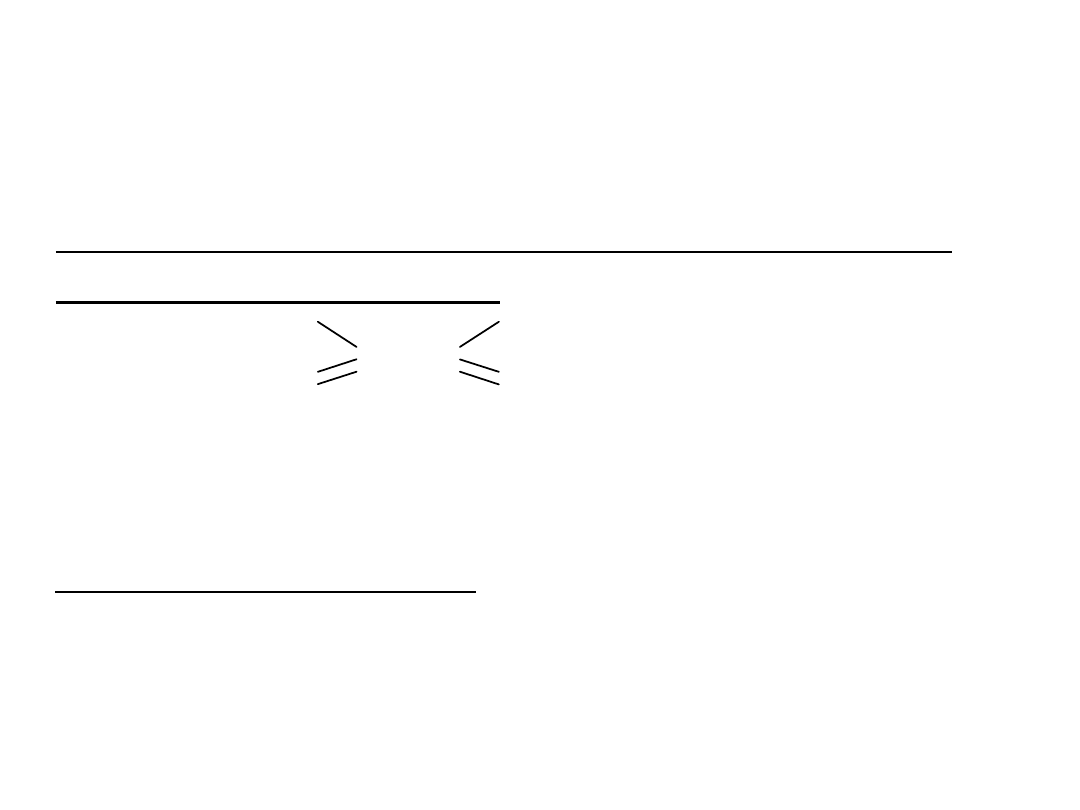
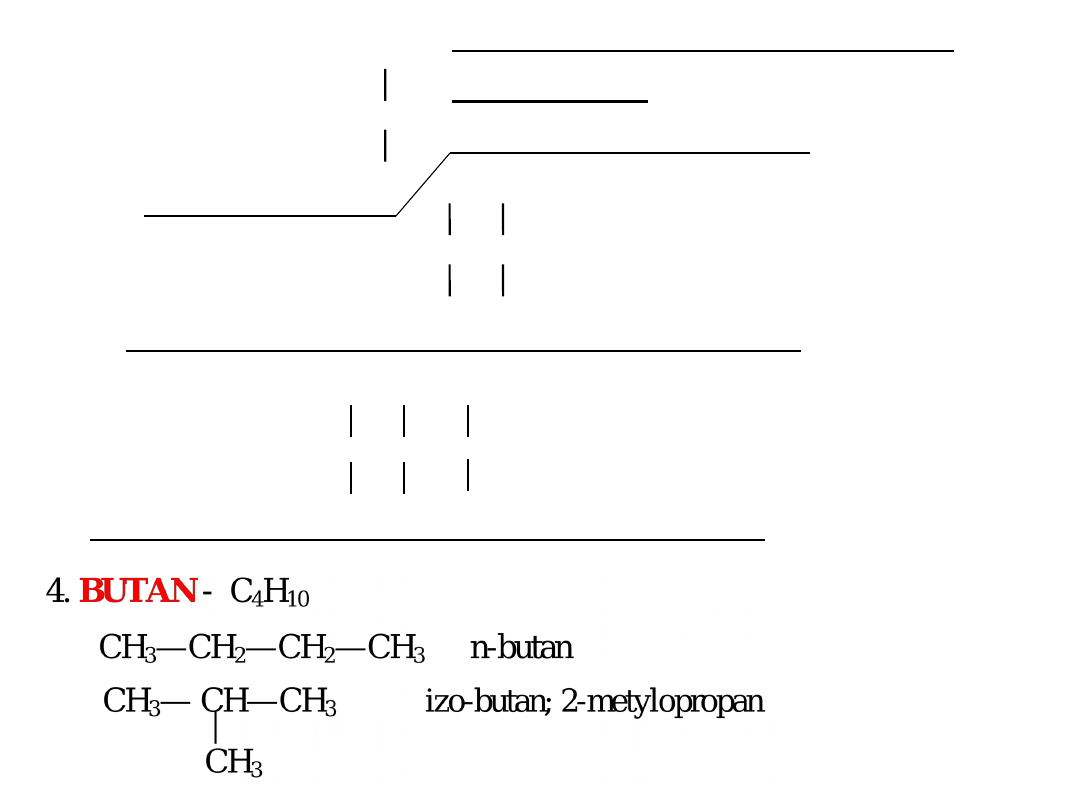
Począwszy od butanu w alkanach występuje zjawisko
izomerii strukturalnej (szkieletowej), związanej są
rozgałęzieniem łańcucha węglowego.
P
E
N
T
A
N
-
C
5
H
1
2
C
H
3
—
C
H
2
—
C
H
2
—
C
H
2
—
C
H
3
n
-
p
e
n
t
a
n
C
H
3
—
C
H
2
—
C
H
—
C
H
3
C
H
3
2
-
m
e
t
y
l
o
b
u
t
a
n
C
H
3
C
H
3
—
C
—
C
H
3
d
i
m
e
t
y
l
o
p
r
o
p
a
n
C
H
3
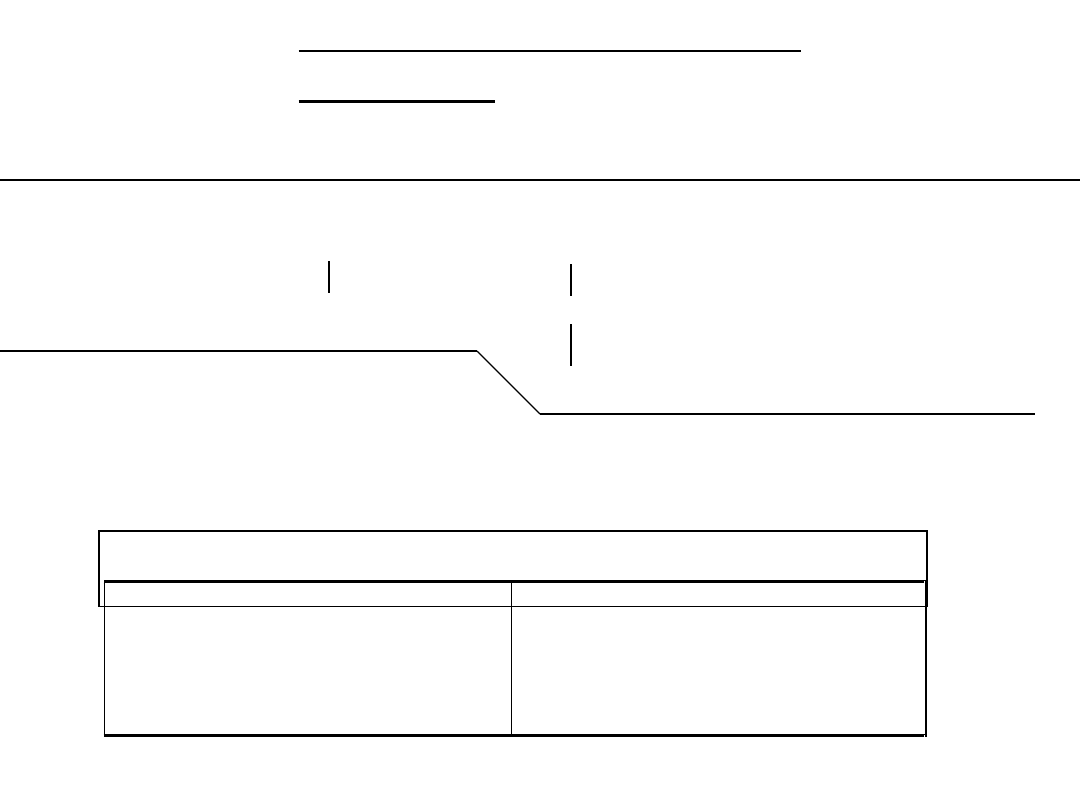
Im większa jest liczba atomów węgla w cząsteczce
węglowodoru tym możliwa jest większa liczba izomerów
strukturalnych:
8
1
8
9
3
5
1
0
7
5
1
5
4
3
4
7
2
0
3
3
6
3
1
9
2
5
3
6
7
9
5
5
8
8
3
0
4
1
1
1
8
4
6
7
6
3
Liczba atomów węgla
liczba izomerów
4
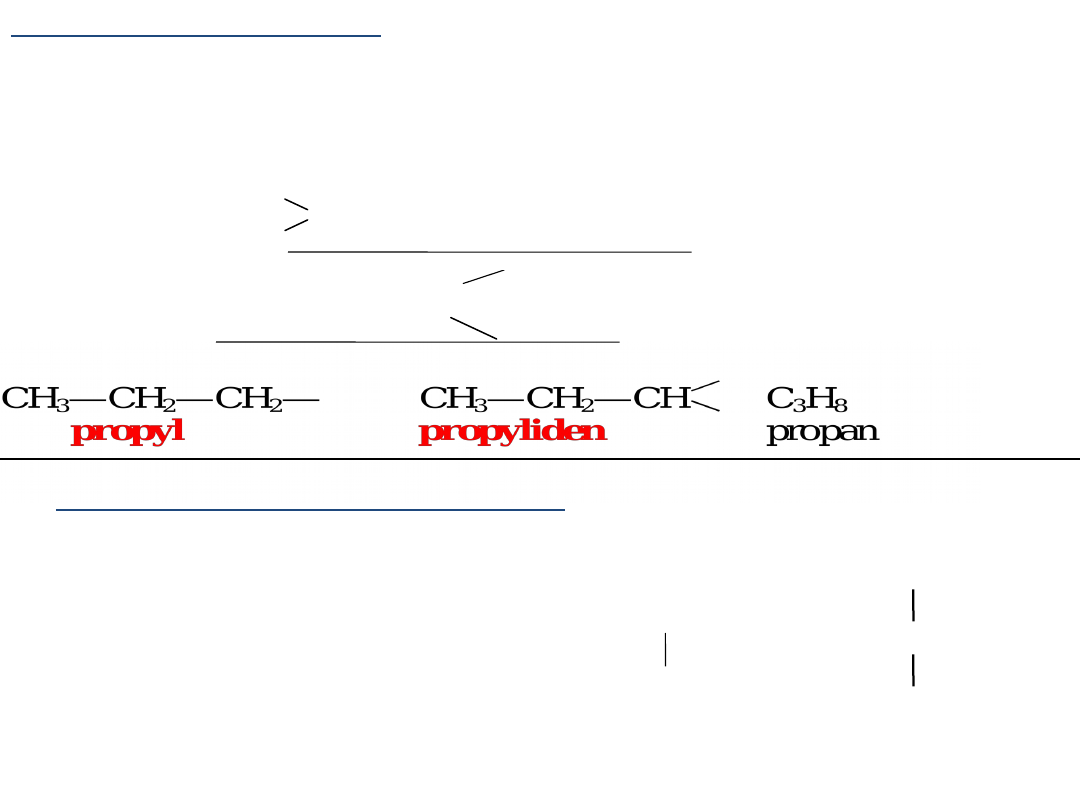
Jest to część cząsteczki węglowodoru mająca określoną
liczbę wolnych jednostek wartościowości. Nazwy rodników
ustala się wychodząc z nazw odpowiednich alkanów, przy
czym końcówkę zmienia się z -an na -yl.
C
H
3
—
m
e
t
y
l
C
H
2
m
e
t
y
l
e
n
C
H
4
m
e
t
a
n
C
H
3
—
C
H
2
—
e
t
y
l
C
H
3
—
C
H
e
t
y
l
i
d
e
n
C
H
3
—
C
H
3
e
t
a
n
Rodniki węglowodorowe
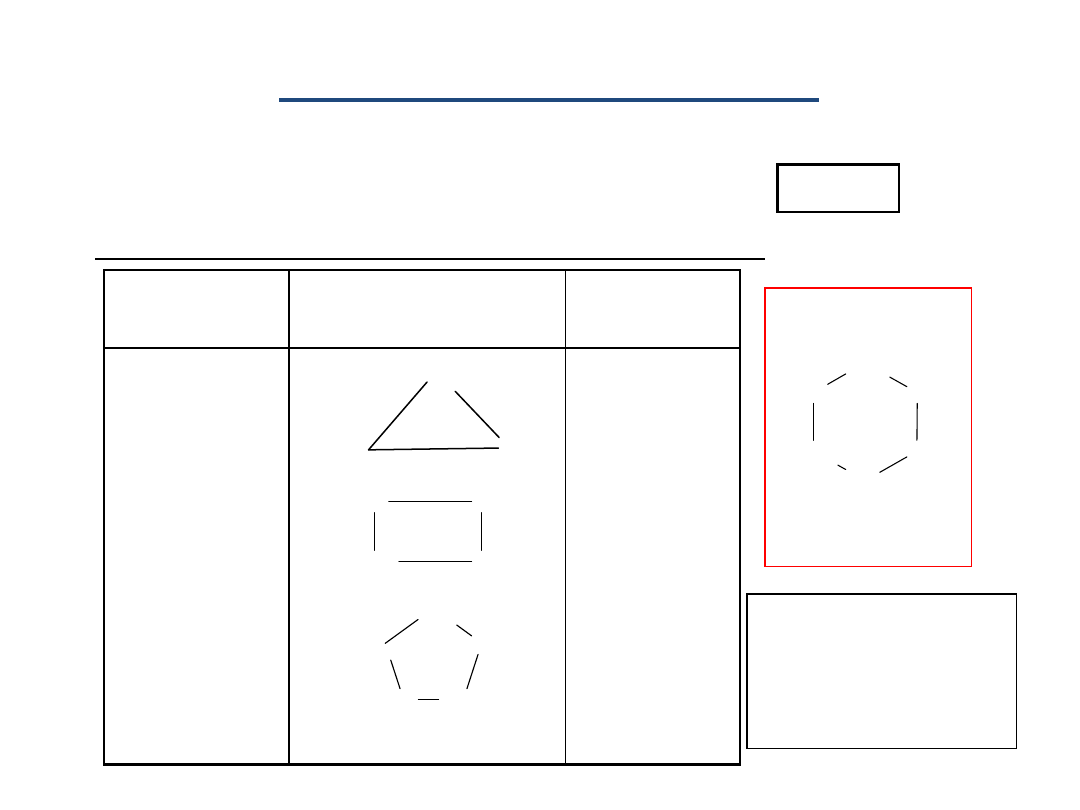
Rzędowość węgla organicznego-stopień podstawienia, czyli liczba
grup alkilowych związanych z określonym atomem węgla.
węgiel
czwartorzędowy
R
4
R
1
—
C
—R
3
R
2
R—
C
H
3
węgiel
pierwszorzędowy
R
1
—
C
H
2
—R
2
węgiel
drugorzędowy
węgiel
trzeciorzędowy
R
1
—
C
H—R
3
R
2
5
CYKLOALKANY
Cykloheksan
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C
6
H
12
Nazwa
Wzór strukturalny
Wzór
sumaryczny
Cyklopropan
Cyklobutan
Cyklopentan
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C
3
H
6
C
4
H
8
C
5
H
10
W
nazwach
stoso-wany jest
przedros-tek
cyklo.
Przykłady najprostszych cykloalkanów:
Tworzą szereg homologiczny o wzorze:
C
n
H
2
n
n - całkowita liczba naturalna
6
Własności chemiczne alkanów
Przemiany
chemiczne
węglowodorów
mogą
zachodzić albo wskutek rozerwania wiązań C—C lub C
—H. Następuje wtedy albo rozpad cząsteczki, albo
podstawienie atomu wodoru innym atomem lub
grupą atomów.
· Ulegają najczęściej reakcji podstawiania -
substytucji
.
· Alkany są odporne na działanie kwasów i
zasad oraz reduktorów.
1. Ulegają spalaniu - przy czym produktami są
albo CO
2
, CO lub C (sadza) w zależności od
ilości tlenu biorącego udział w reakcji.
C
4
H
10
+ 6,5 O
2
= 4 CO
2
+ 5 H
2
O
C
4
H
10
+ 4,5 O
2
= 4 CO + 5 H
2
O
C
4
H
10
+ 2,5 O
2
= 4 C + 5 H
2
O
Utlenienie

7
1.
CHLOROWCOWANIE
- podstawianie atomów
wodoru chlorowcem.
Np. chlorowcowanie metanu:
CH
4
+ Cl
2
= HCl + CH
3
Cl jednochlorometan
CH
3
Cl + Cl
2
= HCl + CH
2
Cl
2
dichlorometan
CH
2
Cl
2
+ Cl
2
= HCl + CHCl
3
trichlorometan-
chloroform
CHCl
3
+ Cl
2
= HCl + CCl
4
tetrachlorometan-
czterochlorek węgla Jest to reakcja łańcuchowa -
zachodzi wg mechanizmu podstawiania
rodnikowego.
Reakcja podstawiania
I etap - rozpad wiązania atomowego Cl—Cl pod wpływem
energii świetlnej lub cieplnej:
Cl—Cl
Cl
*
+ Cl
*
chlor rodnikowy
lub temp.
II etap - wytworzenie rodnika węglowodorowego działaniem
chloru rodnikowego:
CH
4
+ Cl
*
CH
3
*
+ HCl rodnik metylowy
III etap - działanie rodnika węglowodorowego na chlor
cząsteczkowy:
CH
3
*
+ Cl
2
CH
3
Cl + Cl
*
itd.
Reakcja z innymi chlorowcami przebiega podobnie, przy czym
reaktywność chlorowców maleje w szeregu: F > Cl > Br > I

8
Węglowodory
nienasycone
W
cząsteczkach
węglowodorów
nienasyconych
występują:
Wiązania podwójne:
C=C ALKENY
(Olefiny)
Wiązania potrójne:
CC ALKINY
(Acetyleny)
ALKENY tworzą szereg homologiczny o ogólnym
wzorze:
C
n
H
2n
1.
ETEN
C
2
H
4,
(etylen)
CH
2
CH
2
2.
PROPEN
C
3
H
6
,
(propylen)
CH
2
CH CH
3
4
3.
BUTEN
CH
8
CH
2
=
CH—CH2—CH3
1-buten
CH3
—CH=CH—CH3 2-buten
izobuten
metylopropen
3
CH
2
=C—CH3
CH
Występuje izomeria związana z położeniem
wiązania podwójnego.
Również izomeria szkieletowa związana z
rozgałęzieniem łańcucha.

9
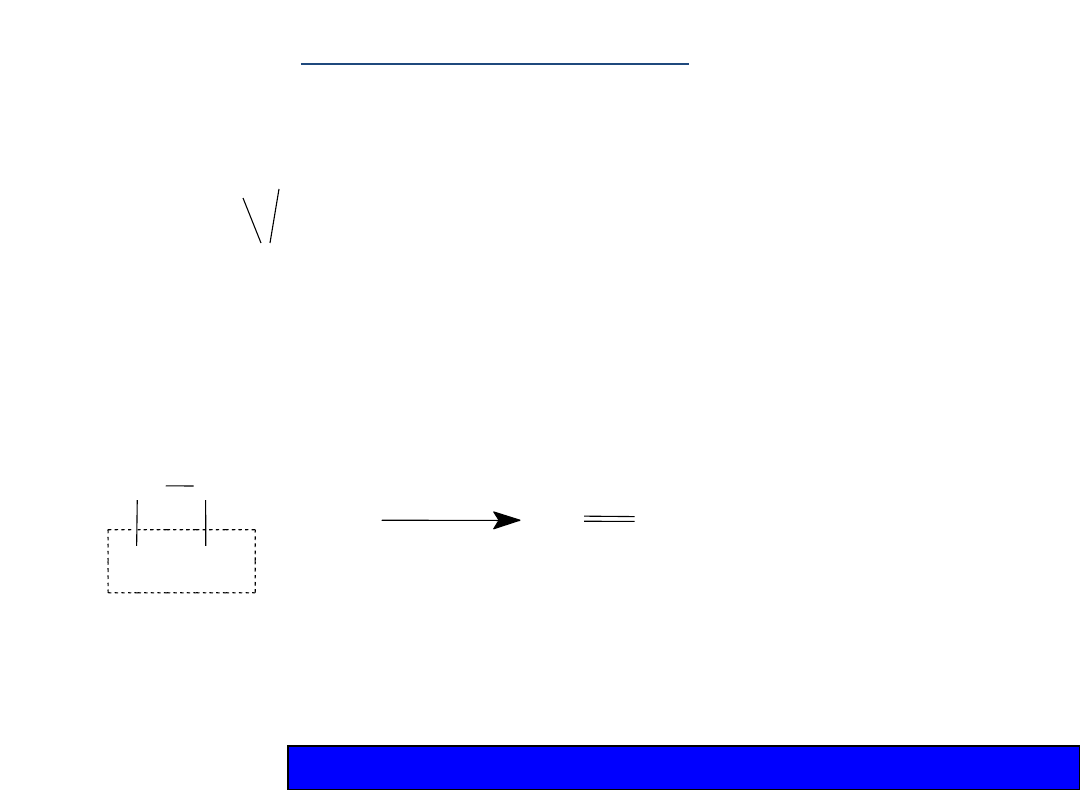
Występuje wiązanie potrójne:
—C
C—
ALKINY tworzą szereg homologiczny o ogólnym wzorze:
C
n
H
2n-2
1.
ETYN
- ACETYLEN C
2
H
2
H—CC—H CHCH
2.
PROPYN
C
3
H
4
CH
3
—CCH
3.
BUTYN
C
4
H
6
CHC—CH
2
—CH
3
1-butyn
CH
3
—CC—CH
3
2-butyn
CHC—CH
2
—CH
2
—CH
3
1-pentyn
CH
3
—CC—CH
2
—CH
3
2-pentyn
CHC—CH—CH
3
3-metylo-1-butyn
CH
3
4.
PENTYN
C
5
H
8
Występuje izomeria związana z położeniem wiązania
podwójnego.
Również
izomeria
szkieletowa
związana
z
rozgałęzieniem łańcucha.
10
Otrzymywanie
1. Acetylen otrzymuje się z karbidu (CaC
2
) działając
na niego wodą:
CC + 2H
2
O CHCH + Ca(OH)
2
Ca
acetylen
Karbid można otrzymać przez ogrzewanie wapna
palonego w temp. 2500 C z węglem:CaO + 3C =
CaC
2
+ CO
CH
2
—CH
2
Br Br
1,2-dibromoetan
+ 2KOH = CHCH + 2KBr + 2H
2
O
2. Eliminacja chlorowcowodorów z jedno- lub
dichlorowco-pochodnych alkanów:
CH
2
CH
2
Br
H
CH
2
CH
2
+ KOH
eten
bromoetan
+ KBr + H2O
etyn
Reakcja eliminacji dotyczy także alkoholi i alkanów
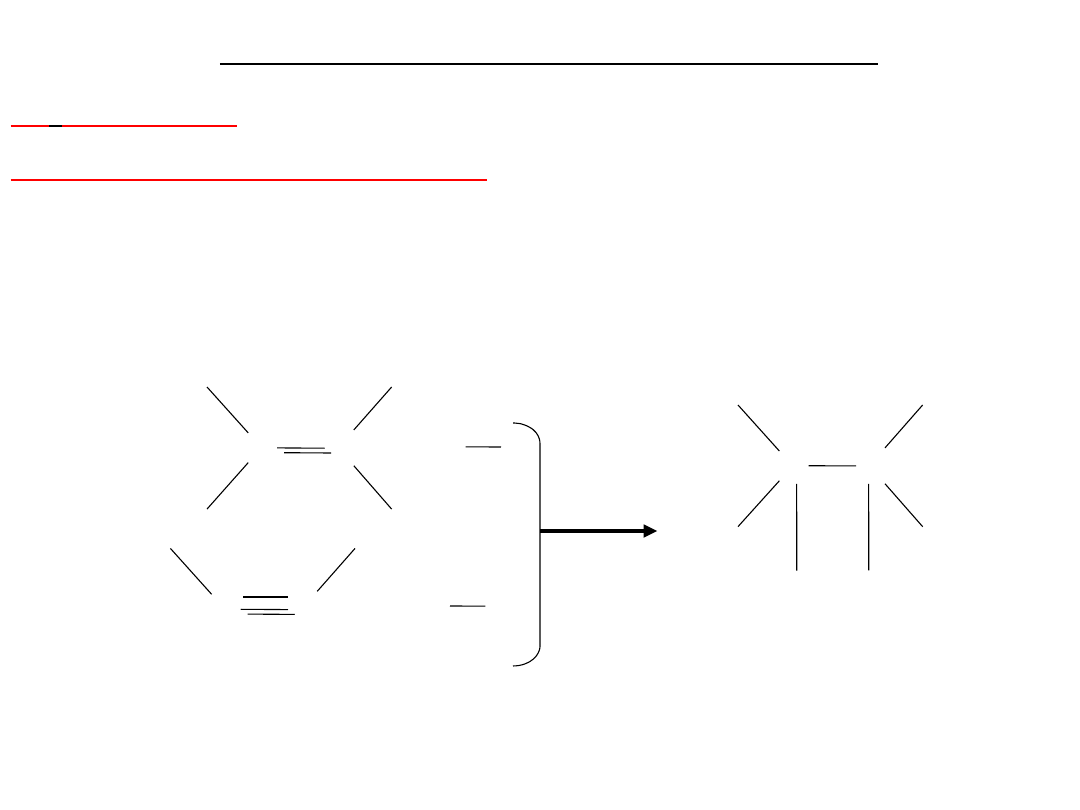
11
WŁASNOŚCI CHEMICZNE
1.
Spalanie
- podobnie jak alkany
2. Reakcja przyłączania
Najbardziej charakterystyczna reakcja alkenów i alkinów.
Polegające na przyłączeniu atomu lub grupy atomów do
wiązań wielokrotnych między atomami węgla.
Wiązanie zostaje zastąpione przez dwa nowo
utworzone wiązania :
C
C
+ A
B
p
s
C
C
s
s
s
B
A
alken
C
C
+ 2 A
p
s
B
alkin
alkan lub jego pochodna
(B)
(A)
Jest to tzw. przyłączenie elektrofilowe, czyli alken
(alkin) reaguje z atomem lub grupą atomów w postaci
kationu lub z dodatnim biegunem dipola.
12
Przyłączenie chlorowców
:
Chlorowce (szczególnie Cl
2
i Br
2
) przyłączają się łatwo do
podwójnego i potrójnego wiązania:
C H2
C H
C H
2
C H
2
C l
C l
+ Cl2
1,2-dichloroetan
2
eten
CHCH + 2Br
2
Br—CH—CH—Br 1,1,2,2,-tetrabromoetan
Br Br
etyn
Przyłączenie chlorowcowodorów
CH
2
=CH
2
+ HI CH
3
—CH
2
—I jodoetan
CH
3
—CH
2
+ I
CH
3
—CH
2
—I
CH
2
=CH
2
H — I
-
+
+
-
etylokarbokation
13
CHCH + HCl CH
2
=CH—Cl chloroeten; chlorek winylu
CH
2
=CH rodnik winylowy
Nadmiar HCl:
CH
2
=CH—Cl + HCl CH
3
—CHCl
2
1,1-dichloroetan
Chlorek winylu służy do otrzymywania polimeru -
poli(chlorku winylu)
Jeżeli alken jest niesymetryczny możliwe są dwa
produkty reakcji, Np.:
CH
3
—CH=CH
2
+ HBr
CH
3
—CH
2
—CH
2
—Br
1-bromopropan
(nie powstaje)
2-bromopropan
CH
3
— CH—CH
Br
Kierunek takiego przyłączania określa reguła
Markownikowa: wodór przyłącza się do węgla,
który związany jest z większą liczbą atomów
wodoru.
14
Przyłączenie wody
CHCH + H
2
O CH
2
=CH—OH CH
3
—C
alkohol winylowy (nietrwały)
W przypadku alkinów powstaje aldehyd octowy
- reakcja Kuczerowa.
W obecności mocnych kwasów (H
2
SO
4
) woda
przyłącza się do alkenów tworząc alkohole.
CH
2
=CH
2
+ H
2
O ® CH
3
—CH
2
—OH
alkohol etylowy
Uwodornienie:
alkiny alkeny alkany
CH
3
—CCH + H
2
CH
3
—CH=CH
2
propyn
propen
CH
3
—CH=CH
2
+ H
2
CH
3
—CH
2
—CH
3
propan
H
= O
15
WĘGLOWODORY
AROMATYCZNE
ARENY
Należą do grupy węglowodorów cyklicznych.
Szczególny rodzaj wiązania występujący w benzenie.
BENZEN C
6
H
6
- posiada raczej własności nasycone
Związki aromatyczne - benzen i jego pochodne
.
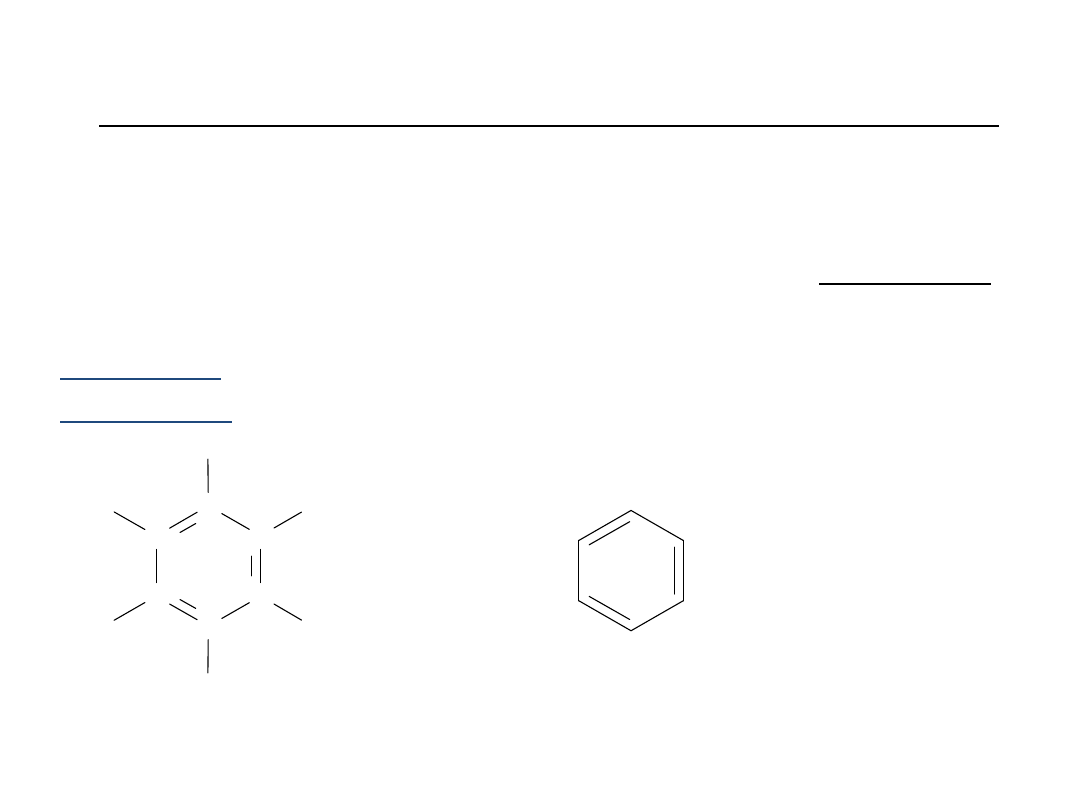
Budowa
benzenu
C
C
C
C
C
C
H
H
H
H
H
H
lub
Kekulé wysunął hipotezę, że benzen
jest cykloheksatrienem
Taka struktura nie tłumaczyła braku własności
nienasyconych układu aromatycznego.
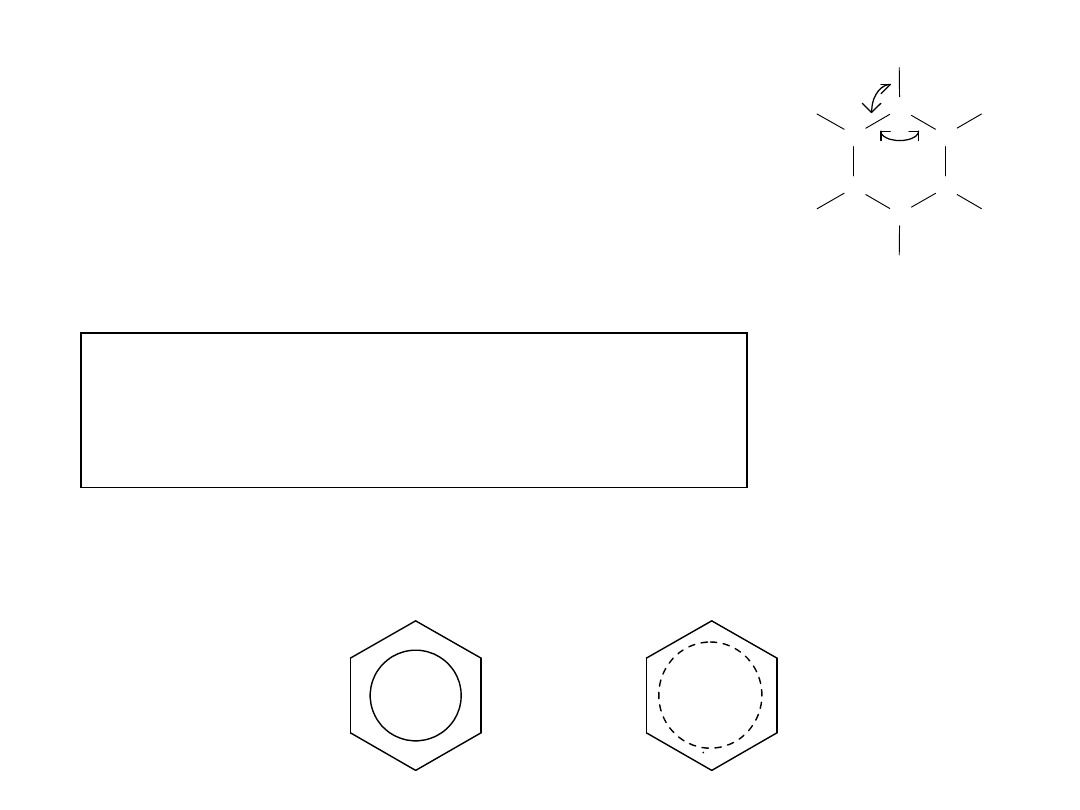
16
Budowa benzenu
Na
podstawie
badań
rentgenograficznych
i
spektroskopowych ustalono, że
cząsteczka benzenu tworzy układ
płaski, w którym atomy węgla
tworzą sześciokąt foremny.
C
C
C
C
C
C
H
H
H
H
H
H
1,09A
1,39A
120
120
Szkieletowy
model
cząsteczki
benzenu
Wszystkie wiązania między atomami
węgla są
równocenne
i nie występują na
przemian
wiązania
pojedyncze
i
podwójne.
· pozostałych
sześć
elektronów
jest
zdelokalizowanych
symetrycznie
na
skutek
nałożenia się orbitali p
z
sześciu atomów węgla.
Elektrony zajmujące zdelokalizowane orbitale benzenu
stanowią tzw. sekstet elektronowy zaznaczany
symbolicznie:
lub
17
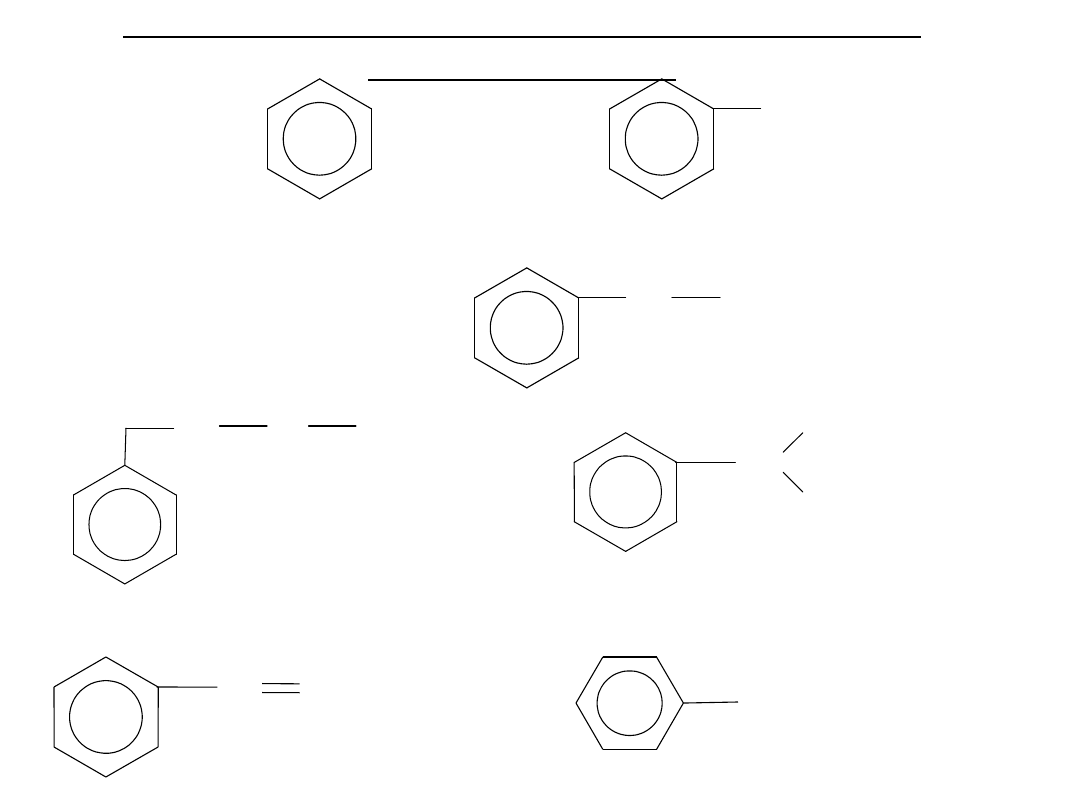
Nazewnictwo i izomeria węglowodorów
aromatycznych
Benzen
: C
6
H
6
Toluen
- metylobenzen:C
6
H
5
—CH
3
CH
3
Etylobenzen
:C
6
H
5
—C
2
H
5
C
8
H
10
C
H
2
C
H
3
CH
CH
2
winylobenzen (styren)
izopropylobenzen (kumen)
C
H
2
C
H
3
C
H
2
C
H
C
H
3
C
H
3
Propylobenzen
Rodnik fenylowy
18
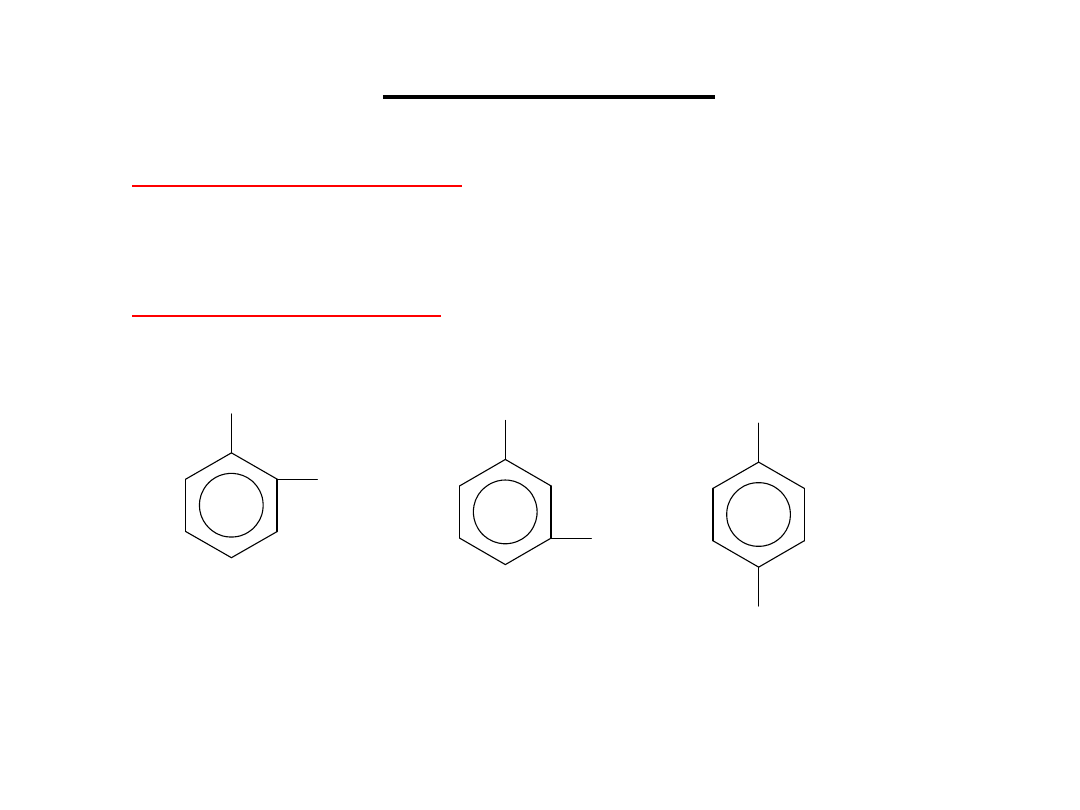
IZOMERIA
· Jednopodstawione
pochodne benzenu nie
posiadają izomerów,
· Dwupodstawione
benzenu istnieją w trzech
odmianach izomerycznych: 1,2-; 1,3- i 1,4-.
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
1,2-dimetylobenzen
orto-dimetylobenzen
o-ksylen
1,3-dimetylobenzen
meta-dimetylobenzen
m-ksylen
1,4-dimetylobenzen
para-dimetylobenzen
p-ksylen
19
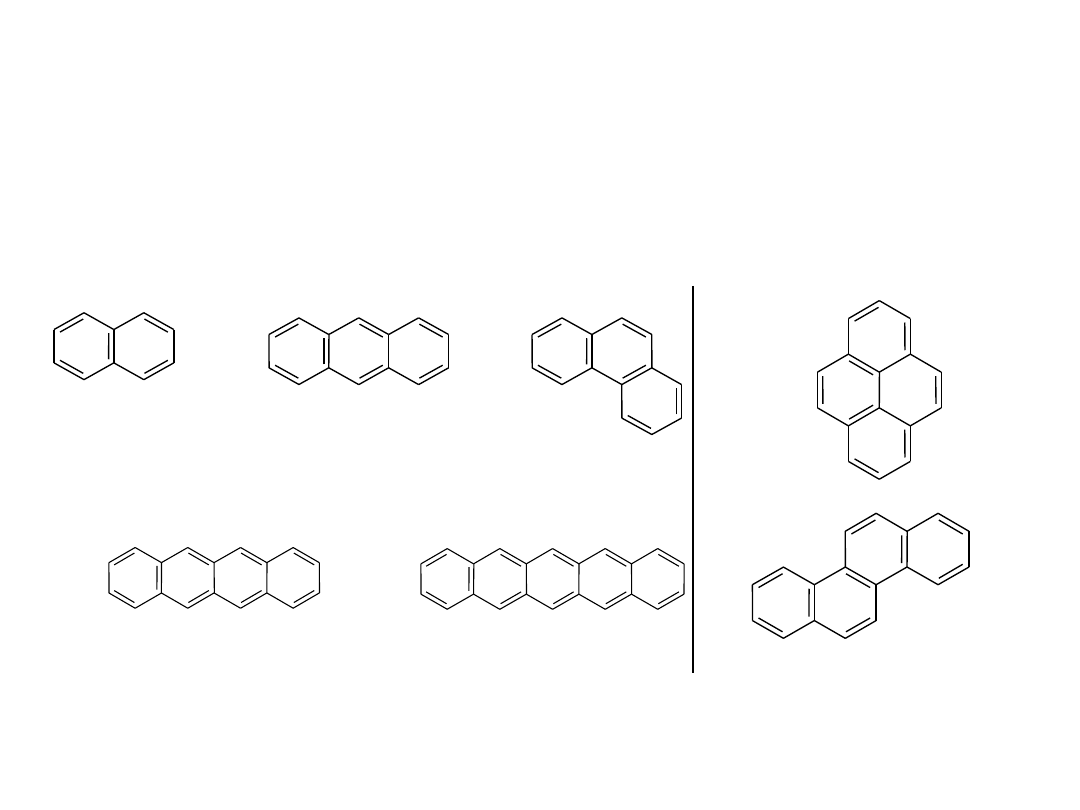
Węglowodory aromatyczne
o pierścieniach
skondensowanych
Znane
są
węglowodory
aromatyczne
zawierające kilka pierścieni skondensowanych
(sąsiadujące ze sobą pierścienie mają po dwa
wspólne atomy węgla):
naftacen (
żółty)
C
18
H
12
pentacen (niebieski)
C
22
H
14
piren
C
16
H
10
chryzen
C
18
H
12
naftalen
C
10
H
8
antracen
C
14
H
10
fenantre
n
C
14
H
10
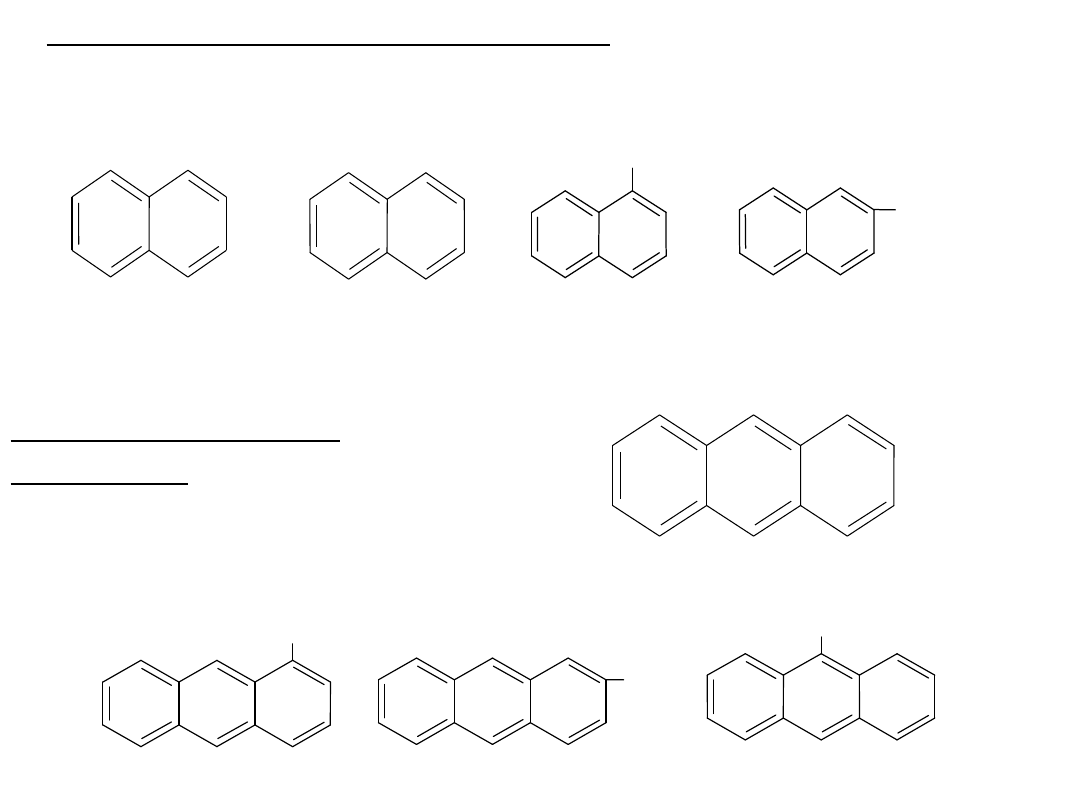
20
Jednopodstawione
pochodne
naftalenu
mają dwa izomery: (alfa) i (beta):
C
H
3
C
H
3
-
m
e
t
y
lo
n
a
f
t
a
le
n -
m
e
t
y
lo
n
a
f
t
a
le
n
Na przykład
:
Jednopodstawione
pochodne
antracenu
mają trzy izomery:
, , .
C
H
3
C
H
3
C
H
3
-
m
e
t
y
l
o
a
n
t
r
a
c
e
n
-
m
e
t
y
l
o
a
n
t
r
a
c
e
n
-
m
e
t
y
l
o
a
n
t
r
a
c
e
n
Na przykład: 3 izomery
metyloantracenu:
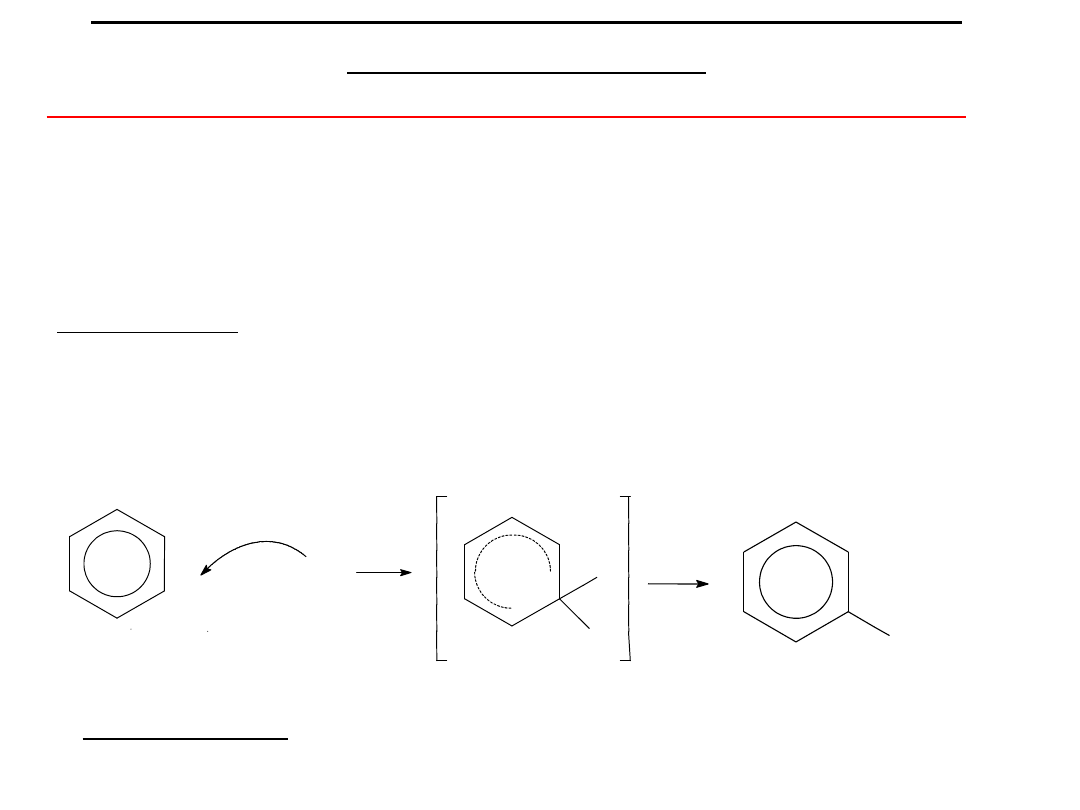
21
Własności chemiczne węglowodorów
aromatycznych
Sumarycznie:
C
6
H
6
+ Z
+
[C
6
H
6
Z]
+
C
6
H
5
—Z + H
+
H
Z
(
+
)
(
-
)
+
Z
+
p
o
l
a
r
n
a
c
zą
s
t
k
a
a
r
o
m
a
t
y
c
z
n
a
k
a
t
i
o
n
p
r
z
e
jś
c
i
o
w
y
+
+
+
+
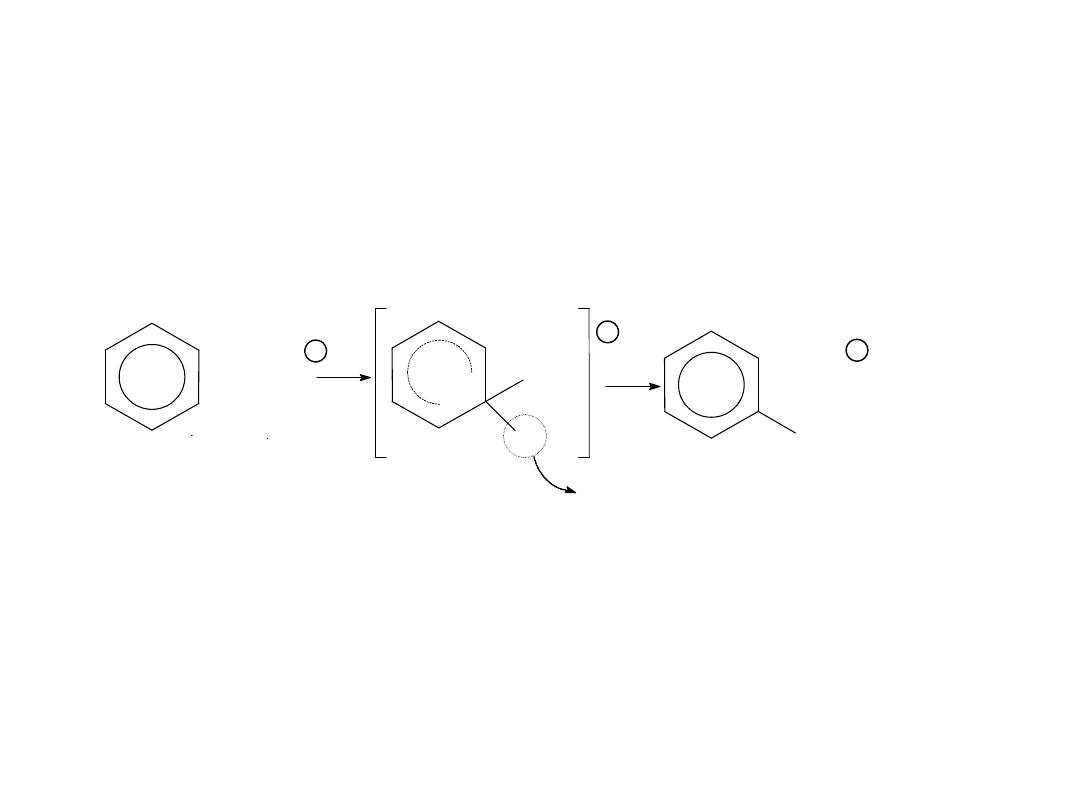
Mechanizm:
I Etap: Kation Z
+
wiąże się z atomem węgla o największym
ładunku ujemnym kation przejściowy o dużej energii -
stan nienasycony. II Etap: Odszczepienie kationu
przejście nienasyconego kationu w cząstkę aromatyczną:
Z
+
H
+
REAKCJE PODSTAWIANIA ELEKTROFILOWEGO.
Czynnikiem atakującym ujemny biegun cząsteczki
układu aromatycznego jest kation lub dodatni
biegun spolaryzowanej cząsteczki odczynnika,
przy czym podstawieniu ulega atom wodoru związany
z węglem pierścienia aromatycznego.
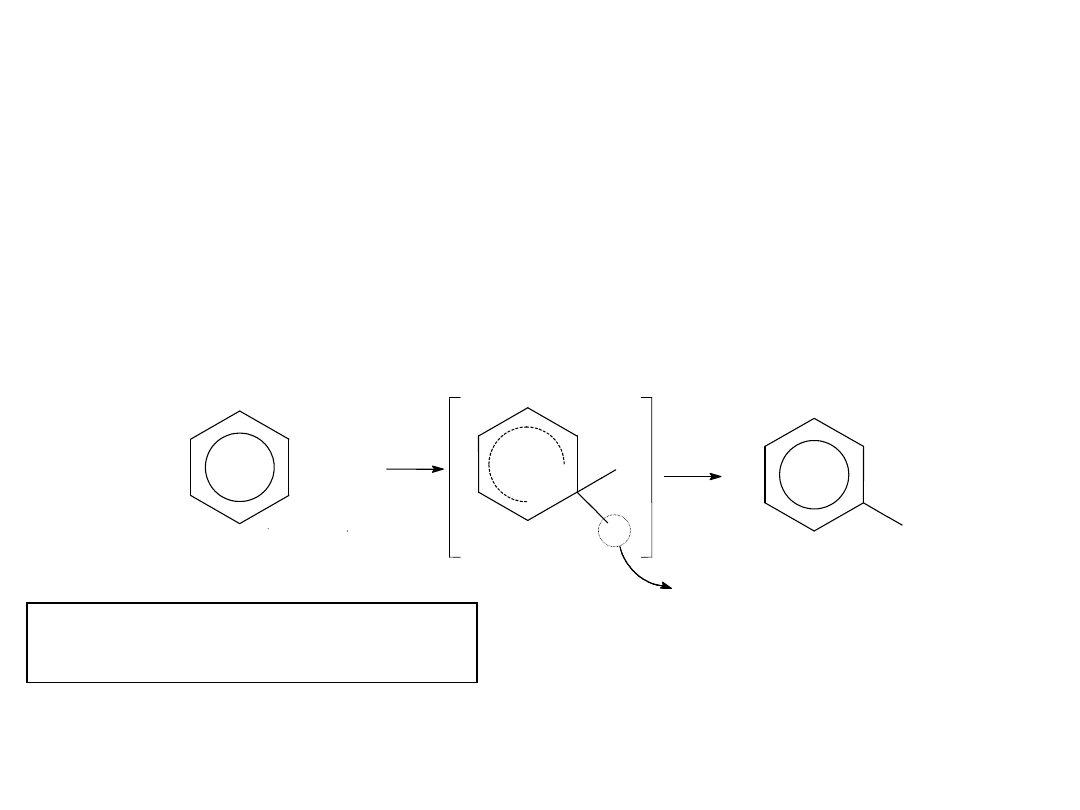
22
CHLOROWCOWANIE
Polega na
podstawieniu
atomem
chlorowca
atomu
wodoru
związanego
z
węglem
pierścienia
aromatycznego.
Stosuje się katalizator w postaci halogenków
żelazowych FeX
3
. Ułatwiają one powstawanie
kationów chlorowcowych:
X
2
+ FeX
3
[FeX
4
]
-
+ X
+
H
X
+
H
+
X
+
X
+
c
h
l
o
r
o
w
c
o
b
e
n
z
e
n
+
+
+
+
Sumarycznie:
X
2
+ Ar—H Ar—X + HX
H
+
+ [FeX
4
]
-
FeX
3
+ HX
Kation chlorowcowy atakuje cząsteczkę związku
aromatycznego zgodnie z mechanizmem:
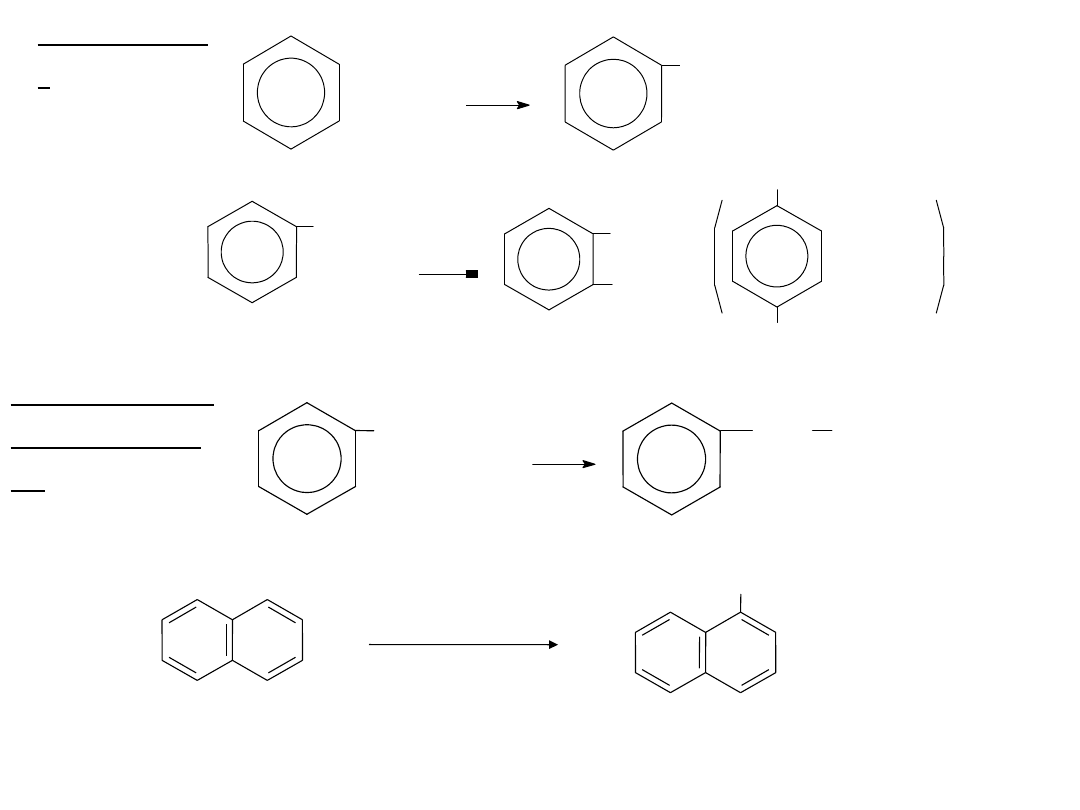
23
C l
+ Cl
2
FeCl
3
+ HCl
chlorobenzen
Przykłady
:
C
H
3
C
H
3
B
r
C
H
3
B
r
+
B
r
2
F
e
B
r
3
+
+
H
B
r
p
-
b
r
o
m
o
t
o
u
l
e
n
t
o
u
l
e
n
o
-
b
r
o
m
o
t
o
u
l
e
n
C
H
3
C
H
2
C
l
+
C
l
2
ś
w
i
a
t
ł
o
+
H
C
l
c
h
l
o
r
e
k
b
e
n
z
y
l
u
Bez użycia
katalizator
a:
Br2
Br
1-bromonaftalen
(-bromonaftalen)
naftale
n
24
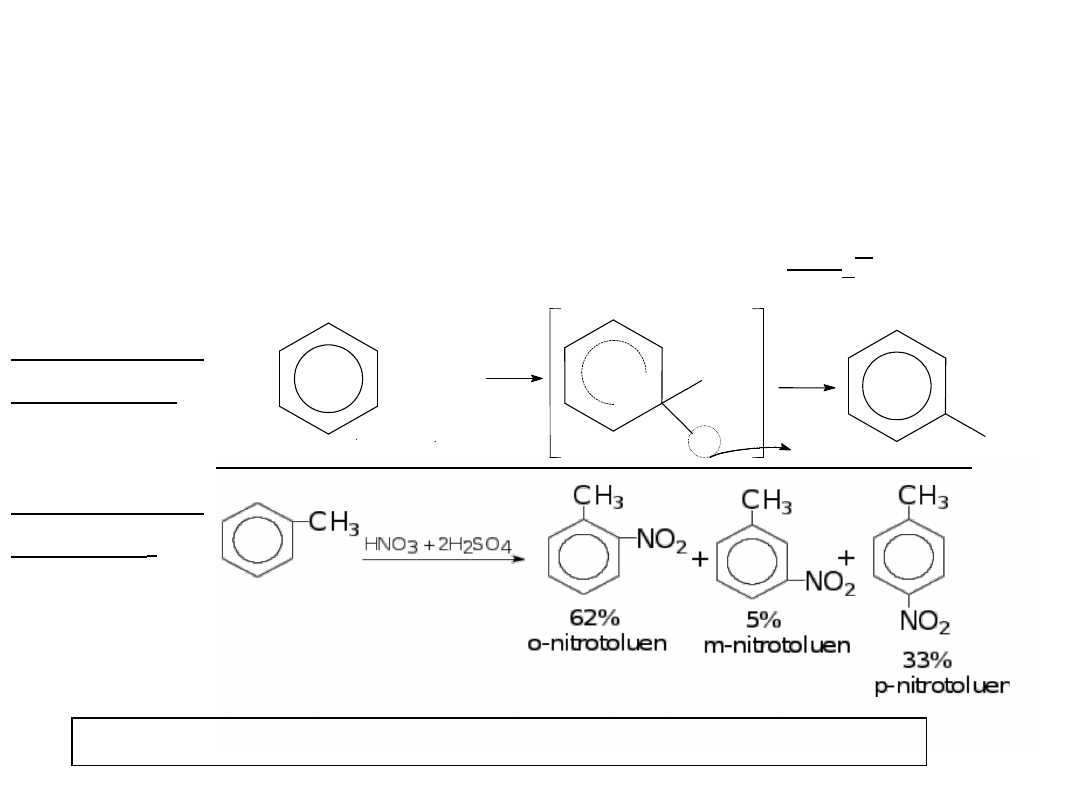
NITROWANIE
Polega na podstawieniu atomu wodoru układu
aromatycznego grupą nitrową - NO
2
Nitrowanie wykonuje się tzw. mieszaniną nitrującą:
2H
2
SO
4
+ HONO
2
2HSO
4
+ H
3
O + NO
2
+
H
N
O
2
+
H
+
N
O
2
+
N
O
2
+
+
+
+
+
Nitrowanie
benzenu:
Sumarycznie:Ar—H + HNO
3
Ar—NO
2
+ H
2
O
Nitrowanie
toluenu
:
25
SULFONOWANIE
Polega
na
wprowadzeniu
do
pierścienia
aromatycznego grupy sulfonowej - SO
3
H w
miejsce atomu wodoru.
Grupa sulfonowa jest resztą kwasu siarkowego i
zachowuje własności tego kwasu:
H
SO
3
H
+ H
SO
3
H
+ SO
3
H
kwas
benzenosulfonowy
+
+
+
+
+
+
Ogólnie:
H
2
SO
4
+ Ar—H H
2
O + Ar—SO
3
H
Reakcja sulfonowania jest reakcją odwracalną.
26
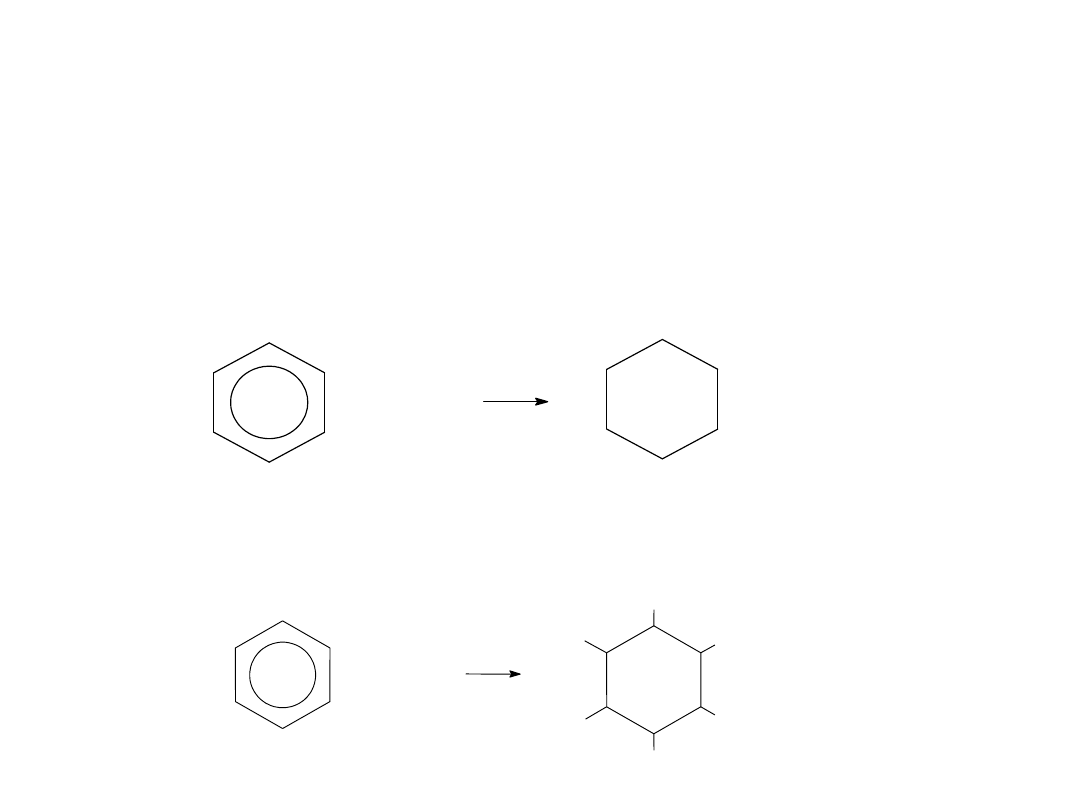
Reakcje przyłączenia
węglowodorów
aromatycznych.
Znane są reakcje przyłączenia do arenów
(przebiegają trudniej niż do węglowodorów
nienasyconych).
Uwodnienie benzenu - przebiega wobec niklu
jako katalizatora oraz przy podwyższonym
ciśnieniu.
benzen
+ 3H
2
Ni
cykloheksan
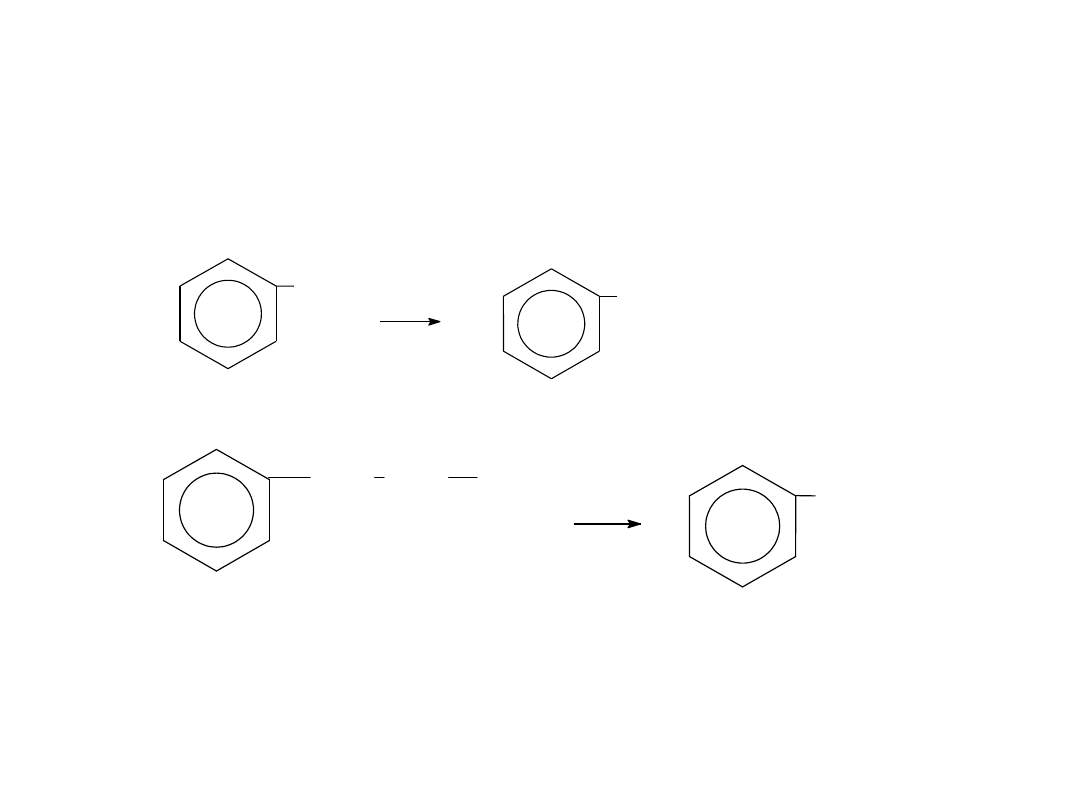
Jeżeli mieszanina benzenu i chloru są
naświetlane
promieniowaniem
ultrafioletowym
następuje
przyłączenie
chloru:
Cl
Cl
Cl
Cl
Cl
Cl
+ 3Cl
2
hn
heksachlorocykloheksan
27
UTLENIENIE
Utlenieniu łatwo ulega łańcuch boczny w
węglowodorach aromatycznych do grupy
karboksylowej:
—COOH.
COOH
CH
2
CH
2
CH
3
[O]
n-propylobenzen
kwas benzoesowy
CH
3
COOH
metylobenze
n
[O]
kwas
benzoesowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
7a weglowodory bez kolor
5 Elektrolity bez kolor
GEOM OBC STROP BEZ KOLOR
5 Elektrolity bez kolor
GEOM OBC STROP BEZ KOLOR
3 Licytacja po otwarciu 1 w kolor i wejściu kolorem bez przeskoku
9 Ch organiczna WĘGLOWODANY
7a) Sarcoptes scabei
bez makijazu www prezentacje org
W08 Patofizjologia zaburzeń gospodarki węglowodanowej
miesnie szkieletowe glowy, szyji, brzucha i grzbietu bez ilustr
Bez tytułu 1
wykład z cholestazy (bez zdjęć)
tkanki bez animacji
więcej podobnych podstron