
Budowa atomu
Pytania i odpowiedzi

2
1. Dane są konfiguracje elektronowe pewnych pierwiastków:
1s
2
2s
2
2p
6
3s
1
1s
2
2s
2
2p
6
3s
2
3p
3
1s
2
2s
2
2p
6
3s
2
3p
6
3d
7
4s
2
Dla każdego pierwiastka:
1. podać liczbę elektronów znajdujących się w atomie,
podać liczbę atomową pierwiastka i jego nazwę
2. podać, do którego bloku energetycznego należy dany
atom
3. podać ogólną liczbę elektronów walencyjnych i ich
rozmieszczenie na podpoziomach energetycznych
przyporządkowując je do odpowiednich bloków
energetycznych
4. na podstawie rozmieszczenia elektronów walencyjnych
określić jaki charakter chemiczny ma pierwiastek
5. na podstawie podanej struktury określić do którego
okresu należy dany pierwiastek
Przykłady zadań

3
Przykład 1- 1s
2
2s
2
2p
6
3s
1
1. Atom zawiera 11 elektronów a więc i jego liczba
atomowa wynosi 11, pierwiastkiem tym jest sód.
2. Atom zapełnia podpowłokę s, a więc należy tym
samym do bloku energetycznego s
3. Atom posiada jeden elektron walencyjny, który
znajduje się na powłoce o najwyższej liczbie
kwantowej czyli 3s
1
i właśnie dlatego znajduje się w
bloku energetycznym s
4. Pierwiastek najłatwiej osiąga optymalną ilość
elektronów na powłoce zewnętrznej, czyli oktet
oddając jeden elektron walencyjny, co czyni bardzo
łatwo i w związku z tym jest niezwykle aktywny
metalem.
5. Elektron walencyjny znajduje się w powłoce 3 i tym
samym znajduje się w okresie trzecim układu
okresowego
.

4
Przykład 2 – 1s
2
2s
2
2p
6
3s
2
3p
3
1. W atomie znajduje się 2 +2 + 6 + 2 + 3 = 15
elektronów, jego liczba atomowa równa się 15,
atom jest atomem fosforu
2. Atom uzupełnia elektrony podpowłoki p więc
należy do bloku energetycznego p
3. Ogólna liczba elektronów walencyjnych wynosi
pięć, dwa na podpowłoce s i trzy na podpowłoce
p, dlatego pierwiastek o takim atomie należy do
bloku energetycznego p.
4. Posiadając
pięć
elektronów
walencyjnych,
pierwiastek może je zarówno przyjmować jak i
oddawać, jest więc niemetalem.
5. Powłoka walencyjna odpowiada głównej liczbie
kwantowej n = 3, pierwiastek ten znajduje się
więc w trzecim okresie

5
Przykład 3 – 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
7
1. Ogólna liczba elektronów: 2 + 2 + 6 + 2 + 6 + 2 +
7 = 27, co odpowiada jego liczbie atomowej, czyli
pierwiastkiem tym jest –
kobalt
2. Atom zapełnia podpowłokę d, należy więc do
bloku
energetycznego d
3. Elektrony walencyjne tego atomu to
dwa
elektrony
podpowłoki 4s i
siedem
elektronów podpowłoki d,
która co prawda nie posiada najwyższej wartości
głównej liczby kwantowej ale jest niezapełniona i
dlatego traktuje się ją jak podpowłokę walencyjną.
4. Jako zewnętrzna występuje, typowa dla metali,
podpowłoka s predestynująca atom do oddawania
elektronów. Pierwiastek ten ma więc charakter
metaliczny.
5. Wartość najwyższa głównej liczby kwantowej wynosi
4
, a więc pierwiastek znajduje się w okresie
czwartym układu okresowego.
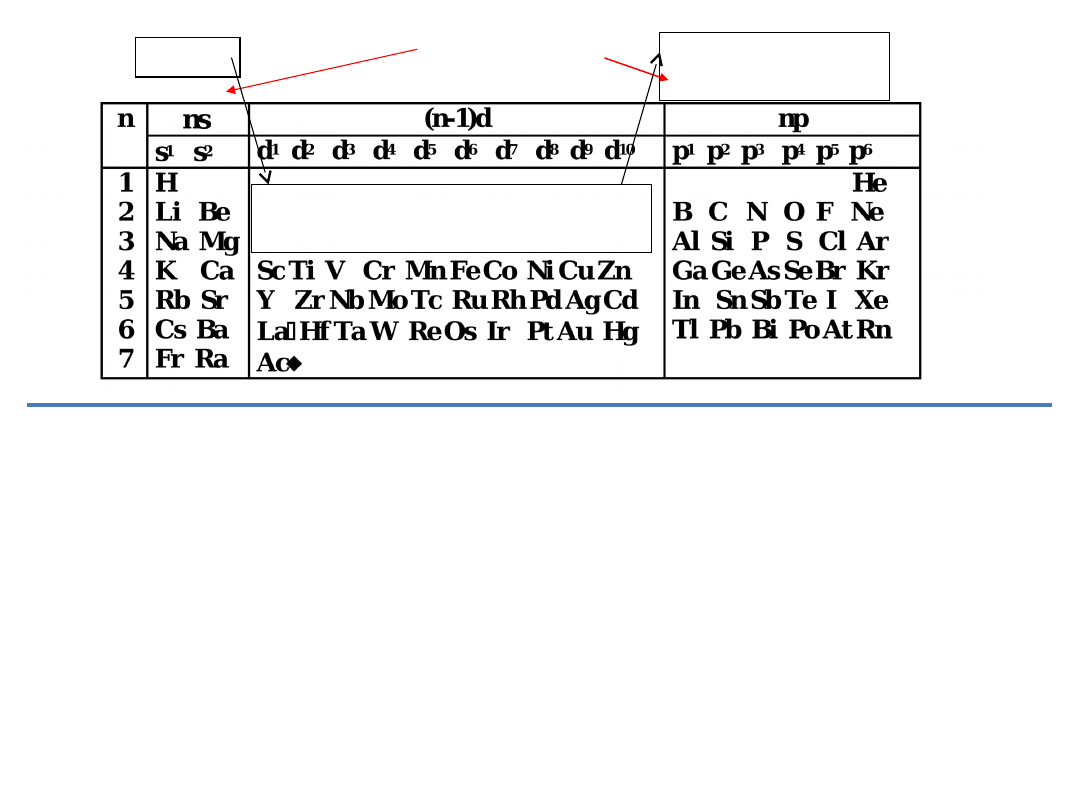
2. Znając następujące konfiguracje elektronowe
walencyjne pierwiastków: 4s
2
4p
2
;
5d
5
6s
2
;
4s
2
3d
10
określić ich położenie w układzie okresowym
Przykład 1 –
4s
2
4p
2
– pierwiastek znajduje się w
okresie
czwartym
, grupie czternastej lub inaczej
czwartej głównej
Przykład 2 –
5d
5
6s
2
– pierwiastek znajduje się w
okresie szóstym
,
piątej
podgrupie (grupie siódmej)
Przykład 3 –
4s
2
3d
10
– pierwiastek znajduje się w
okresie
czwartym
,
dziesiątej
podgrupie (grupie dwunastej)
6
Grupy
główne
1 2 3 4 5 6 7
8 9 10
13 14 15 16
17 18
1 2
3 4 5 6 7 8 9
10 11 12
3 4 5 6 7 8
1 2
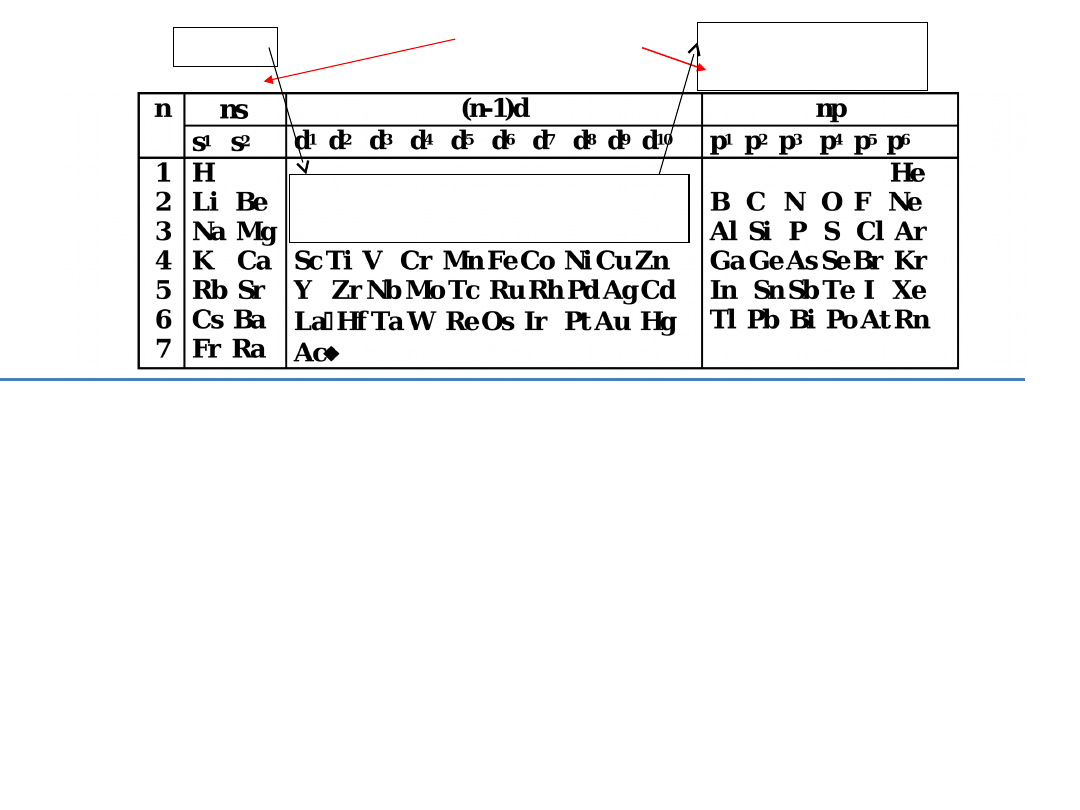
7
Położenie pierwiastka w okresie określa maksymalna wartość
głównej liczby kwantowej:
6p
3
–
okres szósty
gdyż podpowłoka p zapełniana jest jako
zewnętrzna
4f
9
– zapełnianie podpowłoki f następuje jako drugie od końca,
tak więc maksymalna wartość liczby kwantowej takiego atomu
musi być o dwa większa, czyli wynosi sześć a więc pierwiastek
znajduje się w
okresie szóstym
;
6d
4
– podpowłoka d zapełnia się jako przedostatnia, więc
najwyższa wartość głównej liczby kwantowej wynosi 7,
pierwiastek występuje w
okresie siódmym
3. Znając następujące ugrupowania elektronowe w powłokach
zewnętrznych: 6p
3
; 4f
9
; 6d
4
podać do których okresów należą
odpowiednie pierwiastki
Grupy
główne
1 2 3 4 5 6 7
8 9 10
13 14 15 16
17 18
1 2
3 4 5 6 7 8 9
10 11 12
3 4 5 6 7 8
1 2
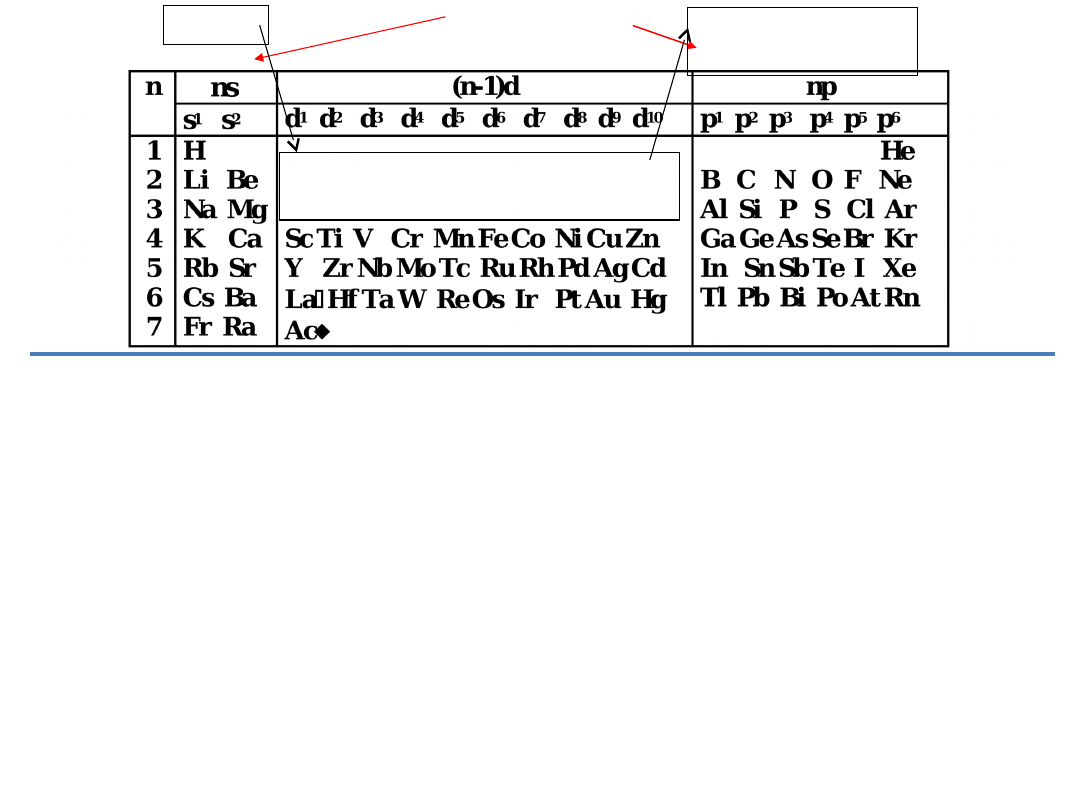
4. Podać grupy główne i poboczne w których atomy pierwiastków
maja
następujące
charakterystyczne
konfiguracje
elektronowe: s
2
p
4
; d
3
s
2
; p
5
s
1
; Które z nich należą do metali a
które do niemetali.
s
2
p
4
– chcąc podkreślić zapis ogólny można go również przedstawić z
uwzględnieniem ogólnego zapisu głównej liczby kwantowej: ns
2
np
4
,
pierwiastki należą do bloku energetycznego p, grupa XVI, lub
szósta
główna
, niemetal gdyż może elektrony oddawać i przyjmować.
d
3
s
2
– blok energetyczny d,
grupa piąta (lub trzecia podgrupa
),
metal gdyż posiada typową dla metali konfigurację s
2
jako
zewnętrzną
s
1
d
5
– zapis nietypowy, gdyż uwzględnia przeniesienie jednego
elektronu s do podpowłoki d. Zewnętrzna podpowłoka s wskazuje na
właściwości typowo metaliczne (zapis typowy dla atomu chromu!).
Grupa szósta lub czwarta podgrupa.
Grupy
główne
1 2 3 4 5 6 7
8 9 10
13 14 15 16
17 18
1 2
3 4 5 6 7 8 9
10 11 12
3 4 5 6 7 8
1 2
8
9
5. Podczas tworzenia jonu Fe
3+
, elektrycznie obojętny atom
żelaza traci dwa elektrony s i jeden elektron d . Podać
konfigurację elektronową trzeciej powłoki powstałego jonu. Jak
wytłumaczyć szczególną trwałość tego jonu ?
Fe
o
– 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
6
6. Podaj konfigurację elektronową atomu węgla w stanach
podstawowym i wzbudzonym
Stan podstawowy
: 1s
2
2s
2
2p
2
Stan wzbudzony:
1s
2
2s
1
2p
3
6
C
4s
2
3d
6
3d
5
Fe
o
– 3e → Fe
3+
szczególna trwałość tego jonu wynika z osiągnięcia bardzo
korzystnej konfiguracji elektronów walencyjnych, po jednym w
każdym z pięciu orbitali d. Jest to konfiguracja optymalna ze
względów energetycznych.
Fe
3+
- 1s
2
2s
2
2p
6
3s
2
3d
5
–

10
7. Jak wytłumaczyć zdolność manganu do występowania na +VII
stopniu utlenienia. Podaj schemat konfiguracji elektronowej
atomu manganu w stanie podstawowym i utlenionym
Powłoka walencyjna atomu manganu przedstawia się
następująco:
[Mn] 4s
2
3d
5
tak więc atom manganu posiada siedem elektronów
walencyjnych a co za tym idzie może być siedmiowartościowy.
Wartościowość ta jest trwała bowiem atom manganu osiąga
wówczas konfigurację gazu szlachetnego – argonu.
[Ar] = 1s
2
2s
2
2p
6
3s
2
3p
6
[Mn] 4s
2
3d
5
-7e
8. Pierwiastek oznaczony symbolem E tworzy wodorek
o wzorze EH
2
. Jaka jest wartościowość tego
pierwiastka? Do której grupy on należy ? Napisać
wzory tlenku tego pierwiastka na wyższych
stopniach utlenienia.
Teoretycznie wodorki takie mogą tworzyć pierwiastki grupy
drugiej i szesnastej. W treści zadania wspomina się o
tlenkach na wyższych stopniach utlenienia, więc w rachubę
wchodzi pierwiastek grupy XVI (VI głównej). Tak więc w
połączeniach z tlenem może wykazywać wartościowość IV
oraz VI a więc tworzy tlenki o wzorach
XO
2
oraz
XO
3
.
Grupy
główne
1 2 3 4 5 6 7
8 9 10
13 14 15 16
17 18
1 2
3 4 5 6 7 8 9
10 11 12
3 4 5 6 7 8
1 2
11

12
12
9. Który z dwu porównywanych tlenków wykazuje większe
właściwości zasadowe: Cr
2
O
3
czy CrO
3
; MnO czy Mn
2
O
7
W przypadku metali wykazujących wiele stopni utlenienia
obserwuje się zależność następującą:
W miarę wzrostu stopnia utlenienia charakter tlenku metalu
zmienia się z zasadowego przez amfoteryczny do kwasowego,
tak więc:
Cr
2
O
3
oraz Cr
2
O
7
– zważywszy, że chrom może być II, III oraz VI
wartościowy, na drugim stopniu wykazuje charakter zasadowy;
trzecim amfoteryczny zaś na szóstym kwasowy. Tlenek
chromu(III) ma charakter amfoteryczny zaś chromu(VI)
kwasowy.
Podobne rozumowanie przeprowadza się w wypadku tlenków
manganu. Tlenek manganu(II), w którym mangan ma najniższy
stopień utlenienia ma charakter zasadowy i dlatego
przykładowo występuje w formie jonu prostego Mn
2+
, mangan
na +VII stopniu utlenienia ma charakter kwasowy, tworząc
hipotetyczny kwas manganowy(VII) – HMnO
4
.
25
Mn - [Ar] 4s
2
3d
5
24
Cr- [Ar] 4s
1
3d
5

13
10.Jaki jest charakter następujących tlenków żelaza: FeO; Fe
2
O
3
;
FeO
3
?
Napisać wzory chemiczne: kwasu żelazowego(VI) i jego soli o
nazwach żelazian(VI) potasu i żelazian(VI) baru
11.Czy mogą być kationami pierwiastki na następującym stopniu
utlenienia: Mn(+VII); Cr(+VI); W(+VI); Mn(+II); Fe(+II); Fe(+VI);
Cr(+II)
Uwzględniając elektrowartościowości żelaza w poszczególnych
związkach można stwierdzić, że: FeO –charakter zasadowy; Fe
2
O
3
– amfoteryczny, FeO
3
– kwasowy.
Wzór związków: żelazianu(VI) potasu – K
2
FeO
4
, żelazian(VI) baru
– BaFeO
4
• Mn(+VII) – na najwyższym stopniu utlenienia mangan ma charakter
kwasowy, więc występuje w formie jonu reszty kwasowe, kwasu
manganowego(VII) – MnO
4
-
• Cr(+VI) – jest to najwyższy stopień utlenienia chromu, więc występuje
jako jon złożony np. reszty kwasu chromowego(VI – CrO
4
2-
)
• W(+VI) – jest to najwyższa wartościowość wolframu, więc występuje w
formie jonu złożonego, reszty kwasu woframowego(VI) – (WO
4
2-
)
• Mn(+II) – najniższy stopień utlenienia, mangan wykazuje charakter
zasadowy i tym samym tworzy jon prosty Mn
2+
• Fe(+II) – najniższy stopień utlenienia, charakter zasadowy więc tworzy
jony proste Fe
2+
• Fe(+VI) – najwyższa wartościowość, żelazo w tej postaci wykazuje
charakter kwasowy a więc występuje w formie jonu złożonego, reszty
kwasowej kwasu żelazowego(VI) – FeO
4
2-
• Cr(+II) – najniższy stopień utlenienia, charakter zasadowy, więc tworzy
jony proste Cr
2+

14
1
Atom pierwiastka o
konfiguracji elektronowej
w stanie podstawowym
1s
2
2s
2
2p
6
3s
1
w układzie
okresowym zajmuje
miejsce
w 3. okresie i 1. grupie
w 1. okresie i 3. grupie
w 3. okresie i 11. grupie
w 11. okresie i 3. grupie
nie można określić jego
położenia bo nie znana jest
liczna protonów
2
Izotony to atomy o tej
samej liczbie neutronów w
jądrze. Izotonami są np.:
wyłącznie pierwiastki
promieniotwórcze
wyłącznie pierwiastki z tej
samej grupy układu
okresowego
Ca
i
K
40
20
39
19
Ca
i
Ar
40
20
40
18
C
i
C
14
6
12
6
14
.
Pierwiastek X o liczbie
atomowej A i liczbie
masowej Z ( ) ulegając
przemianie α daje
pierwiastek Y o zapisie:
X
Z
A
Y
4
Z
2
A
Y
2
Z
A
Y
Z
2
A
Y
2
Z
4
A
Y
4
Z
2
A
25
.
Główna liczba kwantowa n=2
oraz poboczna liczba
kwantowa l=1 oznaczają
odpowiednio:
powłokę L i podpowłokę p
powłokę M i podpowłokę s
powłokę K i podpowłokę p
powłokę L i podpowłokę s
powłokę M i podpowłokę d
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
1 1 Budowa atomu Układ Odpowiedzi
1 1 Budowa atomu Układ Odpowiedzi
Budowa atomu i wiązania chemiczne test odpowiedzi
Wykład 1, budowa atomu, wiązania chemiczne
anomia pytania z odpowiedziami
chemia budowa atomu
Masaż Pytania i Odpowiedzi
AUTOMATYKA w pytaniach i odpowiedziach scan
INTERNA pytania - odpowiedzi, Interna
Parchy pytania z odpowiedziami, Weterynaria, III rok, kolokwia
Radiotelefon - pytania i odpowiedzi, AM SZCZECIN, GMDSS ( GOC ), wsio
Pytania i odpowiedzi, PAUTO
TWN Pytania i odpowiedzi 2014, Wykład(1)
pytania i odpowiedzi 2, PLC, plcc, PLC I
więcej podobnych podstron