
Struktura atomów, budowa materii i
równania schorinnger'a, zapobieganie
korozji.
Piotr Pabiańczyk
Mateusz Soja
Łukasz Sokół



Korozja
Korozja jest to stopniowe niszczenie
tworzyw metalowych i niemetalowych
pod wpływem chemicznego i
elektrochemicznego oddziaływania
środowiska w wyniku którego
zmieniają się stan i właściwości
niszczonego tworzywa.

Ochrona przed korozją
Środki zabezpieczające przed korozją:
• dobor składu chemicznego stopow
pracujących w warunkach korozji,
• ochrona katodowa,
• ochrona protektorowa,
• ochrona anodowa,
• tosowanie inhibitorow,
• powłoki i warstwy ochronne.

Zasady doboru składu chemicznego stopów w celu
zwiększenia odporności na korozję elektrochemiczną
Podatność metali i stopow na korozję
elektrochemiczną jest zależna od składu
chemicznego i struktury fazowej stopu. Odpowiedni
dobor składu chemicznego może spowodować
przesunięcie standardowego potencjału
elektrodowego stopu do dodatnich wartości,
zapewniając wysoką odporność na korozję.
Działanie takie wywołuje np. dodatek ok. 13% Cr w
stali. Dążenie do uzyskania struktury jednofazowej
stanowi więc jedną z zasad komponowania składow
chemicznych stopow odpornych na korozję
elektrochemiczną

Zasady doboru składu chemicznego stopów w celu
zwiększenia odporności na korozję gazową
Skład chemiczny stopu i jego zdolność do tworzenia
zgorzeliny, ktora odgrywa jednocześnie rolę warstwy
ochronnej, należy do najistotniejszych czynnikow
decydujących o przebiegu korozji gazowej. Dobre
własności ochronne wykazuje zgorzelina w postaci
ciągłej warstwy jednofazowej związku ,utworzona na
powierzchni stopu przez dodatek stopowy o
znacznym powinowactwie chemicznym z
utleniaczem.
Dodatkami takimi są np. Zn, Al, Si, Cr, Be i Mg.
Istotne jest przy tym, by związek ściśle przylegał do
metalicznego rdzenia i nie tworzył niskotopliwych
eutektyk z innymi produktami korozji.

Ochrona katodowa
Ochrona katodowa polega na dostarczaniu
elektronów do chronionego metalu z
zewnętrznego źródła i uczynieniu z niego
katody. Postępowanie takie powoduje że
metal staje się katodą a reakcja przebiega
w kierunku przeciwnym czyli jest redukcją.

Metodą tą można chronić:
•metale, miedź, ołow, mosiądze, pracujące w
roztworach wodnych lub glebie,
•metale i stopy pasywne, takie jak aluminium lub stal
odporna na korozję, podlegające korozji wżerowej,
•metale i stopy, takie jak mosiądze, stale odporne na
korozję, stale niskowęglowe,
•magnez i aluminium, ulegające korozji
naprężeniowej,
•metale i stopy, ulegające korozji zmęczeniowej,
•stale kwasoodporne i duraluminium, ulegające
korozji międzykrystalicznej,
•mosiądze, podlegające odcynkowaniu.
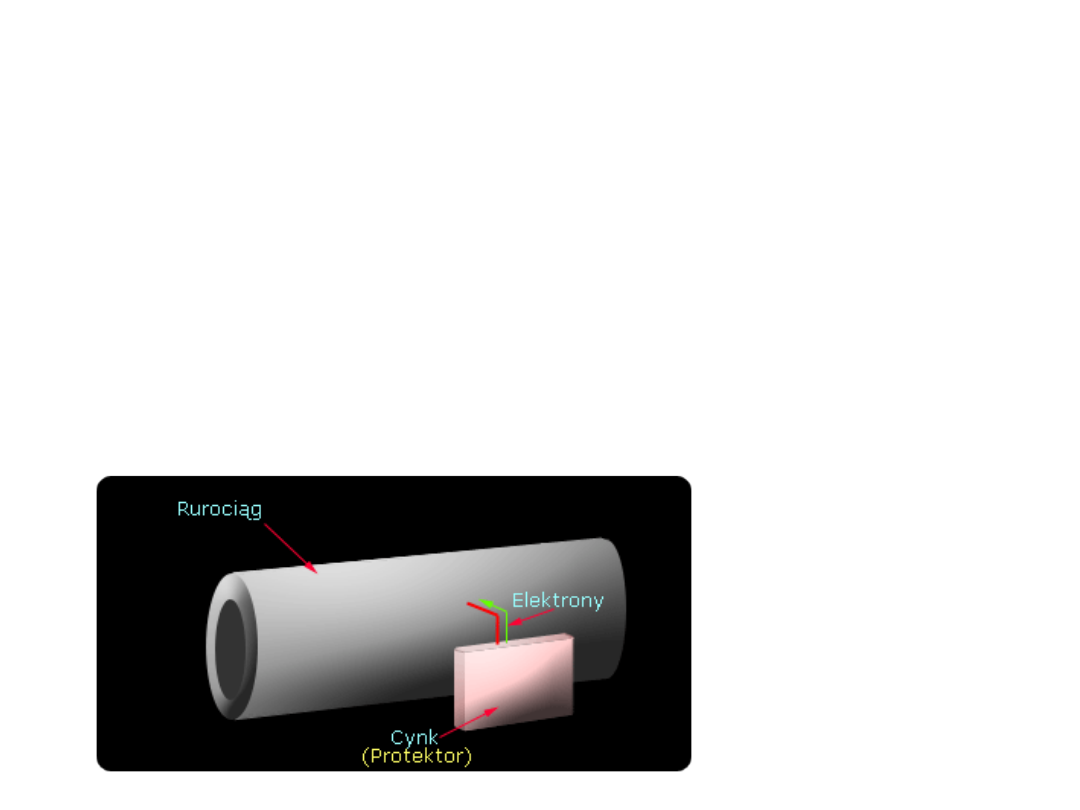
Ochrona protektorowa
Ochrona protektorowa jest odmianą ochrony
katodowej. Jeżeli zewnętrzna elektroda
charakteryzuje się niższym standardowym
potencjałem elektrodowym w szeregu napięciowym
niż chroniony metal, nie trzeba stosować
zewnętrznego źrodła prądu stałego.
Anoda taka, zwana protektorową, ktorą zwykle
stanowi magnez, cynk lub aluminium, wykazuje w
stosunku do stali niewielką rożnicę potencjału, Jedna
anoda protektorowa umożliwia ochronę niewielkiej
tylko powierzchni metalu.

Ochrona anodowa
Metale mniej szlachetne ze względu na swoją aktywność
spełniają rolę anody w większości ogniw
elektrochemicznych. Jeżeli jednak spowoduje się ich
pasywację, to korozja przebiega z mniejszą szybkością.
Pasywację uzyskuje się przez wytworzenie mocnej
polaryzacji anodowej zapobiegającej zachodzeniu normalnej
reakcji anodowej i dlatego nazywa się ją ochroną anodową.
Ochrona anodowa znacznie zmniejsza szybkość korozji, lecz
nie powoduje jej całkowitego ustania. Metodą tą mogą być
chronione zbiorniki i cysterny do przewozu i magazynowania
kwasow siarkowego i fosforowego, wodorotlenkow oraz
roztworow soli, np. siarczanow.

Inhibitory
Inhibitorem jest
nazywana substancja
chemiczna, ktora po
dodaniu do środowiska
korozyjnego wpływa na
zmniejszenie szybkości
korozji. Wzależności od
sposobu działania
rozrożnia się: pasywatory
oraz inhibitory
niepasywujące.

Pasywatory
Pasywatory po zetknięciu się z powierzchnią
metalu chronionego przed korozją wywołują
na powierzchni anodowej dużą gęstość
prądu, tak że zostaje przekroczony prąd
powodujący pasywację metalu.

Powłoki i warstwy ochronne
Powszechnym sposobem zabezpieczania
przed korozją, i to zarowno
elektrochemiczną jak i chemiczną, jest
stosowanie powłok ochronnych. W
zależności od użytych na nie materiałow
rozrożnia się:
• powłoki organiczne,
• powłoki nieorganiczne,
• powłoki metalowe.

Powłoki organiczne
Powłoki organiczne to wszelkiego typu
powłoki malarskie oraz powłoki z
tworzyw sztucznych. Jest to najbardziej
rozpowszechniony sposób
zabezpieczania metali przed wpływami
środowiska.

Powłoki nieorganiczne
Najczęściej stosowanym rodzajem powłok
nieorganicznych są powłoki ceramiczne. Powłoki z
emalii szklistych chronią materiały metalowe.
Na stali często są stosowane warstwy
fosforanowe, na które następnie nakłada się
warstwy malarskie. Warstwy ochronne
zapobiegające przede wszystkim korozji gazowej
mogą być tworzone przez wysokotopliwe tlenki, a
także cermetale oparte na układach równowagi
metale–tlenki, uzyskiwane metodą metalurgii
proszków.

Powłoki metalowe
Powłoki metalowe są stosowane do ochrony przed
korozją elektrochemiczną i chemiczną. Powłoki metalowe
mogą być uzyskane następującymi sposobami:
• galwanicznie – z wodnych roztworow lub z
roztopionych soli,
• natryskowo,
• naparowywaniem w prożni, metodą platerowania
wybuchowego lub przez walcowanie,
• dyfuzyjnie – z proszkow stopionych metali, z fazy
gazowej lub lotnych związkow metali.

Powłoki szlachetne
Powłoki szlachetne, np. na stali – niklowe, srebrne,
miedziowe, ołowiowe lub chromowe, są tworzone przez
metale o dodatnim lub wyższym standardowym potencjale
elektrodowym od metalu podłoża.
Powłoka taka musi być odpowiednio gruba, gdyż w
przypadku odsłonięcia metalu podłoża przez pory w
powłoce –wskutek powstawania ogniwa metal podłoża–
metal powłoki bardzo intensywnie przebiega korozja
elektrochemiczna.

Bibliografia

DZIĘKI ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Korozja
- Ochrona przed korozją
- Slide 6
- Slide 7
- Ochrona katodowa
- Slide 9
- Ochrona protektorowa
- Ochrona anodowa
- Inhibitory
- Pasywatory
- Powłoki i warstwy ochronne
- Powłoki organiczne
- Powłoki nieorganiczne
- Powłoki metalowe
- Powłoki szlachetne
- Bibliografia
- DZIĘKI ZA UWAGĘ
Wyszukiwarka
Podobne podstrony:
Cząsteczkowa budowa materii
pdf wykład 02 budowa materii, podstawowe prawa chemiczne 2014
Budowa materii wykład 2
Budowa materii id 94290 Nieznany (2)
struktura w s.v. werder bremen, Materiały Szkoleniowe Łukasz, uefa b kurs 2013
Wewnętrzna budowa materii GRUPA A
BUDOWA MATERIAŁÓW KOMPOZYTOWYCH
7 Struktura organizacyjna przedsiebiorstwa, Materiały Edukacyjne, Zarządzanie Przedsiębiorstwem, Prz
Budowa materiałów
Wewnętrzna budowa materii GRUPA B
Historyczny rys rozwoju pojęcia budowa materii atomu
Budowa materi Chemia
LAB9, Porównanie struktur i własności wybranych materiałów ceramicznych
budowa materii i wiazania chem, Chemia, Gimnazjum, kl1, Budowa atomu
Zmiany struktury i własności powierzchni materiałów
Druzga, wytrzymałość materiałów Ć, równanie różniczkowe osi odkształconej zadania
1 3 budowa materii
Budowa materii(1), Chemia(1)
więcej podobnych podstron