3
numer studenta
DOROTA BARTCZAK
imię i nazwisko
nr indeksu 116201
Wydział BIOTECHNOLOGII I NAUK O ŻYWIENIU
Semestr TRZECI
Rok akademicki 2003/2004
Laboratorium chemii fizycznej
Ćwiczenie nr 38
Oznaczanie ciepła parowania za pomocą tensometru.
Tytuł ćwiczenia
ocena_____
-1-
CZĘŚĆ TEORETYCZNA
I POJĘCIA PODSTAWOWE.
FAZA - to część układu oddzielona od pozostałych części wyraźnymi granicami oraz rządzona jednym równaniem stanu.
LICZBA STOPNI SWOBODY - to liczba parametrów układu, które możemy zmieniać nie niszcząc jego struktury.
SKŁADNIKI - są to wszystkie substancje chemiczne, z których zbudowany jest układ.
II REGUŁA FAZ GIBBSA.
Reguła ta określa maksymalną liczbę faz P w stanie równowagi fazowej układu o F stopniach swobody, zawierającego K składników.
F = K + 2 - P
III RÓWNANIE CLAUSIUSA - CLAPEYRONA.
Równanie to przedstawia zależność ciśnienia pary nasyconej od temperatury, dla przemian fazowych.
![]()
,
gdzie:
p - ciśnienie,
T - temperatura,
ΔHpar - zmiana entalpii przemiany,
ΔV - zmiana objętości składników (Vp - Vc).
Równanie to można scalkować przy założeniu, że para nasycona spełnia równanie stanu gazu doskonałego oraz uwzględniając, że Vp>>Vc:
![]()
.
Z powyższego równania można graficznie lub rachunkowo wyznaczyć ciepło parowania, jeżeli znana jest zależność prężności pary nasyconej od temperatury. Do kreślenia tej zależności służy tensometr.
IV PRAWO PODZIAŁU NERNSTA.
W stanie równowagi pomiędzy dwiema fazami stosunek stężeń (c1 i c2) trzeciej substancji rozpuszczonej w każdej z tych faz jest wielkością stałą (zwaną współczynnikiem podziału α) w danych warunkach temperatury i ciśnienia.
![]()
,
-2-
gdzie:
α - współczynnik podziału,
c1 - stężenie trzeciej substancji, rozpuszczonej w pierwszej fazie,
c2 - stężenie trzeciej substancji, rozpuszczonej w drugiej fazie.
Wartość współczynnika α zależy od temperatury, ciśnienia i rodzaju rozpuszczalnika.
CZĘŚĆ PRAKTYCZNA
I CEL I METODA ĆWICZENIA.
Celem ćwiczenia jest oznaczenie ciepła parowania toluenu przy pomocy tensometru. Pomiarów wysokości słupów rtęci w ramionach manometru dokonuję przy użyciu katetometru.
II TABELA Z WYNIKAMI I OBLICZENIA WSTĘPNE.
Lp |
t [oC] |
h1 [mmHg] |
h2 [mmHg] |
T [oK] |
103/T |
ln (p/po) |
1 |
21,5 |
151 |
118 |
294,65 |
3,39 ּ 10-3 |
-3,15 |
2 |
24,5 |
152 |
117 |
297,65 |
3,36 ּ 10-3 |
-3,08 |
3 |
29,0 |
156 |
111 |
302,15 |
3,31 ּ 10-3 |
-2,83 |
4 |
34,0 |
161 |
107 |
307,15 |
3,26 ּ 10-3 |
-2,65 |
5 |
39,0 |
168 |
101 |
312,15 |
3,20 ּ 10-3 |
-2,43 |
6 |
44,0 |
176 |
93 |
317,15 |
3,15 ּ 10-3 |
-2,22 |
gdzie:
t - temperatura w [oC],
h1 - wysokość rtęci w lewym ramieniu manometru [mmHg],
h2 - wysokość rtęci w prawym ramieniu manometru[mmHg],
T - temperatura w [oK],
p - ciśnienie, obliczane za pomocą wzoru:
p = h1 - h2,
po = 760 mmHg.
-3-
III WYKRES ZALEŻNOŚCI ln(p/po) = f(103/T).
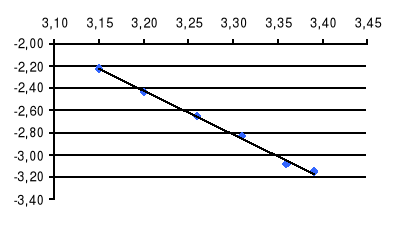
103/T
ln (p/po)
Wykres ten przedstawia liniową zależność określoną wzorem:
ln(p/po) = -3,92 (103/T) + 10,14
IV OBLICZENIA KOŃCOWE.
Ciepło parowania toluenu oblicza się ze wzoru:
![]()
,
gdzie:
b - współczynnik kierunkowy prostej na wykonanym wykresie
R - stała gazowa.
b = -3,92
![]()
ΔHp = -8,314 ּ (-3,92) = ![]()
V WNIOSKI.
Wartość ciepła parowania toluenu odczytana z tablic wynosi:
ΔHp = ![]()
.
Natomiast otrzymana przeze mnie, w wyniku przeprowadzonych pomiarów i obliczeń, wartość ciepła parowania toluenu to:
ΔHp = ![]()
.
Dość duża różnica pomiędzy odczytaną z tablic, a otrzymaną przeze mnie wartością ciepła parowania toluenu mogła być spowodowana zbyt małym odstępem czasu między pomiarami,
-4-
przez co temperatury wody w tensometrze nie zdążyła się podnieść do żądanego poziomu oraz ustabilizować. Odczyt temperatury dokonywany był zbyt wcześnie (w czasie wzrostu temperatury), co było przyczyną błędnego odczytania wysokości słupów rtęci w manometrze (dla danej temperatury), ponieważ zmieniały się one aż do momentu ustabilizowania się temperatury wody. Błąd w odczycie poziomów rtęci był przyczyną otrzymania złej wartości ciśnienia, a co za tym idzie niewłaściwego współczynnika b nachylenia prostej na wykresie ln(p/po) = f(103/T).
-5-
Wyszukiwarka
Podobne podstrony:
38 Zawory hydrauliczne
38 08
38 USTAWA O OC ARCH I INZ
piel 38 1 14 79 id 356923 Nieznany
2 (38)
35 38
2003 02 38
PRS UN str 20 21 i 38 43 nr stron nadrukowane
Psalm 38, Komentarze do Psalmów-Papież Jan Paweł II,Benedykt XVI
Odpowiedzi do tego drugiego ca dałem i jest na 38 pytań, instytucje i źródła prawa w UE
Zagadnienia z botaniki pytania od 30 do 38, Botanika
38 15
38
38 Olimpiada Wiedzy Technicznej I Stopień Rozwiązania Zadań
Prawa czlowieka a policja id 38 Nieznany
więcej podobnych podstron