Miejsce na identyfikację szkoły
Za rozwiązanie
wszystkich zadań
można otrzymać
łącznie 60 punktów.
PESEL ZDAJĄCEGO
Wpisuje zdający przed rozpoczęciem pracy
KOD
ZDAJĄCEGO
Arkusz opracowany przez Wydawnictwo Pedagogiczne OPERON.
Kopiowanie w całości lub we fragmentach bez zgody wydawcy zabronione. Wydawca zezwala na kopiowanie zadań przez dyrektorów
szkół biorących udział w programie Próbna Matura z OPERONEM.
KWIECIEŃ
2014
ARKUSZ PRÓBNEJ MATURY
Z OPERONEM
CHEMIA
POZIOM ROZSZERZONY
Czas pracy: 150 minut
Instrukcja dla zdającego
1. Sprawdź,czyarkuszegzaminacyjnyzawiera15stron(zadania1.–32.).
Ewentualnybrakzgłośprzewodniczącemuzespołunadzorującegoeg-
zamin.
2. Rozwiązaniazadańiodpowiedzizapiszwmiejscunatoprzeznaczonym.
3. W rozwiązaniach zadań rachunkowych przedstaw tok rozumowania
prowadzącydoostatecznegowyniku.
4. Piszczytelnie.Używajdługopisu/pióratylkozczarnymtuszem/atra-
mentem.
5. Nieużywajkorektora,abłędnezapisywyraźnieprzekreśl.
6. Zapisywbrudnopisieniebędąoceniane.
7. Podczasegzaminumożeszkorzystaćzkartywybranychtablicchemicz
nych,linijkiorazkalkulatora.
Życzymy powodzenia!
Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
2
Zadanie 1. (2 pkt)
PierwiastekYleżywukładzieokresowymw4okresie,wblokuenergetycznymd.Maon6 nie-
sparowanychelektronówwalencyjnych.
Podaj nazwę tego pierwiastka oraz zapisz konfigurację elektronową stanu podstawowego dla
tego atomu.
Nazwapierwiastka: ���������������������������������������������������������������������������������������������������������������������������
Konfiguracjaelektronowa: ���������������������������������������������������������������������������������������������������������������
Zadanie 2. (1 pkt)
Na podstawie budowy atomów wyjaśnij różnice w aktywności magnezu i baru.
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 3. (1 pkt)
Uzupełnij tabelę, wpisując w puste miejsca wzory sumaryczne przykładowych związków.
Wzór sumaryczny związku
Typ hybrydyzacji atomu centralnego
sp
3
sp
3
Liczba wolnych par elektronowych
występujących na atomie centralnym
1
2
Liczba wiązań typu v
3
2
Zadanie 4. (2 pkt)
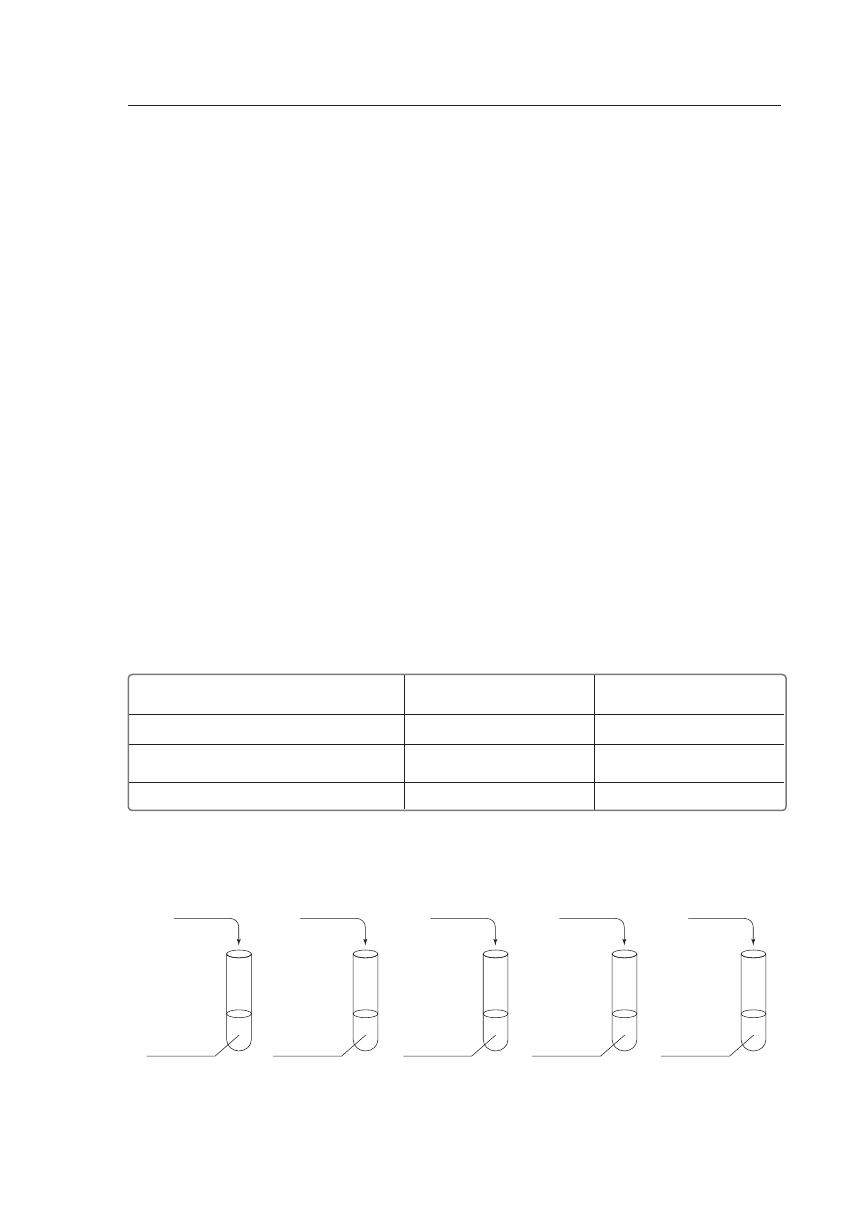
Uczeńprzeprowadziłszeregdoświadczeń,któreprzedstawiononaponiższymschemacie.
H
2
O
HCl
(aq)
H
2
O
NaCl
(aq)
H
2
O
NaOH
(aq)
I
II
III
H
2
O
AlCl
3(aq)
IV
H
2
O
CH
3
COONa
(aq)
V
Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
3
a) Napisz, w których probówkach stężenie jonów oksoniowych jest większe od stężenia jonów
wodorotlenowych.
��������������������������������������������������������������������������������������������������������������������������������������������������������������
b) Wskaż, w których probówkach pH > 7.
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Informacja do zadań 5. i 6.
Uczeń przeprowadził doświadczenie chemiczne, w którym do probówki wlał roztwór man-
ganianu(VII) potasu zakwaszony roztworem kwasu siarkowego(VI). Następnie do tego roz-
tworu dodał niewielką ilość stałego azotanu(III) potasu.
Zadanie 5. (3 pkt)
Napisz równania reakcji redukcji oraz utlenienia w formie jonowej skróconej, wykorzystując
do tego celu zapis jonowo-elektronowy. Następnie napisz równanie reakcji wraz z uzupełnio-
nymi współczynnikami stechiometrycznymi.
Równaniereakcjiredukcji:
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Równaniereakcjiutlenienia:
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Równaniereakcjiwrazzuzupełnionymiwspółczynnikamistechiometrycznymi:
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 6. (1 pkt)
Zapisz obserwacje z przeprowadzonego przez ucznia eksperymentu.
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 7. (1 pkt)
Wybierz spośród podanych jony, które w roztworach wodnych mogą pełnić funkcję tylko zasa-
dy Brønsteda.
NO
2
-
,HCOO
-
,NH
4
+
,CO
3
2-
,CH
3
NH
3
+
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
4
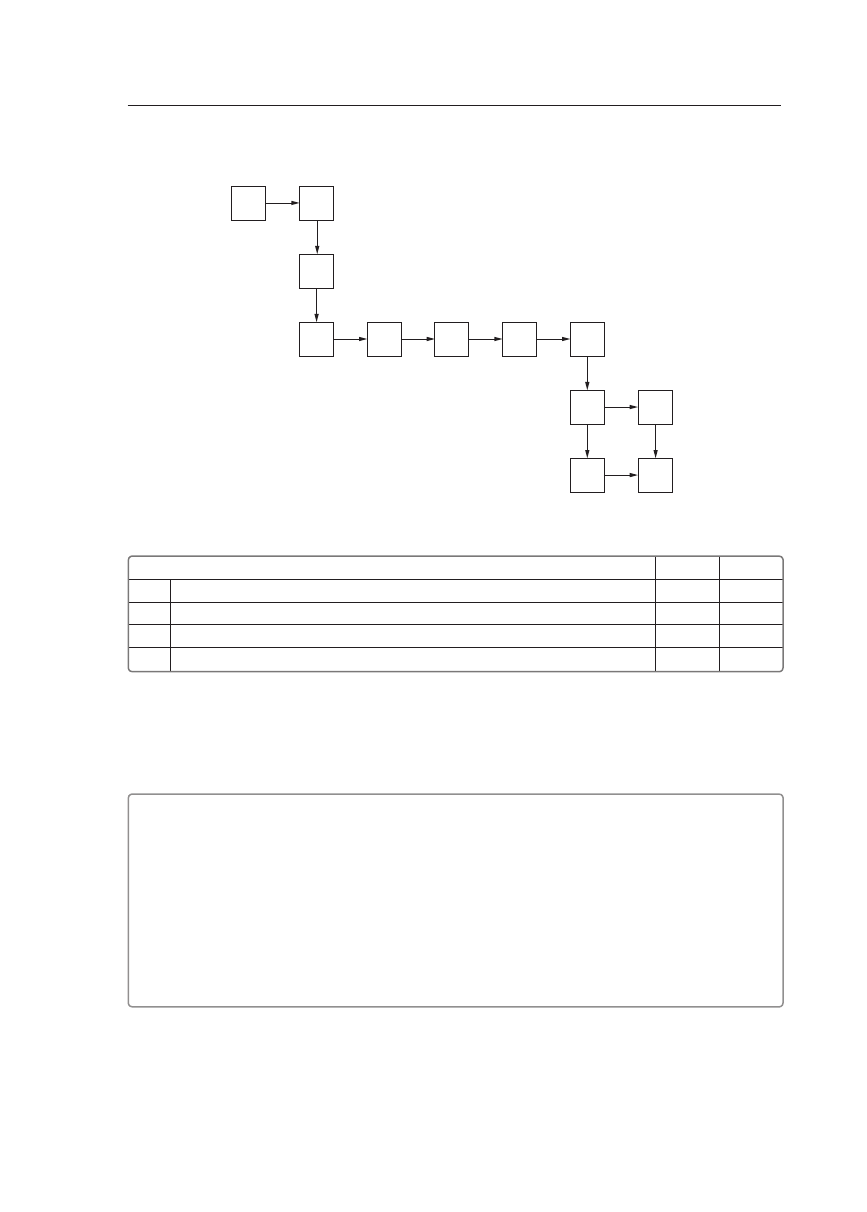
Zadanie 8. (2 pkt)
Naschemacieprzedstawionoszeregtorowy.
231
Th
90
228
Ra
88
228
Ac
89
228
Th
90
224
Ra
88
220
Rn
90
216
Po
90
231
Bi
90
208
Tl
81
221
Po
90
208
Th
90
212
Pb
82
Oceń prawdziwość zdań podanych w tabeli. Wpisz P, jeżeli zdanie jest prawdziwe, lub F, jeżeli
jest fałszywe.
Zdanie
P
F
1.
Szeregtorowyzaczynasięodradionuklidu
231
Th.
2.
Wszeregutorowymwystępuje7rozpadówbeta.
3.
208
Pbkończyszeregtorowy.
4.
224
Raulegaprzemianiealfa.
Zadanie 9. (2 pkt)
Oblicz, w jakiej ilości chalkopirytu zawierającego 82% CuFeS
2
znajduje się 125 kg żelaza. Wy-
nik podać z dokładnością do dwóch miejsc po przecinku.
Obliczenia:
Odpowiedź: ����������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
5
Zadanie 10. (2 pkt)
Reakcjaotrzymywaniatlenuprzebiegazwydajnością80%.
K
2
Cr
2
O
7
+3H
2
O
2
+4H
2
SO
4
$Cr
2
(
SO
4
)
3
+3O
2
+ K
2
SO
4
+7H
2
O
Oblicz, jaką objętość zajmie O
2
w temperaturze 20°C i pod ciśnieniem 2450 hPa, jeżeli w reak-
cji weźmie udział 6,02 · 10
22
cząsteczek K
2
Cr
2
O
7
.
Wartość stałej gazowej R wynosi:
R = 83,14
dm hPa
mol K
3
×
×
. Wynik podaj z dokładnością do
dwóchmiejscpoprzecinku.
Obliczenia:
Odpowiedź: ����������������������������������������������������������������������������������������������������������������������������������������
Zadanie 11. (2 pkt)
Do200cm
3
roztworukwasuetanowegoostężeniumolowymrównym0,05mol/dm
3
dodano
200cm
3
roztworuNaOHostężeniumolowymrównym0,25mol/dm
3
�
Oblicz pH otrzymanego roztworu.
Obliczenia:
Odpowiedź: ����������������������������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
6
Zadanie 12. (2 pkt)
Tleneksiarki(IV)reagujeztlenemzgodniezrównaniem:2SO
2
+O
2
m2SO
3
DH <0.
Oceń, w którą stronę przesunie się równowaga tej reakcji (w prawo, w lewo, nie zmieni się),
w wyniku:
a)podwyższeniatemperatury: ���������������������������������������������������������������������������������������������������������
b)obniżeniaciśnieniaukładu: ���������������������������������������������������������������������������������������������������������
c)wprowadzeniakatalizatora: ����������������������������������������������������������������������������������������������������������
d)wprowadzeniadoukładutlenu: ��������������������������������������������������������������������������������������������������
Zadanie 13. (3 pkt)
Zaplanuj doświadczenie pozwalające na określenie charakteru chemicznego odczynu wodnego
roztworu tlenku potasu. Narysuj schemat doświadczenia oraz zapisz obserwacje i wnioski.
Schematdoświadczenia:
Obserwacje: ����������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Wnioski: ���������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
7
Zadanie 14. (2 pkt)
ReakcjamiędzysubstancjamiAiBzachodzizgodniezrównaniem:
2A+3B$4C+ D�
Szybkośćtejreakcjijestopisanarównaniemkinetycznym:v = k[A]
2
[
B]
3
.Początkowestęże-
niasubstratówwynoszą:[A] =2mol/dm
3
; [B] =3mol/dm
3
.Stałaszybkościreakcjiwynosi
1 dm
12
/
mol
4
·s.
Oblicz szybkość tej reakcji w momencie, gdy stężenie substancji A zmaleje o 1 mol/dm
3
.
Obliczenia:
Odpowiedź: ����������������������������������������������������������������������������������������������������������������������������������������
Informacje do zadań 15. i 16.
Przeprowadzono elektrolizę wodnego roztworu siarczanu(VI) sodu z dodatkiem błękitu
bromotymolowego. Proces elektrolizy prowadzono z użyciem elektrod grafitowych.
Zadanie 15. (2 pkt)
Napisz równania reakcji, które przebiegały na elektrodach w czasie opisanego procesu.
Równaniereakcjianodowej: ������������������������������������������������������������������������������������������������������������
Równaniereakcjikatodowej: ����������������������������������������������������������������������������������������������������������
Zadanie 16. (2 pkt)
Zapisz obserwacje wynikające z przeprowadzonego doświadczenia.
Przestrzeńkatodowa: �������������������������������������������������������������������������������������������������������������������������
Przestrzeńanodowa: ��������������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
8
Zadanie 17. (1 pkt)
Wyjaśnij, dlaczego w celu usunięcia twardości węglanowej w wodzie powinno używać się katio-
nów wapnia, a nie kationów baru. Odpowiedź uzasadnij.
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 18. (2 pkt)
Korozjatoprocespolegającynaniszczeniupowierzchninaskutekoddziaływaniaśrodowiska.
Wymień dwie metody ochrony przed korozją przedmiotów wykonanych ze stali.
MetodaI: ��������������������������������������������������������������������������������������������������������������������������������������������
MetodaII: ������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 19. (2 pkt)
Mieszaninę2molikwasuetanowegoi3molialkoholuetylowegowśrodowiskukwasusiarko-
wego(VI)ogrzanodoodpowiedniejtemperatury.Poustaleniusięstanurównowagi,wnaczy-
niustwierdzonoobecność1,5molaetanianuetylu,1,5molawody,0,5molakwasuetanowego
i1,5molaalkoholuetylowego.
Oblicz wartość stałej równowagi dla tej reakcji.
Obliczenia:
Odpowiedź: ����������������������������������������������������������������������������������������������������������������������������������������
Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
9
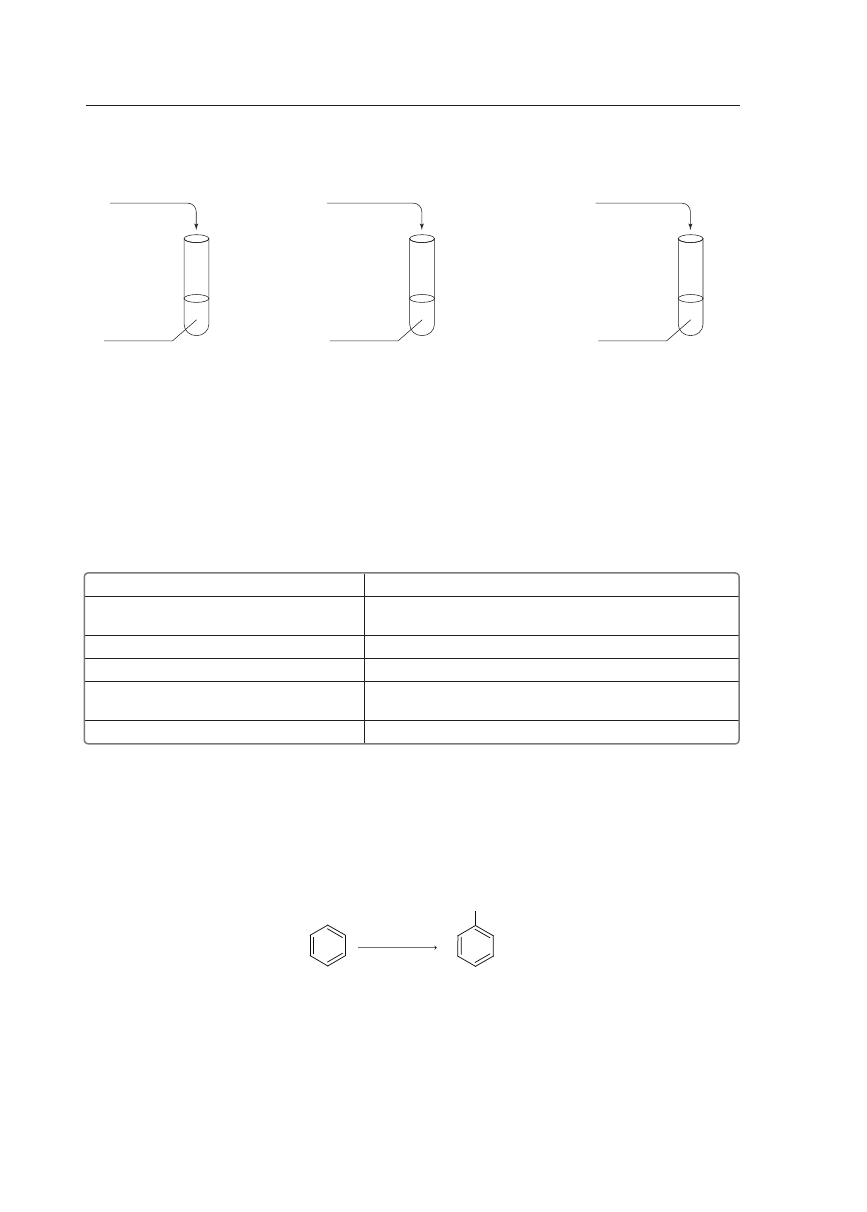
Zadanie 20. (3 pkt)
Przeprowadzonotrzydoświadczeniazilustrowanenarysunkach.
nadmiar HCl
(aq)
Na
2
CO
3(aq)
nadmiar NaOH
(aq)
CH
3
COOH
(aq)
nadmiar NaOH
(aq)
Al(OH)
3(aq)
I
II
III
Dla każdego doświadczenia zapisz równanie reakcji w formie jonowej skróconej.
DoświadczenieI: �������������������������������������������������������������������������������������������������������������������������������
DoświadczenieII:������������������������������������������������������������������������������������������������������������������������������
DoświadczenieIII: ����������������������������������������������������������������������������������������������������������������������������
Zadanie 21. (2 pkt)
Połącz w pary nazwy związków organicznych i opisy ich zastosowań.
Nazwa związku
Zastosowanie
1.Benzoesansodu
A.Stosowanyjestwdużychilościachdootrzymywania
kauczukówsyntetycznych.
2.Etanianetylu
B.Stosowanyjestjakorozpuszczalnik,np.farbilakierów.
3.Butan
C.Stosowanyjestjakośrodekdokonserwacjiżywności.
4.Styren
D.Stosowanyjestwpłynachniezamarzającychdo
chłodnicsilnikówsamochodowych.
5.Glikoletylenowy
E.Stosowanyjestnp.doprodukcjibenzynysyntetycznej.
1.................2.................3.................4.................5.................
Zadanie 22. (1 pkt)
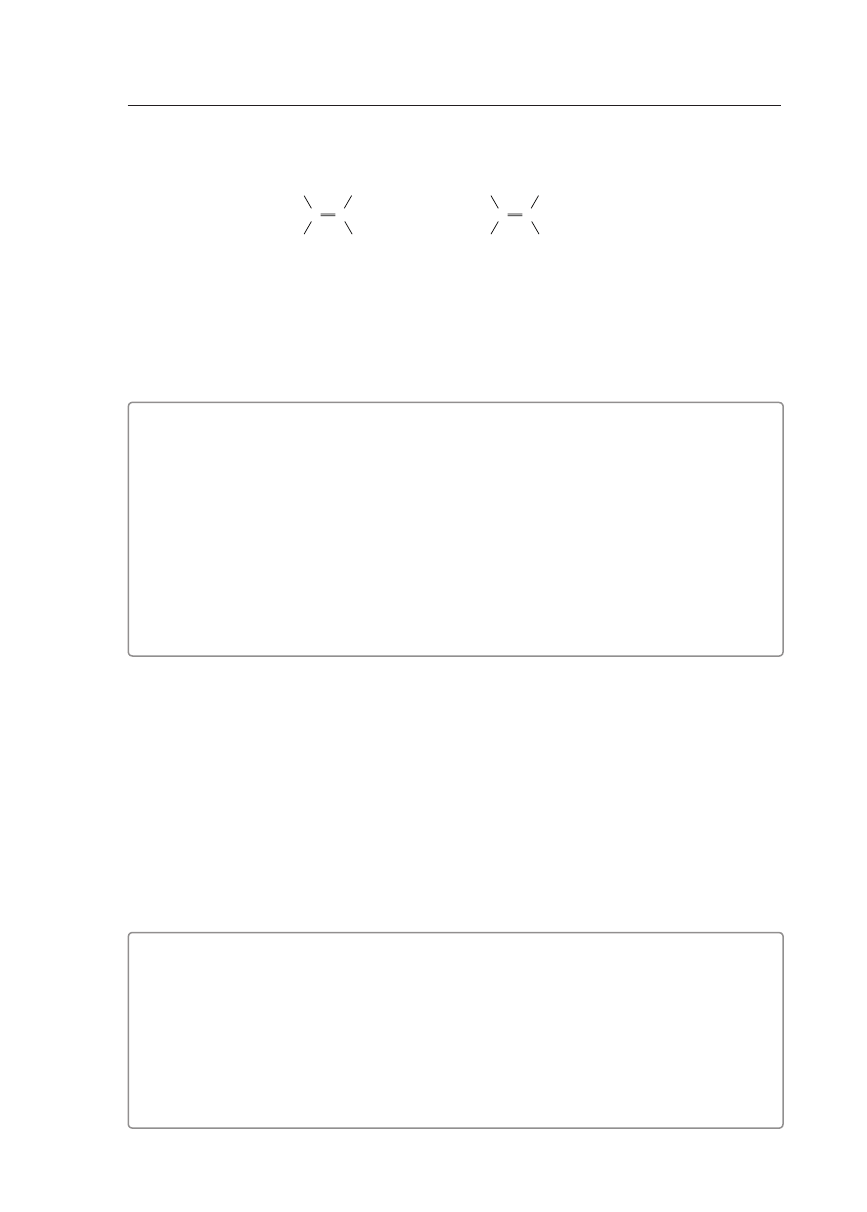
Poniżejprzedstawionoschematreakcjinitrowaniabenzenu.
Podaj wzór jonu, który w poniższej reakcji pełni funkcję odczynnika elektrofilowego.
HNO
3(stężony)
H
2
SO
4(stężony)
NO
2
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
10
Zadanie 23. (1 pkt)
Napisz, jaki rodzaj izomerii reprezentują poniższe związki.
Cl
H
C
C
Cl
CH
2
CH
3
H
Cl
C
C
Cl
CH
2
CH
3
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 24. (3 pkt)
Zaplanuj doświadczenie, w którym można wykazać różnicę w mocy kwasów etanowego i ste-
arynowego. Narysuj schemat doświadczenia oraz zapisz obserwacje oraz wnioski.
Schematdoświadczenia:
Obserwacje:
probówkaI: ����������������������������������������������������������������������������������������������������������������������������������������
probówkaII:���������������������������������������������������������������������������������������������������������������������������������������
Wnioski: ���������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 25. (1 pkt)
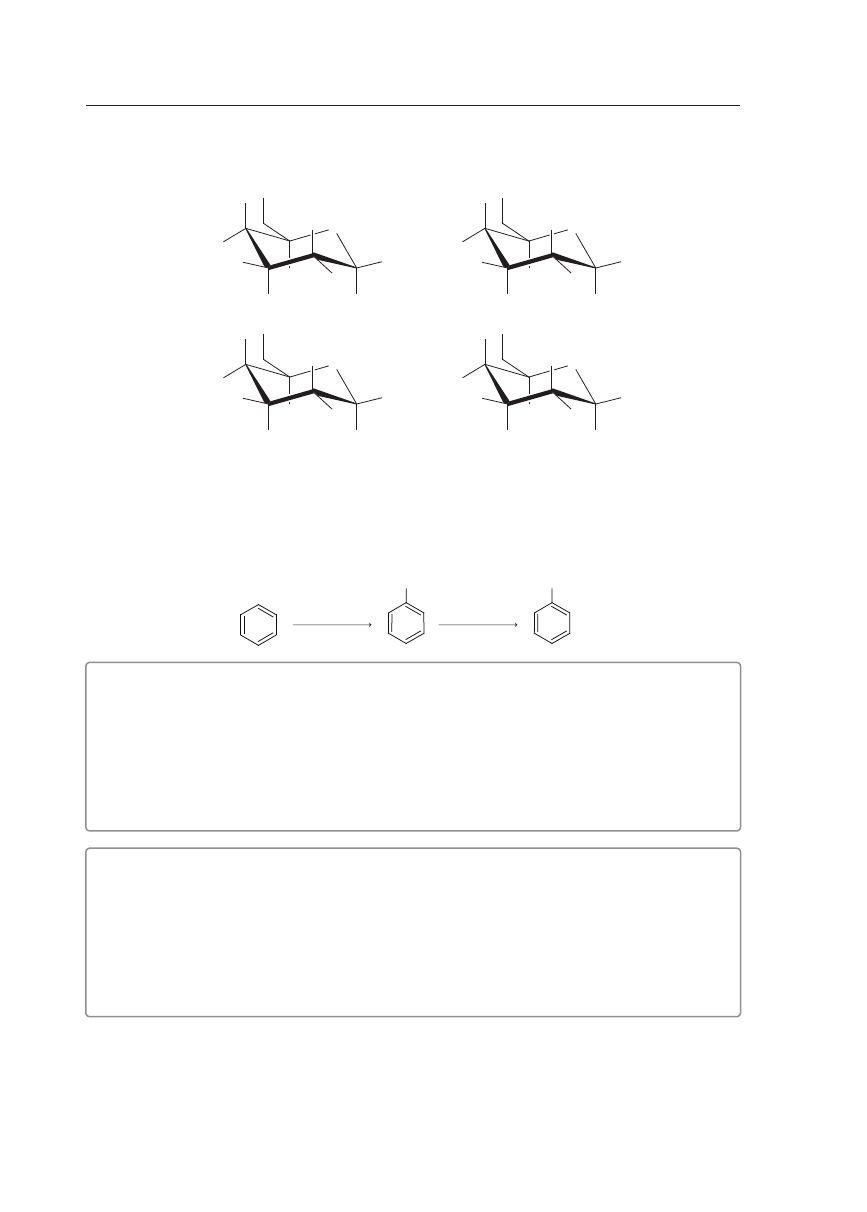
Narysuj schemat reakcji, która pozwoli przeprowadzić węglik wapnia (karbid) w metylobenzen.
Schematdoświadczenia:
Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
11
Zadanie 26. (1 pkt)
Spośród podanych wzorów cukrów wskaż ten, który przedstawia wzór a-D-glukopiranozy.
I
H
H
H
H
H
OH
OH
OH
OH
HO
O
II
H
H
H
OH
H
OH
OH
OH
OH
HO
O
III
HO
HO
H
H
H
H
OH
OH
OH
H
HO
O
IV
H
H
OH
H
OH
OH
H
H
HO
O
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 27. (2 pkt)
Zapisz równania reakcji przedstawionych na poniższym schemacie.
reakcja I
Cl
reakcja II
ONa
ReakcjaI
ReakcjaII

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
12
Zadanie 28. (3 pkt)
Zaplanuj doświadczenie pozwalające określić i uzasadnij charakter chemiczny (kwasowy, za-
sadowy, amfoteryczny lub obojętny) tlenku berylu. Narysuj schemat doświadczenia, zapisz ob-
serwacje oraz wnioski.
Schematdoświadczenia:
Obserwacje: ����������������������������������������������������������������������������������������������������������������������������������������
Wnioski: ���������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
Zadanie 29. (2 pkt)
Oblicz stopień dysocjacji 0,01-molowego roztworu kwasu etanowego, którego pH wynosi 3.
Obliczenia:
Odpowiedź: ���������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
13
Zadanie 30. (2 pkt)
Do zamkniętego naczynia zawierającego w warunkach normalnych 7,8 dm
3
chlorowodoru
wprowadzononadmiaramoniaku.
Oblicz, ile gramów chlorku amonu powstało. Wynik podaj z dokładnością do dwóch miejsc po
przecinku.
Obliczenia:
Odpowiedź: ���������������������������������������������������������������������������������������������������������������������
Zadanie 31. (2 pkt)
Zaplanuj doświadczenie pozwalające na wykrycie białka w śmietanie. Narysuj schemat do-
świadczenia i zapisz obserwacje.
Schematdoświadczenia:
Obserwacje: ����������������������������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
14
Zadanie 32. (2 pkt)
Depolimeryzacjajestprocesemodwrotnymdopolimeryzacji.Polichlorekwinyluulegadepoli-
meryzacji,wwynikuktórejotrzymujesiędwaprodukty.
Podaj nazwy tych produktów oraz opisz metodę, dzięki której można je zidentyfikować.
Nazwyproduktów: ����������������������������������������������������������������������������������������������������������������������������
Opismetody: ��������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������
��������������������������������������������������������������������������������������������������������������������������������������������������������������

Chemia. Poziom rozszerzony
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
15
BRUDNOPIS (nie podlega ocenie)

Wyszukiwarka
Podobne podstrony:
matura podstawowa probna matematyka operon 2014
OPERON 2014 Teatr klucz
matura probna 2014 3 id 288983 Nieznany
matura zamkor 2014 odpowiedzi
matura zamkor 2014 odpowiedzi
matura z j polskiego 2014
OPERON 2014 Teatr kartoteka
matura ustna 2014, Szkolne, Język polski Technikum Liceum kl.2, Wiersze, wiersze
OPERON 2014 Teatr klucz
matura odpowiedzi 2014 chemia
więcej podobnych podstron