1
ĆWICZENIE 1. Jakościowy rozdział barwników roślinnych na drodze
chromatografii kolumnowej i cienkowarstwowej
WSTĘP TEORETYCZNY
Chlorofil jest jednym z najważniejszych barwników występujących w przyrodzie. Jest on
zdolny do przeprowadzania energii świetlnej w energię chemiczną w procesie fotosyntezy, gdzie z
dwutlenku węgla i wody powstaje cząsteczka glukozy i tlen uwalniany do atmosfery:
6CO
2
+ 6H
2
O
C
6
H
12
O
6
+ 6O
2
Chlorofil występuje m.in. w komórkach roślin wyższych, glonów i cyjanobakterii. Należy do
grupy związków zwanych związkami chelatowymi. W chelatach centralnie położony atom metalu
jest związany ze strukturą złożoną z atomów węgla, wodoru, tlenu i azotu Zawiera on cztery
połączone ze sobą pierścienie pirolowe, które łączy centralnie ułożony atom magnezu. W układzie
porfirynowym występują naprzemienne wiązania pojedyncze i podwójne, które tworzą układ
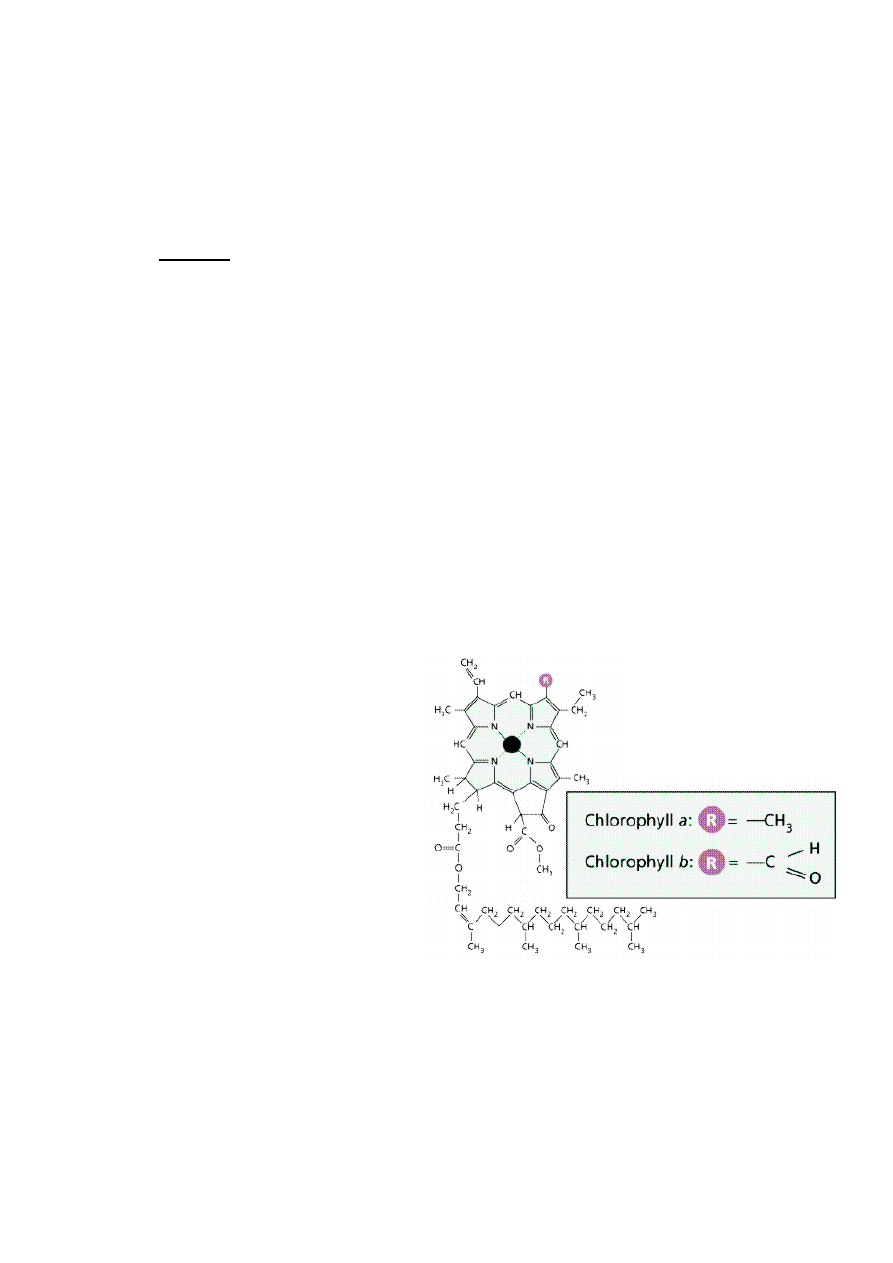
rezonansowy. Istnieje kilka rodzajów chlorofilu: chlorofil a, b, c, d i e.
Intensywny zielony kolor chlorofilu wykorzystywany jest jako pigment w przemyśle np.
używany jest do barwienia mydła, oliwy, wosków, tkanin i kosmetyków. Komercyjnie dostępne
pigmenty o strukturze chemicznej podobnej do chlorofilu wytwarzane są w szerokiej gamie barw np.
poprzez zastąpienie atomu magnezu atomem miedzi uzyskuje się pigment o barwie jasno niebieskiej.
Wzór chlorofilu a oraz chlorofilu b:
Hydroliza chlorofilu w warunkach kwaśnych
W środowisku kwaśnym chlorofil traci atom magnezu, w wyniku czego powstaje oliwkowo-
brunatna feofityna, a następnie odszczepiony zostaje łańcuch fitolu i powstaje feoforbidyna.
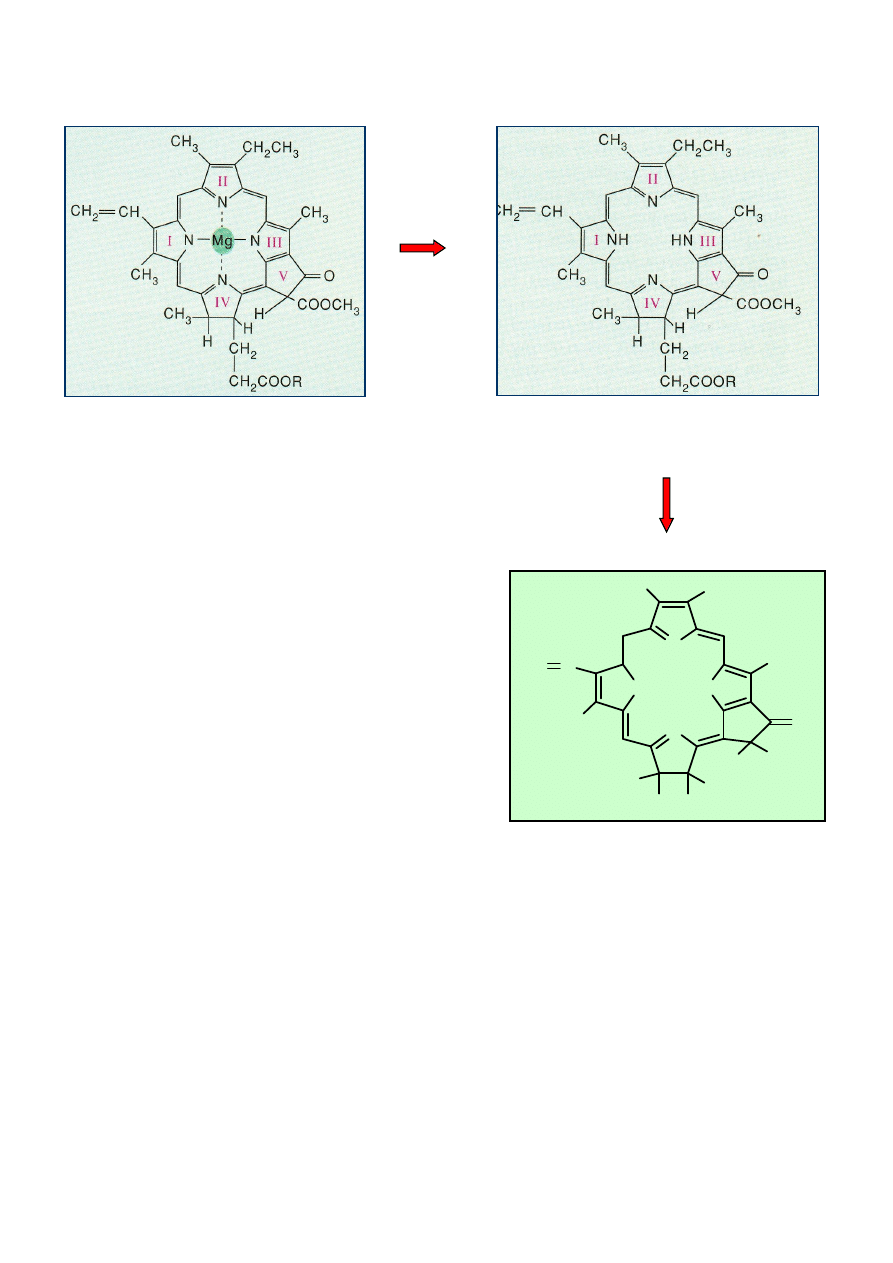
2
chlorofil
feofityna
H+
feoforbidyna
Hydroliza chlorofilu w warunkach zasadowych
W środowisku zasadowym z chlorofilu powstaje szereg różnych chlorofilin.
H+
N
N
H
N
NH
O
H
COOH
CH
3
CH
2
CH
3
C
H
3
C
H
C
H
2
C
H
3
C
H
3
H
H
CH
2
CH
2
COOH
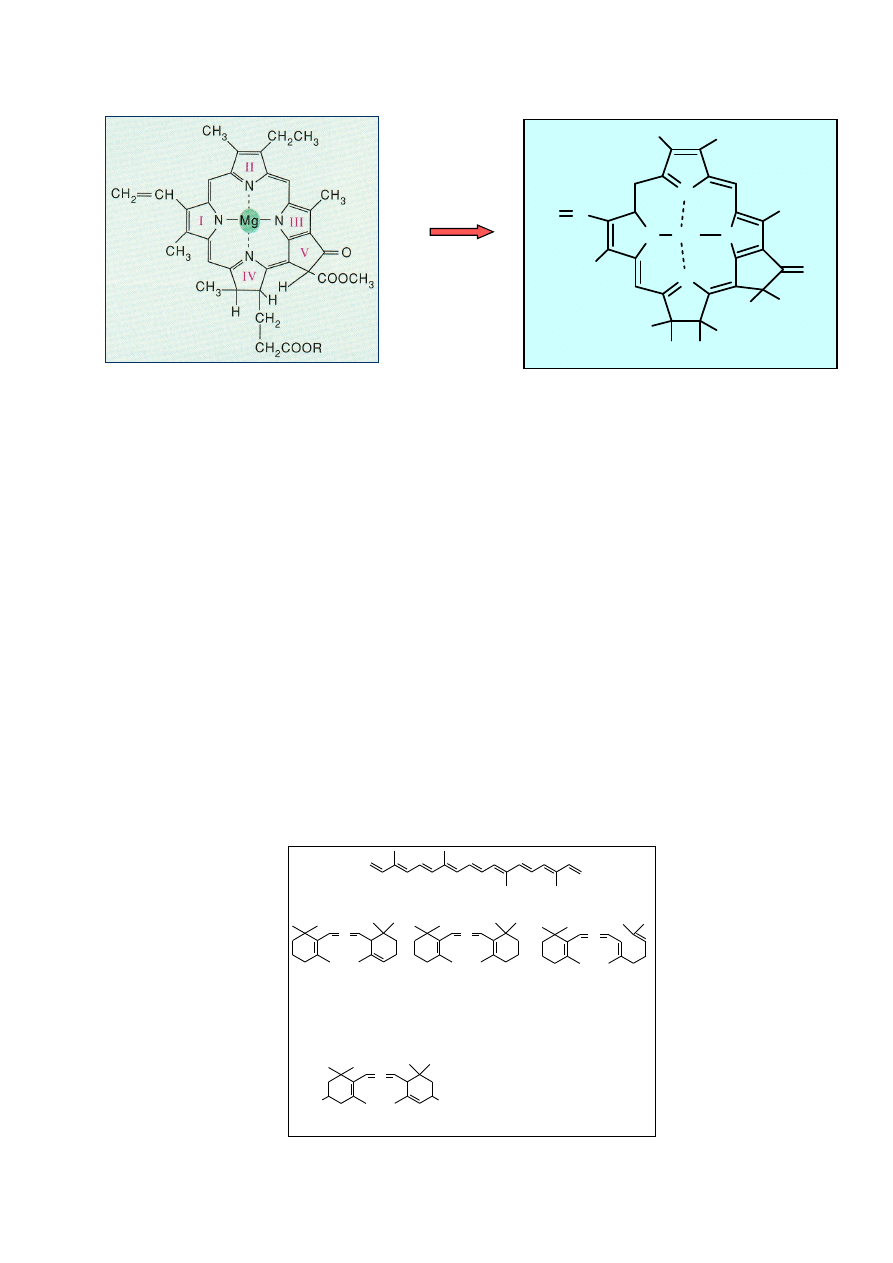
3
chlorofil
chlorofilina
Karotenoidy to grupa około 100 barwników roślinnych; strukturalnie są pochodnymi izopropenu;
zbudowane są z dwóch pierścieni połączonych długimi łańcuchami węglowodorowymi, w których
występują na przemian wiązania pojedyncze i podwójne, tworząc układ wiązań sprzężonych.
Karotenoidy dzielą się na pomarańczowe – karoteny, zbudowane wyłącznie z węgla i wodoru i na
żółto pomarańczowe ksantofile, zawierające również tlen, np. luteina. Karotenoidy są
pomocniczymi barwnikami fotosyntezy. Nadają żółtą, pomarańczową lub czerwoną barwę kwiatom,
owocom a także żółtku jaj (luteina). Zwierzęta nie potrafią produkować karotenoidów, ale mają
zdolność do gromadzenia ich w wątrobie. Wytwarzane są one natomiast bardzo powszechnie przez
bakterie, glony i rośliny wyższe. U roślin występują głównie w kwiatach, owocach, liściach
i nasionach.
Karoten to barwnik o kolorze pomarańczowym. Na największą uwagę zasługuje tzw. beta –
karoten, który stanowi przeciętnie 80% wszystkich karotenów roślin wyższych. Szczególnie obficie
występuje on w korzeniu marchwi. Od marchwi (łac. Daucus carota ) pochodzi jego nazwa. Dla
zwierząt wyższych zasadnicze znaczenie ma tylko beta – karoten. To właśnie z niego produkują one
witaminę A – retinol, którego dalsze produkty przemiany mają istotne znaczenie w procesie
widzenia (wchodzą w skład barwnika wzrokowego – rodopsyny). Dlatego beta - karoten nazywany
jest prowitaminą A.
Ksantofile to pochodne tlenowe karotenów (hydroksylowe, ketonowe, aldehydowe, karboksylowe).
Mają barwę żółtą lub brązową (gr. ksanthos – żółty). Powstają one przy utlenianiu karotenów przy
pomocy enzymów - tzw. oksydaz mieszanych. Najbardziej popularne są pochodne hydroksylowe,
których najbardziej rozpowszechnionym przedstawicielem jest luteina.
R
R
R
R
O
H
OH
R=C
20
H
24
=
alfa-karoten
gamma-karoten
luteina
beta-karoten
KAROTENY
KSANTOFIL
OH
-
N
N
N
N
O
H
COOH
CH
3
CH
2
CH
3
C
H
3
C
H
C
H
2
C
H
3
C
H
3
H
H
CH
2
CH
2
COOH
Mg
4
Wśród jesiennych liści spotykamy też barwę intensywnie czerwoną. Odpowiedzialne za nią są
jednak inne barwniki – antocyjany, które w przeciwieństwie do karotenoidów, nie występują w
liściach cały czas, ale są jesienią specjalnie syntetyzowane.
Chromatografia
Chromatografia jest metodą rozdziału wykorzystującą różnice w oddziaływaniu poszczególnych
związków z dwiema fazami: fazę stacjonarną (ciecz lub ciało stałe) i fazę ruchomą (ciecz lub gaz).
Chromatografia znajduje szerokie zastosowanie jako metoda wyodrębniania i oczyszczania
związków (m.in.chromatografia kolumnowa) jak również analiz mieszanin (m.in. chromatografia
cienkowarstwowa TLC)
CHROMATOGRAFIA
ROZDZIELCZA
ADSORPCYJNA
rozdział polega na podziale składników
rozdział polega na selektywnej adsorpcji
mieszaniny pomiędzy fazy stacjonarną i ruchomą składników mieszaniny na powierzchni
ciała stałego
(układ ciecz-ciecz)
(układ ciecz-gaz)
(układ ciało stałe – ciecz)
chromatografia
chromatografia
chromatografia
chromatografia
bibułowa
gazowa
kolumnowa
cienkowarstwowa
(TLC)
Chromatografia adsorpcyjna
Adsorpcję (nagromadzenie substancji na zewnętrznej powierzchni ciał stałych) wykorzystuje się do
rozdzielenia mieszanin na podstawie różnic w powinowactwie różnych ciał stałych na powierzchni
adsorbenta.
Środki adsorbujące można podzielić na:
- niepolarne (węgiel aktywny, niektóre żywice organiczne)
- polarne (tlenek glinu, żel krzemionkowy, węglowodany tj. skrobia, cukier, celuloza)
W przypadku polarnego adsorbenta kolejność z jaką składniki mieszaniny pojawiają się na płytce
TLC/kolumnie zależy od ich względnych polarności. Tak więc w przypadku dwóch składników
różniących się polarnością składnik bardziej polarny silniej adsorbuje się na powierzchni adsorbenta
(na płytce TLC znajduje się bliżej linii startu; na kolumnie bliżej miejsca naniesienia związku),
natomiast składnik mniej polarny eluowany jest niepolarnym rozpuszczalnikiem (na płytce TLC
znajduje się wyżej od składnika bardziej polarnego; na kolumnie bliżej miejsca wycieku)
Chromatografia cienkowarstwowa (TLC)
W metodzie tej stosuje się warstwę fazy stacjonarnej (najczęściej żel krzemionkowy)
naniesionej na podłoże (płytki szklane, folia aluminiowa, folia z PEG), przylegającej do płytki dzięki
dodatkowi środka wiążącego np. siarczanu wapnia, gipsu). Fazą ruchomą jest ciecz (rozpuszczalniki
organiczne lub ich mieszaniny).
Chromatografia cienkowarstwowa służy do szybkiej analizy jakościowej. Stosuje się ją
głównie do określenia liczby składników w próbce, do wykrywania określonego związku w
mieszaninie oraz jako wstępną próbę przy poszukiwaniu warunków do chromatografii kolumnowej.
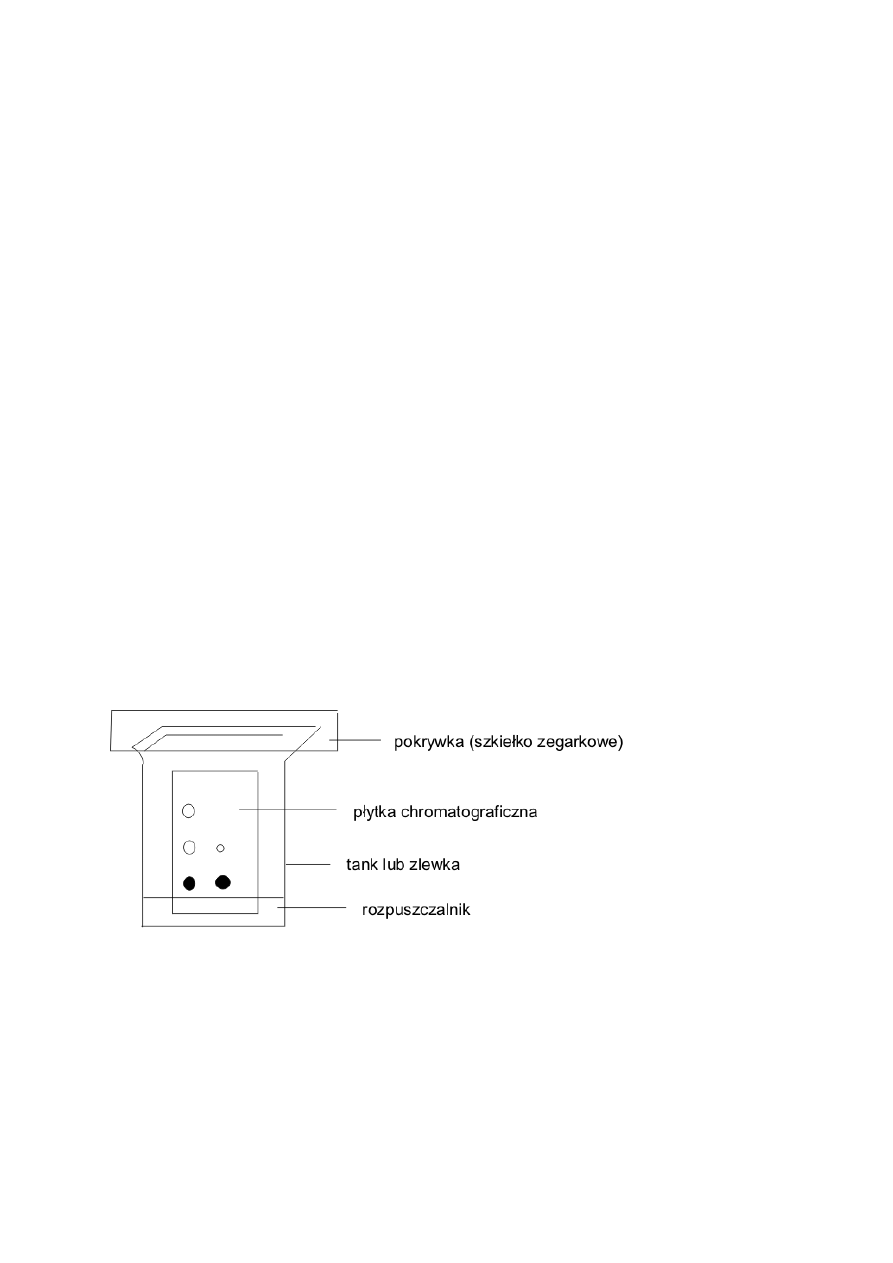
5
Wykonanie analizy TLC obejmuje następujące czynności:
- przygotowanie płytki
- naniesienie badanego roztworu (ewentualnie wzorców, substratów)
- rozwinięcie chromatogramu
- wywołanie chromatografu (wizualizacja)
- analizę wyników
Przygotowanie płytki pokrytej żelem krzemionkowym polega na jej przycięciu nożyczkami do
odpowiedniego wymiaru, zaznaczeniu ołówkiem linii startowej w odległości ok. 1cm od dolnego
brzegu i torów, na które będą nanoszone badane roztwory.
Nanoszenie próbki na płytkę. Nanoszoną próbkę rozpuszczamy w dowolnym, łatwo lotnym
rozpuszczalniku. Roztwór o stężeniu ok. 5-10% sporządzamy w probówce Eppendorfa. Próbkę
nanosimy na płytkę za pomocą cienkiej kapilary. Kapilarę zanurzamy w roztworze, a następnie
dotykamy lekko jej końcem płytkę chromatograficzną na linii startowej. Należy starać się, aby
powstająca plama miała średnicę nie większą niż 2-3mm.
Rozwijanie chromatogramu. Chromatograf rozwijamy w komorze chromatograficznej. Wewnątrz
komory stawiamy bibułę, która nasiąkając rozpuszczalnikiem utrzymuje nasycenie komory jego
parami. Do komory nalewamy rozpuszczalnik lub mieszaninę rozpuszczalników do wysokości
ok.0.5 cm, należy zwrócić przy tym uwagę, czy poziom rozpuszczalnika znajduje się poniżej linii
startowej. Płytkę wstawiamy do komory pionowo - linią startową do dołu i zakrywamy pokrywkę. W
wyniku działania sił kapilarnych eluent wznosi się po płytce – powstaje więc chromatogram
„wstępujący”. Gdy rozpuszczalnik osiągnie wysokość ok. 0.5 cm od górnej krawędzi płytki,
wyjmujemy ją z komory, zaznaczamy czoło rozpuszczalnika i pozostawiamy do wyschnięcia lub
suszymy suszarką.
Przykład prostej komory chromatograficznej:
Wartością charakterystyczną dla danego związku w danych warunkach chromatograficznych
(faza stacjonarna, podłoże, rozpuszczalnik) jest współczynnik podziału R
f
. Jest on zdefiniowany
jako stosunek drogi, jaką na płytce przebył dany związek (droga a), do drogi, jaką w tym czasie
przebyło czoło rozpuszczalnika (droga b).

6
a
b
f
s
R
f
=
a
b
a – odległość od linii startowej do środka plamy
b - odległość od linii startowej do czoła rozpuszczalnika
f – czoło rozpuszczalnika
s – linia startowa
Wywoływanie chromatogramu.
- pozycje związków barwnych można ustalić bez trudu
- pozycje związków bezbarwnych, fluoryzujących pod wpływem promieniowania ultrafioletowego
można określić umieszczając płytkę w świetle lampy UV o długości fali 254 nm.
- umieszczenie płytki w pojemniku zawierającym kryształki jodu. Związki organiczne barwią się na
brązowo. Plamy należy obrysować bezpośrednio po wyjęciu płytki, gdyż w skutek parowania jodu
plamy zanikają.
- substancje organiczne można wykryć także przez spryskanie stężonym kwasem siarkowym lub
roztworem stężonego kwasu siarkowego w etanolu,a następnie wygrzanie w temp 200
o
C do czasu,
gdy na płytce pojawią się ciemne plamy zwęglonych substancji organicznych
- do wywołania związków bezbarwnych stosuje się także inne metody wizualizacji wykorzystujące
charakterystyczne dla badanej grupy związków reakcje barwne. Wywołanie chromatogramu polega
wtedy na spryskaniu płytki odczynnikiem, który daje barwną reakcję z wywoływaną substancją.
Zwykle jest to odczynnik selektywny, reagujący z określoną grupą lub grupami funkcyjnymi
i bardzo czuły, np. ninhydryna stosowana do wykrywania aminokwasów – daje intensywnie
zabarwione na niebiesko produkty.
Chromatografia kolumnowa
Metodę tę wykorzystuje się najczęściej do rozdzielania mieszanin na skalę preparatywną i
wyodrębnienia składników mieszaniny każdego z osobno. Jeżeli jednak nie są nam potrzebne
wyodrębnione składniki mieszaniny, a celem analizy jest poznanie składu badanej mieszaniny, to
proces podziału chromatograficznego prowadzimy jedynie w celu zarejestrowania rodzaju i ilości
składników; takie zastosowanie nazywamy chromatografią analityczną.
Chromatografia kolumnowa polega na naniesieniu próbki rozdzielanej mieszaniny na fazę
stacjonarną (np. żel krzemionkowy, skrobia) umieszczoną w cylindrycznej kolumnie (ustawiona
pionowo rura szklana) i na rozwinięciu chromatogramu za pomocą wprowadzanej ciekłej fazy
ruchomej (niepolarny rozpuszczalnik lub mieszanina rozpuszczalników), która przepływa przez
kolumnę pod działaniem siły ciężkości lub pod wpływem niewielkiego nadciśnienia. W idealnym
przypadku każda indywidualna substancja układa się w kolumnie w postaci wąskiego pasa
adsorpcyjnego. Stały przepływ eluenta (fazy ruchomej) przez kolumnę prowadzi do pojawienia się

7
na dnie kolumny poszczególnych składników mieszaniny (pierwszy pojawia się składnik najmniej
polarny – najsłabiej adsorbuje się na powierzchni polarnego adsorbenta, a w dalszej kolejności coraz
bardziej polarne). W trakcie wymywania można stopniowo zwiększać polarność fazy ruchomej co
skraca ogólny czas chromatografii. W praktyce laboratoryjnej eluat (wyciek z kolumny) zbiera się w
wielu małych porcjach (zazwyczaj probówkach). Proces ten można zautomatyzować stosując
kolektory frakcji. W zebranych probówkach eluatu stwierdza się matodami analitycznymi czy
zawierają one eluowaną substancję (np. wykonuje się płytkę TLC).
Rozdział chromatograficzny mieszaniny dwuskładnikowej A+B w czasie; 1-faza stacjonarna, 2-faza
ruchoma (warstwa rozpuszczalnika- eluent), 3-kolba stożkowa , zawierająca wyciek z kolumny –
eluat:

8
WYKONANIE ĆWICZENIA
Odczynniki/materiały
zielone liście papirusa/pietruszki
2g
skrobia
~11g mała kolumna; 20g duża kolumna
heksan frakcja z nafty
ok.100 ml
mieszanina heksan frakcja z nafty 6 ml /metanol 3 ml
Wykonanie:
1) Przygotowanie wyciągu z liści. Liście papirusa/pietruszki utrzeć z piaskiem w moździerzu
porcelanowym. Dodać mieszaninę heksan/ metanol i pozostawić na 45min. Po tym czasie ekstrakt
zdekantować znad liści zwracając uwagę aby nie pobierać warstwy metanolowej.
pianka
do pompki wodnej
wata
chlorofil b
chlorofil a
luteina
karoteny
ok. 6-8cm
skrobi
Przygotowanie kolumny. Na dnie rurki
szklanej z dnem porowatym umieścić mały
kłębek waty i zalać ok. 5 ml heksanu. Spuścić
ok. 2 ml heksanu. Do rurki wprowadzić
skrobię (ilość zależna od wielkości kolumny
tak aby wysokość kolumny skrobiowej była
ok. 6-8cm) zawieszoną w heksanie. W rurce
wytwarzamy podciśnienie za pomocą pompki
wodnej, uzupełniając heksanem poziom cieczy
nad skrobią aż do czasu „ubicia” kolumny.
Nad górną powierzchnią skrobi pozostawić
ok. 5 mm heksanu.
2) Rozwijanie chromatogramu. Za pomocą pipety wprowadzić ekstrakt z liści papirusa/pietruszki
(objętość jednej pipetki), uważając aby nie wzburzyć górnej powierzchni skrobi. Gdy cały ekstrakt
zaadsorbuje się na skrobi, dodać heksan na wysokość ok. 5 cm, utrzymując ten poziom podczas
elucji barwników. Przepływ przez kolumnę niepolarnego rozpuszczalnika (heksanu)
z zastosowaniem podciśnienia w kolbie ssawkowej powoduje rozdział barwników roślinnych na
barwne pasma według następującej kolejności:

9
- żółtozielony chlorofil b (2 grupy –COOR i 1 grupa –CHO) – najbardziej polarny, który najsilniej
adsorbuje się na skrobi, pozostaje w górnej części kolumny,
- niebieskozielona warstwa chlorofilu a (2 grupy –COOR),
- żółta luteina (2 grupy –OH) – barwnik ksantofilowy
- pomarańczowe karoteny pozbawione grup funkcyjnych, zróżnicowane pod względem liczby
wiązań podwójnych – najmniej polarne
3) Chromatografia cienkowarstwowa barwników liści. Nanieść ekstrakt liści papirusa na płytkę
chromatograficzną zgodnie z instrukcją opisaną w ćw.1. Płytkę rozwinąć w układzie heksan : aceton
: trietyloamina (8:3:0,5 (v/v)). Plamy, które na chromatogamie fluoryzują różowo w świetle lampy
UV zawierają chlorofil. W roślinach znajduje się zasadniczo chlorofil a i chlorofil b, pozostałe
plamy prawdopodobnie pochodzą od produktów degradacji kompleksów chlorofilów z białkami. Na
plamę jednego z chlorofilów nakłada się plama pochodząca od ksantofilu. Najwyższa plama na
płytce odpowiada karotenom.
3) Wykonanie reakcji hydrolizy składników ekstraktu z liści. Do trzech probówek Eppendorfa
wprowadzić przy pomocy pipety Pasteura po 0.5ml ekstraktu z liści, a następnie dodać odpowiednio:
do pierwszej- 0.25ml 10% roztworu wodnego NaOH, do drugiej 0.25ml 10% HCl. Trzecią
pozostawić jako mieszaninę wyjściową (substrat analizowanych reakcji). Po upływie 30 min
przeprowadzić analizę TLC postępu reakcji stosując układ chromatograficzny heksan: aceton:
trietyloamina (8:3:0,5 (v/v)) nanosząc na płytkę chromatograficzną cztery tory- mieszaninę z reakcji
hydrolizy zasadowej, kwasowej, substrat oraz wszystkie mieszaniny na wspólnym torze.
Sprawozdanie z ćwiczenia powinno zawierać dokładny opis wykonanych czynności oraz
komentarz do uzyskanych wyników.
Wyszukiwarka
Podobne podstrony:
CW1 doc
~$cw1 doc
Metrologia elektroniczna sprawko cw1 doc
dobre cw1 DOC
CW1 (4) DOC
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
Opis zawodu Biochemik, Opis-stanowiska-pracy-DOC
Biochemia przedtermin 13 doc
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
Ćw1 MON WZM OPER doc
Ćw1 Zabezp wzm oper przed nasyceniem doc
Łańcuch oddechowy BIOCHEMIA doc
biochemia ćw1
Ćw1 Stabilność wzm operacyjnego ze sprz doc
BIOCHEMIA DAREK CHARMONIJKA DOC
Ćw1 Wzmacniacz operacyjny spraw doc
więcej podobnych podstron