
ROZPORZ
ĄDZENIE KOMISJI (WE) NR 6/2006
z dnia 5 stycznia 2006 r.
zmieniaj
ące załączniki I i II do rozporządzenia Rady (EWG) nr 2377/90 ustanawiającego
wspólnotow
ą procedurę określania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia zwierzęcego w odniesieniu do
dihydrostreptomycyny, tosylchloraminy sodu i
Piceae turiones recentes extractum
(Tekst maj
ący znaczenie dla EOG)
KOMISJA WSPÓLNOT EUROPEJSKICH,
uwzgl
ędniając Traktat ustanawiający Wspólnotę Europejską,
uwzgl
ędniając rozporządzenie Rady (EWG) nr 2377/90 z dnia
26 czerwca 1990 r. ustanawiaj
ące wspólnotową procedurę
okre
ślania maksymalnego limitu pozostałości weterynaryjnych
produktów leczniczych w
środkach spożywczych pochodzenia
zwierz
ęcego (
1
), w szczególno
ści jego art. 2 i 3,
uwzgl
ędniając opinie Europejskiej Agencji Leków wydane przez
Komitet ds. Weterynaryjnych Produktów Leczniczych,
a tak
że mając na uwadze, co następuje:
(1)
Wszystkie substancje czynne farmakologicznie, które s
ą
stosowane we Wspólnocie w produktach leczniczych
przeznaczonych do podawania zwierz
ętom hodowanym
w celu produkcji
żywności powinny być oceniane
zgodnie z rozporz
ądzeniem (EWG) nr 2377/90.
(2)
Dihydrostreptomycyna zosta
ła ujęta w załączniku I do
rozporz
ądzenia (EWG) nr 2377/90 w odniesieniu do
mi
ęśni, tłuszczu, wątroby, nerek i mleka bydła i owiec
oraz w odniesieniu do mi
ęśni, wątroby, nerek, skóry
i t
łuszczu trzody chlewnej, w naturalnych proporcjach.
Pozycja ta powinna zosta
ć rozszerzona z bydła i owiec
na wszystkie prze
żuwacze.
(3)
Tosylchloramina zosta
ła ujęta w załączniku II do rozpo-
rz
ądzenia (EWG) nr 2377/90 w odniesieniu do ryb
wy
łącznie dla postaci przenoszonej wodą oraz
w odniesieniu do byd
ła wyłącznie do stosowania miejs-
cowego.
Pozycja
ta
powinna
zosta
ć rozszerzona
w odniesieniu do koni wy
łącznie do stosowania
zewn
ętrznego.
(4)
W odniesieniu do Piceae turiones recentes extractum został
z
łożony wniosek o ustanowienie najwyższych dopusz-
czalnych limitów pozosta
łości. Substancja ta powinna
zosta
ć ujęta w załączniku II do wymienionego rozporzą-
dzenia w odniesieniu do wszystkich gatunków hodowa-
nych w celu produkcji
żywności wyłącznie do stoso-
wania doustnego.
(5)
Nale
ży zatem odpowiednio zmienić rozporządzenie
(EWG) nr 2377/90.
(6)
Aby umo
żliwić wykonanie przepisów niniejszego rozpo-
rz
ądzenia, jego stosowanie należy rozpocząć dopiero po
odpowiednim okresie, co pozwoli Pa
ństwom Członkow-
skim dostosowa
ć zezwolenia na wprowadzenie do
obrotu wydawane zgodnie z dyrektyw
ą 2001/82/WE
Parlamentu Europejskiego i Rady z dnia 6 listopada
2001 r. w sprawie wspólnotowego kodeksu odnosz
ącego
si
ę do weterynaryjnych produktów leczniczych (
2
).
(7)
Środki przewidziane w niniejszym rozporządzeniu są
zgodne z opini
ą Stałego Komitetu ds. Weterynaryjnych
Produktów Leczniczych,
PRZYJMUJE NINIEJSZE ROZPORZ
ĄDZENIE:
Artykuł 1
Za
łączniki I i II do rozporządzenia (EWG) nr 2377/90 zmienia
si
ę zgodnie z Załącznikiem do niniejszego rozporządzenia.
PL
6.1.2006
Dziennik Urz
ędowy Unii Europejskiej
L 3/3
(
1
) Dz.U. L 224 z 18.8.1990, str. 1. Rozporz
ądzenie ostatnio zmie-
nione rozporz
ądzeniem Komisji (WE) nr 1911/2005 (Dz.U. L 305
z 24.11.2005, str. 30).
(
2
) Dz.U. L 311 z 28.11.2001, str. 1. Dyrektywa ostatnio zmieniona
dyrektyw
ą 2004/28/WE (Dz.U. L 136 z 30.4.2004, str. 58).

Artykuł 2
Niniejsze rozporz
ądzenie wchodzi w życie trzeciego dnia po jego opublikowaniu w Dzienniku Urzędowym
Unii Europejskiej.
Rozporz
ądzenie stosuje się od dnia 7 marca 2006 r.
Niniejsze rozporz
ądzenie wiąże w całości i jest bezpośrednio stosowane we wszystkich
Pa
ństwach Członkowskich.
Sporz
ądzono w Brukseli, dnia 5 stycznia 2006 r.
W imieniu Komisji
Günter VERHEUGEN
Wiceprzewodniczący
PL
L 3/4
Dziennik Urz
ędowy Unii Europejskiej
6.1.2006
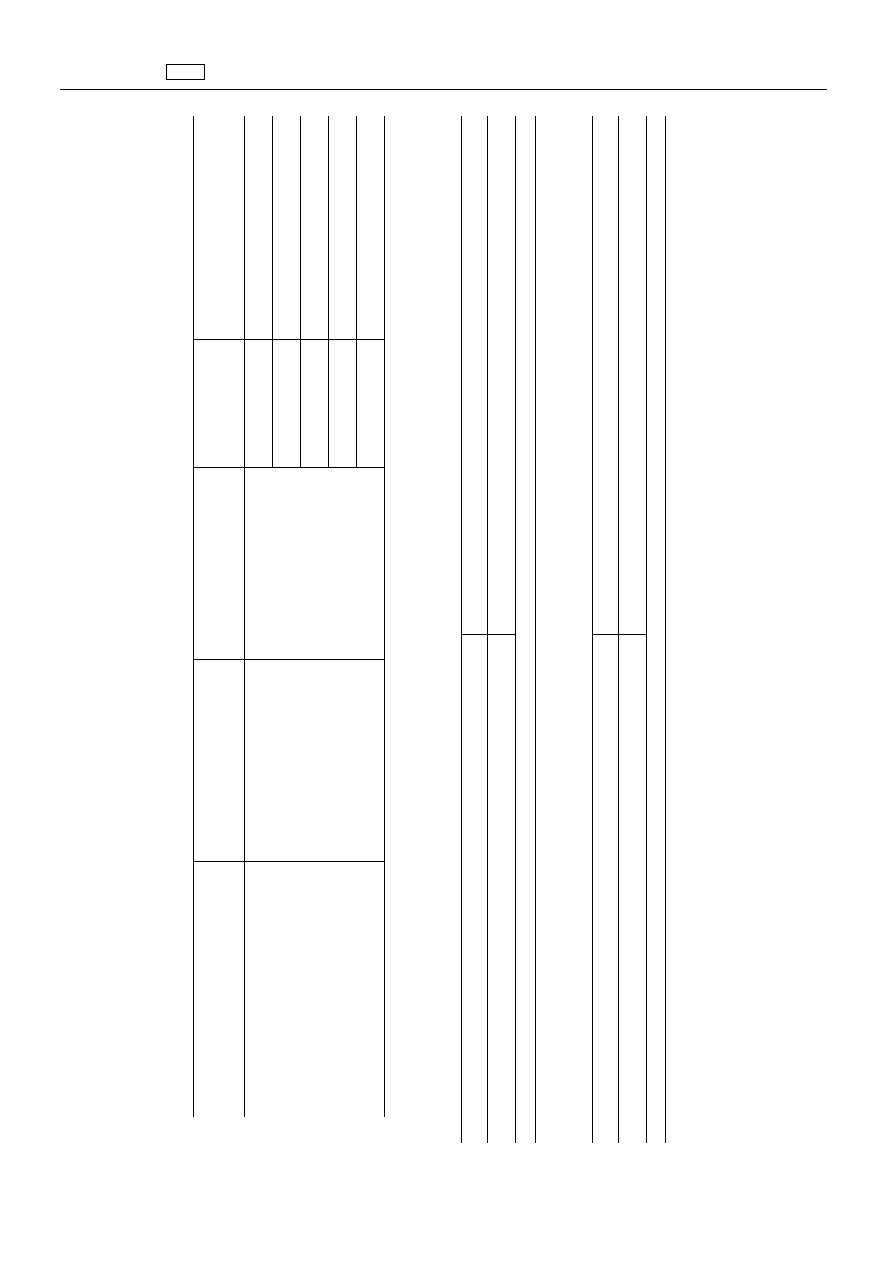
ZA
ŁĄ
CZNIK
A.
Do
za
łą
cznika
I
do
rozporz
ądzenia
(EWG)
nr
2377/90
wprowadza
się
nast
ępuj
ąc
ą
subs
tancj
ę:
1.
Środki
przeciwzaka
źne
1.2.
Antybiotyki
1.2.10.
Aminoglikozydy
Substancja(-e)
czynna(-e)
farmakologiczn
ie
Pozosta
ło
ść
znacznikowa
Gatunki
zwierz
ąt
Najwy
ższy
dopuszczalny
limit
pozosta
ło
ści
Tkanki
docelowe
„Dihydrostreptomycyna
Dihydrostreptomycyna
wszystkie
prze
żuwacze
500
μg/kg
mi
ęś
nie
500
μg/kg
tł
uszcz
500
μg/kg
w
ątroba
1
000
μg/kg
nerki
200
μg/kg
mleko
”
B.
Do
za
łą
cznika
II
do
rozporz
ądzenia
(EWG)
nr
2377/90
wprowadza
się
nast
ępuj
ące
substancje:
2.
Zwi
ązki
organiczne
Substancja(-e)
czynna(-e)
farmakologiczn
ie
Gatunki
zwierz
ąt
„Tosylchloramina
sodu
konie
(
1
)
(
1
)W
yłą
cznie
do
stosowania
miejscowego.
”
6.
Substancje
pochodzenia
ro
ślinnego
Substancja(-e)
czynna(-e)
farmakologiczn
ie
Gatunki
zwierz
ąt
„Piceae
turiones
recentes
extractum
Wszystkie
gatunki
zwierz
ąts
łu
żą
cych
do
produkcji
żywno
ści
(
1
)
(
1
)W
yłą
cznie
do
stosowania
doustnego.
”
PL
6.1.2006
Dziennik Urz
ędowy Unii Europejskiej
L 3/5
Wyszukiwarka
Podobne podstrony:
2006 01 06 glosariusz studia wieczorowe
2006 01 06 handout motivation
!!! Antenne aus , einbauen (ausser CODE 413 ab 01 06 2006)
A05 Zderzenia cial (01 06)
2006 01 Nie chcemy fizjoterapeutow z przypadku
PR 01 P 06
2006 01 15
IPN 08 2006 10 06
cennik system woda pe 100 01 06 2013
2012 01 06 Nota na Rok Wiary
1968stories?utsch 06 01 06
2006 01 10!5659 Maths set1
1968stories english 06 01 06
11 01 06 04 xxx?hrrgln Fähren o L
więcej podobnych podstron