Kierunek: Mikrobiologia
Specjalność: Mikrobiologia medyczna i diagnostyka
laboratoryjna
Sonia Fraenzel
Nr albumu: 351476
Izolacja bakterii fermentacji mlekowej z kiszonek
i charakterystyka ich właściwości
antybakteryjnych
Isolation of lactic acid bacteria from pickled
vegetables and characteristics of their anti-
bacterial properties
Praca magisterska
wykonana w Zakładzie Immunobiologii Bakterii
Instytutu Mikrobiologii, Biotechnologii i Immunologii
pod kierunkiem i opieką dr hab. Agnieszki Torzewskiej
Łódź, 2016

Spis treści
III.2.2. Sprawdzenie przynależności szczepów do rodzaju Lactobacillus. .............. 11
III.2.4. Określenie właściwości antybakteryjnych szczepów Lactobacillus. ........... 13
IV.2. Identyfikacja szczepów pod kątem przynależności do rodzaju Lactobacillus. .. 17
IV.4. Działanie antybakteryjne wybranych szczepów Lactobacillus sp. .................... 19
IV.5.Wytwarzanie wody utlenionej przez wybrane szczepy Lactobacillus sp. ........... 21


3
I. Wstęp
Na przestrzeni ostatnich lat coraz większym problemem stają się nawracające
infekcje układu moczowego zwłaszcza u kobiet i pacjentów cewnikowanych.
Najczęstszymi patogenami atakującymi kobiety są: Escherichia coli (nawet do 80 %
przypadków), Staphylococcus, Klebsiella, Enterobacter, Enterococcus. Dotykają one
kobiety aktywne seksualnie, a także w okresie menopauzy, gdzie patogeny obecne w
pochwie dostają się do cewki moczowej, następnie wędrują wyżej i powodują zakażenie.
Nawracające infekcje dotykają ok. 20- 30% kobiet, z czego większość wymaga leczenia
antybiotykami. Kolejną grupą narażoną na zakażenia układu moczowego są pacjenci
cewnikowani. Bakterie patogenne, najczęściej Proteus mirabilis są zdolne do tworzenia
na ich powierzchni biofilmu, z którego bakterie dostają się do układu moczowego.
Antybiotyki jak do tej pory są jedynym skutecznym sposobem leczenia pacjentów z
zakażeniami urologicznymi, ale coraz częściej bakterie nabywają antybiotykoodporności.
Obiecującą, ale nadal słabo zbadaną alternatywą dla antybiotyków mogłyby stać się
probiotyki. Te zaakceptowane przez WHO (World Health Organisation) i FAO (Food
and Agriculture Organization of the United Nations) bakterie bezpieczne dla zdrowia
człowieka mogły by stać się „lekarstwem” oraz środkiem zapobiegającym infekcjom
układu moczowego (Fraga i in. 2005, Dineshkumar i in. 2013, Borchert i in. 2008).
Probiotyki (pro bios – dla życia) to organizmy żywe, które mają korzystny wpływ
na zdrowie ludzi, po podaniu ich w odpowiedniej dawce (Mojka 2014, Kuśmierska, Fol
2014). Po raz pierwszy termin probiotyki został użyty w 1965 roku przez Lilly i Stilwell.
Organizmy te zostały uznane jako gatunki bezpieczne dla człowieka i zwierząt (GRAS),
oraz dopuszczone do stosowania przed FDA (Food and Drug Administration) oraz Unię
Europejską. Zaakceptowano je jako żywność funkcjonalną, czyli żywność, która ma
korzystny wpływ na funkcjonowanie organizmu ponad efekt odżywczy. Poprawiają stan
zdrowia oraz samopoczucia, a także zmniejszają ryzyko chorób. Żywność funkcjonalna
musi mieć podobną postać jak żywność konwencjonalna, a także mieć korzystne
działanie na organizm w ilościach normalnie przyjmowanych z dietą. Nie są to jednak
tabletki, kapsułki ani krople, tylko składnik prawidłowej diety (Functional Food Science
in Europe). Produkt jest uznawany za probiotyczny, jeśli zawiera co najmniej 10
6
aktywnych komórek bakteryjnych w mililitrze produktu (Mojka 2014).
Kryteria jakie musi spełniać organizm probiotyczny to: pochodzenie od
człowieka, odporność na niskie pH żołądka oraz działanie enzymów i kwasów

4
żółciowych w dwunastnicy, zdolność do przeżycia i aktywności metabolicznej w
środowisku jelita grubego, zdolność adherencji do komórek nabłonka jelitowego i trwałej
lub przejściowej kolonizacji przewodu pokarmowego, musi być bezpieczny dla
człowieka, działać korzystnie na organizm gospodarza oraz być trwały i żywotny w
czasie przechowywania oraz w środowisku niekorzystnym (Banan-Mwine Daliri, Lee
2015).
Do probiotyków należą nieliczne bakterie mlekowe, które są ziarniakami,
pałeczkami bądź laseczkami, barwiące się Gram- dodatnio. Nie posiadają katalazy, ale
produkują dysmutazę nadtlenkową. Są to bakterie homo- i heretofermentatywne,
fermentują glukozę do kwasu mlekowego, etanolu i dwutlenku węgla. Wzrastają w
warunkach beztlenowych, tolerują jednak niewielkie stężenie tlenu w otoczeniu
(Gajewska, Błaszczyk 2012). Stosowane są głównie w dolegliwościach układu
pokarmowego, jak biegunka, biegunka poantybiotykowa, alergie pokarmowe u dzieci.
W ostatnich latach bada się także ich pozytywne znaczenie w leczeniu biegunki
podróżnych, stanach zapalnych jelita grubego i płuc, próchnicy zębów, zespołu jelita
drażliwego, cukrzycy, reumatoidalnego zapalenia stawów, a także infekcji układu
moczowego (Goldin, Gorbach 2008). Prowadzone są także badania nad
immunomodulacją i immunostymulacją w celu leczenia raka m.in. pęcherza (Fraga i in.
2005).
Do bakterii probiotycznych należą bakterie fermentacji mlekowej z rodzaju
Lactobacillus, które znaleźć można w produktach fermentacji mleka, warzyw, mięsa,
kiszonkach oraz w przewodzie pokarmowym ludzi i zwierząt (Buda i in. 2013, Mojka
2014).
Lactobacillus to Gram- dodatnie pałeczki, bardzo zróżnicowane morfologicznie,
w zależności od gatunku przyjmują kształty długich lub krótszych pałeczek o wymiarach
0,5-1,2 x 1-10 µm (Słońska, Klimuszko 2010). Mogą być proste lub wygięte, a także
wąskie lub grube. Na ich morfologię ma wpływ podłoże oraz wiek hodowli (Słońska,
Klimuszko 2010, Buda i in. 2013).
Najlepszym podłożem wzrostowym dla tych bakterii jest MRS agar (de Man,
Rogosa and Sharpe agar). Można je podzielić na gatunki mezofilne, których optymalna
temperatura wzrostu wynosi 20- 28°C oraz termofilne (37- 45°C). Optymalne pH wzrostu
tych bakterii jest dość niskie i wynosi 5,5- 6,2. Ich wzrost obserwuje się w postaci

5
niewielkich (2-5 mm), gładkich i śliskich kolonii. Inną formą wzrostu są matowe,
kremowe, bądź bezbarwne kolonie (Mojka 2014, Buda i in. 2013).
U człowieka zdrowego Lactobacillus występuje w jamie ustnej, jelicie krętym,
okrężnicy oraz są dominujące wśród bakterii występujących w pochwie. Za probiotyczne
uważane są gatunki: L. acidophilus, L. amylovorans, L. cassei, L. crispatus, L. delbruecki
subsp. bulgaricus, L. gallinarum, L. gassei, L. johnsonii, L. paracasei, L. plantarum, L.
reuteri, L. rhamnosus (Gajewska, Błaszczyk 2012).
Bakterie z rodzaju Lactobacillus wykazują działanie antybakteryjne, ponieważ są
zdolne do produkcji substancji o działaniu antybakteryjnym, m.in. bakteriocyn,
biosurfaktantów i białek wiążących kolagen, które zapobiegają adhezji patogenów do
komórek, także kwasy organiczne oraz nadtlenek wodoru, które hamują wzrost i są
toksyczne dla flory patogennej (Słońska, Klimuszko 2010). Dzięki komunikacji i
sygnalizacji
międzykomórkowej
mogą
działać
immunomodulująco
i
immunostymulująco, uruchamiając szlaki oraz cząsteczki sygnałowe komórek
organizmu człowieka (Kuśmierska, Fol 2014).
Ze względu na rodzaj przeprowadzanej fermentacji można podzielić bakterie z
rodzaju Lactobacillus na obligatoryjnie homofermentatywne, które fermentują glukozę
do kwasu mlekowego za pomocą szlaku EMP (szlak Embdena-Meyerhofa-Parnasa), nie
degradują pentozy oraz glukonianu. Fakultatywne homofermentatywne rozkładają
heksozy do kwasu mlekowego oraz degradują pentozy i w pewnej części glukonian.
Obligatoryjnie heterofermentatywne rozkładają heksozy i pentozy z wydzieleniem CO
2
(Gajewska, Błaszczyk 2012). W wyniku fermentacji produkują od 0,6% do 3,0% kwasu
mlekowego. Wytwarzają kwas L(+) mlekowy rozkładany przez człowieka, oraz kwas
D(-) mlekowy. Działanie antybakteryjne tych kwasów polega na neutralizacji potencjału
elektrochemicznego
membrany
komórkowej
i
zniszczenia
białek
wewnątrzkomórkowych bakterii patogennych. Kwasy organiczne gwałtownie obniżają
pH w środowisku, powoduje to hamowanie aktywności biochemicznej bakterii przez
niezdysocjowane cząsteczki kwasu (Mojka 2013, Słońska, Klimuszko 2010).
Charakteryzując budowę komórki Lactobacillus należy wspomnieć, że ściana
komórkowa bakterii Gram - dodatnich złożona jest głównie z peptydoglikanu, kwasów
tejchojowych i lipotejchojowych, białek oraz polisacharydów. Mureina (peptydoglikan)
tworzy sieć i buduje wewnętrzną warstwę ściany komórkowej. Jest to substancja sztywna

6
i wytrzymała na rozciąganie. Kwasy tejchojowe budują różne struktury połączone
kowalencyjnie z mureiną ściany komórkowej, najczęściej fosforany polioli lub polimery
fosforanów glikozydowanych polioli. Natomiast kwasy lipotejchojowe to struktury
zanurzone w membranie poprzez fragment lipidowy. Mają one właściwości silnie
polielektronowe, dlatego, że posiadają silnie kwasowe grupy fosforanowe. W skład
ściany komórkowej Lactobacillus wchodzą również egozpolisacharydy (EPS), które
mają pH kwaśne lub neutralne. Mogą być one połączone ze ścianą w sposób
kowalencyjny lub niekowalencyjny, a także wydzielane do środowiska zewnętrznego,
decydują one o właściwościach ochronnych: zabezpieczają przed utratą wody,
fagocytozą, atakiem fagów czy pierwotniaków, antybiotykami, toksynami oraz stresem
osmotycznym (Buda i in. 2013 Gajewska, Błaszczyk 2012).
Na powierzchni ściany komórkowej Lactobacillus znajduje się wiele rodzajów
białek zależnych od sortazy. Białkami wydzielanymi na zewnątrz są bakteriocyny, które
są białkami działającymi bójczo lub bakteriostatycznie. Są to niskocząsteczkowe związki
chemiczne, które zbudowane są z prostych peptydów lub kompleksów polipeptydów.
Wykazują one zdolności antybakteryjne, lecz bakterie które je wydzielają są odporne na
wytwarzaną przez siebie bakteriocynę, ponieważ kodują białka blokujące aktywność
bakteriocyny. Większość badań dotyczących bakteriocyn poświęconych było szczepom,
które stosuje się do produkcji żywności. Jednym ze zbadanych szczepów był
L. acidophilus, gdzie wśród 52 zbadanych szczepów aż 63% posiadało cechę produkcji
bakteriocyn. Ich produkcja jest uzależniona od warunków środowiskowych, takich jak
pH, temperatura czy skład podłoża (Buda 2013, Słońska, Klimuszko 2010).
Bakteriocyny zostały podzielone na następujące klasy: lantybiotyki, bakteriocyny
nielantybiotykowe, bakteriocyny o dużej masie cząsteczkowej, bakteriocyny
wymagające do działania pewnych substancji. Klasy te zostały podzielone na liczne
podklasy. Lantybiotyki są to termostabilne bakteriocyny o niskiej masie cząsteczkowej.
W ich skład wchodzi lantonina lub 3- metylolantonina. Wyróżnia się typ A i B tych
bakteriocyn, które różnią się budową, mogą być liniowe i cykliczne. Bakteriocyny
nielantybiotykowe nie posiadające w swoim składzie lantoniny, są termostabilne i mają
dość niską masę cząsteczkową. Zostały podzielone na trzy podklasy: pedicynopodobne,
dipeptydowe oraz wydzielane na drodze sekrecji typu Sec. Bakteriocyny klasy trzeciej,
mają duże rozmiary i są termolabilne, produkowane są głównie przez bakterie z rodzaju
Lactobacillus. Klasa czwarta obejmuje białka, które do pełni aktywności potrzebują

7
obecności części lipidowej lub węglowodanowej. Bakteriocyny mogą działać na
wrażliwe komórki w sposób bakteriobójczy lub bakteriostatyczny. Ich mechanizm polega
na destabilizacji błony cytoplazmatycznej, wytworzenie w niej kompleksów poracyjnych
i następnie kanałów jonowych. Biernie wydostają się wtedy z komórki jony potasu,
magnezu, fosforu, aminokwasy i ATP. Prowadzi to do zachwiania pracy pompy
protonowej, potencjału membranowego oraz gradientu pH. Zahamowana zostaje synteza
DNA, RNA i białek, co powoduje zmniejszenie produkcji składników odżywczych i w
efekcie śmierć komórki bakterii. Drugi sposób działania bakteriocyn to zdolność do
wywołania lizy komórki. W tym wypadku bakteriocyna wchodzi w interakcje z kwasami,
które są składnikami ściany komórkowej bakterii wrażliwych. W wyniku tej reakcji
uwalniają się i aktywują związane z nimi enzymy autolityczne, które doprowadzają do
autolizy komórki. Niektóre bakteriocyny mogą zakłócać biosyntezę ściany komórkowej,
przy czym nie zaburzają biosyntezy materiału genetycznego, ani białek (Słońska,
Klimuszko 2010).
Bakteriocyny z reguły działają najsilniej na szczepy blisko spokrewnione ze
szczepem, który je wytwarza. Ze względu na zakres ich działania można je jednak
podzielić na: bakteriocyny o wąskim, umiarkowanym i szerokim spektrum działania.
Pierwsze z wymienionych działają na szczepy tego samego gatunku, drugie działają na
inne bakterie niż produkująca bakteriocyny. Bakteriocyny o szerokim spektrum działania,
wykazują działanie bójcze na bakterie Gram- dodatnie, Gram- ujemne oraz hamują
tworzenie przetrwalników i form wegetatywnych bakterii (Słońska, Klimuszko 2010).
Kolejnymi białkami, które występują na powierzchni komórek Lactobacillus są
adhezyny bakteryjne, które mają za zadanie adhezję do błony śluzowej jelita. Tą samą
funkcję pełnią także w układzie moczowym. Zidentyfikowaną w ciągu ostatnich lat
adhezyną bakterii z rodzaju Lactobacillus jest dehydrogenaza aldehydu 3-
fosfoglicerynowego (GAPDH), która została wykryta u L. plantarum oraz L. crispatus.
Adhezyna ta nie posiada sekwencji syganałowej N- końcowej ani motywów
pozwalających na wydzielanie białka z komórki. GAPDH rozpoznaje antygeny grup krwi
A i B oraz ma zdolność adhezji do błony śluzowej jelita. Kolejną adhezyną jest
oligomeryczne białko zwane mucin adhesion-promoting protein (MAPP), wykryte na
powierzchni L. fermentum. Mechanizm działania tego białka polega najprawdopodobniej
na niekowalencyjnym wiązaniu jego łańcuchów polipeptydowych lub jednostek
białkowych z powierzchnią bakterii. Kolejną adhezyną jest czynnik elongacji Tu, który

8
występuje u L. johnsoni. Przypuszcza się, że czynnik ten ma zdolności adherencji do
komórek nabłonkowych jelita oraz do białek błony śluzowej. Indukuje on także
odpowiedź immunologiczną. Do adhezyn należy także α- enolaza (Eno A1), znajdująca
się na powierzchni L. plantarum, wykazuje duże powinowactwo do plazminogenu oraz
ma zdolność wiązania fibronektyny. Białkiem o dużej masie cząsteczkowej, które
występuje na powierzchni bakterii i bierze udział w adhezji do nabłonka jest także białko
Mub, które zlokalizowane zostało u L. reuteri. U L. rhamnosus GG wykazano obecność
białek piliny, które zbudowane są z połączonych kowalencyjnie polimerów (Tripathi i in.
2012, Kang, Baker 2012).
Kolejnym czynnikiem antybakteryjnym występującym u bakterii z rodzaju
Lactobacillus jest warstwa S, której cechą jest budowa krystaliczna i dwuwymiarowość.
Wykazano jej obecność u takich szczepów jak: L. helveticus, L. brevis, L acidophilus, L.
crispatus, L. amylovorus, L. gallinarum, L. gasseri i L. johnsonii. Zbudowana jest
głównie z glikoprotein o małej masie cząsteczkowej. Ich cechą charakterystyczną jest
wysoki punkt izoelektryczny (pI 9,35- 10,40), który nadaje im charakter silnie zasadowy,
w przeciwieństwie do innych mikroorganizmów, gdzie jest słabo kwaśny.
Przeprowadzone obserwacje świadczą o obecności dwóch regionów strukturalnych i
funkcjonalnych, które odpowiadają za przytwierdzenie białka do ściany komórkowej oraz
za utrzymanie jego struktury na powierzchni (Buda i in. 2013).
Z powierzchni L. johnsonii i L. gasserii wyizolowano białka, będące czynnikami
ułatwiającymi agregację (APF), natomiast u L. reuterii białko mające zdolność do
wiązania się ze składnikami śluzu jelitowego. Wykazano również, że białka warstwy S
mają zdolność do wiązania toksycznych jonów metali, takich jak ołów czy kadm. Białka
powierzchniowe mają zdolność do hamowania inwazji patogenów, zostało to
potwierdzone w badaniach, w których szczep probiotyczny był wcześniej inkubowany ze
szczepem patogennym, agregował z nim i później hamował in vitro jego adhezję i atak
na komórki ludzkie (Buda i in. 2013).
Właściwości antybakteryjne probiotyków z rodzaju Lactobacillus warunkuje
także produkowany przez nie nadtlenek wodoru, który hamuje rozwój i zabija te bakterie,
które nie wytwarzają enzymów: katalazy i peroksydazy (Słońska, Klimuszko 2010).
Do właściwości antybakteryjnych probiotyków można zaliczyć ich interakcje z
układem odpornościowym człowieka. Kilka szczepów z rodzaju Lactobacillus, ich

9
elementy budowy oraz produkowane metabolity mogą zwiększać produkcję IgA,
uruchamiać szlak cytokin przeciwzapalnych, które interferują z molekułami
prozapalnymi (Banan- Mwine Daliri, Lee 2015, Hoesl, Altwein 2005). Właściwości
immunostymulujące mają m.in. szczepy L. plantarum , L. acidophilus, L. reuteri i L.
rhamnosus (Banan- Mwine Daliari, Lee 2015, Kuśmierska, Fol 2014). Dzięki działaniu
probiotyków możliwe jest prawidłowe działanie i różnicowanie się populacji
podstawowych komórek układu odpornościowego, takich jak: makrofagi, limfocyty T i
B, komórki dendrytyczne. Również szlaki sygnałowe, w przebiegu których biorą udział
m.in. jądrowy czynnik transkrypcyjny NF- ĸB, kinazy MAPK, PPAR-γ są modulowane
przez probiotyki. Probiotyki mają także zdolność do modyfikowania wydzielania cytokin
takich jak IFN- γ i IL-12 (Kuśmierska i Fol 2014).
W leczeniu chorych na zakażenia układu moczowego stosuje się antybiotyki,
które są przyczyną wielu negatywnych skutków ubocznych, m. in nabywanie
antybiotykooporności przez bakterie patogenne. Wprowadza się probiotyki do diety
pacjentów oraz kobiet jako środki zapobiegawcze przeciwko zakażeniom. Jednak
leczenie probiotykami nadal jest w fazie badań. Powstało wiele prac poświęconych
działaniu skumulowanemu dwóch lub kilku laboratoryjnych szczepów bakterii
probiotycznych z rodzaju Lactobacillus przeciwko bakteriom patogennym. Na dzień
dzisiejszy klinicznie udowodniono, że szczepy: L. rhamnosus GR-1 w połączeniu z L.
reuteri lub L. fermentum mogą zmniejszyć nawroty infekcji oraz wspomagają
odbudowanie flory bakteryjnej. Niewielka natomiast jest liczba prac poświęconych
działaniu antybakteryjnemu pojedynczych szczepów występujących naturalnie w
środowisku, m.in. w kiszonkach.

10
II. Cel pracy
Celem pracy było wyizolowanie szczepów Lactobacillus z kiszonek o szerokim
zakresie działania przeciwbakteryjnego.
Cel ten realizowano poprzez następujące etapy pracy:
Izolacja i identyfikacja szczepów z rodzaju Lactobacillus z kiszonek.
Wyodrębnienie szczepów o właściwościach antybakteryjnych.
Charakterystyka
właściwości
przeciwdrobnoustrojowych
szczepów
Lactobacillus.

11
III. Materiały i metody
III.1. Materiał
III.1.1 Soki z kiszonych ogórków i kapusty
W pracy analizowano właściwości bakterii obecnych w sokach z kiszonek. Materiałem
do badań były soki z kapusty kiszonej (sok nr 1,2), soki z ogórków kiszonych (sok nr 3-
27) dostępne na różnych bazarach w mieście Łodzi. Pobrano je z drewnianej lub
plastikowej beczki do kiszenia za pomocą jałowego pojemnika.
III.1.2 Szczepy bakteryjne
Do sprawdzenia właściwości antybakteryjnych bakterii z kiszonek wybrano szczep
typowy Escherichia coli ATTC 25922 oraz szczepy bakterii klinicznych z kolekcji
Zakładu Immunobiologii Bakterii: Pseudomonas aeruginosa, Staphylococcus aureus,
Klebsiella pneumoniae , Proteus mirabilis, Providencia stuartii, izolowane z biofilmu na
cewnikach urologicznych pobranych od pacjentow długotrwale cewnikowanych.
III.2. Metody
III.2.1.Izolacja bakterii
Po pobraniu prób w pierwszej kolejności mierzono pH soków za pomocą pH
metru (Elmetron). Następnie wykonano szereg rozcieńczeń soku w postępie
arytmetycznym (od 10
-1
do 10
-6
) w probówkach typu eppendorf dodając 100 µl soku do
900 µl 0.9% NaCl. Kolejne rozcieńczenia, zaczynając od 10
-3
do 10
-6
posiewano
głaszczką na płytki MRS (podłoże de Man, Rogosa i Sharpe, BTL) w dwóch
powtórzeniach w ilości 100 µl. Inkubowano przez 48 godzin w temperaturze 37°C.
Liczbę bakterii określano jako CFU/ml (jednostka tworząca kolonię ang. colony- forming
unit) i wyliczono zgodnie ze wzorem:
CFU/ml = liczba kolonii * rozcieńczenie * 10
Następnie z płytek, na których kolonie były najlepiej rozizolowane pobierano za pomocą
ezy kolonie o różnych morfologiach i posiewano na skosy MRS w probówkach typu
eppendorf. Próby opisano jako: S nr soku K numer kolonii. Inkubowano je 48 godzin w
temperaturze 37°C i później przechowywano w lodówce, aby mogły być na świeżo
przesiewane do dalszych doświadczeń.
III.2.2. Sprawdzenie przynależności szczepów do rodzaju Lactobacillus.

12
W pierwszej kolejności określano zdolność wytwarzania katalazy przez
wyizolowane szczepy. Na odtłuszczone szkiełko podstawowe naniesionio kroplę 3 %
nadtlenku wodoru, pobrano ezą niewielką ilość bakterii z linii posiewu na skosie i
zanurzono w kropli nadtlenku wodoru. W przypadku braku pienienia, uznawano szczep
za katalazo- ujemny i wykonywano z niego preparat. W tym celu na odtłuszczone
szkiełko podstawowe nanoszono za pomocą ezy kroplę 0,9% NaCl, pobrano ezą szczep
ze skosu i rozmazano w kropli. Pozostawiono do wysuszenia. Następnie utrwalone
preparaty barwiono metodą Grama.
Preparaty oglądano pod mikroskopem świetlnym (NIKON) w 1000- krotnym
powiększeniu z olejkiem imersyjnym. Do dalszych badań zakwalifikowano te szczepy,
które odpowiadały morfologii Lactobacillus (pałeczki, Gram- dodatnie).
Podjęto również próbę zaklasyfikowania ich do rodzaju Lactobacillus sp.. W tym celu
sprawdzono fermentację glukozy na podłożu z glukozą, rozkład eskuliny, dihydrolazę
argininy na podłożu z argininą. Szczepy zostały sprawdzone na typowych podłożach
diagnostycznych, przy czym sporządzano je na bazie podłoża MRS. Posiane podłoża
inkubowano do 7 dni w temperaturze 37°C.
III.2.3. Określenie właściwości antybakteryjnych mieszanych hodowli bakterii w
kiszonkach.
Z każdego soku pobrano 200 µl i wysiano na podłoże MRS w probówkach
bakteriologicznych (8 ml). Po 48 godzinach inkubacji w 37°C pobrano szklaną pipetą
1,8 ml hodowli do probówki typu eppendorf (o pojemności 2 ml). Odwirowano 8000 g/15
minut. Następnie odciągnięto supernatant do jałowego eppendorfa o pojemności 2 ml.
Przy pomocy pasków (McolorpHast
TM
MERCK) zmierzono pH supernatantów, w
przypadku zbyt kwaśnego pH ustalano je do 6,0 używając 2 M NaOH. Następnie
supernatanty zostały przesączone przez filtry antybakteryjne o średnicy porów 0,2 µm
(Sartorius).
Właściwości antybakteryjne badano w stosunku do szczepów: Pseudomonas aeruginosa,
Staphylococcus aureus, Klebsiella pneumonie, Escherichia coli, Proteus mirabilis,
Providencia stuarti. Bakterie przed doświadczeniem posiewano na podłoże TSB (tryptic
soy broth, BTL) i inkubowano 24 godziny w temperaturze 37°C. Następnie rozcieńczono
je 1000 razy w podłożu TSB.

13
Supernatanty dodawano w ilości 100 µl na płytkę 96- dołkową typu V nierozcieńczone i
dwukrotnie rozcieńczone w podłożu TSB. Do wszystkich dołków dodawano 5 µl
zawiesiny bakterii. Kontrolę wzrostu bakterii wykonano dodając do 100 µl TSB 5 µl
zawiesiny bakterii. Natomiast kontrolę jałowości podłoża stanowiło 100 µl podłoża TSB.
Płytkę inkubowano przez 24 godziny w komorze wilgotnej w temperaturze 37°C.
Obecność drobnoustrojów działających antybakteryjnie w danym soku wykazano, gdy
zaobserwowano brak wzrostu bakterii.
III.2.4. Określenie właściwości antybakteryjnych szczepów Lactobacillus.
Szczepy ze skosów MRS przesiano ezą na płynny MRS (8 ml) i inkubowano w
eksykatorze 48 godzin w 37°C. Następnie pobrano szklaną pipetą 2 ml hodowli do
probówki typu eppendorf. Odwirowano 12 000 g przez 20 minut w temperaturze
pokojowej. Supernatant przeniesiono do drugiej probówki typu eppendorf (2 ml) i
ustalono pH do 6,0 przy użyciu 2 M NaOH, pH sprawdzano papierkami do mierzenia pH
(McolorpHast
TM
MERCK).
Badano właściwości antybakteryjne supernatantów pohodowlanych przygotowanych w
nastepujący sposób:
bez ustalonego pH, gdzie przygotowanie supernatantów zakończono na
odwirowaniu i odciągnięciu supernatantu,
nieprzesączone, gdzie odciągnięto supernatant i ustalono pH do 6,0,
ogrzewane, gdzie odciągnięto supernatant, następnie ustalono pH 6,0 i ogrzewano
przez 20 minut w 90°C,
przesączone, gdzie odciągnięto supernatant, ustalono pH 6,0 i przesączono przez
filtry antybakteryjne o średnicy porów 0,2 µm (Sartorius),
poddane działaniu peroksydazy, gdzie odciągnięto supernatant, ustalono pH 6,0,
ogrzewano przez 20 minut w temperaturze 90°C i dodano 20 µl peroksydazy z
roztworu wodnego o stężeniu 20 mg/ml (peroxidase type VI from Horse radisch
SIGMA) w celu dezaktywacji nadtlenku wodoru. Inkubowano w 4°C/ noc.

14
Właściwości antybakteryjne tak przygotowanych supernatantów sprawdzono jak
wcześniej opisano w podrozdziale III.2.3. Płytkę inkubowano przez 24 godziny w
komorze wilgotnej w temperaturze 37°C.
III.2.5. Określenie zdolności do wytwarzania nadtlenku wodoru przez szczepy
Lactobacillus.
Wybrane szczepy zostały przesiane z hodowli na świeże podłoże MRS (8 ml).
Inkubowano je w warunkach beztlenowych (w eksykatorze) przez 24 godziny w 37°C.
Pobrano 2 ml hodowli do jałowej probówki typu eppendorf i odwirowano 10 000 g przez
5 minut w temperaturze pokojowej. Następnie odciągnięto supernatant, a osad
zawieszono w 2 ml buforu fosforanowego (pH 6,5) Tak przygotowane próby inkubowano
w temperaturze 5°C przez 48 godzin. Po czasie 1 godziny, 24 godzin i w 48 godzinie
pobrano do probówek typu eppendorf 0,5 ml zawiesiny i dodano po 10 µl ABTS
(2,2’Azino-bis(3-ethylbeznthiazoline-6-sulfonic acid – SIGMA, z roztworu 25 mg/ml w
0,1 M cytrynianie sodu o pH 4,5) i 10 µl peroksydazy (1 mg/ml peroxidase type VI from
Horseradisch SIGMA). Inkubowano przez 45 minut w temperaturze 37°C. Po tym czasie
odwirowano 10 000g przez 5 minut w temperaturze pokojowej i nanoszono w dwóch
powtórzeniach (200 µl) na płytkę 96- dołkową płaskodenną razem z kontrolą, którą
stanowiło 0,5 ml buforu fosforanowego, 10 µl barwnika ABTS (2,2’Azino-bis(3-
ethylbeznthiazoline-6-sulfonic acid – SIGMA, z roztworu 25 mg/ml 0,1 M cytrynianu
sodu o pH 4,5) i 10 µl peroksydazy (1 mg/ml, peroxidase type VI from Horseradisch
SIGMA). Mierzono absorbancję przy długości fali 405 nm.

15
IV. Wyniki
IV.1. Obecność Lactobacillus sp. w soku z kiszonek.
W pobranych do badań sokach poszukiwano drobnoustrojów fermentacji mlekowej z
rodzaju Lactobacillus. O zachodzącej fermentacji może świadczyć niskie pH, dlatego w
pierwszej kolejności zmierzono pH soków. Następnie określono ogólną liczbę bakterii
fermentacji mlekowej jako CFU/ml posiewając soki na podłoże MRS oraz sprawdzono
morfologię ich komórek i barwliwość w metodzie Grama. Wyniki zebrano w Tabeli 1.
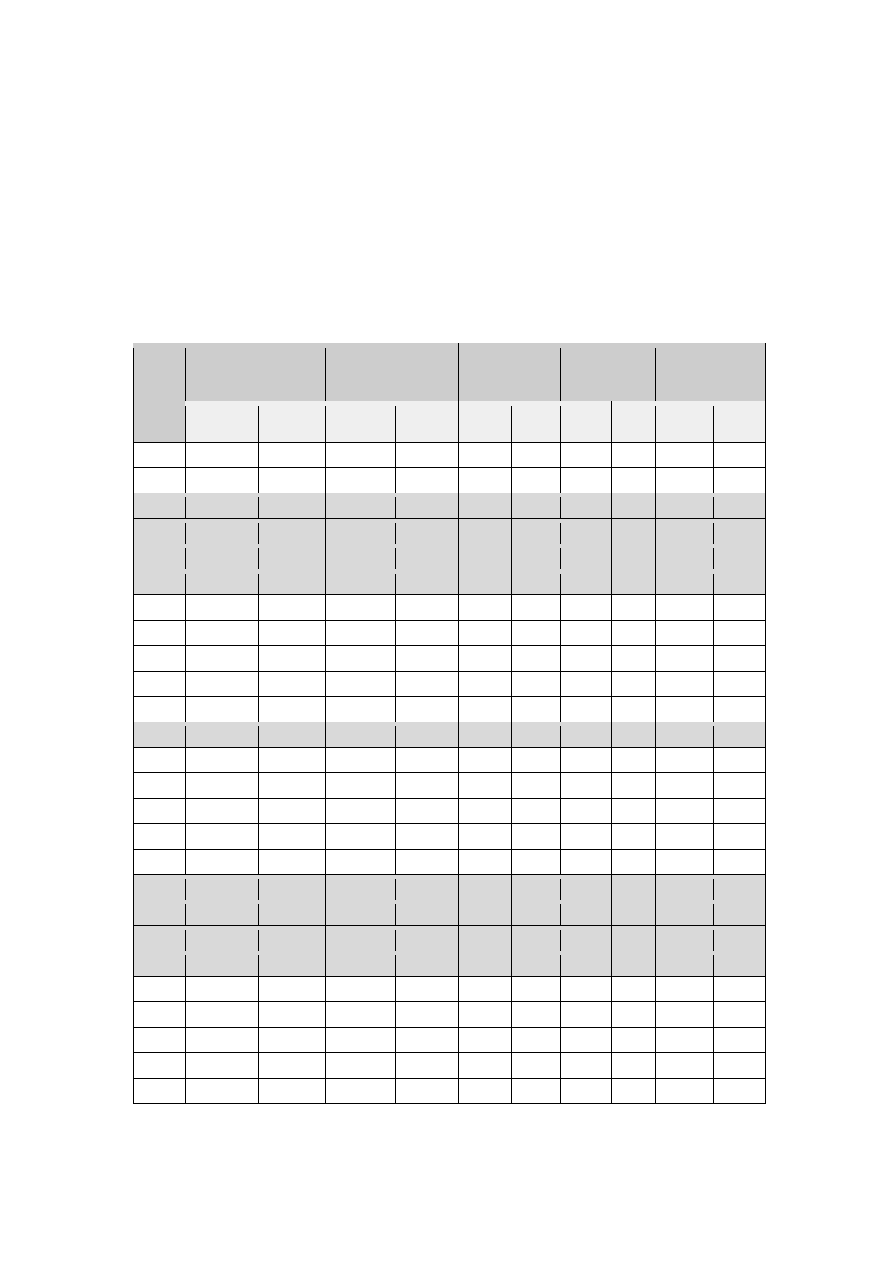
Tabela 1. Ocena pH i charakterystyka mikroflory soków.
Nr soku
pH
CFU/ml ± SEM
Charakterystyka preparatów
1
3,8
7,7 x 10
7
± 3,23
Gram- dodatnie, krótkie i długie pałeczki
2
3,28
0,63 x 10
7
± 0,25 Gram- dodatnie, krótkie, średnie pałeczki, ziarniaki
3
3,25
0,1 x 10
7
± 0,04
Gram- dodatnie, średnie i długie pałeczki, ziarniaki.
4
3,23
1,02 x 10
7
± 0,34 Gram- dodatnie, krótkie, średnie i długie pałeczki, drożdże
5
3,32
0,03 x 10
7
± 0,01 Gram- dodatnie, krótkie, długie pałeczki, ziarniaki
6
3,42
0,36 x 10
7
± 0,06 Gram- dodatnie, krótkie, długie pałeczki, ziarniaki.
7
3,45
3,55 x 10
7
± 0,25 Gram- dodatnie, krótkie, średnie pałeczki, ziarniaki
8
3,31
2,82 x 10
7
± 0,49 Gram- dodatnie, krótkie pałeczki, ziarniaki.
9
3,4
1,43 x 10
7
± 0,14 Gram- dodatnie, krótkie pałeczki, ziarniaki.
10
3,3
1,63 x 10
7
± 0,11 Gram- dodatnie, krótkie, średnie pałeczki.
11
3,45
6,3 x 10
7
± 1,85
Gram- dodatnie, średnie i długie pałeczki, ziarniaki.
12
3,41
3,96 x 10
7
± 0,78 Gram- dodatnie, krótkie i średnie pałeczki, ziarniaki.
13
3,65
1,81 x 10
7
± 0,19 Gram- dodatnie, średnie i długie pałeczki.
14
3,4
5,55 x 10
7
± 0,89 Gram- dodatnie, krótkie, średnie pałeczki, ziarniaki.
15
3,51
9,13 x 10
7
± 1,3
Gram- dodatnie, pałeczki, ziarniaki.
16
3,34
1,18 x 10
7
± 0,17 Gram- dodatnie pałeczki, ziarniaki.
17
3,46
0,61 x 10
7
± 0,19 Gram- dodatnie, pałeczki.
18
3,5
11,08 x 10
7
± 0,78 Gram- dodatnie, pałeczki, ziarniaki.
19
3,77 27,93 x 10
7
± 2,03 Gram- dodatnie, pałeczki.
20
3,73
5,43 x 10
7
± 1,9
Gram- dodatnie, pałeczki.
21
3,52 10,63 x 10
7
± 1,84 Gram- dodatnie, pałeczki, ziarniaki.
22
3,42
0,08 x 10
7
drożdże
23
3,46
1,78 x 10
7
± 1,15 Gram- dodatnie, pałeczki, ziarniaki.

16
Nr soku
pH
CFU/ml ± SEM
Charakterystyka preparatów
24
3,37
1,32 x 10
7
± 0,43 Gram- dodatnie, pałeczki.
25
3,52
3,37 x 10
7
± 0,73 Gram- dodatnie, pałeczki.
26
3,38
2,8 x 10
7
± 0,66
Gram- dodatnie, pałeczki, ziarniaki.
27
3,39
0,06 x 10
7
Gram- dodatnie, pałeczki, ziarniaki.
Sok nr 22 oraz 27 nie zostały wzięte pod uwagę w dalszych badaniach. W pierwszym
występowały tylko grzyby drożdżopodobne natomiast w drugim zaobserwowano bardzo
mały wzrost kolonii na podłożu MRS.
Jak przedstawiono w Tabeli 1, pH wszystkich soków było mocno kwaśne, w granicach
od 3,23 (sok 4) do 3,8 (sok 1). Na wszystkich płytkach MRS nastąpił wzrost kolonii
wysianych z rozcieńczonych soków, świadczy to o obecności bakterii fermentacji
mlekowej. Najniższe CFU/ml zaobserwowano w soku nr 5 (0,03 x 10
7
± 0,01), natomiast
najwyższe w soku nr 19 (27,93 x 10
7
± 2,03). W preparatach mikroskopowych najczęściej
obserwowano Gram- dodatnie pałeczki różnej wielkości. Na Ryc.1. przedstawiono
zróżnicowanie w wielkości i długości obserwowanych pałeczek . Na 27 badanych soków
w 17 obecne były również ziarniaki, a w 2 wykryto drożdże. Do dalszych badań wybrano
drobnoustroje o morfologii pałeczek Gram- dodatnich i podjęto próbę klasyfikacji ich do
rodzaju Lactobacillus.

17
Ryc.1. Morfologia pałeczek Lactobacillus sp. Preparaty barwione metodą Grama, pow.
10x 100 (Nikon).
IV.2. Identyfikacja szczepów pod kątem przynależności do rodzaju Lactobacillus.
Przynależność szczepów do rodzaju Lactobacillus sprawdzono wykonując test na
katalazę. Szczep uznawano za katalazo- ujemny, gdy po dodaniu H
2
O
2
nie pojawiło się
gazowanie związane z wydzielaniem O
2
. Następnie sprawdzono fermentację glukozy,
rozkład eskuliny, obecność dihydrolazy argininy. Szczepy zostały sprawdzone na
typowych podłożach diagnostycznych, przy czym dodawano do nich podłoże MRS.
Wszystkie badane szczepy są katalazo- ujemne. Z badanych szczepów 17 wykazuje
właściwość fermentacji glukozy, z czego 7 wydziela CO
2
, natomiast żaden szczep nie
rozkłada eskuliny ani nie ma aktywności dihydrolazy argininy. Zespół tych cech
potwierdza przynależność badanych bakterii do rodzaju Lactobacillus.
IV.3. Działanie antybakteryjne bakterii w sokach.
W pierwszej kolejności zbadano działanie antybakteryjne wszystkich bakterii
występujących w sokach, aby wyselekcjonować soki zawierające bakterie o takich
właściwościach.
18
Wszystkie badane soki posiewano na płynny MRS i inkubowano 48 godzin w 37°C.
Następnie podłoże odwirowano, a pH supernatantów ustalono na 6,0 i przesączono przez
filtry bakteriologiczne. Działanie antybakteryjne tak przygotowanych supernatantów
sprawdzono wobec hodowli: Pseudomonas aeruginosa, Staphylococcus aureus,
Escherichia coli, Proteus mirabilis, Providencia stuarti. Uzyskane wyniki przedstawiono
w Tabeli 2.
Tabela 2. Działanie antybakteryjne soków.
Nr
soku
Pseudomonas
aeruginosa
Staphylococcus
aureus
Escherichia
coli
Proteus
mirabilis
Providencia
stuarti
N- r
1:1
N- r
1:1
N- r
1:1
N- r
1:1
N- r
1:1
1
NB
NB
NB
NB
NB
NB
NB
NB
NB
NB
2
NB
NB
NB
NB
NB
NB
NB
NB
NB
NB
3
+
-
+
-
+
-
+
-
+
NB
4
+
+
+
-
+
-
+
-
+
NB
5
+
+
+
-
+
-
+
-
+
NB
6
+
+
+
-
+
-
+
-
+
NB
7
+
-
+
-
-
-
-
-
+
NB
8
+
-
-
-
-
-
-
-
-
NB
9
-
-
-
-
-
-
-
-
-
NB
10
+
-
+
-
-
-
-
-
-
-
11
+
-
+
-
-
-
-
-
-
-
12
+
-
+
-
+
-
+
-
+
-
13
+
-
+
-
-
-
-
-
-
-
14
-
-
-
-
-
-
-
-
-
-
15
-
-
+
-
-
-
-
-
-
-
16
-
-
-
-
-
-
-
-
-
-
17
-
-
-
-
-
-
-
-
-
-
18
+
-
+
-
+
-
-
-
+
-
19
+
-
+
-
+
-
+
-
+
-
20
+
-
+
-
+
-
+
-
+
-
21
+
-
+
-
+
-
+
-
+
-
23
+/-
-
+/-
-
+/-
-
+/-
-
+/-
-
24
-
-
-
-
-
-
-
-
-
-
25
-
-
-
-
-
-
-
-
-
-
26
-
-
-
-
-
-
-
-
-
-
27
NB
NB
NB
NB
NB
NB
NB
NB
NB
NB

19
N- r – supernatant nierozcieńczony; 1:1- supernatant rozcieńczony
+ działanie antybakteryjne (brak wzrostu bakterii)
+/- działanie antybakteryjne (zahamowanie wzrostu bakterii, na dnie dołka widoczny osad)
- brak działania antybakteryjnego (wzrost bakterii)
Soki nr 1 i 2 nie zostały tutaj zbadane, ponieważ ich poszczególne szczepy zostały
zbadane w późniejszych etapach badań. Rozcieńczone supernatanty z hodowli soków
(1:1) nie wykazywały właściwości antybakteryjnych. Niektóre supernatanty
nierozcieńczone, w liczbie 9 wykazały działanie bakteriobójcze, ponieważ nie nastąpił
wzrost bakterii. Natomiast jeden supernatant (23) zadziałał bakteriostatycznie, ponieważ
ograniczył jedynie wzrost bakterii
.
IV.4. Działanie antybakteryjne wybranych szczepów Lactobacillus sp.
Z soków, które wykazywały działanie antybakteryjne zbadano wszystkie szczepy pod
kątem właściwości antybakteryjnych. W tym celu kolejne szczepy posiewano na płynny
MRS i inkubowano 48 godzin w temp. 37°C. Właściwości antybakteryjne supernatantów
pohodowlanych zostały następująco zbadane:
bez ustalonego pH, gdzie odwirowano i odciągnięto supernatant,
nieprzesączone, gdzie w supernatancie ustalono pH do 6,0,
ogrzewane, gdzie w supernatancie ustalono pH 6,0 i ogrzewano przez 20 minut w
90°C,
przesączone, gdzie w supernatancie ustalono pH 6,0 i przesączono go przez filtry
antybakteryjne o średnicy porów 0,2 µm,
po działaniu peroksydazy, gdzie w supernatancie ustalono pH 6,0, ogrzewano przez
20 minut w temperaturze 90°C, dodano 20 µl peroksydazy (roztwór wodny 20mg/ml)
aby rozłożyć nadtlenek wodoru i inkubowano w 4°C/ noc.
W tak przygotowanych supernatantach nierozcieńczonych i rozcieńczonych w stosunku
1:1 określano właściwości bójcze jak opisano w podrozdziale Metody (III.2.3). W
poniższej tabeli (Tabela 4) przedstawiono tylko wybrane szczepy, których wyniki
wskazywały na ich działanie antybakteryjne.
20
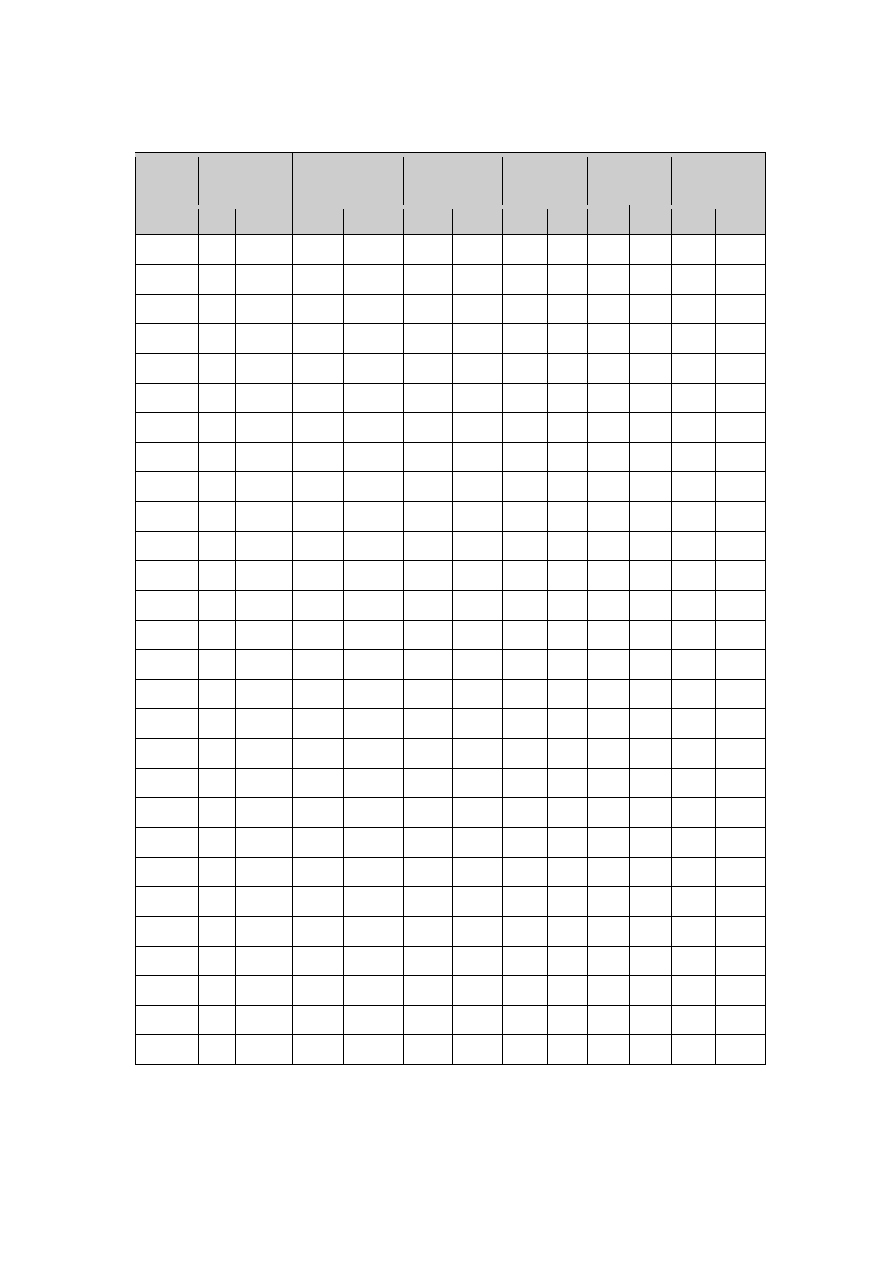
Tabela 4. Właściwości antybakteryjne wybranych szczepów w różnym pH.
Numer
szczepu
Pseudomonas
aeruginosa
Staphylococcus
aureus
Escherichia
coli
Proteus
mirabilis
Providencia
stuarti
Pseudomonas
aeruginosa
*
**
*
**
*
**
*
**
*
**
*
**
S1K1
+
+
+
+
+
+
+
+
+
+
+
+
S2K12
+
+
+
+
+
+
+
+
+
+
+
+
S2K18
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S4K3
+
+
+
+
+
+
+
+
+
+
+
+
S5K3
+
+
+
+
+
+
+
+
+
+
+
+
S6K1
+
+
+
+
+
+
+
+
+
+
+
+
S18K1
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S18K2
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S18K4
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S18K7
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S18K9
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S18K10 +
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S19K1
+
+
+
+
+
+
+
+
+
+
+
+
S19K2
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S19K3
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S19K6
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S19K7
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S19K8
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S19K10 +
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S20K1
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S20K2
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S20K3
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S20K8
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S20K9
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
S21K5
+
+/-
+
+/-
+
+/-
+
-
+
-
+
-
S21K6
+
+/-
+
+/-
+
+/-
+
-
+
-
+
-
S21K7
+
+/-
+
+/-
+
+/-
+
-
+
-
+
-
S23K2
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-
+
+/-

21
*- pH nieustalone
**- pH= 6,0
+ działanie antybakteryjne (brak wzrostu bakterii)
+/- działanie antybakteryjne (zahamowanie wzrostu bakterii, na dnie dołka widoczny osad)
- brak działania antybakteryjnego (wzrost bakterii)
Wszystkie nierozcieńczone badane supernatanty pohodowlane bez ustalonego pH na 6,0
wykazały właściwości bakteriobójcze w stosunku do wszystkich badanych bakterii. Takie
działanie można przypisać niskiemu pH , które wynosiło od 3,5- 4,0. Aby sprawdzić czy
szczepy posiadają inne czynniki antybakteryjne, pH ustalono na 6,0. W tym przypadku
również wszystkie supernatanty nierozcieńczone o pH 6,0 wykazały działanie
antybakteryjne. Sześć szczepów Lactobacillus wykazało działanie bakteriobójcze (S1K1,
S2K12, S4K3, S5K3, S6K1, S19K1), z czego szczepy S1K1, S2K12 i S19K1 również po
rozcieńczeniu, co świadczy o dużej aktywności bójczej tych szczepów. Natomiast reszta
supernatantów posiadała właściwości bakteriostatyczne, z czego w przypadku szczepu
S18K10, także rozcieńczony. Szczepy S21K5, S21K6 i S21K7, w których pH zostało
ustalone na 6,0 wykazywały wybiórcze działanie bakteriostatyczne, bo tylko w stosunku
do Pseudomonas aeruginosa, Staphylococcus aureus i Klebsiella pneumoniae.
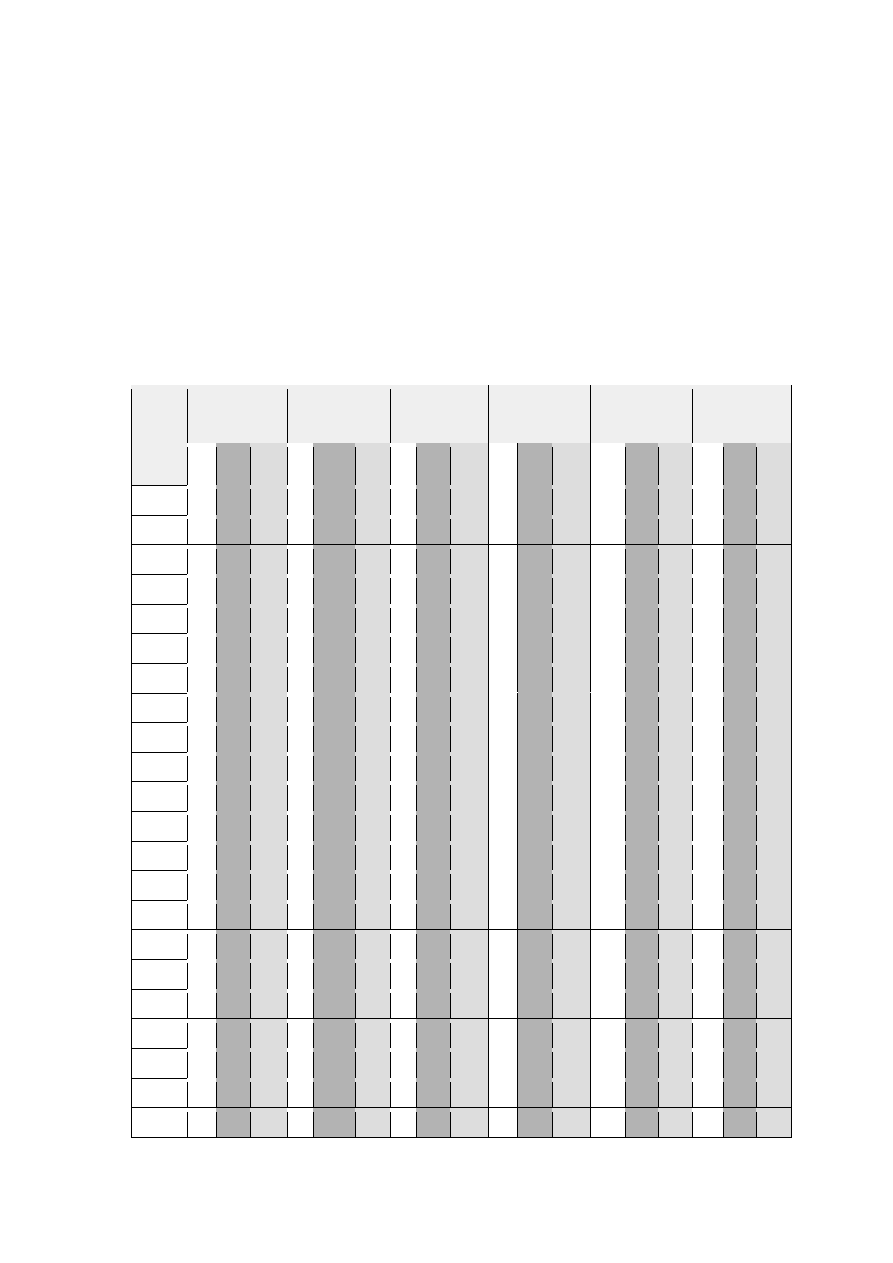
IV.5.Wytwarzanie wody utlenionej przez wybrane szczepy Lactobacillus sp.
Wybrane szczepy bakterii zostały zbadane pod kątem ilości wytwarzanej wody utlenionej
(H
2
O
2
) jako czynnika działającego bójczo na inne drobnoustroje. W tym celu
przygotowano próby jak opisano w rozdziale Metody (III.2.5.), a ilość uwolnionego
produktu oznaczano metodą kolorymetryczną. Wartości absorbancji zostały
przedstawione na Ryc.2.
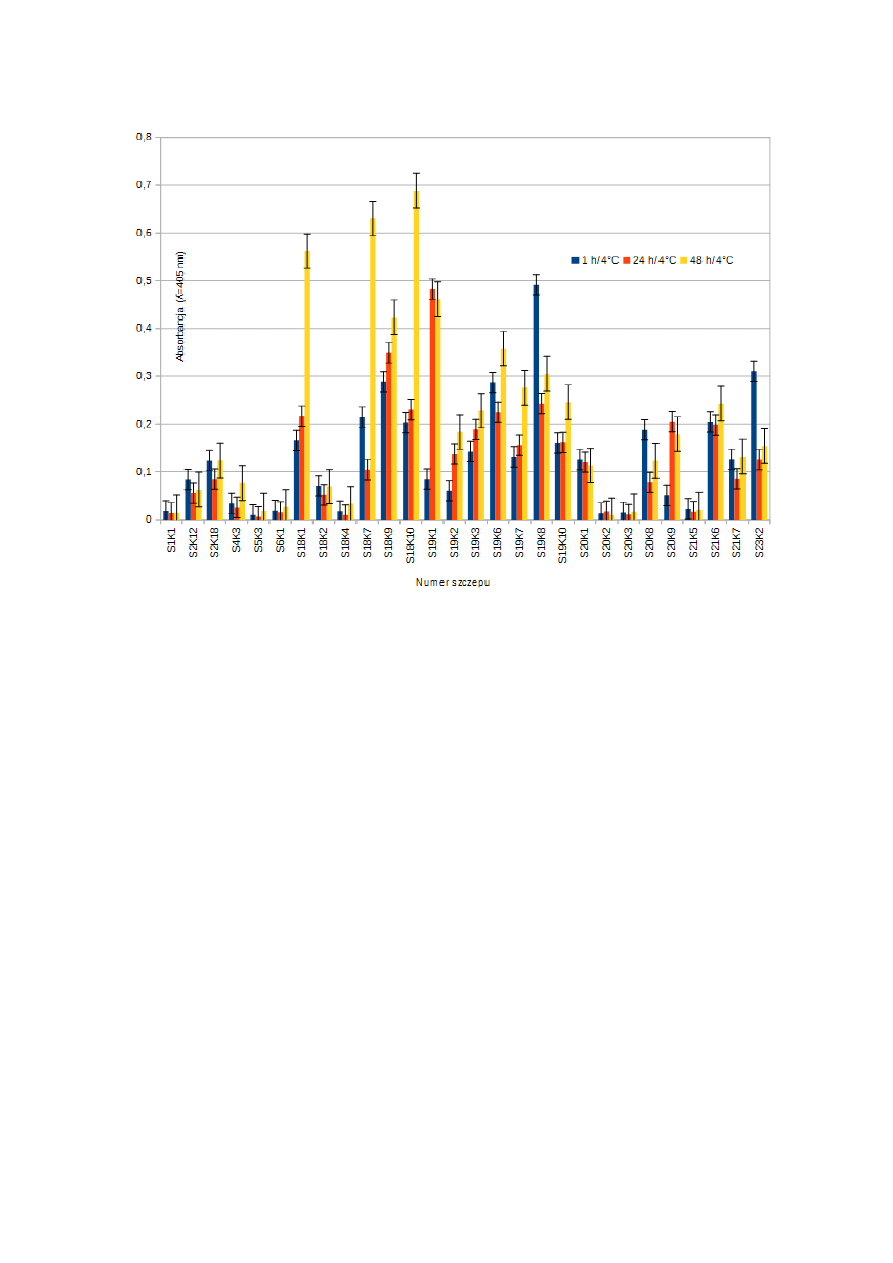
22
Ryc.2. Produkcja H
2
O
2
przez szczepy Lactobacillus po w różnym czasie inkubacji w 4°C.
Wartość absorbancji odpowiada w tym przypadku intensywności produkcji wody
utlenionej przez badany szczep po określonym czasie inkubacji. Wszystkie szczepy
produkowały wodę utlenioną, przy czym z różną intensywnością. Absorbancja prób dla
wszystkich szczepów mieściła się w zakresie 0,006 do ok. 0,7. Najsilniej cechę tą
wykazywały szczepy S18K1, S18K7, S18K9, S18K10, S19K1, S19K6, S19K8, S23K2.
Natomiast najmniejszą zdolnością do produkcji nadtlenku wodoru charakteryzowały się
szczepy: S1K1, S4K3, S5K3, S6K1, S18K2, S18K4, S20K2, S20K3, S21K5. U
pozostałych szczepów wykazano średnią produkcję wody utlenionej. W przypadku
większości szczepów, najwyższy poziom wody utlenionej stwierdzono w 48 godzinie.
Jednak niektóre z nich największą produkcją tego związku charakteryzowały się w
pierwszej godzinie, a później jego produkcja spadała (S19K8, S23K2
).
IV.6. Charakterystyka właściwości antybakteryjnych wybranych szczepów
Lactobacillus.
W celu dalszej charakterystyki właściwości antybakteryjnych supernatanty pohodowlane
Lactobacillus o pH 6,0 i przesączone przez filtry antybakteryjne ogrzewano w 90°C przez
23
20 min. Miało to na celu unieczynnienie czynników termowrażliwych, pozostawiając te
oporne na temperaturę, w tym np. bakteriocyny. W celu poznania sposobu działania
antybakteryjnego szczepów wykonano także test na właściwości antybakteryjne
wybranych szczepów w obecności enzymu peroksydazy, który rozkłada H
2
O
2
. Wyniki
przedstawiono w Tabeli 5, gdzie porównano działanie supernatantów pohodowlanych, po
podgrzaniu do 90°C przez 20 min oraz poddanych działaniu peroksydazy.
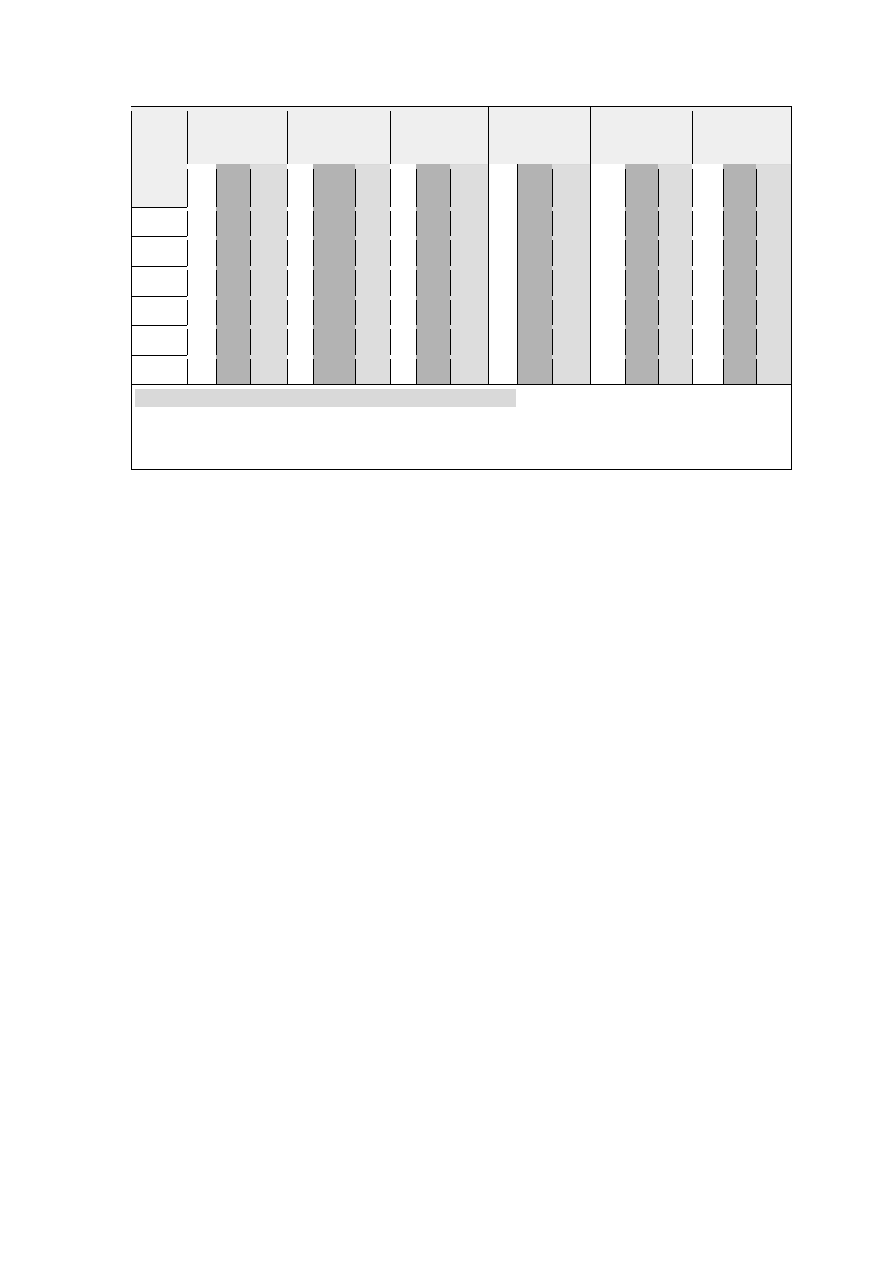
Tabela 5. Właściwości antybakteryjne wybranych szczepów z rodzaju Lactobacillus, po
podgrzaniu oraz po traktowaniu peroksydazą.
Numer
szczepu
Pseudomonas
aeruginosa
Staphylococcus
aureus
Klebsiella
pneumoniae
Escherichia
coli
Proteus
mirabilis
Providencia
stuarti
*
** *** *
** *** * ** *** *
** ***
*
** *** *
** ***
S1K1 +
+
-
+
+/-
-
-
+
-
-
+/-
-
-
+
-
-
+/-
-
S2K12 + +/-
-
+
+/-
-
+ +/-
-
+ +/-
-
+
+/-
-
+ +/-
-
S2K18 +
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
S4K3 +
+
+/- +
+
+/- +
+
+/-
+
+
+/-
-
+
+/-
-
+
+/-
S5K3
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
S6K1 +
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
S18K1 -
-
-
-
-
-
- +/-
-
-
-
-
-
-
-
-
+/-
-
S18K2 -
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
S18K4 +/- +
+
+
+
+ +/
-
-
+
+/- +
+
+
+
+
+
-
+
S18K7 -
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
S18K9 +
+
+
+
+
+ +/
-
+/-
+
+/- +
+
+
+
+
+
+
+
S18K1
0
+/- +
-
+/
-
+
-
+/
-
+
-
+/- +
-
+
+
-
+
+
-
S19K1 + +/-
-
+
-
-
+/
-
+/-
-
+
-
-
+
+/-
-
+/-
-
-
S19K2 +
+
+
+
+
+ +/
-
+
+
+
+
+
+/-
+
+
+
+
+
S19K3 +/- +
-
+/
-
+
-
+/
-
+
-
+/- +
-
+
+
-
+
+
-
S19K6 +
+
+
+/
-
+/-
+ +/
-
+/-
+
+
+
+
+
+
+
+
+
+
S19K7 +
+
-
+
+
-
+/
-
+/- +/- +/- +
-
+
+
-
+
+
-
S19K8 +
+
+/- +
+
+/- +
+
+/-
+
+
+/-
+
+
+/- +
+
+/-
S19K1
0
+
+
-
+
+
-
+
+
-
+
+
-
+
+
-
+
+
-
S20K1 +
+
+
+
+
+
+ +/-
+
+
+
+
+
+
+
+
+
+
S20K2 +/- +/-
-
+/
-
+/-
-
+/
-
+/-
-
+/- +/-
-
+/- +/-
-
+/- +/-
-
S20K3 +
+
-
+
+
-
+
+
-
+
+
-
+
+
-
+
+
-
24
Numer
szczepu
Pseudomonas
aeruginosa
Staphylococcus
aureus
Klebsiella
pneumoniae
Escherichia
coli
Proteus
mirabilis
Providencia
stuarti
*
** *** *
** *** * ** *** *
** ***
*
** *** *
** ***
S20K8 +
+
+
+
-
-
+
+
-
+/- +
-
+
+
-
+
+
-
S20K9 -
-
+
-
-
+
-
-
+
-
-
+
-
-
+
-
-
+
S21K5 +
+
-
+/
-
+
-
+/
-
+
-
+/- +
-
+/-
+
-
+/- +
-
S21K6 -
-
-
-
-
-
-
-
-
-
-
-
-
-
-
+/-
-
-
S21K7 -
-
-
-
-
-
- +/-
-
-
-
-
-
-
-
+/- +/-
-
S23K2 +
+
-
+
+
-
+
+
-
+
+
-
+
+
-
+
+
-
* - przesączone; ** - 90°C/20 min; ***- peroksydaza/noc
+ działanie antybakteryjne (brak wzrostu bakterii)
+/- działanie antybakteryjne (zahamowanie wzrostu bakterii, na dnie dołka widoczny osad)
- brak działania antybakteryjnego (wzrost bakterii)
W supernatantach pohodowlanych przesączonych 23 wykazywało właściwości
antybakteryjne. Dwadzieścia z nich było bakteriobójcze, z czego 7 działało na wszystkie
bakterie, a 13 działało wybiórczo na wybrane bakterie. Szczep S20K3 wykazywał
właściwości bakteriobójcze także w przypadku rozcieńczenia supernatantu w stosunku
1:1. Dziesięć supernatantów pohodowlanych nierozcieńczonych wykazało właściwości
bakteriostatyczne, z czego szczep S18K4 w przypadku Providencia stuarti także
rozcieńczony. Pięć z badanych prób nierozcieńczonych wykazywało właściwości
antybakteryjne wobec jednego lub dwóch szczepów bakterii (S1K1, S4K3, S6K1,S21K6,
S21K7).
Z badanych supernatantów pohodowlanych ogrzewanych w temperaturze 90°C,
nierozcieńczonych 21 posiada właściwości antybakteryjne. Siedemnaście wykazało
właściwości bakteriobójcze, z czego niektóre (S1K1, S4K3, S18K9, S19K3, S19K6,
S19K7, S20K1) działają tylko w stosunku do wybranych bakterii. Dla jednego szczepu
(S20K3), podobnie jak to było w przypadku próby nie podgrzewanej, wykazano
właściwości bakteriobójcze także w przypadku rozcieńczenia podłoża po hodowli.
Dziesięć supernatantów pohodowlanych nierozcieńczonych posiada właściwości
bakteriostatyczne, z czego niektóre (S1K1, S18K1, S18K9, S19K1, S19K6, S19K7,
S20K1, S21K7) działały wybiórczo na wybrane bakterie.
Działanie wysoką temperaturą na badane próby w przypadku niektórych szczepów
wzmogło działanie antybakteryjne (S1K1, S18K1, S18K4, S18K10, S21K5, S21K7), a w

25
niektórych osłabiło (S2K12, S6K1, S18K9, S19K1, S19K3). Zmiany te prawdopodobnie
spowodowane są albo zniszczeniem takich czynników antybakteryjnych jak adhezyny
lub białek warstwy S wrażliwych na wysoką temperaturę lub też wstępne oczyszczenie
preparatów bakteriobójczych z czynników, które hamowały ich aktywność.
Poprzez działanie peroksydazy na uzyskane supernatanty w przypadku jednego szczepu
(S20K9) zaobserwowano wzmożenie działania antybakteryjnego, natomiast u innych
szczepów (S2K18, S18K4, S18K9, S19K2, S19K6, S20K1) działanie antybakteryjne
pozostało bez zmian. W przypadku 2 szczepów Lactobacillus (S4K3, S19K8) efekt
bakteriobójczy był słabszy, a u pozostałych 12 już go w ogóle nie obserwowano. Enzym
peroksydaza rozkłada wodę utlenioną, która jest czynnikiem działającym antybakteryjnie
u szczepów Lactobacillus. Nasuwa się więc wniosek, że w supernatantach, w których
nastąpiło obniżenie lub nie miały wcale właściwości antybakteryjnych głównym
czynnikiem działającym bójczo była właśnie woda utleniona. Porównując uzyskane
wyniki z Ryc.2, na której przedstawiono ilość wytwarzanej wody utlenionej możemy
zauważyć, że w szczepach (S18K10, S19K1, S19K3, S19K7, S19K8, S19K10, S23K2),
które wytwarzały dużą ilość wody utlenionej po zadziałaniu peroksydazy nastąpił spadek
aktywności antybakteryjnej. To potwierdza, że woda utleniona była u nich dominującym
czynnikiem działającym antybakteryjnie. Natomiast w przypadku szczepów
Lactobacillus S18K9 i S19K6, które produkowały dużą ilość wody utlenionej, a działanie
peroksydazy nie wpłynęło na ich bójcze działanie, można stwierdzić że woda utleniona
nie jest ich głównym czynnikiem o działaniu antybakteryjnym.

26
V. Dyskusja
Probiotyki stają się w dzisiejszych czasach alternatywą dla antybiotyków w
zakażeniach układu moczowego. Są już z powodzeniem stosowane w infekcjach układu
pokarmowego prowadzących do biegunek, a także w żywieniu dojelitowym
okołooperacyjnym jako profilaktyka przeciwinfekcyjna. Zakażenia układu moczowego
są problemem medycyny na całym świecie, kobiet, a także pacjentów z urazem rdzenia
kręgowego, pęcherzem neurogennym oraz długotrwale cewnikowanych Długotrwała
antybiotykoterapia skutkuje wzrastającą lekoopornością bakterii chorobotwórczych oraz
niszczy naturalna mikroflorę człowieka (Borchert i in. 2008). Na szczególną uwagę
zasługuje Lactobacillus, które zdolne są do przeżycia w środowisku organizmu. Cechy
jakie posiadają mogą świadczyć o ich zdolności do konkurowania, a nawet zwalczania
bakterii patogennych (Buda i in. 2013). Na podstawie prac różnych autorów można
zauważyć, że do tej pory badane były jedynie szczepy z rodzaju Lactobacillus
wyizolowane od człowieka lub zwierzęcia, ponieważ są to mikroorganizmy naturalnie
zasiedlające organizm, z czego można wnioskować, że są dla niego bezpieczne. Należy
jednak zachować szczególną ostrożność u pacjentów z niedoborem odporności, ponieważ
u takich osób nawet bakterie probiotyczne mogą stać się patogenne (Borchert i in. 2008).
Równie bogatym źródłem bakterii z rodzaju Lactobacillus są kiszone warzywa i
produkty mięsne. W czasie spontanicznej fermentacji, która jest uzależniona od
epifitycznych organizmów, warzywa są zanurzone w roztworze soli na kilkanaście dni w
temperaturze od 8-27°C. W tym czasie mikroorganizmy Gram- ujemne są obecne na
powierzchni warzyw. Ilość bakterii fermentacji mlekowej (LAB) jest niewielka, ale
wzrasta w końcowym etapie fermentacji wraz z obniżeniem ilości tlenu oraz soli. Te dwa
czynniki powodują śmierć bakterii Gram- ujemnych, dla których nie jest to korzystne
środowisko. Natomiast LAB szybko się namnażają, produkują kwas mlekowy i stają się
florą dominującą (Schillinger 1987, Yu 2012). Te informacje pozwoliły wykorzystać w
tej pracy kiszonki jako źródło Lactobacillus. Są to produkty spożywane na co dzień przez
człowieka, daje to pewność, że wyizolowane bakterie będą bezpieczne dla człowieka. Do
izolacji bakterii z kiszonek zastosowano metodę rozcieńczeń soków w postępie
arytmetycznym, następnie wysiano je na podłoże MRS agar, tak jak zostało to opisane
przez Saeedi i wsp. [2014]. Szczepy zaklasyfikowano do rodzaju Lactobacillus, poprzez
wykonanie barwienia Grama, testu na katalazę oraz testów biochemicznych

27
obejmujących fermentację glukozy, eskuliny i dihydrolazę argininy i badano ich
właściwości antybakteryjne (Saeedi i in., 2014).
Najczęściej badania właściwości antybakteryjnych bakterii probiotycznych
dotyczą gotowego preparatu probiotycznego złożonego z jednej lub mieszaniny bakterii
kwasu mlekowego, często w stosunku do jednego konkretnego patogenu. Przykładem
takich badań było zastosowanie probiotyków u osób zakażonych E. coli zarówno u
pacjentów długotrwale cewnikowanych oraz kobiet, co zmniejszyło zapadalność na
odcewnikowe zakażenie układu moczowego oraz epizody nawrotów (Borchert i wsp.,
2008). W badaniach klinicznych stosowano również L. reuteri oraz L. crispatus
(Stapleton i in. 2011, Jones i in., 2012). Stosowanie L. crispatus w czopkach
dopochwowych zmniejszyło występowanie zakażeń układu moczowo- płciowego u
kobiet (Dineshkumar i in. 2013). Szczep ten był głównym składnikiem probiotyku
Lactiv- V, który nie tylko redukował zakażenia, a także powodował odbudowywanie
endogennej flory L. crispatus (Stapleton i in. 2011). Preparat probiotyczny złożony ze
szczepów L. rhamnosus GR-1 i L. reuteri spowodował zmniejszenie liczby nawrotów
zakażeń układu moczowego oraz miał pozytywny wpływ na normalną mikroflorę
bakteryjną badanych kobiet (Banan- Mwine Daliri, Lee 2015). Fraga i wsp. (2005)
przeprowadzili badania na myszach w których wykazali, że L. murinus, będący
składnikiem naturalnej flory myszy, zapobiegał oraz hamował wzrost bakterii
patogennej, towarzyszącej rozwojowi infekcji układu moczowego. Infekcje pęcherza
były rzadsze u myszy przyjmujących probiotyk niż u myszy, którym go nie podawano.
Zjawiska zahamowania wzrostu patogenu nie zaobserwowano w przypadku nerek (Fraga
2005). W prezentowanej pracy magisterskiej wykazano działanie antybakteryjne
szczepów Lactobacillus w stosunku do wielolekoopornych bakterii uropatogennych
izolowanych z cewników urologicznych. Jak wykazano, za efekt ten odpowiadają
zarówno wytwarzane przez bakterie kwasy organiczne i woda utleniona, jak i inne
czynniki o różnej stabilności w wysokiej temperaturze. Juárez i wsp. (2011) sprawdzali
wpływ 38 szczepów Lactobacillus na bakterie powodujące zakażenia układu
moczowego. Prawie połowa szczepów Lactobacillus hamowała wzrost bakterii
patogennych, natomiast ok. 70% wytwarzało nadtlenek wodoru. Ten czynnik oraz
wytwarzanie kwasów organicznych odpowiadało za efekt bakteriobójczy (Juárez i in.
2011). W pracy magisterskiej poprzez podniesienie pH supernatantów pohodowlanych
udowodniono, że nie u wszystkich szczepów właściwości antybakteryjne zależą od

28
produkcji kwasów organicznych. Wykazano również, że wszystkie badane szczepy
produkują w różnym stopniu nadtlenek wodoru. Rozkład wody utlenionej peroksydazą
wykazał, w których z badanych szczepów czynnikiem antybakteryjnym była woda
utleniona, a w których inne czynniki. Próba określenia czynnika antybakteryjnego
wykazała, że część szczepów posiada czynniki antybakteryjne termowrażliwe, a część
termostabilne. Badania powinny być kontynuowane w kierunku szczegółowego poznania
mechanizmów antybakteryjnego działania Lactobacillus wraz z ustaleniem
najefektywniejszego czynnika bójczego oraz jego optymalnej dawki. Praca ukazuje
również korzyści wynikające z profilaktycznego spożywania kiszonek, jako źródła
probiotyków działających dobroczynnie na nasz organizm.

29
IV. Wnioski
1. Wszystkie badane soki z kiszonej kapusty i ogórków były bogatym źródłem szczepów
Lactobacillus.
2. Znaczna część badanych soków (10 z 27 badanych) zawierała bakterie o
właściwościach antybakteryjnych.
3. Wszystkie wyizolowane z soków Lactobacillus zahamowały wzrost wybranych
uropatogenów.
4. Analizując działanie antybakteryjne hodowli Lactobacillus z i bez podnoszenia pH
można stwierdzić, że za efekt ten nie odpowiada tylko produkcja kwasów
organicznych.
5. Wykazano, że wszystkie szczepy Lactobacillus wytwarzają wodę utlenioną, ale ilość
tego produktu uwalnianego w hodowlach była bardzo zróżnicowana. Rozkład wody
utlenionej przez peroksydazę spowodował spadek (12 z 28 badanych) właściwości
antybakteryjnych co potwierdza występowanie jeszcze innych czynników o działaniu
bójczym na bakterie.
6 . Dalsze próby ustalenia czynnika działającego antybakteryjnie polegające na badaniu
właściwości prób po działaniu wysokiej temperatury wykazały, że (5 z 27 badanych)
bakterie posiadają czynniki termowrażliwe oraz te odporne na wysoką temperaturę (6
z 27 badanych).

30
IV. Streszczenie
Bakterie fermentacji mlekowej z rodzaju Lactobacillus to drobnoustroje, które
dzięki posiadanym czynnikom antybakteryjnym mogą być stosowane jako leki lub też w
profilaktyce wielu schorzeń, m. in. w zakażeniach układu moczowego. Badania w
prezentowanej pracy zostały podjęte z uwagi na ogromne zainteresowanie świata nauki
praktycznym zastosowaniem tych bakterii oraz ze względu na mało doniesień o
antybakteryjnym działaniu probiotyków wyizolowanych z fermentującej żywności.
Celem pracy była izolacja i identyfikacja bakterii z rodzaju Lactobacillus z kiszonek, oraz
zbadanie ich właściwości antybakteryjnych. Szczepy izolowano z soków z kiszonej
kapusty i ogórków na podłożu MRS i identyfikowano na podstawie właściwości
biochemicznych i morfologii komórek. Działanie bakteriobójcze badano w stosunku do
szczepów uropatogennych bakterii izolowanych z cewników urologicznych. Początkowo
określono właściwości antybakteryjne supernatantów pohodowlanych mieszanej flory z
poszczególnych soków, a następnie zbadano właściwości antybakteryjne supernatantów
z wybranych szczepów z rodzaju Lactobacillus. Ponadto podjęto próbę wstępnego
określenia czynnika antybakteryjnego. W tym celu zbadano wytwarzanie wody utlenionej
przez wybrane szczepy oraz wpływ na ich działanie pH wzrostu, przesączenia,
podgrzania oraz poddania działaniu peroksydazy supernatantów. Uzyskane wyniki
wykazały, że soki z kiszonek były bogatym źródłem bakterii z rodzaju Lactobacillus.
Duża część soków (10 z 27) zawierała bakterie o właściwościach antybakteryjnych.
Podniesienie pH supernatantów potwierdziło, że za właściwości antybakteryjne nie
odpowiadają tylko kwasy organiczne. Wszystkie badane szczepy w różnym stopniu
wytwarzały wodę utlenioną, a jej rozkład przez peroksydazę spowodował w przypadku
niektórych szczepów (12 z 28) osłabienie działania antybakteryjnego. Wskazało to, w
których szczepach głównym czynnikiem działającym bójczo była woda utleniona.
Podgrzanie supernatantów badanych szczepów potwierdziło występowanie w nich
antybakteryjnych czynników termowrażliwych (w 5 z 28 badanych) i termostabilnych (w
6 z 28 badanych) Uzyskane wyniki mogą stać się podstawą dla dalszych badań nad
skutecznym lekiem probiotycznym na zakażenia układu moczowego.

31
Summary
Lactic acid bacteria of the genus Lactobacillus are microorganisms which possess
antibacterial agents and thus can be used as medicaments or for the prophylaxis of various
disorders, e.g. in urinary tract infections. Research in this paper has been taken due to the
enormous interest in the world of science in practical application of these bacteria, and
because of the few reports about antibacterial activity of probiotics isolated from
fermenting food. The aim of this study was isolation and identification of bacteria of the
genus Lactobacillus from pickled cucumbers and cabbage and to investigate their
antibacterial properties. Strains were isolated from cabbage and cucumber juice on MRS
medium and identified on the basis of morphology and biochemical properties of the cells.
Antibacterial activity was tested against uropathogenic bacteria strains isolated from the
catheter. At first the antibacterial properities were defined in the post-culture supernatants
mixed flora and then the antibacterial properties of supernatants from selected strains of
Lactobacillus were examined. Moreover, there was an attempt to define the antibacterial
agent. For that purpose the production of hydrogen peroxide by the selected strains and
their impact on the pH of their growth was examined as well as filtration, heating and
treatment of supernatants with peroxidase. The results showed that the fermented juices
are rich in bacteria of the genus Lactobacillus. A large part of juice (10 of 27) contained
the bacteria with antibacterial properties. Raising the pH of the supernatants confirmed
that the antibacterial properties do not correspond to only organic acids. All tested strains
produced varying degrees of hydrogen peroxide and its decomposition by peroxidase in
the case of certain strains (12 of 28) caused decrease of antibacterial properites. This
indicated that the strains of the main active antibacterial agent was hydrogen peroxide.
Heating the supernatants of tested strains confirmed the presence of antibacterial
thermosensitive agents (5 of 28 patients) and thermostable agents (6 out of 28
respondents). The results can be the basis for further research on effective probiotic drug
for urinary tract infections.

32
VII. Literatura
1. Banan-Mwine Daliri E., Lee B.H. 2015. New perspectives on probiotics in health and
disease. Food Science and Human Wellness, 4: 56-65
2. Borchert D., Sheridan L., Papatsoris A., Faruquz Z., Barua J.M., Junaid I., Pati Y.,
Chinegwundoh F., Buchholz N. 2008. Prevention and treatment of urinary tract
infection witch probiotics: Review and research perspective. Indian Journal of
Urology. 24, 2:139-144
3. Buda B., Dylus E., Górska- Frączek S., Brzozowska E., Gamian A. 2013. Właściwości
biologiczne białek powierzchniowych bakterii z rodzaju Lactobacillus. Postępy
Higieny i Medycyny Doświadczalnej (online). 67:229-237
4. Dineshkumar B., Krishnakumar K., Jalaja S.M., Anish J., Paul D., Cherian J. 2013.
Natural approaches for Treatmeant of Urinary Tract Infections: A Review. Scholars
Academic Journal of Pharmacy. 2(6): 442-444
5. Fraga M., Scavone P., Zunino P. 2005. Preventive and therapeutic administartion of
a indigenous Lactobacillus sp. strain against Proteus mirabilis ascendind urinary
tract infection in a mouse model. Antoine van Leeuwnhock. 88: 25-34
6. Gajewska J., Błaszczyk M.K. 2012. Probiotyczne bakterie fermentacji mlekowej
(LAB). Postępy Mikrobiologii. 51,1:55-65
7. Goldin B.R., Gorbach S.L. 2008. Clinical Identifications for Probiotics: An Overview.
Clinical Infectious Diseases. 46:96–100
8. Hoesl C.E., Altwein J.E. 2005. The Probiotic Approach: An Alternative Treatment
Option in Urology. European Urology. 47:288-296
9. Jones M.L., Martoni C.J., Di Pietro E., Simon R.R., Prakash S. 2012. Evaluation of
clinical safety and tolerance of a Lactobacillus reuteri NCIMB 30242 supplement
capsule: A randomized control trial. Regulatory Toxicology and Pharmacology. 60,
2: 313–320
10. Juárez T.M.S., Saralegui Duhart C.I., De Gregorio P.R., Vera Pingitore E., Nader-
Macias M.E. 2011. Urogenital pathogen inhibition and compatibility between vaginal
Lactobacillus strains to be considered as probiotic candidates. European Journal of
Obstetrics and Gynecology and Reproductive Biology. 159: 399-406
11. Kang H.J., Baker E.N. 2012. Structure and assembly of Gram-positive bacterial pili:
unique covalent polymers. Current Opinion in Structural Biology. 22: 200-207

33
12. Kuśmierska A., Fol M. 2014. Właściwości immunomodulacyjne i terapeutyczne
drobnoustrojów probiotycznych. Problemy Higieny i Epidemiologii. 95(3):529-540
13. Mojka K. 2014. Probiotyki, Prebiotyki i synbiotyki- charakterystyka i funkcje.
Problemy Higieny i Epidemiologii. 95(3): 541-549
14. Saeedi M., Shahidi F., Mortazavi S.A., Milani E., Yazdi F.T. 2015. Isolation and
identification of lactic acid bacteria in winter salad (local pickle) during
fermantation using 16s rRNA gene sequence analysis. Journal of Food Safety. 35:
287-294
15. Schillinger U., Lucke F-K. 1987. Identification of lactobacilli from meat and meat
products. Food Microbiology. 4: 199-208
16. Słońska A., Klimuszko D. 2010. Bakteriocyny probiotycznych pałeczek z rodzaju
Lactobacillus. Postępy Mikrobiologii. 40, 2: 87-96
17. Stapleton A.E., Au- Yeung M., Hooton T.M., Fredricks D.N., Roberts P.L., Czaja
C.A., Yarova- Yarovaya Y., Fiedler T., Cox M., Stamm W.E. 2011. Randomized,
placebo- controlled phase 2 trial of a Lactobacillus crispatus probiotic given
intravaginally for prevention of recurent urinary tract infection Clinical Infectious
Diseases. 52(10):1212–1217.
18. Tripathi P., Beaussart A., Andre G., Rolain T., Lebeer S., Vanderleyden J., Hols P.,
Dufrěne Y.F. 2012. Towards a nonoscale view of lactic acid bacteria. Micron. 50: 31-
42
19. Yu J., Gao W., Qing M., Sun Z., Wang W., Liu W., Pan L., Sun T., Wang H., Bai N.,
Zhang H. 2012. Identification and characterization of lactic acid bacteria isolated
from traditional pickles in Sichuan, China. Journal of General and Applied
Microbiology. 58:163-172
Wyszukiwarka
Podobne podstrony:
praca magisterska prawo administracyjne wyklad 2 semestr, kompletne magisterki 2016
praca magisterska Akty kończące ogólne postępowanie administracyjne
praca-magisterska-a11406, Dokumenty(2)
praca-magisterska-a11222, Dokumenty(2)
praca-magisterska-6811, Dokumenty(8)
praca-magisterska-a11186, Dokumenty(2)
praca-magisterska-7383, Dokumenty(2)
Metody treningowe, Mikołaj praca magisterska
praca-magisterska-a11473, Dokumenty(2)
praca-magisterska-6699, Dokumenty(8)
praca-magisterska-7444, Dokumenty(2)
praca-magisterska-6435, Dokumenty(8)
praca-magisterska-wa-c-7459, Dokumenty(2)
praca-magisterska-wa-c-7525, Dokumenty(2)
praca-magisterska-7412, Dokumenty(2)
praca-magisterska-wa-c-7468, Dokumenty(2)
praca-magisterska-7092, 1a, prace magisterskie Politechnika Krakowska im. Tadeusza Kościuszki
więcej podobnych podstron