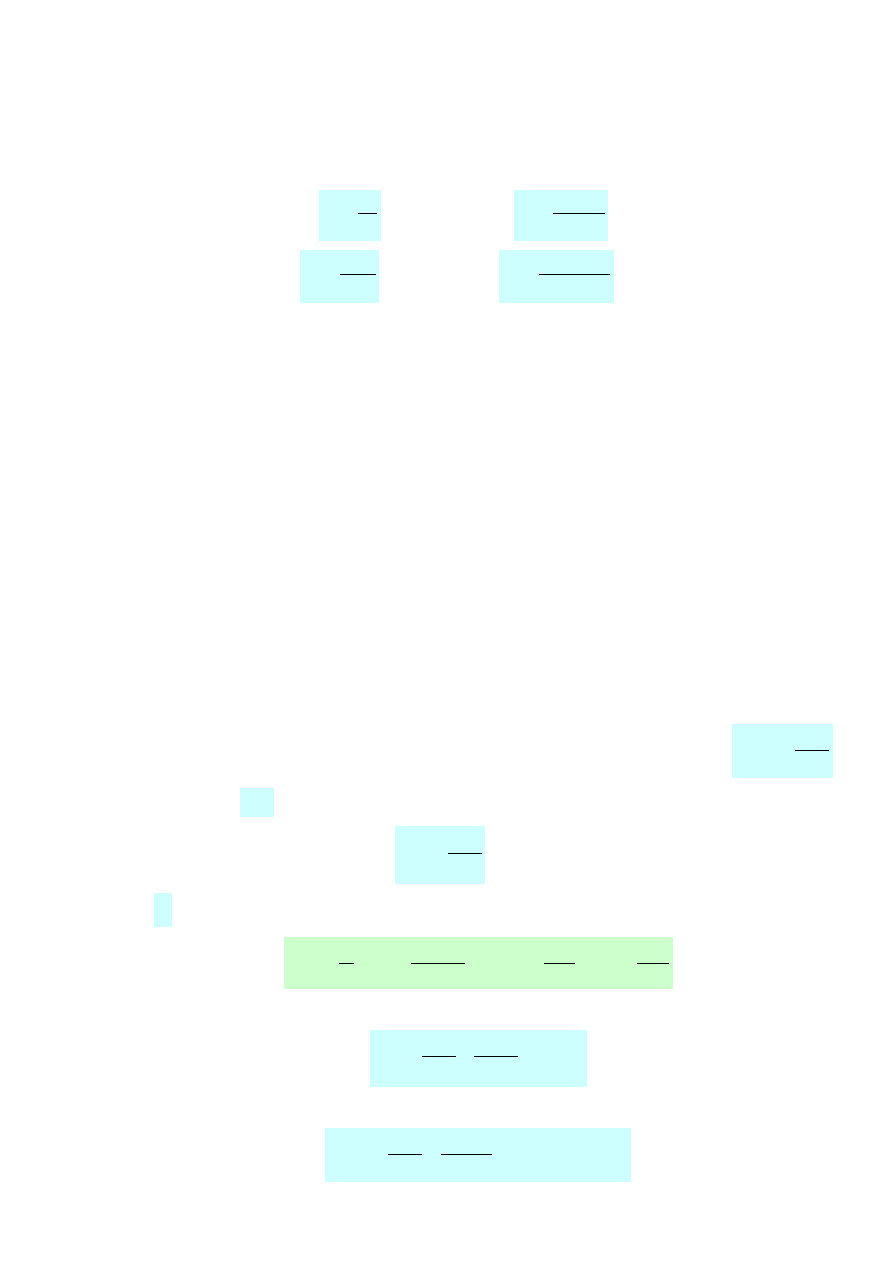
ZADANIA Z CHEMII
Stężenia roztworów - stężenie molowe (c
,
stężenie molalne (c
m
)
Stężenie molowe (c
m
) i stężenie molalne (c
m
) oblicza się z zależności:
r
s
m
V
n
c
=
[1]
s
r
s
m
M
V
m
c
⋅
=
[2]
rozp
s
m
m
n
c
=
[3]
s
rozp
s
m
M
m
m
c
⋅
=
[4]
Gdzie:
n
s
– liczba moli substancji rozpuszczonej w roztworze
m
s
– masa substancji rozpuszczonej w roztworze w [g]
m
rozp
– masa rozpuszczalnika w [kg]
V
r
– objętość roztworu w [dm
3
]
M
s
– masa molowa substancji rozpuszczonej w roztworze w [g/mol]
Zadanie 1. 20 dm
3
amoniaku (warunki standardowe) rozpuszczono w wodzie otrzymując 2 dm
3
roztworu. Oblicz stężenie molowe amoniaku w tym roztworze.
Dane:
20
3
=
NH
V
dm
3
V
r
= 2 dm
3
Rozwiązanie:
Stężenie molowe NH
3
w otrzymany roztworze należy obliczyć wykorzystując wzór:
r
NH
NH
m
V
n
3
3
,
=
c
Liczbę moli NH
3
(
3
NH
n
) oblicza się, zakładając, że gaz ten ma właściwości gazu doskonałego, ze
wzoru:
−
=
V
V
n
NH
NH
3
3
Gdzie
−
V
- objętość molowa gazu doskonałego w warunkach standardowych, obliczona z zależności:
mol
dm
mol
m
p
T
R
V
3
3
44
,
24
02444
,
0
101325
298
31
,
8
=
=
⋅
=
⋅
=
−
A zatem:
8183
,
0
44
,
24
20
3
3
=
=
=
−
V
V
n
NH
NH
Czyli:
3
,
/
4092
,
0
2
8183
,
0
3
3
dm
mol
V
n
c
r
NH
NH
m
=
=
=
Zadanie 2. 20 g glukozy dodano do 200 g wody otrzymując roztwór o objętości 210 cm
3
. Oblicz
stężenie molowe i molalne glukozy w tak otrzymanym roztworze.
Dane:
m
glukozy
= 20 g
m
rozp
= 200 g = 0.20 kg
M
glukozy
= 180 g/mol
V
r
= 210 cm
3
= 0,21 dm
3
Rozwiązanie:
Stężenie molowe glukozy (c
m
) w otrzymany roztworze należy obliczyć wykorzystując wzór:
3
/
5291
,
0
180
21
,
0
20
dm
mol
M
V
m
c
glukozy
r
glukozy
m
=
⋅
=
⋅
=
Stężenie molalne glukozy (c
m
) w otrzymany roztworze należy obliczyć wykorzystując wzór:
rozp
glukozy
rozp
glukozy
m
kg
mol
M
m
m
c
/
5555
,
0
180
20
,
0
20
=
⋅
=
⋅
=
Zadania do samodzielnego rozwiązania:
1. W jakiej objętości roztworu o stężeniu 0,5 mol/dm
3
znajduje się 2 mole substancji rozpuszczonej?
Odp.: V
r
= 4 dm
3
.
2. Oblicz masę molową substancji rozpuszczonej, wiedząc, że w 0,6 dm
3
roztworu tej substancji o
stężeniu 0,2 mol/dm
3
, znajduje się 4,8 g tej substancji. Odp.: M
s
= 40 g/mol.
3. W 5,0 kg wody rozpuszczono 100 g wodorotlenku sodu. Zakładając, że objętość końcowego
roztworu wyniesie 5 dm
3
, oblicz jego stężenie molowe. Odp.: c
m
= 0,5 mol/dm
3
.
4. Oblicz stężenie molowe kwasu azotowego zawierającego 1,50 g czystego składnika 250 cm
3
roztworu. Odp.: c
m
= 0,0952 mol/dm
3
.
5. W 5,0 dm
3
roztworu zasady potasowej o gęstości d = 1,15 g/cm
3
znajduje się 182,5 g KOH. Oblicz
stężenie molowe i stężenie molalne tego roztworu.
Odp.: c
m
= 0,6505 mol/dm
3
, c
m
= 0,5854 mol/kg
rozp
.
6. Do 100,0 g siarczanu(VI) sodu wlano 950 cm
3
wody uzyskując 1,00 dm
3
roztworu. Oblicz stężenie
molowe oraz stężenie molalne tego roztworu. Odp.: c
m
= 0,7040 mol/dm
3
, c
m
= 0,7413 mol/kg
rozp
.
7. Oblicz ile gramów NaOH zawiera 200 cm
3
roztworu o stężeniu 0,245 mol·dm
-3
. Odp.: m = 1,96 g.
8. Ile gramów substancji rozpuszczonej zawiera 25 cm
3
roztworu NH
4
NO
3
o stężeniu 0,1 mol·dm
-3
?
Odp.: m = 0,20 g.
9. Oblicz, w jakiej objętości roztworu NaCl o stężeniu 0,150 mol·dm
-3
rozpuszczone jest 1,200 g
chlorku sodu? Odp.: V
r
= 136,9 cm
3
.
10. Jaka jest masa molowa substancji, której 0,960 grama rozpuszczone jest w 200 cm
3
roztworu o
stężeniu 0,120 mol·dm
-3
? Odp.: M
s
= 40 g/mol.
Wyszukiwarka
Podobne podstrony:
stezenie molowe roztworow wodnych 2
Stezenie molowe-rozwiazania, Dla licealistów
Odpowiedzi 5 1 Stęzenia molowe
9 roztwory-stężenie molowe
Stezenie molowe-rozwiazania, Licencjat, Semestr IV, biologia molekularna
Stężenie % molowe oraz ph zadania, dokumenty, chemia, Zadania
Stężenie molowe, Farmacja(0)
Stężenie molowe roztworów wodnych
stezenie molowe roztworow wodnych
chemia stezenie molowe i procentowe
6.Stężenia molowe, Chemia ogólna ćwiczenia
5 1 Stężenie molowe
stezenie molowe roztworow wodnych 2
Stezenie molowe-rozwiazania, Dla licealistów
zadania na stężenie molowe(1)
10 4 FOLIA Stężenie molowe i przeliczenia stężeń zadania do lekcji nr 1
więcej podobnych podstron