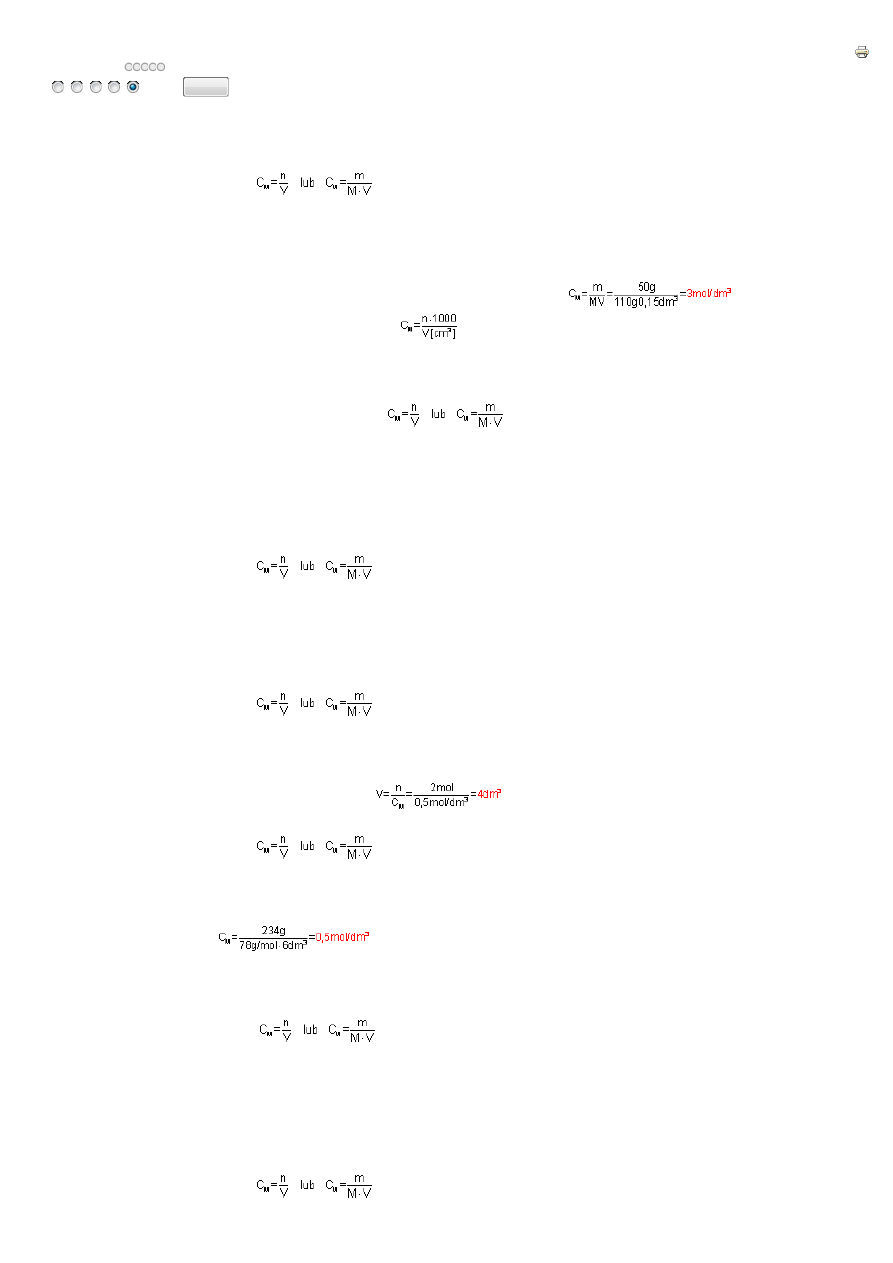
Strona 1
Odpowiedzi 5.1.
2011-05-02 12:43:10
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/89-odp-51.html?tmpl=component&print=1&page=
Odpowiedzi 5.1.
Ocena u
ż
ytkowników:
/ 0
Słaby
Ś
wietny
Oce
ń
5.1. St
ęż
enie molowe
5.1-1.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
50g chlorku wapnia to 50g/111g/
mol
=0,45mol chlorku wapnia. Ta ilo
ść
chlorku wapnia znajduje si
ę
w 150cm
3
=0,15dm
3
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe
otrzymamy: C
M
=0,45mol/0,15dm
3
=3mol/dm
3
. Identyczny wynik otrzymamy podstawiaj
ą
c dane do drugiego wzoru:
. Niekiedy nie zamienia si
ę
obj
ę
to
ś
ci roztworu na dm
3
tylko obj
ę
to
ść
podaje w cm
3
i stosuje mno
ż
nik 1000:
. Bez wzgl
ę
du, który wzór zastosujemy, otrzymamy identyczny wynik.
5.1-2.
St
ęż
enie molowe okre
ś
la ilo
ść
moli substancji w 1dm
3
roztworu. Je
ż
eli w 2dm
3
roztworu znajduje si
ę
6 moli substancji, to w 1dm
3
roztworu znajduj
ą
si
ę
3 mole substancji, roztwór
wi
ę
c ma st
ęż
enie 3mol/dm
3
. St
ęż
enie molowe mo
ż
e by
ć
policzone ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Podstawiaj
ą
c dane z zadania do wzoru otrzymamy: C
M
=6mol/2dm
3
=3mol/dm
3
.
5.1-3.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Podstawiaj
ą
c dane do wzoru i przekształcaj
ą
c go wzgl
ę
dem n otrzymamy: n=C
M
.
V=2mol/dm
3.
0,6dm
3
=1,2mol.
5.1-4.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Podstawiaj
ą
c dane do wzoru i przekształcaj
ą
c go wzgl
ę
dem V otrzymamy:
5.1-5.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Podstawiaj
ą
c dane do wzoru otrzymamy
. Identyczny wynik otrzymamy korzystaj
ą
c z definicji st
ęż
enia molowego. 234g Na
2
S to 234g/78g/
mol
=3mole Na
2
S. 3 mole siarczku sodu w 6dm
3
, to 3mole/6dm
3
=0,5mol/dm
3
.
Roztwór siarczku sodu jest 0,5M.
5.1-6.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Podstawiaj
ą
c dane do wzoru przekształconego wzgl
ę
dem m otrzymamy: m=C
M
MV=0,1mol/dm
3.
103g/
mol
.
0,2dm
3
=2,06g.
W 0,2dm
3
0,1M roztworu znajduje si
ę
2,06g NaBr.
5.1-7.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
3
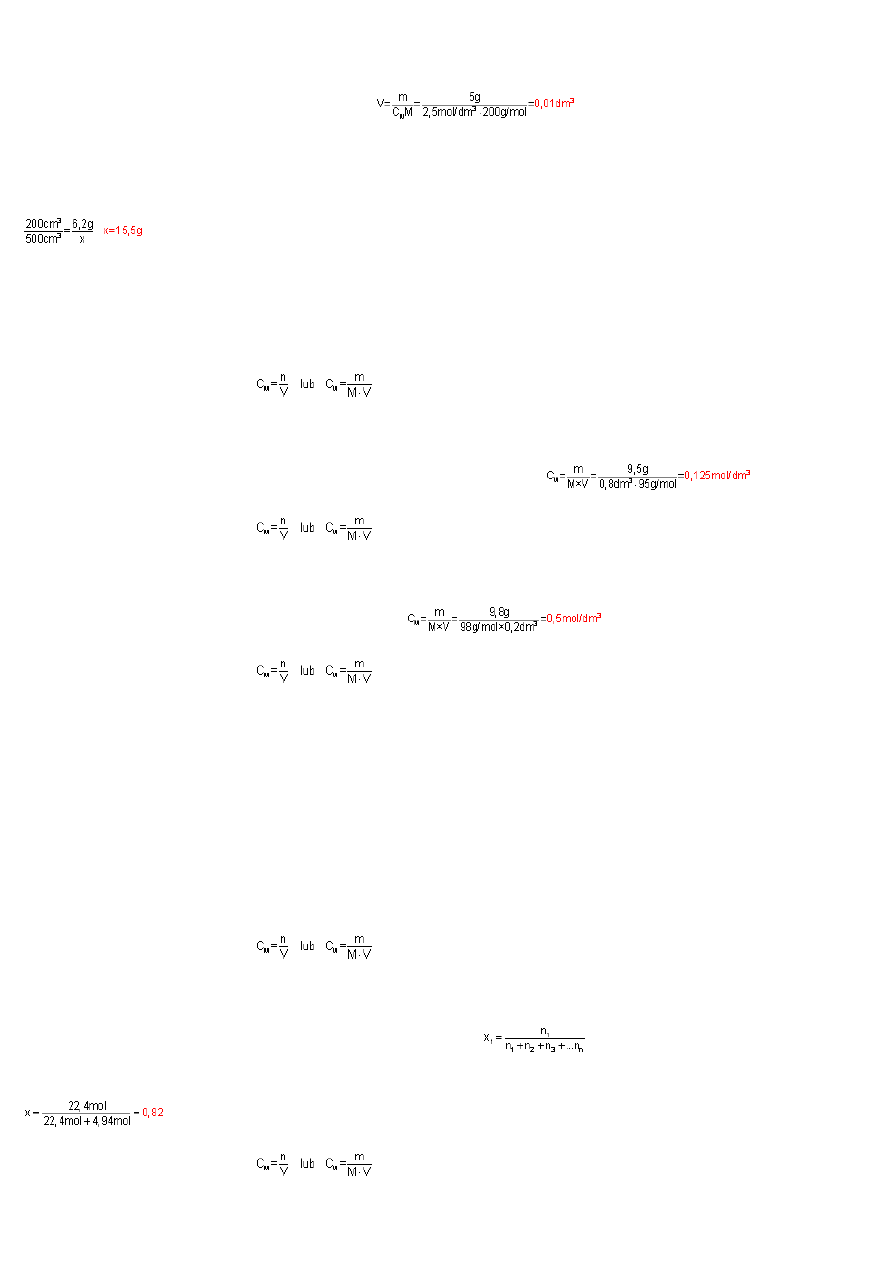
Strona 2
Odpowiedzi 5.1.
2011-05-02 12:43:10
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/89-odp-51.html?tmpl=component&print=1&page=
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Przekształcaj
ą
c wzór wzgl
ę
dem obj
ę
to
ś
ci i podstawiaj
ą
c dane otrzymamy:
5g CaBr
2
znajduje si
ę
w 0,01dm
3
(10cm
3
) 2,5M roztworu.
5.1-8.
Je
ż
eli w 200cm
3
roztworu znajduje si
ę
6,2g H
3
BO
3
, to
w 500cm
3
tego roztworu znajdzie si
ę
x g H
3
BO
3
, czyli:
Liczb
ę
moli kwasu obliczymy ze wzoru n=m/M. Dla H
3
BO
3
masa molowe M=62g/
mol
. Podstawiaj
ą
c dane do wzoru otrzymamy: n=15,5g/62g/
mol
=0,25mol.
W 500cm
3
roztworu znajduje si
ę
0,25 mola kwasu borowego.
5.1-9.
Je
ż
eli st
ęż
enie roztworu jest 0,1M wzgl
ę
dem P
2
O
5
, to w 1 litrze znajduje si
ę
0,1 mola P
2
O
5
. W 0,1 mola P
2
O
5
znajduje si
ę
0,2 mola fosforu. Ta ilo
ść
fosforu znajduje si
ę
w 0,2
mola MgHPO
4
. Czyli w 1 litrze znajduje si
ę
0,2mola MgHPO
4
i roztwór jest 0,2M wzgl
ę
dem MgHPO
4
.
5.1-10.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Masa molowa chlorku magnezu M=95g/
mol
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie procentowe otrzymamy:
5.1-11.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
M
H SO
=98g/
mol
; V=200cm3=0,2dm
3
. Podstawiaj
ą
c dane do wzoru otrzymamy:
5.1-12.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Ilo
ść
moli chlorku sodu w roztworze pierwotnym (w 200cm
3
) i w roztworze powstałym przez odparowanie wody jest taka sama: n=C
M
V=0,2mol/dm
3.
0,2dm
3
=
0,04mol
.
Przekształcaj
ą
c wzór na st
ęż
enie molowe wzgl
ę
dem V otrzymamy: V=n/C
M
=0,04mol/0,5mol
.
dm
-3
=0,08dm
3
=
80cm
3
. Aby otrzyma
ć
t
ę
ilo
ść
roztworu nale
ż
y odparowa
ć
200cm
3
-80cm
3
=
120cm
3
.
5.1-13.
W chemii litera p oznacza –log. Czyli p(SO
4
2-
) oznacza –log[SO
4
2-
]. Musimy wi
ę
c obliczy
ć
st
ęż
enie molowe kwasu siarkowego(VI). St
ęż
enie molowe oznacza ilo
ść
moli kwasu w
1dm
3
roztworu C
M
=n/V (V wyra
ż
ona w dm
3
). 0,48g jonów siarczanowych(VI) to 0,48g/96g/
mol
=
0,005mol
. St
ęż
enie tego kwasu C
M
=0,005mol/0,2dm
3
=
0,025M
.
p(SO
4
2-
)=-log[SO
4
2-
]=-log(0,025)=
1,6
.
5.1-14.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Ułamek molowy x, jest to ilo
ść
moli substancji do liczby moli wszystkich substancji w mieszaninie:
Z definicji st
ęż
enia molowego w 1 dm
3
roztworu kwasu, czyli (d=m/V) m=dV=1500g roztworu znajduje si
ę
22,4
mol
kwasu azotowego(V). Masa tego kwasu (n=m/M):
m=nM=22,4
mol
.
63g/
mol
=
1411g
. W roztworze tym jest 22,40
mol
HNO
3
oraz 1500g-1411g=89g wody, czyli n=
4,94mol
wody. Ułamek molowy kwasu w roztworze
5.1-15.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
2
4

Strona 3
Odpowiedzi 5.1.
2011-05-02 12:43:10
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/89-odp-51.html?tmpl=component&print=1&page=
lub: m – masa substancji
M – masa molowa substancji
Znaj
ą
c mas
ę
i g
ę
sto
ść
roztworu łatwo policzymy jego obj
ę
to
ść
(d=m/V) V=m/d=500g/1,19g/cm
3
=420,2cm
3
=
0,420dm
3
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe i
przekształcaj
ą
c go wzgl
ę
dem m otrzymamy: m=C
M
MV=4,25mol/dm
3.
56,1g/
mol
.
0,420dm
3
=
100,1g
.
5.1-16.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Masa molowa siarczku sodu Na
2
S M=78g/
mol
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy:
5.1-17.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Je
ż
eli w 150g wody rozpuszczono 50g chlorku wapnia (CaCl
2
) to otrzymano 200g roztworu. Jego obj
ę
to
ść
wyliczymy ze wzoru (d=m/V) V=m/d=200g/1,23g/
cm
3
=162,6cm
3
=
0,163dm
3
.
50g chlorku wapnia to 50g/111g/
mol
=
0,45mol
chlorku wapnia. Ta ilo
ść
chlorku wapnia znajduje si
ę
w 0,163dm
3
roztworu. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe
otrzymamy: C
M
=0,45mol/0,163dm
3
=
2,76mol/dm
3
. Identyczny wynik otrzymamy podstawiaj
ą
c dane do drugiego wzoru:
. Niekiedy nie
zamienia si
ę
obj
ę
to
ś
ci roztworu na dm
3
tylko obj
ę
to
ść
podaje w cm
3
i stosuje mno
ż
nik 1000:
. Bez wzgl
ę
du, który wzór zastosujemy, otrzymamy identyczny wynik.
5.1-18.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
200cm
3
roztworu to
0,2dm
3
. Masa molowa NaBr M=
102,9g/
mol
. Podstawiaj
ą
c dane do zadania i przekształcaj
ą
c go wzgl
ę
dem m otrzymamy: m=C
M
MV=
2,06g
.
5.1-19.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Obj
ę
to
ść
roztworu 400cm
3
(0,4dm
3
), st
ęż
enie C
M
=0,5M. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe i przekształcaj
ą
c wzór wzgl
ę
dem n otrzymamy: n=C
M
.
V=0,5mol/
dm
3.
0,4dm
3
=
0,2mol
.
Liczb
ę
moli obliczamy ze wzoru n=m/M, czyli przekształcaj
ą
c go wzgl
ę
dem m i podstawiaj
ą
c za n=0,2mol, za M=56g/
mol
otrzymamy: m=0,2mol
.
56g/
mol
=
11,2g
.
W celu sporz
ą
dzenia 400cm
3
0,5M roztworu KOH nale
ż
y odwa
ż
y
ć
11,2g KOH (0,2mol).
5.1-20.
Ułamek molowy definiowany jest jako
, gdzie n – liczba moli substancji.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
Podstawiaj
ą
c dane do wzoru obliczymy liczb
ę
moli NaOH w roztworze: n=C
M
V=0,5mol/dm
3.
1dm
3
=
0,5mol
, czyli masa NaOH (n=m/M) m=0,5mol
.
40g/
mol
=
20g
. Je
ż
eli g
ę
sto
ść
roztworu jest 1g/cm
3
, to 1dm
3
tego roztworu ma mas
ę
1000g. Na t
ę
mas
ę
składa si
ę
masa rozpuszczalnika (wody) i masa rozpuszczonego w niej NaOH. Masa wody m
rozp
=m
rozt
-
m
s
=1000g-20g=
980g
, czyli n=m/M=980g/18,02g/
mol
=
54,38mol
. Podstawiaj
ą
c dane do wzoru na ułamek molowy otrzymamy:
. Ułamek
molowy wody x
H2O
=1
‑
0,00911=
0,99089
.
5.1-21.
W 25cm
3
(0,025dm
3
) 0,25M roztworu znajduje si
ę
(C
M
=n/V) n=C
M
.
V=0,025dm
3.
0,25mol/dm
3
=0,00625
mol
Ca(NO
3
)
2
. Azotan(V) wapnia w wodzie dysocjuje według równania
reakcji:
Ca(NO
3
)
2
→
Ca
2+
+ 2NO
3
-
(mocny elektrolit - sól, dysocjacja całkowita)
Z równania reakcji wynika,
ż
e z 1 mola Ca(NO
3
)
2
powstaj
ą
w wyniku dysocjacji 2 mole jonów NO
3
-
, a wi
ę
c z 0,00625 mola Ca(NO
3
)
2
znajduj
ą
cego si
ę
w 25cm
3
roztworu
powstanie 2
.
0,0625mol=0,0125
mol
jonów NO
3
-
.
Aby podwoi
ć
ich st
ęż
enie nale
ż
y doda
ć
0,0125 mola jonów azotanowych(V), czyli 0,00625 mola azotanu(V) wapnia. Ta ilo
ść
moli Ca(NO
3
)
2
znajduje si
ę
(n=m/M) w
m=n
.
M=0,00625mol
.
164g/
mol
=1,025g Ca(NO
3
)
2
.

Strona 4
Odpowiedzi 5.1.
2011-05-02 12:43:10
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/89-odp-51.html?tmpl=component&print=1&page=
m=n
.
M=0,00625mol
.
164g/
mol
=1,025g Ca(NO
3
)
2
.
Aby podwoi
ć
st
ęż
enie jonów azotanowych(V) znajduj
ą
cych si
ę
w 25cm
3
0,25M roztworu Ca(NO
3
)
2
nale
ż
y doda
ć
1,025g Ca(NO
3
)
2
.
5.1-22.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Obj
ę
to
ść
roztworu V=500cm
3
=0,5dm
3
, m
s
=11,7g, M
s
=58,4g/
mol
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy:
5.1-23.
St
ęż
enie molowe roztworu liczone jest ze wzoru:
:
gdzie: n –liczba moli substancji,
V – obj
ę
to
ść
roztworu w dm
3
lub: m – masa substancji
M – masa molowa substancji
Obj
ę
to
ść
roztworu 200cm
3
(0,2dm
3
), st
ęż
enie C
M
=0,5M. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe i przekształcaj
ą
c wzór wzgl
ę
dem n otrzymamy: n=C
M
.
V=0,5mol/
dm
3.
0,2dm
3
=
0,1mol
.
Liczb
ę
moli obliczamy ze wzoru n=m/M, czyli przekształcaj
ą
c go wzgl
ę
dem m i podstawiaj
ą
c za n=0,1mol, za M=56g/
mol
otrzymamy: m=0,1mol
.
56g/
mol
=
5,6g
.
W celu sporz
ą
dzenia 200cm
3
0,5M roztworu KOH nale
ż
y odwa
ż
y
ć
5,6g KOH (0,1mol).
5.1-24.
St
ęż
enie molowe liczone jest ze wzoru C
M
=n/V. 117g chlorku sodu, NaCl to n=m/M=117g/58,4g/
mol
=
2,0mol
. Po rozpuszczeniu 117g NaCl w 0,5dm
3
wody otrzymano 117g
+500g=
617g
roztworu. Obj
ę
to
ść
tego roztworu (d=m/V) V=m/d=617g/1,2g/cm
3
=514cm
3
=
0,514dm
3
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy: C
M
=n/
V=2mol/0,514dm
3
=
3,89mol/dm
3
.
5.1-25.
St
ęż
enie molowe okre
ś
la ilo
ść
substancji rozpuszczonej w 1dm
3
roztworu, czyli je
ż
eli st
ęż
enie roztworu wynosi 2mol/dm
3
, oznacza to,
ż
e w 1dm
3
znajduj
ą
si
ę
2 mole substancji, co
mo
ż
na zapisa
ć
:
w 1dm
3
znajduj
ą
si
ę
2 mole Na
2
SO
4
, to
w 0,3dm
3
znajduje si
ę
x moli Na
2
SO
4
, czyli x=0,3dm
3.
2mol/1dm
3
=
0,6mol
. 0,6 mola Na
2
SO
4
to (n=m/M) m=nM=0,3mol
.
142g/
mol
=
42,6g
.
II Sposób
St
ęż
enie molowe liczone jest ze wzoru C
M
=n/V=m
s
/(MV) (obj
ę
to
ść
w dm
3
). Przekształcaj
ą
c wzór wzgl
ę
dem m
s
otrzymamy: m
s
=C
M
MV, a po podstawieniu danych: m
s
=2mol/
dm
3.
142g/
mol
.
0,3dm
3
=
42,6g
.
5.1-26.
St
ęż
enie procentowe (c%=100%
.
m
s
/m
rozt
) oznacza,
ż
e w
100g
roztworu znajduje si
ę
c% gramów substancji rozpuszczonej. Je
ż
eli roztwór amoniaku jest o st
ęż
eniu 30%, to w
100g roztworu znajduje si
ę
30g
amoniaku NH
3
. Ta masa roztworu (d=m/V) zajmuje obj
ę
to
ść
V=m/d=100g/0,89g/cm
3
=112,3cm
3
=
0,1123dm
3
. St
ęż
enie molowe liczone jest ze
wzoru C
M
=n
s
/V
rozt
=m
s
/(M
s
V
rozt
). Podstawiaj
ą
c dane do wzoru (M
NH3
=17g/
mol
) otrzymamy: C
M
=30g/(17g/
mol
.
0,1123dm
3
)=
15,7mol/dm
3
.
Roztwór amoniaku o st
ęż
eniu 30% jest 15,7 molowy.
5.1-27.
St
ęż
enie molowe okre
ś
la ilo
ść
moli substancji rozpuszczonej w 1dm
3
roztworu i liczone jest ze wzoru C
M
=n
s
/V lub C
M
=m
s
/(V
.
M
s
) gdzie V – obj
ę
to
ść
roztworu wyra
ż
ona w dm
3
, m
s
– masa substancji, M
s
– masa molowa substancji, n
s
– liczba moli substancji. Dla jodku potasu KI masa molowa M
s
=
166g
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe
otrzymamy: C
M
=83g/(2dm
3.
166g/
mol
)=
0,25mol/dm
3
.
5.1-28.
St
ęż
enie molowe liczone jest ze wzoru C
M
=n/V (n- ilo
ść
moli substancji rozpuszczonej, V – obj
ę
to
ść
roztworu w dm
3
). Po rozpuszczeniu 234g siarczku sodu w
6dm
3
=6000cm
3
=6000g wody otrzymano m
rozt
=6000g+234g=
6234g
roztworu. Obj
ę
to
ść
tego roztworu (d=m/V) V=m/d=6234g/1,04g/cm
3
=5994,2cm
3
=
5,9942dm
3
. 234g siarczku
sodu (Na
2
S) to (n=m/M) n=234g/78g/
mol
=
3mole
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy: C
M
=3mol/5,9942dm
3
=
0,500mol/dm
3
.
5.1-29.
St
ęż
enie molowe liczone jest ze wzoru C
M
=n/V (n- ilo
ść
moli substancji rozpuszczonej, V – obj
ę
to
ść
roztworu w dm
3
). Po rozpuszczeniu 50g chlorku wapnia w 150cm
3
=150g
wody otrzymamy m
rozt
=50g+150g=200g roztworu, którego obj
ę
to
ść
(d=m/V) V=m/d=200g/1,23g/cm
3
=162,6cm
3
=
0,1626dm
3
. 50g CaCl
2
to (n=m/M) n=50g/110,98g/
mol
=
0,4505mol
. Podstawiaj
ą
c dane do wzoru na st
ęż
enie molowe otrzymamy: C
M
=0,4505mol/0,1626dm
3
=
2,771mol/dm
3
.
5.1-30
St
ęż
enie molowe liczone jest ze wzoru C
M
=n
s
/V lub C
M
=m
s
/(M
s
V). Przekształcaj
ą
c wzór wzgl
ę
dem V otrzymamy: V
rozt
=m
s
/(C
M
M
s
) (dla NaNO
3
M
s
=85g/
mol
). Podstawiaj
ą
c dane
do wzoru na obj
ę
to
ść
roztworu otrzymamy: V
rozt
=15g/(85g/
mol
.
0,08mol/dm
3
)=2,206dm
3
=
2206cm
3
.
5.1-31.
Zakładamy,
ż
e zawarto
ść
azotanu(V) potasu w szynce po konserwacji nie przekracza dopuszczalnej normy: 250 mg/kg szynki. Po konserwacji 7 kg szynki, w szynce znajdzie si
ę
7
kg
.
250 mg/kg=1750 mg=
1,75 g
azotanu(V) potasu.
St
ęż
enie molowe liczone jest ze wzoru C
M
=m/(MV). W 3 dm
3
solanki znajduje si
ę
m=C
M
MV=0,2
mol
/dm
3.
3dm
3.
101,1g/
mol
=
60,66 g
azotanu(V) potasu. Po konserwacji szynki w
roztworze pozostanie m
s
=60,66g-1,75 g=
58,91 g
azotanu(V) potasu. Obj
ę
to
ść
roztworu nie uległa zmianie, wi
ę
c st
ęż
enie azotanu potasu po zakonserwowaniu szynki wynosi:

Strona 5
Odpowiedzi 5.1.
2011-05-02 12:43:10
http://www.chemia.sos.pl/index.php/nieorganiczna/39-stezenia/89-odp-51.html?tmpl=component&print=1&page=
roztworze pozostanie m
s
=60,66g-1,75 g=
58,91 g
azotanu(V) potasu. Obj
ę
to
ść
roztworu nie uległa zmianie, wi
ę
c st
ęż
enie azotanu potasu po zakonserwowaniu szynki wynosi:
C
M
=m/(MV)=58,91 g/(101,1 g/
mol
.
3 dm
3
)=
0,194
mol
/dm
3
.
5.1-32.
St
ęż
enie molowe liczone jest ze wzoru
(gdzie m
s
i n
s
to masa (ilo
ść
moli) substancji rozpuszczonej, M
s
masa molowa substancji rozpuszczonej, V
rozt
obj
ę
to
ść
roztworu). Wg normy dopuszczalne st
ęż
enie arsenu wynosi 0,010mg/dm
3
, czyli masa substancji wynosi 0,010 mg, a obj
ę
to
ść
roztworu wynosi 1dm
3
. Podstawiaj
ą
c dane
do wzoru na st
ęż
enie molowe otrzymamy (M
s
=74,92 g/
mol
):
« poprzednia
nast
ę
pna »
Poprawiony: poniedziałek, 19 lipca 2010 22:19
Wyszukiwarka
Podobne podstrony:
stezenie molowe roztworow wodnych 2
Stezenie molowe-rozwiazania, Dla licealistów
9 roztwory-stężenie molowe
Stezenie molowe-rozwiazania, Licencjat, Semestr IV, biologia molekularna
Stężenie % molowe oraz ph zadania, dokumenty, chemia, Zadania
Stężenie molowe, Farmacja(0)
Stężenie molowe roztworów wodnych
stezenie molowe roztworow wodnych
chemia stezenie molowe i procentowe
6.Stężenia molowe, Chemia ogólna ćwiczenia
5 1 Stężenie molowe
Odpowiedzi 5 2 Stężenia procentowe
stezenie molowe roztworow wodnych 2
Stezenie molowe-rozwiazania, Dla licealistów
Stężenie molowe
zadania na stężenie molowe(1)
więcej podobnych podstron