
1
1. WYZACZAIE CIEPŁA WŁAŚCIWEGO c
p
i c
v
DLA POWIETRZA
1.1 Wprowadzenie
Zgodnie z definicją ciepła właściwe c
v
i c
p
dane są wzorami:
)
-
(
1
2
2
1
T
T
m
Q
c
v
v
−
=
(1)
)
-
(
1
2
2
1
T
T
m
Q
c
p
p
−
=
(2)
gdzie : Q
v1-2
, Q
p1-2
– ciepło doprowadzone do układu przy stałej, odpowiednio objętości,
ciśnieniu,
m – masa czynnika termodynamicznego,
T
1
, T
2
– temperatury bezwzględne w stanie 1 i 2.
Wyznaczenie c
v
i c
p
wymaga więc zmierzenia wszystkich wielkości występujących we
wzorach. Metody korzystające z definicji to metody kalorymetryczne. Dają one dokładne
wyniki dla cieczy i ciał stałych.
Dla gazów, tak w zakresie niskich jak i wysokich ciśnień, prowadzą do dużych błędów.
Dlatego do pomiaru c
v
i c
p
gazu o niskim ciśnieniu używa się metody dynamicznej,
wykorzystującej proces ekspansji adiabatycznej.
Równanie adiabaty powietrza o własnościach zbliżonych do gazu doskonałego ma postać:
const
p
k
=
υ
(3)
gdzie wykładnik adiabaty k:
v
p
c
c
k =
(3.1)
Ponadto c
v
i c
p
powiązane są zależnością:
c
p
– c
v
= R
(4)
gdzie R – indywidualna stała gazowa.
Z indywidualną stałą gazową jest związane pojęcie uniwersalnej stałej gazowej, przedsta-
wianej jako iloczyn (MR) = 8, 314 kJ / kmol K, gdzie M – masa molowa badanego gazu.
Ze skojarzenia wzorów (3.1) i (4) wynika:
1
-
k
R
c
v
=
(5.1)
1
-
k
k
R
c
p
=
(5.2)
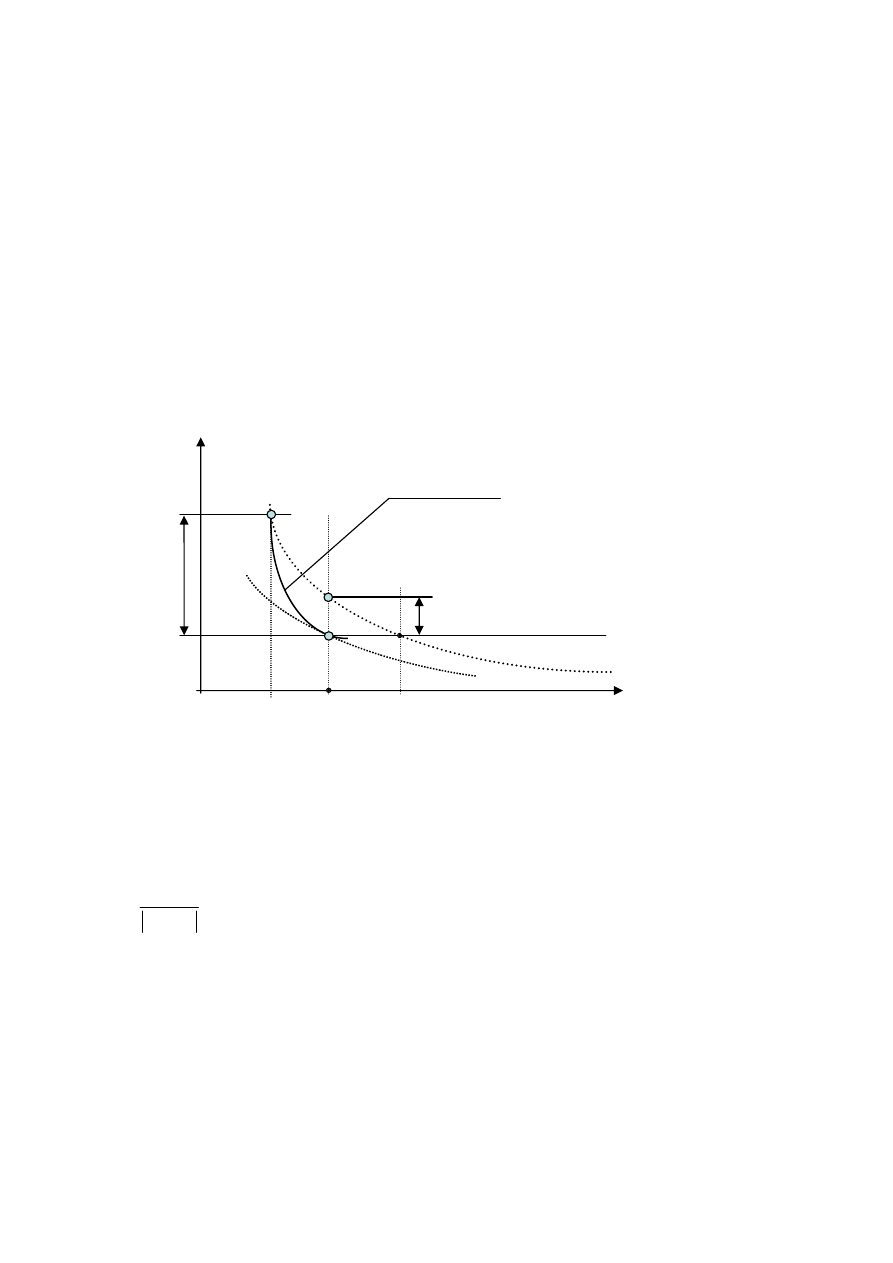
2
1.2 Opis doświadczenia
Zbiornik o stałej objętości napełnia się powietrzem do ciśnienia p
1
> p
o
(p
o
–
ciśnienie otoczenia; p
1
=p
o
+∆p
1
). Temperatura początkowa powietrza t
1
= t
ot
= t
0
. Otwierając
"na moment" zawór łączy się zbiornik z otoczeniem. Następuje szybki wypływ powietrza do
otoczenia. Ciśnienie w zbiorniku spada do wartości p
2
= p
o
, a temperatura osiąga wartość
t
2
< t
0
. Po zamknięciu zaworu należy odczekać, aż temperatura powietrza t
3
zrówna się
z temperaturą otoczenia t
0
, tzn. t
3
= t
0
(a ∆p
3
ustabilizuje się). Wówczas odczytuje się
ciśnienie p
3
> p
o
(p
3
=p
o
+∆p
3
).
Podczas wypływu gazu ze zbiornika z oczywistych względów nieuniknione są dopływy
ciepła, ale można wykazać, że w rozpatrywanym przedziale zmian temperatury i ciśnienia ich
wielkość jest taka, że wskaźnik Y jest mały:
1
2
2
-
1
- U
U
Q
Y
z
=
(6)
gdzie:
• Q
z
l-2
- całkowita ilość ciepła (dodatnia lub ujemna) dostarczona do gazu w czasie ∆τ,
• U
2
– U
1
- całkowita zmiana energii wewnętrznej gazu przy przejściu od stanu 1 do
stanu 2.
p
1
2
3
υ = V/m
p
o
p
1
p
2
= p
o
T
o
T
2
<T
o
p
3
>p
o
; T
3
=T
o
∆p
1
T
1
=T
0
υ
= const
υ
o
υ
1
p
υ
w
= const
∆p
3

3
Rzeczywista adiabata występuje w przypadku Y = 0. W przeciwnym, wypadku w zależności od
konkretnej wartości tego wskaźnika, mówi się o adiabacie zrealizowanej z dokładnością do
1% , 0,1% itd.
Przyjmując wstępnie Q
z
≠ 0, sugeruje się, że realizowana jest przemiana politropowa
o wykładniku w ≠ k . Znając wartość wykładnika „w” możnaby oszacować wielkość Q
z
.
Opisane doświadczenie daję tę możliwość, albowiem „w” można wyliczyć ze wzoru, w
którym po prawej stronie znaku równości występują tylko wielkości mierzone. Poszukiwaną
wartość wykładnika „w” oblicza się ze wzoru:
)
/
ln(
)
/
ln(
3
1
0
1
i
i
i
i
p
p
p
p
w =
(7)
Doświadczenie należy wykonać dla kilku wartości ciśnienia początkowego:
i
i
p
p
p
1
0
1
∆
+
=
gdzie:
• i – numer pomiaru; przyjmuje wartości od 1 do 5,
• ∆p - nadwyżka ciśnienia z przedziału (0 – 1000 mmH
2
O), np. 800, 650, 500, 350, 200.
1.3 Opracowanie wyników
1.3.1 Dla każdego pomiaru „i” obliczyć wartość „w
i
” a następnie wartość średnią
arytmetyczną:
i
w
w
i
i
sr
∑
=
(8)
1.3.2 Obliczyć c
v
i c
p
z zależności:
1
-
sr
vm
w
R
c
=
(9.1)
1
-
sr
sr
pm
w
w
R
c
=
(9.2)
Te wartości należy porównać z wartościami obliczonymi z wzorów (5.1) i (5.2) dla k=1,4
i wyznaczyć błąd względny pomiaru.

4
Wzór tabel:
Ćw. 1. Wyznaczanie ciepła właściwego c
p
i c
v
dla powietrza
data: ....................................godz.: ................................
Układ pomiarowy 1
lp
wielkość \ i
1
2
3
4
5
1
p
o,
Pa /p
o
, mm H
2
O
2
∆p
1i
, mm H
2
O
800
650
500
350
200
3
p
1i
4
∆p
3i
, mm H
2
O
5
p
3i
6
w
i
7
w
sr
8
c
vm
9
c
pm
10
c
v
11
c
p
12
c
vm
/c
v
13
c
pm
/c
p
Układ pomiarowy 2
lp
wielkość \ i
1
2
3
4
5
1
p
o,
Pa /p
o
, mm H
2
O
2
∆p
1i
, mm H
2
O
800
650
500
350
200
3
p
1i
4
∆p
3i
, mm H
2
O
5
p
3i
6
w
i
7
w
sr
8
c
vm
9
c
pm
10
c
v
11
c
p
12
c
vm
/c
v
13
c
pm
/c
p
Wyszukiwarka
Podobne podstrony:
Matlab cw1 2 zaoczni
ćw1 Maszyna turinga
MZ TZrokII cw1(1)
ćw1
cw1 modelowanie id 122786 Nieznany
cw1
Ćw1 Punkty pomiarowe
Ćw1 Budowa i geometria ostrzy skrawających jakieś opracowanko
Tabelka do lab-cw1, Studia Budownictwo PB, 5 semestr, laborki metal
cw1
ĆW1 doc biochemia
cw1 (2)
GRI cw1 id 195763 Nieznany
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
cw1
ćw1&2 3M3
cw1 2
cw1 rysunek
więcej podobnych podstron