
Miejsce na identyfikację szkoły
Za rozwiązanie
wszystkich zadań
można otrzymać
łącznie 50 punktów.
LISTOPAD
2013
PESEL ZDAJĄCEGO
Wpisuje zdający przed rozpoczęciem pracy
KOD
ZDAJĄCEGO
Arkusz opracowany przez Wydawnictwo Pedagogiczne OPERON.
Kopiowanie w całości lub we fragmentach bez zgody wydawcy zabronione. Wydawca zezwala na kopiowanie zadań przez dyrektorów
szkół biorących udział w programie Próbna Matura z OPERONEM.
ARKUSZ PRÓBNEJ MATURY
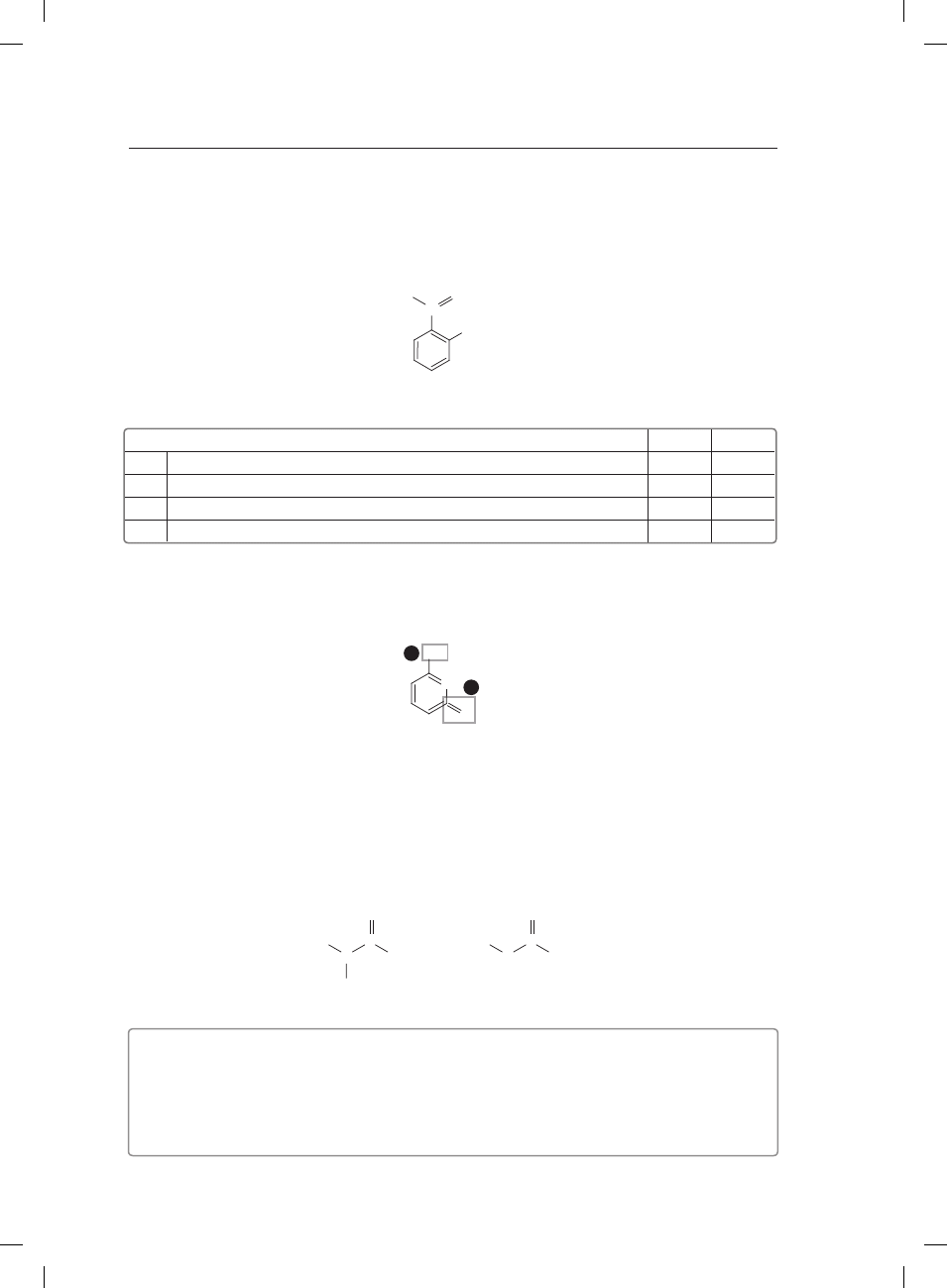
Z OPERONEM
CHEMIA
POZIOM PODSTAWOWY
Czas pracy: 120 minut
Instrukcja dla zdającego
1. Sprawdź,czyarkuszegzaminacyjnyzawiera12stron(zadania1.–29.).
Ewentualnybrakzgłośprzewodniczącemuzespołunadzorującegoeg-
zamin.
2. Rozwiązaniazadańiodpowiedzizapiszwmiejscunatoprzeznaczonym.
3. W rozwiązaniach zadań rachunkowych przedstaw tok rozumowania
prowadzącydoostatecznegowyniku.
4. Piszczytelnie.Używajdługopisu/pióratylkozczarnymtuszem/atra-
mentem.
5. Nieużywajkorektora,abłędnezapisywyraźnieprzekreśl.
6. Pamiętaj,żezapisywbrudnopisieniebędąoceniane.
7. Podczas egzaminu możesz korzystać z karty wybranych tablic
chemicznych,linijkiorazkalkulatora.
Życzymy powodzenia!
N5202_P2_pytania-glowny.indd 1
2013-10-21 15:30:37

Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
2
Zadanie 1. (1 pkt)
Konfiguracjaelektronowapewnegopierwiastkamanastępującąpostać:
1s
2
2s
2
2p
6
3s
2
3p
4
Podaj, ile elektronów walencyjnych ma ten pierwiastek.
Zadanie 2. (2 pkt)
Uzupełnij tabelę, wpisując w puste miejsca odpowiednio liczby protonów, elektronów oraz neu-
tronów.
Jon
Liczba protonów
Liczba elektronów
Liczba neutronów
16
32
S
2-
12
24
Mg
2+
Zadanie 3. (1 pkt)
Z podanego zbioru związków wybierz te, w których występują wiązania kowalencyjne spola-
ryzowane.
H
2
O,NaCl,NH
3
,HCl,H
2
,N
2
Zadanie 4. (2 pkt)
Uczeńprzeprowadziłtrzydoświadczeniachemiczne,którychopisyprzedstawiłponiżej.
I.Dowodnegoroztworuwodorotlenkusodudodałemkilkakroplifenoloftaleiny.
II.Dowodnegoroztworuchlorkusodudodałemkilkakroplioranżumetylowego.
III.Doroztworukwasuchlorowodorowegododałemkilkakroplibłękitubromotymolowego.
Zapisz obserwacje z przeprowadzonych doświadczeń.
DoświadczenieI:
DoświadczenieII:
DoświadczenieIII:
N5202_P2_pytania-glowny.indd 2
2013-10-21 15:30:37

Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
3
Zadanie 5. (2 pkt)
Połącz w pary tlenki metali lub niemetali wraz z ich właściwościami fizykochemicznymi i za-
stosowaniami.
1.tlenekwęgla(IV)
a)biała,higroskopijnasubstancjastała,nierozpuszczalnawwodzie,służy
dootrzymywaniasztucznychszafirów,używanajesttakżejakośrodek
suszący,mawłaściwościamfoteryczne
2.tlenekwapnia
b)wtemperaturzepokojowejjesttobezbarwny,bezwonnygaz,trudno
rozpuszczalnywwodzie
3.tlenekazotu(IV)
c)otrzymujesięgonaskalęprzemysłowąprzezprażeniekamieniawapien-
nego,mazastosowanienp.wbudownictwie(jakozaprawamurarska)
4.tlenekglinu
d)wtemperaturzepokojowejbrunatny,silnietoksycznygazoostrym
zapachu,wreakcjizwodątlenektentworzyrównomolowąmieszaninę
tlenowychkwasównieorganicznych
5.tlenekmanganu(IV) e)wtemperaturzepokojowejjestciałemstałymbarwybrunatnoczarnej;
wykazujewłaściwościamfoteryczne
1 2. 3 4 5
Zadanie 6. (2 pkt)
Zmieszano50cm
3
kwasusiarkowego(VI)ostężeniumolowymrównym2mol/dm
3
z4gwodo-
rotlenkusodu.
Oblicz masę otrzymanego w tej reakcji siarczanu(VI) sodu.
Obliczenia:
Odpowiedź:
N5202_P2_pytania-glowny.indd 3
2013-10-21 15:30:37
Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
4
Zadanie 7. (2 pkt)
Uzupełnij tabelę, wpisując obliczone ilości poszczególnych związków chemicznych, wyrażone
odpowiednio w g, dm
3
(warunki normalne) oraz liczbie cząsteczek.
Związek chemiczny
CO
2
N
2
Objętość
5,6dm
3
Masa
0,28g
Liczba cząsteczek
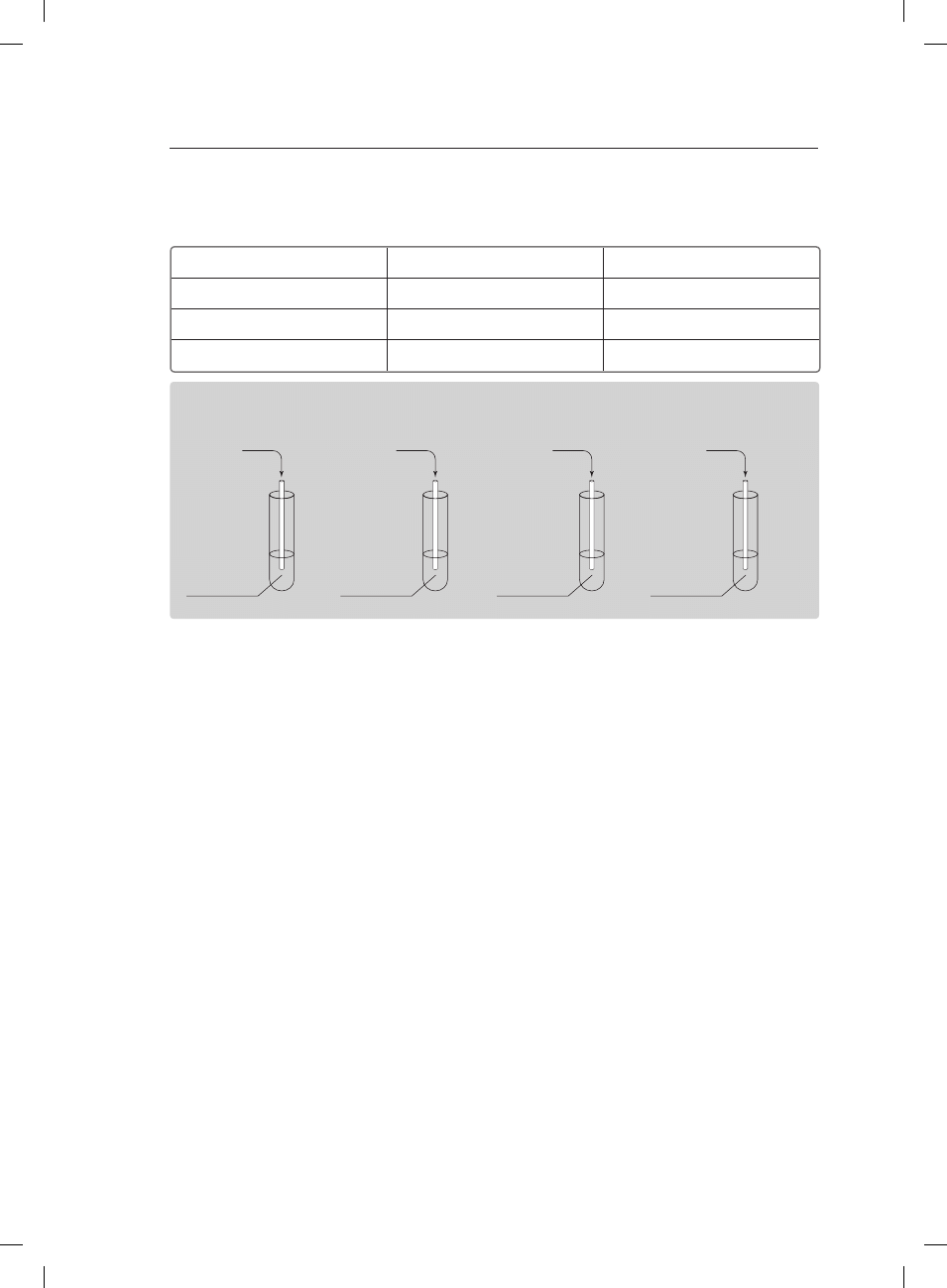
Informacja do zadań 8. i 9.
Przeprowadzono doświadczenie według poniższego rysunku.
I
II
III
IV
Cu
H
2
O
Cu
HCl
(aq)
HCl
(aq)
Li
H
2
O
Li
Zadanie 8. (2 pkt)
Podaj przewidywane obserwacje dla probówek I–IV.
ProbówkaI:
ProbówkaII:
ProbówkaIII:
ProbówkaIV:
Zadanie 9. (2 pkt)
Korzystając z szeregu aktywności metali, sformułuj wnioski wynikające z przeprowadzonego
doświadczenia.
N5202_P2_pytania-glowny.indd 4
2013-10-21 15:30:37

Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
5
Zadanie 10. (2 pkt)
Patyna to produkt korozji atmosferycznej miedzi i jej stopów w wilgotnym powietrzu. Po-
wierzchniowa warstwa patyny tworzy powłokę koloru od jasnozielonego do szarozielonego.
Jejgłównymskładnikiem(przypowstawaniuwniezanieczyszczonejatmosferze)jestwęglan
hydroksomiedzi(II)–[Cu(OH)]
2
CO
3
.Przyjmij,żeM
Cu
=64g/mol.
Oblicz zawartość procentową (w procentach masowych) miedzi w głównym składniku patyny.
Wynik podaj z dokładnością do dwóch miejsc po przecinku.
Obliczenia:
Odpowiedź:
Zadanie 11. (1 pkt)
Zaznacz punkt, w którym wymieniono wyłącznie elektrolity mocne.
A.kwassolny,chloreksrebra,wodorotlenekmiedzi(II),kwassiarkowy(VI)
B.kwassiarkowy(IV),wodorotleneksodu,wodorotlenekglinu,kwasortofosforowy(V)
C.kwassolny,wodorotlenekpotasu,chloreksodu,kwasazotowy(V)
D.kwassiarkowy(VI),kwassiarkowy(IV),wodorotleneksodu,chloreksodu
Zadanie 12. (2 pkt)
Wykres przedstawia zależność masy izotopu promieniotwórczego pewnego pierwiastka
wpróbcewfunkcjiczasu.
0 1 2 3 4 5
6
7
8
0,2
0,4
0,6
0,8
1,0
1,2
masa izotopu [g]
t [h]
Na podstawie schematu uzupełnij zdania.
Czaspołowicznegorozpadutegoizotopuwynosi
Po3godzinachmasapróbkitegoizotopuwyniesieokoło
N5202_P2_pytania-glowny.indd 5
2013-10-21 15:30:38

Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
6
Zadanie 13. (1 pkt)
Zaprojektuj doświadczenie pozwalające na określenie charakteru chemicznego tlenku wap-
nia. W tym celu narysuj schemat doświadczenia.
Zadanie 14. (2 pkt)
Zapisz w formie cząsteczkowej równania reakcji potwierdzające amfoteryczny charakter tlen-
ku glinu. Masz do dyspozycji kwas solny, wodorotlenek sodu i wodę.
ReakcjaI:
ReakcjaII:
Zadanie 15. (2 pkt)
Właściwościfizycznezwiązkówchemicznychwdużejmierzezależąodrodzajuwiązańwystę-
pującychwichcząsteczkach.
Wpisz w odpowiednie miejsca tabeli właściwości fizyczne będące konsekwencją występowania
wiązania jonowego i kowalencyjnego w cząsteczkach związków chemicznych.
A.dobrzerozpuszczająsięwwodzie
B.przewodząprądwpostacistopionej
C.rozpuszczoneprzewodząprąd
D.mogącharakteryzowaćsięzarównoniskimi,jakiwysokimitemperaturamitopnienia
E.mająwysokietemperaturytopnienia
F.sąnaogółsłaborozpuszczalnewrozpuszczalnikachpolarnych
Typ związków
Właściwości fizyczne
związkijonowe
związkikowalencyjne
N5202_P2_pytania-glowny.indd 6
2013-10-21 15:30:38
Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
7
Zadanie 16. (1 pkt)
Korzystając z szeregu aktywności metali, wybierz spośród podanych metale, które reagują ze
stężonym roztworem kwasu solnego.
sód,miedź,srebro,lit,złoto,magnez,rtęć,wapń
Zadanie 17. (2 pkt)
Napisz równania reakcji cynku i tlenku potasu z roztworem kwasu bromowodorowego.
Informacja do zadań 18. i 19.
Chlor w laboratorium otrzymuje się w wyniku reakcji kwasu solnego z manganianem(VII)
potasu (KMnO
4
). Produktami tej reakcji, oprócz chloru, są: woda, chlorek manganu(II) oraz
chlorek potasu.
Zadanie 18. (2 pkt)
Zapisz w sposób cząsteczkowy równanie reakcji otrzymywania chloru z manganianu(VII) po-
tasu i kwasu solnego. Dobierz współczynniki stechiometryczne metodą bilansu jonowo-elek-
tronowego.
Równaniereakcji:
N5202_P2_pytania-glowny.indd 7
2013-10-21 15:30:38
Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
8
Zadanie 19. (1 pkt)
Wskaż utleniacz i reduktor w równaniu reakcji otrzymywania chloru z manganianu(VII) potasu.
Utleniacz:
Reduktor:
Zadanie 20. (2 pkt)
Podane tlenki wpisz do tabeli zgodnie z ich charakterem chemicznym.
CaO,SO
2
,NO,SO
3
,Na
2
O,MgO,NO
2
,N
2
O
5
,CO,CO
2
Charakter kwasowy
Charakter zasadowy
Charakter obojętny
Zadanie 21. (2 pkt)
Oceń, jak się zmieni szybkość reakcji: Fe + 2 HCl $ FeCl
2
+ H
2
, gdy:
a) użyjemy do niej mocno rozcieńczonego kwasu chlorowodorowego zamiast roztworu stężo-
nego;
b) podwyższymy temperaturę.
Zadanie 22. (2 pkt)
Oblicz, ile gramów siarczanu(VI) sodu należy odważyć i ile cm
3
wody należy odmierzyć, by
uzyskać 220 g nasyconego wodnego roztworu tej substancji w T = 25 °C, jeśli rozpuszczalność
tej soli w podanej temperaturze wynosi 28g/100g H
2
O.
W obliczeniach przyjmij, że gęstość wody wynosi 1 g/cm
3
. Wynik podaj z dokładnością do
trzechmiejscpoprzecinku.
Obliczenia:
Odpowiedź:
N5202_P2_pytania-glowny.indd 8
2013-10-21 15:30:38
Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
9
Zadanie 23. (2 pkt)
Tabelazawierawartościtemperaturwrzenia(T
wrz
)itopnienia(T
top
)dlatrzechalkanówróżnią-
cychsięstopniemrozgałęzieniałańcuchawęglowego.
Nazwa alkanu
T
wrz
[°C]
T
top
[°C]
2-metylopentan
60
–154
2,3-dimetylobutan
58
–135
2,2-dimetylobutan
50
–98
Na podstawie podanych informacji sformułuj wnioski dotyczące zależności pomiędzy stop-
niem rozgałęzienia łańcucha węglowego a wartością temperatury topnienia i wrzenia dla
przedstawionych alkanów.
Zadanie 24. (2 pkt)
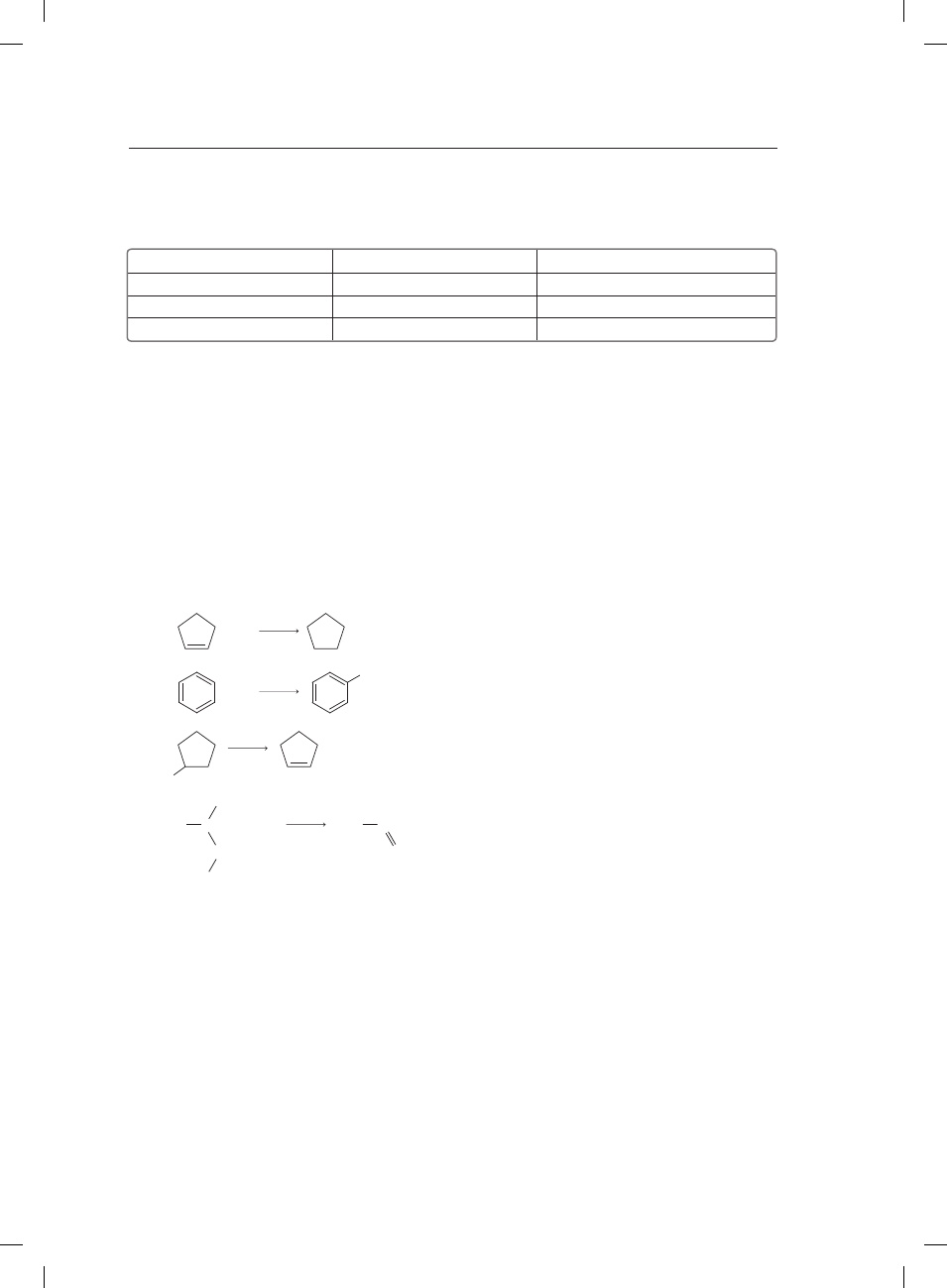
Określ, jakie typy reakcji (substytucji, addycji, eliminacji) stanowią podane równania reakcji.
+ H
2
I
II
III
IV
Ni
+ Zn
+ ZnCl
2
+ H
2
O
HO
+ Cl
2
+ HCl
H
3
C
CH
Cl
Cl
CH
2
H
3
C
CH
CH
2
FeCl
3
Cl
T
Al
2
O
3
ReakcjaI:
ReakcjaII:
ReakcjaIII:
ReakcjaIV:
N5202_P2_pytania-glowny.indd 9
2013-10-21 15:30:38

Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
10
Zadanie 25. (2 pkt)
Zaproponuj metody odróżniania związków organicznych zestawionych w poszczególnych pod-
punktach.
a)
b)
c)
d)
H
3
C
H
3
C
C
O
H
3
C
H
3
C
CH
3
CH
3
H
2
C
CH
2
CH
HC
CH
2
H
2
C
CH
3
CH
3
CH
3
CH
2
H
3
C
CH
3
HC
CH
C
O
H
CH
3
CH
C
H
OH
O
a)
b)
c)
d)
H
3
C
H
3
C
C
O
H
3
C
H
3
C
CH
3
CH
3
H
2
C
CH
2
CH
HC
CH
2
H
2
C
CH
3
CH
3
CH
3
CH
2
H
3
C
CH
3
HC
CH
C
O
H
CH
3
CH
C
H
OH
O
a)
b)
c)
d)
Zadanie 26. (2 pkt)
Gęstośćparpewnegoalkenuwwarunkachnormalnychwynosi2,5g/dm
3
Wykorzystując ogólny wzór odpowiedniego szeregu homologicznego, wykonaj obliczenia i ustal
wzór sumaryczny tego związku.
Obliczenia:
Odpowiedź:
N5202_P2_pytania-glowny.indd 10
2013-10-21 15:30:38
Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
11
Zadanie 27. (2 pkt)
Aldehyd salicylowy to bezbarwna, oleista ciecz o aromatycznym zapachu, rozpuszczalna
walkoholuetylowymieterzedietylowym.Występujewroślinnycholejkacheterycznych,sto-
sowanyjestwprzemyśleperfumeryjnymdosyntezykumarynyorazdoprodukcjiniektórych
barwników.Poniżejprzedstawionowzórchemicznyaldehydusalicylowego.
C
o
H
OH
Przeanalizuj strukturę aldehydu salicylowego. Na tej podstawie określ, którym reakcjom ule-
ga ten związek. Wpisz do tabeli P, jeśli zdanie jest prawdziwe, lub F, jeśli zdanie jest fałszywe.
Zdanie
P
F
1.
ZwiązektendajepozytywnywynikpróbyTrommera.
2.
ZwiązektendajepozytywnywynikpróbyTollensa.
3.
AldehydsalicylowynieulegareakcjizroztworemNaOH.
4.
Związektenulegareakcjinitrowania.
Zadanie 28. (1 pkt)
Poniżej przedstawiono strukturę cytozyny – organicznego związku chemicznego, który jest
jednązzasadpirymidynowych,występującychwDNAiRNAjakoelementnukleozydów.
NH
2
o
N
2
1
Podaj nazwy systematyczne grup oznaczonych we wzorze numerami 1 i 2.
Grupa1:
Grupa2:
Zadanie 29. (1 pkt)
Poniżejpodanowzorydwóchaminokwasów:alaninyiglicyny.
Narysuj wzór dowolnego dipeptydu zbudowanego z tych dwóch aminokwasów.
alanina
H
3
C
NH
2
C
O
CH
OH
glicyna
H
2
N
C
O
CH
2
OH
N5202_P2_pytania-glowny.indd 11
2013-10-21 15:30:38

Chemia. Poziom podstawowy
Próbna Matura z OPERONEM i „Gazetą Wyborczą”
12
BRUDNOPIS (nie podlega ocenie)
N5202_P2_pytania-glowny.indd 12
2013-10-21 15:30:38
Document Outline
- chemia_arkusz_PP
- Chemia_odpowiedzi_PP
Wyszukiwarka
Podobne podstrony:
Arkusz próbnej matury z operonem Chemia Listopad 2012 pp
Arkusz próbnej matury z operonem Chemia Listopad 2012 pr
Arkusz próbnej matury z operonem Chemia Listopad 2010 pr
ARKUSZ PRÓBNEJ MATURY OPERON 2010
ARKUSZ PROBNEJ MATURY Z OPERONE Nieznany
ARKUSZ PRÓBNEJ MATURY OPERON 2010
Listopad 2013 PP
Chemia PR operon listopad 2013
2013 pp listopad odp
2010 operon chemia pp
więcej podobnych podstron