
Absorpcyjna spektrometria
atomowa (AAS)
Analiza Instrumentalna
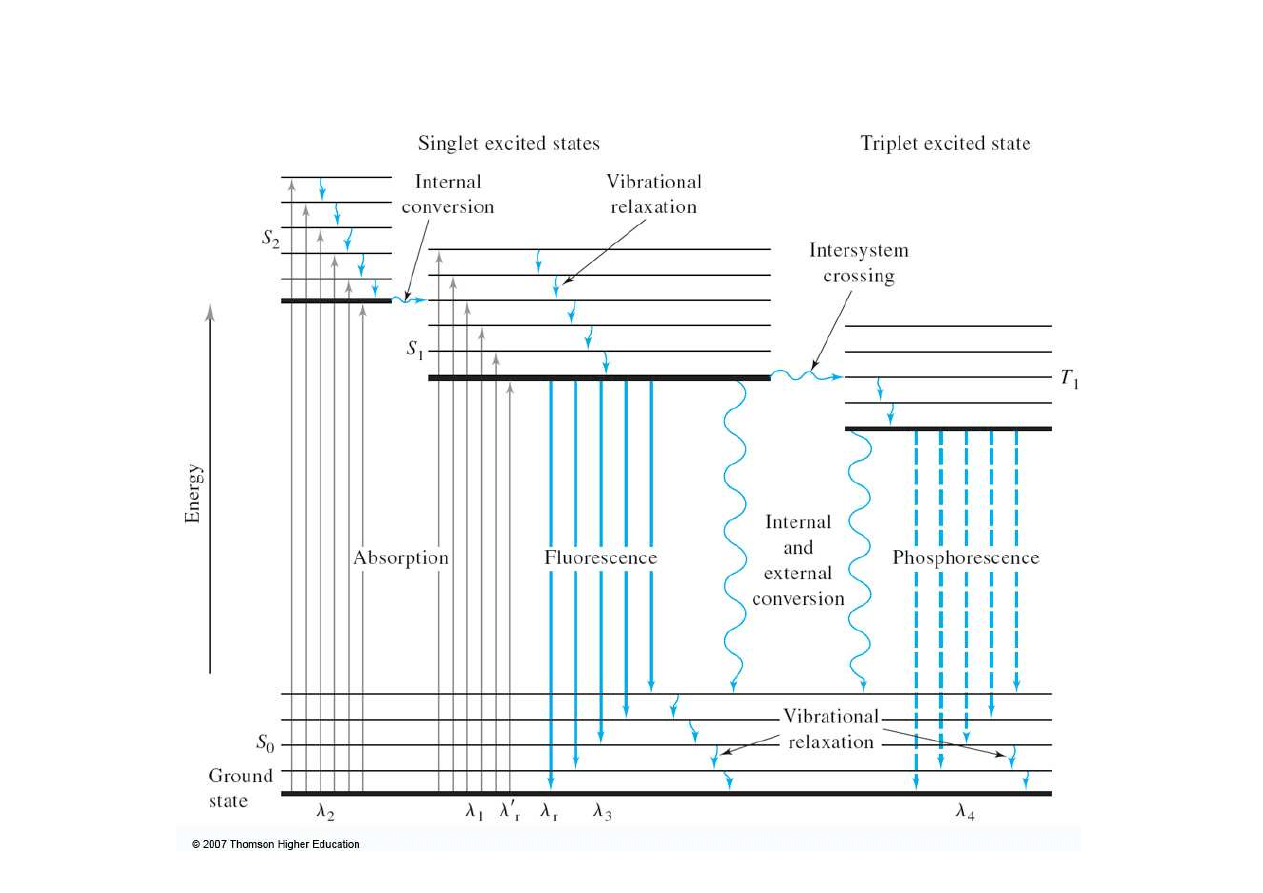
Diagram Jabłońskiego
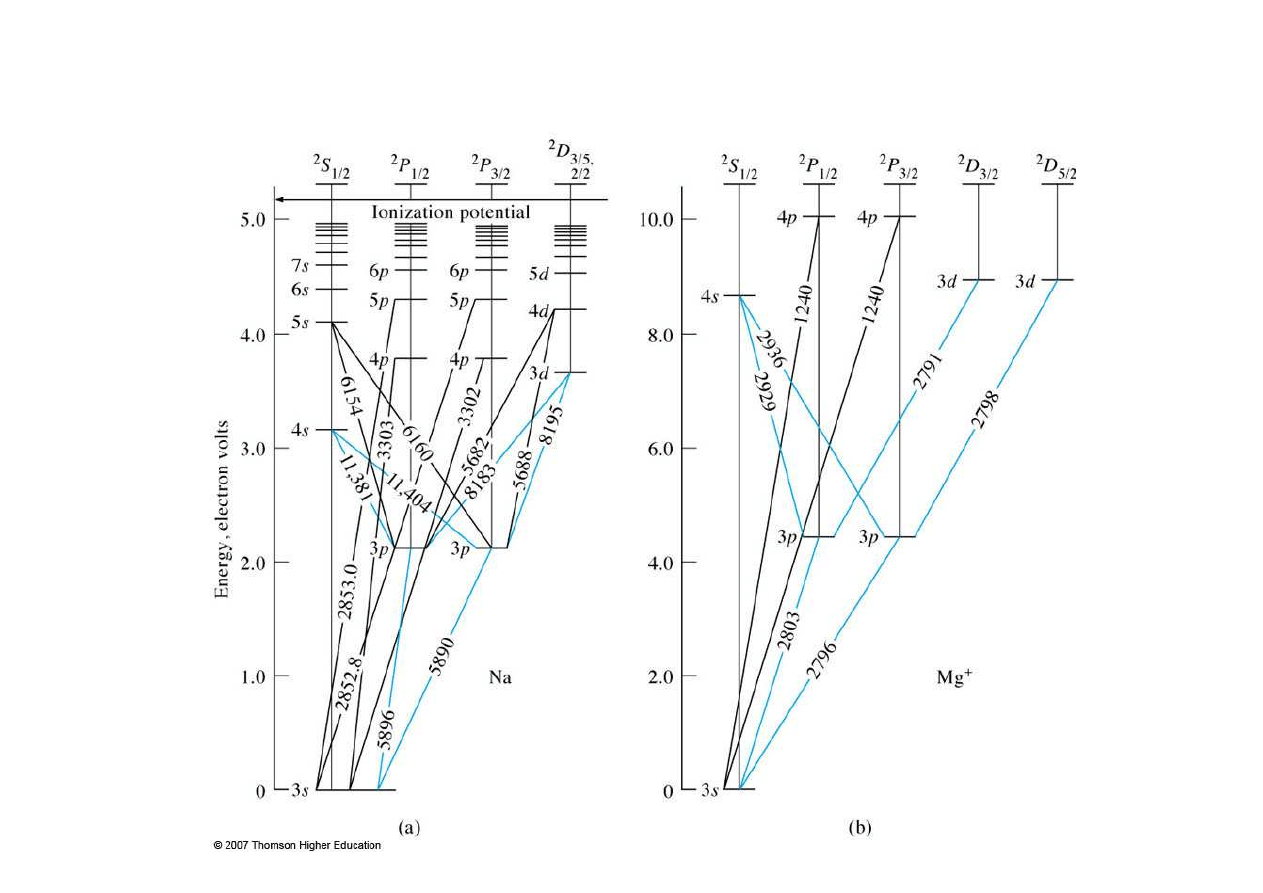
Poziomy energetyczne
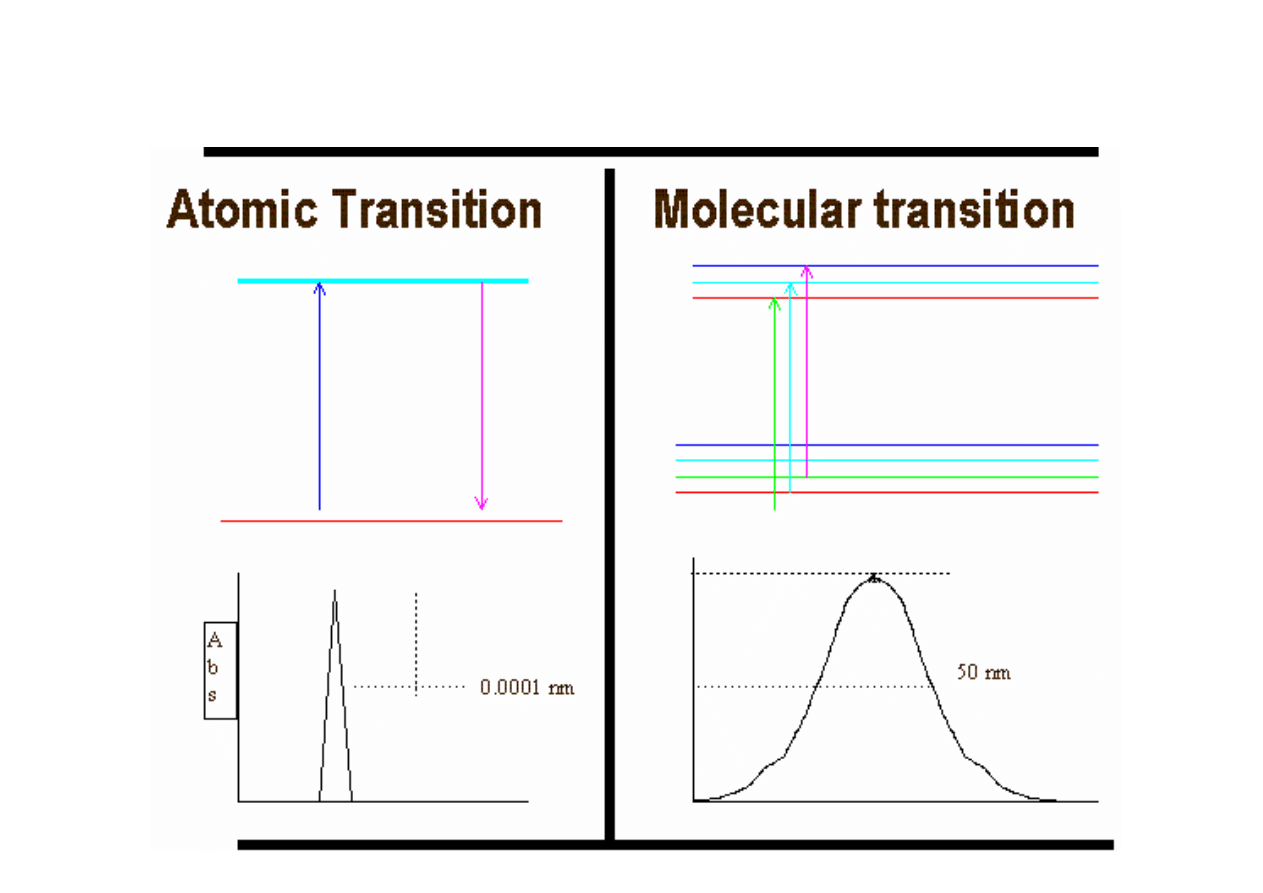
Porównanie widm atomowych i cząteczkowych

Poszerzenie linii atomowej
• naturalne
(zasada nieokre
ś
lono
ś
ci Heisenberga)
• efekt Dopplera
(ruch obiektu w wyniku temp.)
• efekt Lorentza
(ci
ś
nieniowy, zderzeniowy)
– efekt Starka (zderzenia z cz
ą
stkami naładowanymi
elektrycznie)
– efekt van der Waalsa (zderzenia z cz
ą
stkami
oboj
ę
tnymi elektrycznie)
– efekt Holtsmarka (zderzenia mi
ę
dzy jednakowymi
cz
ą
stkami)
• poszerzenie Starka
(pole elektryczne)
• poszerzenie Zeemana
(pole magnetyczne)

Wzór Boltzmanna
kT
E
g
g
a
e
g
g
N
N
−
∗
∗
=
gdzie: N
*
— liczba cząstek w stanie wzbudzonym
N
g
— liczba cząstek w stanie podstawowym
g
*
— waga statystyczna stanu wzbudzonego
g
g
— waga statystyczna stanu podstawowego
E
a
— energia wzbudzenia
k — stała Boltzmanna
T — temperatura

Stosunek N
*
/N
g
5,010
–10
7,510
–15
Zn
6,610
–7
4,810
–10
Cu
5,810
–4
1,010
–5
Na
3273 K
2273 K
Rodzaj atomu
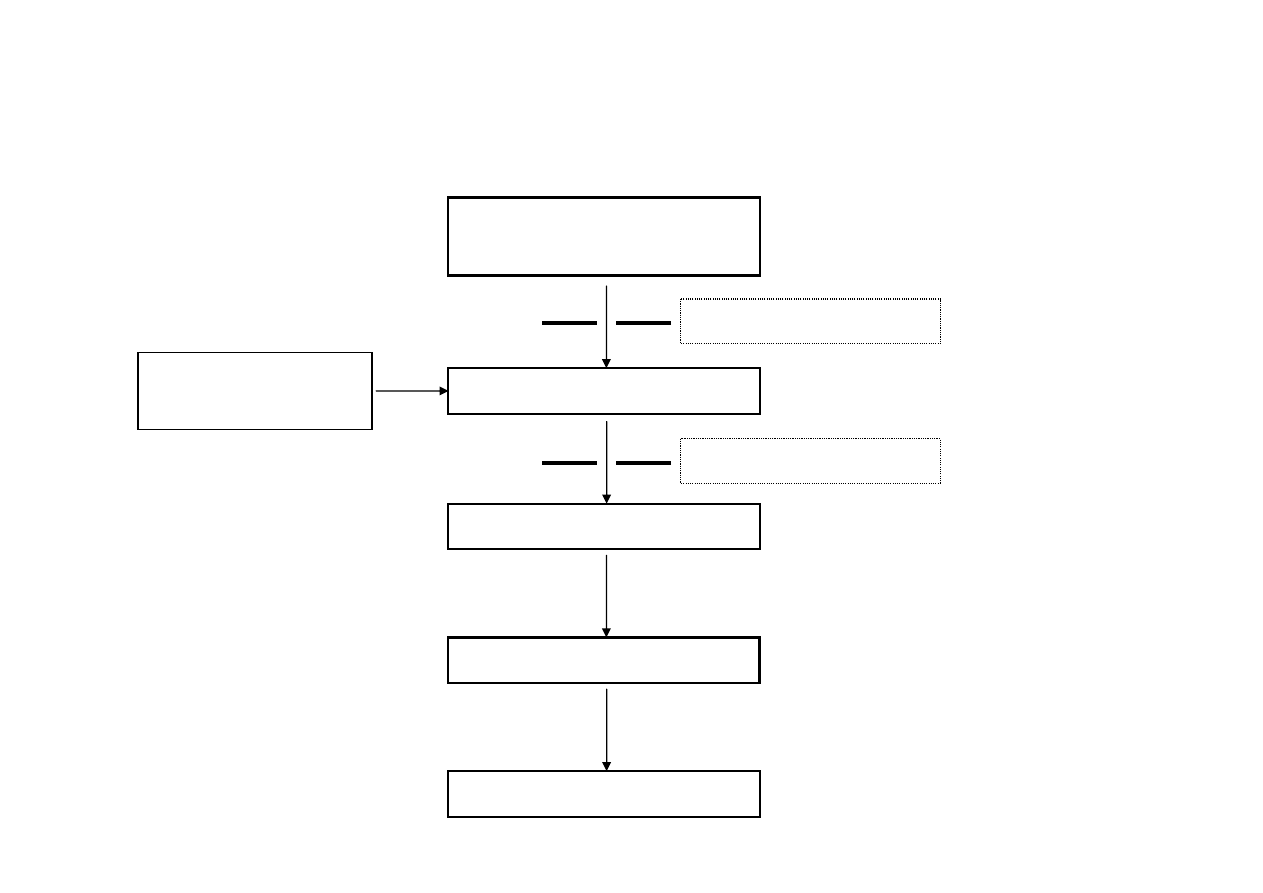
Schemat blokowy spektrofotometru AAS
Źródło
promieniowania
Atomizer
Szczelina wejściowa
Szczelina wyjściowa
Monochromator
Detektor
Wskaźnik
wprowadzanie
próbki
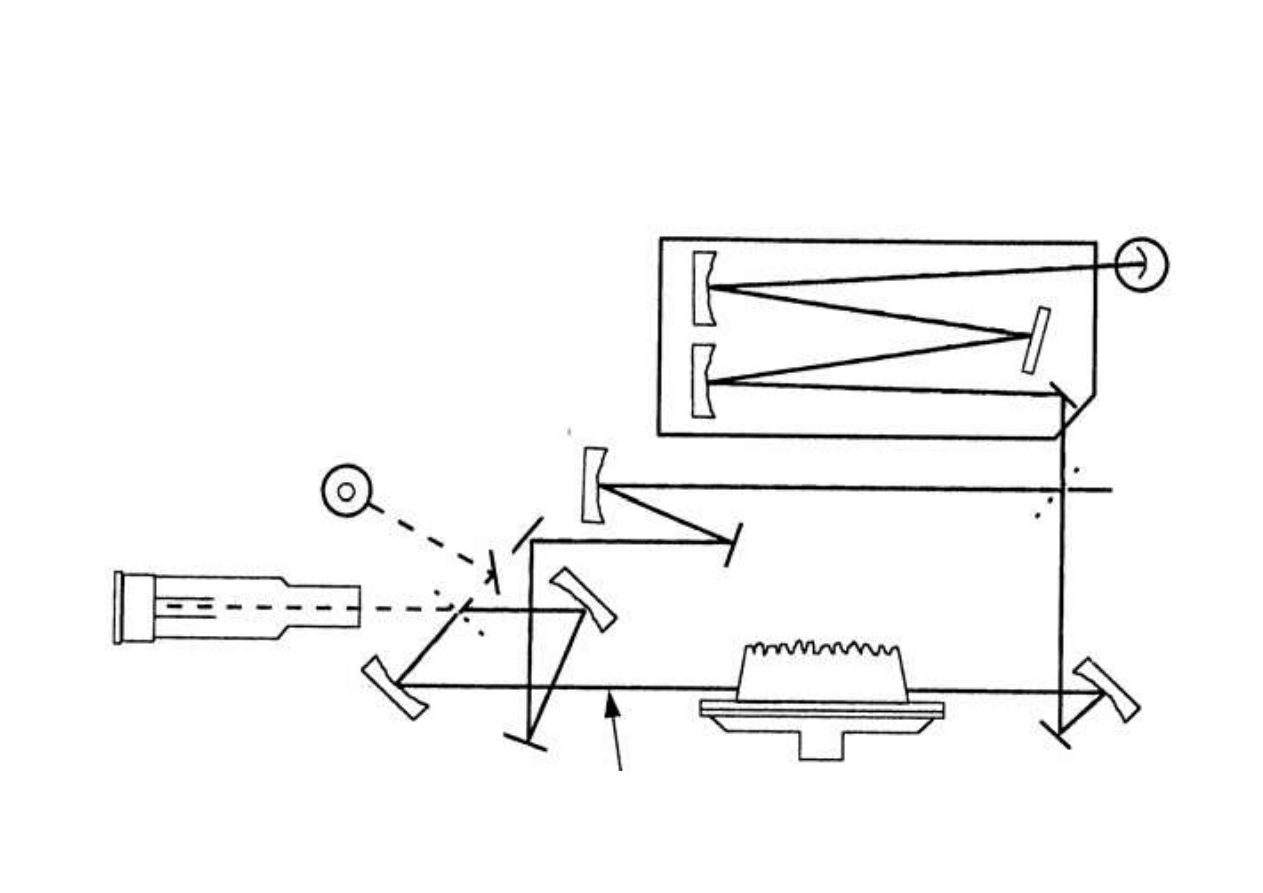
Schemat aparatu AAS
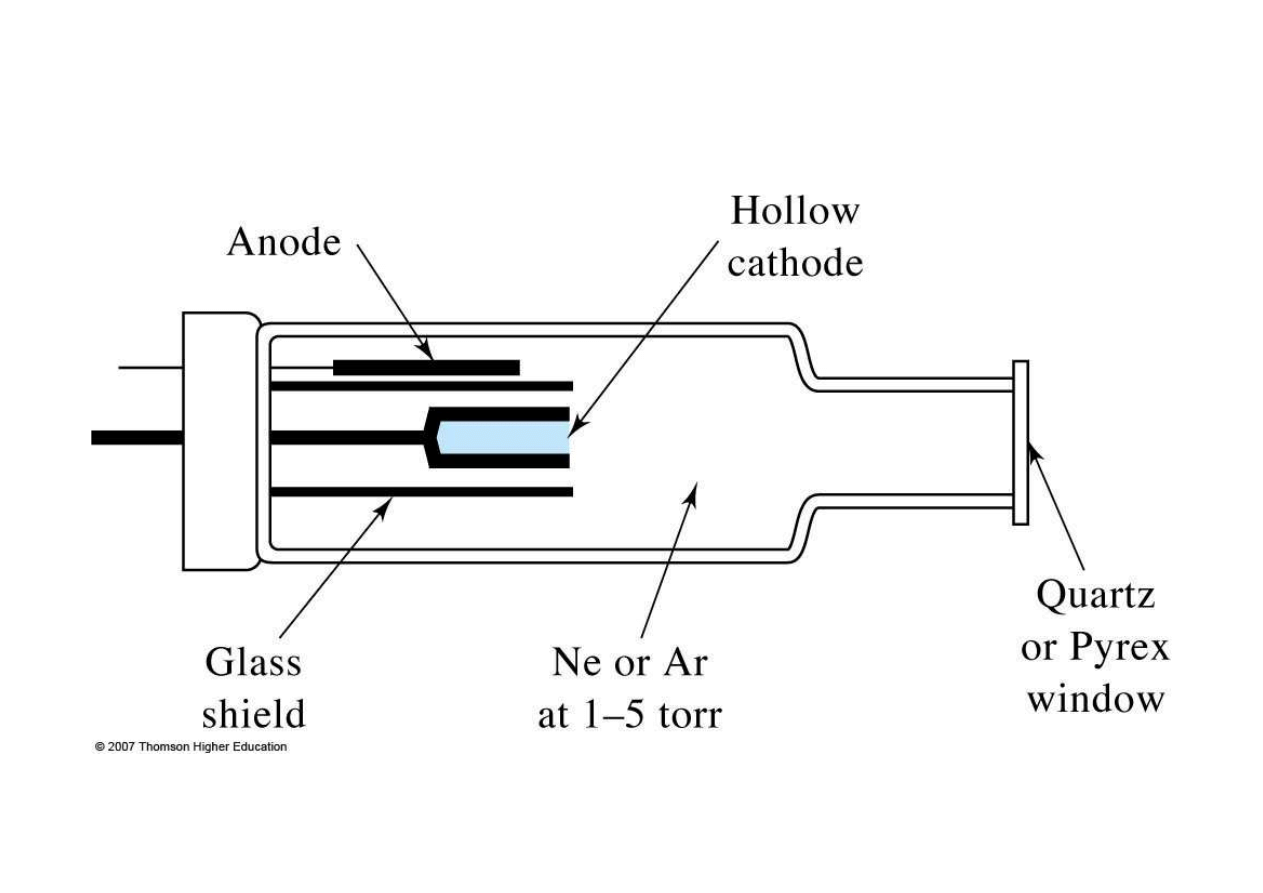
Schemat lampy HCL
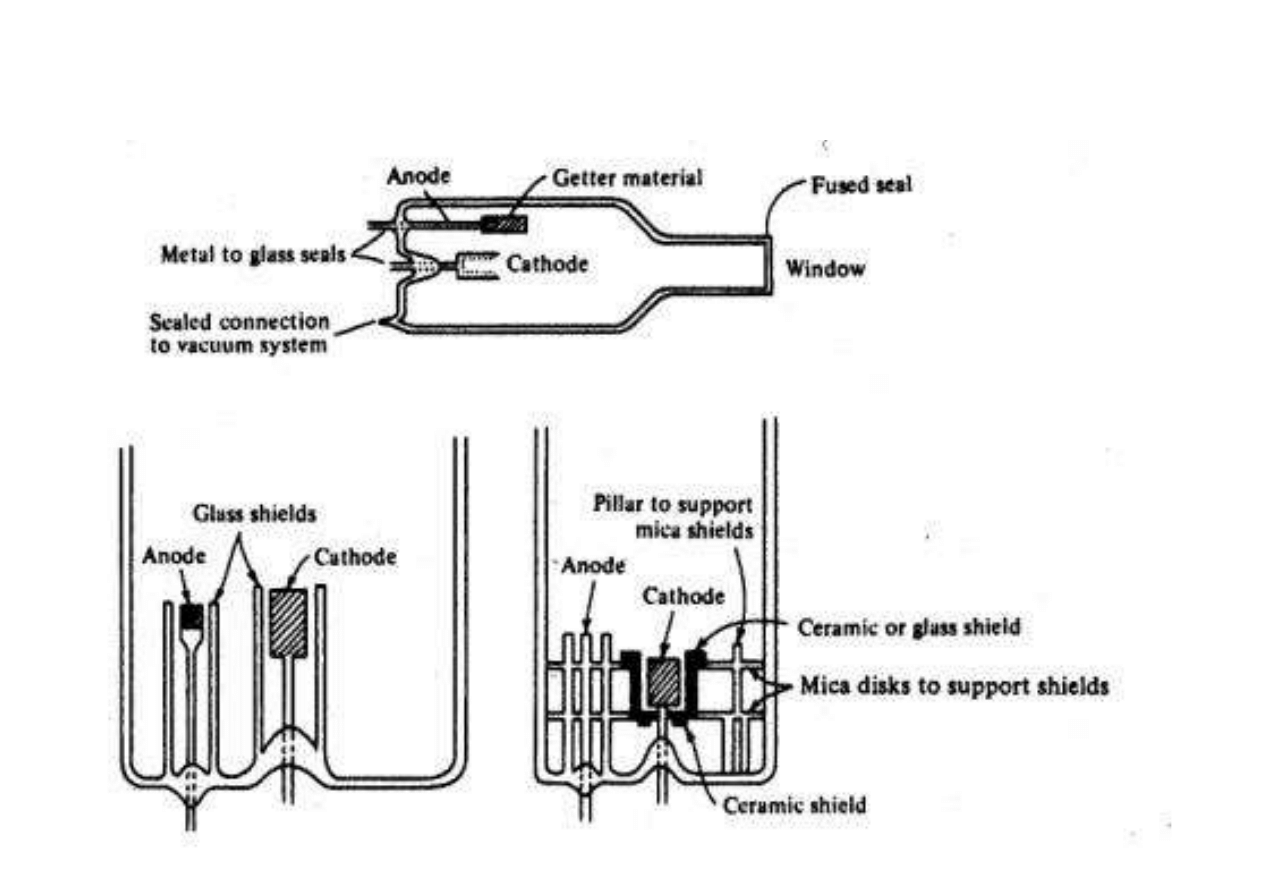
Schemat lampy HCL
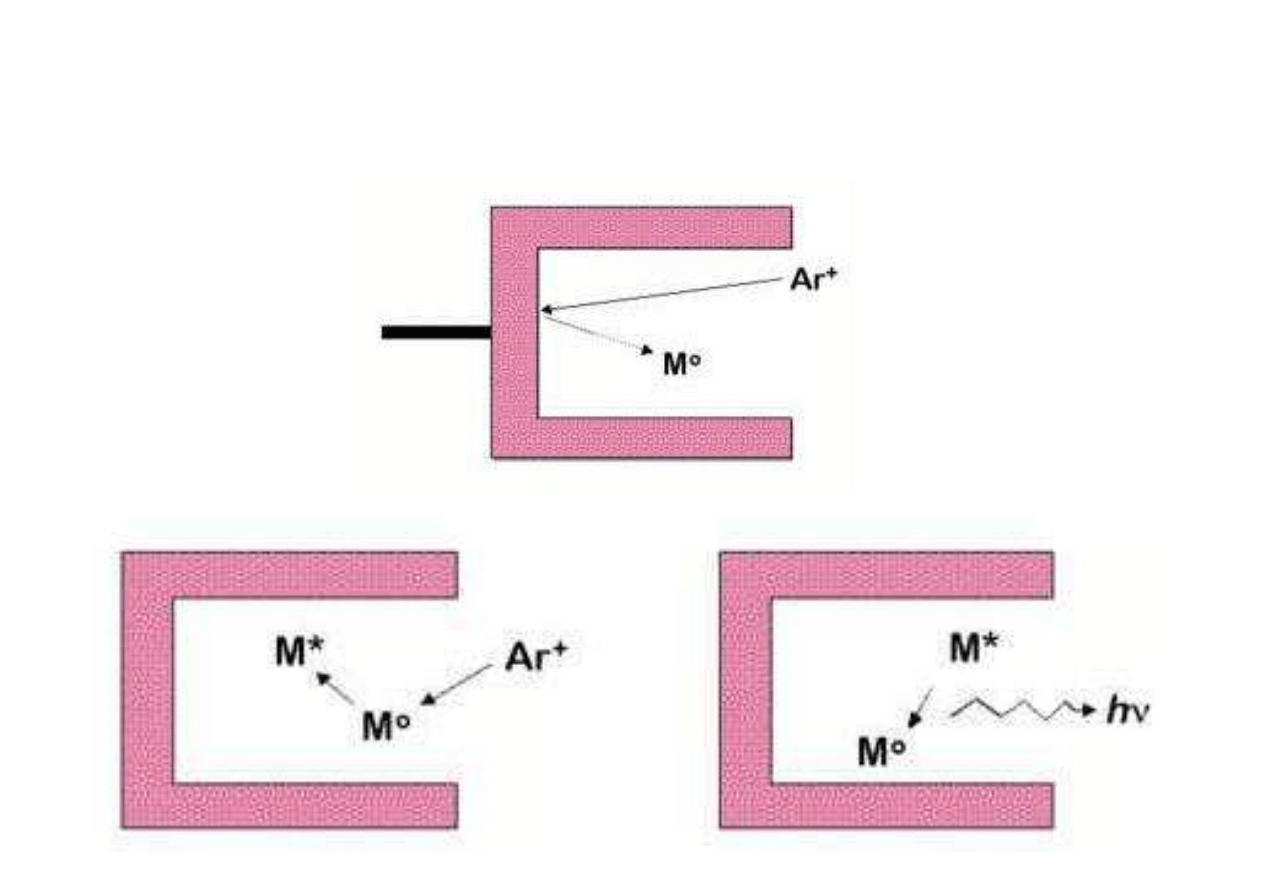
Schemat działania lampy HCL


Lampy HCL
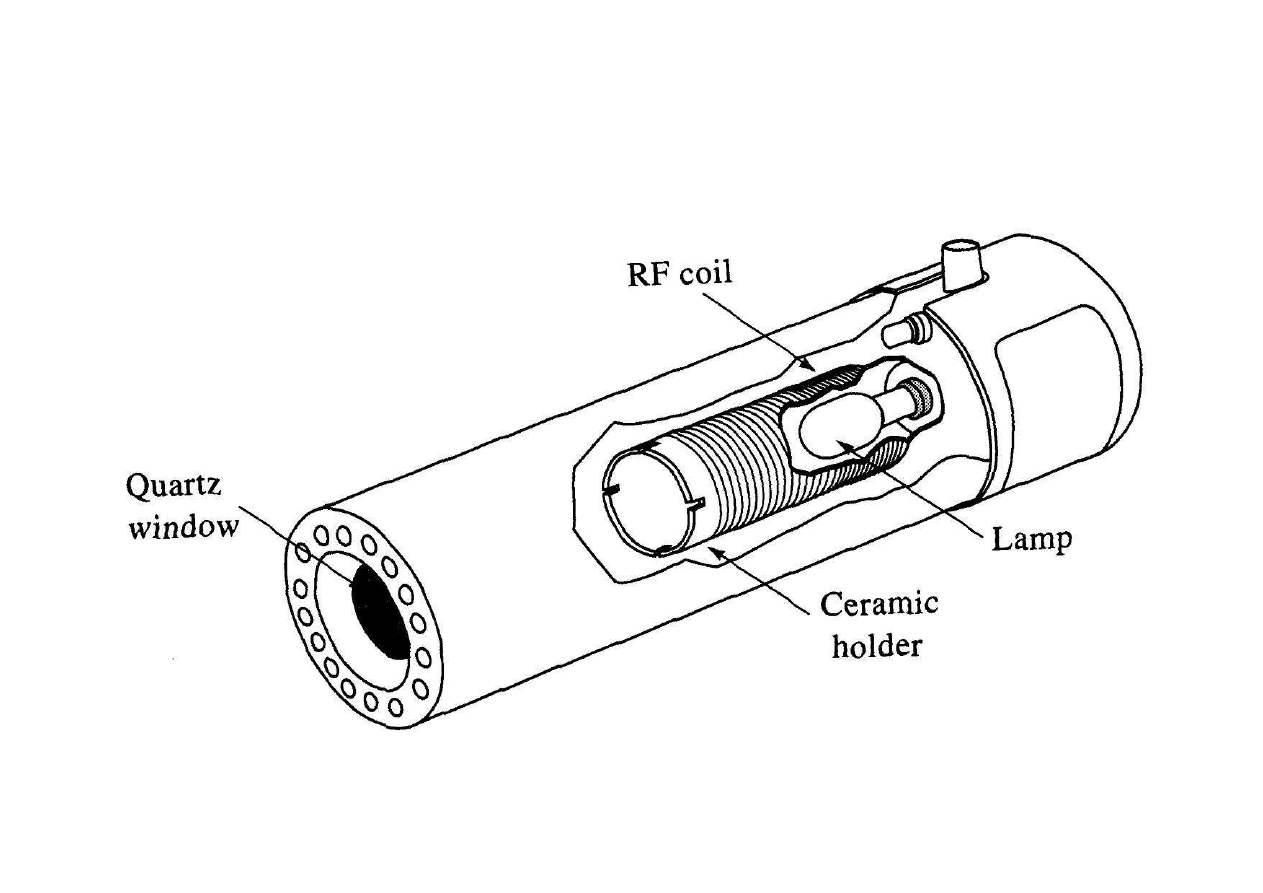
Schemat lampy EDL
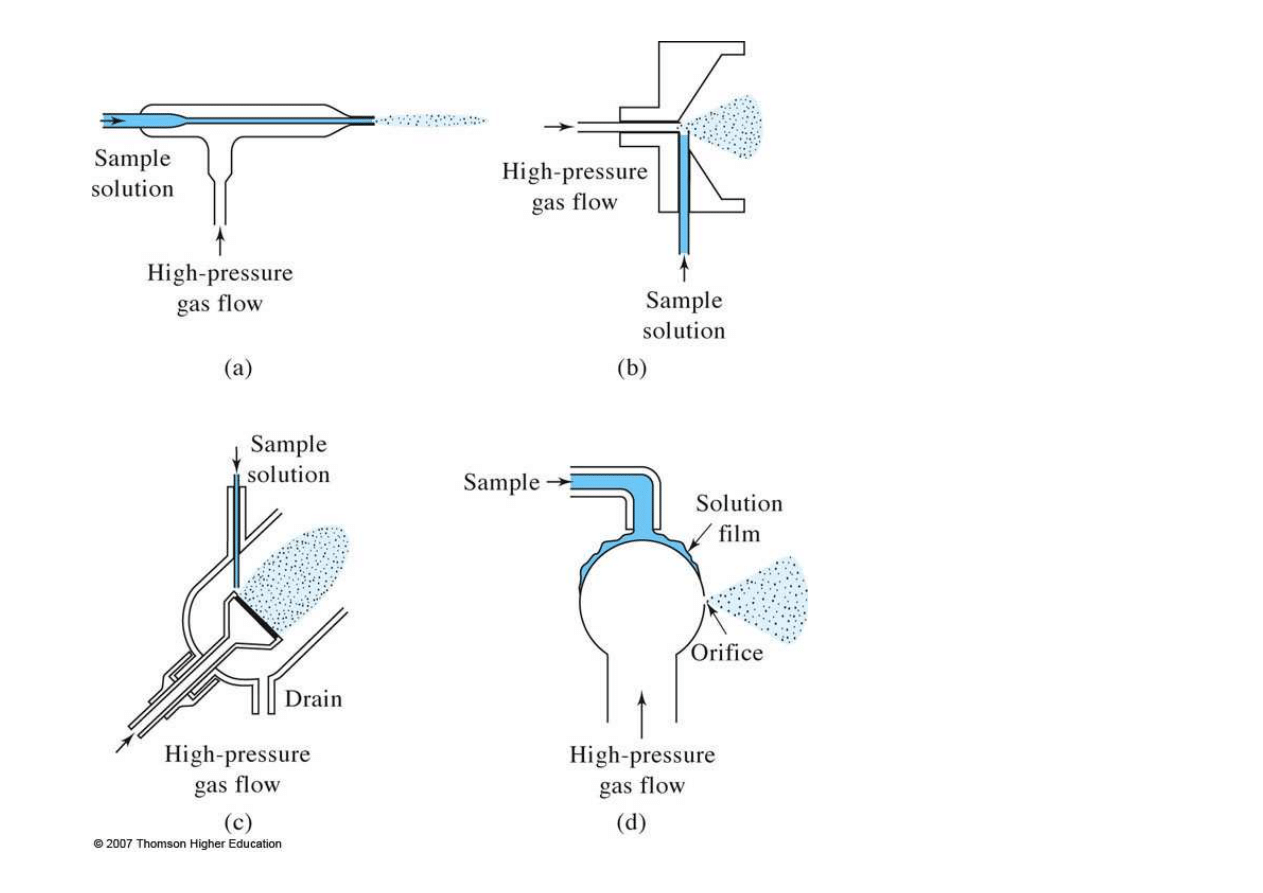
Nebulizery
a) koncentryczny
b) krzyżowy
c) ze szkłem
spiekanym
d) Babingtona
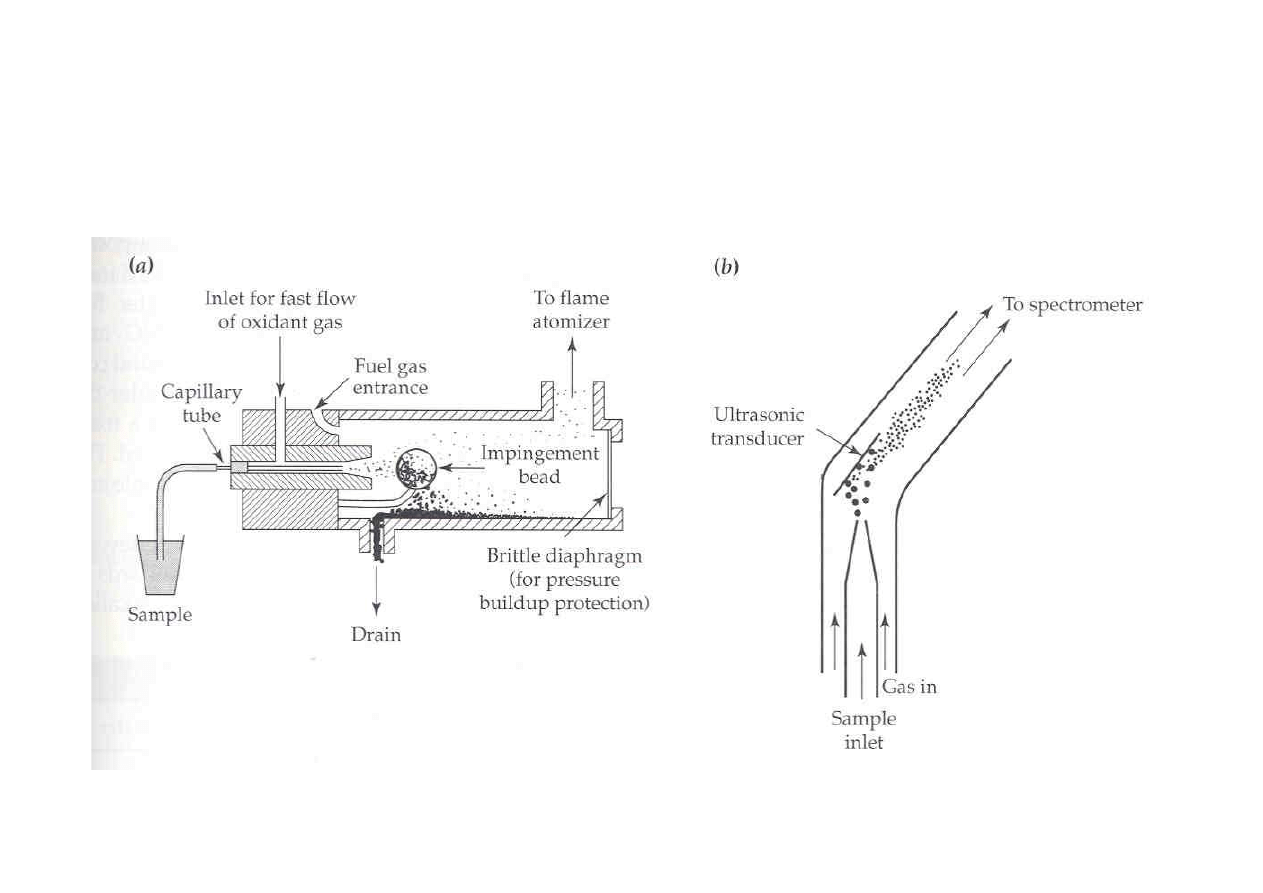
Nebulizery
a) ciśnieniowy b) ultradźwiękowy
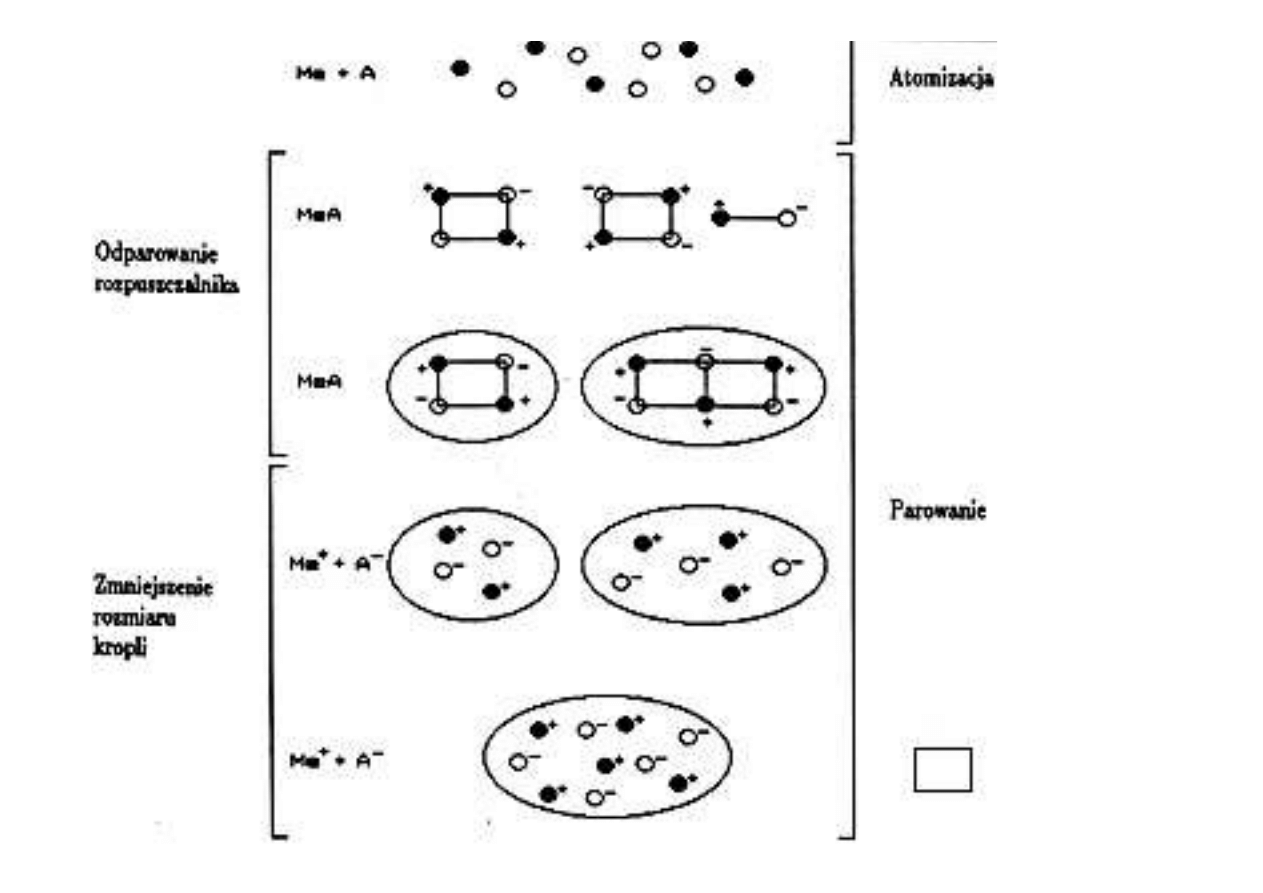
Schemat
atomizacji
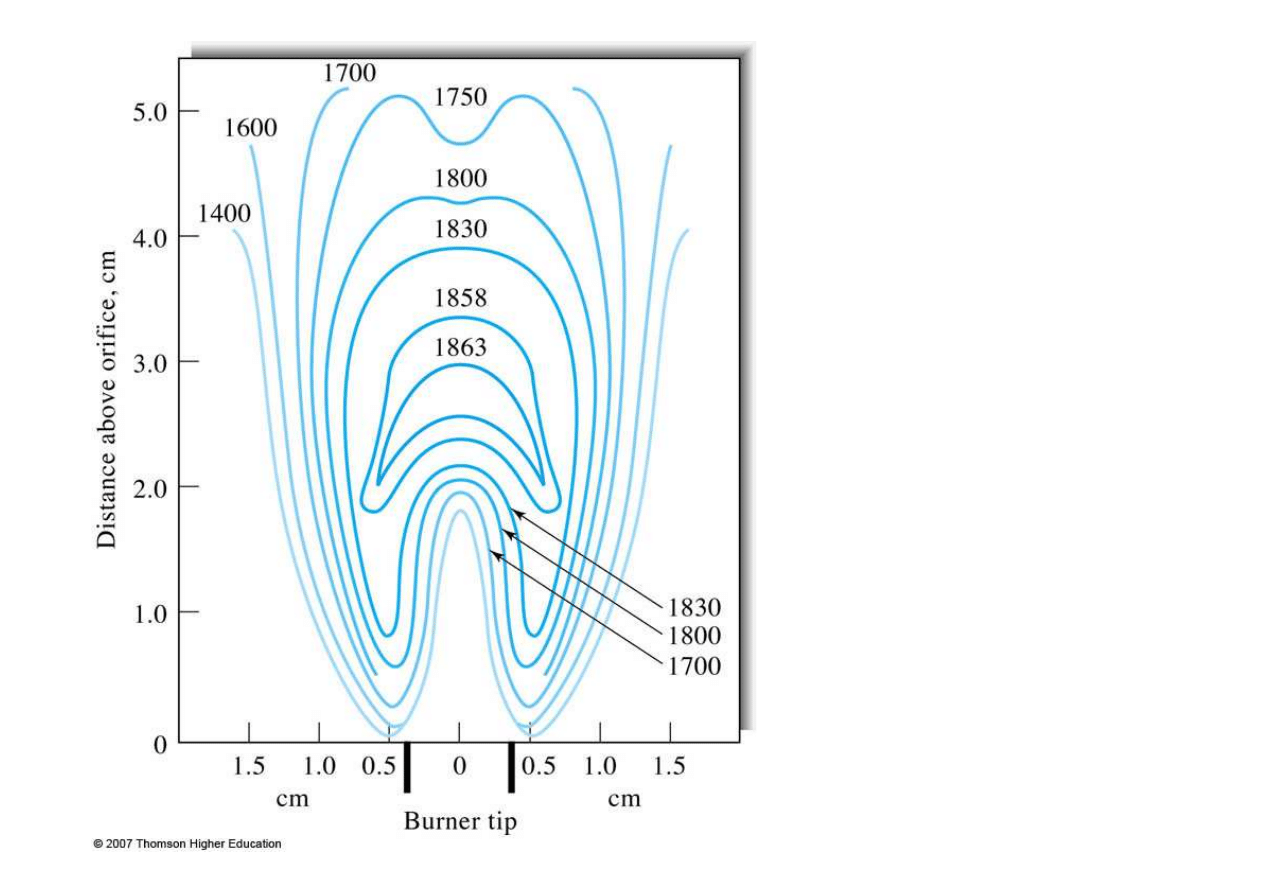
Rozkład
temperatur
w płomieniu
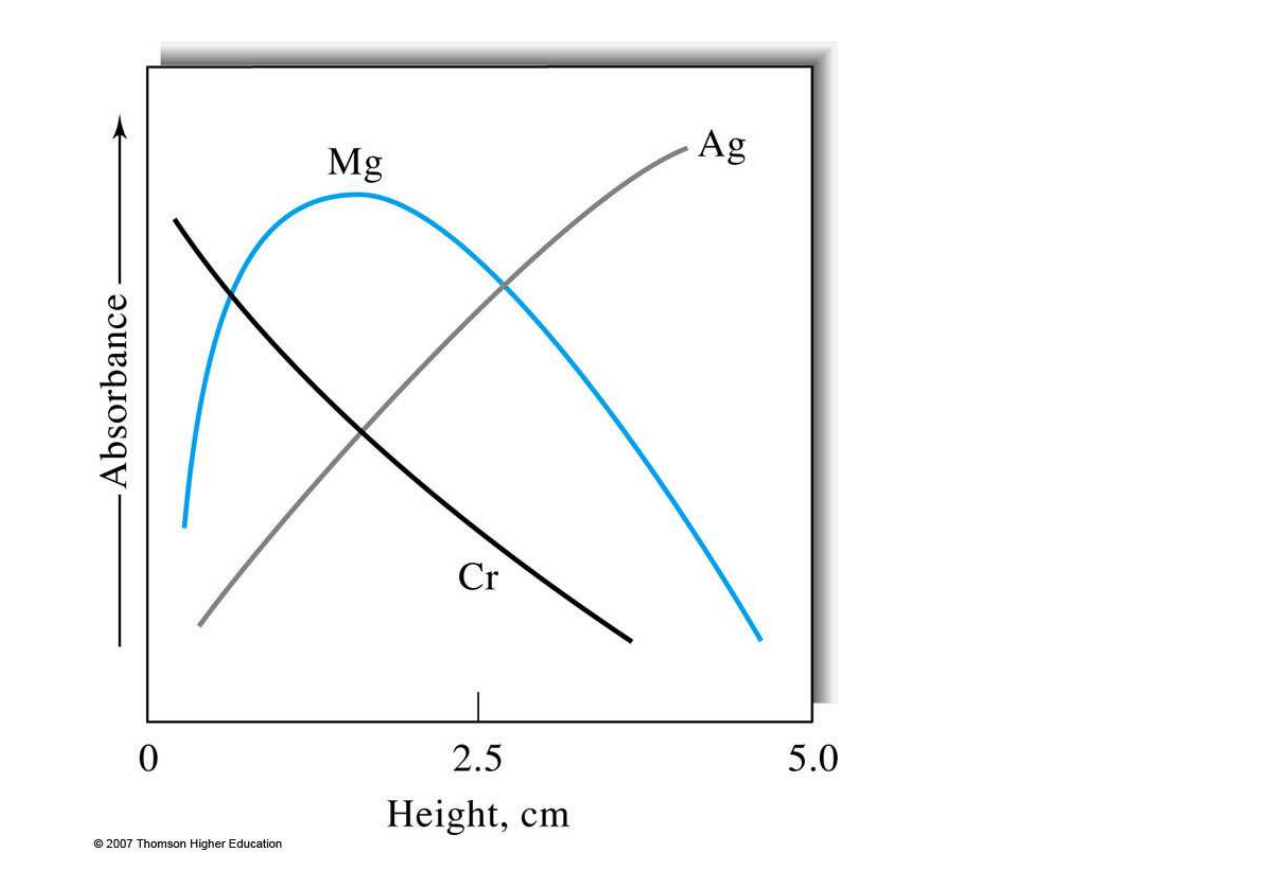
Zależność
absorbancji
od
położenia
palnika dla:
Mg, Ag i Cr
w metodzie
FAAS
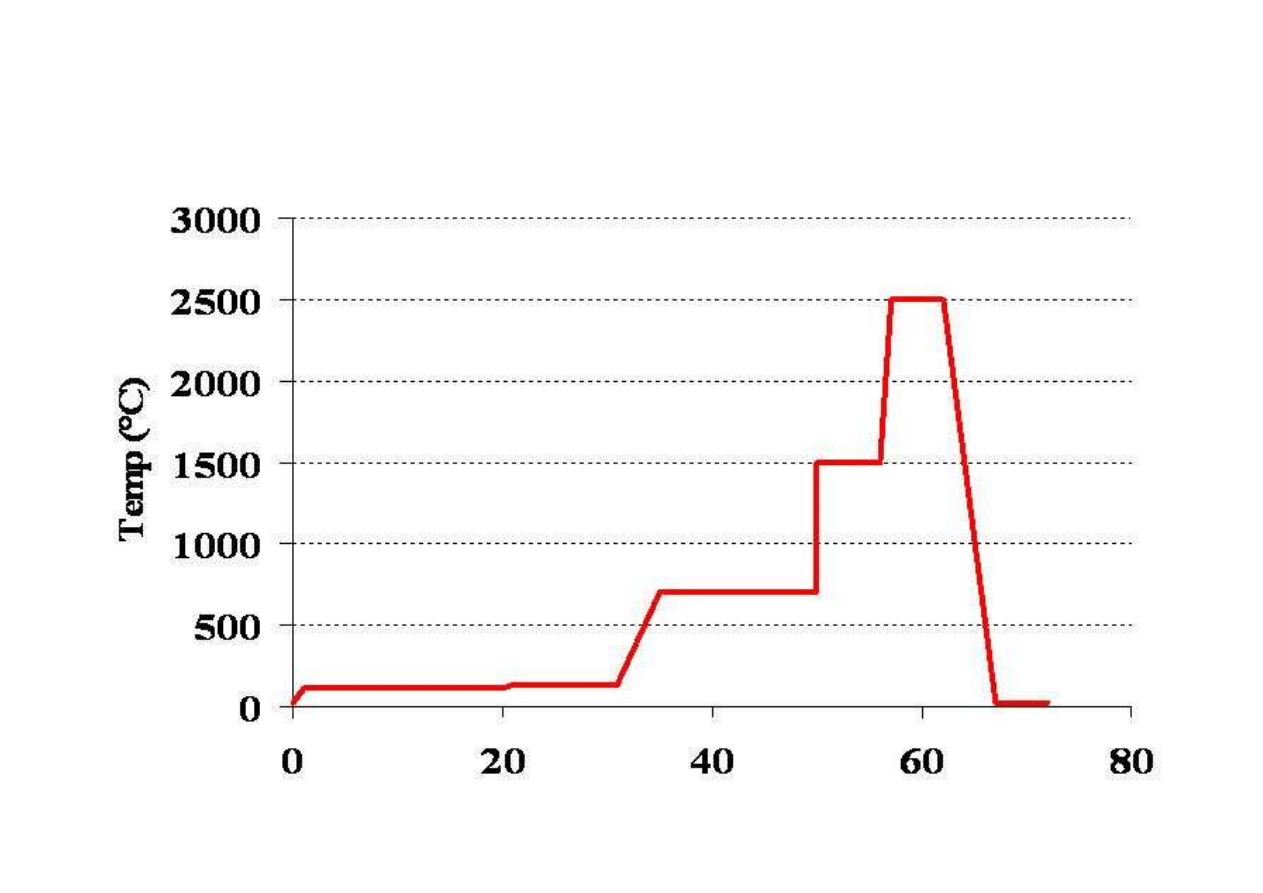
Program temperaturowy pieca grafitowego
T [s]
suszenie
spopielanie
atomizacja
czyszczenie

Wyszukiwarka
Podobne podstrony:
aas
AAS
AAS piatek 14 30 id 50013 Nieznany
ABSORPCYJNA SPEKTOMETRIA ATOMOWA (AAS)
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
1-AAS Sprawozdanie
proto AAS, Rok I, analiza instrumentalna
AAS 2 Solar Engineering Condensed Course
AAS interferencje, Analiza instrumentalna
interferencje AAS AES
AAS id 50012 Nieznany
Absorpcyjna spektrometria atomowa, Absorpcyjna spektrometria atomowa, AAS, z angielskiego Atomic Abs
aas
Die Werbung ist ein parfümiertes Stück Aas
AAS
więcej podobnych podstron