
*** VIII Wojewódzki Konkurs „Duety Chemiczne” *** 30.01.2007 r. *** VIII Wojewódzki Konkurs „Duety Chemiczne” ***
Katowice, 30.01.2007
VIII Wojewódzki Konkurs
„DUETY CHEMICZNE”
I etap
ZADANIE I. TEST. (10 punktów)
1. W reakcji: 2K + 2H
2
O
→
2KOH + H
2
↑
reagentami są:
a) KOH i H
2
,
b) K i H
2
O,
c) K, H
2
O, KOH i H
2
,
d) tylko H
2
.
2. Ze zbioru atomów:
A
41
28
,
A
41
29
,
A
42
28
izotopami tego samego pierwiastka są:
a)
A
41
28
,
A
41
29
,
b)
A
41
28
,
A
42
28
,
c)
A
41
29
,
A
42
28
,
d)
A
41
28
,
A
41
29
,
A
42
28
.
3. Cząsteczka wody jest dipolem, oznacza to, że:
a) wiązania w cząsteczce wody tworzą kąt około 104
0
,
b) w cząsteczce wody można wyróżnić dwa bieguny: dodatni i ujemny,
c) w cząsteczce wody znajdują się dwa takie same atomy,
d) wiązania w cząsteczce wody mają charakter jonowy.
4. Piana, mgła i dym to przykłady:
a) mieszanin substancji o różnych stanach skupienia,
b) różnych stanów skupienia,
c) roztworów stałych,
d) roztworów rzeczywistych.
5. Chlor tworzy wiele kwasów tlenowych. W którym spośród niżej wymienionych chlor
wykazuje najwyższą wartościowość?
a) HClO,
b) HClO
2
,
c) HClO
3
,
d) HClO
4
.
6. Ozon, czyli trójatomowa cząsteczka tlenu jest gazem:
a) szlachetnym,
b) powstającym podczas wyładowań atmosferycznych,
c) bezwonnym,
d) wszystkie odpowiedzi są prawidłowe.
7. Uczeń sporządził w zlewce roztwór wody wapiennej i pozostawił go bez przykrycia.
Następnego dnia stwierdził, że woda wapienna zmętniała. Przyczyną tego zjawiska był
fakt, iż:
a) woda wapienna uległa rozkładowi,
b) woda wapienna utleniła się w obecności tlenu zawartego w powietrzu,
c) wykrystalizował Ca(OH)
2
– główny składnik wody wapiennej,
d) roztwór pochłonął CO
2
z powietrza i powstał trudno rozpuszczalny CaCO
3
.
8. Wskaż prawdziwe zdanie definiujące pojęcie „związki uwodnione”:
a) są to substancje higroskopijne, które pochłaniają wilgoć z powietrza,
b) są to substancje zawierające w stanie krystalicznym cząsteczki wody,
c) są to substancje, których rozpuszczalność jest większa niż 100g/100g wody,
d) są to substancje, które rozpuszczają się wyłącznie w wodzie.
9. Perhydrol, czyli 30%-owy roztwór nadtlenku wodoru rozkłada się, z utworzeniem wody
i tlenu. Suma współczynników stechiometrycznych, określających ilość cząsteczek
w równaniu reakcji rozkładu dwóch moli perhydrolu wynosi:
a) 3,
b) 4,
c) 5,
d) 6.
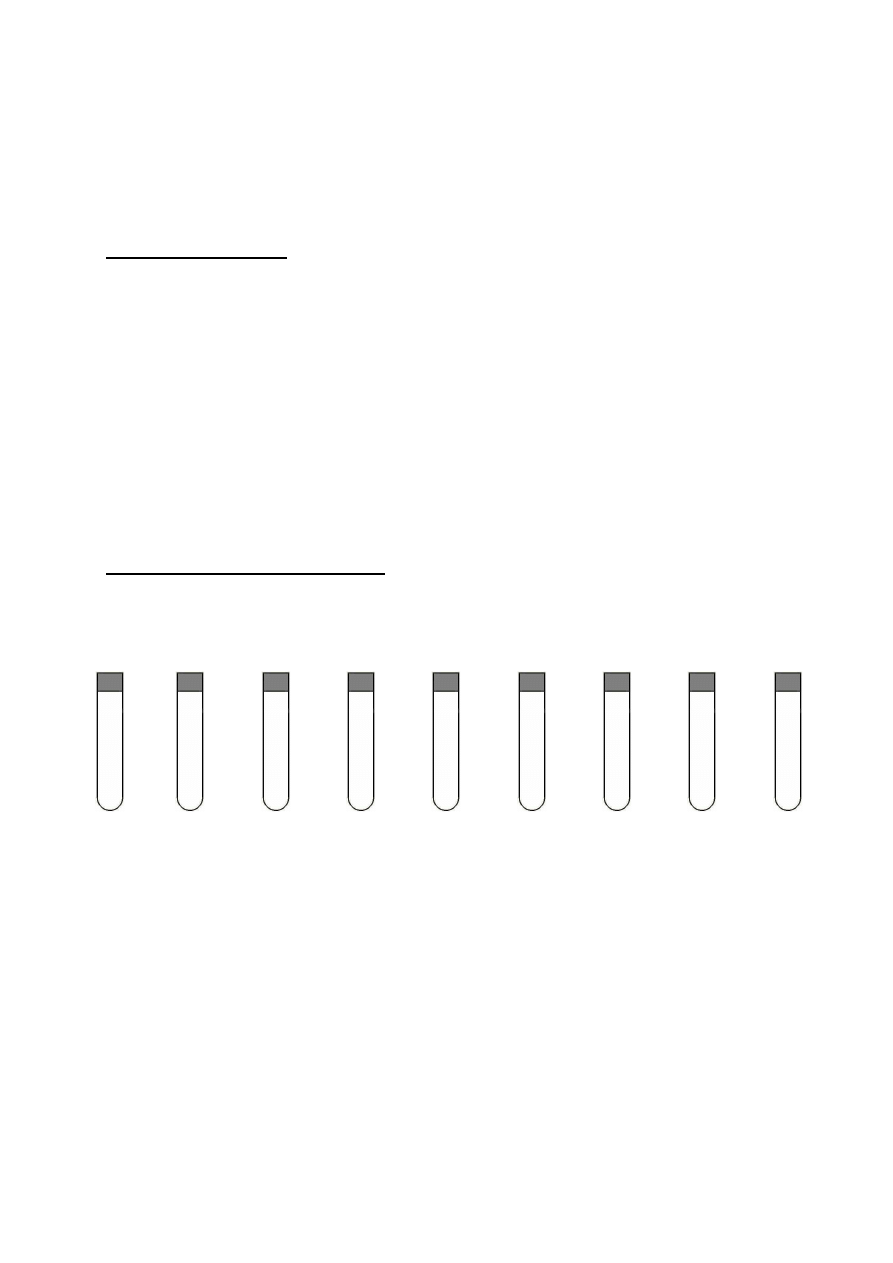
*** VIII Wojewódzki Konkurs „Duety Chemiczne” *** 30.01.2007 r. *** VIII Wojewódzki Konkurs „Duety Chemiczne” ***
10. W której z niżej wymienionych reakcji nie można otrzymać charakterystycznego,
niebieskiego osadu Cu(OH)
2
?
a) Cu + H
2
O,
b) CuO + H
2
O,
c) Cu(NO
3
)
2
+ NaOH,
d) odpowiedzi a i b są prawidłowe.
ZADANIE II. OBLICZENIA (10 punktów)
1. Jeden człowiek w procesie oddychania przekazuje do atmosfery ok. 1 kg CO
2
w ciągu
doby. Jaka to objętość ?.
a) 509,1 cm
3
,
b) 50,9 dm
3
,
c) 509,1 dm
3
,
d) 5,09 m
3
.
2. 1 mol to 6,02
⋅
10
23
cząstek, a jedna cząstka to?
a) 1,66·10
-24
mola, b) 1,66·10
24
mola,
c) 1,66·10
-22
mola, d) 1,66·10
22
mola.
3. Ile gramów substancji należy dosypać do 60g roztworu 4%-owego, aby uzyskać roztwór
o stężeniu 10%?
a) 0,24 g,
b) 3,6 g,
c) 4 g,
d) 6 g.
4. W nasyconym w temperaturze 20
0
C roztworze jodku potasu procentowa zawartość wody
(w % masowych) wynosi ok. 41%. Oblicz jaka jest rozpuszczalność KI w tej temperaturze.
a) 69,5 g,
b) 98,0 g,
c) 143,9 g,
d) 202,9 g.
5. Siarczan(VI) pewnego II-wartościowego metalu zawiera około 26,7% siarki. Metal ten to:
a) Ca,
b) Cu,
c) Mg,
d) Zn.
Masy atomowe [u]: C – 12, O –16, Mg –24, K –39, Ca – 40, Cu – 64, Zn – 65, Sr – 88, I – 127.
ZADANIE III. CO TO ZA SUBSTANCJE? (9 punktów)
W 9 ponumerowanych zamkniętych probówkach znajdują się substancje chemiczne –
korzystając z zamieszczonych poniżej podpowiedzi ustal, co to za substancje. Podaj wzory
sumaryczne związków lub symbole pierwiastków.
a) 1 tworzy z 6 substancję 3,
b) substancje 1, 2, 4, 6 i 8 w temperaturze pokojowej są gazami,
c) z połączenia wodnych roztworów substancji 4 i 5 powstaje w reakcji zobojętniania
substancja 3 i 9,
d) człowiek nie może żyć bez substancji 3 i 6,
e) 2 jest produktem spalania żółtego niemetalu, i zawiera w swojej cząsteczce
3 atomy,
f) substancję 9 można znaleźć w każdej kuchni,
g) 1, 6 i 8 to pierwiastki,
h) roztwory 4 i 7 mają odczyn kwasowy,
i) substancja 8 ma barwę żółto-zieloną i ostry, drażniący zapach,
j) 2 z 3 tworzy 7.
1
2
3
4
5
6
7
8
9
*** VIII Wojewódzki Konkurs „Duety Chemiczne” *** 30.01.2007 r. *** VIII Wojewódzki Konkurs „Duety Chemiczne” ***
ZADANIE IV. CHEMOGRAF (11 punktów)
Ustal, jakie substancje kryją się pod literami: A, B, C, D, E, F, G, H, I, J. Podaj symbole
pierwiastków i wzory sumaryczne związków chemicznych.
A
+
B
→
FeCl
3
+
H
2
O +
C
→
D
↑
V
2
O
5
↓
O
2
FeSO
4
E
+
F
→
K
2
SO
3
+
+
+
G
+
O
2
→
F
H
+
O
2
→
H
2
O
↓
FeCl
3
+
I
→
J
+
KCl
ZADANIE V. „PRZECIWIEŃSTWA” (8 punktów)
Poniżej podano definicje pojęć, które stanowią swoje „chemiczne przeciwieństwa”. Napisz
jakie to pojęcia – dla ułatwienia podano „końcówki” wyrazów.
pochłaniane:
1)
Reakcja, w której ciepło jest
wydzielane:
TERMICZNA
dodatnim:
2) Cząstka elementarna o ładunku
ujemnym:
ON
łączenia:
3)
Reakcja
rozkładu:
ZA
Mg, Ca, Sr:
4)
Jest nim np.
He, S, P
TAL
przewodzi prąd
elektryczny:
5)
Substancja, która
w roztworze nie przewodzi prądu
elektrycznego:
LIT
dodatnim:
6)
Jon obdarzony ładunkiem
ujemnym:
ION
ciała stałego w gaz:
7)
Przejście
gazu w ciało stałe:
ACJA
kwasowym:
8)
Kolor uniwersalnego papierka
wskaźnikowego zanurzonego
w roztworze o odczynie zasadowym:
ONY
Wyszukiwarka
Podobne podstrony:
3 etap 2007 experimental solutions
3 etap 2007 solutions
Etap rejonowy 2007 2008 klucz
Etap rejonowy 2006 2007 arkusz
konkurs V 2007 etap II, edu, Konkurs Gliwice
Etap wojewódzki 2006 2007
Łamigłówki liczbowe 2006 - 2007- Etap II, ĆWICZENIA OGÓLNOUSPRAWNIAJĄ, Matematyka, Łamigłówki liczbo
konkurs V 2007 etap I, edu, Konkurs Gliwice
czerwiec 2007 etap pisemny x id Nieznany
Etap wojewódzki 2007 2008
Etap wojewódzki 2006 2007 klucz
Etap rejonowy 2006 2007 klucz
Etap rejonowy 2006 2007 klucz
Etap szkolny 2006 2007
Etap wojewódzki 2007 2008 arkusz
Etap rejonowy 2006 2007
więcej podobnych podstron