Politechnika Śląska w Gliwicach
Wydział Chemiczny
Polskie Towarzystwo Chemiczne
Gliwice, 15. kwietnia 2009.
Główny Sponsor Konkursu
Pozostali sponsorzy:
XVII OGÓLNOPOLSKI KONKURS CHEMICZNY
DLA MŁODZIEŻY SZKÓŁ ŚREDNICH
Zadania laboratoryjne
Część I
W przydzielonym Ci zestawie znajduje się dziesięć
ponumerowanych probówek:
1. Cztery probówki zawierają wodne roztwory
pojedynczych substancji organicznych spośród pięciu
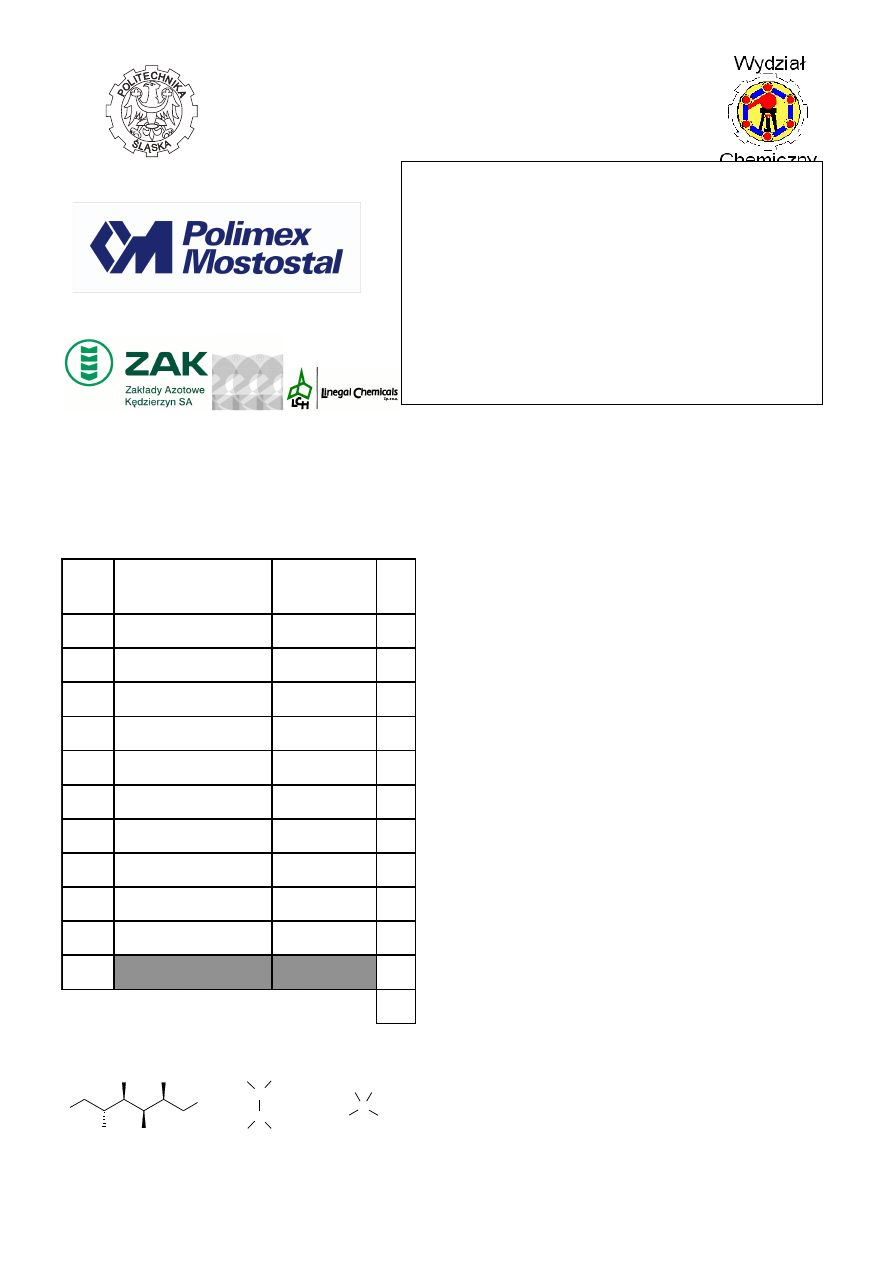
podanych poniżej: sorbitol
*
, kwas winowy, kwas
aminooctowy (glicyna), octan sodu, mrówczan sodu.
Wzory strukturalne wybranych związków zamieszczono
poniżej.
2. Sześć probówek zawiera wodne roztwory
pojedynczych różnych substancji nieorganicznych: 0,05
M AgNO
3
, 2 M NaOH, 2 M NH
3
, 0,1 M CuSO
4
, 1 M
Na
2
CO
3
, 2 M HCl.
Mając do dyspozycji probówki w statywach, lejki
jakościowe, sączki, palnik gazowy, łyżeczkę do spalania,
papierki wskaźnikowe pH, tryskawkę z wodą destylowaną,
określ zawartość każdej z probówek. Potwierdź swoje
ustalenia, przeprowadzając niezbędną liczbę eksperymentów
chemicznych i fizycznych. Powinieneś nie tylko
jednoznacznie potwierdzić obecność 10 substancji (6
nieorganicznych i 4 organicznych) w swoich probówkach,
ale także wykluczyć obecność pozostałych. Szczególnie
istotne przy ocenie rozwiązania będą równania
wykonywanych reakcji lub opis poczynionych przez Ciebie
obserwacji w trakcie wykonywania eksperymentów i sposób
wnioskowania prowadzący do jednoznacznej identyfikacji substancji. Za każdą prawidłowo wykrytą substancję
wraz z pełnym uzasadnieniem możesz uzyskać: 3 punkty.
Uwaga: nie można korzystać z substancji pomocniczych
dostępnych na sali.
*
Sorbitol, jako wielowodorotlenowy alkohol będący
produktem redukcji glukozy wykazuje właściwości
chemiczne bardzo zbliżone do glukozy.
Nr
prob.
Zawartość probówki
Nry testów
uzasadniających
zawartość
pkt
1
2
3
4
5
6
7
8
9
10
Cz. II
SUMA
Nazwisko (z dopełniaczem) i imię.......................................
..............................................................................................
Pesel.....................................................................................
Adres zamieszkania .............................................................
Szkoła
....................................................................
Miejscowość
....................................................................
Imię i nazwisko nauczyciela ...............................................
Numer zestawu
......................................................
O
H
OH
OH
OH
OH
OH
CH
CH
O
H
O
H
COOH
COOH
N
H
2
C
COOH
H
H
sorbitol
kwas winowy
kwas aminooctowy
glicyna
Część II
Na stołach znajdują się ponumerowane zestawy złożone ze źródła prądu stałego oraz
elektrod grafitowych. Posługując się roztworami dostępnymi na sali oraz krążkiem bibuły
zaproponuj sposób określenia biegunów źródła prądu za pomocą reakcji barwnych.
Krążek bibuły (sączek) umieść na szalce Petriego (lub szkiełku zegarkowym), nasącz
bibułę wybranym roztworem (ewentualnie z dodatkiem wskaźników), a następnie przyłóż
do bibuły końcówki elektrod. Na bibule powinny pojawić się barwne efekty, które
powinieneś opisać i zinterpretować, podając równania przebiegających reakcji.
Po wyborze jednego z zestawów określ, z którym biegunem źródła prądu związane jest
wyprowadzenie koloru czerwonego, a z którym – czarnego. Za prawidłowe określenie
bieguna źródła prądu, właściwy dobór roztworów i wskaźników, za poprawny opis
i przekonywującą interpretację możesz uzyskać maksymalnie 10 punktów.
Nr zestawu Przewód
Biegun (wpisz + lub –)
Czerwony
Czarny
Document Outline
Wyszukiwarka
Podobne podstrony:
Konkurs 2009 XVII etapI
Prawo konkurencji 2009
konkurs XIV 2006 etapII
J polski konkurs 2009 wojewódzki model, konkurs polonistyczny
konkurs 2009, klucz do testu
Konkurs 2008 XVI etapII
Konkurs 2003 XI etapII
Landeskunde Konkurs 2009 Andrychów
Konkurs 1996 IV etapIiII
Konkurs 2000 VIII etapII
Konkurs 2000 VIII etapII
geografia konkurs gim 2008 2009
2009 01 Vim – konkurent prawie doskonały! [Poczatkujacy]
XVII PRZEDMIOTOWY KONKURS Z INFORMATYKI 2008
SZKOLNY KONKURS 2008 - 2009, Klasa VI(1)
KONKURS ORTOGRAFICZNY 2009-kl5, gimnazjum i podstawówka, gimnazjum, polak
więcej podobnych podstron