
WPROWADZENIE
Komórki NK (ang. natural killer) s¹ to du¿e ziarniste
limfocyty, które pe³ni¹ funkcje cytotoksyczne i immuno-
regulatorowe (1, 2). Komórki NK maj¹ zdolnoæ sponta-
nicznego zabijania komórek nowotworowych i zaka¿o-
nych wirusem, dziêki czemu odgrywaj¹ kluczow¹ rolê
w odpowiedzi na nowotwory i infekcje (3). S¹ tak¿e uwa-
115
Onkol. Pol. 2007, 10, 3: 115-119
ISSN 1505-6732
Copyright © 2007 Almamedia
http://www.almamedia.com.pl
PPRRAACCEE PPOOGGLL¥¥DDOOW
WEE // RReevviieeww aarrttiicclleess
Biologia komórek NK (Natural Killer)
Natural Killer cell biology
Joanna Kopeæ-Szlêzak, Urszula Podstawka
Zak³ad Cytobiologii Hematologicznej Instytutu Hematologii i Transfuzjologii w Warszawie
Adres do korespondencji:
Prof. dr hab. n. med. Joanna Kopeæ-Szlêzak
Instytut Hematologii i Transfuzjologii
Zak³ad Cytobiologii Hematologicznej
ul. Indiry Gandhi 14; 02-776 Warszawa
tel. (022) 349 61 66; fax (022) 349 61 78
e-mail: facsiht@ihit.waw.pl
Praca wp³ynê³a do Redakcji: 2007.07.26.
STRESZCZENIE
Komórki NK (ang. natural killer) tworz¹ pierwsz¹ liniê obrony przed patogenami (wirusami)
i w³asnymi zmienionymi (nowotworowo) komórkami. Komórki NK powstaj¹ w szpiku kostnym
z progenitorowej komórki hematopoetycznej. Wyró¿nia siê komórki NK cytotoksyczne
(CD16++CD56-/+) i immunoregulatorowe (CD56++CD16-/+). Na komórkach NK wystêpuj¹ 3
g³ówne nadrodziny receptorów: receptory cytotoksycznoci naturalnej (natural cytotoxity re-
ceptors NCRs) aktywatory cytolizy, receptory immunoglobulinopodobne (killer Ig-like re-
ceptors KIR) aktywatory i inhibitory cytolizy oraz receptory lektynowe typu C (killer lecti-
ne like receptors KLR) wystêpuj¹ce w postaci heterodimerów, aktywatory i inhibitory
cytolizy. Wa¿ne dla procesów cytotoksycznoci s¹ tak¿e moleku³y z grupy SLAM (np. CD244)
i LAMP (CD107a). Reakcja cytotoksyczna komórki NK jest wynikiem równowagi pomiêdzy ak-
tywnoci¹ receptorów o w³asnociach stymulacyjnych i inhibitorowych. W przewlek³ych bia-
³aczkach i ch³oniakach z komórek B liczba komórek NK w krwi obwodowej chorych nieleczo-
nych jest 2-3-krotnie wy¿sza ani¿eli u zdrowych dawców; wyj¹tek stanowi bia³aczka
w³ochatokomórkowa, w której liczba komórek NK w krwi jest ni¿sza ni¿ u dawców.
S£OWA KLUCZOWE:
komórki NK, subpopulacje, receptory, cytotoksycznoæ
ABSTRACT
Natural killer (NK) cells play a critical role in the innate immune response against infections
and tumors through the production of cytokines and direct cytolytic activity. Natural killer cell
development occurs in the bone marrow from hematopoetic progenitor cells. Human NK cells
can be divided into two functional subsets based on their surface expression of CD56:
CD56
bright
immunoregulatory cells and CD56
dim
cytotoxic cells. The CD56
bright
subset has low
expression of CD16 and CD56
dim
NK cells have high CD16 expression. Three major super-
families of NK cell receptor have been described: cytolysis activators natural cytotoxity re-
ceptors (NCRs), the killer immunoglobulin (Ig) like receptors (KIR) cytolysis activators and
inhibitors and C-type lectin superfamily receptors (killer lectine like receptors KLR). Also ac-
tivating co-receptors as CD244 and CD107a on NK cells are described. NK cells recognize
target cell via activating and inhibitory receptors and the balance of signals from these recep-
tors can modulate NK cell activity.
In B-cell chronic leukemia and lymphoma the NK cell number in patient peripheral blood is si-
gnificantly higher than in healthy donors, except hairy cell leukemia.
KEY WORDS:
NK cells, subsets, receptors, cytotoxicity
7OP3_04P.QXD 11/16/07 10:34 AM Page 115
¿ane za elementy ³¹cz¹ce procesy odpornoci wrodzonej
i nabytej (4), w której uczestnicz¹ m.in. poprzez kontak-
ty z komórkami dendrytycznymi (5). Populacja komórek
NK stanowi od 10 do 15% wszystkich limfocytów krwi
obwodowej. Cech¹ wspóln¹ dla wszystkich komórek NK
jest brak ekspresji moleku³y CD3, co pozwala je odró¿niæ
od limfocytów T CD3+. Komórki NK wykazuj¹ ekspre-
sjê CD56 i CD16, lecz intensywnoæ ekspresji tych mole-
ku³ jest zró¿nicowana w zale¿noci od funkcji (1).
ROZWÓJ KOMÓREK NK
Kolejne stadia rozwoju komórek NK u cz³owieka nie
s¹ jeszcze dok³adnie poznane, ale wiadomo, ¿e rozwój ko-
mórek NK zachodzi najpierw w szpiku z komórek proge-
nitorowych CD34++ przy udziale m.in. czynnika wzrostu
komórek macierzystych (stem cell factor SCF) oraz ki-
nazy tyrozynowej FLT3 i interleukin IL-2 i IL-15. Stwier-
dzono in vitro, ¿e mo¿na wyró¿niæ dwie subpopulacje ko-
mórek NK CD56+ stosuj¹c kryterium ekspresji CD117
i CD94 (receptora lektynowego): subpopulacjê CD117++
CD94-negatywn¹ i subpopulacjê CD117-/+CD94+. Obie
subpopulacje pochodz¹ od komórki CD34+CD38-nega-
tywnej i wykazuj¹ ekspresjê NKp44 (CD336), ale ró¿ni¹
siê charakterem ekspresji m.in. CD16 i receptorów z gru-
py immunoglobulinopodobnych KIR (ang. killer Ig-like
receptors). Komórki NK CD117++ CD94- dominuj¹ we
wczeniejszym okresie ró¿nicowania i z czasem ich licz-
ba maleje, a wzrasta liczebnoæ subpopulacji CD117-
/+CD94+, która ju¿ wykazuje aktywnoæ cytotoksyczn¹
i wydziela interfon gamma (IFN-C). Autorzy badañ twier-
dz¹, ¿e te dwie subpopulacje stanowi¹ dwa kolejne stadia
rozwojowe komórek NK, choæ wyró¿niaj¹ te¿ stadium
przejciowe: CD117-/+CD94-/+ (6). Mo¿na wiêc powie-
dzieæ, ¿e na opisanym etapie rozwoju komórki NK trac¹
ekspresjê CD117 i uzyskuj¹ ekspresjê CD94. Czêæ ko-
mórek NK mo¿e przechodziæ do wêz³ów ch³onnych, gdzie
powstaj¹ g³ównie komórki NK CD56++CD16-ujemne.
W tym procesie uczestnicz¹ komórki dendrytyczne (7).
Ostatnio ukaza³a siê praca, w której autorzy opisali w gra-
sicy myszy subpopulacjê komórek NK, która wymaga do
swojego rozwoju IL-7 oraz czynnika transkrypcyjnego
Gata-3. Te nowe dane sugeruj¹, ¿e komórki NK mog¹ siê
adaptowaæ do ró¿nych rodowisk, w zale¿noci od zapo-
trzebowania (8).
SUBPOPULACJE KOMÓREK NK
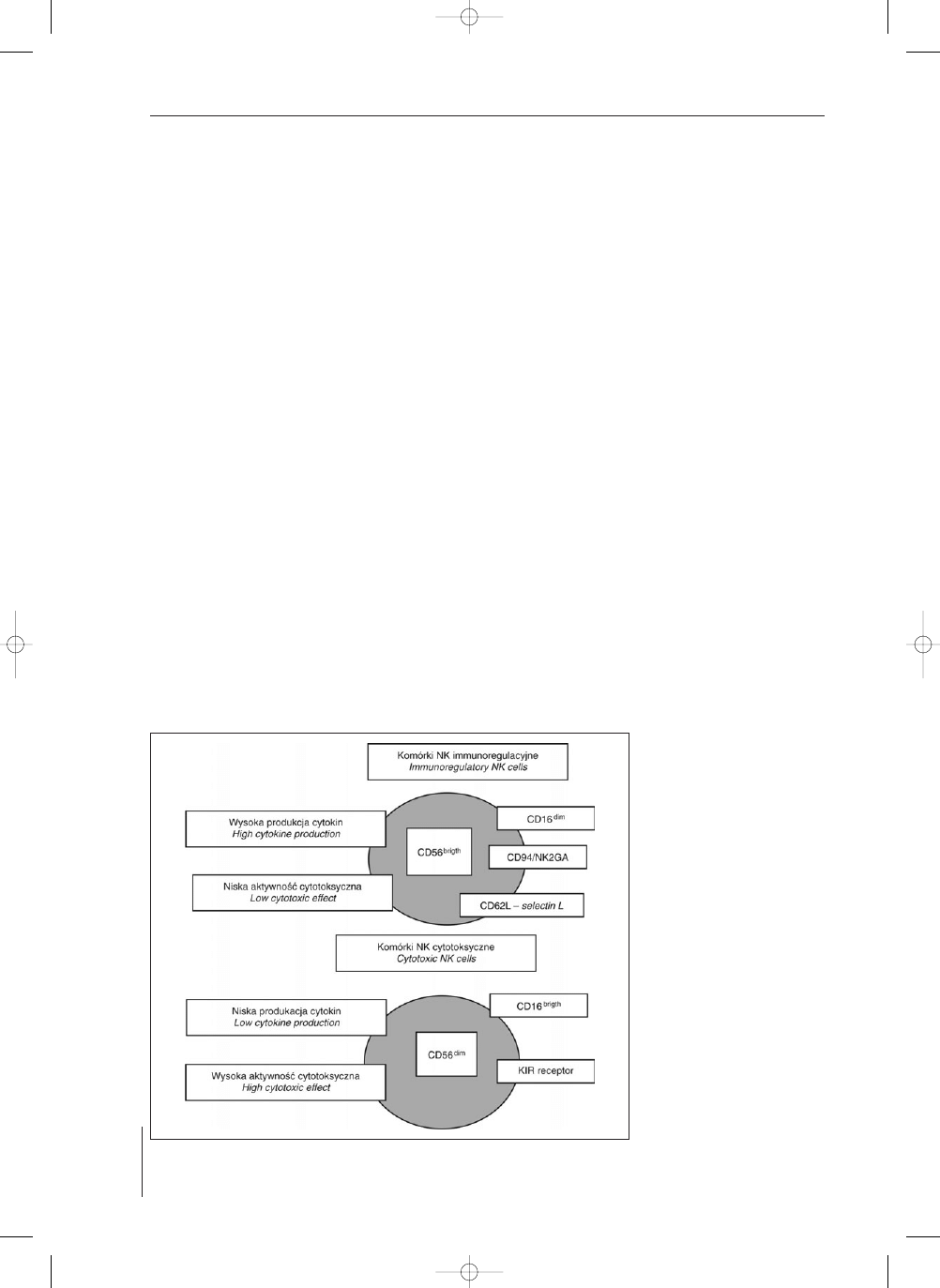
Komórki NK tworz¹ dwie subpopulacje zró¿nicowa-
ne pod wzglêdem immunofenotypu i pe³nionych funkcji:
NK immunoregulatorowe CD56++ oraz NK cytotoksycz-
ne CD56-/+ (9), (ryc. 1). Zatem wyznacznikiem podzia³u
komórek NK na dwie wyrane subpopulacje jest zró¿ni-
cowanie intensywnoci ekspresji adhezyjnej moleku³y
powierzchniowej tzw. N-CAM (neural cell adhesion mo-
lekule), czyli CD56 i wyró¿niane s¹ subpopulacje ko-
mórek NK: CD56
bright
i CD56
dim
. Komórki NK CD56
bright
wykazuj¹ jednoczenie s³ab¹ ekspresjê CD16, a komórki
CD56
dim
siln¹ ekspresjê CD16 (1). W krwi obwodowej
subpopulacja CD56++CD16-/+ stanowi zaledwie 10%
a subpopulacja CD16++CD56-/+ 90% wszystkich ko-
mórek NK. Te dwie subpopulacje komórek NK ró¿ni¹ siê
nie tylko ekspresj¹ CD56, ale i CD16 (receptora dla ³añ-
cucha lekkiego immunoglobulin). Komórki
CD56++CD16-/+ jako komórki immunoregulacyjne, wy-
dzielaj¹ liczne cytokiny, w przeciwieñstwie do CD56-
116
Kopeæ-SzlêzakJ., Podstawka U.
Natural Killer cell biology
Onkol. Pol. 2007, 10, 3: 115-119
ISSN 1505-6732
RYCINA 1. Komórki NK CD56
bright
(immunoregulatorowe)
i CD56
dim
(cytotoksyczne)
odmienna ekspresja
CD16, receptorów immu-
noglobulinopodobnych
KIR, selektyny L (CD62L)
i sekrecji cytokin (wg 9
uproszczone)
FIGURE 1. Human Natural Killer cells
CD56
bright
(immunoregula-
tory) and CD56
dim
(cytoto-
xic) show different surfa-
ce receptors: CD16, the
killer immunoglobulin (Ig)
like receptors (KIR), L-se-
lectin (CD62L) and cytoki-
ne secretion (acc. 9 mo-
dified)
7OP3_04P.QXD 11/16/07 10:34 AM Page 116

/+CD16++, efektorowych komórek cytotoksycznych (9).
Ponadto komórki NK CD16+CD56-/+ maj¹ znacznie
krótsze telomery ni¿ komórki CD56+CD16-/+ i s¹ trakto-
wane jako komórki bardziej dojrza³e (10).
Komórki CD56++ wykazuj¹ ekspresjê selektyny
L (CD62L) i receptora CCR7 dla chemokin CCL19
i CCL21 i wystêpuj¹ g³ównie w wêz³ach ch³onnych, gdzie
kontaktuj¹ siê z limfocytami T oraz komórkami dendry-
tycznymi w procesach prezentacji antygenu i stymulacji
powstawania subpopulacji limfocytów T (11). Aktywo-
wane komórki CD56++ wydzielaj¹ równie¿ cytokiny
TNF-= (tumor necrosis factor) oraz IFN-C, a tak¿e IL-10.
Wprawdzie stanowi¹ tylko 10% wszystkich komórek NK,
ale podczas d³ugotrwa³ej terapii interleukin¹ 2 mog¹ staæ
siê subpopulacj¹ dominuj¹c¹ w krwi obwodowej chorych
na nowotwory lub z wirusem HIV (12).
Komórki CD56-/+CD16++ wykazuj¹ ekspresjê recep-
tora dla IL-2 (CD25) i IL-15, czyli dla cytokin, które
znacznie zwiêkszaj¹ zdolnoæ komórek NK do zabijania
komórek docelowych op³aszczonych antygenami oraz ko-
mórek bez ekspresji MHC (molecular histocompatibility
complex) (1).
Retencjê komórek NK CD56
bright
i CD56
din
w organi-
zmie warunkuje ekspresja wielu receptorów chemokin;
wa¿na jest tu ekspresja receptora CXCR4 (CD184) dla
chemokiny SDF-1 (stromal derived factor), który uczest-
niczy w migracji komórek NK do szpiku i ledziony (13).
RECEPTORY KOMÓREK NK
Na komórkach NK wyró¿niane s¹ 3 g³ówne nadro-
dziny receptorów (1, 3, 14):
1. Receptory lektynowe cytotoksycznoci naturalnej
(natural cytotoxity receptors NCRs) aktywatory cyto-
lizy. Nale¿¹ tu receptory: NKp46 CD335, NKp44
CD336, NKp30 CD337. Receptory te nie u¿ywaj¹ HLA
jako liganda, a w przypadku wirusów jako ligand dla -
NKp46 i NKp44 s³u¿y hemaglutynina.
2. Receptory immunoglobulinopodobne (killer Ig-like
receptors KIR); nale¿¹ tu zarówno aktywatory (w licz-
bie 6) i inhibitory cytolizy (w liczbie 7). Receptory KIR
u¿ywaj¹ jako liganda HLA klasy I, np. HLA-C i HLA-G.
W klasyfikacji moleku³ CD zajmuj¹ numer CD158 (od
CD158a do CD158k). Receptory KIR nie wystêpuj¹ na
komórkach CD56++ (14).
3. Receptory lektynowe typu C (killer lectine like re-
ceptors KLR) wystêpuj¹ce w postaci heterodimerów,
aktywatory i inhibitory cytolizy. Receptory aktywuj¹ce to
CD94/NKG2C i CD94/NKG2E, a o w³asnociach hamu-
j¹cych to CD94/NKG2A oraz NKG2D. CD94/NKG2 to
heterodimer, którego funkcja aktywuj¹ca, b¹d hamuj¹ca
cytotoksycznoæ komórki NK, zale¿y od izoformy NKG;
np. NKG2A ma dzia³anie hamuj¹ce. CD94/NKG u¿ywa-
j¹ ligandów HLA klasy I lub tzw. polimorficznych MHC-
podobnych tzw. MIC (np. MIC A i MIC B na komórkach
bia³aczkowych) (15, 16).
Wa¿n¹ grupê receptorów na komórkach NK stanowi¹
moleku³y nale¿¹ce do rodziny limfocytowych moleku³ sy-
gnalizacyjnych (SLAM), np. CD2 i CD244, dla których li-
gand stanowi CD48, który tak¿e nale¿y do tej samej gru-
py moleku³. S¹ to koreceptory uczestnicz¹ce w interak-
cjach heterotypowych i homotypowych, tzn. pomiêdzy
komórkami NK i innymi komórkami, ale te¿ i pomiêdzy
komórkami NK. CD244 to moleku³a aktywacyjna, istot-
na dla stymulacji cytotoksycznoci komórek NK, jak i dla
syntezy oraz wydzielania IFN-C (17). Stwierdzono, ¿e
przy braku interakcji pomiêdzy CD244 i CD48 aktywnoæ
cytotoksyczna wobec komórek nowotworowych jest po-
wa¿nie obni¿ona. Funkcje komórek NK s¹ tak¿e regulo-
wane poprzez interakcje homotypowe pomiêdzy komór-
kami NK via CD244/CD48 (18).
CD107a inaczej LAMP-1 (lysosomal-associated mem-
brane protein-1) to moleku³a zwi¹zana z b³on¹ lizosomów
komórek NK i jest uwa¿ana za wyznacznik procesu degra-
nulacji tych komórek. W przewlek³ej bia³aczce limfocy-
towej B (PBL-B) liza komórek bia³aczkowych przy lecze-
niu przeciwcia³ami monoklonalnymi anty-CD20
i anty-CD52 dokonuje siê za porednictwem komórek
NK, które wykazuj¹ wysok¹ ekspresjê CD107a (19).
Stwierdzono równie¿, ¿e ekspresja CD107a koreluje po-
zytywnie z intensywn¹ liz¹ komórek docelowych wywo-
³an¹ przez komórki NK (20).
Jako koreceptory aktywuj¹ce wymienia siê rów-
nie¿: CD16, dla którego ligand stanowi Fc immunoglobu-
lin oraz integryna CD18/11a, dla której ligandem jest mo-
leku³a adhezyjna z nadrodziny immunoglobulin CD54,
a tak¿e CD69 o nieznanym dot¹d ligandzie. Moleku³a
CD154 znana do niedawna jako CD40L, ³¹czy siê z CD40
m.in. na komórkach dendrytycznych, w reakcjach odpor-
nociowych. Niezale¿nie od intensywnoci ekspresji
CD56 wszystkie komórki NK u cz³owieka wykazuj¹ eks-
presjê moleku³y aktywacyjnej CD161 (1).
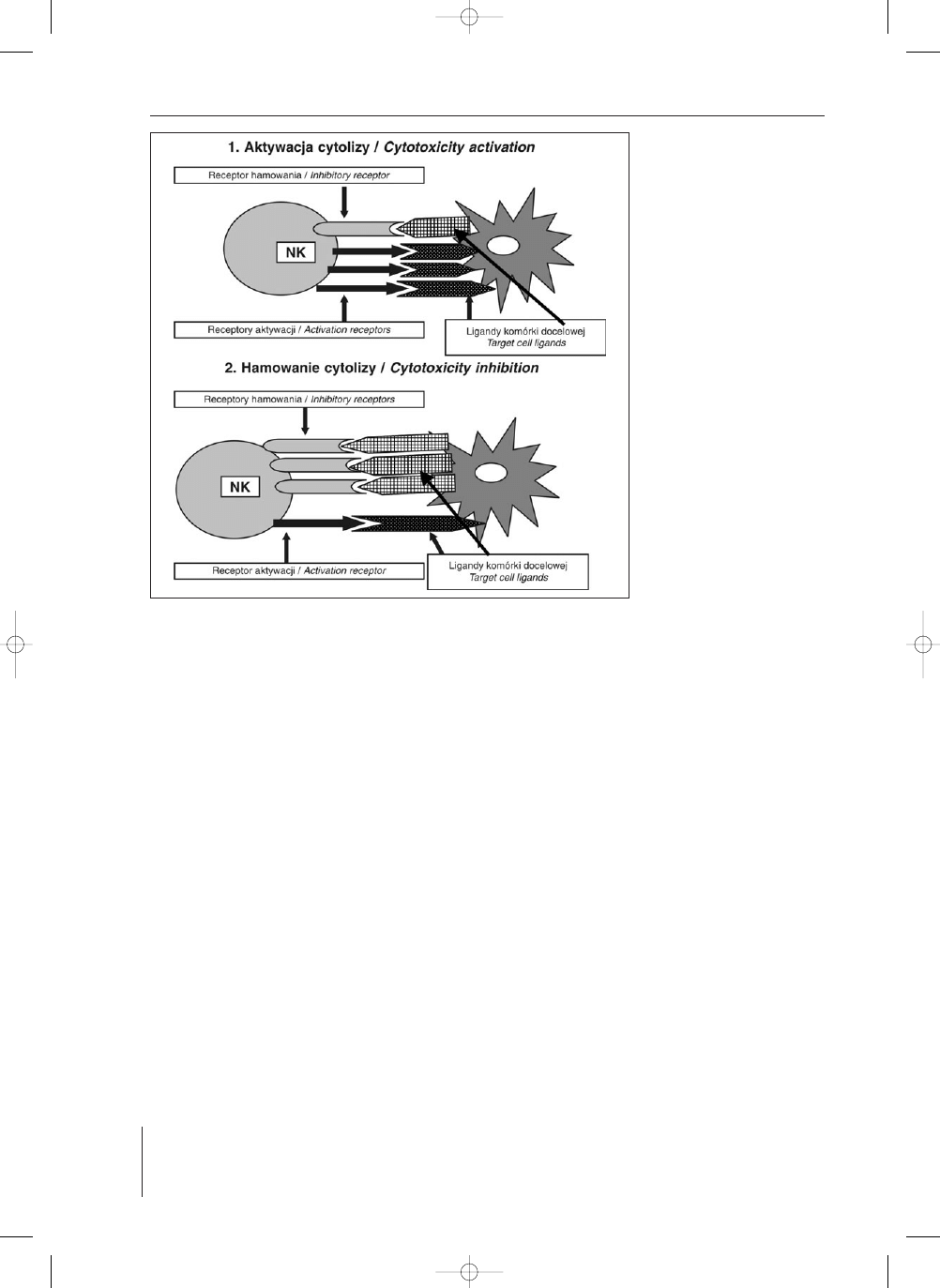
REGULACJA AKTYWNOCI KOMÓREK NK
Reakcja komórki NK (np. cytotoksyczna) jest wyni-
kiem proporcji liczby receptorów stymulacyjnych i inhi-
bitorowych na komórce NK oraz równowagi pomiêdzy
aktywnoci¹ receptorów o w³asnociach stymulacyjnych
cytolizê i hamuj¹cych ten proces.
Aktywacja cytotoksycznoci komórki NK nastêpuje
wówczas, gdy komórka docelowa (np. nowotworowa) nie
wykazuje ekspresji liganda dla receptora o w³asnociach
inhibitorowych na komórce NK, a wykazuje ekspresjê dla
receptora aktywacji na komórce NK. Aktywacja komór-
ki NK nastêpuje równie¿ wtedy, gdy liczebnoæ ligandów
na komórce docelowej dla receptorów aktywacji jest wy-
¿sza ani¿eli dla receptorów hamowania na komórce NK.
Natomiast hamowanie aktywnoci cytotoksycznej ko-
mórki NK zachodzi wówczas, gdy komórka docelowa wy-
kazuje jedynie ekspresjê liganda dla receptorów hamowa-
nia na komórce NK oraz wtedy, gdy aktywnoc ligandów
na komórce docelowej dla receptorów hamowania jest
wy¿sza ani¿eli dla receptorów aktywacji cytotoksyczno-
ci na komórce NK (ryc. 2) (21). Przyk³adem mo¿e byæ
dzia³anie hamuj¹ce i aktywuj¹ce receptory komórki NK
przez ligandy prawid³owych i nowotworowych komórek
w procesie decyzji komórki NK o rozpoczêciu proce-
117
Kopeæ-SzlêzakJ., Podstawka U.
Biologia komórek NK
Onkol. Pol. 2007, 10, 3: 115-119
ISSN 1505-6732
7OP3_04P.QXD 11/16/07 10:34 AM Page 117
sów cytolizy. Komórka prawid³owa krwi wykazuje eks-
presjê moleku³y MHC klasy I, która jest ligandem dla re-
ceptora typu KIR o w³asnociach hamuj¹cych cytolitycz-
n¹ aktywnoæ komórki NK; w tej sytuacji proces cytolizy
komórki prawid³owej nie zachodzi. Natomiast komórka
bia³aczkowa niewykazuj¹ca ekspresji liganda dla recepto-
ra typu KIR o w³asnociach hamuj¹cych, ale dla recepto-
ra o w³asnociach aktywuj¹cych np. z grupy NCR (czyli
cytotoksycznoci naturalnej), wywo³uje aktywacjê proce-
su cytotoksycznego przez komórki NK. Efekt przeciwbia-
³aczkowy poprzez receptory NCR stwierdzono w ostrych
bia³aczkach limfoblastycznych i w szpiczaku mnogim
(22, 23).
Podobne procesy zachodz¹ pomiêdzy komórkami NK
a komórkami zaka¿onymi wirusami. Receptor KIR o w³a-
snociach aktywuj¹cych komórki NK wi¹¿e siê z moleku-
³¹ HLA klasy I komórki zaka¿onej wirusem, czego efek-
tem jest cytoliza tej komórki. W procesie niszczenia
komórek zainfekowanych wirusami mog¹ uczestniczyæ
tak¿e monocyty, które poprzez wydzielanie interleukiny
12 (IL-12) stymuluj¹ wydzielanie z komórek NK interfe-
ronu gamma o aktywnoci przeciwwirusowej (24).
PROCES CYTOLIZY
Proces cytolizy komórek docelowych przez komórki
NK jest zale¿ny od aktywnoci granulosomów wystêpu-
j¹cych w cytoplazmie komórek NK. Ka¿dy granulosom
sk³ada siê z czêci korowej, w której wystêpuj¹, tzw. mi-
niziarna zawieraj¹ce perforynê enzym proteolityczny.
Rdzeñ granulosomu zawiera granzymy. W procesach cy-
tolizy najpierw aktywne s¹ perforyny, które dokonuj¹ na
drodze enzymatycznej perforacji b³ony komórkowej two-
rz¹c w niej kana³y, co oznacza koniec integralnoci np. ko-
mórki nowotworowej. Nastêpnie proteazy pochodz¹ce
z granzymów wnikaj¹ do cytoplazmy komórki docelowej
i aktywuj¹ kaspazy, kluczowe enzymy procesu apoptozy.
W ten sposób procesy cytolizy powoduj¹ apoptozê niepra-
wid³owych komórek (25).
Jednak¿e nie zawsze proces cytolizy komórek nowo-
tworowych przez komórki NK jest mo¿liwy. Stwierdzo-
no m.in., ¿e komórki NK u chorych na ostr¹ bia³aczkê
szpikow¹ (OBS) wykazuj¹ nisk¹ aktywnoæ cytolityczn¹
wobec komórek bia³aczkowych z powodu znacznie obni-
¿onej ekspresji receptorów NCR tzw. cytotoksycznoci
naturalnej, niezbêdnych do stymulacji procesu cytolizy.
Nie wykazano zale¿noci niskiej ekspresji receptorów
NCR od aberracji cytogenetycznych czy od podtypu OBS
wg klasyfikacji FAB. Wprawdzie u chorych w ca³kowitej
remisji stwierdzono wy¿sz¹ ekspresjê tych receptorów, ale
autorzy sugeruj¹, ¿e obni¿enie ekspresji receptorów cyto-
toksycznoci naturalnej na komórkach NK mo¿e byæ nie-
korzystnym czynnikiem rokowniczym (26).
W innej pracy wykazano, ¿e komórki NK najbardziej
efektywnie wywo³uj¹ cytolizê komórek nowotworowych
podczas ich mitozy, w porównaniu do innych faz cyklu ko-
mórkowego. Rozpoznanie przez komórki NK komórek no-
wotworowych podczas mitozy wymaga aktywacji recepto-
rów komórek NK rozpoznaj¹cych hialurany (stanowi¹ce
sk³adnik tzw. macierzy oko³okomórkowej), których iloæ
wzrasta podczas mitozy komórek nowotworowych (27).
118
Kopeæ-SzlêzakJ., Podstawka U.
Natural Killer cell biology
Onkol. Pol. 2007, 10, 3: 115-119
ISSN 1505-6732
RYCINA 2. Regulacja reakcji cytoto-
ksycznej komórek NK jako
wynik równowagi pomiê-
dzy ekspresj¹ receptorów
aktywuj¹cych i hamuj¹-
cych oraz odpowiednich
ligandów na komórkach
docelowych (wg 21 upro-
szczone)
FIGURE 2. Regulation of NK cell cyto-
toxocity response as ba-
lance effect of activating
and inhibitory receptors
and receptor-ligand inte-
ractions. (acc. 21 modi-
fied)
7OP3_04P.QXD 11/16/07 10:34 AM Page 118

BIA£ACZKA / CH£ONIAK Z KOMÓREK NK
W pimiennictwie wyró¿niane s¹ dwie formy bia³acz-
ki z komórek NK CD56+CD16+CD3-: przewlek³a i agre-
sywna. Obie charakteryzuje limfocytoza komórek NK.
Forma agresywna wystêpuje przewa¿nie poni¿ej 40 roku
¿ycia, charakteryzuje siê jednoczesnym zaka¿eniem wiru-
sem EBV, organomegali¹, cytopeni¹ i z³ym rokowaniem.
Natomiast forma przewlek³a pojawia siê g³ównie po 60 ro-
ku ¿ycia przewa¿nie u mê¿czyzn, jest EBV-ujemna, a po-
jedyncza organomegalia wystêpuje tylko u 40% chorych;
rokowanie jest pomylne (28).
LICZEBNOÆ KOMÓREK NK
W PRZEWLEK£YCH CHOROBACH
LIMFOPROLIFERACYJNYCH Z LINII B
W przewlek³ych bia³aczkach i ch³oniakach z komórek
B generalnie liczba bezwzglêdna komórek NK w krwi ob-
wodowej chorych nieleczonych jest 2-3-krotnie wy¿sza
ani¿eli u zdrowych dawców i jest to ró¿nica istotna; naj-
bardziej zaznacza siê u chorych na ch³oniaka p³aszcza.
Wyj¹tek stanowi bia³aczka w³ochatokomórkowa, w której
liczba komórek NK w krwi obwodowej jest znamiennie
ni¿sza ni¿ u zdrowych dawców. Stwierdzono, ¿e u cho-
rych na PBL-B po leczeniu leukeranem liczebnoæ ko-
mórek NK w krwi obwodowej ulega normalizacji, nato-
miast po leczeniu analogami puryn, tj. 2CdA i fludarabin¹,
liczba komórek NK w krwi obwodowej jest istotnie ni¿-
sza ani¿eli u dawców, co najmniej przez kilka miesiêcy po
zakoñczeniu leczenia (dane w³asne niepublikowane).
Wiedza na temat udzia³u komórek NK w procesach
obrony organizmu przed patogenami rozszerza siê bardzo
szybko. W pracach z ostatnich miesiêcy podkrela siê
m.in. wystêpowanie dodatniej korelacji pomiêdzy aktyw-
noci¹ komórek NK a opornoci¹ narz¹dów przed prze-
rzutami. Komórki NK staj¹ siê w ten sposób istotnym ele-
mentem obrony przeciwnowotworowej, mog¹ likwidowaæ
nie tylko kr¹¿¹ce komórki nowotworowe, ale i zapobiegaæ
mikroprzerzutom (29).
Pimiennictwo
1. Farag S.S., Caligiuri M.A.: Human natural killer cell development and bio-
logy. Blood Rev. 2006, 20, 123-137.
2. Lanier L.L.: Natural killer cells: roundup. Immunol. Rev. 2006, 214, 5-8.
3. OConnor G.M., Hart O.M., Gardiner C.M.: Putting the natural killer cell
in its place. Immunology 2005, 117, 1-10.
4. Cooper M., Fehniger T.A., Fuchs A. i wsp.: NK cell and dendritic cells in-
teraction. Trends Immunol. 2004, 25, 47-52.
5. Kalinsky P., Maillard R.B., Giermasz A. i wsp.: Natural killer-dendritic cell
cross-talk in cancer immunotherapy. Expert Opin. Biol. Ther. 2005, 5,
1303-1315.
6. Grzywacz B., Kataria N., Sikora M. i wsp.: Coordinated acquisition of in-
hibitory and activating receptors and functional properties by developing
human natural killer cells. Blood 2006, 108, 3824-3833.
7. Ferlazzo G., Pack M., Thomas D. i wsp.: Distinct roles of IL-2 and IL-15
in human natural killer cell activation by dendritic cells from secondary
lymphoid organs. Proc. Natl. Acad. Sci. USA 2004, 101, 16606-16611.
8. Di Santo J.P., Vosshenrich C.A.J.: Bone marrow versus thymic pathwa-
ys of natural killer cell development. Immunol. Rev. 2006, 214, 35-46.
9. Cooper M.A., Fehniger T.A., Turner S.C. i wsp.: Human natural killer
cells: a unique innate immunoregulatory role for the CD56(bright) sub-
set. Blood 2001, 97, 3146-3151.
10. Ouyang Q., Baerlocher G., Vulto I., Lansdorp P.M.: Telomere length in hu-
man natural killer cell subsets. Ann. N Y Acad. Sci. 2007, 1106, 240-252.
11. Fehniger T.A., Cooper M.A., Nouvo G.J. i wsp.: CD56bright natural kil-
ler cells are present in human lymph nodes and are activated by T-cell
derived IL-2; a potential new link between adaptive and innate immu-
nity. Blood 2003, 101, 3052-3057.
12. Alter G., Altfelt M.: NK cell function in HIV-1 infection. Curr. Mol. Med.
2006, 6, 621-629.
13. Beider K., Nagler A., Wald O. i wsp.: Involvment of CXCR4 and IL-2 in
the homing and retention NK and NKT cells to the bone marrow and
spleen of NOD/SCID mice. Blood 2003, 102, 1951-1958.
14. Hsu K.C., Dupont B.: Natural killer cell receptors: regulating innate im-
mune responses to hematologic malignancy. Semin. Hematol. 2005,
103, 42-49.
15. Karre K.: Natural killer cell biology: relevance of missing self-recogni-
tion another aspects of basic natural killer cell biology for clinical appro-
aches. Hematology (EHA Educ Program) 2006, 2, 239-242.
16. Borrego F., Masilamani M., Marusina A.I. i wsp.: The CD94/NKG2 fa-
mily of receptors: from molecules and cells to clinical relevance. Immu-
nol. Res. 2006, 35, 263-278.
17. Sandusky M.M., Messmer B., Watzl C.: Regulation of 2B4 (CD244)-me-
diated Nk cell activation by ligand-induced receptor modulation. Eur. J.
Immunol. 2006, 36, 3268-3276.
18. Lee K.M., Forman J.P., McNerney M.E. i wsp.: Requirement of homo-
typic NK-cell interactions through 2B4 (CD244)/CD48 in the generation
of NK effector functions. Blood 2006, 107, 3181-3188.
19. Fischer L., Penack O., Gentilini C. i wsp.: The anti-lymohoma effect of
antibody-mediated immunotherapy is based on an increased degranu-
lation of peripheral blood natural killer (NK) cells. Exp. Hematol. 2006,
34, 753-759.
20. Alter G., Malefant J.M., Altfeld M.: CD107a as a functional marker for
the identification of natural killer cell activity. J. Immunol. Methods
2004, 294, 15-22.
21. Farag S.S., Fehniger T.A., Ruggeri L. i wsp.: Natural killer cell recep-
tors: new biology and insights into the graft-versus-leukemia effect. Blo-
od 2002, 100, 1935-1947.
22. Pende D., Spaggiari G., Marcenaro S. i wsp.: Analysis of the receptor-
ligand interactions In the NK-mediated lysis of freshly isolated myeloid
or lymphoblastic leukemia. Blood 105, 2005, 2066-2073.
23. Carbone E., Neri P., Mesuraca M.: HLA-class I, NKG2and natural cy-
totoxicity receptors regulate multiple myeloma cell recognition by NK
cells. Blood 2005, 105, 251-258.
24. Chiesa M., Romagnani C., Thiel A. i wsp.: Multidirectional interactions
are bridging human NK cells with dendritic cells during innate immune
responses. Blood 2006, 108, 3851-3858.
25. Voskobojnik I., Smyth M., Trapani J.: Perforin-mediated target-cell de-
ath and immune homeostasis. Nat. Rev. Immunol. 2006, 6, 940-952.
26. Fauriat C., Just-Landi S., Mallet F. i wsp.: Deficient expression of NCR
in NK cells from acute myeloid leukemia; evolution during leukemia tre-
atment and impact of leukemia cells in NCRdull phenotype induction.
Blood 2007, 109, 323-330.
27. Nolte-t Hoen E., Almeida C., Cohen N. i wsp.: Increased surveillance
of cells in mitosis by human NK cells suggests a novel strategy for li-
miting tumor growth and viral replication. Blood 2007, 109, 670-673.
28. Sokol L., Loughran T.: Large granular lymphocyte leukemia. Oncologist
2006, 11, 263-273.
29. Yang Q., Goding S., Hokland M., Basse P.: Antitumor activity of NK
cells. Immunol. Res. 2006, 36, 13-26.
Konflikt interesów: nie zg³oszono
119
Kopeæ-SzlêzakJ., Podstawka U.
Biologia komórek NK
Onkol. Pol. 2007, 10, 3: 115-119
ISSN 1505-6732
7OP3_04P.QXD 11/16/07 10:34 AM Page 119
Wyszukiwarka
Podobne podstrony:
MAKROELEMENTY, Matura, Biologia Matura, składniki chemiczne komórek
porównanie komórek prokariotycznej i eukariotycznej, Farmacja UMB, Biologia z genetyką, Ćwiczenia
kubica, biologia z elementami mikrobiologii, Ogólna charakterystyka komórek nowotworowychx
biologia-tkanka chrzestna kostna (2) , Tkanka chrzęstna, rodzaj tkanki łącznej podporowej cechujący
biologia, ZANIECZYSZCZENIA WODY2, Zanieczyszczenia wód, wprowadzone do wód naturalnych organizmy żyw
3. Wzrost, roznicowanie, starzenie sie i naturalna mierc komorek - pytania
Mikroelementy i makroelementy, Matura, Biologia Matura, składniki chemiczne komórek
SKLAD CHEMICZNY KOMOREK ORAZ WIAZANIA I ODDZIALYWANIA CHEMICZNE, Biologia - mapy
44. Naturalne i antropogeniczne zakłócenia sukcesji w środowiskach wodnych, studia-biologia, Opracow
Separacja komórek zwierzęcych w gradiencie gęstości-Biotechnologia, dokumenty, anatomia i biologia o
05 tensegralnosc komorek, Biologia Komórki
2 Naturalne uwarunkowania biologiczneid 21054
Dobór naturalnydod, !Nauka! Studia i nie tylko, Biologia, egzamin biol~, egzamin biol
Biologia część V Różne typy komórek
Biologia komórki adhezja, komunikacja komórek, macierz międzykomórkowa
więcej podobnych podstron