
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Jadwiga Kuszerska
Planowanie i prowadzenie badań laboratoryjnych
322[14].Z2.04
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
lek. wet. Katarzyna Nowakowska
lek. wet. Jan Pliszek
Opracowanie redakcyjne:
mgr inż. Jadwiga Kuszerska
Konsultacja:
mgr inż. Krystyna Kwestarz
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 322[14].Z2.04
,,Planowanie i prowadzenie badań laboratoryjnych”, w modułowym programie nauczania dla
zawodu technik weterynarii.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1.
Wprowadzenie
3
2.
Wymagania wstępne
5
3.
Cele kształcenia
6
4.
Materiał nauczania
6
4.1.
Zasady bhp oraz organizacja laboratorium analitycznego
w diagnostyce weterynaryjnej
6
4.1.1.
Materiał nauczania
12
4.1.2.
Pytania sprawdzające
12
4.1.3.
Ć
wiczenia
13
4.1.4.
Sprawdzian postępów
13
4.2.
Diagnostyka weterynaryjna. Badanie krwi, moczu i treści żwacza
15
4.2.1.
Materiał nauczania
15
4.2.2.
Pytania sprawdzające
20
4.2.3.
Ć
wiczenia
21
4.2.4.
Sprawdzian postępów
22
4.3.
Diagnostyka weterynaryjna. Badania parazytologiczne
24
4.3.1.
Materiał nauczania
24
4.3.2.
Pytania sprawdzające
26
4.3.3.
Ć
wiczenia
27
4.3.4.
Sprawdzian postępów.
28
4.4.
Diagnostyka weterynaryjna. Badania mikrobiologiczne, serologiczne.
Badanie nasienia
29
4.4.1.
Materiał nauczania
29
4.4.2.
Pytania sprawdzające
35
4.4.3.
Ć
wiczenia
35
4.4.4.
Sprawdzian postępów
36
5.
Sprawdzian osiągnięć
37
6.
Literatura
42
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1.
WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o planowaniu i prowadzeniu badań
laboratoryjnych.
W poradniku zamieszczono:
−
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane,
abyś bez problemów mógł korzystać z poradnika,
−
cele kształcenia – wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
−
materiał nauczania – wiadomości teoretyczne niezbędne do opanowania treści jednostki
modułowej,
−
zestaw pytań, abyś mógł sprawdzić, czy już opanowałeś określone treści,
−
ć
wiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
−
sprawdzian postępów,
−
sprawdzian osiągnięć, przykładowy zestaw zadań. Zaliczenie testu potwierdzi
opanowanie materiału całej jednostki modułowej,
−
literaturę.
Schemat układu jednostek modułowych
322[14].Z2.03
Udzielanie pierwszej
pomocy i asystowanie
przy zabiegach
322[14].Z2.02
Posługiwanie się sprzętem
i urządzeniami
weterynaryjnymi
322[14].Z2.04
Planowanie i prowadzenie
badań laboratoryjnych
322[14].Z2
Choroby zwierząt
322[14].Z2.01
Rozpoznawanie chorób

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
2.
WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
—
korzystać z różnych źródeł informacji naukowo-technicznej,
—
korzystać z przepisów prawa żywnościowego,
—
korzystać z sieci Internet,
—
określać skutki błędnych rozwiązań i je eliminować,
—
obsługiwać podstawowe programy komputerowe,
—
opracowywać i prezentować projekt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
3.
CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej, powinieneś umieć:
−
zastosować przepisy bezpieczeństwa i higieny pracy w laboratorium,
−
określić znaczenie badań laboratoryjnych w weterynarii,
−
zaprojektować i zorganizować pomieszczenia laboratoryjne,
−
zaplanować wyposażenie laboratorium,
−
posłużyć się podstawową aparaturą i sprzętem laboratoryjnym,
−
wymyć i wyjałowić szkło laboratoryjne,
−
pobrać materiały do badań laboratoryjnych, zabezpieczyć i opisać je,
−
scharakteryzować i przeprowadzić podstawowe badania morfologiczne krwi,
−
ocenić właściwości fizyczne moczu i przeprowadzić analizę chemiczną,
−
przeprowadzić badania koproskopowe,
−
scharakteryzować właściwości fizykochemiczne treści żwacza,
−
scharakteryzować podstawowe metody diagnostyki laboratoryjnej chorób pasożytniczych
zwierząt,
−
scharakteryzować metody badań bakteriologicznych,
−
przeprowadzić podstawowe badania bakteriologiczne,
−
scharakteryzować najważniejsze metody badań wirusologicznych oraz zasady pracy
obowiązujące podczas ich wykonywania,
−
scharakteryzować odczyny serologiczne i ich znaczenie w wykrywaniu chorób zakaźnych
u zwierząt,
−
posłużyć się testami do badań laboratoryjnych,
−
dokonać oceny wstępnej nasienia zwierząt oraz wykonać badanie szczegółowe,
−
wykonać badanie cytologiczne pochwy,
−
ustalić optymalny termin krycia samicy,
−
scharakteryzować znaczenie zwierząt laboratoryjnych w diagnostyce chorób zakaźnych,
−
zorganizować chów zwierząt laboratoryjnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
4.
MATERIAŁ NAUCZANIA
4.1.
Zasady bhp oraz organizacja laboratorium analitycznego
w diagnostyce weterynaryjnej
4.1.1.
Materiał nauczania
Przepisy bezpieczeństwa i higieny pracy w laboratorium analitycznym
Praca w laboratorium wymaga szczególnego przestrzegania zasad bezpieczeństwa
i higieny. W tym zakresie obowiązują odpowiednie przepisy, które określają zasady ogólne
oraz instrukcje szczegółowe dotyczące sposobu posługiwania się aparaturą specjalną oraz
wykonywania niektórych czynności. Zasady ogólne określone są w sposób następujący:
a)
wszelkie prace laboratoryjne wykonuje się w odpowiednim ubraniu ochronnym, a prace
niebezpieczne dodatkowo przy użyciu specjalnego sprzętu (okulary, rękawice gumowe,
maski przeciwgazowe itp.),
b)
przystępując do wykonywania analiz należy posługiwać się aparaturą i sprzętem oraz
znać właściwości stosowanych odczynników chemicznych,
c)
wszelkie operacje, w czasie których wydzielają się szkodliwe dla zdrowia gazy i pary, np.
tlenki azotu, chlorowodór, siarkowodór i dwutlenek siarki, należy wykonywać pod
wyciągiem,
d)
nie wolno posługiwać się uszkodzoną aparaturą lub uszkodzonym sprzętem
laboratoryjnym,
e)
nie wolno zostawiać bez nadzoru palących się palników i włączonej aparatury
elektrycznej,
f)
w miejscu pracy należy zachowywać bezwzględną czystość, posiłki spożywać tylko
w specjalnie do tego celu wydzielonym miejscu,
g)
w przypadku wystąpienia pożaru należy umieć posłużyć się sprzętem przeciwpożarowym,
a w razie niemożliwości stłumienia pożaru należy natychmiast wezwać straż pożarną,
h)
ż
adnych substancji nie należy badać na smak;
i)
nie należy pochylać się nad naczyniem i nie należy wdychać oparów substancji,
j)
przy przelewaniu i ogrzewaniu cieczy nie nachylamy się nad nimi, ponieważ mogą
wyprysnąć i trafić do oka lub poparzyć twarz,
k)
ogrzewanie cieczy w probówkach należy wykonywać w ten sposób, że wylot probówki
skierowujemy tak, aby ciecz przy ewentualnym wypryśnięciu nie oblała nikogo
znajdującego się w laboratorium,
l)
należy znać przepisy bhp, a w razie nieszczęśliwych wypadków umieć udzielić pierwszej
pomocy poszkodowanemu.
Zasady udzielania pierwszej pomocy w nieszczęśliwych wypadkach
Skaleczenia. Pomoc polega na ewentualnym zatamowaniu upływu krwi, oczyszczaniu rany,
jej zdezynfekowaniu i nałożeniu opatrunku z wysterylizowanej gazy i bandaża. Dezynfekcji
rany dokonuje się za pomocą wody utlenionej. Przy poważniejszych skaleczeniach należy
zatamować krwotok za pomocą opaski uciskowej powyżej skaleczenia przy krwotoku
tętniczym a poniżej przy żylnym. Zamiast opaski można użyć węża gumowego i natychmiast
udać się do lekarza.
Oparzenia. Wyróżnia się oparzenia termiczne lub spowodowane roztworami stężonych
kwasów lub zasad. W przypadku lżejszych oparzeń termicznych stosuje się okład ze
stężonego alkoholu etylowego, natomiast przy cięższych oparzeniach należy stosować okład

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
z 5% roztworu manganianu potasu. Przy oparzeniach kwasami stosuje się nasycony roztwór
wodorowęglanu sodu, a przy oparzeniach zasadami 1% roztwór kwasu octowego.
Stłuczenia. Na miejsca stłuczone stosuje się zimne okłady w postaci czystej ściereczki
zwilżonej zimną wodą lub stosuje się przyłożenie przedmiotu metalowego o
odsłoniętejgładkiej powierzchni.
Zaprószenia oczu. Przy zaprószeniach oczu przemywa się je 2% roztworem kwasu
borowego. W przypadku zanieczyszczenia oczu chemikaliami (kwasy, zasady, alkohol,
aceton) oczy należy niezwłocznie przemyć dużą ilością wody.
Zatrucia. W przypadku zatruć gazami poszkodowanego umieszcza się przy otwartym oknie
zwiększając dostęp świeżego powietrza i następnie wzywa się lekarza.
Gdy jakaś substancja dostanie się do ust, należy natychmiast wypłukać usta wodą. Przy
dostaniu się substancji do żołądka należy ją zobojętnić 1% roztworem kwasu octowego lub
cytrynowego w przypadku zasady oraz papką z tlenku magnezu rozpuszczonego w wodzie,
lub alusalem w przypadku kwasu i natychmiast należy udać się do lekarza.
Omdlenia są powodowane odpływem krwi z naczyń krwionośnych mózgu. W tym przypadku
chorego układa się poziomo, rozluźnia ubranie, spryskuje twarz zimna wodą i podaje do
wąchania 3% roztwór amoniaku.
Wymienione zasady są wystarczające w przypadkach lekkich obrażeń. We wszystkich
poważniejszych wypadkach po udzieleniu pierwszej pomocy, należy niezwłocznie wezwać
lekarza lub odwieźć poszkodowanego do szpitala.
Wyposażenie pomieszczeń laboratoryjnych
W laboratorium chemicznym powinny znajdować się:
1)
stoły laboratoryjne różnej konstrukcji z półkami do częściej używanych odczynników
oraz szafkami i szufladami do przechowywania sprzętu
2)
szafa wyciągowa (dygestorium) ze sprawnie działającym wentylatorem,
3)
półki do sprzętu ogólnego użytku i rzadziej stosowanych odczynników,
4)
specjalne stołki laboratoryjne,
5)
stoły przy ścianach z suszarkami, piecami, chłodziarkami, pompą próżniową, itp.,
W laboratorium mikrobiologicznym powinny być wyodrębnione pomieszczenia
(np. pożywkarnia, pracownia mikrobiologiczna, sterylizacja sucha). Laboratorium musi być
wyposażone w instalacje: wodno-ściekową, gazową, elektryczną, często także sprężonego
powietrza oraz próżniową. Przewody instalacji mają określone zabarwienie:
−
dla wody – zielony.
−
dla gazu – żółty.
−
dla próżni – szary.
−
dla powietrza – błękitny.
−
dla pary – czerwony.
Ponadto, w laboratorium powinien znajdować się następujący sprzęt przeciwpożarowy:
koce azbestowe, gaśnice wraz ze szczegółową instrukcją obsługi oraz apteczka pierwszej
pomocy z odpowiednim wyposażeniem. Gaśnice to najczęściej: proszkowe, śniegowe
i pianowe.
Organizacja stanowiska pracy
Zasadniczym miejscem pracy jest stół laboratoryjny o wymiarach 100–120 cm długości,
70–80 cm szerokości i 80–90 cm wysokości. Blaty stołów powinny być z laminatów lub
wykładane płytkami ceramicznymi. Stół powinien być wyposażony w półkę, na której można
ustawić butelki z odczynnikami. W stole powinna być szafka i szuflada do przechowywania
sprzętu laboratoryjnego specyficznego do konkretnej metodyki badawczej W szufladach
powinny znajdować się naczynia szklane długie i cienkie, takie jak pipety, biurety, rurki oraz

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
bibuła i korki. Każdy stół powinien być wyposażony w zawór wodociągowy ze studzienką
ś
ciekową, kurek gazowy oraz uziemione gniazdko sieci elektrycznej małej mocy.
Instalacja wodno-ściekowa. Instalacja składa się z przewodów rurowych doprowadzających
wodę bieżącą, z zaworów służących do czerpania wody, zlewów i przewodów rurowych
odprowadzających ścieki. Zawór czerpalny jest tak uformowany, aby zapobiec zsuwaniu
nałożonego węża gumowego. Pod każdym zaworem czerpalnym jest zlew, połączony
z przewodami rurowymi odprowadzającymi ścieki. Zlewy i przewody muszą być wykonane
z kamionki kwasoodpornej lub porcelany. Zlew jest połączony z rurą odprowadzającą ścieki
za pomocą syfonu. Zabezpiecza to przewód kanalizacyjny przed zanieczyszczeniami oraz
przed przedostawaniem się do laboratorium gazów o nieprzyjemnym zapachu z sieci
kanalizacyjnej. Do zlewów nie należy wrzucać ciał stałych: papierków, bibuły, kawałków
szkła oraz piasku.
Instalacja gazowa. Instalacja powinna być wykonana z grubościennych rur stalowych, dobrze
uszczelnionych. Końcówki kurków do gazu muszą mieć specjalne zakończenia, które
ułatwiają nakładanie wężów gumowych i zapobiegają ich zsuwaniu. Palnik gazowy należy
połączyć z kurkiem za pomocą węża gumowego o długości 50-100cm.
Instalacja elektryczna. W laboratorium powinny znaleźć się dwa rodzaje instalacji:
jednofazowa o napięciu 220V oraz trójfazowa instalacja siły o napięciu 400 V. Sieć 230 V
jednofazowa służy do oświetlania, ogrzewania, poruszania mieszadełek oraz zasilania
niektórych urządzeń. Ze względu na bezpieczeństwo każde gniazdko powinno być
wyposażone w kołek ochronny, a przewody służące do podłączania grzejników elektrycznych,
silników i innych urządzeńpowinny być czterożyłowe ze stykami ochronnymi. Sieć trójfazowa
służy do włączania urządzeń o dużej mocy takich jak destylarki, pompy próżniowe, sprężarki.
Wyciągi. Większość substancji, których używa się w badaniach chemicznych jest trująca.
Wiele z nich wydziela trujące opary i gazy. Aby uniknąć zatruć i aby w laboratorium była
czysta atmosfera należy pomieszczenie wyposażyć w szafę wyciągową ze sprawnie
działającym wentylatorem (dygestorium) Jest to oszklona szafa z otwieranymi oknami, które
są przesuwane za pomocą specjalnego urządzenia w kierunku pionowym. Szafa musi być
wyłożona wykładziną odporną na chemikalia. Ponadto muszą być do niej podłączone
przewody z wodą, gazem i przewody do odprowadzania cieczy oraz instalacja elektryczna
zarówno oświetleniowa jak i siłowa.
Aparatura i sprzęt laboratoryjny
W skład aparatury wchodzą: suszarki, łaźnie wodne, piece do spalań, wagi, kolorymetry,
chromatografy, lupy, wirówki, homogenizatory, wstrząsarki, cieplarki, suszarki, sterylizatory,
autoklaw, mikroskopy, spektrofotometry, pehametry, analizator hematologiczny, analizator
moczu itp. Sprzęt laboratoryjny dzieli się na sprzęt: metalowy, drewniany, szklany
i porcelanowy.
Sprzęt metalowy to:
1)
statywy służące do umieszczenia w nich biurety,
2)
łapy (czteropalczaste, okrągłe, pryzmatyczne, pojedyncze lub podwójne) służące do
przytrzymywania różnych naczyń i sprzętu szklanego).
3)
łączniki służące do łączenia łap ze statywami,
4)
pierścienie służące do umieszczenia w nich lejków lub innego sprzętu.
5)
trójnogi stosowane przy ogrzewaniu,
6)
trójkąty służące do umieszczania w nich tygli podczas prażenia,
7)
szczypce służące do wyjmowania tygli z pieców i naczyń,
8)
inne: palniki, pęsety, ezy i igły do posiewów, ściskacze, itp.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Sprzęt drewniany to: podstawki do kolb kulistych i parownic, podstawki do probówek
i pipet, łapki (szczypce) do probówek, deski z kołkami do suszenia naczyń szklanych,
podstawki do sączenia.
Sprzęt szklany dzieli się na:
1)
ogólnego przeznaczenia,
2)
naczynia i sprzęt szklany odpowiednio wyskalowany tzw. miarowy,
3)
naczynia i sprzęt szklany o przeznaczeniu specjalnym,
Sprzęt ogólnego przeznaczenia to np.: probówki, zlewki, cylindry, kolby stożkowe, kolby
płaskie okrągło denne, lejki zwykłe oraz z dnem sitowym, płytki Petriego, szkiełka zegarowe,
itp. znajduje liczne zastosowanie w następujących pracach laboratoryjnych:
−
probówki do reakcji chemicznych jakościowych i badań mikrobiologicznych,
−
płytki Petriego do posiewów mikrobiologicznych,
−
zlewki do rozpuszczania substancji stałych w cieczach, mieszania różnych substancji,
z ewentualnym podgrzewaniem, zagęszczaniem, itp.,
−
cylindry do pomiaru, np. gęstości za pomocą aerometrów,
−
kolby stożkowe do miareczkowania badanych roztworów za pomocą roztworów
mianowanych, tj. o ściśle określonym stężeniu,
−
kolby okrągło denne stanowią elementy zestawów destylacyjnych,
−
kolby płaskodenne stanowią elementy zestawów destylacyjnych, w których zawartości
kolb ogrzewa się płomieniem palnika,
−
lejki do przenoszenia roztworów do naczyń o wąskich szyjkach (butelki, kolby miarowe),
do sączenia roztworów lub zawiesin przez sączki z bibuły filtracyjnej,
−
lejki z dnem sitowym do sączenia roztworów lub zawiesin przez sączki z bibuły
filtracyjnej,
−
szkiełka zegarowe do sporządzania naważek substancji stałych, zamykania naczyń, np.
zlewki, kolby stożkowej,
−
szkiełka podstawowe (przedmiotowe) i nakrywkowe do wykonywania preparatów do
badań mikroskopowych,
−
kroplomierze do dozowania niewielkich ilości płynów, jak. np. do wskaźników
barwnych,
−
bagietki do mieszania zawartości zlewek podczas rozpuszczania substancji stałych,
−
krystalizatory do zagęszczania stężonych roztworów w celu wykrystalizowania substancji
rozpuszczonej,
−
butelki do przechowywania odczynników chemicznych w postaci roztworów, przy czym
do alkaliów stosuje się butelki zamykane korkami gumowymi, a do kwasów i większości
innych roztworów stosuje się butelki zamykane doszlifowanymi korkami szklanymi.
Szkło miarowe takie jak: pipety, biurety, kolby, cylindry o zróżnicowanej pojemności,
odpowiednio wyskalowane znajduje różnorodne zastosowania w następujących pracach
laboratoryjnych:
−
pipety do dokładnego odmierzania niewielkich objętości roztworów,
−
biurety do miareczkowania,
−
kolby do sporządzania roztworów mianowanych, dokonywanie rozcieńczeń roztworów
stężonych do bardziej rozcieńczonych,
−
cylindry do stosunkowo dokładnego odmierzania większych objętości roztworów.
Naczynia i sprzęt specjalnego przeznaczenia taki jak: kolby destylacyjne z tubusem,
chłodnice wodne i powietrzne, deflegmatory, kolby ssawkowe, pompki wodne, rozdzielacze,
eksykatory, naczyńka wagowe, sączki ze szkła spiekanego, przedłużacze (końcówki) do
chłodnic, itp. znajduje zastosowanie w następujących pracach laboratoryjnych:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
−
kolby destylacyjne z tubusem do szybkich destylacji bez stosowania deflegmatorów,
−
kolby ssawkowe do sączenia pod zredukowanym ciśnieniem,
−
chłodnice powietrzne do procesów ogrzewania bez odparowywania,
−
chłodnice Liebiga i kulkowe do skraplania oparów destylacyjnych,
−
przedłużacze do chłodnic do odprowadzania skroplin oparów łatwo lotnych lub skroplin
wymagających kontaktu z roztworem w odbieralniku,
−
deflegmatory są to nasadki na kolby destylacyjne, zawierające pewne frakcje oparów do
kolb destylacyjnych,
−
pompki wodne do wytwarzania zredukowanego ciśnienia w czasie sączenia, destylacji,
−
eksykatory do chłodzenia wysuszonych naważek przed ich ważeniem,
−
naczynka wagowe do dokładnego odważania odczynników lub próbek,
−
rozdzielacze do wytrząsania i ekstrakcji układów dwufazowych a następnie ich rozdział,
−
sączki ze szkła spiekanego do sączenia roztworów lub zawiesin w przypadkach, gdy nie
jest możliwe użycie bibuły filtracyjnej ze względu na jej organiczny charakter.
Sprzęt porcelanowy taki jak: parownice, tygle, lejki sitowe, moździerze, łyżki i łopatki,
wkładki do eksykatorów znajduje zastosowanie w następujących pracach laboratoryjnych:
−
parownice do odparowania cieczy z roztworów i do stapiania substancji pochodzenia
organicznego,
−
tygle do spalania sączków i prażenia osadów oraz do stapiania,
−
lejki sitowe do odsączania osadów pod próżnią,
−
moździerze do proszkowania substancji stałych,
−
łyżki i łopatki do pobierania substancji stałych i mazistych,
−
stosuje się także wkładki do eksykatorów – porcelanowe krążki z kilkoma dużymi
otworami lub małymi otworami.
Mycie naczyń i sprzętu szklanego
Wszystkie naczynia i sprzęt szklany, używane w pracach analitycznych powinny być
idealnie czyste, gdyż jest to niezbędne do uzyskiwania dokładnych wyników analiz. Mycie
wykonuje się bezpośrednio po ich użyciu. Czystość naczyń można sprawdzić opłukując je
wodą. Jeżeli woda spływa idealnie, nie pozostawiając kropel, dowodzi to czystości
powierzchni naczyń, natomiast zatrzymanie kropel wody świadczy o zanieczyszczeniach
powierzchni.
Metody mycia naczyń i sprzętu
1)
Mycie wodą. Wyróżnia się dwa rodzaje mycia:
a)
mechaniczne usunięcie resztek osadów i nalotów ze ścianek za pomocą szczotki,
b)
mycie gorącą lub ciepłą wodą z dodatkiem mydła, sody lub innego środka
zmiękczającego.
2)
Mycie kwasami. W przypadku zanieczyszczeń wodorotlenkami, tlenkami czy węglanami
przeprowadza się mycie technicznym kwasem solnym. W przypadku zanieczyszczeń
związkami nieorganicznymi i organicznymi stosuje się kwas siarkowy (VI). Przy
usuwaniu materii organicznej należy zadziałać kwasem na gorąco. Nie należy używać
kwasu siarkowego do usuwania baru, ołowiu i strontu, gdyż ich siarczany są
nierozpuszczalne w wodzie. Kwasem azotowym (V) myje się na zimno jak i na gorąco
przy zanieczyszczeniach organicznych.
3)
Mycie nadmanganianem (VII) potasu. Do usuwania zanieczyszczeń organicznych, np.
tłuszczów, stosuje się 5% roztwór nadmanganianu potasu z dodatkiem 5% kwasu
siarkowego (VI) lub zasady sodowej albo potasowej. Do wstępnie umytego naczynia
wlewa się roztwór nadmanganianu i cienkim strumieniem kwas siarkowy w ilości 5 cm
3
na 100 cm
3
roztworu nadmanganianu. Mieszanina ogrzewa się do temperatury około 60
0

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
C. Po umyciu nadmanganianem potasu występuje na ściankach naczynia brązowy nalot,
który usuwa się roztworem kwasu szczawiowego lub siarczanu sodu.
4)
Mycie mieszaniną chromową (tzw. chromianką). Mieszanina chromowa bardzo silnie
działa na tkanki żywych organizmów. Mieszaninę chromową przygotowuje się ze
stężonego kwasu siarkowego (VI) i dwuchromianu (VI) potasu lub sodu. Świeżo
sporządzona mieszanina chromowa ma zabarwienie ciemnopomarańczowe. Najlepszy
efekt uzyskuje się wlewając mieszaninę do mytych naczyń lub zanurzając myty sprzęt
szklany w mieszaninie, np. pipety w wąskim, wysokim cylindrze. Należy bezwzględnie
zastosować bezpieczeństwo podczas używania chromianki. Nie należy zasysać jej ustami,
lecz za pomocą pompki wodnej. Naczynia i sprzęt po umyciu chromianką płucze się
najpierw kilkakrotnie wodą z kranu i ostatecznie jeden raz wodą destylowaną.
Suszenie naczyń szklanych
Do suszenia stosuje się deski z kołkami, na które zawiesza się umyte naczynia. Suszenie
można przyspieszyć przez zastosowanie strumienia zimnego lub gorącego powietrza.
Niekiedy można suszyć w suszarkach laboratoryjnych w temp. 90 -115
0
C.
Mycie i wyjaławianie szkła i sprzętu do badań mikrobiologicznych. Wyjaławianie podłóż
mikrobiologicznych
Szkło i sprzęt laboratoryjny używane w analizie mikrobiologicznej powinny być
bezwzględnie czyste i wyjałowione. W tym celu należy myć je w gorącej wodzie
z detergentem lub kolejno roztworem alkalicznym (np. roztwór 0,125% (m/m) węglanu sodu)
i rozcieńczonym kwasem (np. 0,1 molowy roztwór kwasu solnego), a następnie starannie
płukać w bieżącej, gorącej wodzie wodociągowej i w zimnej destylowanej. Czyste
i wysuszone szkło oraz czysty i wysuszony sprzęt poddaje się wyjaławianiu suchym gorącym
powietrzem przez godzinę w temperaturze 170 -175
0
C lub (w przypadku pakowania np.
w folię aluminiową) przez 2 godziny w temp. 160
0
C w sterylizatorze. Podłoża
mikrobiologiczne sterylizuje się z parą wodną w autoklawach w temperaturze 121
0
C
w określonym czasie (ok. 20 minut). Podczas sterylizacji należy przeprowadzać kontrolę jej
skuteczności. Tylko przez stosowanie odpowiednich wskaźników można uzyskać pewność, że
proces sterylizacji przebiegał prawidłowo. Wskaźniki do kontroli dzielą się na:
−
fizyczne (mechaniczne),
−
chemiczne,
−
biologiczne.
Wskaźniki fizyczne rejestrują pomiary temperatury, ciśnienia i czasu. Wskaźniki
chemiczne są w postaci taśm, pasków, rurek zawierających substancje chemiczne zmieniające
barwę lub stan skupienia, jeśli osiągnięte zostały odpowiednie parametry sterylizacji.
Wskaźniki biologiczne zawierają spory bakterii wysoce oporne na czynniki sterylizacji.
Wyróżnia się następujące wskaźniki biologiczne:
a)
w sterylizacji z parą wodną zawierają minimum 1x10
5
spor Bacillus stearothermophilus,
b)
w sterylizacji suchym gorącym powietrzem zawierają minimum 1x10
5
spor Bacillus
subtilis.
Wskaźniki biologiczne jako jedyne są wiarygodną kontrolą skuteczności sterylizacji.
W analizach mikrobiologicznych duże znaczenie ma czystość rąk. Zdecydowanie większość
zakażeń jest przenoszona przez zanieczyszczone ręce, dlatego też prawidłowa higiena rąk jest
najprostszym i najbardziej efektywnym zabiegiem ograniczającym szerzenie się zakażeń.
Florę drobnoustrojową skóry rąk dzieli się na florę przejściową i florę stałą. Flora przejściowa
jest luźno związana ze skórą, do której zalicza się patogenne szczepy drobnoustrojów
pochodzące ze środowiska. Flora stała wykazująca niski stopień patogenności namnaża się
głównie w gruczołach łojowych i potowych i jest trudna do usunięcia z zastosowaniem
ś
rodków mechanicznych. Aby wykonywać badania mikrobiologiczne należy przeprowadzić

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
dekontaminację rąk za pomocą środków myjąco-dezynfekujących. W każdym laboratorium
powinna znajdować się instrukcja mycia i dezynfekcji rąk.
4.1.2.
Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Jakie są zasady bezpieczeństwa i higieny pracy w laboratorium chemicznym
i mikrobiologicznym?
2.
Na czym polega udzielanie pierwszej pomocy przy skaleczeniach?
3.
Na czym polega udzielanie pierwszej pomocy przy oparzeniach?
4.
Na czym polega udzielanie pierwszej pomocy przy stłuczeniach?
5.
Na czym polega udzielanie pierwszej pomocy przy zaprószeniu oczu?
6.
Na czym polega udzielanie pierwszej pomocy przy zatruciu?
7.
Na czym polega udzielanie pierwszej pomocy przy omdleniu?
8.
Jak wyposażone jest stanowisko pracy w laboratorium?
9.
Jaka jest przykładowa aparatura w laboratorium chemicznym i mikrobiologicznym?
10.
Jaki jest przykładowy sprzęt w laboratorium chemicznym i mikrobiologicznym?
11.
Na czym polega mycie i wyjaławianie naczyń szklanych do analiz chemicznych
i mikrobiologicznych?
12.
Jaki ma wpływ czystość rąk na jakość analiz mikrobiologicznych?
13.
W jaki sposób sprawdza się skuteczność sterylizacji naczyń szklanych i podłóż
mikrobiologicznych?
4.1.3.
Ćwiczenia
Ćwiczenie 1
Wykonaj proces wyjaławiania przykładowych laboratoryjnych naczyń szklanych gorącym
powietrzem w sterylizatorze. Skontroluj skuteczność sterylizacji.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
włożyć naczynia do sterylizatora,
2)
przeanalizować procedurę sterylizacji szklanych naczyń,
3)
wyjąć z opakowania foliowego Sporal S (wskaźnik biologiczny),
4)
sprawdzić zadaną temperaturę sterylizatora (170
0
C) i ustawić czas właściwej sterylizacji
(1 godzina),
5)
ułożyć Sporal S na płytce Petriego,
6)
włożyć naczynia szklane do sterylizatora,
7)
włączyć sterylizator,
8)
wyjąć po skończonej sterylizacji jałową pęsetą Sporal S i włożyć do probówki
zawierającej bulion,
9)
probówkę inkubować 7 dni w temp. 37
0
C,
10)
ocenić po 7 dniach czy w probówce pojawił się wzrost (zmętnienie lub kożuch),
11)
zinterpretować wyniki:
−
czy zawarte w Sporalu S spory Bacillus subtilis zginęły,
−
czy sterylizator jest sprawny i wskazania termometru pokazują rzeczywistą
temperaturę w komorze sterylizatora,
12)
zaprezentować uzyskane wyniki na forum grupy.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
Wyposażenie stanowiska pracy:
−
sterylizator, cieplarka,
−
procedura sterylizacji naczyń szklanych,
−
wskaźnik biologiczny Sporal S,
−
naczynia szklane,
−
pęseta,
−
probówka z bulionem,
−
rękawiczki jednorazowe, fartuch ochronny,
−
tekst przewodni.
Ćwiczenie 2
Sporządź mieszaninę chromową – chromiankę do mycia szklanych naczyń używanych
w analizie mikrobiologicznej. Pamiętaj o zachowaniu zasad bezpieczeństwa podczas
wykonywanych czynności.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeczytać metodykę wykonania,
2)
odważyć 15 gramów dwuchromianu potasu w zlewce o poj. 500 cm
3
i przenieść
ilościowo do kolby stożkowej (popłukując 50 cm
3
wody destylowanej),
3)
rozpuścić odczynnik w wodzie (zastosować ruch kołowy),
4)
dodać (cylindrem) 450 cm
3
stężonego kwasu siarkowego (uwaga! reakcja silnie
egzotermiczna!),
5)
zostawić całość do ochłodzenia
6)
przelać gotową chromiankę do butelki szklanej zamykanej doszlifowanym korkiem.
Wyposażenie stanowiska pracy
−
sprzęt: waga techniczna, kolba stożkowa poj. 500 cm
3
, butelka szklana z doszlifowanym
korkiem poj. 500 cm
3
, cylindry miarowe o poj. 50 cm
3
i 500 cm
3
, zlewki poj. 50 cm
3
i 1000 cm
3
),
−
odczynniki: dwuchromian potasu (VI) czysty lub techniczny, kwas siarkowy (VI) stężony
techniczny,
−
metodyka badania,
−
rękawiczki jednorazowe, fartuch ochronny, okulary ochronne,
−
wyciąg,
−
zeszyt.
4.1.4.
Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wyjaśnić ogólne zasady bezpieczeństwa i higieny pracy w laboratorium
chemicznym i mikrobiologicznym?
2)
wyjaśnić, na czym polega udzielanie pierwszej pomocy przy
skaleczeniach?
3)
wyjaśnić, na czym polega udzielanie pierwszej pomocy przy
oparzeniach?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
4)
wyjaśnić, na czym polega udzielanie pierwszej pomocy przy
stłuczeniach?
5)
wyjaśnić, na czym polega udzielanie pierwszej pomocy przy
zaprószeniu oczu?
6)
wyjaśnić, na czym polega udzielanie pierwszej pomocy przy zatruciu?
7)
wyjaśnić, na czym polega udzielanie pierwszej pomocy przy omdleniu?
8)
wyjaśnić, wyposażenie stanowiska pracy w laboratorium?
9)
wymienić przykładową aparaturę w laboratorium chemicznym
i mikrobiologicznym?
10)
wymienić
przykładowy
sprzęt
w
laboratorium
chemicznym
i mikrobiologicznym?
11)
wyjaśnić, na czym polega mycie i wyjaławianie naczyń szklanych do
analiz chemicznych i mikrobiologicznych?
12)
wyjaśnić wpływ czystości rąk na jakość analiz mikrobiologicznych?
13)
wyjaśnić sposób sprawdzania skuteczności sterylizacji naczyń
szklanych i podłóż mikrobiologicznych?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
4.2.
Diagnostyka weterynaryjna. Badanie krwi, moczu, treści
żwacza
4.2.1.
Materiał nauczania
Znaczenie badań laboratoryjnych w diagnostyce chorób zwierząt
Diagnostyczne badania lekarskie obejmują badania podstawowe i dodatkowe. Do
podstawowych badań należy przedmiotowe badanie chorego zwierzęcia, a do dodatkowych
pomocnicze badania laboratoryjne. Wykonywanie ich jest wskazane:
−
w celu właściwego leczenia zwierząt,
−
w masowych zachorowaniach zwierząt gdzie w celu rozpoznania choroby, a zwłaszcza
wykluczenia choroby zakaźnej, należy zbadać kilka zwierząt aby ustalić postępowanie
zapobiegawcze i leczenie.
Badania hematologiczne
Dzięki badaniom krwi i moczu diagnozuje się choroby nerek, wątroby, tarczycy, trzustki,
nowotwory, ropomacicze i wiele innych schorzeń. Krew stanowi część środowiska
wewnątrzustrojowego najbardziej dostępną badaniu. Jest uniwersalnym łącznikiem pomiędzy
wszystkimi komórkami organizmu. Dostarcza tlen, substancje odżywcze, hormony i enzymy
niezbędne do prawidłowej funkcji każdej komórki. Chroni przed wniknięciem do organizmu
chorobotwórczych mikroorganizmów. Dzięki unikalnej właściwości krzepnięcia krwi po
uszkodzeniu tkanek tworzy się skrzeplina czopująca otwór w naczyniu. W składzie krwi
wyróżniamy krwinki czerwone i białe, płytki krwi oraz płynne osocze. Przenośniki tlenu, czyli
erytrocyty (krwinki czerwone, inaczej czerwone ciałka krwi) mają barwę czerwoną
uzależnioną od zawartej w nich hemoglobiny - substancji, która potrafi wiązać i oddawać tlen
w odpowiednim momencie. Ponieważ jest ich najwięcej, stąd krew przyjmuje barwę
czerwoną – jest to kolor krwi utlenowanej (tętniczej). Po oddaniu tlenu kolor krwi zmienia się
na ciemnoczerwony (taką krew nazywamy żylną). Drugim ważnym elementem krwi są
leukocyty (krwinki białe, inaczej białe ciałka krwi). Służą one obronie przed bakteriami,
wirusami, pierwotniakami itp. Składają się z kilku podgrup – granulocytów, limfocytów
i monocytów. Trzecią ważną grupą są płytki krwi (trombocyty) – wyspecjalizowane komórki,
które potrafią się w odpowiednim momencie łączyć ze sobą i tworzyć skrzep
uniemożliwiający wypływ krwi z uszkodzonego naczynia.
Morfologia - podstawowe badanie krwi
Jest to najczęściej wykonywane badanie krwi u zwierząt. Badanie to daje informacje
o stanie nawodnienia, istniejącej anemii czy infekcji, możliwości krzepnięcia krwi oraz
skuteczności układu immunologicznego. Badanie jest niezbędne dla zwierząt z występującą
gorączką, wymiotami, biegunką, znacznym osłabieniem, bladością błon śluzowych czy
brakiem apetytu. Przykładowe parametry morfologii to:
a)
RBC (erytrocyty, krwinki czerwone). Niedobór może świadczyć o anemii, nadmiar
krwinek jest również czasem niekorzystny i może wskazywać na chorobę płuc,
b)
WBC (kwinki białe, leukocyty). Wzrost lub spadek tych wartości jest charakterystyczny
dla infekcji lub pewnych innych schorzeń układu odpornościowego, np. białaczki,
c)
HCT (hematokryt) informuje o procentowej zawartości erytrocytów (czerwonych ciałek
krwi) w stosunku do całej objętości krwi. Z jego pomocą można ocenić stopień
odwodnienia czy stwierdzenia anemii,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
d)
Hb (hemoglobina) i MCHC (średnia zawartość hemoglobiny w krwince) umożliwiają
ocenę zawartości podstawowego nośnika tlenu znajdującego się w krwinkach czerwonych,
e)
GRANS i L/M (różne rodzaje krwinek białych). Ich wzajemny stosunek wskazuje na
możliwość występowania infekcji czy stanów zapalnych w organizmie,
f)
EOS (eozynofile). Specyficzny rodzaj krwinek białych aktywnych w szczególności
w stanach alergicznych (np. astmie kotów) czy infekcjach pasożytniczych,
g)
PLT lub TRO (płytki krwi lub trombocyty). Odpowiedzialne są za tworzenie skrzepów,
h)
RETICS (retikulocyty – niedojrzałe krwinki czerwone). Wysoki poziom tych krwinek
może wskazywać na stan zwany anemią regeneratywną.
Przygotowanie zwierzęcia do badania i pobieranie próbki krwi
Zwierzę powinno być na czczo gdyż nakarmione może spowodować zmiany w składzie
krwi. Gwałtowne poskramianie zwierząt, wysiłek fizyczny, czynniki psychiczne prowadzą do
zwiększenia liczby krwinek oraz zmian w rozmieszczeniu leukocytów w naczyniach
krwionośnych. Należy wybrać miejsce nakłucia zwierzęcia w celu pobrania krwi, np.:
a)
bydło – żyła jarzmowa, żyła mleczna zewnętrzna,
b)
ś
winie – żyła czcza przednia,
c)
psy – żyła jarzmowa (psy duże), żyła udowa, żyła dogłowowa ramienia, opuszki palców
(psy małe, szczenięta).
Małe ilości krwi pobiera się na szkiełko podstawowe lub zegarkowe. Większe ilości krwi
należy pobrać do strzykawki.
Wybrane metody badania krwi
Analizator hematologiczny
Automatyczny analizator (Rys.1). hematologiczny (AH) w ogólnym zarysie wykorzystuje
metodę cytometrii przepływowej z laserem półprzewodnikowym jako źródłem światła.
Cytometria przepływowa bazuje na zjawisku rozpraszania światła laserowego przez komórki
oraz ich struktury. Komórki krwi są kolejno analizowane przez wiązkę lasera helowo-
neonowego.
Rys. 1. Automatyczny analizator hematologiczny [14]
Atuty analizatora hematologicznego (AH).
1.
Prosta obsługa i szybkie pomiary. Pomiar 18 parametrów. Oznaczane parametry
morfologii krwi to: WBC, LYM%, LYM#, Mon%, MON#, GRA%, GRA#, RBC, HGB,
HCT, MCV, MCH, MCHC, RDW, PLT, MPV, PDV, PCT.
2.
Obsługujący nie ma bezpośredniego kontaktu z krwią. Unika się zakażeń i błędów
spowodowanych manualnym oczyszczaniem sondy.
3.
Wszystkie nastawienia na ekranie dotykowym. Proste czynności przeprowadzane na
ekranie dotykowym umożliwiają szybki i łatwy dostęp do wszystkich nastawień takich
jak inicjalizacja, warunki pomiaru i automatyczne czyszczenie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Metoda mikroskopowa badania krwi
W wielu przypadkach metoda mikroskopowa jest metodą referencyjną bardzo cenną
diagnostycznie. Rozmaz krwi obwodowej jest niezastąpionym źródłem informacji. Preparat
winien być oglądany obiektywem 100x z wykorzystaniem właściwej dla niego immersji
(gliceryna, olej, woda). Do efektywnego przeglądania wielu preparatów potrzebne jest
wprawne oko i obyte nie tylko z komórkami występującymi w fizjologii.
W celu otrzymania rozmazu krwi należy wykonać następujące czynności:
−
pobranie kropli krwi na szkiełko podstawowe,
−
ustawienie szkiełka pod kątem 30-45
0
– krew rozpłynie się wzdłuż krawędzi, dobry
rozmaz powinien być cienki i połyskiwać tęczowo,
−
suszenie w temperaturze pokojowej, nie należy suszyć grzejąc lub dmuchając.
−
barwienie rozmazu najpóźniej po godzinie od pobrania.
Rozmazy krwi mogą być barwione np. metodą Giemsy. Rozmazy barwione tym
sposobem są najdogodniejsze do morfologicznych badań krwi i wykrywania jej pasożytów.
Rozmaz należy utrwalić alkoholem metylowym, następnie zalać świeżo przygotowanym
wodnym roztworem macierzystego barwnika Giemsy na okres 15 minut. Aby uwidocznić
strukturę krwinek należy barwić dwa razy po 15 minut każdorazowo świeżym roztworem
barwnika. Następnie barwnik zlać, a rozmaz spłukać wodą i wysuszyć w pokojowej
temperaturze. Preparat oglądać pod mikroskopem.
Badanie właściwości fizycznych i chemicznych moczu.
Rutynowe badanie moczu składa się z dwóch elementów:
a)
badania makroskopowego (właściwości fizykochemiczne),
b)
badania mikroskopowego osadu moczu.
Do badania makroskopowego należy pobrać co najmniej 100ml moczu za pomocą
cewnika. Do badania można zbierać mocz oddawany podczas moczenia, jednak taki mocz
może zawierać zanieczyszczenia, np. wyciek z macicy lub pochwy albo z worka
napletkowego. Właściwości fizykochemiczne moczu:
a)
zapach moczu – zmiana zapachu pojawia się przy nasilonej infekcji bakteryjnej dróg
moczowych (np. amoniakalny, gnilny),
b)
ciężar właściwy moczu – niski ciężar pojawia się przy wielomoczu, wysoki przy
skąpomoczu,
c)
przejrzystość moczu – prawidłowy mocz jest przejrzysty, zmętnienie może być
spowodowane dużą ilością kryształów, śluzu, komórek, ropy i białka,
d)
barwa moczu – fizjologicznie barwa moczu jest żółta lub bursztynowa (nieprawidłowa
barwa: ciemna, krwista, mleczna),
e)
odczyn moczu (pH) – np. psy mają pH 5,5 – 6,5, koty 5,0 – 6,0, alkalizacja lub nadmierne
zakwaszenie jest nieprawidłowe,
f)
białko – białkomocz jest przejawem choroby,
g)
hemoglobinuria – występuje wtedy, gdy mocz po odwirowaniu jest różowy, czerwony lub
brunatny; w osadzie występują wałeczki hemoglobiny i mała liczba erytrocytów,
h)
cukromocz – pojawia się gdy zawartość cukru przekroczy stężenie > 180 mg%.
Badanie osadu moczu.
Mocz do badania osadu powinien być pobrany rano. Powinno się badać środkową porcje
gdyż mocz poranny ma największe stężenie, a pierwsze porcje mogą zawierać nabłonki worka
napletkowego bądź pochwy. Osad otrzymuje się przez odwirowanie próbki moczu w wirówce
przez mniej niż 5 minut przy obrotach 2000 obr. /min. Po odwirowaniu należy zlać
supernatant, pozostawiając około 0,5 ml moczu, dokładnie wymieszać, przenieść kroplę na

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
szkiełko podstawowe i przykryć nakrywkowym. Preparat oglądać pod mikroskopem
w powiększeniu 400 -600x. W preparatach osadu można znaleźć następujące składniki :
−
leukocyty,
−
erytrocyty (wyługowane, świeże),
−
nabłonki (przejściowe, powierzchowne, komórki z warstw głębszych, miedniczek
nerkowych, z warstw głębszych, kanalików nerkowych),
−
wałeczki (hialitowe – szkliste, nabłonkowe, ziarniste, woskowe, wałeczki z leukocytów,
wałeczki z erytrocytów, wałeczki z hemoglobiny, wałeczki tłuszczowe, rzekome),
−
kryształy (w moczu zasadowym: węglany wapnia, moczany amonowe, trójfosforany
amonowo-magnezowe, obojętne fosforany wapnia, fosforany bezpostaciowe; w moczu
kwaśnym: szczawiany wapnia, kryształy kwasu moczowego, moczany bezpostaciowe,
leucyny, tyrozyny).
Testy do badań szybkich.
Badanie ogólne moczu jest jednym z podstawowych badań laboratoryjnych, niezbędnym
w praktyce lekarskiej. Obecnie dzięki zastosowaniu testów paskowych do badania moczu,
badanie to można wykonać szybko i wygodnie. Należy pamiętać, że jest to badanie wstępne,
a uzyskane w ten sposób wyniki są orientacyjne. Dlatego wartości nieprawidłowe wymagają
potwierdzenia za pomocą metod laboratoryjnych. Badanie moczu należy również powtórzyć
w laboratorium, jeśli w badaniu wykonanym za pomocą testów paskowych uzyskano
prawidłowe wyniki, lecz nie pokrywają się one z obserwacjami klinicznymi. Zalecenie
weryfikacji wyników badań moczu uzyskanych za pomocą testów paskowych nie wyklucza
wdrożenia odpowiedniego leczenia lub postępowania diagnostycznego, jeśli dane z wywiadu,
wynik badania fizykalnego oraz analiza moczu wskazują na taką konieczność.
W badaniach moczu najczęściej stosuje się wieloparametrowe paski, których panel
oznaczeń
w dużej
mierze
odpowiada
badaniu
ogólnemu
moczu.
Za
pomocą
wieloparametrowych pasków testowych można ocenić obecność w moczu takich składników,
jak: leukocyty, bakterie, erytrocyty, białka (albuminy), glukozę, ciała ketonowe, bilirubinę,
urobilinogen, oraz pH i ciężar właściwy moczu.
Pasek testowy do badania moczu (dipstick) to cienki pasek plastiku pokryty bibułą
i podzielony na kwadraty nasączone odczynnikami (pola testowe), które reagują z wybranymi
składnikami moczu. Liczba pól testowych odpowiada liczbie oznaczanych parametrów.
Zanurzenie paska w próbce moczu powoduje nasączenie moczem pól testowych i reakcję
składników moczu z zawartymi w bibule odczynnikami. Efektem reakcji jest zmiana
zabarwienia pola testowego. Oceniając intensywność barwy pola testowego można dokonać
półilościowej (wzrokowe porównanie barw na polach testowych paska z barwną skalą) lub
ilościowej analizy poszczególnych parametrów (ocena nasilenia barwy pól testowych za
pomocą specjalnego czytnika testów paskowych). Schemat postępowania podczas
wykonywania badania za pomocą pasków testowych.
1.
Pobieranie próbki moczu. Pojemnik do pobrania moczu powinien być czysty (do badań
biochemicznych nie jest wymagana jego sterylność) o pojemności co najmniej 50 ml
szczelnie zamykany z otworem o średnicy co najmniej 5 cm, aby umożliwić łatwe
pobranie moczu i jego badanie za pomocą testu paskowego. Do badania należy użyć
ś
wieżego
niewirowanego
moczu
o temperaturze
pokojowej.
Badanie
należy
przeprowadzić w ciągu 15-30 minut po pobraniu.
2.
Wykonanie badania:
−
przygotowanie barwnej skali (znajduje się na opakowaniu pasków) do odczytania pól
testowych paska oraz stopera lub zegarka z sekundnikiem,
−
wyjęcie paska testowego z opakowania bezpośrednio przed użyciem,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
−
wymieszanie próbki moczu,
−
zanurzenie paska testowego w moczu, tak aby całkowicie zwilżyć wszystkie pola;
czas zanurzenia 30 – 120 sekund, (Rys.2).
−
wyjęcie paska, zwilżony pasek należy trzymać w pozycji poziomej,
−
odczytanie wyniku na skali barwnej. (Rys. 3).
Rys. 2. Zanurzenie paska w moczu [19]
Rys. 3. Odczyt wyników analizy [19
]
W przypadku większości oznaczeń można określić czy dana substancja występuje (+) lub
nie występuje (-) w badanym moczu. Jeśli dana substancja jest obecna, jej stężenie można
ocenić według skali: ślad (+), małe stężenie (++), umiarkowane stężenie (+++), duże stężenie
(++++). Ocena wzrokowa pasków testowych jest obarczona dużym ryzykiem błędu ze
względu na dowolność interpretacji zaobserwowanych barw, szczególnie w przypadku
niewielkich niuansów kolorystycznych pól testowych.
Uwaga! Nie należy dotykać palcami pól testowych paska. Przed użyciem należy
sprawdzić, czy barwa poszczególnych pól testowych na pasku jest zbieżna z pierwszymi
kwadracikami na skalibarwnej, które określają "wyjściową" barwę poszczególnych pól paska.
Nie należy używać pasków, na których stwierdzono zmiany w zabarwieniu jednego lub więcej
pól testowych.
Inne testy w diagnostyce chorób zwierząt
Testy do diagnostyki chorób bydła:
−
diagnostyka białaczki,
−
diagnostyka brucelozy,
−
diagnostyka biegunki cieląt,
−
diagnostyka choroby niebieskiego języka,
−
diagnostyka chorób układu oddechowego bydła,
−
diagnostyka gorączki,
−
diagnostyka hypodermozy,
−
diagnostyka toxoplasmozy,
−
diagnostyka zarazy płucnej bydła.
Testy do diagnostyki chorób świń:
−
diagnostyka brucellozy,
−
diagnostyka choroby Aujeszkyego,
−
diagnostyka trychinellozy.
Badanie właściwości fizykochemicznych treści żwacza
Badanie treści żwacza i żołądka wykonuje się w nieżytach żwacza występujących przy
niestrawnościach, upośledzeniach trawienia, braku apetytu lub wzdęciach. Wzdęcia to
widoczne powiększenie objętości brzucha, wypełnienie dołów głodowych (szczególnie
lewego), osowienie, brak apetytu, zwierzę stoi z rozstawionymi kończynami. W cięższych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
przypadkach u zwierzęcia stwierdza się: napięte powłoki brzucha, nie uginające się pod
uciskiem doły głodowe, stękanie, porykiwanie, wyciągnięcie szyi i wysunięcie języka,
zasinienie błon śluzowych, duszność, bezwolne oddawanie kału.
Zmiany anatomopatologiczne: przemieszczenie krwi na obwód, przekrwienie płuc, sinica.
Niestrawność powstaje najczęściej z powodu błędów żywieniowych, którego
następstwem jest brak apetytu, atonia żwacza, wzdęcie żwacza, objawy morzyskowe,
podniecenie przechodzące w stan otępienia. Zwiększa się ilość płynnej treści żwacza. Tętno
i oddechy są przyspieszone, ciepłota ciała zmienna. Przy postępującym odwodnieniu
zmniejsza się elastyczność skóry, zapadają się gałki oczne. Ruchy zwierzęcia stają się
nieskoordynowane, zwierzę niechętnie wstaje. W cięższych stanach może wystąpić zapaść
i śpiączka. Kał jest zwykle rzadki, szary, cuchnący. U sztuk, które przechorowały kwasicę
ż
wacza, stwierdza się czasami mięśniochwat.
Zmiany anatomopatologiczne: treść żwacza o ostrym kwaśnym zapachu, zapalenie błony
ś
luzowej żwacza zwłaszcza worka brzusznego, obrzęk płuc, wybroczyny pod nasierdziem
i wsierdziem, zwyrodnienie wątroby, wybroczyny w oponach mózgu.
Badanie płynnej treści żwacza oraz osadu soku żołądkowego.
Płynną treść żwacza można uzyskać z jamy ustnej podczas odżuwania (w niewielkiej
ilości), bądź nakłuwając żwacz (250 – 500 ml). Badanie płynnej treści żwacza dotyczy:
−
badania cech fizycznych (barwa, zapach, konsystencja),
−
sedymentacji i flotacji płynnej treści żwacza,
−
badania pH treści żwacza (pH 4,0–5,5),
−
badania ilości i żywotności wymoczków,
−
próby flotacji (opóźniona),
−
określenia wartości hematokrytowej.
Sok żołądkowy pobiera się zgłębnikiem przełykowo-żołądkowym, na czczo po 12–24
godzinnej głodówce. Badanie soku i osadu soku żołądkowego obejmuje:
−
badanie właściwości fizycznych (barwa, zapach, konsystencja),
−
badanie pH i całkowitej kwasoty i wolnego kwasu solnego,
−
badanie mikroskopowe osadu soku żołądkowego.
Osad otrzymuje się przez odwirowanie 10 ml soku żołądkowego. Otrzymany osad należy
nanieść pipetą na 4 szkiełka podstawowe, po jednej kropli na szkiełko. Pierwsze szkiełko
przykryć szkiełkiem nakrywkowym. Do kropli na drugim szkiełku dodać roztworu sudanu III,
zmieszać, przykryć szkiełkiem nakrywkowym. Do kropli na trzecim szkiełku dodać płyn
Lugola. Na czwartym szkiełku wykonać rozmaz i utrwalić błękitem metylenowym, spłukać
wodą i wysuszyć. Wszystkie preparaty należy oglądać w mikroskopie stosując powiększenie
100-krotne, oraz 400–600 -krotne.
Zwiększenie liczby leukocytów, krwinek czerwonych, komórek nabłonkowych jest
objawem zapalenia błony śluzowej żołądka powodującej nieżyt. Znaczna liczba krwinek
czerwonych, strzępków tkanek i komórek nowotworowych jest objawem choroby wrzodowej
lub nowotworowej.
4.2.2.
Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń
1.
Jakie jest znaczenie badań laboratoryjnych w diagnostyce chorób zwierząt?
2.
Jakie choroby diagnozuje się dzięki badaniom krwi i moczu?
3.
Jaką rolę pełni krew w organizmie zwierzęcia?
4.
Jak należy przygotować zwierzę do badania krwi?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
5.
W jaki sposób należy pobrać krew zwierzęciu?
6.
Na czym polega badanie morfologiczne krwi?
7.
W jaki sposób wykonuje się rozmazy krwi?
8.
W jaki sposób bada się krew w analizatorze hematologicznym?
9.
Na czym polega badanie właściwości fizycznych i chemicznych moczu.
10.
W jaki sposób pobiera się próbki moczu do badania makroskopowego?
11.
W jaki sposób otrzymuje się osad moczu?
12.
W jakim celu bada się osad moczu?
13.
Jakie jest zastosowanie szybkich testów w diagnostyce weterynaryjnej?
14.
W jaki sposób przeprowadza się badanie moczu z wykorzystaniem testu paskowego?
15.
W jaki sposób pobiera się treść żwacza?
16.
Na czym polega badanie płynnej treści żwacza?
17.
W jaki sposób pobiera się sok żołądkowy?
18.
W jaki sposób otrzymuje się osad soku żołądkowego?
19.
Na czym polega badanie osadu soku żołądkowego?
4.2.3.
Ćwiczenia
Ćwiczenie 1
Zbadaj odczyn (pH) moczu bydła, świń i psa metodą papierków wskaźnikowych i metodą
potencjometryczną z wykorzystaniem pehametru. Zastosuj się do wymagań związanych
z przygotowaniem zwierzęcia do pobrania próbki moczu.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować
metodykę badania moczu metodą papierków wskaźnikowych
i potencjometryczną z wykorzystaniem pehametru,
2)
przygotować potrzebny sprzęt i materiały do badania,
3)
przygotować pehametr zgodnie z instrukcją,
4)
przygotować zwierzę do badania,
5)
pobrać próbkę moczu od wymienionych zwierząt,
6)
zbadać pH za pomocą papierków wskaźnikowych,
7)
zbadać pH pehametrem,
8)
porównać uzyskane wyniki,
9)
zinterpretować uzyskane wyniki,
10)
przedstawić wyniki na forum grupy.
Wyposażenie stanowiska pracy:
−
sprzęt i materiały (pehametr, paski wskaźnikowe, naczyńka na mocz),
−
metodyka badania,
−
tablice interpretacyjne (wartości prawidłowe pH dla badanych zwierząt),
−
rękawiczki jednorazowe, fartuch ochronny,
−
zeszyt.
Ćwiczenie 2
Wykonaj badanie moczu psa z wykorzystaniem szybkiego testu (testu paskowego).
Zachowaj zasady bezpieczeństwa podczas wykonywania czynności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować metodykę badania moczu metodą testu paskowego,
2)
pobrać próbkę moczu,
3)
przygotować test,
4)
wykonać badanie,
5)
zinterpretować wyniki,
6)
przedstawić wyniki na forum grupy.
Wyposażenie stanowiska pracy:
−
mocz,
−
metodyka badania,
−
test,
−
rękawiczki jednorazowe, fartuch ochronny,
−
tekst przewodni,
−
zeszyt.
Ćwiczenie 3
Wykonaj pod nadzorem lekarza weterynarii badanie wybranych fizycznych właściwości
treści żwacza (barwa, zapach, konsystencja).
Sposób wykonania ćwiczenia:
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować metodykę badania cech fizycznych treści żwacza,
2)
przygotować sprzęt laboratoryjny,
3)
pobrać próbkę z jamy ustnej zwierzęcia w obecności lekarza,
4)
ocenić barwę,
5)
ocenić zapach,
6)
ocenić konsystencję
7)
zapisać w zeszycie zebrane informacje i zaprezentować na forum grupy.
Wyposażenie stanowiska pracy:
−
sprzęt laboratoryjny,
−
metodyka badania,
−
treść żwacza,
−
tekst przewodni,
−
rękawiczki jednorazowe, fartuch ochronny,
−
zeszyt.
4.2.4.
Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wyjaśnić, jakie jest znaczenie badań laboratoryjnych w diagnostyce
chorób zwierząt?
2)
wskazać choroby, które diagnozuje się dzięki badaniom krwi i moczu?
3)
wyjaśnić, jaką rolę pełni krew w organizmie zwierzęcia?
5)
przygotować zwierzę do badania krwi?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
6)
wyjaśnić, w jaki sposób wykonuje się rozmazy krwi?
7)
wyjaśnić, na czym polega badanie morfologiczne krwi?
8)
wyjaśnić,
w
jaki
sposób
bada
się
krew w analizatorze
hematologicznym?
9)
przeprowadzić badanie właściwości fizycznych moczu?
10) wyjaśnić, na czym polega badanie właściwości chemicznych moczu?
11) wykonać badanie pH moczu?
12) wyjaśnić, w jaki sposób pobiera się próbki moczu do badania
makroskopowego?
13) wyjaśnić, jak otrzymuje się osad moczu?
14) wskazać celowość badania osadu moczu?
15) wskazać zastosowanie szybkich testów w diagnostyce weterynaryjnej?
16) przeprowadzić badanie moczu z wykorzystaniem testu paskowego?
17) wyjaśnić w jaki sposób pobiera się treść żwacza?
18) wyjaśnić na czym polega badanie płynnej treści żwacza?
19) wykonać badanie cech fizycznych płynnej treści żwacza?
20) wyjaśnić, w jaki sposób pobiera się sok żołądkowy?
21) wyjaśnić, w jaki sposób otrzymuje się osad soku żołądkowego?
22) wyjaśnić, na czym polega badanie soku i osadu soku żołądkowego?
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
4.3.
Diagnostyka weterynaryjna. Badania parazytologiczne
4.3.1.
Materiał nauczania
Parazytologia - podstawowa diagnostyka laboratoryjna chorób pasożytniczych
Parazytologia prowadzi badania nad pasożytami wywołującymi u zwierząt choroby.
Ponadto zajmuje się profilaktyką i leczeniem chorób pasożytniczych. W badaniach
parazytologicznych stosuje się najczęściej kał, krew, mocz, zeskrobiny.
Badanie kału na obecność pasożytów- koproskopia
Kał nie zanieczyszczony moczem zbiera się do suchego naczynia. Może być też pobierany
prosto z prostnicy. Do tego celu należy użyć probówki o grubszych ściankach. Po
wprowadzeniu do prostnicy wskazane jest poskrobanie błony śluzowej brzegiem probówki.
U zwierząt większych wskazane jest pobieranie kału w gumowej rękawiczce i staranne
przemywanie jej po pobraniu każdej próbki. U małych zwierząt pobiera się kał szklaną
pałeczką zaopatrzoną przy końcu w małe wyżłobienie. W diagnostyce owsicy stosuje się
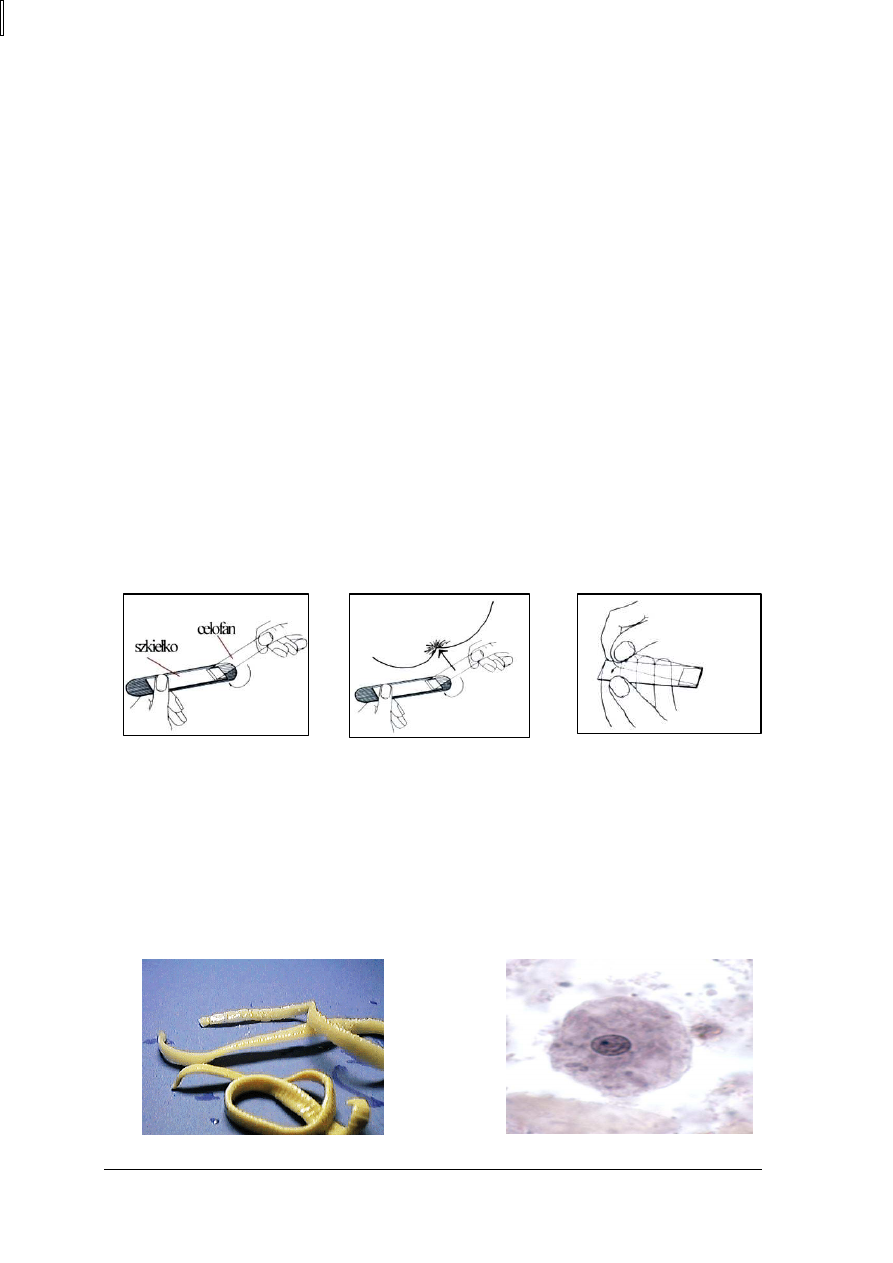
wymaz okołoodbytowy otrzymany metodą przylepca celofanowego. Materiał pobiera się
z fałdów około odbytowych.Pobieranie wymazu okołoodbytowego polega na wykonaniu
następujących czynności:
−
należy oderwać (nie do końca) celofan od szkiełka, (Rys. 4),
−
trzymając jedną ręką szkiełko, lepką stronę paska celofanowego przykleić jak najgłębiej,
w okolicę otworu odbytowego (Rys. 5),
−
pasek celofanowy przykleić (rozprostowując) z powrotem na szkiełko (Rys. 6).
Rys. 4. [18]
Rys. 5. [18]
Rys. 6. [18]
Przechowywanie materiału:
−
jeśli materiał nie może być badany bezpośrednio po pobraniu, należy przechować go
w temp. od 2 do 8 ºC do 24 h.
Formy pasożytów wykrywane w kale:
−
formy dojrzałe robaków (Rys. 7),
−
jaja robaków,
−
larwy robaków,
−
trofozoity pierwotniaków (Rys. 8),
−
cysty pierwotniaków.
Rys. 7
.
Tasiemiec – forma dojrzała [18]
Rys. 8. Entamoeba coli - trofozoit [18]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Metody badań kału
I.
Badanie makroskopowe (pozwala na wykrycie w kale członów tasiemca lub drobnych
nicieni). Porcję kału należy rozcieńczyć wodą na płytce Petriego i pozostawić do
opadnięcia osadu, zlać ostrożnie wierzchnią warstwę płynu nie dopuszczając do wylania
osadu, na który należy nalać powtórnie wodę. Czynności te powtarza się kilkakrotnie,
mieszając zawiesinę, gdyż chodzi o możliwie dokładne usunięcie śluzu zaciemniającego
obraz. Następnie należy obejrzeć przy pomocy lupy i igieł preparacyjnych.
II.
Metody bezpośrednie
1.
Rozmaz w soli fizjologicznej (ułatwia rozpoznanie trofozoidów pierwotniaków).
Niewielką ilość kału należy rozprowadzić na szkiełku podstawowym z kilkoma
kroplami soli fizjologicznej i oglądać pod mikroskopem.
2.
Rozmaz w płynie Lugola (ułatwia rozpoznanie cyst pierwotniaków). Niewielką ilość
kału należy rozprowadzić na szkiełku podstawowym z kilkoma kroplami płynu Lugola
i oglądać pod mikroskopem.
III.
Metody zagęszczające (umożliwiają wykrycie pasożytów trudnych do zaobserwowania
w metodach bezpośrednich z powodu niewielkiej ich ilości).
1.
Flotacja - polega na wykorzystaniu roztworów o większej gęstości niż gęstość jaj, larw
lub cyst (jako lżejsze powinny wypłynąć na powierzchnię). Próbkę kału np. 10 g
miesza się w 200 ml nasyconego roztworu soli kuchennej, pozostawia na ok. 45 minut.
Po upływie tego czasu za pomocą ezy o średnicy 1 cm należy zebrać powierzchowną
błonę z kilku miejsc. Zebrane krople należy przenieść na szkiełko podstawowe
i nakryć szkiełkiem nakrywkowym i tak przygotowany preparat oglądać pod
mikroskopem.
2.
Dekantacja – należy do metod sedymentacyjnych. Wykrywa wszystkie jaja zarówno
„lekkie” jak i „ciężkie” larwy, cysty i trofozoity. Grudkę kału należy rozetrzeć
w probówce z niewielką ilością wody wodociągowej, po czym dopełnić wodą
i pozostawić do opadnięcia osadu. Czynność należy powtarzać do momentu uzyskania
przezroczystego płynu. Uzyskany osad należy odwirować i oglądać pod mikroskopem
lub pod lupą preparacyjną.
IV.
Hodowla larw pasożytów.
Prowadzenie hodowli kultur wynika z trudności oznaczenia jaj gatunków pasożytów,
które ze względu na podobieństwo trudno jednoznacznie zbadać. Wyklucie się larw
i doprowadzenie ich do stadium rozwoju możliwym do ich identyfikacji jest jedynym
pewnym sposobem ich rozpoznawania. Hodowla polega na inkubacji odpowiednio
przygotowanego kału w temperaturze 30
0
C przez 5–6 dni. Po tym czasie należy polewać
powierzchnie wodą i spłukać larwy do naczynia. Po odwirowaniu otrzymuje się osad,
w którym występują larwy
Badanie moczu na obecność pasożytów
Próbkę moczu pobranego od zwierzęcia należy przelać do cylindrycznego naczynia
i pozostawić na pół godziny. Po odlaniu płynu osad należy przelać do probówek i odwirować
przez 2 minuty z szybkością 1500 obr./min. Otrzymany osad oglądać pod mikroskopem.
Badanie krwi na obecność pasożytów – metody badań
1.
Ś
wieża krew. Kroplę należy nanieść na szkiełko przedmiotowe i przykryć szkiełkiem
nakrywkowym i oglądać pod silnym powiększeniem mikroskopu.
2.
Rozmazy krwi. Kroplę krwi należy nanieść na szkiełko przedmiotowe i rozmazać za
pomocą drugiego szkiełka przedmiotowego. Gdy kropla krwi znajdzie się w miejscu
zetknięcia się dwóch szkiełek należy zdecydowanym ruchem przesunąć szkiełkiem

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
i uzyskać cienką jednolitą warstwę krwi. Rozmaz należy wysuszyć na powietrzu. Preparat
zabarwić np. metodą Giemsy i oglądać pod mikroskopem.
3.
Metoda grubej kropli. Pobraną krew na szkiełko przedmiotowe rozpościera się igłą
preparacyjną do wielkości monety groszowej i suszy się w ciągu kilku godzin.
Wysuszonej kropli nie należy barwić. Uzyskany preparat oglądać pod mikroskopem.
4.
Metoda wirowania krwi. Do krwi w ilości 10–15 ml dodać odpowiednich odczynników
zgodnie z metodyką. Płyn należy odwirować, a otrzymany osad oglądać pod
mikroskopem.
Diagnostyka pasożytów stałych (np. wszy, świerzbowce, nużeńce)
W diagnostyce wykorzystuje się zeskrobiny pozyskane ze zwierzęcia. Ostrzem skalpela
należy zdrapać dość silnymi pociągnięciami warstwy powierzchowne skóry, aż do jej warstwy
właściwej. Zeskrobiny najlepiej zebrać do grubościennej niewielkiej probówki, którą należy
szczelnie zamknąć korkiem i lekko podgrzać. Większe świerzbowce wędrują wzdłuż ścian
probówek.
Metody mikroskopowe badania świerzbowców
Przykładem jest metoda ługu potasowego, która polega na przeniesieniu całej ilości
zeskrobin do probówki i zalaniu 10% ługiem potasowym. Następnie probówkę należy
podgrzać. Tak przygotowany materiał krótko wiruje się w wirówce (15–20 obr./min.) i zlewa
płyn. Otrzymany osad oglądać pod mikroskopem przy słabym powiększeniu.
Cytologia złuszczeniowa
Jest to metoda histopatologiczna opierająca się na fizjologicznych właściwościach
złuszczania komórek nabłonkowych. Materiał do badania pobiera się tępymi lub tępo –
ostrymi narzędziami z powierzchni ciała, otworów naturalnych, jam ciała. Należy badać
zeskrobiny, wydzieliny, popłuczyny lub materiał uzyskany w wyniku bezpośredniego
przytknięcia (odciśnięcia) szkiełka podstawowego do powierzchni np. owrzodziałych guzów
(otrzymuje się tzw. preparaty przytykowe). Badanie cytologiczne zależnie od miejsca pobrania
może spełniać dwa zasadnicze cele: służyć ocenie cytoonkologicznej i cytohormonalnej
tj. wykazać nowotwory, bądź też wykazać zaburzenia hormonalne na podstawie wyglądu
badanych komórek.
4.3.2.
Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń
1.
Jakie jest znaczenie badań parazytologicznych w diagnostyce chorób zwierząt?
2.
W jaki sposób pobiera się próbkę kału do badań?
3.
W jaki sposób przechowuje się próbki kału do badań?
4.
Jakie są formy pasożytów wykrywane w kale?
5.
Na czym polega badanie makroskopowe kału?
6.
Na czym polegają metody bezpośrednie badania kału?
7.
Na czym polegają metody zagęszczające badania kału?
8.
W jakim celu prowadzi się hodowlę larw pasożytów w kale?
9.
Jak przygotowuje się mocz na obecność pasożytów?
10.
Jakie są metody badań krwi na obecność pasożytów?
11.
Jak otrzymuje się zeskrobiny do badań na pasożyty stałe?
12.
Jakie pasożyty bada się z zastosowaniem zeskrobin?
13.
W jakim celu wykonuje się cytologię zeskrobin?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
4.3.3.
Ćwiczenia
Ćwiczenie 1
Zbadaj pod nadzorem lekarza weterynarii świeżą krew dowolnego zwierzęcia na
obecność pasożytów. Zachowaj zasady bezpieczeństwa podczas wykonywanych czynności.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować metodykę badania ,
2)
przygotować sprzęt i materiały pomocnicze,
3)
pobrać krew do badania,
4)
wykonać preparat,
5)
oglądać preparat w mikroskopie,
6)
zapisać wyniki badania,
7)
zinterpretować wyniki badania,
8)
przedstawić wyniki na forum grupy.
Wyposażenie stanowiska pracy:
−
metodyka badania,
−
sprzęt i materiały pomocnicze (mikroskop, szkiełko przedmiotowe, sterylna igła),
−
krew,
−
rękawiczki jednorazowe, fartuch ochronny,
−
zeszyt.
Ćwiczenie 2
Wykonaj badanie pasożytów jelitowych w kale metodą bezpośrednią. Zachowaj zasady
bezpieczeństwa podczas wykonywanych czynności.
Sposób wykonania ćwiczenia:
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować metodykę badania,
2)
zgromadzić sprzęt i materiały pomocnicze,
3)
wykonać rozmaz w kropli soli fizjologicznej,
4)
wykonać rozmaz w kropli płynu Lugola,
5)
oglądać w mikroskopie pod powiększeniem 100x (w poszukiwaniu jaj robaków),
6)
oglądać w mikroskopie pod powiększeniem 400x ( w poszukiwaniu cyst i trofozoitów
pierwotniaków),
7)
zinterpretować wyniki badania,
8)
zapisać w zeszycie zebrane informacje i zaprezentować na forum grupy.
Wyposażenie stanowiska pracy:
−
sprzęt i materiały pomocnicze – mikroskop, szkiełka podstawowe, szkiełka nakrywkowe,
bagietki szklane, sól fizjologiczna, płyn Lugola,
−
metodyka badania,
−
rękawiczki jednorazowe, fartuch ochronny,
−
tekst przewodni,
−
zeszyt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
4.3.4.
Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1)
wyjaśnić, jakie jest znaczenie badań parazytologicznych w diagnostyce
chorób zwierząt?
2)
wyjaśnić, w jaki sposób pobiera się próbkę kału do badań?
3)
pobrać próbkę kału do badań?
5)
wyjaśnić, jakie są formy pasożytów wykrywane w kale?
6)
wyjaśnić, badanie makroskopowe kału?
7)
wyjaśnić metody bezpośrednie badania kału?
8)
wyjaśnić metody zagęszczające badania kału?
9)
przygotować próbkę moczu na obecność pasożytów?
10) wyjaśnić badania krwi na obecność pasożytów?
11) wyjaśnić, jak się otrzymuje zeskrobiny?
12) wyjaśnić wykorzystanie zeskrobin do badania na pasożyty?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
4.4.
Diagnostyka weterynaryjna. Badania mikrobiologiczne,
serologiczne. Badanie nasienia
4.4.1.
Materiał nauczania
Podstawowe badania mikrobiologiczne
Metody badań mikrobiologicznych mogą być bezpośrednie (mikroskopowe) i pośrednie
(hodowlane). Metoda mikroskopowa jest to szczegółowa obserwacja drobnoustrojów za
pomocą mikroskopów.
Rys. 9. Mikroskop optyczny [20]
Podstawowe elementy mikroskopu optycznego:
−
okular – służy do powiększenia obrazu tworzonego przez obiektyw mikroskopu,
−
tubus – służy do formowania powiększonego obrazu pośredniego,
−
ś
ruba mikrometryczna – służy do wstępnej regulacji odległości,
−
ś
ruba mikrometryczna – służy do ustalenia ostrości,
−
rewolwer – umożliwia prostą zmianę obiektywu,
−
obiektywy – zbierają światło wychodzące z przedmiotu i tworzą jego powiększony obraz
pośredni,
−
kondensator – koncentruje światło formując z niego stożek,
−
lusterko – służy do naświetlania badanego obiektu.
Dokładność obserwacji mikroskopowych uzależniona jest od rodzaju i stanu mikroskopu
oraz od przestrzegania zasad metodyki sporządzania i barwienia preparatów. Klasyczną
metodą stosowaną w diagnostyce mikrobiologicznej jest hodowla drobnoustrojów na
pożywkach (podłożach) sztucznych. Pożywki bakteriologiczne to środowiska, w których
w sztuczny sposób stworzono warunki do rozwoju bakterii, możliwie najbardziej zbliżone do
naturalnych warunków ich bytowania.
Hodowla bakterii
Bakterie w hodowli wykazują wzrost cykliczny, który obejmuje:
a)
fazę przygotowawczą – przystosowanie się bakterii do podłoża (faza zastoju, adaptacji),
b)
fazę logarytmicznego wzrostu – komórki dzielą się w regularnych odstępach czasu,
z największą możliwą w danych warunkach szybkością,
c)
fazę równowagi (zastoju) – występuje stała liczba żywych bakterii (następuje po
wyczerpaniu się składników odżywczych lub akumulacji toksycznych metabolitów),
d)
fazę zamierania – występuje wzrost liczby martwych komórek, następuje proces autolizy.
Bakterie w laboratoriach hoduje się na podłożach płynnych (np. bulion) w butelkach
i kolbach oraz na podłożach stałych na płytkach Petriego. Do izolacji dużej liczby bakterii
stosuje się podłoża płynne, natomiast do izolowania poszczególnych bakterii i ich
przechowywania stosuje się podłoża stałe. Do zestalania podłoży płynnych stosuje się agar,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
wielocukier otrzymywany z krasnorostów, który po skrzepnięciu pozostaje stały, aż do
podgrzania do temp. 80–90
0
C. Agar zwykle nie jest rozkładany przez bakterie. Celem
wykrywania konkretnych grup drobnoustrojów stosuje się podłoża selekcyjne lub różnicujące.
Podłoża selekcyjne zawierają składniki hamujące wzrost niechcianych bakterii i stymulują
wzrost pożądanych. W przypadku podłoży różnicujących pozwalają na rozróżnienie dwu
rodzajów bakterii. Przykłady zastosowania podłóż:
−
agar z krwią pozwolą na wykrycie bakterii hemolizujących np. paciorkowców
hemolizujących, powodujących lizę erytrocytów,
−
celem wyselekcjonowania pałeczek okrężnicy stosuje się pożywkę MacConkeya
zawierającą agar z żółcią i barwniki hamujące wzrost bakterii Gram- dodatnich
a pozwalającą na wzrost bakterii Gram- ujemnych.
Większość bakterii do prawidłowego wzrostu potrzebuje odpowiedniej temperatury.
Wyróżnia się dla nich temperaturę maksymalną, minimalną i optymalną. W zależności od pH
rozróżnia się bakterie zasadolubne rosnące w wysokim pH- 8,5 – 11,5 oraz kwasolubne
rosnące do pH 5,5. Podobnie jak wszystkie organizmy żywe bakterie są wrażliwe na
osmolarność otaczającego środowiska. W warunkach niskiej osmolarności wewnątrz komórki
gromadzi się woda, a przy wysokiej następuje jej utrata. Obecność ściany komórkowej
zapobiega lizie komórki przy niskiej osmolarności.
Podłoża stosowane w badaniach mikrobiologicznych powinny charakteryzować się:
−
odpowiednią wartością odżywczą niezbędną do życia, wzrostu i rozmnażania się
drobnoustrojów,
−
optymalnym odczynem w zależności od potrzeb, np. dla bakterii ok. pH 7,2-7,4,
−
przejrzystością, w celu wizualnego stwierdzenia wzrostu mikroorganizmów,
−
sterylnością, aby uniknąć zanieczyszczenia hodowli innymi drobnoustrojami,
−
izotonicznością, polega to na stworzeniu w nich podobnego ciśnienia do panującego
w komórkach.
Podłoża mogą być: naturalne (składniki pochodzenia naturalnego), syntetyczne (składniki
chemiczne), półsyntetyczne (składniki naturalne i związki chemiczne).
W celu prawidłowego wykonania badania mikroskopowego wykonuje się preparaty.
Przygotowuje się je na szkiełkach przedmiotowych dokładnie umytych i odtłuszczonych.
Muszą być odpowiednio przygotowane i utrwalone, a następnie barwione. Barwnikami
stosowanymi w barwieniu bakterii są np.: fiolet krystaliczny (gencjana), fiolet metylenowy,
fuksyna, błękit metylenowy, zieleń malachitowa, safranina, fiolet metylowy. Barwienie
bakterii może być:
a)
proste,
b)
złożone (pozytywne, negatywne),
c)
pozytywne,
d)
negatywne,
e)
pozytywno-negatywne,
f)
specjalne,
g)
przyżyciowe.
Barwienie proste polega na stosowaniu tylko jednego barwnika, np. błękitu metylenowego
lub fuksyny. Barwienie złożone polega na barwieniu preparatu kilkoma barwnikami wg ściśle
określonej kolejności lub znajdującymi się w mieszaninie, np. metoda Grama, Neissera czy
Ziehl – Neelsena. Barwienie pozytywne ma na celu wybarwienie komórek drobnoustrojów na
niezabarwionym tle. Barwienie negatywne polega na zabarwieniu tła preparatu. Wynikiem
barwienia jest uzyskanie wyraźnego obrazu niezabarwionych bakterii na ciemnym tle.
Barwienie negatywno-pozytywne jest kombinacją negatywnego i pozytywnego. Barwienie
specjalne polega na użyciu specjalnych metod i odpowiednich barwników, którymi można

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
barwić struktury komórkowe bakterii, takie jak spory (przetrwalniki), rzęski, otoczki.
Barwienie przyżyciowe jest modyfikacją barwienia pozytywnego prostego, ale stosowanych
do preparatów mokrych i żywych. Celem takiego barwienia jest odróżnianie komórek żywych
od martwych.
Podstawowe znaczenie taksonomiczne i diagnostyczne ma metoda Grama wymyślona
w 1884 roku przez Christiana Grama. Pozwala ona na rozróżnienie dwu grup bakterii na
podstawie struktury ściany komórkowej. Bakterie Gram – dodatnie mają jedną błonę
cytoplazmatyczną otoczoną grubą warstwą peptydoglikanu (20–80 nm) – barwią się na
niebiesko-fioletowo. Są to bakterie kształtu kulistego (ziarenkowce ułożone w dwoinki,
czworaczki, sześcianki, łańcuszki lub grona) oraz kształtu cylindrycznego (laseczki). Bakterie
Gram - ujemne mają cienką warstwę peptydoglikanu (1–3 nm), ale na zewnątrz tej warstwy
jest błona zewnętrzna, która stanowi dodatkową barierę – barwią się na czerwono. Są to
bakterie kształtu cylindrycznego (pałeczki) oraz kształtu kulistego (dwoinki). Etapy barwienia
bakterii metodą Grama:
1)
naniesienie na szkiełko roztworu fioletu krystalicznego (gencjany) na 2–3 minuty.
2)
utrwalenie płynem Lugola (roztworem jodu w jodku potasu) na 1,5 – 2 minut.
3)
odbarwienie etanolem (90% etanolem z dodatkiem acetonu) przez 30 sekund.
4)
dobarwienie barwnikiem kontrastowym (fuksyną lub safraniną) przez 15 sekund.
Po każdym etapie barwienia preparat należy spłukać bieżącą wodą. Następnie preparat
trzeba wysuszyć odciskając go w bibule. Mechanizm barwienia
1.
Komórki bakteryjne, zarówno Gram – dodatnie jak i Gram – ujemne, zabarwiają się
fioletem krystalicznym.
2.
Dodanie płynu Lugola powoduje, że fiolet reaguje z jodem, w wyniku czego tworzą się
stosunkowo duże kompleksy złożone z barwnika i jodu. Na tym etapie obydwa typy
komórek mają zabarwienie granatowe.
3.
Płukanie w alkoholu powoduje, że w komórkach Gram-dodatnich następuje zmniejszenie
pustej przestrzeni w wielowarstwowych ścianach komórkowych mających wygląd wielu
(ok. 50) nałożonych na siebie siatek. W rezultacie kompleksy fioletu krystalicznego z
jodem nie mogą ulec wypłukaniu. W przypadku bakterii Gram-ujemnych alkohol
wypłukuje barwnik.
Po zakończonym płukaniu komórki Gram-dodatnie są granatowe, zaś komórki Gram-
ujemne są
bezbarwne.
4.
Dodatkowy barwnik (np. safranina, fuksyna) dobarwia niezbyt mocno komórki Gram-
ujemne nie zmieniając barwy komórek Gram-dodatnich.
Przykład barwienia bakterii metodą Grama (Rys. 10).
Rys. 10. Wąglik zabarwiony metodą Grama [20]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Wąglik – choroba zakaźna, zaraźliwa, wywoływana przez Gram-dodatnią bakterię
nazywaną laseczką wąglika (Bacillus anthracis). Wąglik występuje najczęściej u bydła, koni,
owiec i kóz. Świnie rzadko chorują. Psy cechuje znaczna odporność.
W ocenie mikrobiologicznej wykorzystuje się charakterystykę morfologiczną kolonii
bakterii i komórki bakteryjnej.
Przy charakterystyce morfologii kolonii bierze się pod uwagę:
a)
wzrost kolonii – powierzchniowy, podpowierzchniowy, wgłębny.
b)
wielkość kolonii – pomiar średnicy,
c)
kształt kolonii – okrągła, rozgałęziona, nitkowata, korzonkowa, itp.
d)
wzniesienie kolonii – płaska, wypukła, pępkowata, itp.
e)
brzeg kolonii – gładki, falisty, kosmkowy, itp.
f)
przejrzystość kolonii – przejrzyste, półprzejrzyste, nieprzejrzyste,
g)
barwa kolonii i otoczenie kolonii – brak, zabarwienie, otoczenie zabarwione,
niezabarwione,
h)
struktura kolonii – ziarnista, włóknista, krucha, skórzasta, itp.
i)
zapach kolonii – brak, słaby, mocny, itp.
W charakterystyce morfologii komórki bierze się pod uwagę:
a)
wielkość komórki – za pomocą mikrometru okularowego,
b)
kształt komórki – kulisy, cylindryczny, spiralny, itp.
c)
układ komórek – położenie jednych komórek do drugich: pojedynczy, podwójny,
poczwórny, w łańcuszkach, itp.
d)
występowanie otoczek – bada się za pomocą barwienia negatywno-pozytywnego,
e)
występowanie przetrwalników – przez zastosowanie odpowiedniego barwienia,
f)
występowanie ziarnistości – bada się za pomocą specjalnego mikroskopu lub przez
zastosowanie odpowiedniego barwienia.
Podstawą badań diagnostycznych przy opracowywaniu materiału klinicznego jest
wykazanie w nim obecności drobnoustrojów patogennych, które są czynnikiem rozwijającego
się procesu chorobowego. Obok metod bakterioskopowych pozwalających na szybką
interwencję kliniczną istnieje szereg technik umożliwiających dokładną identyfikację
mikrobiologiczną. Płytkowa metoda posiewów jest stosowana do ilościowych i jakościowych
analiz mikrobiologicznych. Metoda ta oznacza wyłącznie komórki żywe. Technika posiewów
ilościowych polega na wprowadzeniu do wyjałowionych podłóż selektywnych (na płytkach
Petriego lub w probówkach) określonej ilości badanego materiału (zwykle po 1 ml)
z kolejnych dziesięciokrotnych rozcieńczeń. Płytki lub probówki inkubuje się w cieplarce
w określonej temperaturze i czasie. Uzyskane po posiewie hodowle identyfikuje się na
podstawie charakteru wzrostu i właściwości biochemicznych, które są typowe dla
poszczególnych gatunków bakterii. Następnie należy policzyć wyrosłe kolonie (jtk)
i przeliczyć np. na 1 ml, 1 cm
2
, 1 gram.
Badanie cytologiczne pochwy
Badanie polega na mikroskopowej ocenie wyglądu komórek nabłonkowych, które
pokrywają błonę śluzową pochwy po uprzednim ich pobraniu, utrwaleniu i wybarwieniu.
Zależnie od sposobu pobierania materiału wyróżnia się metody pośrednie, polegające na
aspirowaniu (zasysaniu) treści zawierającej samoczynnie złuszczone komórki i metody
bezpośrednie, polegające na ścieraniu nabłonka z powierzchni błony śluzowej. Badanie
cytologiczne pochwy (części pochwowej szyjki macicy) służy profilaktyce i wykrywaniu
stanów przednowotworowych (przedrakowych) i raka inwazyjnego szyjki macicy, a także
kontroli efektywności ich leczenia. Na podstawie badania cytologicznego ustala się dalsze

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
postępowanie diagnostyczne oraz terapeutyczne Ponadto badanie cytologiczne umożliwia np.
stwierdzenie zmian zapalnych pochwy.
Badania serologiczne
Choroby zakaźne to grupa chorób zwierząt, będących następstwem zakażenia ustroju
czynnikiem zakaźnym i złamania sił odpornościowych organizmu lub obecności
w organizmie bioaktywnych toksyn (jadów) drobnoustrojów. Choroby zakaźne mogą mieć
podłoże bakteryjne i wirusowe. Przykłady chorób wirusowych u zwierząt to m.in.: pryszczyca,
wścieklizna, nosówka, ptasia grypa, choroba Aujeszkyego, choroba guzowata, choroba
pęcherzykowata świń, choroba skokowa owiec, pomór bydła, niedokrwistość zakaźna koni,
pęcherzykowe zapalenie jamy ustnej, zapalenie żołądka i jelit świń. W ostatnich latach
doskonałym narzędziem w diagnostyce wielu chorób zakaźnych zwierząt stały się badania
serologiczne. Odczyny serologiczne stosowane w diagnostyce wirusologicznej są oparte na
reakcji antygenu z przeciwciałem. Odczyny wykorzystuje się do wykrywania:
1)
antygenów obecnych w pobranym materiale,
2)
antygenów po namnożeniu wirusa we wrażliwych komórkach (w hodowli komórkowej,
zwierzętach laboratoryjnych),
3)
przeciwciał obecnych w surowicy chorego zwierzęcia (czasem również w płynie
mózgowo-rdzeniowym lub wydzielinach ustroju) będących następstwem reakcji
immunologicznej na toczące się zakażenie.
W badaniu serologicznym stosuje się m.in.: odczyn neutralizacji (ONt), odczyn
immunoenzymatyczny (EIA, ELISA), odczyn immunofluorescencyjny (OIF), odczyn
radioimmunologiczny (RIA), odczyn wiązania dopełniacza (OWD), odczyn zahamowania
hemaglutynacji (OZHA). Szeroko stosowanym w diagnostyce jest odczyn ELISA. Stosuje się
go do rozpoznawania chorób: zakaźne zapalenie mózgu i rdzenia kręgowego, białaczka,
anemia zakaźna kurcząt, Choroba Gumboro, rzekomy pomór drobiu, Salmonella Enteritidis,
Salmonella Typhimurium itd.
Cele i możliwości monitoringu serologicznego na przykładzie drobiu.
1.
Określanie poziomu przeciwciał matczynych. Znajomość poziomu przeciwciał
u jednodniowych piskląt ma niesłychanie ważne znaczenie praktyczne Wiedza ta pozwala
między innymi ocenić program szczepień w stadach rodzicielskich, umożliwia także
precyzyjne określenie terminu szczepień ptaków np. przeciwko chorobie Gumboro czy
rzekomemu pomorowi drobiu. Należy dążyć do sytuacji, kiedy każde stado piskląt
opuszczające zakład wylęgowy będzie zaopatrzone w wyniki badań serologicznych.
Korzystając z pomocy programów komputerowych można w sposób automatyczny
wyliczyć optymalny termin szczepienia dla każdego stada.
2.
Ocena odpowiedzi serologicznej po szczepieniu. Śledzenie odporności poszczepiennej
pozwala na optymalizację zużycia szczepionek. W przypadku, gdy stopień odporności
poszczepiennej nie jest zadowalający możliwe jest skrócenie odstępu czasowego
pomiędzy poszczególnymi szczepieniami.
3.
Ocena skuteczności zastosowanej techniki podania szczepionki. W wielu przypadkach
błędy w technice szczepienia mają negatywny wpływ na powstanie odporności
poszczepiennej . W takiej sytuacji monitorowanie serologiczne pozwala na bardzo szybką
reakcję i poprawę techniki szczepienia.
4.
Rozpoznawanie chorób. Regularne badania serologiczne pozwalają również na bardzo
szybkie i precyzyjne rozpoznanie wielu chorób . Dotyczy to zwłaszcza często spotykanych
w praktyce jednostek chorobowych o przebiegu podklinicznym. Dobrym przykładem
możliwości diagnostycznych przy zastosowaniu monitorowania serologicznego jest
szybkie zróżnicowanie, czy za występujący u niosek nagły spadek produkcji jest

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
odpowiedzialny wirus zakaźnego zapalenia oskrzeli (IB), czy na przykład wirus
zakaźnego zapalenia mózgu i rdzenia kręgowego (AE). Monitorowanie serologiczne
pozwala na obiektywną ocenę stanu zdrowia danego stada. Na podstawie wyników badań
wielu stad można sporządzić ocenę stanu zagrożenia chorobami zakaźnymi na danym
terenie.
W diagnostyce laboratoryjnej chorób zakaźnych wykorzystuje się zwierzęta laboratoryjne,
które muszą być utrzymywane zgodnie z Rozporządzeniem Ministra Rolnictwa i Rozwoju
Wsi z dnia 24 lutego 2005 r. w sprawie szczegółowych warunków utrzymywania zwierząt
w hodowlach zwierząt laboratoryjnych oraz w jednostkach prowadzących doświadczenia lub
testy.
.
Badanie nasienia
Wskazaniem do badania nasienia jest ustalenie przydatności do unasienienia,
a w następstwie przydatności rozpłodnika. Stosuje się następujące metody badań:
1)
makroskopowe,
2)
mikroskopowe.
Niekiedy
stosuje
się
badania:
biochemiczne,
bakteriologiczne,
serologiczne,
parazytologiczne. Badanie makroskopowe uwzględnia następujące cechy nasienia:
a)
objętość – uzależniona od wieku i eksploatacji,
b)
barwę – prawidłowa: mlecznobiała z odcieniem kości słoniowej, niekiedy żółtawa,
c)
zapach – prawidłowy: brak zapachu,
d)
konsystencję – prawidłowa: śmietany, śmietanki, mleka.
e)
pH – prawidłowe: 6,4 – 6,8.
Badanie mikroskopowe nasienia polega na:
a)
określeniu jego ruchliwości i gęstości – do unasienienia można używać nasienia gdy
występuje średni ruch falowy a powierzchnia nasienia przypomina wrzącą smołę,
b)
ocenie liczby plemników ruchliwych – nadające się do unasienienia gdy jest min. 60-80%
ruchliwych plemników,
c)
ocenie aglutynacji plemników (zlepianie się plemników) – można używać nasienia, gdy
zlepianiu ulegają pojedyncze plemniki,
d)
oznaczaniu gęstości nasienia – nasienie nadaje się gdy jest gęste lub średnio gęste,
e)
określaniu koncentracji plemników – nasienie nadaje się gdy jest min. 600000 plemników
w 1 mm
3
,
f)
badaniu morfologii nasienia.
Badanie morfologiczne nasienia polega na:
−
ocenie anomalii pierwotnych (wielkość i kształt główki, wstawki, witki),
−
ocenie anomalii wtórnych ( zawinięcie lub brak witki, brak kapturka ),
−
oznaczaniu plemników martwych (obecność komórki nabłonka nasieniotwórczego i cewki
moczowej lub napletka dyskwalifikuje nasienie),
−
oznaczaniu przeżywalności (nasienie o przeżywalności krótszej niż 1 godzina jest
dyskwalifikowane).
Inne przykładowe metody badań nasienia
Badanie biochemiczne nasienia polega na zastosowaniu testów służących do określenia
aktywności enzymów wewnątrzkomórkowych. Przykładem może być enzym fosfataza
zasadowa, której aktywność decyduje o drożności przewodów wprowadzających nasienie.
Badanie to wykonuje się przy azoospermii czyli braku plemników w nasieniu. W ostatnich
latach do badań nasienia wprowadza się komputerowe analizatory właściwości plemników.
Zastosowanie tych urządzeń niweluje subiektywizm oceny nasienia. Urządzenia pozwalają na
analizę wielu (do jedenastu) parametrów charakteryzujących ruch poszczególnych plemników.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Badanie bakteriologiczne nasienia wykonuje się przy podejrzeniu zakażenia jąder i najądrzy.
Zakażenie może być przeniesione na drugiego osobnika podczas krycia, kiedy występuje
zapalenie narządu płciowego reproduktora prowadzące do zapalenia jader i w rezultacie do
trwałej niepłodności.
4.4.2.
Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1.
Od czego uzależniona jest dokładność obserwacji mikroskopowych?
2.
Jaki jest cel prowadzenia hodowli drobnoustrojów w analizie mikroskopowej?
3.
Na czym polega hodowla drobnoustrojów w kontekście badań mikroskopowych?
4.
Jakie podłoża wykorzystuje się do hodowli drobnoustrojów?
5.
W
jakich
warunkach
zachodzi
hodowla
drobnoustrojów
w
celach
badań
mikrobiologicznych?
6.
Jakie są metody barwienia bakterii?
7.
W jaki sposób barwi się bakterie metodą Grama?
8.
Jakie cechy bierze się pod uwagę przy charakterystyce morfologii kolonii bakterii?
9.
Jakie cechy bierze się pod uwagę przy charakterystyce morfologii komórki bakteryjnej?
10.
Na czym polega metoda płytkowa ilościowego oznaczania drobnoustrojów?
11.
W jakim celu stosuje się metodę płytkowa w analizie mikrobiologicznej?
12.
W jaki sposób wykonuje się cytologię pochwy?
13.
W jakim celu wykonuje się cytologię pochwy?
14.
Na czym polega badanie nasienia?
15.
Na czym polegają badania serologiczne w diagnostyce weterynaryjnej?
16.
W jakim celu prowadzi się badania serologiczne?
4.4.3.
Ćwiczenia
Ćwiczenie 1
Wykonaj preparat bakterii Escherichia coli pobranych z hodowli laboratoryjnej barwiony
metodą Grama.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować metodykę otrzymania preparatu bakterii Escherichia coli barwionych
metodą Grama,
2)
przygotować sprzęt i materiały pomocnicze,
3)
przygotować barwniki,
4)
wykonać preparat,
5)
przedstawić otrzymany preparat na forum grupy.
Wyposażenie stanowiska pracy:
−
metodyka otrzymania preparatu bakterii Escherichia coli barwionych metodą Grama,
−
sprzęt i materiały: szkiełka podstawowe, eza bakteryjna, bibuła,
−
barwniki: fiolet krystaliczny (gencjana), płyn Lugola, 90% etanol z dodatkiem acetonu,
fuksyna.
−
rękawiczki jednorazowe, fartuch ochronny,
−
zeszyt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
Ćwiczenie 2
Przeprowadź pod nadzorem lekarza weterynarii badanie makroskopowe nasienia.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1)
przeanalizować metodykę badania nasienia,
2)
przygotować sprzęt laboratoryjny,
3)
pobrać próbkę nasienia,
4)
zbadać objętość,
5)
ocenić barwę,
6)
ocenić zapach,
7)
ocenić konsystencję,
8)
zbadać pH,
9)
zinterpretować wyniki, wyciągnąć wnioski,
10)
przedstawić wyniki na forum grupy.
Wyposażenie stanowiska pracy:
−
nasienie,
−
sprzęt laboratoryjny,
−
rękawiczki jednorazowe, fartuch ochronny,
−
zeszyt
4.4.4.
Sprawdzian postępów
Czy potrafisz?
Tak
Nie
1)
wyjaśnić,
od
czego
uzależniona
jest
dokładność
obserwacji
mikroskopowych?
2)
określić
cel
prowadzenia
hodowli
drobnoustrojów
w
analizie
mikroskopowej?
3)
wyjaśnić, na czym polega hodowla drobnoustrojów w kontekście badań
mikroskopowych?
4)
wymienić podłoża, które wykorzystuje się do hodowli drobnoustrojów?
5)
wymienić
warunki
hodowli
drobnoustrojów
w
celach
badań
mikrobiologicznych?
6)
określić metody barwienia bakterii?
7)
wykonać barwienie bakterii metodą Grama?
8)
wymienić cechy, które bierze się pod uwagę przy charakterystyce morfologii
kolonii?
9)
wymienić cechy, które bierze się pod uwagę przy charakterystyce morfologii
komórki?
10) wyjaśnić metodę płytkową ilościowego oznaczania drobnoustrojów?
11) wyjaśnić, w jaki sposób wykonuje się cytologię pochwy?
12) wyjaśnić celowość wykonania cytologii pochwy?
13) wyjaśnić, na czym polega badanie nasienia?
14) wyjaśnić, na czym polegają badania serologiczne w diagnostyce
weterynaryjnej i w jakim celu się je wykonuje?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
5.
SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1.
Przeczytaj uważnie instrukcję.
2.
Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3.
Zapoznaj się z zestawem zadań testowych.
4.
Test składa się z 20 zadań wielokrotnego wyboru.
5.
Tylko jedna odpowiedź jest prawidłowa.
6.
Udzielaj odpowiedzi na załączonej karcie odpowiedzi.
7.
W razie pomyłki, błędną odpowiedź weź w kółko i zaznacz prawidłową.
8.
Za każdą prawidłową odpowiedź otrzymasz 1 punkt.
9.
Na rozwiązanie testu masz 30 minut.
10.
Pracuj samodzielnie.
Powodzenia!
ZESTAW ZADAŃ TESTOWYCH
1.
Oparzenia w laboratorium analitycznym mogą być
a)
termiczne.
b)
spowodowane roztworami stężonych kwasów.
c)
spowodowane roztworami stężonych zasad.
d)
wszystkie odpowiedzi są prawidłowe.
2.
Przy zaprószeniach oczu podczas wykonywanych analiz laboratoryjnych pierwsza pomoc
polega na
a)
przemywaniu dużą ilością wody.
b)
przemywaniu 2% roztworem kwasu borowego.
c)
użyciu wykałaczki.
d)
użyciu chusteczki.
3.
Mieszaninę chromową (tzw. chromiankę) przygotowuje się
a)
ze stężonego kwasu siarkowego (VI) i dwuchromianu (VI) potasu.
b)
ze stężonego kwasu siarkowego (VI) i dwuchromianu (VI) sodu.
c)
ze stężonego kwasu siarkowego (VI) i dwuchromianu (VI) potasu lub sodu.
d)
z kwasu siarkowego (VI) i dwuchromianu (VI) potasu lub sodu.
4.
Czyste i wysuszone szkło poddaje się wyjaławianiu suchym gorącym powietrzem
w sterylizatorze przez godzinę w temperaturze
a)
170
0
C.
b)
170–175
0
C.
c)
140–170
0
C.
d)
160
0
C.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
5.
Zwierzę podczas pobierania krwi powinno
a)
być nakarmione.
b)
być na czczo.
c)
być na czczo po 12 godzinnej głodówce.
d)
być po 24 godzinnej głodówce.
6.
Podczas badania krwi w analizatorze hematologicznym wykonuje się
a)
pomiar 10 parametrów.
b)
pomiar 16 parametrów.
c)
pomiar 18 parametrów.
d)
pomiar 20 parametrów.
7.
Mocz do badania osadu powinien być pobrany rano gdyż
a)
mocz poranny ma największy ciężar właściwy.
b)
mocz poranny ma odpowiednie cechy fizyczne.
c)
mocz poranny ma odpowiednie właściwości chemiczne.
d)
mocz poranny ma największe stężenie.
8.
W badaniach parazytologicznych w próbce krwi należy w mikroskopie zastosować
powiększenie
a)
100-krotne.
b)
400-600 krotne.
c)
400 krotne.
d)
600 krotne.
9.
Przez nakłuwanie żwacza zwierzęcia pobiera się
a)
200–500 ml płynnej treści żwacza.
b)
250–1000 ml płynnej treści żwacza.
c)
250–500 ml płynnej treści żwacza.
d)
150–500 ml płynnej treści żwacza.
10.
Dokładność obserwacji mikroskopowych uzależniona jest od
a)
rodzaju mikroskopu oraz od przestrzegania zasad metodyki sporządzania i barwienia
preparatów.
b)
rodzaju i stanu mikroskopu oraz od metodyki sporządzania i barwienia preparatów.
c)
stanu mikroskopu oraz od przestrzegania zasad metodyki sporządzania i barwienia
preparatów.
d)
rodzaju i stanu mikroskopu oraz od przestrzegania zasad metodyki sporządzania
i barwienia preparatów.
11.
W badaniach bakteriologicznych do izolacji dużej liczby bakterii stosuje się podłoża
a)
półpłynne.
b)
stałe.
c)
płynne.
d)
miękkie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
12.
Barwienie proste bakterii polega na stosowaniu
a)
kilku barwników wg ściśle określonej kolejności.
b)
tylko jednego barwnika.
c)
kilku barwników znajdujących się w mieszaninie.
d)
jednego barwnika zasadowego.
13.
Bakterie Gram- dodatnie barwią się na
a)
niebiesko- fioletowo.
b)
niebiesko.
c)
fioletowo-niebiesko.
d)
czerwono.
14.
Badanie cytologiczne pochwy polega na
a)
mikroskopowej ocenie wyglądu komórek nabłonkowych, które pokrywają błonę
ś
luzową pochwy po uprzednim ich utrwaleniu.
b)
mikroskopowej ocenie wyglądu komórek nabłonkowych, które pokrywają błonę
ś
luzową pochwy po uprzednim ich utrwaleniu i wybarwieniu
c)
makroskopowej ocenie wyglądu komórek nabłonkowych, które pokrywają błonę
ś
luzową pochwy po uprzednim ich pobraniu, utrwaleniu i wybarwieniu.
d)
mikroskopowej ocenie wyglądu komórek nabłonkowych, które pokrywają błonę
ś
luzową pochwy po uprzednim ich wybarwieniu.
15.
Badanie ogólne moczu z zastosowaniem testów paskowych jest badaniem, w którym
uzyskane wyniki są
a)
pewne.
b)
orientacyjne.
c)
ostateczne.
d)
wiarygodne.
16.
W badanich serologicznyh test ELISA jest odczynem
a)
neutralizacji.
b)
radioimmunologicznym.
c)
immunofluorescencyjnym.
d)
immunoenzymatycznym.
17.
Rozmaz kału w soli fizjologicznej (metoda bezpośrednia) w badaniu parazytologicznym
ułatwia rozpoznanie
a)
jaja robaków.
b)
cyst pierwotniaków.
c)
trofozoidów pierwotniaków.
d)
larwy robaków.
18.
Barwienie negatywne preparatów bakteryjnych polega na zabarwieniu
a)
tła preparatu.
b)
koloni bakterii.
c)
przetrwalników.
d)
komórek bakterii.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
19.
Parazytologia lekarska prowadzi badania
a)
nad pasożytami wywołującymi choroby u ludzi i zwierząt.
b)
w ramach profilaktyki chorób pasożytniczych.
c)
w celach leczniczych chorób pasożytniczych.
d)
wszystkie odpowiedzi są prawidłowe.
20.
Badanie biochemiczne nasienia wykonuje się
a)
przy braku plemników w nasieniu.
b)
przy podejrzeniu zakażenia jąder i najądrzy.
c)
przy słabej aktywności plemników.
d)
przy braku ruchu plemników.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
KARTA ODPOWIEDZI
Imię i nazwisko:................................................................................................
Planowanie i prowadzenie badań laboratoryjnych
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
6. LITERATURA
1.
Anusz Z.: Choroby odzwierzęce. Wydawnictwo ART, Warszawa 1991
2.
Drzazga B.: Analiza techniczna w przemyśle spożywczym. WSiP, Warszawa 1997
3.
Gundłach J. L, Sadzikowski A. B.: Parazytologia parazytozy zwierząt. PWRiL,
Warszawa 2004
4.
Heczko P.(red.): Mikrobiologia lekarska. WUJ, Kraków 1991
5.
Kocowa E.: Ćwiczenia z mikrobiologii ogólnej. PWN, Warszawa 1981
6.
Modzelewski M, Woliński J.: Pracownia chemiczna – Technika laboratoryjna. WSiP,
Warszawa 1993
7.
Rozporządzenie Ministra Rolnictwa i Rozwoju Wsi
z dnia 24 lutego 2005 r. w sprawie
szczegółowych warunków utrzymywania zwierząt w hodowlach zwierząt laboratoryjnych
oraz w jednostkach prowadzących doświadczenia lub testy
8.
Sikora J. Niestrawność kwaśna żwacza, PPR Weterynaria, 12/2001
9.
Stefański W:, śarnowski E. Rozpoznawanie inwazji pasożytniczych u zwierząt, PWRiL
Warszawa 1971
10.
Magazyn Weterynaryjny:2/1996, 10/2007; 7-8,12/2005, 4,6/2005, 7-8/2006.
11.
www.resmedica.pl
12.
www. agrvet.pl
13.
www.biolab.pl.
14.
www.icn-diagnosttics.pl.
15.
www. podr.pl
16.
www.zdrowie.med.pl
17.
www.pigon.pl
18.
www.wsseolsztyn.pl
19.
www.mikrobiologia.yoyo.pl.
20.
www.wikipedia.org.pl.
21.
www.toya.net.pl
22.
www.polrentgen.pl
Wyszukiwarka
Podobne podstrony:
planowanie i prowadzenie badań, pedagogika
Kontrola badań laboratoryjnych
Podstawowe zasady prowadzenia badań socjologicznych
Konwencja o zakazie prowadzenia badań, produkcji i gromadzenia zapasów broni bakteriologicznej (b
2011 12 jak prowadzic zeszyt praktyki budownictwa kl tb, praktyki zawodowe, 2 tb budowlaniec
Planowanie i organizacja badań geofizycznych
Analiza i interpretacja badań laboratoryjnych
Wykład 12 Planowanie fin
Profile badan laboratoryjnych w stanach klinicznych
Zestawy badań laboratoryjnych z Mechaniki Gruntów
Rola badań laboratoryjnych w Szpitalnym Oddziale Ratunkowym (2)
Normy badań laboratoryjnych, DO EGZAMINU
Chemia kliniczna 20.12.2010, BIO, Diagnostyka Laboratoryjna, chemia kliniczna, semestr V
więcej podobnych podstron