
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Joanna Dorota Górzyńska
Badanie właściwości szkła 311[33].Z1.02
Poradnik dla ucznia
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
mgr inż. Stanisław Pelczar
mgr Elżbieta Pietrasz
Opracowanie redakcyjne:
mgr inż. Joanna Górzyńska
Konsultacja:
mgr Czesław Nowak
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311[33].Z1.02
Badanie właściwości szkła, zawartego w modułowym programie nauczania dla zawodu technik
technologii szkła.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2007

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
3
2. Wymagania wstępne
4
3. Cele kształcenia
5
4. Materiał nauczania
6
4.1. Otrzymywanie szkła
6
4.1.1. Materiał nauczania
6
4.1.2. Pytania sprawdzające
12
4.1.3. Ćwiczenia
13
4.1.4. Sprawdzian postępów
15
4.2. Właściwości szkła
16
4.2.1. Materiał nauczania
16
4.2.2. Pytania sprawdzajace
35
4.2.3. Ćwiczenia
36
4.2.4. Sprawdzian postępów
38
4.3. Badanie właściwości szkła
39
4.3.1. Materiał nauczania
39
4.3.2. Pytania sprawdzające
48
4.3.3. Ćwiczenia
49
4.3.4. Sprawdzian postępów
50
5. Sprawdzian osiągnięć
51
6. Literatura
56
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Poradnik będzie Ci pomocny w przyswajaniu wiedzy o podstawowych technikach
otrzymywania szkieł, właściwościach szkieł, metodach badania właściwości szkieł oraz
o przepisach bhp podczas badania właściwości szkieł.
W poradniku zamieszczono:
–
wymagania wstępne – wykaz umiejętności, jakie powinieneś mieć już ukształtowane, abyś
bez problemów mógł korzystać z poradnika,
–
cele kształcenia – wykaz umiejętności, jakie ukształtujesz podczas pracy z poradnikiem,
–
materiał nauczania – wiadomości teoretyczne niezbędne do opanowania treści jednostki
modułowej,
–
zestaw pytań, abyś mógł sprawdzić, czy już opanowałeś określone treści,
–
ćwiczenia, które pomogą Ci zweryfikować wiadomości teoretyczne oraz ukształtować
umiejętności praktyczne,
–
sprawdzian postępów,
–
sprawdzian osiągnięć, przykładowy zestaw zadań. Zaliczenie testu potwierdzi opanowanie
materiału całej jednostki modułowej,
–
literaturę uzupełniającą.
Schemat układu jednostek modułowych
311[33].Z1.01
Określenie właściwości
surowców szklarskich
311[33].Z1.02
Badanie właściwości szkła
311[33].Z1.03
Wykonywanie analiz
laboratoryjnych surowców
i szkła
311[33].Z1
Metody badań surowców
i szkła

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej powinieneś umieć:
−
posługiwać się podstawowymi pojęciami z technologii szkła,
−
określać właściwości związków chemicznych,
−
określać przeznaczenie poszczególnych surowców szklarskich,
−
charakteryzować surowce szklarskie,
−
rozróżniać składniki szkła,
−
korzystać z różnych źródeł informacji,
−
odczytywać dokumentację techniczną,
−
obsługiwać komputer,
−
współpracować w grupie.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
3. CELE KSZTAŁCENIA
W wyniku realizacji programu jednostki modułowej powinieneś umieć:
−
scharakteryzować sposoby otrzymywania szkła,
−
odróżnić stan szklisty od innych stanów skupienia,
−
sklasyfikować szkło ze względu na skład chemiczny,
−
określić przeznaczenie szkła w zależności od jego składu chemicznego,
−
wyjaśnić zjawisko przechodzenia światła przez ciała stałe, ciecze i gazy,
−
wyjaśnić zasady barwienia szkła sposobem jonowym i koloidalnym,
−
scharakteryzować właściwości płynnej masy szklanej,
−
określić właściwości szkła,
−
określić czynniki wpływające na zmianę właściwości szkła,
−
dobrać składnik szkła zmieniający określoną właściwość szkła,
−
dobrać metodę badania właściwości szkła,
−
wyjaśnić budowę i zasadę działania urządzeń do badania właściwości szkła,
−
dobrać sprzęt laboratoryjny i urządzenia do badania właściwości szkła,
−
posłużyć się instrukcjami oraz normami podczas wykonywania badań i pomiarów,
−
przygotować próbkę do badania właściwości szkła,
−
wyznaczyć charakterystyczne punkty lepkościowe szkła,
−
określić współczynnik rozszerzalności cieplnej szkła,
−
określić współczynnik rozszerzalności liniowej szkła,
−
wyznaczyć zakres krystalizacji szkła,
−
oznaczyć klasę hydrolityczną szkła,
−
zmierzyć absorbancję szkła,
−
ocenić bezbarwność szkła,
−
zbadać mikrotwardość szkła,
−
opracować wyniki pomiarów z wykorzystaniem programu komputerowego,
−
zastosować przepisy bezpieczeństwa i higieny pracy, ochrony przeciwpożarowej oraz
ochrony środowiska podczas wykonywania badań i pomiarów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
4. MATERIAŁ NAUCZANIA
4.1. Otrzymywanie szkła
4.1.1. Materiał nauczania
Sposoby otrzymywania szkła.
Obecnie powszechnie przyjmuje się, że materia może występować w trzech stanach
skupienia: gazowym, ciekłym i stałym. Każdy z tych stanów skupienia występuje w dwóch
różnych formach. Stan gazowy obejmuje gazy zwykłe i gazy zjonizowane (plazmę). Stan ciekły
— to ciecze zwykłe i ciekłe kryształy. Stan stały obejmuje dwie zasadniczo różne formy, a
więc stan krystaliczny i stan bezpostaciowy.
Substancje w bezpostaciowym stanie stałym występują w postaci proszków, błonek, żeli,
żywic i szkieł. Podstawową formą stanu bezpostaciowego jest stan szklisty. Substancja
znajdująca się w stanie szklistym jest to ciało stałe, jednorodne, kruche, w mniejszym lub
większym stopniu przezroczyste, mające przełom muszlowaty. Stan szklisty zajmuje jakby
pośrednie miejsce między stanem krystalicznym a ciekłym. Sprężystość postaci upodabnia
szkło do stałych ciał krystalicznych, a brak symetrii w strukturze i wynikająca stąd
izotropowość decyduje o podobieństwie do cieczy.
Dotychczas nie ustalono jeszcze jednolitej definicji szkła. W literaturze można znaleźć wiele,
nieco odmiennych od siebie, definicji szkła. Dla przykładu można przytoczyć kilka z nich
najbardziej znanych.
W 1938 r. Komisja do Spraw Terminologii Akademii Nauk ZSRR przyjęła następującą
definicję szkła: szkłem nazwano wszystkie ciała bezpostaciowe, otrzymywane wskutek
przechłodzenia stopu, niezależnie od ich składu chemicznego, zakresu temperatury
i krzepnięcia, posiadające w wyniku stopniowego zwiększania lepkości mechaniczne
właściwości ciał stałych, przy czym proces przejścia ze stanu ciekłego w szklisty powinien być
odwracalny.
Amerykańska norma ASTM C 162-47 z 1950 r. podaje: szkło jest produktem topienia
składników nieorganicznych, ostudzonym aż do stwardnienia bez krystalizacji. Z reguły szkło
jest twarde i kruche, przełom jego jest muszlowy. Może ono być bezbarwne lub barwne,
przezroczyste lub nieprzejrzyste. Szkło w masie lub w wyrobach można uczynić barwnym,
przez obecność ciał rozpuszczonych, bezpostaciowych lub krystalicznych.
Według J.D. Mackenziego (1960 r.): szkłem jest dowolny, bezpostaciowy, izotropowy
materiał pochodzenia nieorganicznego lub organicznego, który nie ma dalekiego
uporządkowania struktury i który ma lepkość większą niż 10
14
dPas.
J. Jabłkowski podaje przyjętą przez PKN następującą definicję szkła: szkło jest to produkt
pozostający w swej masie w stanie nieskrystalizowanym, otrzymany z substratów po stopieniu
i ostudzeniu poniżej temperatury wykrywalnej krystalizacji.
Z przytoczonych definicji wynika, że wszystkie substancje znajdujące się w stanie szklistym
charakteryzują się kilkoma wspólnymi cechami, a mianowicie:
1) są izotropowe, tj. ich właściwości są jednakowe we wszystkich kierunkach dlatego, że ich
struktura we wszystkich kierunkach średnio jest taka sama – jednorodna,
2) przy ogrzewaniu nie topią się tak jak kryształy, lecz stopniowo miękną przechodząc ze
stanu kruchego w ciągliwy stan o dużej lepkości i w końcu w stan ciekły, przy czym nie

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
tylko lepkość, ale i inne właściwości fizykochemiczne zmieniają się w sposób ciągły
bezskokowy,
3) topią się i krzepną w sposób odwracalny, a więc wytrzymują wielokrotne rozgrzewanie do
stanu stopienia, a po ochłodzeniu w jednakowych warunkach ponownie osiągają
początkowe właściwości (jeżeli nie nastąpi krystalizacja lub likwacja). Odwracalność
procesów i właściwości wskazuje, że stopy tworzące szkła i zakrzepnięte szkła są
rzeczywistymi roztworami, gdyż odwracalność jest podstawową cechą rzeczywistego
roztworu.
Szkła jako ciała amorficzne mogą być otrzymywane za pomocą różnych technik, jak:
−
chłodzenie stopu,
−
kondensacja pary,
−
amortyzacja sieci ciała krystalicznego,
−
dyfuzja wzajemna i spiekanie,
−
elektroliza,
−
piroliza,
−
reakcje w roztworze (metoda zol-żel).
Najczęściej stosowaną techniką otrzymywania szkieł jest metoda chłodzenia stopu, w której
materiałem wyjściowym są odpowiednio dobrane surowce szklarskie.
Surowcami do produkcji szkieł są: piasek – źródło krzemionki SiO
2
, boraks – dostarczający
tlenek boru B
2
O
3
, skalenie sodowo-potasowe – źródło tlenku glinu Al
2
O
3
, surowce będące
źródłem tlenków metali zasadowych (Na
2
O, K
2
O, Li
2
O), surowce będące źródłem tlenków
MgO, CaO, PbO, ZnO, a także surowce bogate w tlenki: P
2
O
5
, TiO
2
, ZrO
2
. W produkcji szkła
stosuje się również surowce zawierajace związki barwiące (np. Cu
2
O w celu uzyskania barwy
niebieskiej i zielonej, itd.) lub odbarwiające, przyśpieszające topienie lub klarowanie.
Zmagazynowane w silosach surowce są pobierane i odważane w zestawiarniach za pomocą
wag sprzężonych z silosami w ilościach wynikających z receptury zestawu, a następnie
przekazywane transportem taśmowym do mieszarki. Inne surowce, jak np. klarujące
i odbarwiające są pobierane oddzielnie z magazynu, ważone i wsypywane bezpośrednio do
zestawu w mieszarce.
Mieszanie surowców odbywa się w urządzeniach zwanych mieszarką przez określony czas,
wyznaczony doświadczalnie.
Wymieszany w mieszarce zestaw jest zasypywany na przenośnik taśmowy do transportu
pneumatycznego lub do pojemników i dostarczony do zasypników przywannowych, z których
odpowiednie urządzenia zwane zasypnikami zasypują zestaw do pieca szklarskiego, gdzie
następuje ich topienie. Nastepnie w wyniku stopniowego i równomiernego obniżania
temperatury zachodzi proces studzenia i przygotowanie masy szklanej (głównie pod względem
lepkości) do odpowiedniej metody formowania. Gwałtowne powtórne podgrzanie powoduje
wtórne pienienie szkła.
Inną techniką otrzymywania szkieł wysokiej jakości – jest technika podstawowego procesu
elektrochemicznego, polegającego na chemicznej przemianie składników elektrolitu
(mieszanina surowców szklarskich), przebiegającej na elektrodach pod wpływem prądu
elektrycznego. Proces ten nosi nazwę elektrolizy i przebiega w piecach elektrycznych.
Czynności przygotowawcze surowców szklarskich są analogiczne, jak przy metodzie
chłodzenia stopu, a znaczna różnica procesu otrzymywania szkieł zachodzi podczas topienia.
Piec elektrodowy ma wbudowane elektrody zasilane prądem, które w wyniku różnicy
potencjałów powodują ruch jonów elektrolitu. Przenoszenie ładunku miedzy elektrodami
powoduje, że płynna masa szklana pełni funkcję elementu grzejnego, a towarzyszące temu
reakcje utleniania i redukcji związków chemicznych stanowią podstawę do otrzymania

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
klarownej i ujednorodnionej płynnej masy szklanej, która będzie chłodzona i poddana dalszym
procesom technologicznym.
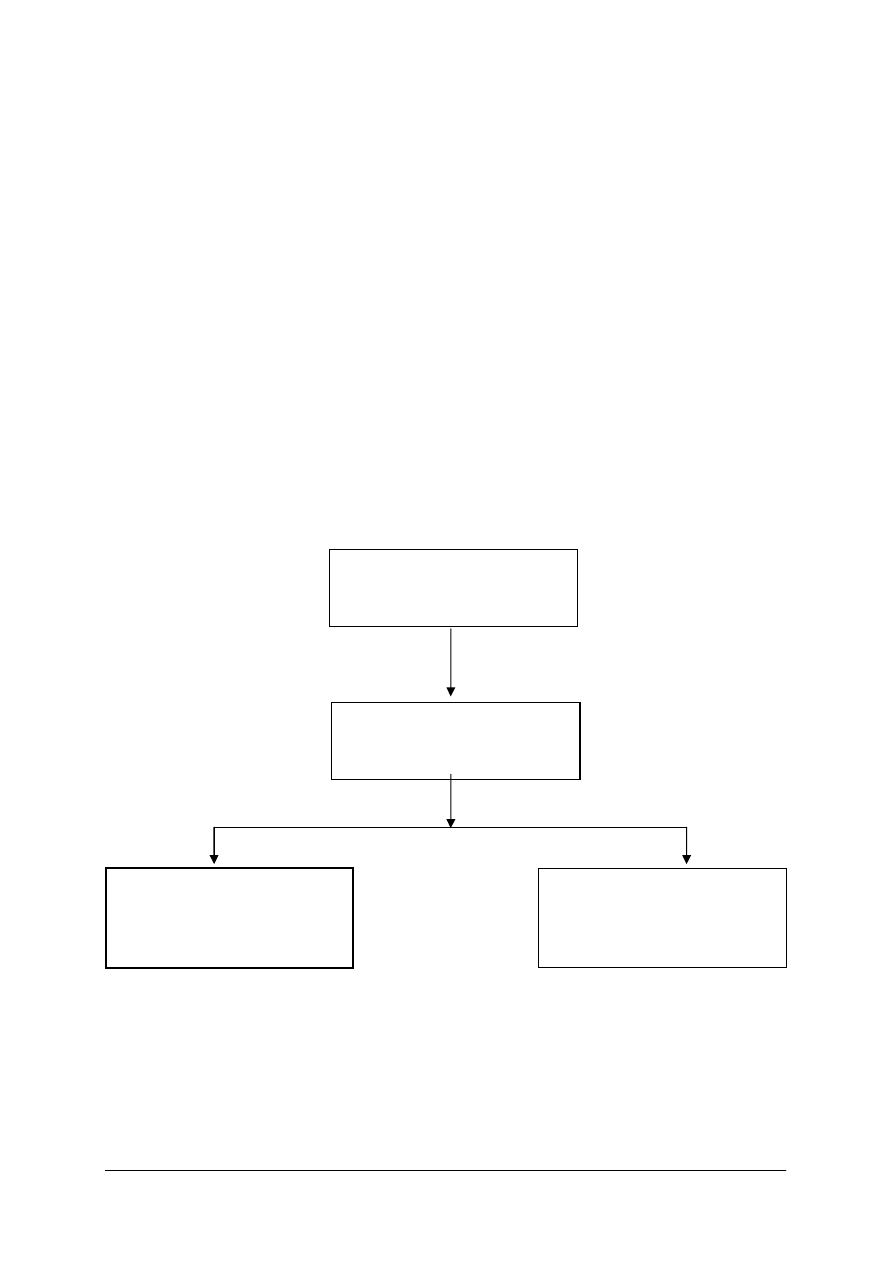
Schemat technologiczny otrzymywania szkieł w uproszczonej wersji można przedstawić
w następujący sposób:
POBÓR I ODWAŻANIE SUROWCÓW
ò
MIESZANIE SUROWCÓW
ò
TRANSPORT ZESTAWU DO PIECÓW SZKLARSKICH
ò
TOPIENIE
ò
FORMOWANIE
ò
ODPRĘŻANIE
ò
KONTROLA JAKOŚCI
ò
PAKOWANIE, WYSYŁKA DO ODBIORCY
Rys. 1 – Schemat technologiczny produkcji szkieł.
Składy chemiczne szkła
Zestaw szklarski sporządzony z surowców szklarskich ustala producent okreslonego wyrobu
szklanego, bacząc na jakość i ilość otrzymanego produktu, przy zaoszczędzeniu kosztów
wkładanych do zestawu szklarskiego surowców. W literaturze przyjmuje się uproszczony
skład szkieł użytkowych:
a) szkło gospodarcze
−
74 % SiO
2
– piasek
−
10 % CaO – wapień
−
16 % Na
2
O – soda
b) szkło budowlane
−
72 % SiO
2
– piasek
−
10 % CaO – wapień
−
13 % Na
2
O – soda
−
3 % MgO – dolomit
−
2 % Al
2
O
3
– skaleń
−
0,3 % Fe
2
O
3
– zanieczyszczenia
c) szkło kryształowe
−
58 % SiO
2
– piasek
−
28 % PbO – minia
−
14 % K
2
O – potaż
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
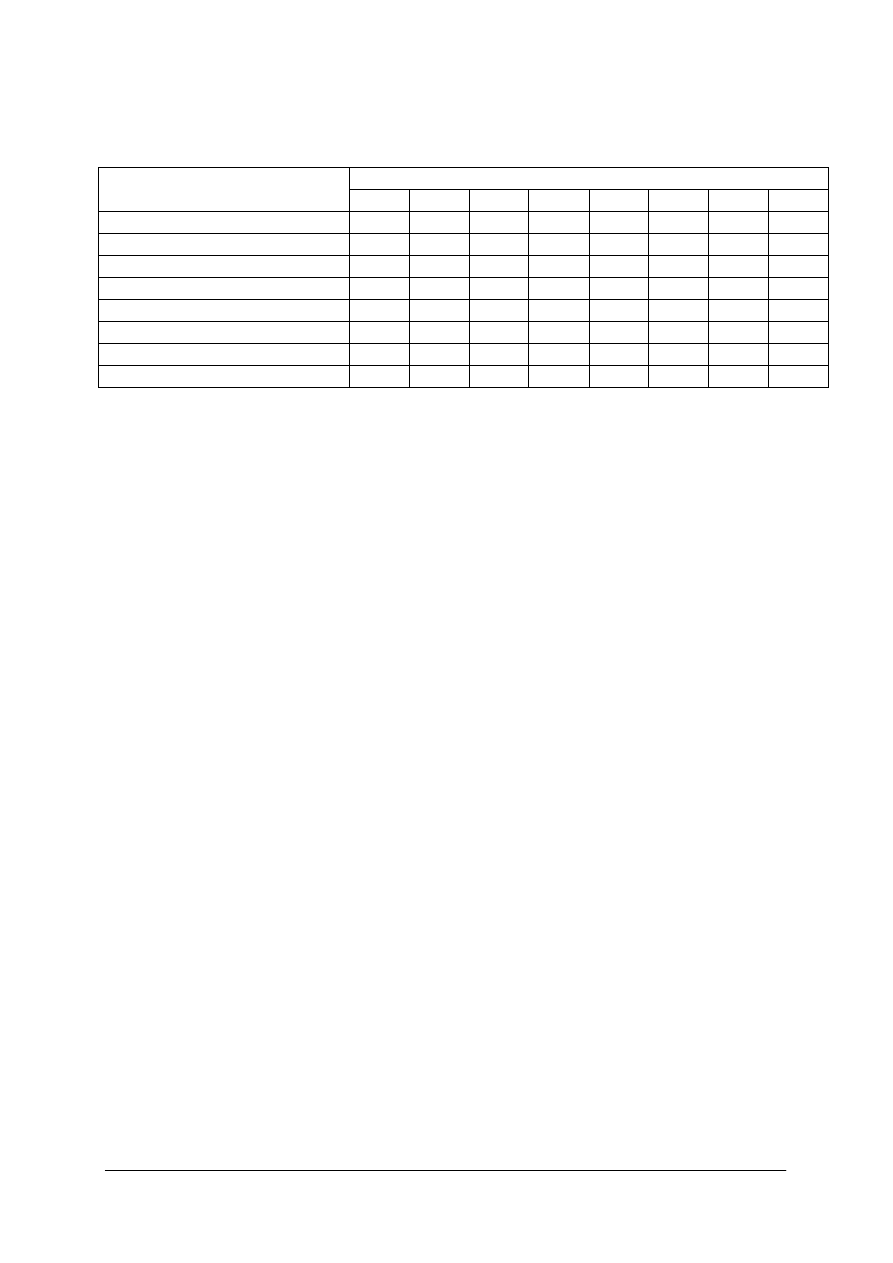
Skład chemiczny różnego rodzaju szkieł przedstawia poniższa tabela.
Tabela 1 – Skład chemiczny szkieł. [1,s. 19]
Zawartość tlenków, w %
Rodzaj szkła
SiO
2
Al
2
O
3
Na
2
O B
2
O
3
CaO
MgO
BaO
K
2
O
Szkło do formowania ręcznego
71,5
1,1
11,15 0,45
6,6
-
4,55
4,6
Opakowania bezbarwne
73,0
1,0
14,0
-
8,0
2,5
1,0
0,5
Opakowania zielone
70,1
2,3
12,8
-
10,6
2,16
-
1,0
Opakowania bursztynowe
71,2
1,9
14,6
0,25
11,4
0,15
-
0,5
Szkło formowane metodą float
72,6
1,0
14,0
-
8,4
4,0
-
-
Szkło walcowane
73,2
0,85
13,85 -
11,6
-
0,5
-
Szkło płaskie ciagnione
72,3
0,5
14,0
-
9,2
4,0
-
-
Pustaki szklane
71,4
1,8
15,6
0,3
7,6
2,5
0,8
-
Przechodzenie światła przez ciała stałe, ciecze i gazy
Poznając procesy przechodzenia światła przez materię należy znać ich budowę
wewnętrzną, gdyż ułatwia to w znaczny sposób rozumienie opisywanych zjawisk i procesów.
Stan szklisty pod względem chemicznej natury, a co za tym idzie pod względem właściwości
i struktury, charakteryzuje się wielką różnorodnością. Niemniej przy określonej różnorodności
szkła posiadają niektóre wspólne właściwości, np.: kruchość, zdolność do stopniowego
mięknięcia i inne. Zatem obok różnic powinny istnieć ogólne charakterystyki struktury szkieł.
Jednak aby określić te podobieństwa, należy rozpatrzyć dostępne dane eksperymentalne
o budowie najbardziej typowych szkieł. Do nich należą wieloskładnikowe nieorganiczne szkła
krzemianowe szeroko produkowane w przemyśle.
Jeżeli mówi się o strukturze wewnętrznej szkła, to pełnowartościowa teoria jego budowy
powinna przede wszystkim wyjaśnić:
−
nadzwyczajną skłonność jednych substancji i praktycznie pełną niezdolność innych do
przejścia w stan szklisty,
−
ogólne podobieństwo wielu właściwości szkieł przy bardzo dużym zróżnicowaniu ich
składu chemicznego,
−
istotę zmian temperaturowych w szkle i tak zwanej „równowagi wewnętrznej".
Szkło krzemianowe od dawna uważane jest za typowe ciało bezpostaciowe.
Współczesne wyobrażenia o stanie szklistym biorą za podstawę dwa bezspornie ustalone
czynniki:
1) przy zmianie temperatury w cieczach lub stopach, z których po ostudzeniu otrzymuje się
szkło, zachodzą procesy zmieniające w sposób ciągły ich strukturę,
2) między jonami w szkle otrzymanym ze stopu i tymi samymi cząstkami w stanie
krystalicznym powstają głównie więzi międzyatomowe takiej samej natury. Dlatego nie
można rozszyfrować budowy szkieł bez uwzględnienia zarówno budowy wewnętrznej
cieczy, jak i danych krystalicznych dotyczących związków nieorganicznych.
Szkło jako ciało stałe lub stan szklisty charakteryzuje się uporządkowaniem dalekiego zasięgu;
oznacza to, że w każdej substancji krystalicznej występuje określony porządek przestrzennego
ułożenia atomów, odpowiadający pod względem symetrii jednemu z siedmiu układów
krystalograficznych. Każdy kryształ stanowi swoistą trójwymiarową siatkę dyfrakcyjną na
której następuje ugięcie promieniowania rentgenowskiego pod ściśle określonymi kątami.
Stan szklisty różni się od krystalicznego brakiem uporządkowania dalekiego zasięgu.
Jednocześnie, statystycznie średnie rozmieszczenie atomów we wszystkich kierunkach jest
podobne, czego konsekwencją jest izotropowość wszystkich właściwości szkieł. Efekt ugięcia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
promieniowania X w szkłach zazwyczaj nie zachodzi, stąd szkło traktuje się jako materiał
rentgenograficznie bezpostaciowy. Szkło, podobnie jak kryształ, jest przy tym ciałem
sztywnym, obdarzonym sprężystością postaci, twardym, ale kruchym.
Ciała stałe przezroczyste, takie jak szkło, czy kwarc, rozpraszają i pochłaniają światło.
Niezbyt grube warstwy szkła lub kwarcu są przezroczyste dla wszystkich długości fal
stanowiących światło widzialne, ponieważ żadna długość fali nie jest przez szkło szczególnie
silnie pochłaniana.
Ciała stałe będące przewodnikami (np. miedź) są nieprzezroczyste, jako że elektrony
swobodne znajdujące się w sieci krystalicznej oraz atomy tworzące strukturę krystaliczną
przewodników pochłaniają wszystkie długości padających na nie fal świetlnych.
Istnieją kryształy, w których padający promień świetlny zostaje rozdzielony na dwa promienie.
Kryształy takie nazywany dwójłomnymi. Przykładem kryształu dwójłomnego jest kalcyt.
Promień światła niespolaryzowanego, padający na powierzchnię kalcytu, rozszczepia się na
dwa promienie spolaryzowane: zwyczajny i nadzwyczajny. Płaszczyzny polaryzacji tych
promieni są do siebie prostopadłe. Promień zwyczajny spełnia prawo załamania, zaś
nadzwyczajny nie spełnia go, gdyż współczynnik załamania kryształu tego promienia zależy od
kierunku rozchodzenia się tego światła w krysztale.
Bardzo interesujące właściwości optyczne mają ciekłe kryształy, czyli substancje będące
cieczami, ale zachowujące porządek molekularny charakterystyczny dla kryształów. Ciekłe
kryształy czasem tworzą struktury spiralne, co powoduje, że mogą skręcać płaszczyznę
polaryzacji przechodzącego przez nie światła.
Przez gazy, które są w dużym stopniu przezroczyste, promienie świetlne biegną po liniach
prostych, zakładając model optyki geometrycznej. W rzeczywistości współczynnik załamania
powietrza zależy od jego gęstości. Jak zapewne wiecie, gęstość powietrza maleje wraz
z wysokością. A zatem również współczynnik załamania powietrza maleje wraz z wysokością.
Jest to przyczyną faktu, że promienie świetlne przechodzące przez atmosferę się zakrzywiają.
Gęstość powietrza, a więc również jego współczynnik załamania, może się zmieniać w wyniku
silnego nagrzania się powietrza.
Oddziaływanie światła z cząsteczkami atmosfery jest odpowiedzialne za odbieraną przez nas
barwę. Zjawisko rozpraszania światła polega na tym, że światło padające z jednego kierunku
na cząsteczki powietrza pobudza te cząsteczki do świecenia. Świecenie cząsteczek odbywa się
we wszystkich kierunkach. Oznacza to, że tylko część początkowej energii niesionej przez
światło dociera do obserwatora. Stopień rozproszenia światła przez cząsteczki atmosfery
zależy od długości fali. Im długość fali światła jest mniejsza, tym światło jest silniej
rozpraszane.
Światło przechodzące z powietrza do wody ulega załamaniu. Jednak kąt załamania nie jest
jednakowy dla wszystkich długości fal.
Różne jest również pochłanianie światła przez wodę. Światło o długościach fal
odpowiadających barwie czerwonej i żółtej jest o wiele silniej pochłaniane niż światło
o długościach fal odpowiadających barwie niebieskiej i fioletowej. Światło biegnące w głąb
wody również ulega rozproszeniu Pewna część tego światła wydostaje się na powierzchnię
wody. Światło, które po rozproszeniu pod wodą wraca nad jej powierzchnie, odgrywa istotną
rolę w odbieraniu przez nas zabarwienia wody, szczególnie jej wielkich zbiorników, jak jeziora
czy morza. Rozproszone pod wodą światło, wracając ponad jego powierzchnię, przybiera
barwę zielonkawoniebieską. Jednakże nie wszystkie morza mają taką barwę. Światło jest
bowiem pochłaniane i rozpraszane nie tylko przez cząsteczki wody, ale również przez
substancje w niej rozpuszczone. W zależności od ilości i rodzaju tych substancji woda morska
może przyjmować różne odcienie. Odbierane przez oko ludzkie zabarwienie morza zmienia się
również pod wpływem falowania wody. Kiedy toń wody w morzu jest spokojna, ilość światła

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
dochodzącego spod wody jest o wiele mniejsza od ilości światła odbitego od jej powierzchni,
a więc barwa morza zależy w tym wypadku od zabarwienia nieba. Gdy morze faluje, do
obserwatora dociera więcej światła rozproszonego pod wodą, więc woda w morzu będzie
przyjmować barwę zieloną, błękitną, itp. Woda jest przezroczysta dla światła.
Omówienie zjawisk przechodzenia światła przez ośrodki materii jest bardzo istotne dla
następnego procesu opisywanego poniżej, tj. dla barwienia szkła.
Zasady barwienia szkła sposobem jonowym i koloidalnym.
Barwa szkła podobnie, jak innych nieświecących uwarunkowana jest właściwościami
zmieniania składu spektralnego padającego na szkło strumienia świetlnego. Rozmaita
częstotliwość fal świetlnych odczuwana jest przez nerwy oczne i kojarzona z pojęciem
określonej barwy. Oko ludzkie odróżnia około 130 barw. Podział barw jest umowny
i najczęściej przyjmuje się podział zależny od długości fal.
Tabela 2 – Grupy barw [3,s.115]
Zakres długości fali
(nm)
Grupa barw
380-440
440-480
480-500
500-560
560-590
590-620
620-750
Fioletowych
Granatowych
Niebieskich
Zielonych
Żółtych
Pomarańczowych
Czerwonych
Wybiórcza przepuszczalność (lub pochłanianie) promieniowania przez szkło w różnych
zakresach długości fal determinuje otrzymaną barwę szkła. Dla uzyskania efektu barwienia
szkła wprowadza się do jego składu różne barwniki w postaci tlenków lub soli metali ciężkich.
Wszystkie znane barwniki można podzielić na trzy zasadnicze grupy:
a) barwniki jonowe, do których zalicza się tlenki Co, Ni, Fe, Cu, Mn, Cr, V, U, Nd, Pr i Ce,
b) cząsteczkowe , barwniki w postaci związków FeS, FeSe, CdS, CdSn∙CdSe,
c) barwniki metaliczne, głównie Cu, Ag, Au.
Barwa szkła zależy od: rodzaju barwnika, jego ilości, rodzaju barwionego szkła i warunków
topienia.
W przypadku barwników jonowych barwa szkieł zależy od: rodzaju jonu, stopnia utlenienia,
liczby koordynacji.
Innym podziałem barwników szkła, ze względu na budowę cząsteczek zawiesiny jest podziała
na barwniki:
−
koloidalne – metale w rozproszeniu koloidalnym, np. Ag, Cu, Se,
−
krystaliczne – CdS, CdSe.
Barwa szkieł w tym przypadku zależy od: procesu wtórnej obróbki termicznej, podczas której
cząsteczki osiągają wymaganą wielkość.
Za zjawisko barwy w szkłach odpowiedzialne są procesy fizyczne, takie jak: rozpraszanie
światła, załamanie, odbicie, czy dyfrakcja promieniowania.
Barwa szkieł najczęściej powstaje w wyniku:
a) selektywnego pochłaniania światła, następuje za pomocą:
−
barwników jonowych,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
−
barwników cząsteczkowych,
−
pierwiastków bloku d (Fe, Co, Ni, Mn, Cu),
−
pierwiastków bloku f (Nd, Ce),
b) selektywnego rozpraszania światła, następuje za pomocą zawiesiny cząsteczek
o wymiarach 1-200nm, np. Ag, Au, Cu, Se, CdSe, CdS.
Do najczęściej spotykanych metod barwienia szkieł należą:
−
metody chemiczne,
−
metody fizyczne.
Najczęściej stosowanymi metodami barwienia chemicznego jest metoda zanurzeniowa oraz
metoda pirolizy, a wśród metod fizycznych – metoda próżniowa, której schematy
przedstawiono poniżej.
Schemat metody zanurzeniowej: Kąpiel wyrobu w roztworach związków metaloorganicznych
→ hydroliza związków metaloorganicznych → obróbka cieplna 350-450
0
C, tworzenie się
warstwy metali na powierzchni wyrobu szklanego.
Schemat metody pirolizy: Natryskiwanie powierzchni wyrobu w temperaturze 260-580
0
C,
wodnymi roztworami soli metali lub związkami metaloorganicznymi → dysocjacja termiczna
→ wytworzenie warstwy tlenków metali na powierzchni wyrobu szklanego.
Schemat metody próżniowej: W komorze próżniowej następuje rozpylanie katodowe (katoda z
warstwą Au, Ag, Cu, Cr, Ni) → wytworzenie bombardowania katody zjonizowanymi
cząsteczkami lub atomami rozrzedzanego gazu → uwalnianie cząstek materiału katody →
osadzanie materiału na powierzchni szkła.
4.1.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak zdefiniujesz pojęcie szkła?
2. Jakie znasz techniki otrzymywania szkieł?
3. Jakie są etapy w schemacie technologicznym otrzymywania szkieł?
4. Jakie znasz czynniki opisujące stan szklisty szkła?
5. Na czym polega zjawisko dwójłomności w kryształach?
6. Jaka gęstość powietrza wpływa na optyczne właściwości szkieł?
7. Na czym polega zjawisko rozpraszania światła?
8. Jakie znasz grupy barwników szklarskich?
9. Jakie znasz rodzaje barwników cząsteczkowych?
10. Jakie znasz metody fizycznego barwienia szkieł?
11. Jakie etapy występują podczas barwienia szkła metodą próżniową?
12. Jakie etapy występują podczas barwienia szkła metodą pirolizy?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
4.1.3. Ćwiczenia
Ćwiczenie 1
Zapisz, jakimi technikami można otrzymać szkło.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia techniki otrzymywania szkieł,
2) zapisać techniki otrzymywania szkieł,
3) zaprezentować wykonane zadanie.
Wyposażenie stanowiska pracy:
−
kartka papieru, ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Zapisz etapy otrzymywania szkieł za pomocą dwóch dowolnych technik.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia techniki otrzymywania szkła,
2) zapisać informacje niezbędne do schematu,
3) zapisać etapy otrzymywania szkieł,
4) porównać zapisane schematy,
5) zaprezentować wykonane zadanie.
Wyposażenie stanowiska pracy:
−
kartka papieru, ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 3
Dokonaj oględzin zewnętrznych dwóch materiałów - zlewki z wodą, kawałka szkła.
Wymień znaczące różnice właściwości pomiędzy dwoma stanami materii.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia opisy stanów materii,
2) zapisać cechy zewnętrzne materiałów,
3) zaprezentować zadanie na forum klasy.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Wyposażenie stanowiska pracy:
−
materiały – zlewka z wodą, kawałek szkła,
−
kartka papieru, ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 4
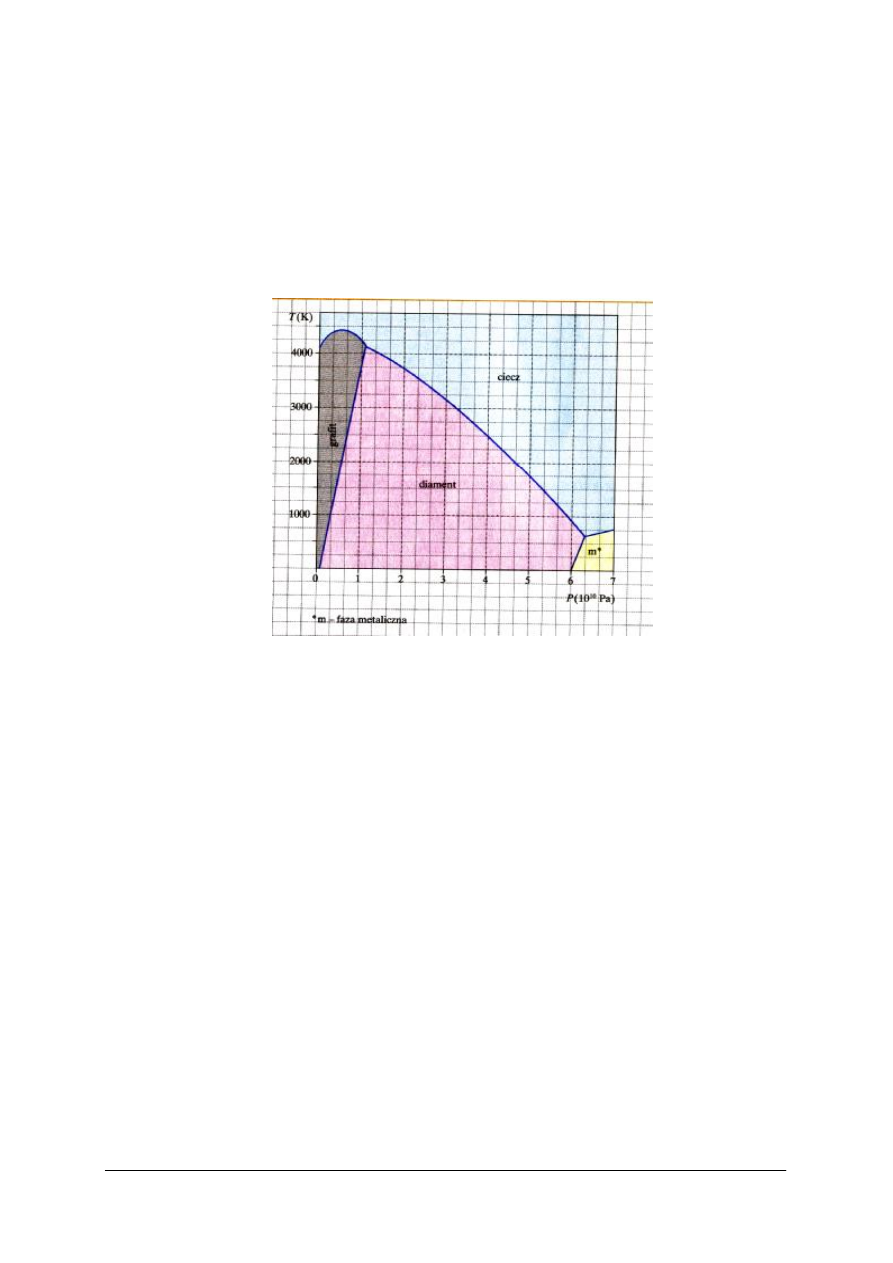
Określ właściwości substancji: diament, ciecz - przedstawionych na rycinie diagramu.
Rys. do ćwiczenia 5. [5]
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia opis właściwości stanów skupienia,
2) zapisać wszystkie cechy substancji,
3) dokonać analizy ryciny diagramowej,
4) określić różnice pomiędzy substancjami,
5) zapisać cechy wspólne substancji.
Wyposażenie stanowiska pracy:
−
kartka papieru, ołówki,
−
poradnik dla ucznia,
−
rycina diagramu,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
4.1.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie szkła?
2) określić techniki otrzymywania szkieł?
3) sporządzić schemat technologiczny otrzymywania szkieł?
4) wskazać etapy procesów w schemacie technologicznym otrzymywania
szkieł?
5) określić skład chemiczny szkła?
6) dobrać zawartość tlenków dla określonego rodzaju szkła?
7) zdefiniować proces dwójłomności szkieł?
8) zdefiniować zjawisko rozpraszania światła?
9) określić grupy barwników szklarskich?
10) rozpoznać barwniki szklarskie?
11) określić metody fizycznego barwienia szkieł?
12) scharakteryzować metodę próżniowego barwienia szkieł?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
4.2. Właściwości szkła
4.2.1. Materiał nauczania
Właściwości płynnej masy szklanej
Masa szklana w stanie stopionym jest cieczą, a najważniejszą jej technologiczną
właściwością jest lepkość albo inaczej tzw. tarcie wewnętrzne. Jest to właściwość cieczy, która
wywołuje opór jednych warstw cieczy przeciwko wciąganiu ich w ruch przez inne poruszające
się warstwy.
Podczas ruchu dwóch sąsiednich warstw cieczy przesuwających się względem siebie z różną
prędkością powstaje przeciwnie skierowana siła F, która jest proporcjonalna do powierzchni S
stykających się warstw i różnicy prędkości dv/dx:
F = η∙S∙dv/dx
Wzór ten jest matematycznym wyrazem hipotezy tarcia wewnętrznego, sformułowany
w 1687r. przez Newtona. Współczynnik proporcjonalności η nazywa się współczynnikiem
tarcia wewnetrznego, współczynnikiem lepkości dynamicznej, czy lepkością newtonowską
cieczy. Współczynnik ten zależy od rodzaju cieczy i temperatury, a nie zależy od prędkości
ścinania.
Jednostką lepkości dynamicznej w układzie SI jest paskalosekunda [Pas = N∙s∙m
-2
] lub
decypaskalosekunda [dPas], odpowiadająca lepkości 1 pauza w układzie cgs.
Lepkość dynamiczna cieczy nienewtonowskich, w określonych warunkach ciśnienia
i temperatury, nie jest wartością stałą lecz zmienia się w zależności od szeregu czynników, np.
szybkości ścinania, kształtu naczynia, w którym się znajduje, itp.
Przyjmuje się, że w obszarach niskich prędkości przepływu i małych lepkości szkło jest cieczą
newtonowską. Przy dużych szybkościach ścinania i dużych lepkościach (np. w niektórych
procesach formowania wyrobów) szkło jest cieczą nienewtonowską.
Lepkość w odniesieniu do stanu szklistego posiada ogromne znaczenie teoretyczne
i praktyczne. Ogólnie wiadomo, że przejście dowolnej substancji w stan szklisty
uwarunkowane jest jej lepkością w temperaturze topienia lub likwidusu (dla układów
wieloskładnikowych) oraz szybkością ochładzania.
Z praktycznego punktu widzenia znajomość lepkości konieczna jest dla prawidłowego
prowadzenia procesów topienia, klarowania, formowania i obróbki szkła, gdyż te stadia jego
wytwarzania uwarunkowane są procesami płynięcia.
Nadzwyczaj ważną, z technologicznego punktu widzenia, jest zależność lepkości szkła od
temperatury. Podczas wytwarzania np. zwykłych krzemianowych szkieł sodowo-wapniowych
lepkość masy szklanej od temperatury topienia (około 1500 °C) do temperatury odprężania
wyrobów (około 500 °C) zmienia się w przybliżeniu 10
13
razy. Ogólnie przyjmuje się, że
lepkość szkła w temperaturze topienia i klarowania wynosi 10
2
dPas, a w temperaturze
pokojowej około l0
20
dPas.
Na rysunku przedstawiono wykres zależności lepkości szkła od temperatury. Na krzywej
można wyróżnić szereg charaktycznych punktów ważnych zarówno dla teorii, jak i dla
praktyki technologicznej.
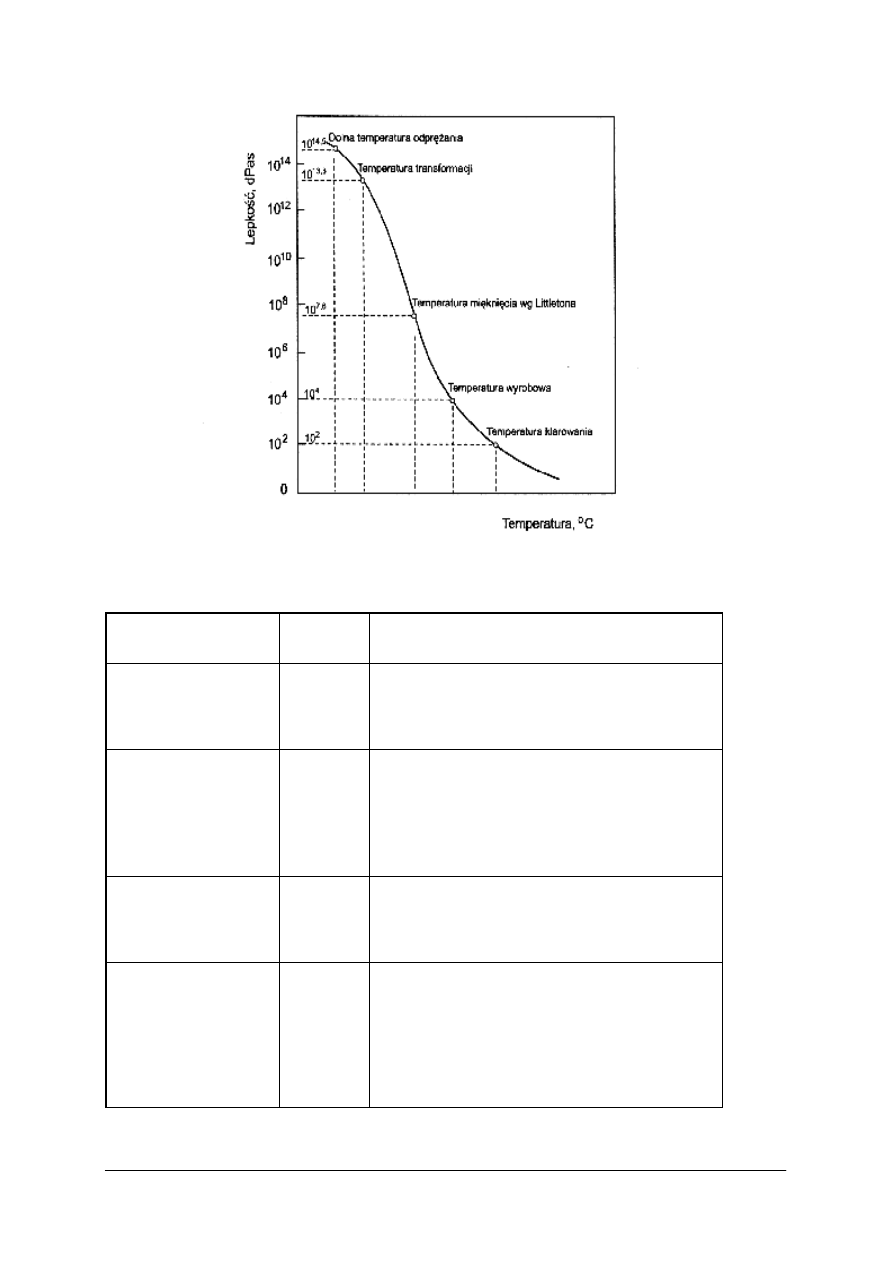
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
Rys. 2 – Zależność lepkości szkła od temperatury. [1,s.89 ]
Tabela 3 – Charakterystyczne punkty na krzywej lepkości. [1,s. 90]
Oznaczenie
Lepkość,
dPas
Opis
Temperatura osiadania
10
4
Temperatura, w której pręt 80Pt+20Rh
(o średnicy 0,5 mm, wysokości 241 mm)
zanurza się w szkło z prędkością 2 cm/min.
Temperatura
mięknięcia wg
Littletona
10
7,65
Temperatura, w której nić szklana o średnicy
0,55-0,77 mm i długości 235 mm, ogrzewana
z szybkością 5-10°C/min wydłuża się pod
własnym ciężarem (w górnych 100 mm nici)
z prędkością
1 mm/min.
Temperatura
mięknięcia
dylatometrycznego
10
11,3
Temperatura, w której występuje maksimum na
krzywej dylatometrycznej. Czas relaksacji
naprężeń wynosi 15 sekund.
Średnia temperatura
deformacji
10
13,3
Temperatura, w której następuje przejście szkła
ze stanu ciekłego w stan stały. Zgodnie
z normami francuskimi ten punkt leży przy
pierwszej anomalii krzywej rozszerzalności
odprężonego szkła; określa się z krzywej
rozszerzalności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
Górna temperatura
odprężania
10
13
Temperatura, w której czas relaksacji naprężeń
wynosi 15 minut.
Dolna temperatura
odprężania
10
14,5
Temperatura, w której czas relaksacji naprężeń
wynosi 4 godziny.
Ze wszystkich właściwości fizykochemicznych szkła, lepkość szczególnie zależy od jego
składu chemicznego. Wpływ poszczególnych składników na lepkość szkła określana jest nie
tylko jego naturą, ale także jego ilością i składem chemicznym szkła podstawowego. Z tego
względu wpływ poszczególnych tlenków na lepkość szkła można rozpatrywać jedynie
jakościowo.
Przy omawianiu wpływu składu chemicznego szkieł na lepkość należy rozróżnić dwa obszary:
wysokotemperaturowy (η < 10
6
dPas) i niskotemperuturowy (η > lO
6
dPas). Wpływ tego
samego składnika na lepkość szkła może być rożny w obu obszarach.
W zakresie wysokich temperatur zmniejszenie lepkości przy zmianie składu chemicznego jest
bezpośrednio związane z osłabieniem sieci przestrzennej szkła, przy czym wzrost efektywności
wprowadzanych do szkła tlenków układa się w szeregu: tlenki szkłotwórcze-tlenki przejściowe
- tlenki modyfikujące. Te ostatnie są więc najbardziej efektywne. W niskotemperaturowym
obszarze lepkości, w którym energia aktywacji lepkościowego płynięcia jest wysoka,
decydującą rolę odgrywa zwięzłość sieci przestrzennej szkła. W tym przypadku efektywność
wpływu poszczególnych kationów w danej grupie tlenków jest funkcją ich wartościowości,
liczby kordynacyjnej i promienia jonowego.
Na podstawie literatury można stwierdzić, że:
−
alkalia obniżają lepkość bardziej, niż wszystkie pozostałe tlenki w zakresie wysokich
temperatur, przy czym Na
2
O obniża bardziej niż K
2
O;
−
MgO i ZnO podnoszą lepkość w niskich temperaturach, ZnO obniża lepkość w wysokich
temperaturach;
−
CaO podnosi lepkość w niskich temperaturach bardziej niż wszystkie inne tlenki.
W wysokich temperaturach natomiast powoduje silne obniżenie lepkości;
−
BaO i PbO w każdej temperaturze obniżają lepkość. Szkła barowe i ołowiowe są szkłami
długimi i miękkimi;
−
B
2
O
3
(do 15% mas.) podnosi lepkość w zakresie niskich temperatur, natomiast obniża
w zakresie wysokich temperatur;
−
A1
2
O
3
, przy niskiej zawartości w szkle podnosi lepkość w całym zakresie. Przy
zwiększeniu stosunku Al
2
O
3
/Na
2
O zmienia się liczba koordynacyjna glinu z 4 na 6
i lepkość szkieł relatywnie obniża się.
Przyjęto umownie, że przeciętny zakres lepkości, odpowiedni do formowania wyrobów
szklanych wynosi 10
3
– 10
8
puazów. Nazywa się go zakresem lepkości kształtowania masy
szklanej lub zakresem lepkości wywarzania wyrobów.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
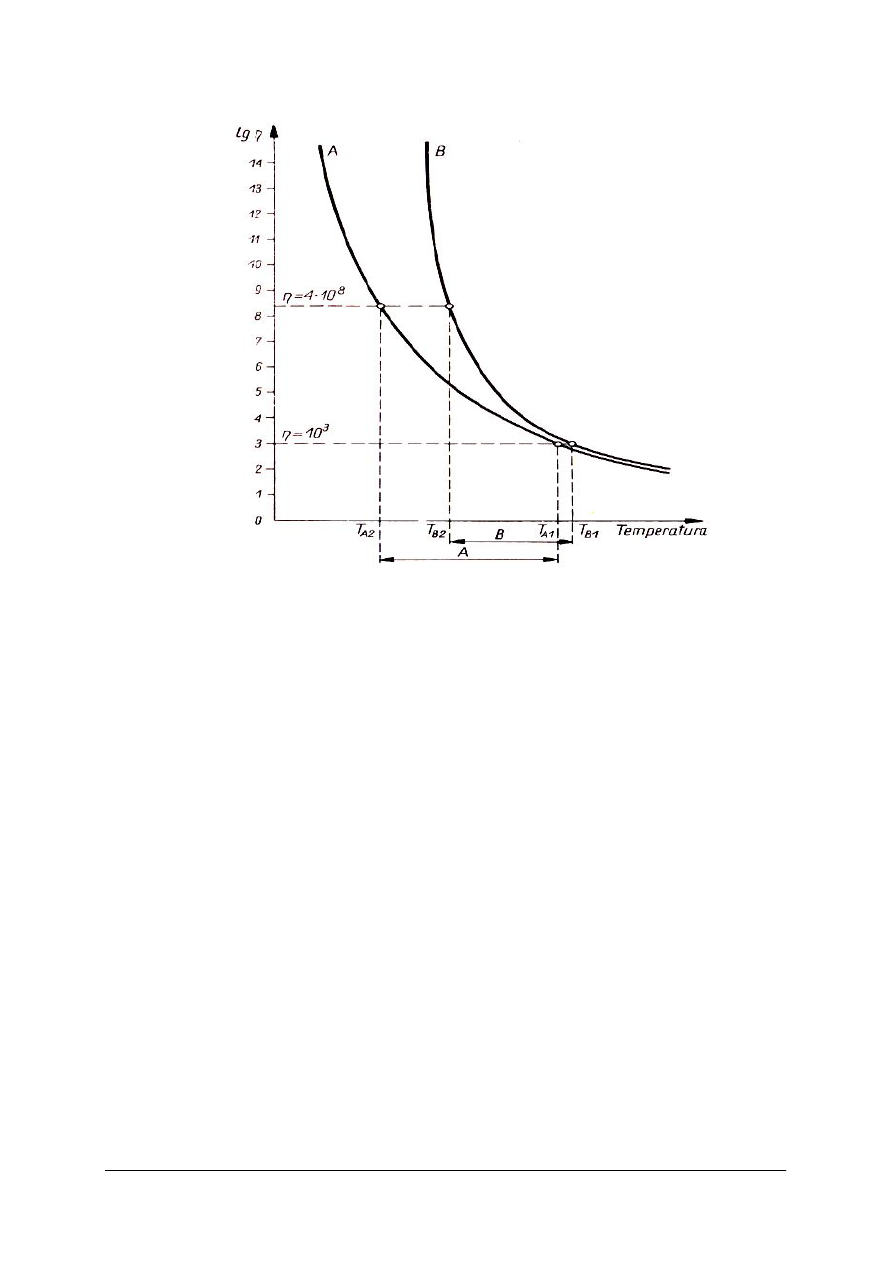
Rys. 3. Wykres zmian lepkości dwóch różnych szkieł różnej długości technologicznej, zależnie od zmian
temperatury. [1,s.93]
Zakres temperatury kształtowania zmienia się w zależności od rodzaju szkła, ściślej –
w zależności od składu chemicznego szkła. Na rysunku 3 przedstawiono wykres lepkości
w funkcji temperatury dla dwóch szkieł o różnym składzie chemicznym. Porównując ich
zakresy temperatury wytwarzania wyrobów, wyznaczone zakresem lepkości 10
3
– 10
8
dPas,
stwierdzamy, że szkło A ma większy zakres temperatury kształtowania masy.
Ponieważ zakłada się, że w jednakowych warunkach stygnięcie bezbarwnych szkieł
przezroczystych odbywa się z jednakową w przybliżeniu szybkością, wnioskujemy iż szkło A,
mające większy zakres temperatury kształtowania, będzie stygło dłużej. Mówi się więc, że
szkło A jest dłuższe technologicznie, zaś szkło B – krótsze. Stąd pojęcie długości
technologicznej szkła.
Jasne jest, że szkła dłuższe mogą być kształtowane dłużej, a więc dokładniej, lub wymyślniej,
ale odbije się to na wydajności produkcji. Szkła krótsze mogą być produkowane szybciej, nie
należy jednak żądać, aby były kształtowane wymyślnie, co wymaga przecież czasu dłuższego.
Stąd wniosek, że długość technologiczna szkła musi być dobrana bardzo wnikliwie do rodzaju
wyrobów i do sposobów ich wytwarzania. Dostosowanie odpowiedniej długości szkła jest
szczególnie ważne przy wytwarzaniu wyrobów za pomocą automatów, mających określony
czas wytwarzania wyrobów. Technolog musi przeto umieć dostosować długość szkła do
warunków pracy wiedząc, iż długość technologiczna szkła zależy od jego składu chemicznego.
Poszczególne tlenki – składniki szkła – wpływają na długość technologiczną w sposób niżej
opisany.
Tlenki podstawowe - Z trzech podstawowych składników szkła: SiO
2
, Na
2
O, CaO, najbardziej
zwiększa długość szkła tlenek sodowy Na
2
O, a najbardziej zmniejsza – tlenek wapniowy CaO.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
Tak więc zamiana CaO na Na
2
O powoduje duże zwiększenie długości szkła. Krzemionka
w tym wypadku nie odgrywa ważniejszej roli. O długości technologicznej zwykłego
trójskładnikowego szkła decyduje stosunek Na
2
O do CaO.
Zamiana SiO
2
na tlenek glinowy Al
2
O
3
powoduje, że długość szkła maleje (szkło staje się
krótsze). Po zamianie CaO na Al
2
O
3
długość szkła się zwiększa.
Zamiana Na
2
O na tlenek borowy B
2
O
3
(co stosuje się najczęściej) powoduje, że długość szkła
wyraźnie się zmniejsza. Po zamianie CaO na tlenek magnezowy MgO w ilości 2% (wagowo)
długość szkła nieco się zwiększa, jednak przy większej zawartości MgO długość szkła nie
zmienia się tak, żeby mogło to odgrywać poważniejszą rolę przy kształtowaniu. Po zamianie
CaO na tlenek cynkowy ZnO długość szkła nieco maleje. Zamiana CaO na tlenek barowy BaO
powoduje wyraźne zwiększenie się długości szkła. Zamiana CaO na tlenek ołowiany PbO
powoduje duże zwiększenie długości szkła. Również zamiana SiO
2
na PbO zwiększa długość
szkła. Zamiana Na
2
O na tlenek potasowy K
2
O powoduje wyraźne zwiększenie długości szkła.
Można więc ułożyć najczęściej stosowane tlenki w następujący szereg, w którym na początku
(od lewej strony) znajdują się tlenki najbardziej zmniejszające (skracające) długość szkła, a na
końcu (po prawej stronie) tlenki najbardziej wydłużające szkło:
ZnO – MgO – CaO – Al
2
O
3
– SiO
2
– B
2
O
3
– Na
2
O – K
2
O – PbO
Wprawdzie takie uszeregowanie porównawcze tlenków pod względem ich wpływu na długość
szkła może mieć tylko znaczenie orientacyjne, jednak na tej podstawie można ocenić
w przybliżeniu i porównać długość różnych szkieł.
Drugą ważną własnością płynnej masy szklanej jest jej podatność na krystalizację. Szkło
w zwykłych warunkach jest nietrwałe, tj. znajduje się w stanie metastabilnym i zawsze istnieje
w nim tendencja przejścia w trwalszy stan krystaliczny. Tendencję tę określa się jako
podatność szkła na krystalizację. Zatem wszystkie szkła będą krystalizować, jeżeli stworzy się
im odpowiednie warunki. Przez termin krystalizacja należy rozumieć cały proces
uporządkowania struktury substancji tak w jawnej, jak i w niejawnej (skrytej) postaci od
powstania elementarnych zarodków krystalicznych do całkowicie skrystalizowanej substancji.
Proces krystalizacji uzależniony jest od wielu czynników. W zależności od tego, który czynnik
przeważa,
rozróżnia
się
następujące
rodzaje
(typy)
krystalizacji:
homogeniczną
i heterogeniczną, spontaniczną (samorzutną) i regulowaną.
Homogeniczna krystalizacja jest to taki proces, w którym w stopie lub w roztworze powstają
samowolnie zarodki krystalizacji i rosną dalej.
Gdy w postaci zarodków krystalizacji będą występować cząstki innej substancji, to wtedy
mówi się o krystalizacji heterogenicznej. Gdy raz rozpoczęty proces krystalizacji przebiega
samorzutnie i nie ma możliwości wpływania na ilość, rodzaj i wymiary powstających
kryształków, to taki proces nazywa się krystalizacją spontaniczną. Jeżeli zmieniając
odpowiednie parametry wpływające na krystalizację można kontrolować ten proces, to taki
proces nazywa się krystalizacją regulowaną (lub kontrolowaną).
Podstawowe zasady krystalizacji szkła poznamy na podstawie wyników niżej opisanego
doświadczenia.
Do pieca elektrycznego w kształcie rury, wewnątrz której temperatura maleje stopniowo, od
pewnej najwyższej do pewnej najniższej – wkładamy pręt szklany. Po odpowiednio długim
przetrzymaniu szkła w tych warunkach cieplnych studzimy szybko pręt i badamy zaszłe
w szkle zmiany. Stwierdzamy, że część pręta, która przebywała w najwyższej temperaturze,
pozostała bez zmian, ale w części dalszej, przetrzymywanej w temperaturze niższej, widać
szkło skrystalizowane. W części pręta bliżej najwyższej temperatury stwierdzamy nieliczne,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
lecz duże kryształy; dalej kryształy maleją, ale liczba ich zwiększa się tak, że tworzą one
w szkle gęstą mlecznobiałą zawiesinę. Jeszcze dalej zawiesina rzednie i wreszcie przechodzi w
szkło czyste.
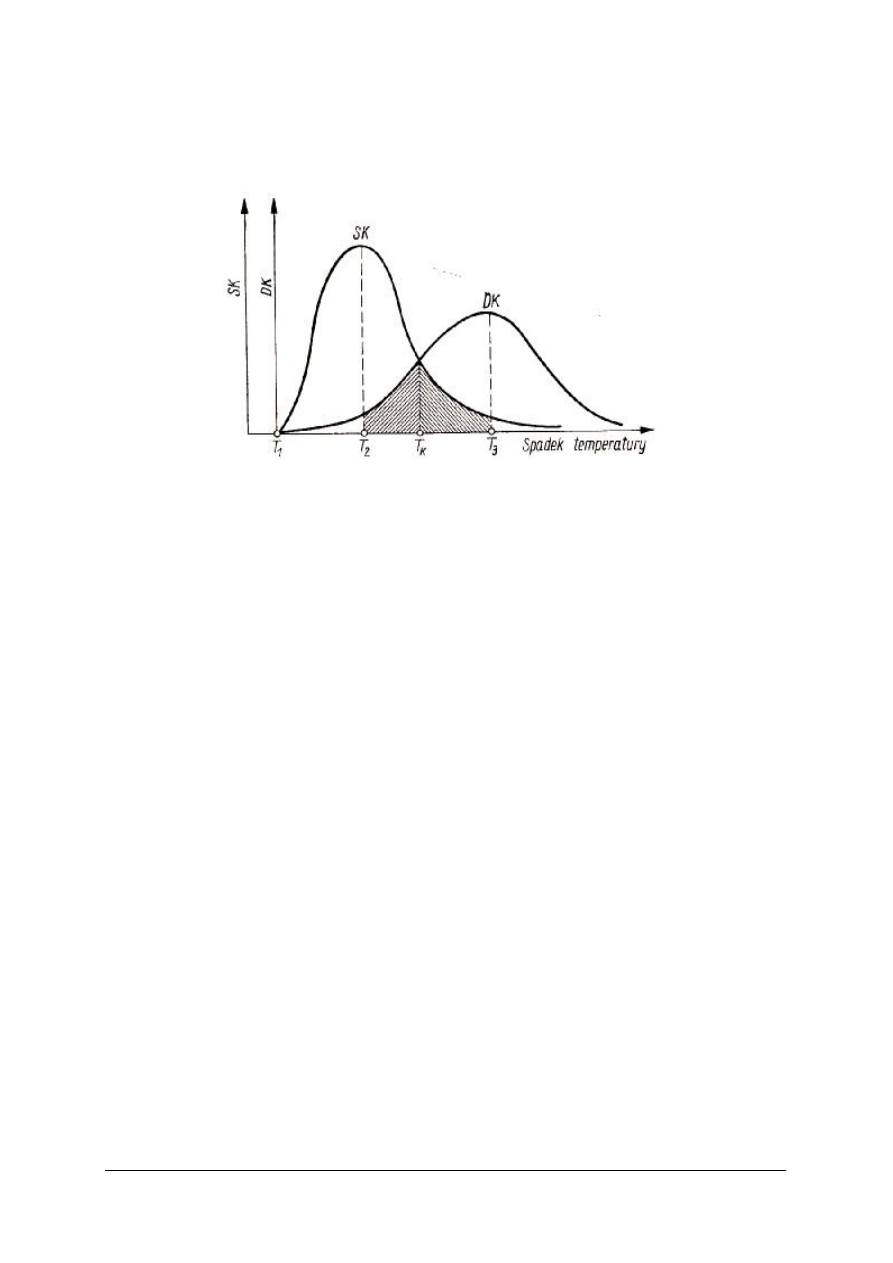
Rys. 4.Wykres szybkości krystalizacji (SK) i dążności do krystalizacji (DK) zależnie od temperatury. [2, s.67]
Wyniki tego doświadczenia przedstawiają się następująco: W pewnym zakresie temperatury
wyższej występuje zdolność wzrostu kryształów, czyli powiększania się ich w miarę upływu
czasu. Zdolność ta potęguje się, gdy temperatura maleje i osiąga maksimum w pewnej
określonej temperaturze, a następnie znów zmniejsza się. Wielkością charakterystyczną dla
stadium krystalizacji, w którym występuje wzrost kryształów, jest szybkość krystalizacji
(symbol SK), czyli szybkość wzrostu kryształów. W pewnym zakresie, nieco niższej
temperatury występuje zwiększenie liczby kryształów, osiągające także maksimum w pewnej
określonej temperaturze, a następnie maleje, aż do zaniku krystalizacji w ogóle. Dla tego
stadium krystalizacji wielkością charakterystyczną jest dążność do krystalizacji (symbol DK),
czyli liczba kryształów tworzących się w jednostce czasu w określonej objętości szkła.
Z wykresu na rysunku wnioskujemy, że szkło może krystalizować tylko w zakresie
temperatury od T
1
do T
3
. W temperaturze wyższej niż T
1
kryształy nie mogą powstawać ani
rosnąć. Czyli temperaturę T
1
można uważać za początkową dla krystalizacji. Nazywa się ją
temperaturą likwidus albo (choć nie ściśle) temperaturą krystalizacji.
W temperaturze niższej od T
3
krystalizacji nie stwierdzamy. Teoretycznie może ona jednak
powstać, lecz w niezmiernie długim czasie, co nie ma znaczenia praktycznego.
Zakres temperatury T
1
– T
3
nazywamy zakresem temperatury krystalizacji. Szkło znajdujące
się w tym zakresie temperatury przez pewien okres (potrzebny do pokonania hamującego
wpływu dużej lepkości szkła) ulegnie krystalizacji; aby więc ustrzec szkło (ewentualnie masę
szklaną) przed krystalizacją, nie należy przetrzymywać go przez dłuższy czas w zakresie
temperatury krystalizacji.
Krzywe SK i DK przecinają się w punkcie odpowiadającym temperaturze T
K
. W tej
temperaturze może wystąpić największa krystalizacja masy szklanej.
W zakresie temperatury T
2
– T
K
tworzy się niewiele kryształów, gdyż wartość DK jest mała,
ale będą one za to rosły dość szybko, gdyż wartość SK jest stosunkowo duża. Kryształy te
składają się przeważnie w kształt kulisty i dlatego nazywane są sferolitami. Mają one widoczną
budowę promieniową, wskazują na to, że narastanie kryształów odbywało się we wszystkich
kierunkach od zarodka znajdującego się w środku kulistego kryształu. Średnica sferolitów
znajdującego się w środku kulistego kryształu. Średnica sferolitów dochodzi niekiedy do
kuliku centymetrów.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
W zakresie T
K
– T
3
zachodzi odmienne zjawisko – tworzy się dużo zarodków (duża wartość
DK), ale rosną one wolno (mała wartość SK). Powstaje mlecznobiała zawiesina dużej
stosunkowo liczby małych kryształków. Tak skrystalizowane szkło upodabnia się do
porcelany. Mówimy, że szkło jest zamącone.
Opisany zakres temperatury krystalizacji jest dla każdego szkła ( mamy na myśli jego skład
chemiczny) inny; inna jest także temperatura początku tego zakresu, czyli temperatura
krystalizacji (likwidus). Dla praktyki przemysłowej bardzo ważna jest znajomość wartości
temperatury krystalizacji każdego szkła, czyli znajomość wpływu składu chemicznego szkła na
wysokość tej temperatury.
Krystalizację ułatwia obecność w masie szklanej innych ciał, np. cząstek niestopionych
surowców z zestawu, kamieni z materiałów ogniotrwałych, a nawet pęcherzy. Powstaje ona na
granicy (na styku) faz, na przykład krystalicznej (kamieni) i ciekłej (masy szklanej) lub gazowej
(pęcherzy). Wszelkie zanieczyszczenia masy szklanej powodują, więc zwiększenie
niebezpieczeństwa krystalizacji.
Z rozważań wynika, że jeśli masa szklana znajduje się w zakresie temperatury krystalizacji,
a szczególnie w krytycznej temperaturze krystalizacji, to może skrystalizować. O tym, czy
skrystalizuje, decyduje czas przebywania masy w zakresie temperatury krystalizacji.
Jeśli masa będzie studzona w sposób naturalny, jak to się zwykle dzieje przy kształtowaniu
wyrobów, to czas, w jakim przebywa ona w zakresie temperatury krystalizacji, jest zbyt krótki,
aby mogła nastąpić krystalizacja. W tym wypadku masa nie skrystalizuje i uda się nam
stosunkowo łatwo otrzymać ją w stanie przechłodzonym bezpostaciowym.
Jeśli jednak masa znajduje się w piecu w zakresie temperatury krystalizacji, to czas
przebywania jej w tym zakresie może być dostatecznie długi do powstawania pełnej
krystalizacji.
Żeby masa szklana nie uległa krystalizacji w dowolnie długim czasie, musi być utrzymywana w
temperaturze wyższej od temperatury likwidusu danego szkła. Należy również liczyć się z tym,
że masa szklana przy dnie wanny i przy bokach, a jeszcze bardziej w rogach wanny ma
temperaturę niższą niż przy powierzchni. Z tego względu należy dążyć do stworzenia takich
warunków, aby i tam nie nastąpiła krystalizacja masy szklanej.
Jednak masę szklaną przeznaczoną do wytwarzania wyrobów utrzymuje się z reguły w takiej
temperaturze, żeby jej lepkość była najbardziej odpowiednia do wytwarzania: nabierania na
piszczel lub nabierak, wydmuchiwania, ciągnięcia itp. Temperatura, w której lepkość szkła jest
odpowiednia do wytwarzania wyrobów, nazywana jest temperaturą wyrobową albo roboczą.
Zadaniem technologów jest tak dobrać chemiczny skład szkła, żeby jego temperatura
wyrobowa była odpowiednio wyższa od temperatury likwidusu tego szkła. Nie jest to zadanie
łatwe. Wymaga ono gruntownej znajomości właściwości szkła i wpływu poszczególnych
składników na tę właściwość.
Zależność podatności na krystalizację od składu chemicznego była przedmiotem wielu prac,
z których wysunięto następujące wnioski:
1. Wprowadzenie tlenku magnezu zamiast tlenku wapnia do 5% znacznie zmniejsza
prędkość krystalizacji i obniża temperaturę znikania kryształów.
2. Zastąpienie krzemionki tlenkiem glinu w ilości 1-1,5% zmniejsza krystalizację szkieł
sodowo-wapniowo-krzemianowych. Zwiększenie zawartości A1
2
O
3
do 3,5%; prawie nie
zmienia krystalizacji szkieł w porównaniu ze szkłami wyjściowymi. Dalsze zwiększenie
zawartości Al
2
O
3
działa szkodliwie, zwiększając krystalizację szkieł.
3. Zastąpienie tlenku wapnia tlenkiem magnezu, przy jednoczesnym wprowadzeniu tlenku
glinu, zamiast krzemionki, wykazuje korzystne działanie w sensie zmniejszenia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
krystalizacji szkieł w porównaniu z wyjściowymi szkłami sodowo-wapniowo-
krzemianowymi.
Różne tlenki wprowadzane do składu szkła wpływają niejednakowo na jego podatność na
krystalizację. Często ten sam tlenek przy małych ilościach wpływa korzystnie na trwałość stanu
szklistego, a przy większych stężeniach wywołuje intensywną krystalizację szkieł. Do takich
tlenków zaliczają się A1
2
O
3
, ZrO
2
, CaO, MgO, BaO, SrO, CdO, ZnO, PbO i in.
E.J. Muchin i N.G. Gutkina na podstawie analizy obszernego materiału eksperymentalnego,
zarówno własnego jak i innych autorów, sformułowali zasady fizykochemiczne ujmujące
zależność między składem chemicznym a podatnością szkieł na krystalizację. Zasady te są
następujące:
−
W układach szkłotwórczych, w obszarze pola krystalizacji danego związku (w ogólnym
przypadku dla związku topiącego się kongruentnie) maksymalną podatność na
krystalizację będzie miało to szkło, którego skład odpowiada składowi związku.
−
Dla szkieł o innym składzie tego samego pola krystalizacji obserwuje się stopniowe
zmniejszenie się podatności na krystalizację w miarę oddalania się ich składów od składu
związku.
−
Podatność na krystalizację osiąga minimum w obszarach jednoczesnej krystalizacji danego
związku ze związkami o innych składach chemicznych (linie i punkty eutektyczne).
Oprócz temperatury (przechłodzenia), czasu i składu chemicznego na podatność na
krystalizację wpływają także inne czynniki: lepkość, stopień niejednorodności masy szklanej,
obecność ciał obcych, kontakt z materiałami ogniotrwałymi, obecność gazów w masie szklanej.
Oprócz dwóch wymienionych wcześniej własciowści masy szklanej, trzecią znaczącą jest
napięcie powierzchniowe, występujace na powierzchni masy szklanej.
Cząsteczki znajdujące się na powierzchni są mocniej przyciągane ze strony warstw
wewnętrznych cieczy niż ze strony cząsteczek ośrodka otaczającego powierzchnię masy
szklanej. Istnienie wypadkowej siły wciągającej cząsteczki do wnętrza powoduje to, że
zwiększenie powierzchni cieczy wymaga zawsze pewnego nakładu energii. Wielkość tej
energii,
odniesiona
do
powierzchni
jednostkowej,
otrzymała
nazwę
napięcia
powierzchniowego i wyraża się w J/m
2
(ergach/m
2
). Napięcie można także zdefiniować jako
siłę potrzebną do utrzymania w równowadze rozciągniętej błonki powierzchniowej stycznie do
linii rozgraniczenia faz. Siła f będzie tym większa, im większa jest długość granicy błonki l, a
więc: f = σl
Współczynnik proporcjonalności σ charakteryzujący daną ciecz nosi nazwę współczynnika
napięcia powierzchniowego i ma wymiar N/m (dyna/m). Wartość liczbowa tego współczynnika
będzie identyczna z ilością energii zużytej na powiększenie powierzchni cieczy o l m
2
.
Do właściwości powierzchniowych związanych z napięciem powierzchniowym należy także
zwilżalność. Ta właściwość jest determinowana stosunkiem między swobodnymi energiami
powierzchniowymi stykających się faz. Intensywność zjawiska zwilżalności wyrażona jest
siłami napięcia powierzchniowego.
Napięcie powierzchniowe masy szklanej odgrywa bardzo dużą rolę w technologii szkła, gdyż
wpływa w sposób zasadniczy nie tylko na przebieg produkcji, ale i na jakość wyrobów. Przy
wytapianiu szkła napięcie powierzchniowe wpływa na usuwanie pęcherzyków gazowych
z masy szklanej oraz na jej homogenizację. Od wielkości napięcia powierzchniowego zależy
szybkość wzrostu pęcherzy gazowych i szybkość ulatniania się ich z masy szklanej. Szybkość
mieszania i znikania nici (niejednorodności) w masie szklanej zależy od stosunku napięcia
powierzchniowego szkła podstawowego i szkła nici. Jeżeli napięcie powierzchniowe szkła nici
jest większe od napięcia powierzchniowego szkła podstawowego, to nić dąży do przyjęcia
formy kulistej, a co za tym idzie, będzie trudno rozpuszczać się. Przy stosunku odwrotnym

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
tych napięć nić będzie dążyć do rozciągnięcia się w błonkę, a więc będzie łatwiej rozpuszczać
się.
Przy wytwarzaniu wyrobów szklanych napięcie powierzchniowe wpływa na to, że:
1) powierzchnie wyrobów dmuchanych lub odlewanych stają się gładkie,
2) przy formowaniu wyrobów metodą wytłaczania masa szklana o dużym napięciu
powierzchniowym źle wypełnia wklęsłości formy i nie daje ostrych krawędzi wzoru,
3) przy wyciąganiu szkła płaskiego sposobem zmechanizowanym napięcie powierzchniowe
powoduje zwężanie się taśmy,
4) przy wytwarzaniu szkła płaskiego metodą float napięcie powierzchniowe warunkuje
uzyskanie wysokiej jakości powierzchni (polerowanie ogniowe).
Napięcie powierzchniowe praktycznych szkieł przemysłowych mieści się w granicach
0,22-0,38 N/m.
Wpływ składu chemicznego szkła na napięcie powierzchniowe jest bardzo zróżnicowany. Duża
grupa składników szkieł krzemianowych wywiera niewielki wpływ na napięcie
powierzchniowe i dlatego zalicza się je do składników nieaktywnych powierzchniowo. Do tej
grupy należą następujące tlenki: SiO
2
, TiO
2
, ZrO
2
, SnO
2
, A1
2
O
3
, BeO, MgO, CaO SrO, BaO,
ZnO, CdO, MnO, FeO, CoO, NiO, Li
2
O, Na
2
O i CaF
2
. Dodatkowe do tej grupy można
zaliczyć rzadziej stosowane składniki, jakimi są La
2
0
3
, Pr
2
O
3
, Nd
2
O
3
, GeO
2
. Niewielką grupę
składników stanowią składniki o charakterze przejściowym, których działanie jest zmienne. Do
nich zalicza się K
2
O, Rb
2
O, Cs
2
O, PbO, B
2
O
3
, Sb
2
O
3
, P
2
O
5
, Na
3
AlF
6
i Na
2
SiFe
6
.
Trzecia grupa składników — to są składniki powierzchniowe aktywne, które na ogół są mało
rozpuszczalne w szkle. Należą do nich As
2
O
3
, V
2
O
5
, WO
3
, MoO
3
, CrO
3
(Cr
2
O
3
) i SO
3
. Te
składniki mogą obniżyć napięcie powierzchniowe szkieł o 20-30% i więcej.
Pod względem wpływu na wartość napięcia powierzchniowego szkła można tlenki
uszeregować następująco:
Al
2
O
3
– MgO – CaO – FeO – BaO – ZnO – Li
2
O – MnO – Na
2
O – SiO
2
– TiO
2
– K
2
O –
PbO – Sb
2
O
3
– Cr
2
O
3
– V
2
O
5
– MoO
3
– WO
3
W praktyce przemysłowej występują często wymagania sprzeczne, a mianowicie:, aby masa
szklana podczas topienia miała napięcie powierzchniowe możliwie najmniejsze, zaś przy
wytwarzaniu wyrobów – największe. W tych wypadkach technolodzy stosują dodatki, które
zmniejszają napięcie powierzchniowe tylko podczas topienia masy, później zaś rozkładają się
lub utleniają i przestają wpływać na wartość napięcia powierzchniowego szkła. Są to (chlorki,
fluorki, sole amonowe i inne).
Oprócz składu chemicznego i temperatury duży wpływ na napięcie powierzchniowe wykazują
inne czynniki, np. otaczająca atmosfera. Napięcie powierzchniowe szkła topionego
w atmosferze silnie redukującej może być większe nawet o 22% od napięcia takiego samego
szkła, lecz topionego w środowisku utleniającym.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
Właściwości fizyczne, chemiczne, optyczne i mechaniczne szkła.
1. Właściwości fizyczne opisane są przez szereg cech fizycznych, z których należy wymienić:
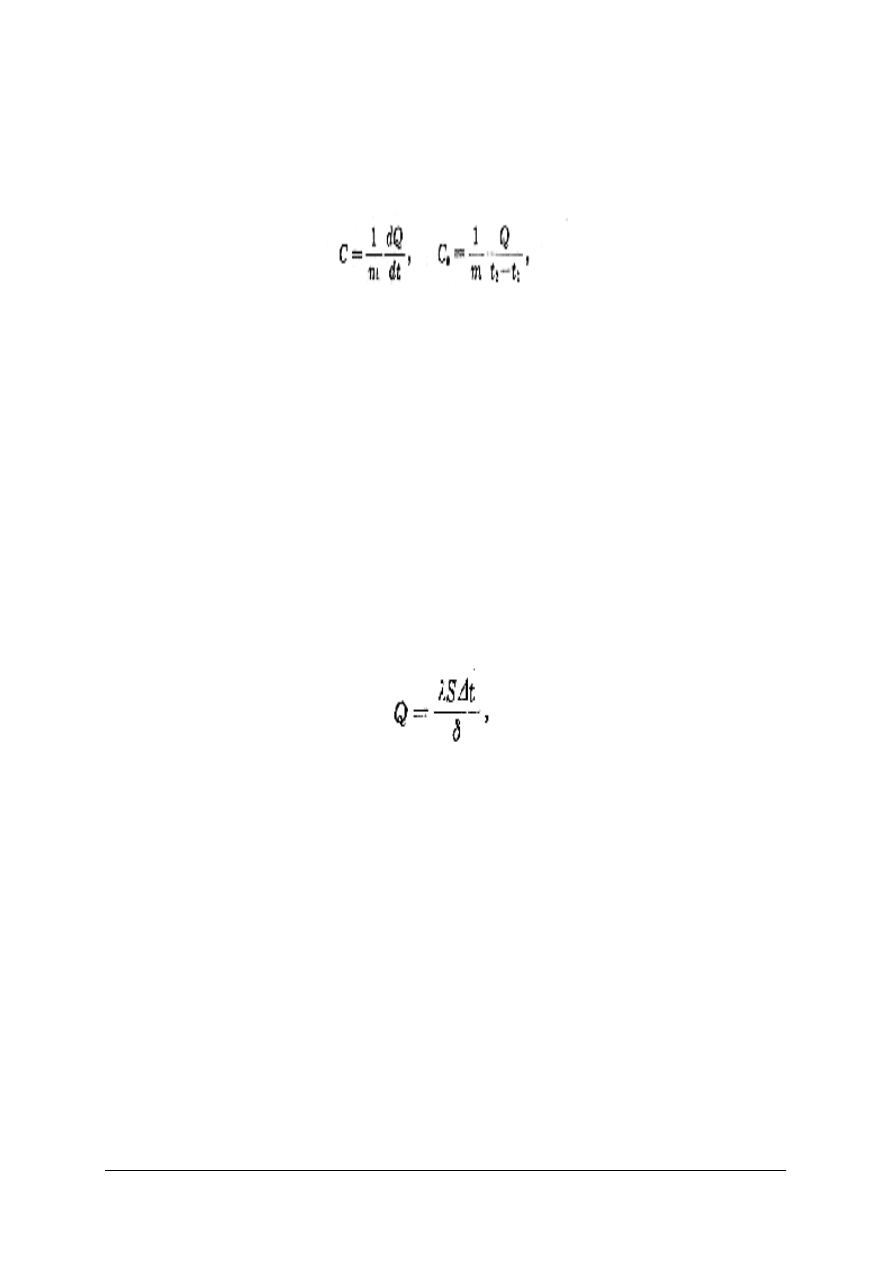
A. Ciepło właściwe jest to ilość ciepła niezbędna w danej temperaturze do ogrzania jednostki
masy o l K. Rozróżnia się wartość rzeczywistą ciepła właściwego C i wartość średnią C
s
,
wyrażone następującymi wzorami:
Gdzie: m – masa substancji,
dQ i Q – ilość ciepła,
dt i (t
2
– t
1
) – różnice temperatur.
Wartość ciepła właściwego szkieł zwiększa się ze wzrostem temperatury. Szczególnie szybko
zwiększa się ona w anomalnym zakresie. W stanie stopionym (ciekłym) wartość ciepła
właściwego dalej wzrasta, ale z mniejszą szybkością. Wielkość ciepła właściwego określa się
zwykle na podstawie pomiaru wzrostu temperatury wody w kalorymetrze, do którego
wrzucono odważoną masę szkła uprzednio nagrzanego do określonej temperatury.
Ciepło właściwe zależy od składu chemicznego szkła. SiO
2
, A1
2
O
3
, B
2
O
3
, MgO, Na
2
O
i szczególnie Li
2
O podwyższają ciepło właściwe. Szkła zawierające duże ilości PbO i BaO
mają niskie ciepło właściwe. Wpływ pozostałych tlenków jest wyraźnie mniejszy. Ciepło
właściwe dla rozmaitych szkieł ma wartość 420-1000 J/kg∙K , przy czym niższe wartości
obserwuje się dla szkieł o większej sztywności szkieletu.
B. Przewodnością cieplną nazywa się zdolność ciała do przekazywania ciepła w kierunku
niższych temperatur. Ilość ciepła Q przepływającego przez ciało w jednostce czasu przy
ustalonym strumieniu cieplnym wynosi:
Gdzie: λ – współczynnik przewodności cieplnej,
S – powierzchnia przekroju,
∆t – różnica temperatury,
δ – grubość.
Współczynnik przewodności cieplnej określa się ilością ciepła, która przenika w ciągu
l sekundy przez l m
2
powierzchni przedmiotu szklanego grubości l m przy różnicy temperatury
ścianek przedmiotu wynoszącej l K i wyraża się w W/m∙K.
Podobnie jak w metalach, występowanie błonek powierzchniowych wywiera w szkle znaczny
wpływ na przepływ ciepła; jednakże – odmiennie niż dla metali – wielkie znaczenie dla
przepływu ciepła ma również stopień przezroczystości szkła, zwłaszcza w wyższej
temperaturze.
Dla przemysłowych warunków formowania i użytkowania szkła przewodność cieplna ma
zasadnicze znaczenie. Mała przewodność cieplna szkła przejawia się głównie w małej
odporności na zmiany temperatury i w zdolności szkła do hartowania się. Przy produkcji
różnych mas szybciej stygnie to szkło, które ma większy współczynnik . Ma to niewątpliwie
wpływ na wydajność formowania, szczególnie przy tłoczeniu, choć przepuszczalność dla
promieniowania odgrywa przy formowaniu nie mniejszą rolę. Szkło o dużym współczynniku
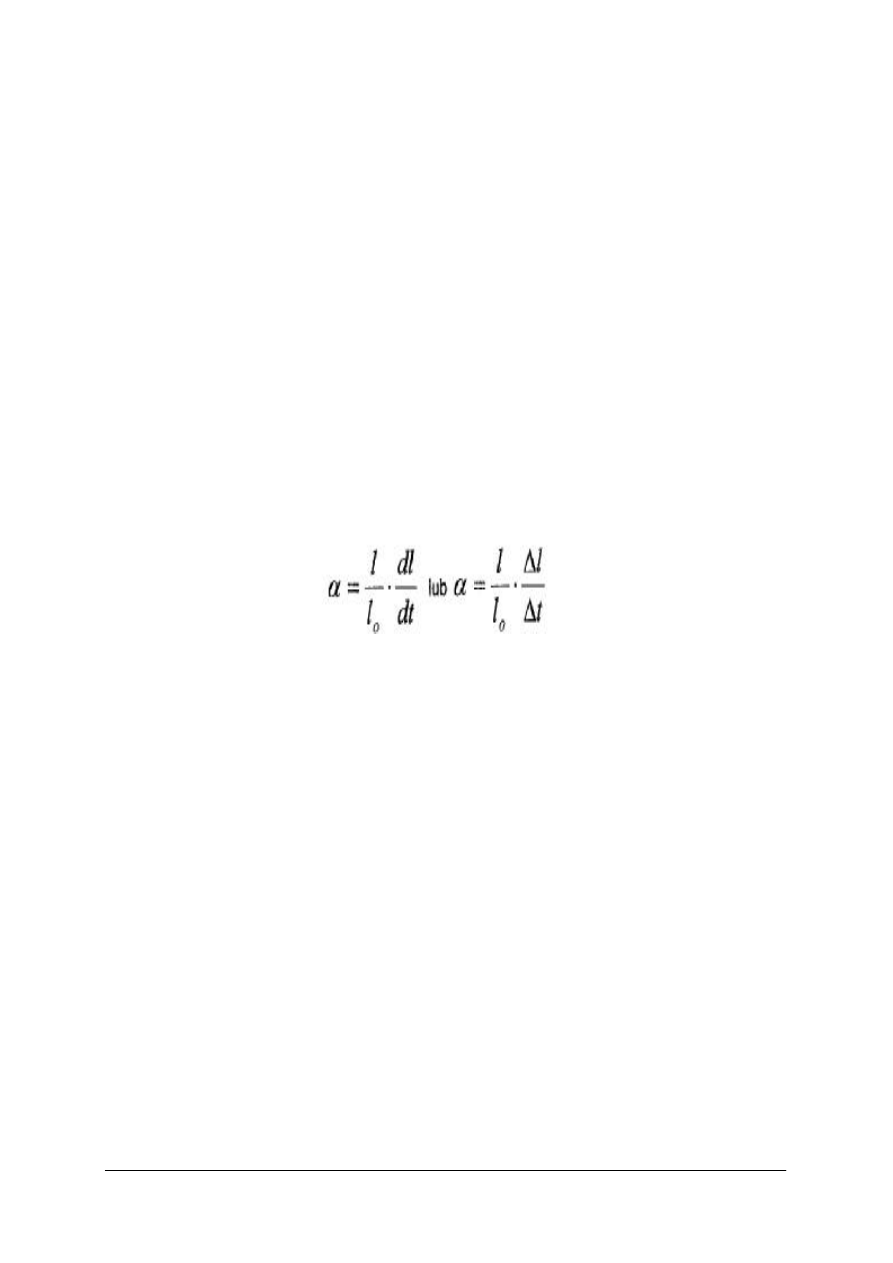
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
(zawierające więcej krzemionki) jest również bardziej wytrzymałe na nagłe zmiany
temperatury.
Przewodność cieplna wywiera wpływ na technologiczną przydatność szkła nie tylko w zakresie
temperatur formowania; ma ona również decydujące znaczenie dla szybkości odprężania szkła.
Mała przewodność cieplna szkła jest jedną z ważniejszych przyczyn powstawania naprężeń w
szkle przy formowaniu, a najważniejszą – przy hartowaniu.
W użytkowaniu szkło jest względnie dobrym izolatorem ciepła, co z powodzeniem
wykorzystywane jest w budownictwie (szyby w oknach).
Na przewodność cieplną silniejszy wpływ ma struktura niż skład chemiczny szkła. Można
jednak ogólnie stwierdzić, że zwiększenie liczby wiązań o dużej energii (większa sztywność
szkieletu) powoduje zwiększenie przewodności cieplnej, dlatego wzrost zawartości SiO
2
,
zastępowanie CaO przez BaO, Na
2
O przez K
2
O poprawia przewodność cieplną.
Z pojęciem przewodności cieplnej ściśle związana jest rozszerzalność cieplna, gdyż większość
ciał, a wśród nich wszystkie szkła, zwiększają przy ogrzewaniu swoją objętość, a zatem i swe
wymiary liniowe. Rozszerzalność cieplną szkła charakteryzuje się liniowym lub objętościowym
współczynnikiem rozszerzalności cieplnej.
Liniowym współczynnikiem rozszerzalności cieplnej szkła w danej temperaturze nazywa się
przyrost długości próbki szkła – najlepiej w postaci pręta – przeliczonym na jednostkę
długości, przy wzroście temperatury o 1K. Można to przedstawić wzorami:
Gdzie: l
0
– długość próbki,
dl i ∆l – przyrost długości próbki,
dt i ∆t – różnice temperatury odpowiadające przyrostom długości.
Skład chemiczny szkieł ma istotny wpływ na współczynnik rozszerzalności cieplnej.
Zmniejszeniu współczynnika rozszerzalności sprzyja zwiększenie zawartości B
2
O
3
, SiO
2
, ZnO,
A1
2
O
3
, ZrO
2
i MgO. Wprowadzenie zwiększonej zawartości tlenków alkalicznych oraz CaO i
BaO zwiększa wartość współczynnika rozszerzalności. Odpowiednio do tego wielkość
współczynnika rozszerzalności różnych szkieł zmienia się w bardzo szerokich granicach.
C. Odporność termiczna szkła to właściwość szkła do wytrzymywania nagłych zmian
temperatury bez zniszczenia. Określa się ją przez pomiar największej różnicy temperatury, jaką
mogą wytrzymać – nie pękając – próbki szkła. W odróżnieniu od innych właściwości cieplnych
odporność termiczna szkła jest charakterystyką szkła zależną od intensywności przekazywania
ciepła na powierzchni szkła, jakości tej powierzchni oraz od wymiarów geometrycznych.
Dlatego też rozróżnia się odporność termiczną szkła jako tworzywa określaną na
znormalizowanych próbkach oraz odporność termiczną wyrobu szklanego określaną na
gotowych wyrobach. Odporność termiczna szkła jest skomplikowanym zespołem
podstawowych
właściwości
szkła,
z
których
najważniejszymi
są:
współczynnik
rozszerzalności, stan powierzchni oraz wytrzymałość na rozciąganie w warstwach
powierzchniowych.
A. Winkalmann i O. Scott na podstawie rozważań teoretycznych doszli do wniosku, że
odporność szkła na nagłe zmiany temperatury można opisać współczynnikiem wyliczonym ze
wzoru:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
Gdzie: K- współczynnik odporności termicznej szkła,
λ – współczynnik przewodności cieplnej,
c – ciepło właściwe,
σ
r
– wytrzymałość szkła na rozciaganie,
ς – gęstość,
ά – współczynnik liniowej rozszerzalności cieplnej,
E – moduł sprężystości szkła (Younga).
Odporność termiczną wyrobu określa się w zależności: ∆t = W∙ K
Gdzie: ∆t – różnica temperatur, przy której następuje zniszczenie wyrobu próbki,
W – stała zależna od kształtu i wymiarów wyrobu lub próbki,
K – współczynnik odporności termicznej szkła.
Odporność termiczna zależy od składu chemicznego szkła, w sposób określony wpływem
składu na współczynnik rozszerzalności cieplnej i na właściwości mechaniczne szkła, gdyż
wielkości znajdujące się pod znakiem pierwiastka mało wpływają na wartość współczynnika
odporności termicznej.
Odporność na zmiany temperatury kształtuje się dla różnych szkieł jak następuje: szkło
sodowo-wapniowe (zwykłe) do 90K (opakowania ok. 35 K), baloniki żarówkowe ok. 150 K,
szkło laboratoryjne ok. 140 K, szkło Pyrex ok. 250 K, szkło krzemionkowe ok. 800 K.
Szkło wytrzymuje ok. 8 razy większe zmiany temperatury przy nagłych, nie skupionych
ogrzaniach niż przy nagłych oziębieniach. Wytłumaczenie tego zjawiska opiera się na fakcie
znacznie większej wytrzymałości szkła na ściskanie niż na rozciąganie; uwzględniając małą
przewodność cieplną szkła łatwo sobie uprzytomnić, że przy nagłym ogrzewaniu zimnego
szkła warstwy zewnętrzne są ściskane, podczas gdy przy nagłym studzeniu gorącego szkła - na
odwrót - warstwy powierzchniowe są rozciągane (a wnętrze szkła podlega wtedy ściskaniu).
Szkło hartowane ma ok. 2÷4-krotnie wyższą odporność na zmiany temperatury niż szkło
dobrze odprężone. Na przykład szyby ze szkła hartowanego wytrzymują różnicę temperatur do
270 K, podczas gdy szyby odprężone wytrzymują tylko 70 K.
Jeżeli cykliczne wahania temperatur nie są wielkie, to ich wpływ można pominąć, jednakże dla
wahań o średniej i dużej wielkości wpływ ten gwałtownie rośnie z częstością wahań
temperatury.
2. Właściwości chemiczne szkła, reprezentowane są przez następujące cechy:
A. Odporność na działanie wody.
Chemiczną odpornością nazywa się zdolność do przeciwstawienia się szkła niszczącemu
działaniu środków chemicznych. Szkło, w porównaniu z innymi materiałami, odznacza się dużą
odpornością na wpływy atmosferyczne i na działanie substancji chemicznych. Ze względów
praktycznych odporność na działanie wody ma największe znaczenie.
Należy rozróżniać dwa sposoby oddziaływania wody na szkło: w postaci wilgotnej atmosfery i
ciekłej wody. Mechanizm niszczenia szkła przez wilgotną atmosferę zaczyna się od
zaadsorbowania na powierzchni szkła cząsteczek wody. Zaadsorbowana woda wiąże się
strukturalnie ze szkłem i w postaci grup OH pokrywa jego powierzchnię. Te grupy powodują
dalszą sorpcję wody i powstanie warstewki wody grubości kilkudziesięciu cząsteczek. Jeżeli w
szkle znajduje się niewielka ilość higroskopijnych krzemianów (sodu, potasu, rubidu. cezu
i baru), to proces kończy się na utworzeniu tej warstewki.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
Jeżeli szkło zawiera dużo alkaliów, to proces sorpcji wody następuje dalej i woda przenika
w głąb szkła, a powierzchnia pokrywa się kroplami i ciągłymi warstwami stężonego roztworu i
produktów rozpuszczania szkła (głównie wodorotlenków alkalicznych). W dalszym
oddziaływaniu wilgotnej atmosfery może nastąpić takie zniszczenie powierzchni szkła,
że wystąpi zmętnienie szkła (zwietrzenie). Duża higroskopijność szkieł uniemożliwiająca
praktyczne ich stosowanie występuje, gdy zawartość alkaliów przekracza 17% mol., a dla
szkieł optycznych 13% mol.
Higroskopijność zmniejszają następujące tlenki wprowadzane do składu szkła: B
2
O
3
, A1
2
O
3
,
TiO
2
, CaO, ZnO, ZrO
2
, SnO
2
i tlenki ziem rzadkich. Słabsze działanie wykazują PbO, MgO,
SrO i BaO.
Ciekła woda oddziałuje na szkło przede wszystkim w wyniku wyługowywania rozpuszczalnych
w wodzie krzemianów metali alkalicznych i baru. Krzemiany ciężkich metali (Pb, Zn, Cd)
także ulegają hydrolizie przy działaniu wody, jednak nierozpuszczalne produkty hydrolizy
pozostają na miejscu ich powstania. Po wyługowaniu krzemianów pozostaje błonka
krzemionki, która hamuje proces działania wody na szkło. W temperaturze powyżej 60°C
woda zaczyna w określonym stopniu rozpuszczać także krzemionkę i oddziaływanie wody
sprowadza się w tym przypadku nie tylko do wyługowywania, lecz do pewnego rozpuszczania
szkła jako całości. Proces taki następuje, gdy objętość wody jest dostatecznie duża, aby
odprowadzić z miejsca reakcji produkty powstające przy niszczeniu szkła. Natomiast gdy na
szkło działa ograniczona ilość wody i produkty reakcji pozostają na miejscu ich powstawania,
to wzrasta ich stężenie w miarę upływu czasu, i to powoduje wtórne oddziaływanie na szkło
produktów powstających przy niszczeniu szkła. Oddziaływanie takich roztworów zbliżone jest
do oddziaływania zasad na szkło.
Z innych czynników wpływających na odporność hydrolityczną szkła można wymienić
ważniejsze, gdyż w tej dziedzinie prowadzone są bardzo obszerne badania:
1) obróbka cieplna (szkła hartowane mają mniejszą odporność),
2) cykliczność działania wody (powoduje zmniejszenie odporności szkła),
3) kształt (stosunek powierzchni do objętości) i sposób formowania (np. wewnętrzna
powierzchnia butelek wykazuje mniejszą odporność),
4) erozja bądź warunki badania w parze wodnej lub w autoklawie (co może prowadzić nawet
do całkowitego roztwarzania szkła),
5) wpływ środków przyspieszających (np. małe ilości NaOH) lub środków opóźniających
(tzw. inhibitorów, np. mały dodatek A1(OH)
3
lub ZnSiO
3
),
6) obecność SO
2
(16-krotne zwiększenie odporności dzięki utworzeniu zmywalnej warstewki
sulfatu o grubości 30-70 nm),
7) absorpcja CO, z powietrza i wiele innych.
B. Odporność na działanie kwasów
Niszczenie szkła roztworami kwasów następuje na zasadzie wypierania kwasu krzemowego
z krzemianów kwasami silniejszymi.
Powstający kwas krzemowy szybko polimeryzuje i koaguluje do postaci żelu, przedostając się
do roztworu tylko w małych ilościach. Metale natomiast prawie całkowicie przechodzą do
roztworu i w ten sposób szkło pokrywa się warstewką krzemionki, której grubość może sięgać
setek nanometrów.
Odporność szkieł przemysłowych na działanie kwasów jest dużo większa niż odporność na
działanie wody (ze względu na zobojętnienie wydzielanych ze szklą alkaliów), z wyjątkiem
roztworów kwasu fluorowodorowego, który już na zimno rozkłada szkło (z wydzieleniem
SiF
4
, i fluorków), oraz kwasu fosforowego, który rozkłada szkło już w temperaturze 100°C.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
Na odporność chemiczną na działanie kwasów wpływają te same czynniki i w takim samym
kierunku jak w przypadku higroskopijności szkła i odporności hydrolitycznej. Jedynie w danym
przypadku obserwuje się mniejsze zróżnicowanie wpływu poszczególnych tlenków, gdyż
wodorotlenki prawie wszystkich metali stosowanych w szklarstwie są rozpuszczalne
w kwasach. Wyjątek stanowią wodorotlenki Ta, Nb i Ti, które w dużym stopniu podnoszą
odporność chemiczna na działanie kwasów. Metale alkaliczne i ziem alkalicznych podwyższają
odporność na działanie kwasów odwrotnie proporcjonalnie do promienia jonowego metalu.
Zwiększenie stężenia kwasów do wartości pH = 1,5 powoduje intensyfikację niszczenia szkła
w przybliżeniu proporcjonalnie do logarytmu stężenia. Dalszy wzrost stężenia kwasu
powoduje zahamowanie reakcji, a według niektórych danych w bardzo stężonych kwasach
ustaje całkowicie ich działanie niszczące. Według intensywności oddziaływania różnych
kwasów na szkło przy takim samym pH można kwasy uszeregować zgodnie ze stałymi
dysocjacji.
Poddając szkło odpowiedniej obróbce można kilkadziesiąt razy zwiększyć odporność szkła
przez wytrawienie jego powierzchni kwasami i następnie wygrzanie szkła w temperaturze
około 400°C. Zwiększenie odporności osiąga się przy tym przez wytworzenie trwałej
warstewki krzemionkowej, następnie jej zagęszczenie.
C. Odporność na działanie zasad
Ługi działają na szkła przemysłowe na ogół około 100 razy silniej niż kwasy, gdyż powodują
przejście żelu krzemionkowego z powierzchni szkła do roztworu koloidalnego. Silniejszy niż
w przypadku działania kwasów rozkład szkła tłumaczy się tym, że na szkle nie mogą
wytworzyć warstewki ochronne.
Zniszczenie więźby, rozrywanie wiązań Si-O-Si gra decydującą rolę przy działaniu roztworów
alkalicznych na zwykłe szkła przemysłowe.
Charakterystyczną
cechą
oddziaływania
zasad
na
szkło,
podobnie
jak
kwasu
fluorowodorowego i fosforowego, jest rozpuszczanie warstw powierzchniowych całkowicie,
przy czym prędkość rozpuszczania jest stała, a grubość strawianej warstwy jest proporcjonalna
do czasu oddziaływania roztworu. Działanie takich reagentów zwykle wywołuje naruszenie
gładkości powierzchni szkła i utratę przezroczystości.
Niszczenie szkła roztworami zasad polega na rozpuszczaniu krzemionki znajdującej się w szkle
i tworzeniu stabilnych anionów Si
2
O
5
2-
, Si
2
O
4
4-
, SiO
3
2-
. Kationy znajdujące się w szkle tworzą
wodorotlenki lub związki typu glinianów i cynkanów.
Pod względem korozyjności wodorotlenki alkaliów układają się w szereg Na > K > Li > NH
4
,
a wodorotlenki metali ziem alkalicznych – w szereg Ba > Sr > Ca. Odporność na działanie
ługów wzrasta pod wpływem dodatku ZrO
2
i BeO.
Be, Zn i Al w postaci anionów mogą być inhibitorami korozji, zmniejszając korozję nawet
około 20 razy.
Roztwory fosforanów wywierają wielokrotnie silniejsze działanie korodujące niż roztwory
wodorotlenków alkaliów. Roztwory mieszanin węglanów alkaliów i roztwory mieszanin
węglanów z wodorotlenkami alkaliów działają silniej niż roztwory tychże substancji wziętych
pojedynczo. Jest to tzw. I i II paradoks sodowy.
W zwykłych szkłach przemysłowych odporność na działanie zasad maleje proporcjonalnie do
wzrostu stężenia reagentów, lecz w szkłach zawierających PbO i ZnO odporność przechodzi
przez minimum przy stężeniach ok. 6-7 normalnych.
D. Odporność na wietrzenie
Wietrzenie jest to proces chemicznych zmian na szkle spowodowany działaniem wody lub pary
wodnej oraz gazów zawartych w atmosferze, głównie CO
2
i SO
2
. W przypadku szkła skutki

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
wietrzenia występują początkowo w postaci cienkiej, iryzującej (powodującej tęczowe
odblaski) warstewki, później - opalescencji, białego nalotu, galaretowatego osadu na
powierzchni, a na koniec - łusek. Początkowe stadia wietrzenia można obserwować na starych
oszkleniach, a stadia końcowe - na szkłach starożytnych, w muzeach.
Iryzację powoduje ochronna warstwa żelu krzemionkowego na powierzchni szkła, mająca
grubość wyrażającą się w ułamkach długości fal świetlnych. W warstwie tej zachodzi
interferencja światła, która jest przyczyną zjawiska iryzacji.
Opalescencję (zmatowienie) i białe naloty powodują produkty reakcji wodorotlenków
(powstałych wskutek hydratacji i hydrolizy) z CO
2
z powietrza, nie usuwane z powierzchni
szkła. W wyniku reakcji powstają uwodnione węglany, które wraz z galaretowanym żelem
krzemionkowym, ługami i wodą tworzą biały osad na powierzchni. Wysychanie tego osadu
powoduje białe naloty na powierzchni szkła.
Występowanie galaretowatego osadu lub łusek świadczy o tym, iż proces korozji posunął się
już daleko w głąb szkła.
Jak widać, wietrzenie jest złożonym procesem chemicznym. Odporność na wietrzenie jest
właściwością pokrewną odporności szkła na działanie wody. Wpływ różnych czynników
opisanych przy omawianiu tamtej właściwości szkła odnosi się zatem i do odporności szkła na
wietrzenie.
Znaczenie przemysłowe odporności szkła na wietrzenie jest oczywiście bardzo duże dla
właściwego transportu, przechowywania i użytkowania
szkła. Na przykład wytworzony wilgotny osad może stać się spoiwem między płytami szkła, co
powoduje zlepianie się płyt szkła przechowywanego:
1) w wilgoci,
2) w temperaturze niższej od temperatury napływającego z zewnątrz powietrza (wykraplanie
się wilgoci),
3) w nieodpowiednim (higroskopijnym lub alkalicznym) papierze.
Wietrzenie zależy od zdolności zwilżania szkła, na którą można oddziaływać czynnikami
fizycznymi i chemicznymi. Jednym z wielu problemów związanych z metodami chroniącej
przed wietrzeniem obróbki jest hydrofobizacja szkła, która może mieć duże znaczenie
praktyczne.
3. Właściwości optyczne
Do podstawowych cech optycznych szkła należą: współczynnik załamania światła, dyspersja
całkowita i cząstkowa oraz współczynnik dyspersji.
Własności optyczne wyznaczone są przez następujące cechy:
A. Absolutny współczynnik załamania światła monochromatycznego o długości fali dla danego
ośrodka jest to stosunek szybkości rozchodzenia się drgań w próżni i w badanym ośrodku.
Względny współczynnik załamania światła dla danego szkła jest to stosunek szybkości fali
w powietrzu i w badanym szkle. Współczynnik załamania światła jest także równy stosunkowi
sinusów kąta padania i kąta załamania, w płaszczyźnie padania.
Zależność współczynnika załamania od długości fali promieniowania (światła) nazywa się
dyspersją.
Na podstawie współczynnika załamania i dyspersji szkła optyczne są dzielone na dwie wielkie
grupy: krony i flinty. Krony mają niską wartość współczynnika załamania i wysokie
współczynniki dyspersji. Flinty charakteryzują się wysokimi wartościami współczynnika
załamania i niskimi wartościami współczynnika dyspersji.
Stałe optyczne zależą od wielu czynników. Przede wszystkim od składu chemicznego szkieł
i ich struktury, a także od temperatury i czasu.
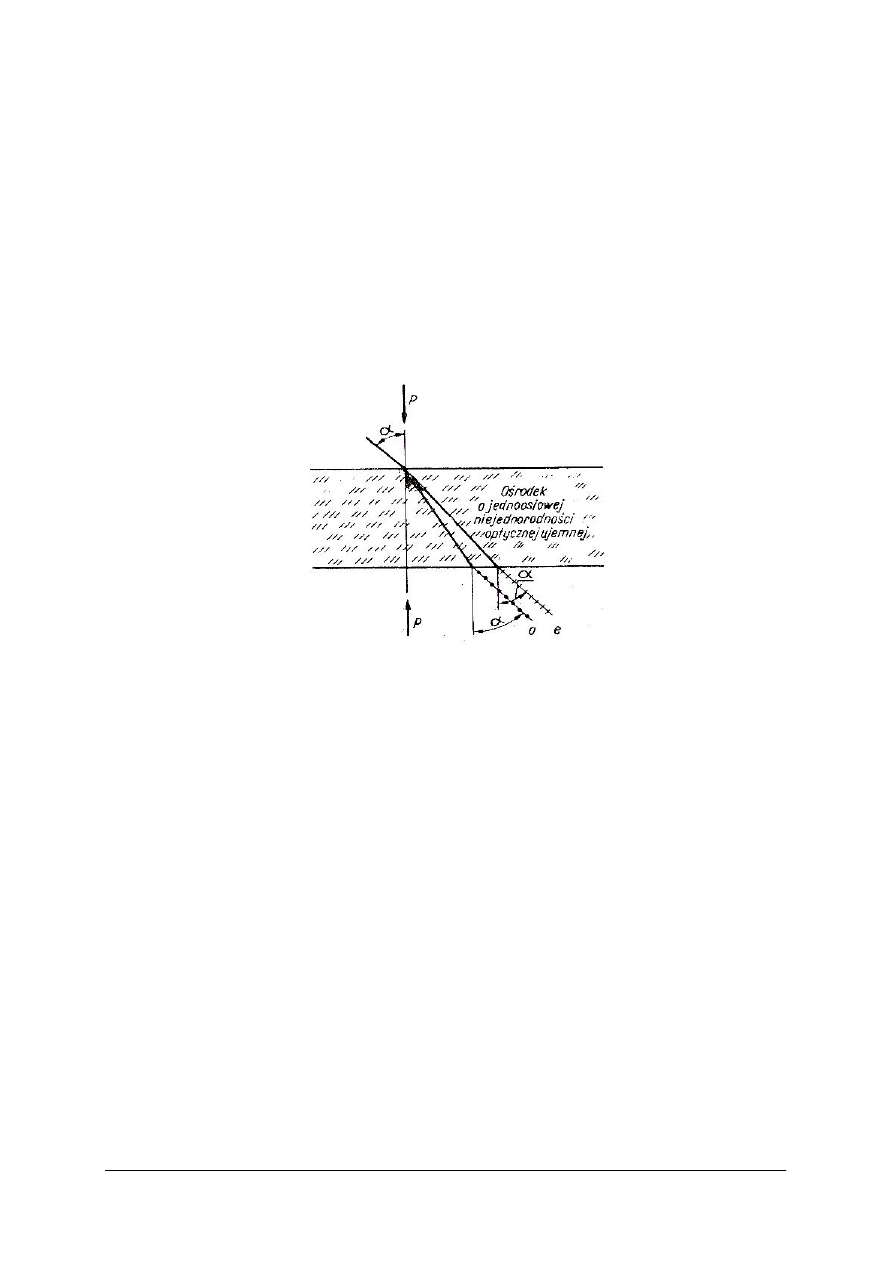
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
Dokładna znajomość wartości współczynnika załamania jest oczywiście najważniejsza przy
produkcji i użytkowaniu szkieł optycznych.
B. Dwójłomność
Dwójłomnością nazywa się występujące w ciałach optycznie anizotropowych zjawisko
rozszczepienia światła na dwa promienie światła spolaryzowanego liniowo. Szkło jest ciałem
izotropowym, lecz zjawisko dwójłomności można wywołać w nim następującymi sposobami:
−
przez przyłożenie nieizotropowych obciążeń mechanicznych,
−
przez przyłożenie nieizotropowych obciążeń termicznych,
−
przez wytworzenie niejednorodności chemicznej (różnicy współczynników rozszerzalności
lub różnicy temperatur zeszklenia),
−
przez wytworzenie niejednorodności innych rodzajów, np. radiacyjnej.
Rys. 5. Obraz przebiegu promieni fal świetlnych jednobarwnych przez ośrodek o jednoosiowej
niejednorodności optycznej. Kropki – drgania prostopadłe, kreski – drgania równoległe
do płaszczyzny padania. [3,s. 109]
Szkła są zwykle optycznie ujemne, tzn. że promień zwyczajny ma większy współczynnik
załamania światła niż nadzwyczajny.
Różnica współczynników załamania obu promieni na l cm grubości szkła nazywa się
dwójłomnością.
Dwójłomność jest, praktycznie biorąc, jedyną właściwością umożliwiającą w hutach szkła
ocenianie jakości odprężenia, od której, jak wiadomo, decydująco zależy trwałość wyrobów
szklanych.
C. Odbicie, pochłanianie i przepuszczalność promieniowania przez szkło
Przy oddziaływaniu promieniowania elektromagnetycznego na szkło zachodzą zjawiska, które
ujawniają pewne cechy szkła określane jako właściwości optyczne. Zakres długości fal
elektromagnetycznych 180-5000 nm określany jest jako zakres optyczny.
Jeżeli strumień promieniowania monochromatycznego o określonym natężeniu światła, pada na
wypolerowaną płytkę szklaną, to ulega następującym zmianom:
−
część strumienia odbije się, (Iρ)
−
część zostanie pochłonięta, (Iά)
−
część przejdzie przez szkło (Iτ).
A zatem Io = Iρ + Iά + Iτ
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Rys. 6. Przepuszczalność, załamanie i odbicie światła na powierzchni granicznej szkło-powietrze. [3,s.112]
Każdy z tych współczynników zależy od długości fali (koloru).
Współczynnik odbicia zależy od kata padania wiązki świtała. Im większy jest kąt padania, tym
większy jest współczynnik odbicia.
Przepuszczalność i absorpcja (pochłanianie) promieniowania, a więc i gęstość optyczna zależą
od długości fali promieniowania. Dlatego rozróżnia się wartości tych współczynników
podawane dla danej długości fali (wartości widmowe) i wartości sumaryczne obejmujące cały
zakres promieniowania np. części widzialnej.
W przypadku gdy powierzchnia szkła nie jest gładka lub szkło jest optycznie niejednorodne,
następuje rozproszone (dyfuzyjne) odbicie lub przepuszczenie światła. Z tymi zjawiskami
związane są pojęcia matowości i blasku szkła (z rozproszonym odbiciem) oraz zamącenia szkła
(z dyfuzyjnym przepuszczaniem światła).
Wpływ składu chemicznego szkła na odbicie, pochłanianie i przepuszczanie światła jest
zróżnicowany. Odbicie światła zależy przede wszystkim od współczynnika załamania światła, a
zatem te pierwiastki, które podwyższają współczynnik załamania, zwiększają także
współczynnik odbicia. Współczynnik odbicia światła można znacznie zmniejszyć przez
stosowanie powłok przeciwodblaskowych (np. CaF
2
), przy czym współczynnik załamania dla
powłoki powinien być zbliżony do pierwiastka kwadratowego ze współczynnika załamania dla
szkła podstawowego. Dodatek BaO i PbO poprawia połysk szkieł.
Przepuszczalność i pochłanianie światła w mniejszym stopniu zależą od składu podstawowego
szkła. Duży wpływ na te wielkości mają pierwiastki barwiące, których niewielka zawartość w
istotny sposób wpływa na wartość współczynnika pochłaniania, przepuszczalności i gęstości
optycznej.
Ultrafioletową część widma pochłaniają szkła zawierające duże ilości tlenków tytanu, ołowiu i
bizmutu oraz zabarwione Fe
3+
i Ce
4+
. Pochłanianie infraczerwonej części widma osiąga się przy
zabarwieniu szkła Cr
3+
i Fe
2+
.
Największą
przepuszczalność
ultrafioletu
mają
szkła
krzemionkowe,
fosforanowe
i fluoroberylowe. W podczerwonej części widma szkła krzemianowe przepuszczają do 2,5 μm,
szkło krzemionkowe do 5,0 μm. Szkła glinowo-wapniowe, a także szkła zawierające duże
ilości tlenku ołowiu, siarczków, seleninków, tellurków, arsenu, antymonu i germanu wykazują
stosunkowo wysoką przepuszczalność w podczerwieni (4-5 μm). Dla przepuszczalności
dalekiej podczerwieni (15-20 μm) stosuje się szkła chalkogenkowe, a w szczególności
siarczkowo-arsenowe.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
4. Właściwości mechaniczne
Wytrzymałością mechaniczną szkła nazywa się przeciwstawianie się szkła mechanicznemu
zniszczeniu. W zależności od rodzaju niszczących sił rozróżnia się wytrzymałość szkła na
rozrywanie, ściskanie, zginanie i uderzenie.
Za wytrzymałość szkła na rozrywanie, ściskanie lub zginanie przyjmuje się naprężenia, które
powodują zniszczenie próbki poddanej działaniu siły rozciągającej, ściskającej lub zginającej.
Wyraża się je w MPa (kG/mm
2
). Używane w praktyce przemysłowej szkła mają wytrzymałość
na rozrywanie 30-90 MPa, na ściskanie 500-2000 MPa i na zginanie 25-85 MPa.
Wytrzymałością szkła na uderzenie zginające nazywa się pracę niezbędną do zniszczenia
próbki szklanej przy uderzeniu poprzecznym. Jednostką wytrzymałości na uderzenie zginające
jest praca odniesiona do jednostki powierzchni przekroju poprzecznego próbki – J/m
2
.
Wskaźnik ten charakteryzuje lepkość uderzeniową materiału i dla szkła wynosi 1500-2000
J/m
2
.
Niewystarczająca wytrzymałość mechaniczna szkła i jego kruchość ograniczają szerokie
zastosowanie szkła jako materiału konstrukcyjnego.
Wytrzymałość szkła zależy od stanu jego powierzchni, składu chemicznego, stopnia
odprężenia, jednorodności, wymiaru badanych próbek, środowiska i temperatury. Teoretyczna
wytrzymałość szkła doskonałego na rozrywanie powinna wynosić 10-30 GPa. Wady struktury
w szkłach rzeczywistych obniżają tę wytrzymałość do wartości rzędu 4 GPa osiąganej przez
pojedyncze wzorce włókien szklanych. Mikrowady na powierzchni powodują dalsze obniżenie
wytrzymałości do wartości rzędu mniej niż l GPa osiąganej przez świeże szkła z politurą
ogniową lub kwasową, lecz w krótkim stosunkowo czasie – nawet bez umyślnych uszkodzeń –
szkła takie wykażą wytrzymałość rzędu 100 MPa. Wreszcie nieuniknione makroskopowe wady
powierzchni (zarysowania) wpływają na to, że wytrzymałość szkieł zwykłych w dobrych
warunkach jest rzędu 10 MPa. Szersze zastosowanie szkła jako materiału konstrukcyjnego
będzie zaleźć od zwiększenia jego efektywnej wytrzymałości na rozrywanie, co wpłynie
zarazem na poprawę innych właściwości szkła (np. odporności chemicznej, odporności na
zmiany temperatury).
Wpływ składu chemicznego na wytrzymałość jest mniej wyraźny ze względu na przeważający
wpływ zjawisk powierzchniowych. Jednakże wpływ chemicznej jednorodności masy jest
bardzo znaczny.
Zamiana SiO
2
w szkle na CaO, BaO, A1
2
O
3
, PbO, K
2
O lub Na
2
O powoduje wzrost
wytrzymałości na rozrywanie (coraz mniejszy w podanej kolejności). Naprężenia powodujące
rozrywanie wynoszą dla różnych szkieł 30-90 MPa, przy czym według przepisów stosowanych
w przemyśle elektrotechnicznym dopuszczalne obciążenia powinny wynosić 5% naprężeń
rozrywających dla określonego szkla.
Według G. Gehlhoffa i M. Thomasa wytrzymałość na ściskanie zależy od następujących
tlenków, podanych w kolejności malejącego ich wpływu: Al
2
O
3
, SiO
2
, MgO, ZnO, Fe
2
O
3
,
BaO, CaO, PbO, Na
2
O i K
2
O. Główne tlenki, ze względu na ich wpływ na wytrzymałość na
zginanie, można uporządkować następująco: CaO, BaO, PbO, ZnO, MgO, Fe
2
O
3
, SiO
2
,
A1
2
O
3
.
Temperatura ma znaczny wpływ na wytrzymałość szkła. W zakresie temperatury od -190 do
+520°C wytrzymałość szkła przechodzi przez minimum w temperaturze ok. 150 °C.
Wytrzymałość spada wtedy do ok. 30% wytrzymałości szkła w temperaturze pokojowej.
W temperaturze niższej niż 0°C i wyższej niż ok. 200 °C szkło ma wytrzymałość większą niż w
temperaturze pokojowej. Od temperatury ok. 450 °C wytrzymałość znowu się zmniejsza
z powodu rozpoczynającego się mięknięcia szkła, ale w temperaturze 700 °C szkło
przemysłowe jest w stanie przyjmować (niewielkie) trwałe obciążenia.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
W procesie produkcyjnym pogorszenie jednorodności bardzo obniża wytrzymałość szkła.
W obszarze szkła zawierającym nici i inne wtrącenia powstają dodatkowe naprężenia, które
stają się ogniskiem zniszczenia materiału. Szczególnie niekorzystne są nici znajdujące się
w stanie rozciągania i rozmieszczone przy powierzchni wyrobu lub w jej pobliżu. Nakładanie
się rozciągających naprężeń przy zginaniu lub szoku termicznym na istniejące naprężenia
wewnętrzne wokół nici w istotny sposób obniża wytrzymałość szkła. Spadek wytrzymałości
może osiągać 30-40%.
Podobne oddziaływanie wykazują także inne wady szkła i wady powierzchni. Spękania
wewnętrzne, zarodki krystaliczne, obce ciała (kamienie), pęcherze i pęcherzyki,
niejdnorodność chemiczna i termiczna szkła powodują zakłócenia w równomiernym
przenoszeniu naprężeń przez pręt: zamiast wartości średniej w niektórych miejscach mogą
powstawać naprężenia lokalne, wielokrotnie wyższe, są to tzw. zagęszczenia linii naprężeń,
najsilniej występujące na ostrych przejściach (załamaniach, karbach).
Działanie na powierzchnię szkła czynników atmosferycznych powoduje zmniejszenie
wytrzymałości ok. 20% w porównaniu z wytrzymałością szkła w powietrzu suchym,
a ok. 250% w porównaniu z wytrzymałością szkła wygrzanego w próżni. Jak widać, chodzi tu
głównie o działanie wody, jednakże alkohol wywiera też analogiczny wpływ.
Działanie czynników usuwających wady powierzchni lub ochraniających powierzchnię szkła
przed wpływem atmosferycznej wilgoci powoduje zwiększenie wytrzymałości około 20%
(np. hydrofobizacja powierzchni).
Na wytrzymałość wpływa nie tylko intensywność, ale i czas działania czynników zewnętrznych
na powierzchnię szkła, dlatego wytrzymałość szkła przechowywanego w normalnych
warunkach atmosferycznych maleje z upływem czasu.
Wytrzymałość szkła oprócz cech podanych powyżej, jest opisywana jeszcze przez inne, są
nimi:
A. Twardość, czyli zdolność materiału do przeciwstawiania się wnikaniu w głąb innego
sztywniejszego materiału.
W zależności od sposobu oznaczania (pomiaru) rozróżnia się następujące rodzaje twardości:
sklerometryczną (twardość przy zarysowaniu), ścierną (twardość przy szlifowaniu) i twardość
przy wciskaniu (mikrotwardość).
W pojęciu twardości mieści się pojęcie mechanicznej wytrzymałości masy (głównie na
rozrywanie) jak i energii powierzchniowej.
Do najtwardszych szkieł należą szkła krzemionkowe i szkła borokrzemowe. Ze zwiększeniem
zawartości alkaliów twardość szkieł obniża .się. Do najbardziej miękkich należą szkła o dużej
zawartości tlenku ołowiu. Twardość szkieł krzemianowych zależy od promienia jonowego
kationów wchodzących w skład szkła. Biorąc pod uwagę stopień wpływu kationów na
twardość szkła, można je uszeregować w następujący sposób, w kolejności wzrastającego ich
działania: K
+
< Na
+
< Li
+
; Ba
2+
< Sr
2+
< Ca
2+
< Mg
2+
< Be
2+
; Cd
2+
< Zn
2+;
Fe
2+
< Co
2+
< Ni
2+
.
W szkłach borokrzemowych kolejność ta jest nieco zmieniona.
Stopień odprężenia wpływa także na twardość szkieł, dobrze odprężone .szkło ma wyższą
mikrotwardość niż szkło źle odprężone. Wpływ temperatury na twardość jest podobny jak na
wytrzymałość mechaniczna szkła. Obecność wody i gazów zaabsorbowanych w szkle
powoduje zmniejszenie twardości. Inne czynniki, a zwłaszcza niejednorodność szkła i wady
mają również duży wpływ na twardość szkła, podobnie jak na wytrzymałość mechaniczną.
B. Kruchością nazwano właściwość lub stan materiału, w którym odkształcenie niszczące
nieznacznie tylko przewyższa odkształcenie sprężyste i w którym odkształcenia plastyczne
(trwałe) są nieznaczne w porównaniu z odkształceniami sprężystymi, a same odkształcenia

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
sprężyste są również niezbyt duże. Kruchość jest stanem zależnym od temperatury, szybkości
narastania obciążenia i rodzaju odkształceń, stanu powierzchni, zmęczenia materiału wskutek
wielokrotności obciążeń, niejednorodności, naprężeń wewnętrznych i składu chemicznego
szkła.
Za miarę kruchości szkieł przyjęto uważać odporność na dynamiczne obciążenie (uderzenie).
Pomiar przeprowadza się zwykle na przyrządzie z młotem uderzającym ruchem wahadłowym
w próbkę szkła opartą o dwie opory.
Zależność kruchości szkła od składu chemicznego nie została jeszcze zbadana w stopniu
dostatecznym. Znane są tylko ogólne wskazania: dodatek PbO, MgO lub SiO
2
powoduje
zmniejszenie kruchości. Dodatek BaO zwiększa kruchość i pogarsza wytrzymałość szkła na
uderzenie.
Wzrost temperatury powoduje obniżenie kruchości szkła. Kruchość zależy od wytrzymałości
szkła na rozrywanie. Podobnie jak i inne właściwości mechaniczne silnie zależy ona od stanu
powierzchni, niejednorodności szkła, naprężeń wewnętrznych i zapewne od agresywności
chemicznej otoczenia.
C. Sprężystością nazywa się zdolność ciała stałego do przyjmowania pierwotnej postaci po
zaprzestaniu oddziaływania na nie siły obciążającej (po zaniku naprężeń). Deformację ciała
stałego uważa się za sprężystą, jeżeli znika ona po zaniku obciążenia, i uważa się za
plastyczną, jeżeli pozostaje ona całkowicie lub częściowo po zaniku obciążenia. Szkło
praktycznie me wykazuje deformacji plastycznej.
Właściwości sprężyste szkieł charakteryzuje się trzema wielkościami: modułem sprężystości
(modułem Younga) E, modułem ścinania G i współczynnikiem (liczbą) Poissona.
4.2.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jak zdefiniujesz lepkość szkła?
2. Wymień czynniki wpływające na lepkość szkła?
3. Jak scharakteryzujesz średnią temperaturę deformacji na krzywej lepkości?
4. Jak zdefiniujesz pojęcie krystalizacji heterogenicznej?
5. Jakie czynniki wpływają na krystalizację szkieł?
6. Jak zdefiniujesz napięcie powierzchniowe szkieł?
7. Jakie znasz pozytywne i negatywne aspekty istnienia napięcia powierzchniowego
w szkłach?
8. Jak zdefiniujesz pojęcie ciepła właściwego?
9. Jakie tlenki szkła podwyższają ciepło właściwe w szkłach?
10. Jak zdefiniujesz przewodność cieplną szkieł?
11. Jakie czynniki wpływają na przewodność cieplną szkieł?
12. Jak zdefiniujesz współczynnik rozszerzalności cieplnej?
13. Na czym polega odporność termiczna szkieł?
14. Jakie tlenki zmniejszają higroskopijność w szkłach?
15. Jakie czynniki wpływają na odporność hydrolityczną szkła?
16. Jak zdefiniujesz proces wietrzenia szkieł?
17. Kiedy możemy zaobserwować zjawisko dwójłomności?
18. Jakie czynniki wpływają na odbicie, pochłanianie, rozpraszanie, przepuszczalność światła
w szkłach?
19. Od czego uzależniona jest wytrzymałość mechaniczna szkła?
20. Jakie tlenki wpływają na zginanie szkieł?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
21. Jakie znasz kationy szeregu twardości szkieł?
22. Jak zdefiniujesz kruchość szkła?
23. Jak zdefiniujesz sprężystość szkła?
4.2.3. Ćwiczenia
Ćwiczenie 1
Scharakteryzuj właściwości płynnej masy szklanej. W opisie uwzględnij czynniki
wpływające na daną właściwość szkła.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia właściwości płynnej masy szklanej,
2) zapisać właściwości płynnej masy szklanej,
3) zapisać czynniki wpływające na właściwość szkła,
4) przedstawić charakterystykę na forum klasy.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Scharakteryzuj czynniki wpływające na właściwości termiczne szkła.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia właściwości, termiczne szkła,
2) zapisać czynniki mające wpływ na właściwości,
3) przedstawić opis na forum klasy.
Wyposażenie stanowiska pracy:
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
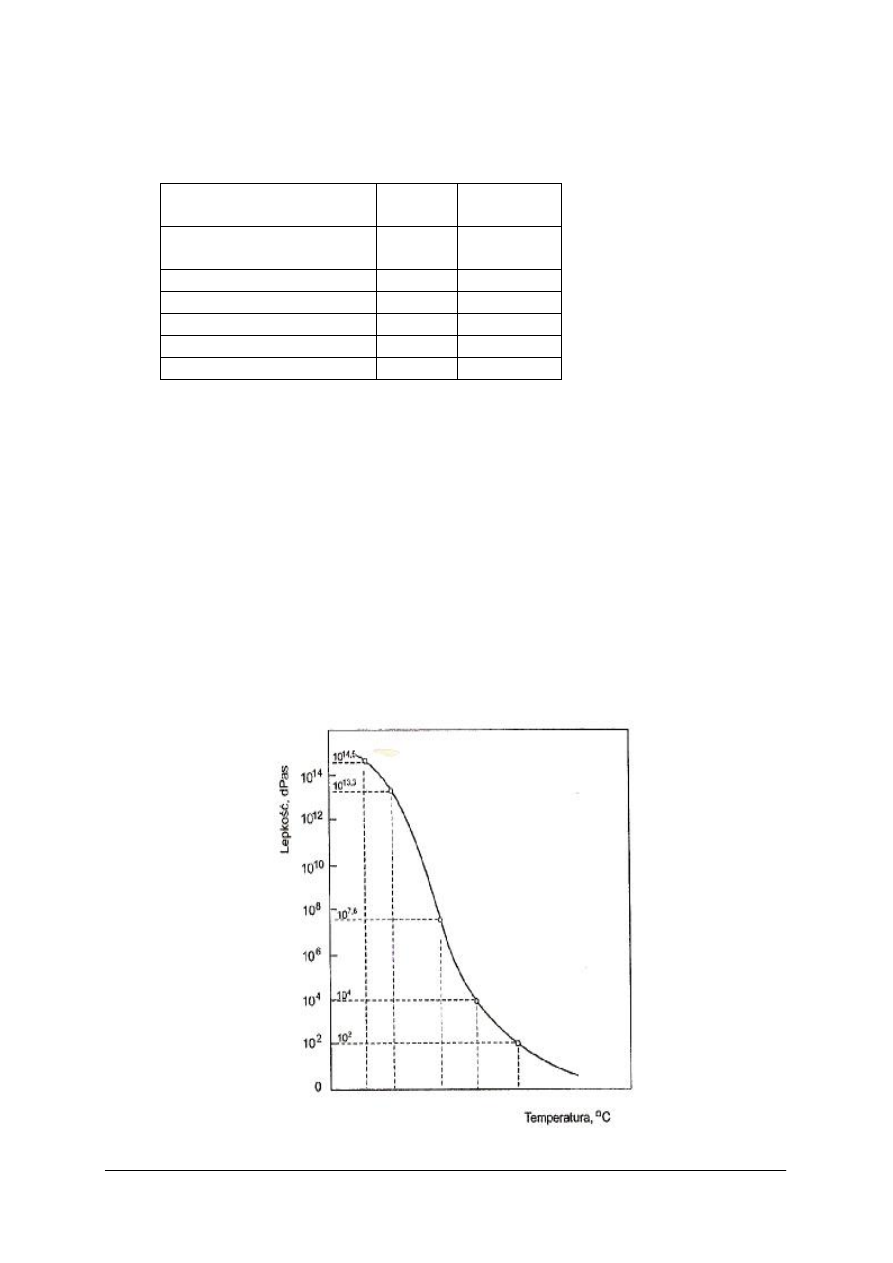
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
Ćwiczenie 3
Przyporządkuj tlenki w tabeli stawiając znak (+) w odpowiedniej kolumnie.
Tabela do ćwiczenia 3.
Tlenki
Obniżają
lepkość
Podwyższają
lepkość
Na
2
O, K
2
O w wysokich
temp.
MgO, ZnO w niskich temp.
ZnO w wysokich temp.
CaO w niskiej temp.
BaO, PbO
Al
2
O
3
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia opis lepkości szkła,
2) zapisać znak (+) w odpowiedniej kolumnie,
3) przedstawić zadanie na forum klasy.
Wyposażenie stanowiska pracy:
−
tabela,
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 4
Zapisz na krzywej charakterystyczne punkty lepkościowe szkła.
Rys. do ćwiczenia 4 – Krzywa lepkości. [1]

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odszukać w poradniku dla ucznia opis lepkości szkła,
2) zapisać charakterystyczne punkty do krzywej lepkości,
3) przedstawić zadanie na forum klasy.
Wyposażenie stanowiska pracy:
−
rysunek krzywej,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.2.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) zdefiniować pojęcie lepkości szkła?
2) określić czynniki wpływające na lepkość szkieł?
3) zdefiniować średnią temperaturę deformacji na krzywej lepkości?
4) zdefiniować pojęcie krystalizacji heterogenicznej szkła?
5) określić czynniki wpływające na krystalizację szkieł?
6) zdefiniować napięcie powierzchniowe szkieł?
7) określić pozytywne i negatywne cechy napięcia powierzchniowego
wpływające na procesy technologiczne?
8) zdefiniować pojęcie ciepła właściwego szkła?
9) określić tlenki podwyższające ciepło właściwe szkła?
10) zdefiniować przewodność cieplną szkła?
11) określić czynniki wpływające na przewodność cieplną szkła?
12) zdefiniować współczynnik rozszerzalności cieplnej szkła?
13) wyjaśnić pojęcie odporności termicznej szkła?
14) dobrać tlenki zmniejszające higroskopijność szkła?
15) określić czynniki wpływające na odporność hydrolityczną szkła?
16) zdefiniować proces wietrzenia szkła?
17) zdefiniować zjawisko dwójłomności szkła?
18) określić czynniki wpływające na właściwości optyczne w szkłach?
19) zdefiniować wytrzymałość mechaniczną szkieł?
20) określić szereg kationów wpływający na twardość szkła?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
4.3. Badanie właściwości szkła
4.3.1. Materiał nauczania
Badanie właściwości szkła
1. Lepkość
Metody pomiaru lepkości można podzielić na dwie grupy:
a) metody pomiaru małych lepkości (10
2
– 10
5
dPas) w zakresie wysokich temperatur,
b) metody pomiaru dużych lepkości (10
7
– 10
17
dPas) w zakresie niskich temperatur.
Jedną z ważniejszych metod pomiaru lepkości cieczy jest metoda opadającej kulki oparta na
prawie Stokesa, uwzględniającym siłę przeciwdziałającą opadaniu kulki w „nieograniczonej
cieczy". Jest to metoda bezwzględna, gdyż pozwala mierzyć i wyliczać lepkość cieczy bez
konieczności cechowania przyrządu. W metodzie tej mierzy się prędkość v opadania kulki
(najczęściej platynowo-rodowej) o promieniu r wzdłuż osi cylindra o średnicy R i wysokości L.
Lepkość wylicza się według wzoru Stokesa zmodyfikowanego przez R. Ladenburga dla
uwzględnienia wpływu ścianek i dna cylindra:
d
1,
d
2
– gęstość odpowiednio platyny i szkła,
K – stała przyrządu określona na podstawie pomiaru wykonanego dla cieczy o znanej
lepkości.
Odmianą opisanej metody ruchu kulki w cieczy lepkiej jest metoda pomiaru lepkości na
podstawie pomiaru szybkości poruszania się kulki platynowej ku górze pod wpływem
przyłożonej siły. W metodzie tej do kulki platynowej przyspawany jest platynowy pręcik,
za który podwiesza się kulkę do cienkiej nici przerzuconej przez dwa bloki i obciążonej
z drugiej strony określonym ciężarem. Lepkość tę wylicza się ze także z zmodyfikowanego
wzoru.
Inną stosowaną metodą jest metoda wiskozymetru rotacyjnego, która polega na pomiarze
momentu wywołanego siłami lepkości (tarcia wewnętrznego) przy ruchu obrotowym elementu
roboczego wiskozymetru zanurzonego w stopie. Jako elementy robocze wiskozymetrów
stosuje się cylindry, kulki, pręciki z platyny lub z innych materiałów odpornych na korozję i
mogących pracować w wysokiej temperaturze (np. molibden). Najczęściej stosuje się obrót
elementu roboczego, znane są jednak wiskozymetry, w których w ruch obrotowy wprawiany
jest tygiel razem z piecem. Średnica obracającego się cylindra lub kulki wynosi 10-20 mm
(zależnie od konstrukcji). Elementy robocze wprawiane są w ruch odpowiednimi ciężarkami
przymocowanymi do nici, których końce nawinięte są na bęben połączony wrzecionem, albo za
pomocą silników elektrycznych.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
Rys. 7. Wiskozymetr dla zakresu topienia i formowania.: 1 – cylinder, 2 - kulka platynowa,
3 – skala pomiarowa. [3,s.53]
Wiskozymetry rotacyjne łatwo dają się zmechanizować i zautomatyzować. Zakres pomiarowy
tych wiskozymetrów zależy od konstrukcji i mieści się w granicach 10
-1
- 10
6
dPas. Przy
pomiarach w wysokiej temperaturze należy przestrzegać specjalnych warunków cieplnych dla
uniknięcia ulatniania się niektórych składników szkła. Wiskozymetry rotacyjne są na ogół
cechowane przy użyciu cieczy, których lepkość zmierzona była innymi dokładnymi metodami
bezwzględnymi.
Druga grupa metod pomiaru lepkości obejmująca zakres w pobliżu temperatury mięknięcia,
gdy szkło znajduje się w stanie plastycznym, wykorzystuje pomiar prędkości deformacji próbek
szklanych o określonych wymiarach przy działaniu siły rozciągającej, ściskającej lub
skręcającej. Stosowane są także metody polegające na wciskaniu odpowiednio zaostrzonych
wgłąbników (prętów) w płytki szklane nagrzane do założonej temperatury – penetrometria.
Do szybkich metod pomiaru można zaliczyć opracowaną w Instytucie Szkła i Ceramiki
w Warszawie i z powodzeniem stosowaną metodę pomiaru lepkości w zakresie 10
8
-10
12,5
dPas
opartą na pomiarze szybkości deformacji próbki szklanej w postaci pręcika pod działaniem siły
ściskającej. Schemat urządzenia do pomiaru tą metodą pokazany jest poniżej.
Rys. 8. Schemat wiskozymetru do pomiaru lepkości opracowany przez Instytut Szkła i Ceramiki w Warszawie.
1 – próbka, 2 – uchwyt, 3 – pręt ze szkła krzemionkowego, 4 – czujnik, 5 – dźwignia, 6 – piec.[3,s.54 ]
Do pomiaru w tym urządzeniu używa się próbek średnicy 2-4 mm i długości 15-25mm, można
też stosować próbki o przekroju prostokątnym o boku do 3 mm. Próbka l jest umieszczona w
uchwycie 2 i wkładana do nagrzanego pieca 6. Po ustabilizowaniu się temperatury przykłada
się do próbki siłę ściskającą od dźwigni 5 poprzez pręt ze szkła krzemionkowego 3 i mierzy
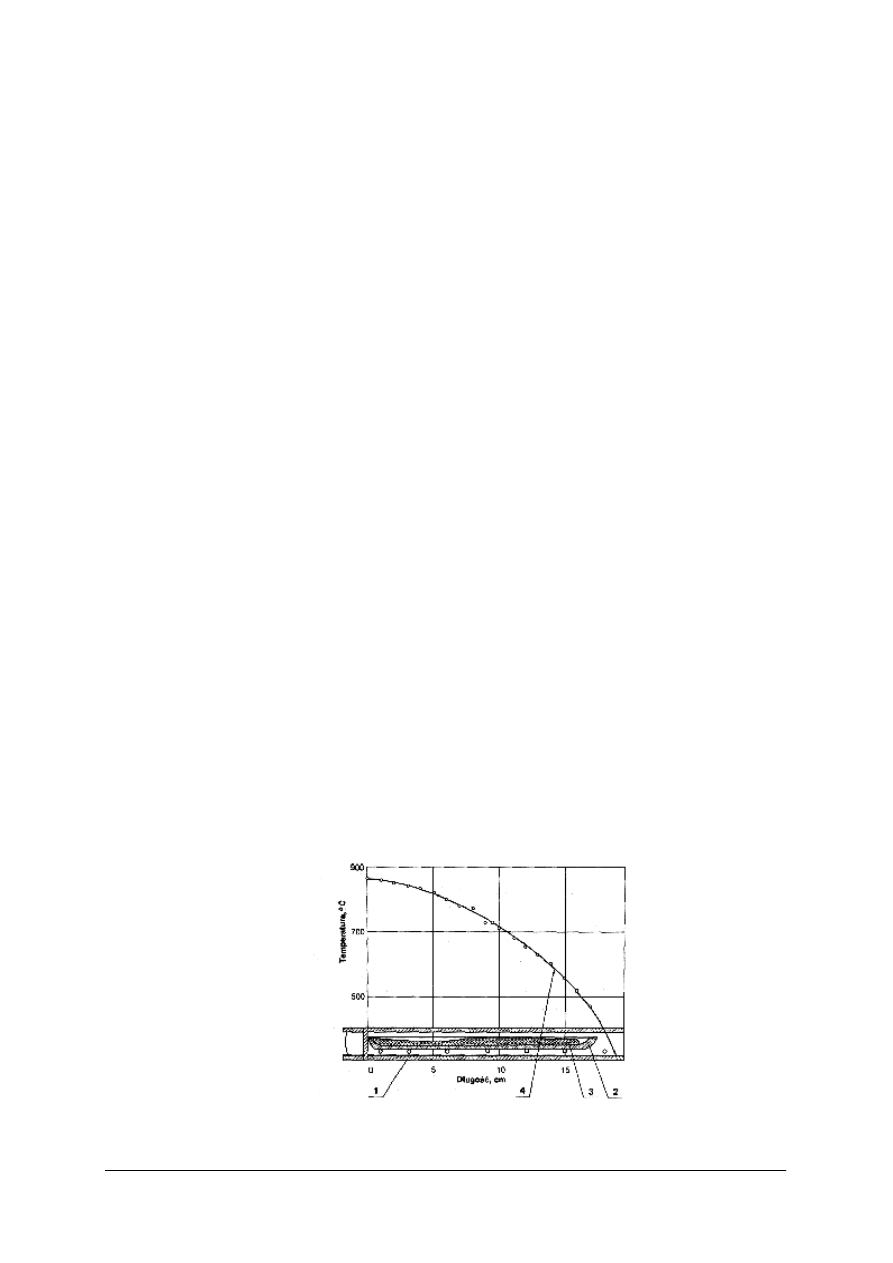
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
prędkość deformacji wykazywanej na czujniku 4. Lepkość próbki w danej temperaturze
wylicza się z określonego wzoru.
Inną jeszcze metodą pozwalającą mierzyć lepkość szkła w założonej temperaturze– jest pomiar
temperatury mięknięcia według Littletona.
Metoda ta polega na pomiarze wydłużenia włókna szklanego nie obciążonego podczas
ogrzewania w piecu ze stałą prędkością. Oba końce włókna obtapia się, przy czym koniec
służący do zawieszenia włókna w piecu formuje się w kulkę, a drugi tylko zaokrągla. Tak
przygotowaną próbkę umieszcza się centralnie w piecu. Przed oknem komory pomiarowej
ustawia się katetometr (przyrząd pomiarowy) i sprawdza ostrość obrazu. Następnie ogrzewa
się włókno z szybkością 5-10
0
C/min. Przyrost temperatury powinien być stały. Prowadzi się
odczyty temperatury i położenia włókna na skali katetometru co 30 sekund, zapisując wyniki
pomiaru.
Z uzyskanych wyników wykreśla się dwie krzywe: pierwszą przedstawiającą zależność
temperatury od czasu i drugą przedstawiającą zależność wydłużenia włókna od czasu.
2. Krystalizacja
Badanie zdolności do krystalizacji wykonuje się w piecu elektrycznym poziomym, z tak
dobranym układem grzejnym, aby wzdłuż pieca wytworzyć równomierny spadek temperatury.
Schemat takiego pieca i rozkład temperatur zamieszcza rysunek 8.
Rura grzewcza pieca ma zwykle długość od 25 do 30 cm i średnicę wewnętrzną około 3-4 cm.
Najwyższa temperatura jest na jednym końcu rury i obniża się liniowo w kierunku drugiego
końca. Szkło w postaci beleczki lub niewielkich kawałków umieszcza się w łódce wykonanej z
platyny lub ze stali żaroodpornej chromoniklowej na całej długości łódki. Pomiary w łódce
chromoniklowej można prowadzić do temperatury max. 1200
0
C. W przypadku wyższych
temperatur należy stosować łódkę, z platyny. Łódkę z umieszczonym szkłem wkłada się do
uprzednio nagrzanego i ustabilizowanego cieplnie pieca w ten sposób, że jeden koniec łódki
znajduje się w najwyższej założonej temperaturze a drugi koniec w najniższej temperaturze,
która wynika z krzywej rozkładu temperatury w piecu. W ten sposób na całej długości łódki
poszczególne fragmenty szkła znajdują się w różnych temperaturach. Łódkę z badanym szkłem
przetrzymuje się w piecu w założonym przedziale temperatur od l do 24 godzin, w zależności
od skłonności badanego szkła do krystalizacji, po czym wyjmuje się ją. Przykładając łódkę z
badanym szkłem do krzywej rozkładu temperatury na długości pieca można obserwować
rezultaty krystalizacji szkła w strefach różnych temperatur i pobierać próbki szkła do badań
szczegółowych (np. mikroskopii optycznej, analizy fazowej itp.).
Rys. 9. Schemat pieca gradientowego poziomego: 1 – rura grzewcza, 2 – łódka (katalizator),
3 – próbka pobranego szkła, 4 – krzywa zmiany temperatury w piecu. [1,s. 84]
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
W przypadku szkieł odpornych na krystalizację, np. szkła okiennego, czas przetrzymywania
szkła w piecu gradientowym jest długi (nawet do 24 godzin). W wyniku takiego badania
można wyznaczyć zakres temperaturowy maksimum szybkości zarodkowania. W zakresie tym
dostrzega się największą opalizację, gdyż powstaje bardzo duża ilość kryształów wolno
rosnących. Przedział temperaturowy maksymalnej szybkości krystalizacji, w którym obserwuje
się duże, niezbyt skupione kryształy o pokroju sferolitów, co spowodowane jest dużą
szybkością krystalizacji i małą szybkością zarodkowania. Wyznaczyć można również górną
temperaturę krystalizacji T
K
, odpowiadająca równowadze, kiedy w stopie w danym momencie
powstaje i rozpuszcza się taka sama ilość kryształów, która odpowiada w przybliżeniu
temperaturze likwidusu oraz dolną temperaturę krystalizacji T
d
(graniczna temperatura, w
której jeszcze nie obserwuje się krystalizacji).
3. Napięcie powierzchniowe
Do pomiaru napięcia powierzchniowego masy szklanej w stanie ciekłym, przy lepkości poniżej
3000 dPas, stosuje się metodę ciężaru kropli (stalagmometru), którą szczegółowo opracował
A. A, Appien. Zasadę pomiaru tą metodą ilustruje rysunek 9.
Rys. 10. Zasada oznaczania napięcia powierzchniowego roztopionego szkła.
1 – naczynie platynowo-rodowe, 2 – piec, 3 – zatyczka, 4 – układ optyczny, 5 – termopara. [3,s.64 ]
Szkło topi się w naczyniu platynowo-rodowym l, przy czym wypływ reguluje się zatyczką
platynowo-rodową 3. Ogrzewanie następuje w piecu 2, w którym temperaturę mierzy się
termoparą 5. Obserwacji wypływającej kropli szkła dokonuje się za pomocą układu
optycznego 4. Znając ciężar i średnicę kropli oblicza się napięcie powierzchniowe.
Napięcie powierzchniowe masy szklanej o wysokiej lepkości najprościej jest mierzyć metodą
ściągającej się wiszącej nitki. Polega ona na tym, że nitkę z badanego szkła średnicy
0,2-0,6 mm i długości 100-150 mm zawiesza się pionowo w piecu. Podnosząc powoli
temperaturę obserwuje się zachowanie nitki. Gdy nitka ogrzeje się do temperatury
przekraczającej temperaturę mięknięcia, zaczyna zmieniać się jej kształt.
W górnej części następuje rozciąganie podłużne i ściskanie poprzeczne, w dolnej części zaś
długość zmniejsza się i powiększa się średnica. W miejscu nitki, gdzie średnica nie ulega
zmianie, występuje równowaga sił napięcia powierzchniowego i sił grawitacji (ciężar nitki
poniżej tego przekroju). Określając ciężar części nitki znajdującej się poniżej nie zmienionej
średnicy nitki wylicza się napięcie powierzchniowe według określonego wzoru.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
4. Przewodność cieplna
Do pomiaru przewodności cieplnej szkła służy przyrząd Russa. W przyrządzie tym okrągła
płytka miedziana ogrzewana prądem elektrycznym umieszczona jest między okrągłymi
płytkami szklanymi; zabezpieczające pierścienie zewnętrzne gwarantują wyeliminowanie
wpływu brzegów, zakłócającego układ pola temperatur płytek.
Odpowiednie temperatury ścianek mierzy się za pomocą termopar. Z pomiarów otrzymuje się
ilość przepływającego ciepła, temperaturę ścianki wewnętrznej szkieł, czas przepływu ciepła,
powierzchnię i grubość płytek szklanych i temperaturę ścianki zewnętrznej. Przeliczając te
dane na wielkości jednostkowe otrzymuje się, według definicji, wielkość przewodności
cieplnej.
5. Współczynnik rozszerzalności cieplnej.
Mierzy się najczęściej metodą dylatometryczną, termometru wagowego, metodą
podwójnej nici lub metodą interferometryczną.
Rys. 11. Schemat budowy dylatometru: 1 – piec elektryczny, 2 – próbka, 3 – lusterko, 4 – skala,
5 – szkło kwarcowe.[4, s. 104]
Dylatometry mogą mieć różną konstrukcję, lecz zasada ich działania jest podobna. Próbki
szklane, najczęściej w postaci pręta lub beleczki długości 50-l00 mm i średnicy 3-6 mm,
umieszcza się w piecu elektrycznym między prętami (lub w rurze z prętem) ze szkła
krzemionkowego i ogrzewając dokonuje się pomiaru wydłużenia, np. za pomocą przekładni
optycznej lub innych czujników. Dylatometry pozwalają mierzyć wydłużenie w szerokim
zakresie temperatury z dostateczną dokładnością dochodzącą do 0,5%.
Do badania różnicy współczynników rozszerzalności dwóch szkieł stosuje się metodę
podwójnej nici lub elastooptyczną. W metodzie podwójnej nici spaja się nałożone na siebie
dwa rozpłaszczone końce prętów (ze szkła badanego i ze szkła o znanym współczynniku),
rozciąga się miejsce spojenia w nić średnicy 0,l-0,3 mm i długości ponad 200 mm. Nić wygnie
się po ostygnięciu w stronę szkła o mniejszym współczynniku rozszerzalności (tj. szkło to
znajdzie się na zewnętrznej stronie łuku).
Współczynnik rozszerzalności cieplnej ma duże znaczenie przemysłowe, ponieważ determinuje
możliwość łączenia różnych szkieł ze sobą lub z metalami albo powlekania (obciągania)
jednych szkieł drugimi.
Dla obliczania współczynnika rozszerzalności liniowej na podstawie składu chemicznego szkła
zaproponowano
wiele
wzorów
empirycznych
i
odpowiednich
współczynników
obliczeniowych. Do najbardziej odpowiadających rzeczywistym wartościom i jednocześnie
najprostszych należy zaliczyć metodę i współczynniki opracowane przez A. A. Appena.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
6. Odporność na działanie wody
Istnieje szereg metod pomiaru i opracowane są współczynniki do wzajemnego przeliczania
wyników, jakich one dostarczają: dokładność pomiarów wynosi jednakże 3-6% z powodu
trudności stworzenia powtarzalnych warunków badania, tak że można tu ograniczyć się do
przytoczenia wymagań polskiej normy.
Celom naukowym bardziej odpowiada badanie odporności sproszkowanego szkła, celom
praktyki – badanie odporności powierzchni wyrobu szklanego.
Odporność sproszkowanego szkła oznacza się (wg PN-82/B-13164) przez miareczkowanie
0,01 n HC1 (wobec czerwieni metylowej) składników wyługowanych po l h gotowania we
wrzącej (98 ± 0,5°C), dwukrotnie destylowanej wodzie z próbki sproszkowanego szkła
o uziarnieniu 0,315-0,5 mm (średnice oczek sit) i następnie przeliczenie na ilość μg Na
2
O
składników wyługowanych w tych warunkach z l g ziarna szklanego.
Szkła zawierające ponad 5% B
2
O
3
bada się według normy PN-80/B-13163, metodą polegającą
na analitycznym oznaczaniu zawartości SiO
2
, B
2
O
3
, Na
2
O i K
2
O w ekstrakcie uzyskanym przez
ługowanie wodą redestylowaną rozdrobnionego szkła i uziarnieniu jak wyżej w temperaturze
98°C.
Badanie szkieł o wysokiej odporności chemicznej na działanie wody przeprowadza się metodą
ziarnową w autoklawach w temperaturze 121
0
C, według PN-83/B-13162. Metoda ta polega
na wyługowaniu, w ściśle określonych warunkach z próbki rozdrobnionego szkła i oznaczania
ich przez miareczkowanie roztworem kwasu solnego.
Metoda polega na wyługowaniu w ściśle określonych warunkach składników alkalicznych
z próbki rozdrobnionego szkła (0,315-0,500 mm) i oznaczaniu ich przez miareczkowanie
roztworem kwasu solnego o stężeniu 0,02 mol/dm
3
. Podział na klasy odporności na działanie
wody w temperaturze 121 °C.
Badanie odporności powierzchni wyrobów szklanych na działanie wody przeprowadza się (wg
PN-74/B-13161) metodą wyługowania składników szkła z wewnętrznej powierzchni wyrobów
(butelek, fiolek, ampułek) przy ługującym działaniu wody destylowanej w ciągu l godziny, w
autoklawie, w temperaturze 121°C. W otrzymanym ekstrakcie oznacza się ilość
wyługowanych składników alkalicznych przez miareczkowanie roztworem kwasu siarkowego
o stężeniu 0,02 mol/dm
3
. Uważa się zwykle, że szkła przemysłowe zawierające powyżej 18%
Na
2
O należą do 4 klasy, powyżej 15% Na
2
O – do 3 klasy, a powyżej 11% – do klasy 2.
7. Odporność na działanie kwasów
Do badania odporności chemicznej szkła na działanie kwasów wg PN-76/B-13111 stosuje
się dwie metody, w zależności od rodzaju szkła. W przypadku szkieł, których stopień
odporności chemicznej na działanie kwasów można scharakteryzować ilością wyługowanych
alkaliów, stosuje się metodą wyługowania Na
2
O i K
2
O z próbki szkła w ciągu 3 godzin
działania kwasu solnego o stężeniu 6 moli/dm
3
w temperaturze 100°C i oznaczania zawartości
tych tlenków w ekstrakcie metodą fotometrii płomieniowej. Wynik badania podaje się w
miligramach Na
2
O i K
2
O w przeliczeniu na 100 cm
2
powierzchni próbki szkła. Do innych szkieł
stosuje się metodę, w której stopień odporności chemicznej na działanie kwasów określa się
przez oznaczenie ubytku masy próbki badanego szkła po 3 godzinach gotowania w roztworze
kwasu solnego o stężeniu 6 moli/dm
3
. Wynik podaje się w miligramach ubytku masy, w
przeliczeniu na 100 cm
2
całkowitej powierzchni próbki szkła.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
8. Odporność na działanie zasad
Według PN-70/B-13110 odporność na działanie ługów oznacza się przez pomiar ubytku masy
po 3-godzinnym gotowaniu próbki szkła o łącznej powierzchni 10-20 cm
2
we wrzącym
roztworze wodnym (NaOH+Na
2
CO
3
) o stężeniu l mola/dm
3
. Wynik wyraża się w miligramach
ubytku masy na 100 cm
2
powierzchni próbki.
9. Właściwości optyczne
Pomiar współczynnika załamania światła i, co za tym idzie, dyspersji przeprowadza się różnymi
metodami.
Zestawienie schematów przyrządów do pomiaru wartości współczynnika załamania światła
podano na poniższym rysunku.
Rys. 12. Schematy przyrządów stosowanych do pomiaru współczynnika załamania: a) spektrometr,
b) refraktor Pulfricha, c) refraktor Abbego. [3, s.107]
Badania przeprowadza się najlepiej w świetle jednobarwnym uzyskiwanym np. za pomocą
filtrów jednobarwnych.
Sposób pomiaru współczynnika załamania świtała w wyższej temperaturze pokazano na
rysunku 12.
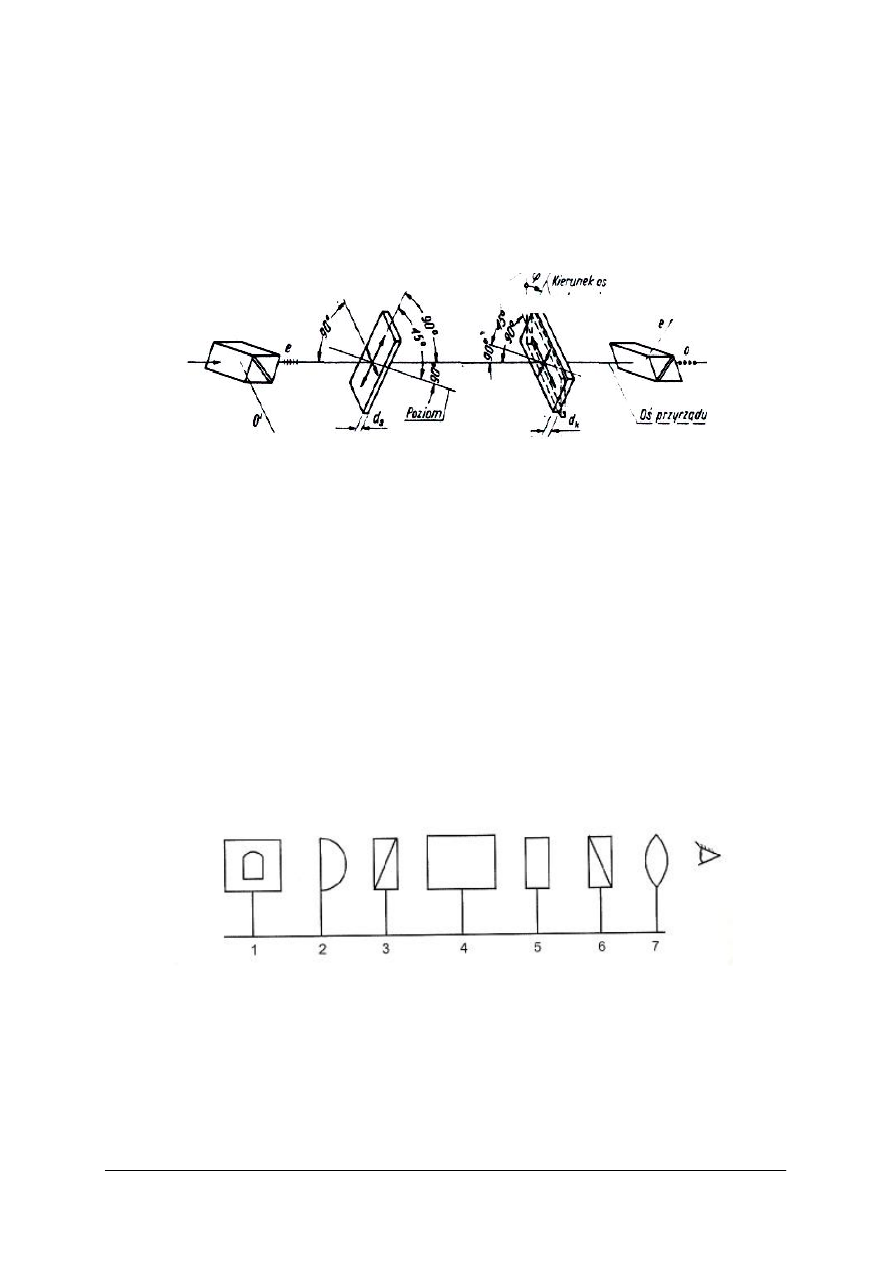
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
Rys. 13. Zasada pomiaru współczynnika załamania światła w wyższej temperaturze. [3,s.107]
Pryzmat badanego szkła o współczynniku załamania umieszczony jest pomiędzy dwoma
pryzmatami ze szkła o współczynniku załamania. Poszukiwany współczynnik załamania oblicza
się z określonego wzoru.
Dwójłomność mierzy się za pomocą polarymetrów – najczęściej metodą kompensacji, tzn.
zrównoważenia (nieznanej) dwójłomności w szkle przeciwnie skierowaną dwójłomnością
o znanej wielkości. Rysunek 14 ilustruje zasadę działania kompensatora obrotowego.
Rys. 14. Zasada działania kompensatora obrotowego. [3,s. 110]
Jakościową oceną wielkości dwójłomności uzyskuje się przez badanie w polaryskopie.
Pojawienie się barw w polaryskopie z lampą dającą światło białe, z włączoną ćwierćfalówką
i ze skrzyżowanymi nikolami opiera się na fakcie, że polaryskop wykaże rozświetlenie dla tych
dwójłomności, które odpowiadają nieparzystej wielokrotności połówek fali. Suma tych
rozświetleń składa się na wrażenie obserwowanej barwy.
Dwójłomność w szkłach nieprzejrzystych mierzy się stosując albo podczerwień, albo
ultrakrótkie fale radiowe.
Wszystkie urządzenia polaryzacyjne optyczne zawierają zasadniczy element, jakim jest układ
filtrów polaryzacyjnych, tj. polaryzator i analizator. Polaryzator ma na celu wytworzenie ze
światła naturalnego światła liniowo spolaryzowanego. Analizator służy do analizowania światła
przechodzącego przez ciało dwójłomne. W polaryskopach jako filtry polaryzacyjne, stosowane
są najczęściej polaroidy, natomiast w mikroskopach polaryzacyjnych stosuje się najczęściej
pryzmaty.
Rys. 15. Schemat polaryskopu do pomiaru różnicy dróg optycznych w szkle: 1 – źródło światła, lampa,
2 – kondensator dający światło prawie równoległe, 3 – polaryzator, 4 – badany przedmiot, 5 – płytka, ustawiona
w ten sposób, że jej oś optyczna tworzy kąt 45
o
z kierunkami polaryzacji polaryzatora i analizatora,
6 – analizator ustawiony w położeniu skrzyżowania z polaryzatorem, 7 – soczewka powiększająca. [1, s.106]
Polaroidy są to płytki z herapatytu, wykazujące zjawisko dichroizmu, polegające na
selektywnym pochłanianiu promieni. Pochłanianiu ulegają promienie zwyczajne, natomiast
promienie nadzwyczajne są przepuszczane.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
47
Dzięki temu otrzymujemy światło drgające w jednym kierunku, a więc liniowe spolaryzowane.
Filtry przepuszczają światło liniowo spolaryzowane zgodnie prawem Malusa, tj. całkowicie,
gdy drga ono w płaszczyźnie równoległej do ich kierunku drgań, a wygaszają całkowicie, gdy
te dwa kierunki są do siebie prostopadle. W położeniach pośrednich przepuszczają tylko część
promieniowania. W polaryskopach najczęściej stosuje się skrzyżowany układ filtrów
polaryzacyjnych, tzn. oś polaryzacji polaryzatora (kierunek drgań) tworzy z osią polaryzacji
analizatora kąt 90°. W takim układzie światło nie przechodzi, zostaje przez analizator
wygaszone. Jeżeli w przestrzeni pomiarowej między skrzyżowanymi filtrami polaryzacyjnymi
umieścimy płytkę szklaną wykazującą naprężenia, a więc optycznie dwójłomną, to pole
widzenia rozjaśnia się.
Bieg światła w układzie polaryzator - ciało dwójłomne - analizator przedstawi się następująco
Promień światła monochromatycznego wychodzący ze źródłu światła pada na polaryzator
o kierunku drgań zorientowanym pionowo i zostaje spolaryzowany liniowo. Drgania wektora
elektrycznego światła spolaryzowanego odbijają się w płaszczyźnie wyznaczonej przez
kierunek drgań polaryzatora oraz kierunek biegu promienia i przemieszczają się według
krzywej sinusoidalnej. Padając na płytkę szklaną, poddaną jednokierunkowemu stanowi
naprężenia umieszczoną w przestrzeni pomiarowej polaryskopu w położeniu 45°, promień
świetlny rozdziela się na dwa promienie liniowo spolaryzowane: zwyczajny i nadzwyczajny,
których wektory elektryczne drgają w płaszczyznach wzajemnie prostopadłych. Drgania
promienia nadzwyczajnego zachodzą w płaszczyźnie kierunku głównego, drgania promienia
zwyczajnego odbywają się w płaszczyźnie prostopadłej. Oba promienie przemieszczają się
w płytce z różnymi prędkościami, skutkiem czego wytwarza się między nimi różnica dróg
optycznych.
Promienie wychodzące z płytki szklanej przedstawiają dwa drgania wzajemnie prostopadłe,
o tym samym okresie lecz różnych fazach. Możemy je więc traktować, jako składowe liniowe
wypadkowego drgania eliptycznego. Składowe te przy wejściu do analizatora rozdzielają się,
dając w sumie promienie, z których dwa drgają w płaszczyźnie zgodnej z kierunkiem drgań
analizatora, dwa zaś w płaszczyźnie prostopadłej. Analizator przepuszcza tylko składowe
poziome, drgające zgodnie z jego kierunkiem drgań. Te obie składowe przy przejściu przez
analizator nie ulegają względnemu opóźnieniu, zachowując różnicę dróg optycznych
wytworzoną w próbce szklanej. Drgania te są spójne, leżą w jednej płaszczyźnie, mogą więc
interferować. Warunek interferencji w świetle spolaryzowanym przy skrzyżowanych filtrach
polaryzacyjnych jest jednak inny niż przy zwykłym nakładaniu się drgań harmonicznych.
Wygaszenie światła następuje przy różnicy dróg optycznych odpowiadającej całkowitej
długości fali, względnie jej wielokrotności, natomiast maksymalne wzmocnienie zachodzi przy
różnicy dróg, wynoszącej połowę długości fali świetlnej, względnie jej nieparzystą
wielokrotność.
10. Wytrzymałość mechaniczna szkła
Wytrzymałość szkła na uderzenie (kulą) pośrednio wyraża najbardziej charakterystyczną
właściwość szkła, jaką jest kruchość, i określa się pracą niezbędną do zniszczenia jednostki
objętości szkła. Wytrzymałość na uderzenie bada się przez opuszczenie (na środek płyty
szklanej lub próbki ułożonej na dwu podporach) kuli stalowej o określonej masie (np. 800 g).
Wytrzymałość szkła na zginanie bada się albo przy zginaniu poprzecznym (3 lub
4-punktowym), albo zginaniu centralnym. Wytrzymałość szkła na uderzenie zginające bada się
przy użyciu tzw młotów wahadłowych. Do badań wytrzymałości na uderzenie kulą stosuje się
odpowiednie przyrządy pozwalające na zrzucenie kuli z zadanej wysokości.
Do metod pomiaru wytrzymałości mechanicznej możemy zaliczyć również metody pomiaru
twardości, które nie są do dziś przyjętymi, każdy z wykonawców bada twardość szkieł według
własnego uznania. Spośród wielu stosowanych metod wymienić należy skalę twardości Mohsa,
który uporządkował dziesięć minerałów w ten sposób, że twardszy minerał rysuje bardziej
miękkie. Twardość określa się także przyrządem Knoppa.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
48
Do szkła, zamiast przyrządu Knoppa, częściej stosuje się mikrotwardościomierz, w którym
piramidkę diamentową wciska się z siłą wywołującą odcisk o przekątnej mniejszej niż 10 μm.
Metody opracowywania wyników pomiarów.
Najprostszą metodą pomiaru jest otrzymanie danego wyniku z urządzenia, za pomocą systemu
elektronicznego. Dane uzyskane z pomiaru porównuje się wtedy z określonym wzorcem i na
ich podstawie wysuwa określone wnioski pomiarowe.
Inną metodą jest badanie za pomocą aparatury danych potrzebnych do obliczenia wyników
i wpisanie ich do określonego wzoru, a obliczone punkty nanosi się na odpowiednie krzywe
w celu ich scharakteryzowania i wysunięcia wniosków.
Z badania danych pomiarowych laborant sporządza protokół pokontrolny, który może
zawierać następujące dane:
−
rodzaj szkła,
−
datę sporządzenia badania,
−
informacje o wstępnej obróbce próbki,
−
wyniki poszczególnych oznaczeń,
−
średnią arytmetyczną oznaczenia,
−
nazwisko i podpis wykonującego oznaczenie,
−
datę i miejsce wykonania oznaczenia.
Przepisy bezpieczeństwa i higieny, ochrony przeciwpożarowej oraz ochrony środowiska
podczas wykonywania badań i pomiarów.
Badania właściwości szkieł nie stanowią dla osób pracujących w laboratoriach znacznych
obciążeń zdrowotnych, choć jak przy każdej z wykonywanych w hutach czynności muszą
spełniać określone wymogi przepisów bhp.
Osoby pracujące przy oznaczeniach właściwości szkieł powinny posiadać przede wszystkim
odpowiedni strój, składający z fartucha, okularów, rękawic, gdyż na stanowiskach pracy
podczas pomiarów i badań mogą wystąpić: skaleczenia, poparzenia, działania wzmożonym
promieniowaniem cieplnym, czy szkodliwość odczynnikami chemicznymi podczas badań
i wykonane pomiarów.
4.3.2. Pytania sprawdzające
Odpowiadając na pytania, sprawdzisz, czy jesteś przygotowany do wykonania ćwiczeń.
1. Jakie znasz metody pomiaru lepkości szkła?
2. Na czym polega metoda wiskozymetru rotacyjnego badania lepkości szkła?
3. Jakie znasz elementy budowy wiskozymetru?
4. Na czym polega metoda pomiaru lepkości opracowana przez Instytut Szkła i Ceramiki
w Warszawie?
5. W jaki sposób przeprowadza się badanie zdolności do krystalizacji w piecu
gradientowym?
6. Jakie wymienisz metody badania współczynnika rozszerzalności cieplnej?
7. W jaki sposób przeprowadzamy badanie odporności powierzchni szkła na działanie wody?
8. W jaki sposób przeprowadzamy badanie odporności szkła na działanie kwasów?
9. Do czego służy kompensator obrotowy?
10. Jak przebiega badanie współczynnika załamania światła w szkłach?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
49
4.3.3. Ćwiczenia
Ćwiczenie 1
Opracuj w formie pisemnej przeprowadzenie badania pomiaru zakresu temperatury
krystalizacji na podstawie normy branżowej BN-83/6803-04. W opisze uwzględnij:
a) zasadę pomiaru,
b) aparaturę i sprzęt pomiaru,
c) przygotowanie próbek,
d) pomiar zakresu temperatur krystalizacji.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odebrać od nauczyciela określoną normę branżową,
2) przeanalizować dane potrzebne do sporządzenia pracy,
3) zapisać punkty potrzebne do określenia badania,
4) przedstawić pracę na forum klasy.
Wyposażenie stanowiska pracy:
−
norma branżowa,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
Ćwiczenie 2
Wykonaj oznaczenie mikrotwardości szkła na podstawie normy PN – 70/B – 13150.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odebrać od nauczyciela normę branżową,
2) przeanalizować zakres czynności podczas wykonania oznaczenia,
3) odebrać od nauczyciela potrzebne materiały do oznaczenia, instrukcję bhp,
4) przeprowadzić oznaczenia mikrotwardości szkła,
5) obliczyć mikrotwardośc z wzorem,
6) porównać wyniki grupach.
Wyposażenie stanowiska pracy:
−
Polska Norma PN – 70/ B – 13150 oznaczenia mikrotwardości szkło,
−
próbki szkła,
−
mikrotwardościomierz,
−
karta papieru,
−
ołówki,
−
kalkulator,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
50
Ćwiczenie 3
Wykonaj protokół z pomiaru wytrzymałości szkła na zginanie zgodnie z normą
PN – 82/B – 13151.
Sposób wykonania ćwiczenia
Aby wykonać ćwiczenie, powinieneś:
1) odebrać od nauczyciela normę oraz dane do sporządzenia protokołu,
2) przeanalizować dane, które powinny znaleźć się w protokole,
3) wypisać dane do protokołu,
4) sporządzić protokół,
5) porównać protokół w grupach.
Wyposażenie stanowiska pracy:
−
norma PN – 82/ B – 13151,
−
papier,
−
ołówki,
−
poradnik dla ucznia,
−
literatura zgodna z punktem 6 poradnika.
4.3.4. Sprawdzian postępów
Czy potrafisz:
Tak
Nie
1) określić metody pomiaru lepkości szkła?
2) dobrać urządzenie do badania lepkości szkła?
3) określać elementy budowy wiskozymetru?
4) dobrać metodę badania krystalizacji w szkłach?
5) określić metody badania współczynnika rozszerzalności cieplnej?
6) dobrać aparaturę do badania odporności szkła na nagłe zmiany
temperatury?
7) dobrać odczynniki do oznaczania odporności ziaren szkła ma działanie
wody?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
51
5.
SPRAWDZIAN OSIĄGNIĘĆ
INSTRUKCJA DLA UCZNIA
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem zadań testowych.
4. Test zawiera 20 zadań. Do każdego zadania dołączone są 4 możliwości odpowiedzi. Tylko
jedna jest prawidłowa.
5. Udzielaj odpowiedzi na załączonej karcie odpowiedzi, stawiając w odpowiedniej rubryce
znak X. W przypadku pomyłki należy błędną odpowiedź zaznaczyć kółkiem, a następnie
ponownie zakreślić odpowiedź prawidłową.
6. Pracuj samodzielnie, bo tylko wtedy będziesz miał satysfakcję z wykonanego zadania.
7. Jeśli udzielenie odpowiedzi będzie Ci sprawiało trudność, wtedy odłóż jego rozwiązanie na
później i wróć do niego, gdy zostanie Ci wolny czas.
8. Na rozwiązanie testu masz 40 minut.
Powodzenia!

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
52
ZESTAW ZADAŃ TESTOWYCH
1. Szkło to
a) ciało gazowe charakteryzujące się chaotyczną strukturą.
b) ciało amorficzne chrakteryzujace się brakiem uporządkowania elementów struktury.
c) ciało ciekłe charakteryzujące się uporządkowaną strukturą.
d) ciało stałe charakteryzujące się uporządkowaniem elementów struktury.
2. Do technik otrzymywania szkieł zaliczamy
a) elektrolizę.
b) hydrolizę.
c) syntezę.
d) biosyntezę.
3. W jednej z odpowiedzi odporności szkła na czynniki chemiczne uszeregowano wg
tendencji malejącej. Poprawnym uszeregowaniem jest
a) kwas, zasada, woda.
b) woda, zasada, kwas.
c) kwas, woda, zasada.
d) zasada, woda, kwas.
4. Pojęcie długości technologicznej szkła odnosi się do
a) długości linii produkcyjnej.
b) zakresu temperatur kształtowania masy szklanej.
c) czasu odprężania wyrobów.
d) całkowitego czasu potrzebnego do wytworzenia wyrobu.
5. Jednakowe właściwości we wszystkich kierunkach określonego stanu skupienia materii
nazywamy:
a) izotropią.
b) idealnością.
c) uporządkowaniem.
d) brakiem struktury.
6. Gwałtowne, powtórne podgrzewanie szkła spowoduje
a) lepsze wyklarowanie szkła.
b) pienienie szkła.
c) wyklarowanie masy szklanej.
d) usuniecie kamieni z masy szklanej.
7. Zjawisko rozpraszania światła w gazach powoduje
a) rozszczepienie promieni świetlnych.
b) odbicie światła.
c) świecenie cząstek.
d) uporządkowanie struktury.
8. Do barwników metalicznych szkła zaliczamy:
a) Ag.
b) Co.
c) FeS.
d) Nd.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
53
9. Ze względu na budowę cząstek zawiesiny, barwniki szkła dzielimy na
a) jonowe, cząsteczkowe.
b) koloidalne, krystaliczne.
c) metaliczne, cząsteczkowe.
d) krystaliczne, jonowe.
10. Barwa w szkłach uzależniona jest od
a) warunków formowania.
b) rodzaju barwionego szkła.
c) długości linii barwiącej.
d) koloru barwnika.
11. Tarcie wewnętrzne to inaczej
a) lepkość.
b) napięcie powierzchniowe.
c) sprężystość.
d) krystalizacja.
12. Proces, w którym w stopie lub w roztworze powstają samowolne zarodki krystalizacji i w
wyniku trwania procesu rosną dalej, nazywamy
a) krystalizacją spontaniczną.
b) krystalizacją heterogeniczną.
c) krystalizacją homogeniczną.
d) krystalizacją regulowaną.
13. Współczynnik przewodności cieplnej wyrażamy w
a) W/m∙K.
b) W/kg∙K.
c) N/m.
d) J/m.
14. Czynnikiem wpływającym na proces ługowania jest
a) korozja.
b) obróbka cieplna.
c) wpływ środków klarujących.
d) warunki prowadzonego procesu.
15. Rozszczepianie światła na dwa promienie nosi nazwę
a) załamania.
b) pochłaniania.
c) odbicia.
d) dwójłomności.
16. Do najtwardszych szkieł należą
a) szkła krzemionkowe.
b) szkła sodowe.
c) szkła kryształowe.
d) szkła optyczne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
54
17. Obniżenie kruchości w szkłach powoduje
a) dodanie związku BaO.
b) odkształcenie.
c) powierzchnia.
d) wzrost temperatury.
18. Za pomocą pieca gradientowego badamy
a) lepkość.
b) kruchość.
c) krystalizację.
d) dwójłomność.
19. Metodą wyługowania bada się odporność szkieł na działanie
a) wody.
b) kwasów.
c) zasad.
d) soli.
20. Dylatometrem bada się
a) napięcie powierzchniowe.
b) załamanie świetlne.
c) przewodność cieplną.
d) współczynnik rozszerzalności cieplnej.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
55
KARTA ODPOWIEDZI
Imię
i
nazwisko.............................................................................................................................
Badanie właściwości szkła
Zakreśl poprawną odpowiedź.
Nr
zadania
Odpowiedź
Punkty
1
a
b
c
d
2
a
b
c
d
3
a
b
c
d
4
a
b
c
d
5
a
b
c
d
6
a
b
c
d
7
a
b
c
d
8
a
b
c
d
9
a
b
c
d
10
a
b
c
d
11
a
b
c
d
12
a
b
c
d
13
a
b
c
d
14
a
b
c
d
15
a
b
c
d
16
a
b
c
d
17
a
b
c
d
18
a
b
c
d
19
a
b
c
d
20
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
56
6. LITERATURA
1. Cienińska M., Dorosz D., Greiner-Wrona E., Gruszka B., Kucharski J., Lisiecki M.,
Łączka M., Procyk B., Siwulski S., Środa M., Wacławska I., Wasylak J.: Technologia
szkła – właściwości fizykochemiczne, cz.1, Kraków 2002
2. Nowotny W.: Technologia szkieł gospodarczych, cz.1, Państwowe Wydawnictwa
Szkolnictwa Zawodowego, Warszawa 1975
3. Praca zbiorowa: Technologia szkła I, Arkady, Warszawa 1987
4. Praca zbiorowa: Technologia szkła, Arkady, Warszawa 1962
5. Walczak P., Wojewoda G.: Fizyka, Operon, Gdynia 2003
Czasopismo:
6. Szkło i ceramika.
Wyszukiwarka
Podobne podstrony:
02-badanie wlasciwosci fizykochemicznych wody
Cw 02 M 04A Badanie wlasciwos Nieznany
Badanie właściwości statystycznych elektronów emitoawany 02, Tabela do sprawozdań
Obl, Poniedziałek - Materiały wiążące i betony, 02. (17.10.2011) Ćw D - Badanie właściwości zapraw b
Cw 02 M 04A Badanie wlasciwos Nieznany
Cw 07 E 01 Badanie właściwości elektrycznych kondensatora pł
Badanie właściwości minerałów i skał
Badanie właściwości aplikacyjnych i eksploatacyjnych powłok polimerowych - sprawozdanie, metody bada
ćw.10.Badanie właściwości łuku prądu stałego, Elektrotechnika - notatki, sprawozdania, Urządzenia el
BADANIE WŁAŚCIWOŚCI UKŁADU NERWOWEGO, dietetyka umed, fizjologia
Badanie właściwości materiałów magnetycznych –?rromagnetyki
Badanie właściwości przetworników prędkości liniowej
Doswiadczalne badanie właściwości optycznych teleskopu
Badanie wlasciwosci statycznych
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
Badanie właściwości tensometrów oporowych, Studia, sprawozdania, sprawozdania od cewki 2, Dok 2, Dok
więcej podobnych podstron