

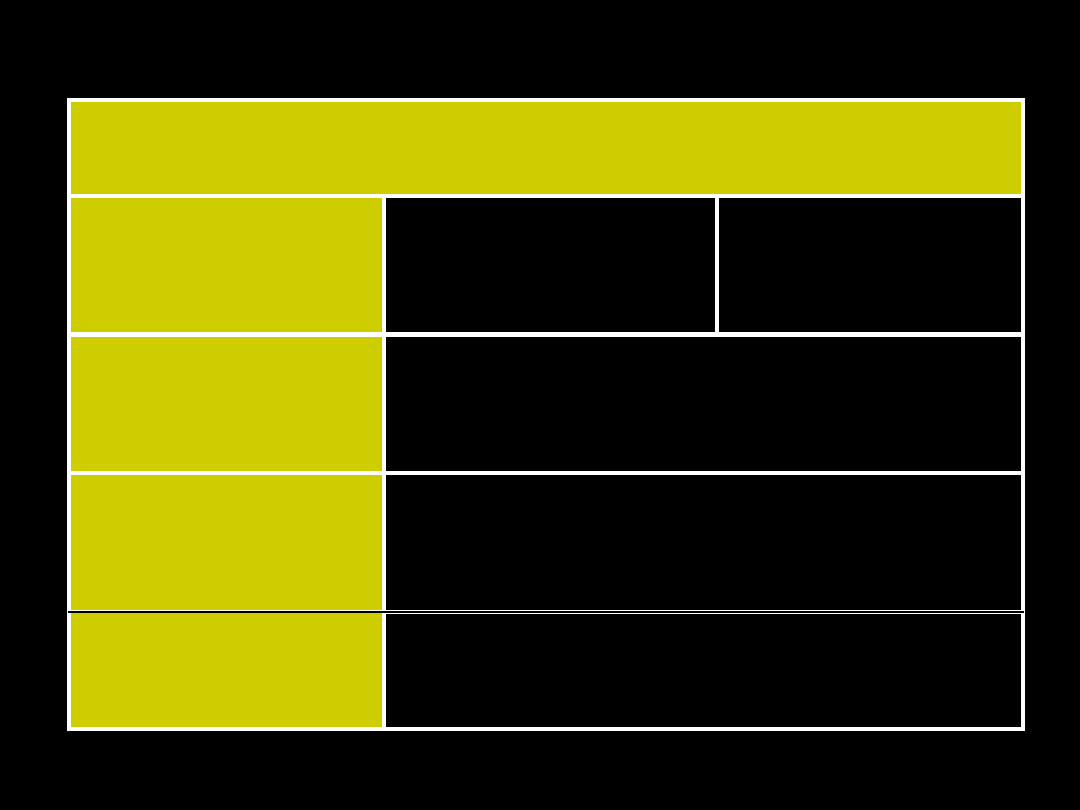
Rozdział kationów na grupy analityczne
wg
BUNSENA
Nr
grup
y
Kationy
Odczynnik
grupowy
Osady
Osady kationów z
odczynnikiem grupowym
I
HCl
AgCl, PbCl
2
,
Hg
2
Cl
2
IIA Hg
2
Pb
2+
Cu
2+
Bi
3+
Cd
2+
H
2
S
[AKT]
HgS, PbS,
CuS, Bi
2
S
3
, CdS,
IIB Sb
3+
Sb
5+
Sn
2+
Sn
4+
As
3+
As
5+
H
2
S
[AKT]
Sb
2
S, Sb
2
S
5
, SnS,
SnS
2
As
2
S
3
, As
2
S
5
III Ni
2+
Co
2+
Fe
2+
Fe
3+
Mn
2+
Zn
2+
Al
3+
Cr
3+
(NH
4
)
2
S
[AKT]
CoS, NiS, FeS,
Fe
2
S
3
,
MnS, ZnS,
Al(OH)
3
, Cr(OH)
3
IV
Ca
2+
Sr
2+
Ba
2+
(NH
4
)
2
CO
3
CaCO
3
, SrCO
3
,
BaCO
3
V
Mg
2+
K
+
Na
+
brak
odczynnik
a
grupoweg
o
brak osadów
2
2
2
Hg
Pb
Ag
4
NH

2
2
2
Pb
,
Hg
,
Ag
nie
rozpuszczają
się w wodzie
i
rozcieńczonych
kwasach
nie
rozpuszczają
się w wodzie
i
rozcieńczonych
kwasach
odczynnik grupowy:
HCl
odczynnik grupowy:
HCl
PbCl
2
,
AgCl
,
Hg
2
Cl
2
AgCl
+ 2NH
3
.
H
2
O [Ag(NH
3
)
2
]Cl + 2H
2
O
Hg
2
Cl
2
+ 2NH
3
.
H
2
O
HgNH
2
Cl + Hg
0
+
NH
4
Cl + 2H
2
O
c z a r n y
c z a r n y
rozpuszcza się w gorącej
wodzie
rozpuszcza się w gorącej
wodzie
PbCl
2
rozpuszcza się w NH
3
.
H
2
O
rozpuszcza się w NH
3
.
H
2
O
HgNH
2
Cl+Hg
0
pod wpływem NH
3
.
H
2
O
przechodzi
w będący
mieszaniną
AgCl
Hg
2
Cl
2
czarny osad
Pb
2+
, Hg
2+
, Bi
2+
, Cd
2+
,
Cu
2+
,
Sn
2+
, Sn
4+
, Sb
3+
, Sb
5+
,
As
3+
, As
5+
odczynnik grupowy:
H
2
S
lub
tioacetamid
(AKT)
środowisko słabo kwaśne
środowisko słabo kwaśne
S
H
NH
COO
CH
O
H
2
CSNH
CH
2
4
3
2
2
3
tioacetamid
AKT
2
2
H S
2H
S
+
-
�
+

HgS, PbS,
CuS
czarne
Bi
2
S
3
,
SnS
brunatne
Sb
2
S
3
,
Sb
2
S
5
pomarańcz
owe
SnS
2
,
As
2
S
3
,
As
2
S
5
żółte
CdS
kanarkowy
Podział kationów II grupy na dwie
podgrupy:
Podział kationów II grupy na dwie
podgrupy:
—
tworzą siarczki o charakterze
zasadowym
— siarczki
n
n
ie
ie
rozpuszczalne
rozpuszczalne w:
(NH
4
)
2
S i (NH
4
)
2
S
2
KOH
jony Hg
2+
, Pb
2+
, Cu
2+
, Cd
2+
,
Bi
3+
II A:
—
tworzą siarczki o charakterze
amfoterycznym
— siarczki
rozpuszczalne
rozpuszczalne w:
(NH
4
)
2
S
2
KOH
jony Sn
2+
, Sn
4+
, Sb
3+
, Sb
5+
,
As
3+
, As
5+
II B:

Al
3+
, Cr
3+
, Fe
2+
, Fe
3+
,
Mn
2+
, Zn
2+
, Co
2+
,
Ni
2+
środowisko obojętne lub lekko alkaliczne
(w obecności NH
4
Cl i NH
3
·H
2
O)
środowisko
obojętne
lub lekko
alkaliczne
(w obecności NH
4
Cl i NH
3
·H
2
O)
odczynnik grupowy: (NH
4
)
2
S
lub
tioacetamid
(AKT)
odczynnik grupowy: (NH
4
)
2
S
lub
tioacetamid
(AKT)
S
H
NH
COO
CH
O
H
2
CSNH
CH
2
4
3
2
2
3
AKT
w środowisku
zasadowym
2
2
S
H
2
S
H
2
2
S
H
2
S
H
2
4
2
4
S
NH
2
S
)
NH
(
OH
2
S
H
O
H
2
S
2
2
2
NH
4
Cl:
zapobiega wytrącaniu się
Mg(OH)
2
ułatwia wytrącanie Al(OH)
3
,
Cr(OH)
3,
które w nadmiarze
jonów OH
-
mogłyby ulec
rozpuszczeniu

CoS, NiS,
FeS, F
2
S
3
czarne
ZnS,
Al(OH)
3
białe
MnS
cieliste
Cr(OH)
3
zielonkaw
e

CoS
jest nierozpuszczalny nawet
w stężonych kwasach
nie rozpuszcza się w
rozcieńczonym HCl
NiS
pozostałe
siarczki i
wodorotlenki
rozpuszczają się
w rozcieńczonym HCl

Ca
2+
, Sr
2+
, Ba
2+
O
H
NH
HCO
O
H
CO
NH
2
3
3
2
2
2
4
odczynnik grupowy:
(NH
4
)
2
CO
3
NH
4
Cl , NH
3
ZABARWIENIE
PŁOMIENIA PALNIKA
Ba
2+
Ca
2+
zielone
ceglastoczerwo
ne

Reakcja z wodą gipsową:
BaCl
2
+ CaSO
4
BaSO
4
+CaCl
2
rozpuszcza się
BaCrO
4
Ba
2+
nie rozpuszcza się
z rozcieńczonych
i obojętnych
roztworów osadu
nie wytrąca
Ca
2+
Rozpuszczanie szczawianów
CaC
2
O
4
, BaC
2
O
4
w 6M CH
3
COOH
Reakcja z jonami
2
7
2
2
4
O
Cr
,
CrO
Reakcje odróżniające jon Ca
2+
od Ba
2+

Na
,
K
,
Mg
,
NH
2
4
Brak odczynnika grupowego
Mg
2+
MgCl
2
+Na
2
HPO
4
+ NH
3
.
H
2
O 2NaCl + MgNH
4
PO
4
+ H
2
O
MgCl
2
+Na
2
HPO
4
+ NH
3
.
H
2
O 2NaCl + MgNH
4
PO
4
+ H
2
O
MgNH
4
PO
fosforan
magnezowo-amonowy
2
OH
N
+ MgCl
2
+ 2HCl
N
N
O
Mg
O
zielono
-
żółty
8-hydroksy chinolinian
magnezowy

zapachu
zmianie na
niebiesko-
różowego,
zwilżonego wodą,
papierka lakmusowego
4
NH
Mocne zasady
wypierają z soli amonowych
amoniak, który można
zidentyfikować po:
odczynnik NESSLERA
(zasadowy roztwór jodortęcianu potasowego)
(zasadowy roztwór jodortęcianu potasowego)
4
NH
NH
4
Cl+2K
2
HgI
4
+4KOH
[O
Hg
Hg
NH
2
]I
+KCl+7KI+3H
2
O
czerwono-brunatny
jodek tlenoamino rtęciowy

Na
+
zabarwienie płomienia:
intensywnie
żółte
(reakcja bardzo czuła)
NaCl + K[Sb(OH)
6
]
Na[Sb(OH)
6
] + KCl
NaCl + K[Sb(OH)
6
]
Na[Sb(OH)
6
] + KCl
Na[Sb(OH)
6
]
biały krystaliczny osad
heksahydroksyantymo
nian
sodowy
K
+
zabarwienie płomienia -
fioletowe
KCl + NaHC
4
H
4
O
6
KHC
4
H
4
O
6
+
NaCl
KCl + NaHC
4
H
4
O
6
KHC
4
H
4
O
6
+
NaCl
kwas winowy i kwaśny winian sodu:
KHC
4
H
4
O
6
kwaśny winian
potasu
Na
3
[Co(NO
2
)
6
]+ 2KCl K
2
Na[Co(NO
2
)
6
] +
2NaCl
Na
3
[Co(NO
2
)
6
]+ 2KCl K
2
Na[Co(NO
2
)
6
] +
2NaCl
heksaazotynokobaltan (III) sodowy
K
2
Na[Co(NO
2
)
6
heksaazotynokobaltan(III)
sodowo-potasowy


I
II
III
IV
V
VI
VI
I
HCOO
,
COO
CH
,
NO
,
S
3
2
2
ClO
,
]
)
CN
(
Fe
[
,
]
)
CN
(
Fe
[
,
SCN
,
CN
,
I
,
Br
,
Cl
3
6
4
6
3
4
3
3
3
4
2
7
2
2
4
2
3
2
AsO
,
AsO
,
PO
,
O
Cr
,
CrO
,
O
S
,
MnO
,
ClO
,
ClO
,
NO
4
4
3
3
2
3
SiO
Podział anionów na grupy analityczne wg BUNSENA
2
6
2
4
]
SiF
[
,
F
,
SO
,
O
H
C
,
O
H
C
,
)
COO
(
,
SO
,
BO
,
CO
3
7
5
6
2
6
4
4
2
2
2
3
2
2
3

Ba(NO
3
)
2
lub
BaCl
2
AgNO
3
ODCZYNNIKI
GRUPOWE
dla anionów

AgNO
3
BaCl
2
AgCl
nie strąca
osadów
AgBr
nie strąca
osadów
osad
nierozpuszczalny
w rozcieńczonym
HNO
3
Cl
Br
ClO
,
]
)
CN
(
Fe
[
,
]
)
CN
(
Fe
[
,
SCN
,
CN
,
I
,
Br
,
Cl
3
6
4
6
2
HgI
2
4
]
HgI
[
I
2
2
HgCl
2
3
)
NO
(
Pb
2
2
Cl
Hg
2
3
2
)
NO
(
Hg
2
PbCl
2
PbI
I
,
Br
,
Cl
:
ce
odróżniają
akcje
Re
I
2
Hg
2
2
HgI

2
S
AgNO
3
BaCl
2
Ag
2
S
nie strąca
osadów
AgNO
2
nie strąca
osadów
rozpuszczalny w
rozcieńczonym
HNO
3
2
NO
2
S
HCOO
,
COO
CH
,
NO
,
S
3
2
2

S
Ag
2
3
AgNO
z
akcje
Re
rozpuszcza się na gorąco,
w rozcieńczonym HNO
3
COOAg
CH
3
strąca się ze stężonego
roztworu octanu,
rozpuszcza się w gorącej
wodzie
strąca się ze stężonego
roztworu octanu,
rozpuszcza się w gorącej
wodzie
2
AgNO
rozpuszcza się w:
gorącej wodzie
rozcieńczonym HNO
3
nadmiarze azotanów (III)
]
)
NO
(
Ag
[
K
KNO
AgNO
2
2
2

Reakcje odróżniające aniony II
grupy
KWASY
— wypierają z octanów kwas octowy
CH
3
COOH,
który po ogrzaniu można wykryć po
zapachu
— rozkładają siarczki z wydzieleniem
siarkowodoru o
zapachu zgniłych jaj
— rozkładają azotany (III) (NO
2
-
) z
wydzielaniem
tlenków azotu:
— rozkładają azotany (III) (NO
2
-
) z
wydzielaniem
tlenków azotu:
2
2
2
3
2
2
2
NO
2
O
NO
2
O
H
NO
2
HNO
HNO
3
HNO
NO
H
2
2
2
3
2
2
2
NO
2
O
NO
2
O
H
NO
2
HNO
HNO
3
HNO
NO
H
)
NO
(
2

KMnO
4
odbarwia się w środowisku
kwaśnym
w obecności
:
jonów S
2-
utleniając je
do wolnej
siarki
azotanów (III)
utleniając je do
azotanów (V)

AgNO
3
Ba(NO
3
)
2
rozpuszczalny
w HNO
3
i NH
3
.
H
2
O
rozpuszczalny w
HNO
3
i
rozcieńczonych
kwasach HNO
3
i HCl
2
3
CO
2
3
SO
3
2
CO
Ag
3
2
SO
Ag
3
BaCO
3
BaSO
,
O
H
C
,
O
H
C
,
)
COO
(
,
SO
,
BO
,
CO
3
7
5
6
2
6
4
4
2
2
2
3
2
2
3

Reakcje odróżniające aniony
III grupy
KWASY
—
— rozkładają siarczany(IV) z
wydzieleniem
SO
2
:
Na
2
SO
3
+ 2HCl 2NaCl +
SO
2
+ H
2
O
—
rozkładają
węglany(IV)
z
wydzieleniem
CO
2
:
Na
2
CO
3
+ H
2
SO
4
Na
2
SO
4
+ H
2
CO
3
Na
2
SO
4
+
CO
2
+ H
2
O

KMnO
4
odbarwia się w obecności
jonów:
siarczanowych(IV)
szczawianowych
winianowych
2
3
SO
2
4
2
O
C
2
6
4
4
O
H
C

AgNO
3
BaCl
2
Ag
2
S
2
O
3
BaS
2
O
3
AgCrO
4
BaCrO
4
rozpuszczalny
w
rozcieńczony
m HNO
3
rozpuszczalny w
rozcieńczonym
HNO
3
2
3
2
O
S
2
4
2
O
Cr
3
4
3
3
3
4
2
7
2
2
4
2
3
2
AsO
,
AsO
,
PO
,
O
Cr
,
CrO
,
O
S

Na
2
S
2
O
3
+H
2
SO
4
Na
2
SO
4
+ H
2
S
2
O
3
S +
SO
2
+
H
2
O + Na
2
SO
4
Na
2
S
2
O
3
+H
2
SO
4
Na
2
SO
4
+ H
2
S
2
O
3
S +
SO
2
+
H
2
O + Na
2
SO
4
KWASY
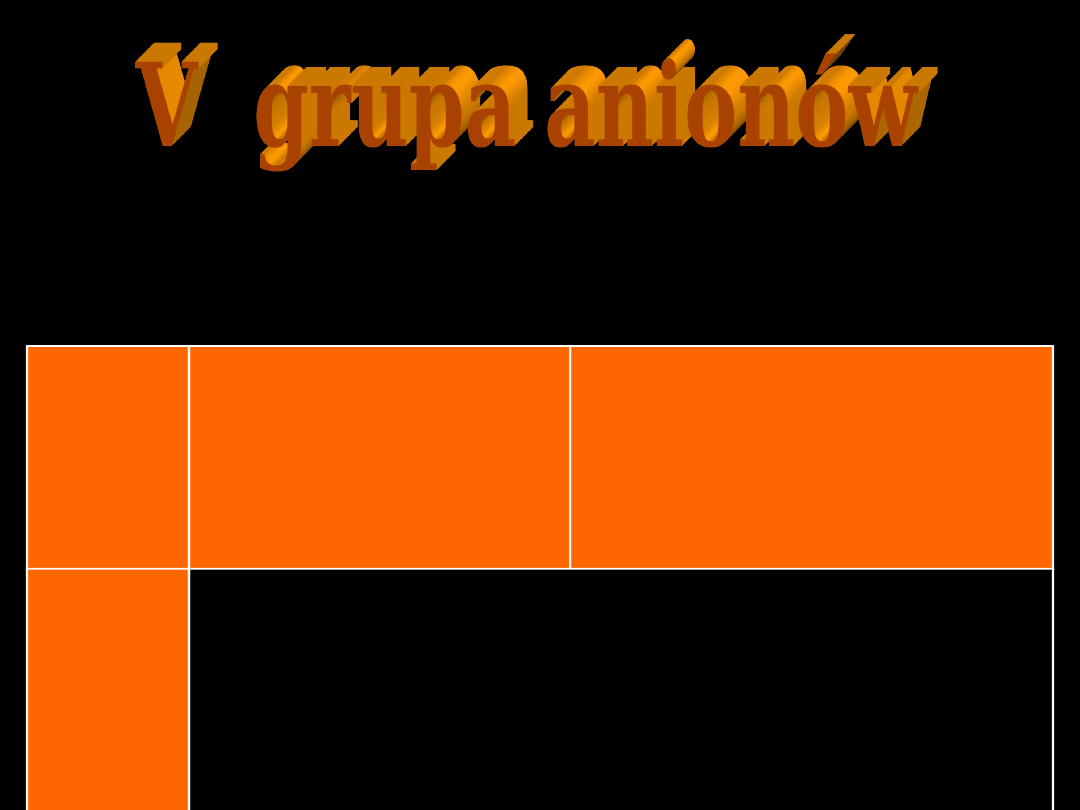
AgNO
3
BaCl
2
nie wytrącają osadów z
roztworów,
zawierających aniony V grupy
3
NO
,
MnO
,
ClO
,
ClO
,
NO
4
4
3
3

3
NO
O
H
2
NO
Fe
3
H
4
NO
Fe
3
2
3
3
2
O
H
]
)
O
H
)(
NO
(
Fe
[
NO
]
)
O
H
(
Fe
[
2
2
5
2
2
6
2
pentaakwanitrozylożelazo(II)
Reakcje charakterystyczne
Reakcja obrączkowa

AgNO
3
BaCl
2
nie wytrąca
osadu z
roztworu
zawierającego
aniony VI grupy
BaSO
4
nierozpuszczalny
w rozcieńczonym
HNO
3
2
4
SO
2
6
2
4
]
SiF
[
,
F
,
SO
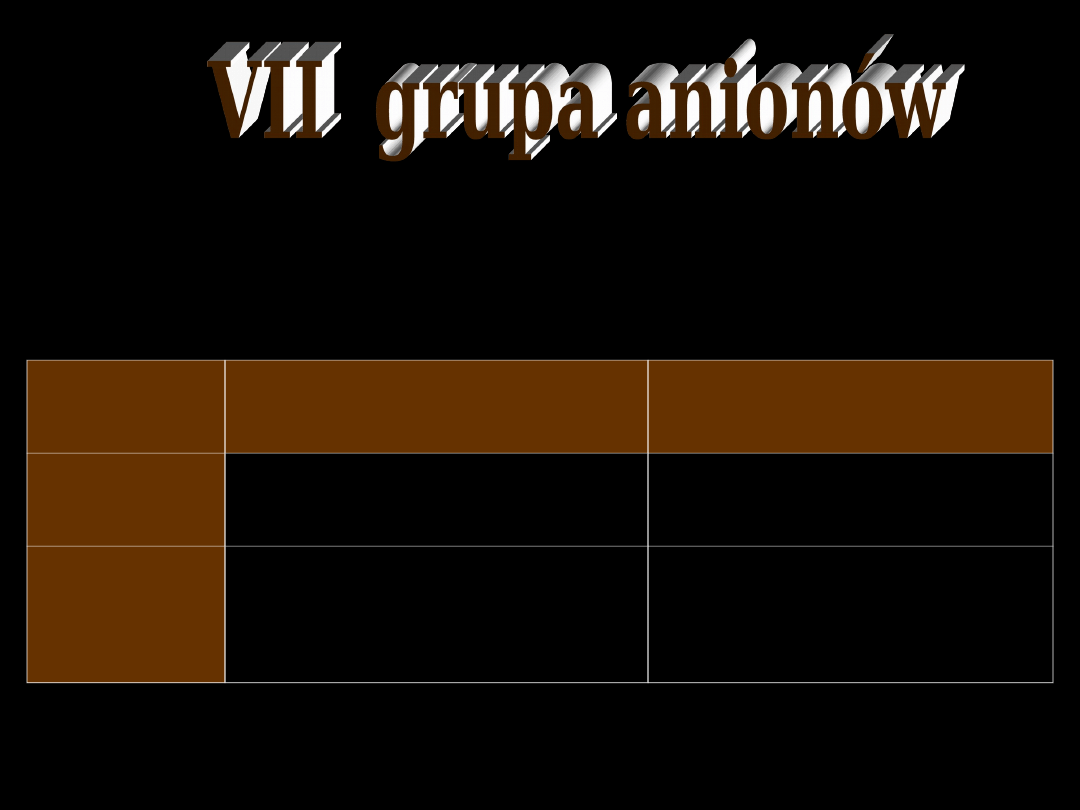
AgNO
3
BaCl
2
Ag
2
SiO
3
BaSiO
3
nierozpuszczaln
y w HNO
3
rozpuszczalny
w HNO
3
2
3
SiO
2
3
SiO


postać (ciało stałe, roztwór, zawiesina)
zapach lub odczyn roztworu
barwa (roztworu, osadu)

Wykaz barw niektórych związków
nieorganicznych
CZARNA
Hg
2
O, CuO, NiO, FeO, Fe
3
O
4
, MnO
2
, Ag
2
S, HgS, PbS,
Cu
2
S, CuS, FeS, Fe
2
S
3
, CoS, NiS, Hg
2
S
BRUNATNA
Ag
2
O, PbO
2
, Bi
2
O
3
, CdO, uwodniony Fe
2
O
3
, Bi
2
S
3
, SnS,
CuCrO
4
, CuBr
NIEBIESKA
uwodnione sole miedzi i bezwodne sole kobaltu
ZIELONA
uwodnione
sole
Fe(II),
Cu
2
(OH)
2
CO
3
,
CuCl
2
,
Cu(AsO
2
)
2
, sole niklu i chromu, Cr
2
O
3
ŻÓŁTA
większość chromianów, HgO, PbO, CdS, SnS
2
, As
2
S
3
,
As
2
S
5
, niektóre sole Fe(III), AgI, AgBr, PbI
2
, Ag
3
PO
4
,
Ag
3
AsO
3
,
FePO
4
,
cyjanożelaziany(II),
cyjanożelaziany(III)
CZERWONA
HgO, Cu
2
O, Pb
3
O
4
, Fe
2
O
3
, Bi
2
O
5
, HgS, Sb
2
S
3
, As
2
S
3
,
BiOI, HgI
2
, bezwodny FeCl
3
, CoCl
3
, uwodniony CoCl
2
,
Ag
2
Cr
2
O
7
, K
3
[Fe(CN)
6
]
RÓŻOWA
sole manganu, uwodnione sole kobaltu
FIOLETOWA
niektóre sole chromu Cr(III), KMnO
4
POMARAŃCZOW
A
Sb
2
S
5
, CdS, dwuchromiany

Wykrywanie kationu
amonowego
Wykrywanie kationów lotnych
soli
Na
Ca
Ba, Cu
As, Sb, Pb,
Sn
K
ANALIZA WSTĘPNA
:
Wykrywanie anionów:
2
3
2
2
3
2
2
3
2
3
NO
,
COO
CH
,
S
,
O
S
,
SO
,
CO
H
2
SO
4
:
— bezwonny gaz (CO
2
) - świadczy to o obecności
jonu CO
3
2-
— gaz o zapachu płonącej siarki (SO
2
) świadczy to
obecności SO
3
2-
lub (jeżeli równocześnie wytrąca się osad siarki) o
obecności S
2
O
3
2-
— brunatne dymy tlenków azotu (NO, NO
2
) świadczą o
obecności
jonu NO
2
-
po
ogrzaniu:
— gaz o zapachu octu wskazuje na obecność jonu CH
3
COO
— gaz o zapachu zgniłych jaj (H
2
S) świadczy o obecności S
2-
,

badana próbka jest rozpuszczalna
w wodzie
badana próbka jest rozpuszczalna
w kwasach
badana próbka nie jest
rozpuszczalna
w wodzie i w kwasach
Badania substancji
na jej rozpuszczalność
Badania substancji
na jej rozpuszczalność
Badania systematyczne
soli –
rozpuszczalnych
w wodzie
lub
rozcieńczonych kwasach
Badania systematyczne
soli –
rozpuszczalnych
w wodzie
lub
rozcieńczonych kwasach
Wykrywanie kationu
Wykrywanie anionu
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
Wyszukiwarka
Podobne podstrony:
1A wykad Kationy i aniony[F]id 18641 ppt
6 wykad WiĄzania chemiczne[F]
Wyk%c5%82ad Niepewno%c5%9b%c4%87 pomiaru
Pytania z Patofizjologii zebrane do 12 wИеcznie wersja 0 01 DODANE TESTY z wyjШЖ, wykИadвwek i egza
Ekonomia wyk%c5%82ad
WYKLADY, GR W5, WYK˙AD V
Semestr 1, Wykład 11, WYK˙AD XI
chemia, ANIONY i kationy, ANIONY:1)Uz
21 wykładów, MIKRO14, Wyk˙ad 14.
Semestr 2, Wykład 15, WYK˙AD XV
WYKLADY, GR W13, WYK˙AD XIV ( II SEMESTR )
PAS07, wyk˙ad PASCAL - pliki zdefiniowane
Semestr 1, Wykład 13, WYK˙AD XIII:
Semestr 2, Wykład 17, WYK˙AD XVI
Semestr 2, Wykład 15, WYK˙AD XV
WYKLADY, GR W13, WYK˙AD XIV ( II SEMESTR )
PAS07, wyk˙ad PASCAL - pliki zdefiniowane
Semestr 1, Wykład 13, WYK˙AD XIII:
więcej podobnych podstron