
RÓWNOWAGI JONOWE
W WODNYCH ROZTWORACH
ELEKTROLITÓW

DYSOCJACJA ELEKTROLITYCZNA
Dysocjacją elektrolityczną nazywamy rozpad
substancji na jony pod wpływem
rozpuszczalnika.
W wyniku tego procesu powstaje roztwór
przewodzący prąd. Substancje ulegające
dysocjacji elektrolitycznej nazywamy
elektrolitami.

elektrolity (kwasy, zasady i sole) podczas
rozpuszczania w wodzie rozpadają się na
elementy naładowane elektrycznie, czyli ulegają
dysocjacji elektrolitycznej. Elementy te
nazwano jonami. Jony naładowane dodatnio
nazywa się kationami, a ujemne anionami.
suma ładunków elektrycznych kationów i
anionów, powstających na skutek dysocjacji
elektrolitycznej elektrolitów jest zawsze równa
zeru.
nieelektrolity tzn. substancje, które w roztworach
i w stanie stopionym nie przewodzą prądu
elektrycznego, nie ulegają dysocjacji
elektrolitycznej.
właściwości chemiczne jonów różnią się zupełnie
od własności obojętnych atomów i cząsteczek.
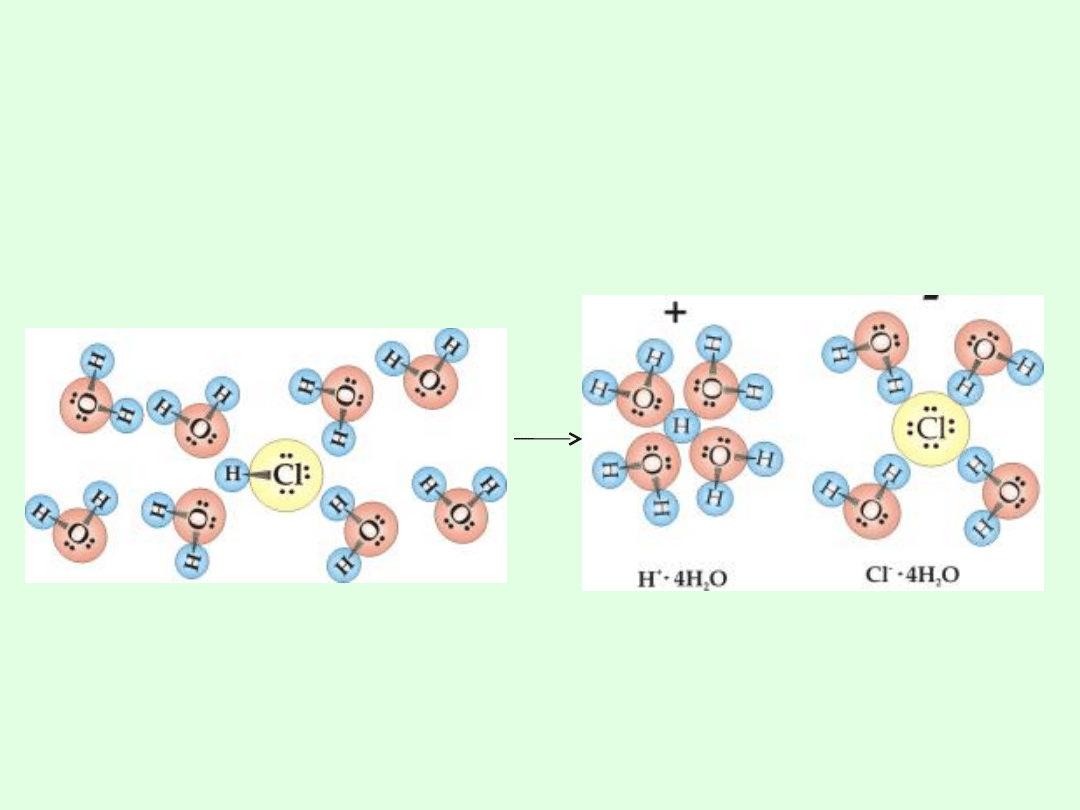
W cząsteczce chlorowodoru atom wodoru związany jest z
chlorem silnie spolaryzowanym wiązaniem atomowym.
Wprowadzenie chlorowodoru do wody prowadzi do
orientacji polarnych cząsteczek wokół cząsteczek HCl
.Następuje rozerwanie wiązania wodór-chlor i utworzenie
uwodnionych jonów H
+
i Cl
-
. Powstaje w ten sposób
wodny roztwór kwasu solnego.
Proces dysocjacji chlorowodoru możemy zapisać w
postaci równania chemicznego:
HCl → H
+
+ Cl
-

Zdolność substancji do dysocjacji zależy od jej
polarności oraz polarności rozpuszczalnika. Im
silniej jest spolaryzowana cząsteczka tym łatwiej
ulega ona rozpadowi na jony w rozpuszczalniku
polarnym.
Chlorowodór jest cząsteczką bardzo silnie
spolaryzowaną. W wodzie praktycznie całkowicie
rozpada się na jony i stąd dysocjację HCl
przedstawiono jako reakcję nieodwracalną,
zachodzącą tylko w jednym kierunku, w kierunku
tworzenia jonów.
HCl
→
H
+
+ Cl
-

Nie wszystkie substancje rozpadają się w
jednakowym stopniu na jony. Niektóre cząsteczki o
silnych, słabo spolaryzowanych wiązaniach
atomowych w ogóle nie ulegają dysocjacji.
Nazywamy je
nieelektrolitami
. Przykładem mogą
być cząsteczki cukru.
Generalnie dysocjacji ulegają związki
nieorganiczne:
kwasy, zasady i sole.
Związki organiczne praktycznie nie dysocjują
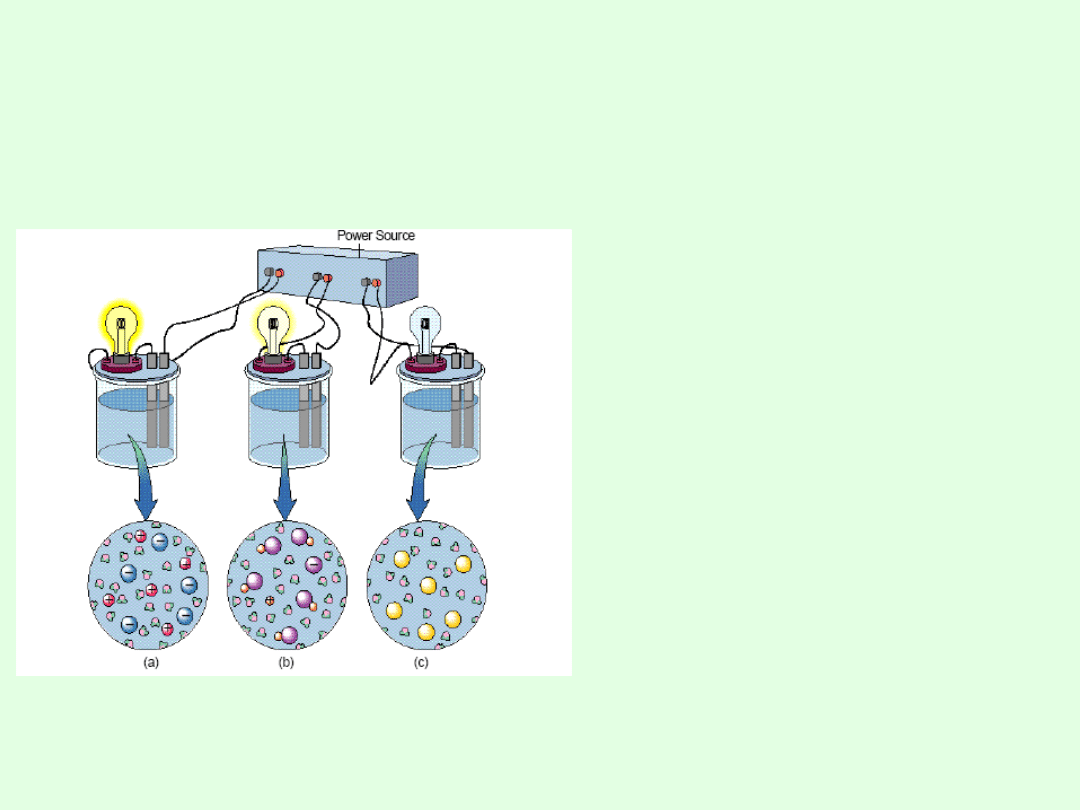
Przewodnictwo
elektryczne roztworów
wodnych
Obwód zostaje zamknięty i
zaczyna płynąć prąd jeżeli
roztwór zawiera nośniki
ładunku.
(a) Mocny elektrolit
zawiera jony gotowe do
przenoszenia ładunku.
(b) Słaby elektrolit zawiera
mało jonów i jest w stanie
przenieść mniej ładunków.
(c) Nie-elektrolit nie
zawiera jonów i nie
przewodzi prądu.
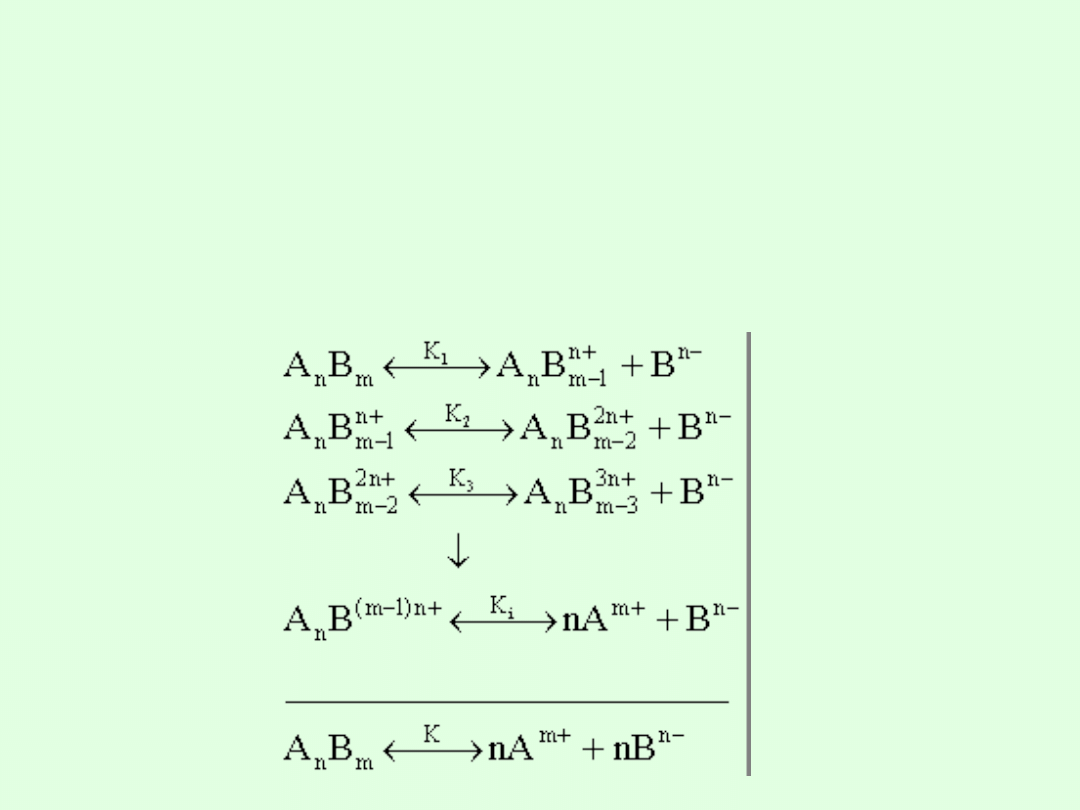
Dysocjacja wielostopniowa
Dysocjację prostego związku o budowie jonowej AB, zbudowanego
z jednowartościowych jonów, można opisać jedną reakcją.
Dla cząsteczek o skomplikowanej budowie jonowej A
n
B
m
zbudowanych z jonów wielowartościowych dysocjacja przebiega w
wielu etapach i każdy etap można opisać odpowiednimi
cząstkowymi reakcjami równowagi:

HNO
3
H
+
+ NO
3
-
kwas jednoprotonowy
H
2
SO
4
H
+
+ HSO
4
-
kwas dwuprotonowy
HSO
4
-
H
+
+ SO
4
2-
H
3
PO
4
H
+
+ H
2
PO
4
-
kwas
trójprotonowy
H
2
PO
4
-
H
+
+ HPO
4
2-
HPO
4
2-
H
+
+ PO
4
3-

NaOH Na
+
+ OH
-
Ca(OH)
2
CaOH
+
+ OH
-
CaOH
+
Ca
2+
+ OH
-
Al(OH)
3
Al(OH)
2
+
+ OH
-
Al(OH)
2
+
AlOH
2+
OH
-
AlOH
2+
Al
3+
OH
-

Sole mają budowę jonową (kation metalu lub
amonowy i anion reszty kwasowej.
Proces rozpuszczania soli w wodzie polega zatem na
przechodzeniu do roztworu istniejących już w krysztale
kationów i anionów.
Ca
3
(PO
4
)
2
3Ca
2+
+ 2PO
4
3-
Do porównania mocy elektrolitów Arrhenius wprowadził
pojęcia:
stopnia dysocjacji elektrolitycznej,
stałej dysocjacji elektrolitycznej.
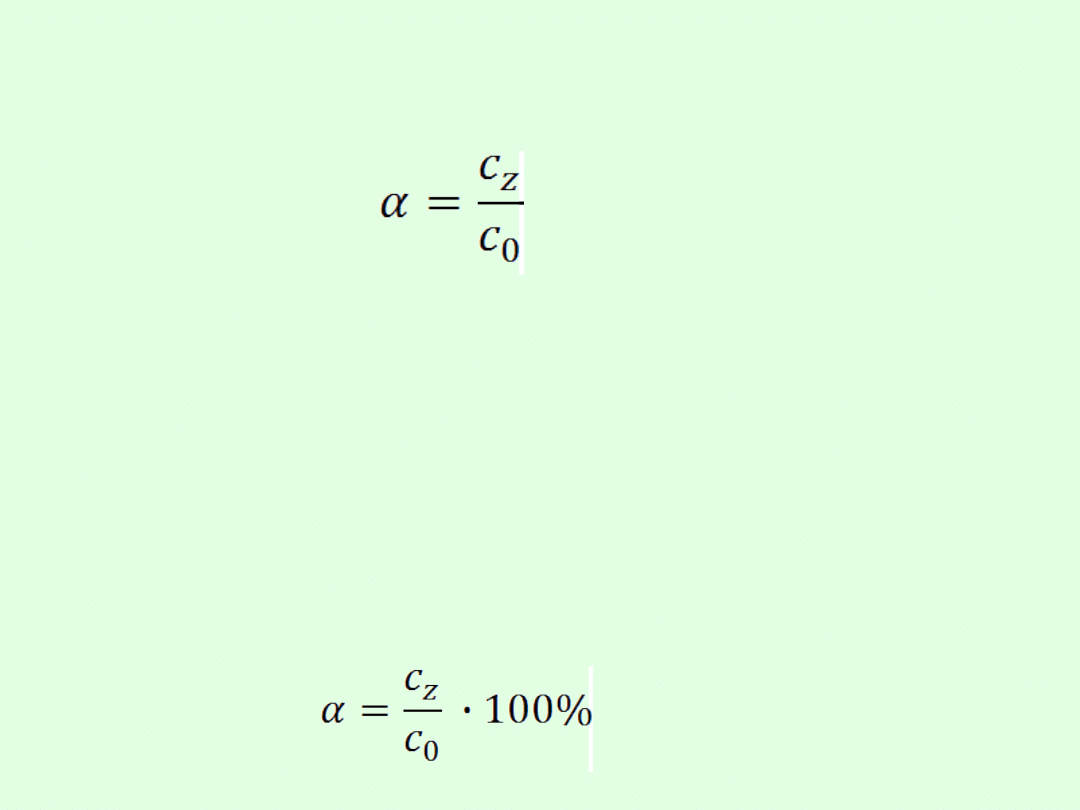
gdzie: (alfa) - stopień dysocjacji,
c
z
- liczba moli cząsteczek zdysocjowanych na jony,
c
0
- liczba moli cząsteczek substancji rozpuszczonej czyli
stężenie początkowe
Stopień dysocjacji jest liczbą bezwymiarową mieszczącą się
w przedziale <0,1>.
Można go również wyrazić w procentach:
Stopień dysocjacji elektrolitu określa się stosunkiem liczby
moli cząsteczek zdysocjowanych na jony do liczby moli
cząsteczek substancji rozpuszczonej.

Pomiary wykazały, że stopień dysocjacji wzrasta
z rozcieńczeniem elektrolitu i w roztworach bardzo
rozcieńczonych wszystkie elektrolity wykazują
stopień dysocjacji zbliżony do jedności,
tzn. niemal wszystkie cząsteczki lub zgrupowania
jonów substancji rozpuszczonej ulegają
zdysocjowaniu na jony.

Elektrolitami mocnymi nazywamy takie
związki, które w niezbyt stężonym roztworze
wodnym są całkowicie zdysocjowane na jony.
Ich stopień dysocjacji jest równy jedności.
Do elektrolitów mocnych należą
prawie
wszystkie sole
oraz niektóre kwasy i zasady
:
(H
2
SO
4
, HNO
3
, HCl, NaOH, KOH ).

Elektrolitami słabymi nazywamy takie związki,
które
w roztworze wodnym tylko częściowo dysocjują
na jony, a więc roztwór oprócz jonów zawiera
zawsze cząsteczki niezdysocjowane. Stopień
dysocjacji słabych elektrolitów jest mniejszy od
jedności ponieważ rośnie wraz
z rozcieńczeniem roztworu więc przy określeniu
jego wartości należy zawsze uwzględniać
stężenie elektrolitu.
Np.
kwas octowy CH
3
COOH,
wodorotlenek amonowy NH
4
OH
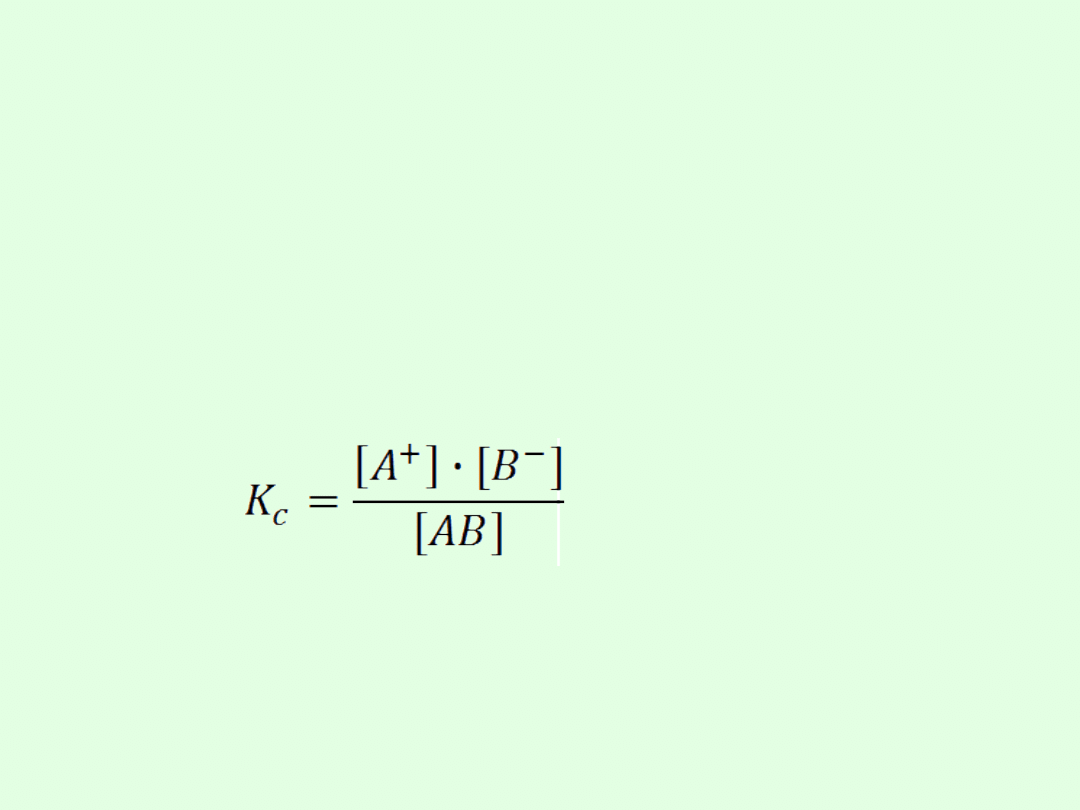
Dysocjację słabych elektrolitów można traktować jako
odwracalną reakcje chemiczną. Słaby elektrolit, o
wzorze ogólnym AB, ulega w roztworze wodnym
dysocjacji według równania:
AB A
+
+ B
-
W stanie równowagi równanie można wyrazić
zależnością:
gdzie: K
c
nosi nazwę stałej dysocjacji.
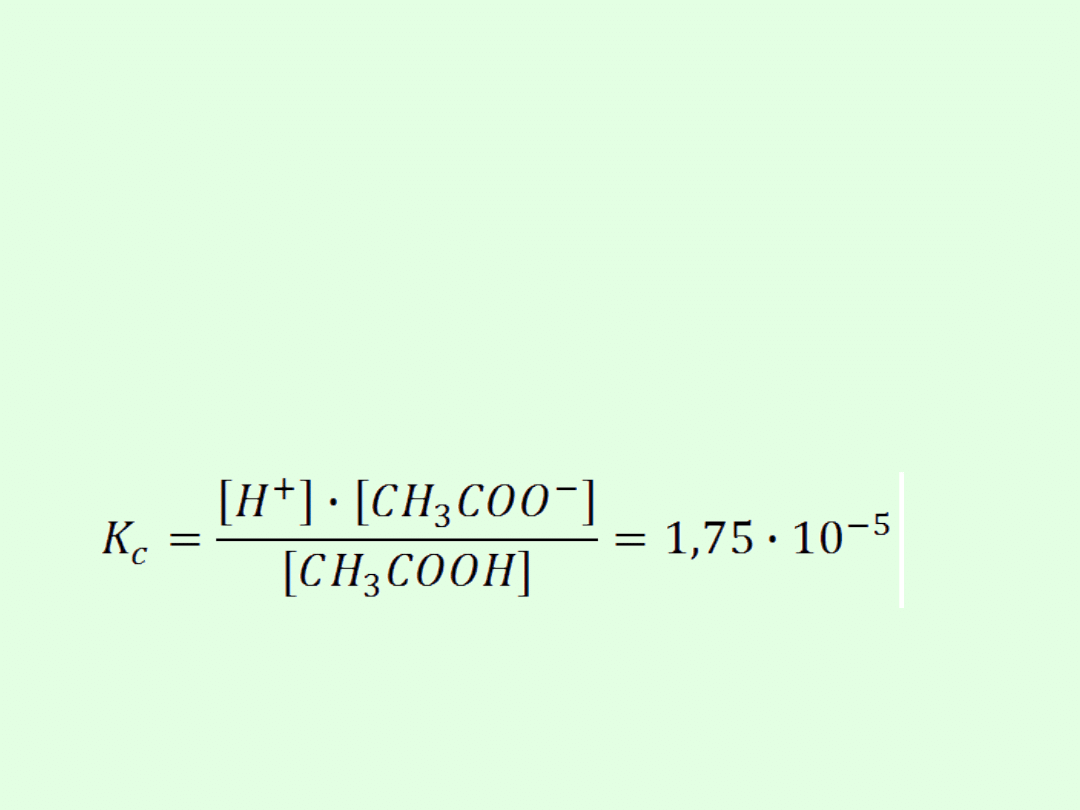
Stała K
c
jest wielkością stałą w określonej
temperaturze, niezależną od stężenia. Dlatego może
służyć jako miara mocy elektrolitów.
Im elektrolit jest mocniejszy, tym wartość stałej K
c
jest większa.
Przykład: CH
3
COOH CH
3
COO
-
+ H
+
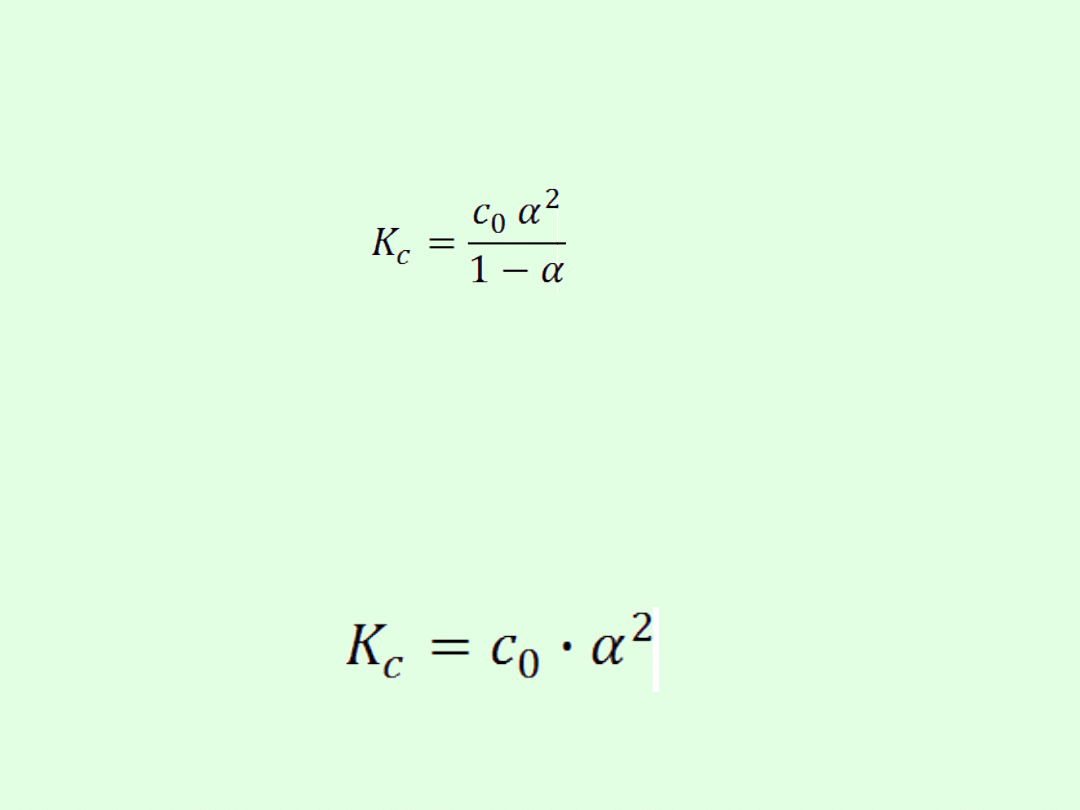
Związek pomiędzy stopniem dysocjacji a stałą
dysocjacji ujmuje ogólnie tzw. prawo
rozcieńczeń Oswalda
gdzie c
0
- stężenie molowe [mol/dm
3
]
Dla elektrolitów słabych wartość stopnia
dysocjacji jest bardzo mała. Wtedy wynik
odejmowania [1- ()] jest bliskie 1 i możemy
zapisać:

Stopień dysocjacji słabego elektrolitu jest
zatem odwrotnie proporcjonalny do
pierwiastka kwadratowego stężenia molowego
tego elektrolitu i wprost proporcjonalny do
pierwiastka kwadratowego jego stałej
dysocjacji.
Prawo rozcieńczeń Oswalda słuszne jest
jedynie w przypadku roztworów elektrolitów
słabych i bardzo rozcieńczonych.
Aktywność jonów w roztworach. Skala pH
Woda ulega autoprotolizie (autodysocjacji) w/g równania:
H
2
O + H
2
O H
3
O
+
+ OH
-
W wyniku tej reakcji powstaje jon hydroniowy H
3
O
+
oraz jon hydroksylowy OH
-
.
H
3
O
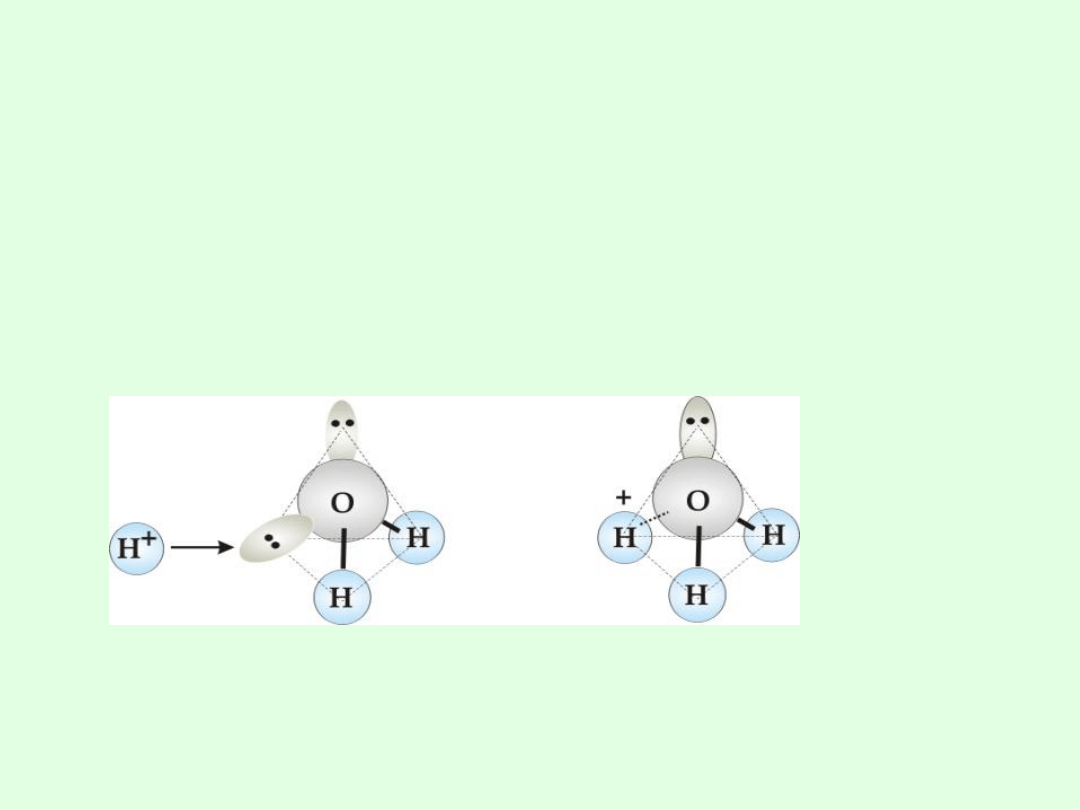
+
- kation wodorowy solwatowany 1 cząsteczką wody
Tworzenie jonu hydroniowego w wyniku przyłączenia
jonu wodorowego przez cząsteczkę wody

Reakcję można uprościć odejmując jedną
cząsteczkę wody:
H
2
O H
+
+ OH
-
Równowaga pomiędzy jonami H
+
, OH
-
a
niezdysocjowaną wodą można wyrazić stałą
równowagi
K = [H
+
] · [OH
-
] / [H
2
O]
Ponieważ stężenie czystej wody w wodzie jest
wielkością stałą to iloczyn K · [H
2
O] jest również
wielkością stałą i nazywany jest iloczynem
jonowym wody K
w
.
K
w
= K · [H
2
O] = [H
+
] · [OH
-
] = 10
-14
(mol/dm
3
)

W temperaturze 298,15
o
K (25
o
C) stężenie jonów
wodorowych w czystej wodzie jest równe
stężeniu jonów wodorotlenowych i wynosi:
[H
+
] = [OH
-
] = 1,00 · 10
-7
mol/dm
3
Podobnie jak w czystej wodzie, również we
wszystkich roztworach obojętnych [H
+
] = 10
-7
mol/dm
3
.
W roztworach kwaśnych [H
+
] > 10
-7
mol/dm
3
a w roztworach zasadowych [H
+
] < 10
-7
mol/dm
3
.

Posługiwanie się tak małymi stężeniami jest
niewygodne w zapisach i obliczeniach. Przyjęto
wyrażać aktywność jonów wodorowych w roztworze w
tzw. skali pH.
pH definiujemy jako ujemny logarytm dziesiętny
z wartości liczbowej stężenia (aktywności) jonów
wodorowych
pH = - log[H
+
]
analogicznie
pOH = - log[OH
-
]

Roztwory, których pH jest
niższe od 7 mają odczyn
kwaśny
, tym bardziej kwaśny, im niższe jest pH
roztworu.
Roztwory, których pH jest
wyższe od 7 mają odczyn
zasadowy
, tym bardziej zasadowy im wyższe jest pH
roztworu.
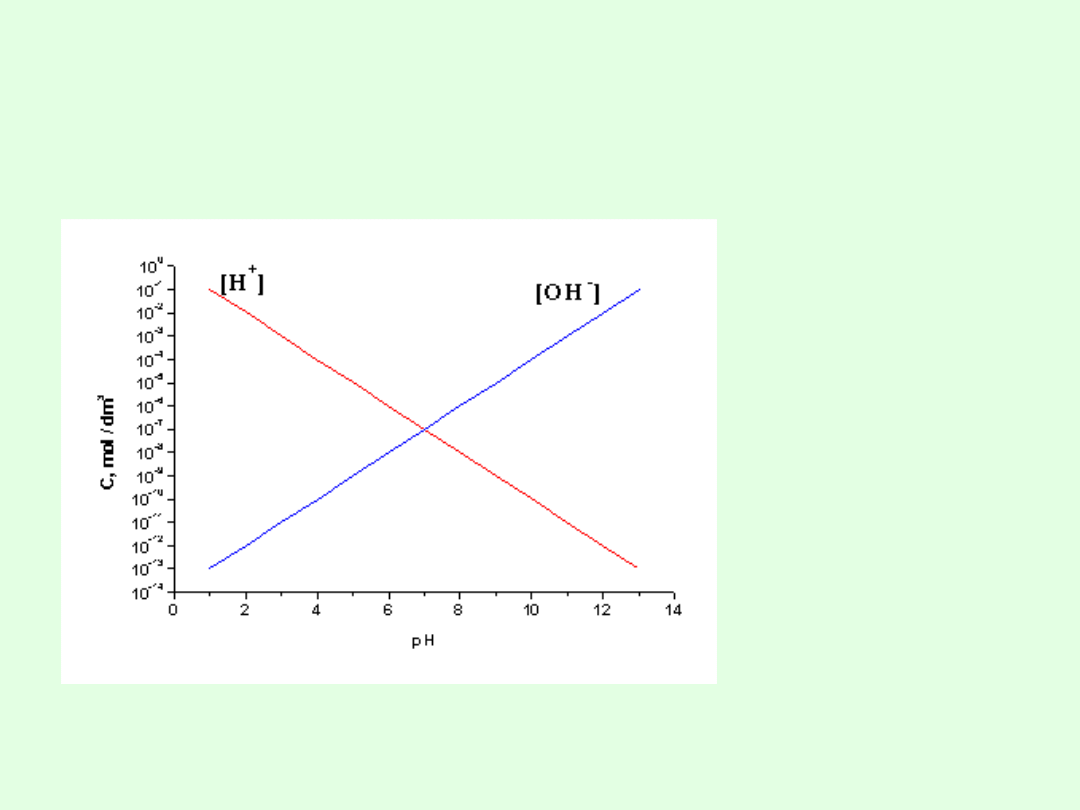
Wartość pH jest powszechnie przyjętą miarą kwasowości
roztworów. W rozcieńczonych roztworach wodnych
(roztworach doskonałych) może ona przyjmować wartości
od 0 do 14
Graficzny wykres zależności między pH a stężeniem
jonów wodorowych i hydroksylowych
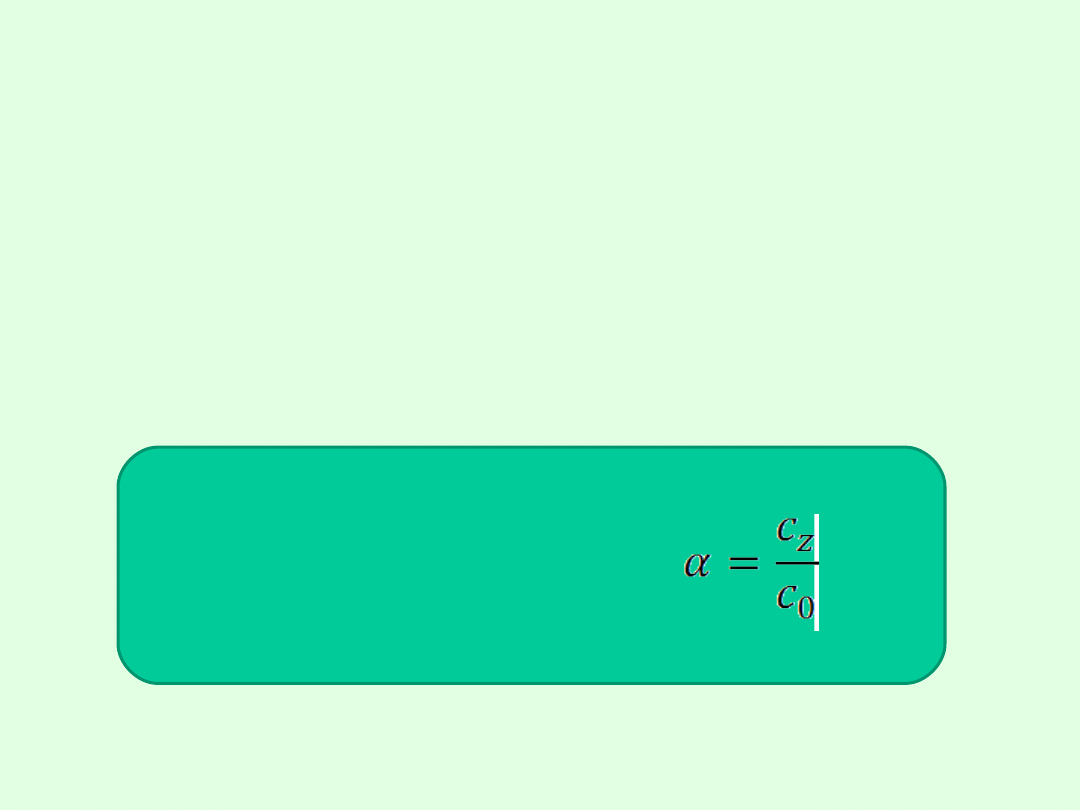
Logarytm dziesiętny – to wykładnik potęgi, do
której należy podnieść liczbę 10 aby uzyskać
liczbę logarytmowaną.
log a = x a = 10
x
czyli pH = -log [H
+
] a więc [H
+
] = 10
-pH
[H
+
] · [OH
-
] = 10
-14
oraz
pH + pOH = 14
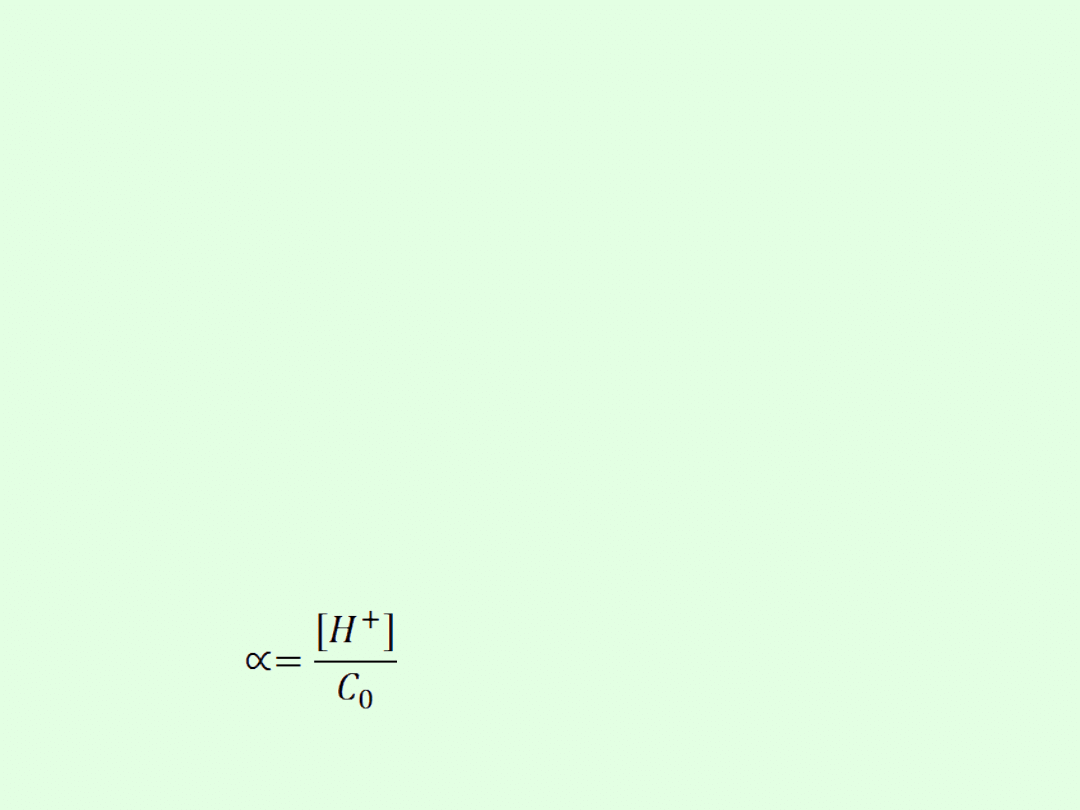
Przykłady obliczeń:
1.Obl [OH
-
] w 0,002-molowym roztworze kwasu
octowego zdysocjowanego w 7%.
CH
3
COOH CH
3
COO
-
+ H
+
i = 0,07 !!!
Cząstki zdysocjowane to jony H
+
!!!
Więc
ale C
0
= C
n
i dla kwasu octowego C
m
= C
n
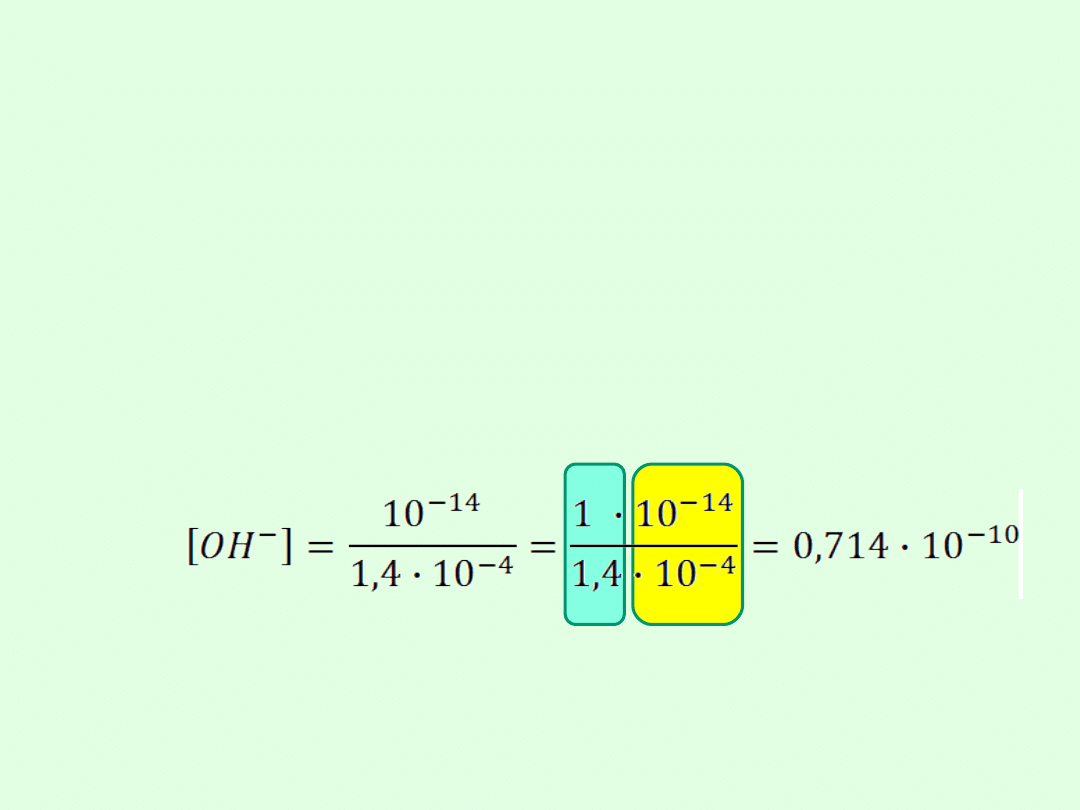
Czyli
[H
+
] = · C
n
więc [H
+
] = 0,07 · 0,002 = 0,00014 =
1,4 · 10
-4
[H
+
] · [OH
-
] = 10
-14
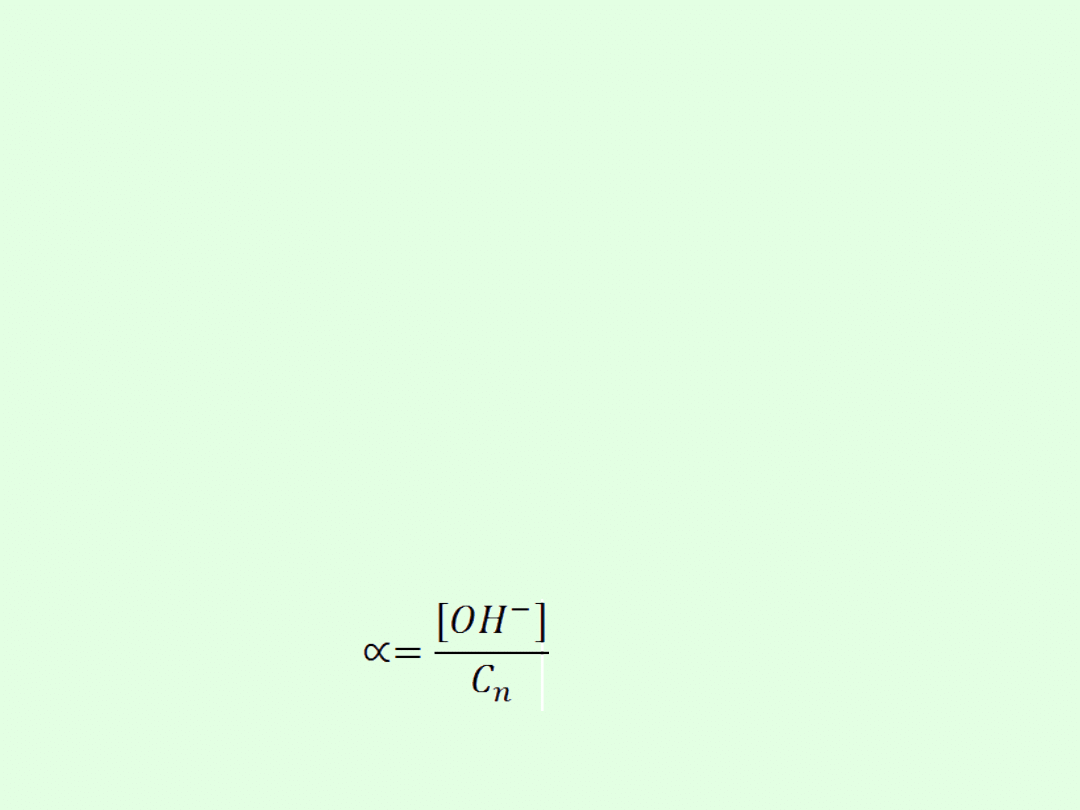
Przykład 2
Obl. C
n
roztworu NH
4
OH jeśli = 25% a wykładnik
wodorowy 11,3.
Dane:
= 0,25; pH = 11,3
A dysocjacja zachodzi następująco:
NH
4
OH NH
4
+
+ OH
-
Dla wodorotlenków
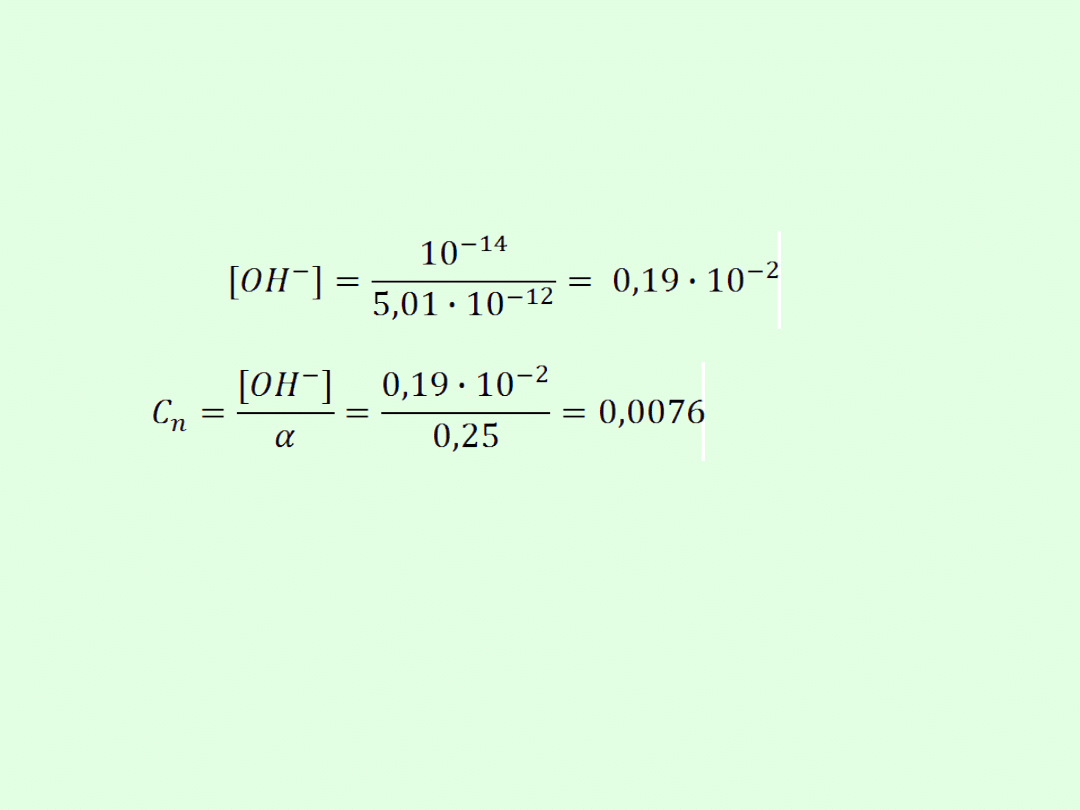
Więc trzeba obliczyć [OH
-
]
I sposób na obl. [OH
-
]:
pH = 11,3 to [H
+
] = 10
-11,3
= 5,01 · 10
-12
Wtedy
II sposób na obl. [OH
-
]:
jeśli pH = 11,3 to
pOH = 2,7
(bo
pH+pOH=14)
Więc [OH
-
] = 10
-2,7
= 0,0019 = 0,19 · 10
-2
Obliczenie C
n
jak wyżej
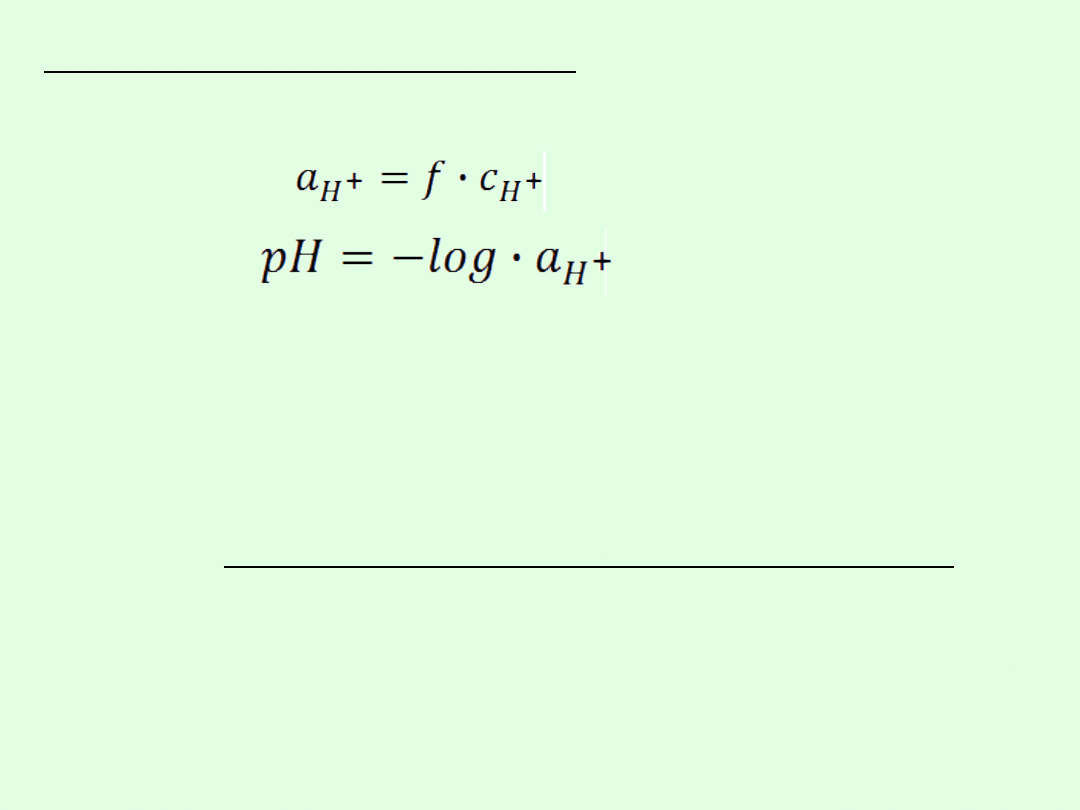
Dla roztworów rzeczywistych definicję pH należy
wyrazić poprzez aktywność jonów wodorowych:
Współczynniki aktywności zależą bowiem m.in. od
mocy jonowej roztworu. Równania które opisują tę
zależność mają jednak tylko przybliżony charakter.
Ponieważ aktywności nie da się dokładnie obliczyć,
zatem również
nie da się dokładnie obliczyć wartości
pH dla roztworów stężonych!
Wzór z logarytmem jest więc przybliżonym sposobem
oszacowania
pH dla roztworów stężonych.
Dla roztworów rozcieńczonych a = c

Pomiar pH
Najprostszym sposobem pomiaru pH jest pomiar przy
pomocy wskaźników (indykatorów). Wskaźniki są to
przeważnie słabe kwasy lub zasady organiczne,
których cząsteczka w postaci niezdysocjowanej
ma inne zabarwienie niż powstający w wyniku
dysocjacji produkt.

Do pomiarów pH stosuje się często uniwersalne
papierki wskaźnikowe będące mieszaniną różnych
wskaźników naniesionych na cienką bibułę.
Zanurzenie papierka w badanym roztworze i
porównanie jego barwy ze skalą pozwala na
określenie wartości pH.
Skala barw wskaźnika
uniwersalnego
Innym bardziej dokładnym pomiarem pH jest pomiar
elektrochemiczny –
zostanie omówiony dokładnie w
części analitycznej

Obliczenia związane z iloczynem rozpuszczalności – do
określania warunków w jakich wytrącają się osady.
Iloczyn jonowy trudno rozpuszczalnego elektrolitu w roztworze
nasyconym, pozostającym w równowadze z nadmiarem fazy
stałej, jest równy iloczynowi rozpuszczalności (wielkość stała w
określonej temperaturze).
W przypadku gdy elektrolit dysocjuje na kilka jonów:
Fe
2
S
3
2Fe
3+
+ 3S
2-
wyrażenie na iloczyn rozpuszczalności przyjmie postać
K
s
= [Fe
3+
]
2
· [S
2-
]
3
Molową rozpuszczalność trudno rozpuszczalnego elektrolitu w
nasyconym roztworze oznacza się literą
S
.
K
s
= [Bi
3+
]
2
· [S
2-
]
3
= (2
S
)
2
· (3
S
)
3
Wartości iloczynów rozpuszczalności dla różnych substancji są
stabelaryzowane i dostępne.

Przykład
Do 500 cm
3
0,008 molowego roztworu CaCl
2
dodano 500 cm
3
0,01 molowego roztworu Na
2
SO
4
. Czy w danych warunkach strąci
się osad CaSO
4
?
Wartość iloczynu rozpuszczalności CaSO
4
K
s
= 2,4 · 10
-5
Rozwiązanie
Po zmieszaniu roztworów objętość wynosi 1 dm
3
, a stężenia soli
wynoszą:
[Ca
2+
] = 0,008 · 0,5 = 0,004 mol/dm
3
[SO
4
2-
] = 0,01 · 0,5 = 0,005 mol/dm
3
K
s
= [Ca
2+
] · [SO
4
2-
] = 0,004 · 0,005 = 2,0 · 10
-5
i jest mniejszy od wartości iloczynu rozpuszczalności CaSO
4
:
2,0 · 10
-5
< 2,4 · 10
-5
Taki roztwór siarczanu VI wapnia jest nienasycony i osad
się nie strąci.

Przykład
Obliczyć rozpuszczalność PbI
2
w nasyconym roztworze w temperaturze
pokojowej.
Wartość iloczynu rozpuszczalności PbI
2
K
s
= 7,1 · 10
-9
Rozwiązanie: PbI
2
dysocjuje według równania
PbI
2
Pb
+2
+ 2I
-
Jeżeli molowa rozpuszczalność PbI
2
wynosi S, to [Pb
+2
] = S, [I
-
] = 2S
K
s
= [Pb
+2
] · [I
-
]
2
= S · (2S)
2
= 7,1 · 10
-9
To S = 1,52 · 10
-3
mol/dm
3
.
Ponieważ rozpuszczalność trudno rozpuszczalnego elektrolitu określa jego
stężenie molowe w roztworze nasyconym, więc dla :
[PbI
2
] = 1,52 · 10
-3
mol/dm
3
[Pb
+2
] = 1,52 · 10
-3
mol/dm
3
[I
-
]
= 3,04 · 10
-3
mol/dm
3

Hydroliza soli
Hydrolizą nazywa sie ogólnie reakcję związku
chemicznego
z wodą, a szczególnym rodzajem reakcji hydrolizy jest
odwracalny proces hydrolizy soli. Proces taki
występuje
w czasie rozpuszczania soli w wodzie. Produktami
reakcji hydrolizy są: kwas i zasada.
W przypadku reakcji hydrolizy soli pochodzącej od
kwasu jednowodorowego (HA) i jednowodorotlenowej
zasady (MeOH), reakcję hydrolizy można zapisać
schematycznie:
Me
+
+ A
-
+ H
2
O MeOH + HA

Reakcją odwrotną do reakcji hydrolizy jest reakcja
zobojętnienia:
MeOH + HA Me
+
+ A
-
+ H
2
O
Nie wszystkie sole ulegają reakcji hydrolizy.
4 grupy soli:
- sole od mocnych kwasów i mocnych zasad (np. NaCl)
- sole od mocnych kwasów i słabych zasad (np. NH
4
Cl)
- sole od słabych kwasów i mocnych zasad (np.
CH
3
COONa)
- sole od słabych kwasów i słabych zasad (np.
CH
3
COONH
4
)

Sole słabych kwasów i mocnych zasad
(CH
3
COONa) - odczyn zasadowy.
Przebieg procesu hydrolizy dla CH
3
COONa przedstawia
równanie.
CH
3
COO
-
+ Na
+
+ H
2
O <=> CH
3
COOH + Na
+
+
OH
-
Z równania widzimy, że jon sodowy nie uczestniczy w
równowadze kwasowo-zasadowej, dlatego powyższe
równanie możemy zapisać w postaci
CH
3
COO
-
+ H
2
O <=> CH
3
COOH + OH
-
Ten stan równowagi nazywany jest reakcją hydrolizy
anionowej (zasadowej)

Sole mocnych kwasów i słabych zasad
(NH
4
NO
3
) - odczyn kwasowy
NH
4
+
+ NO
3
-
+ H
2
O <=> NH
4
OH + NO
3
-
+ H
+
Jon NO
3
-
nie uczestniczy w równowadze kwasowo-
zasadowej.
NH
4
+
+ H
2
O <=> NH
4
OH + H
+
Ten stan równowagi nazywany jest reakcją hydrolizy
kationowej (kwasowej)

Sole słabych kwasów i słabych zasad.
CH
3
COONH
4
- odczyn może być obojętny, kwasowy lub
zasadowy, zależnie od wartości stałych dysocjacji
odpowiednich kwasów i zasad.
CH
3
COO
-
+ NH
4
+
+ H
2
O <=> CH
3
COOH + NH
4
OH + H
+
+
OH
-
Ponieważ stałe dysocjacji tych związków niewiele się
od siebie różnią odczyn roztworu będzie praktycznie
obojętny (pH 7).

Sole mocnych kwasów i mocnych zasad.
NIE ULEGAJA HYDROLIZIE!!!
Na
+
+ Cl
-
+ H
2
O = Na
+
+ Cl
-
+H
+
+ OH
-

Miarą zaawansowania procesu hydrolizy jest
stopień hydrolizy β
h
, określony stosunkiem liczby
cząsteczek (moli) zhydrolizowanych c
h
do liczby
cząsteczek (moli) soli c wprowadzonych
pierwotnie do roztworu.
β
h
= c
h
/ c
Drugą wielkością charakteryzującą sól w
roztworze jest stała hydrolizy K
h
, która zależy od
temperatury.

Roztwory buforowe
Są to roztwory, których wartość pH po dodaniu
mocnych kwasów albo zasad, jak i po
rozcieńczeniu wodą zmienia się nieznacznie.
Są to przeważnie roztwory wodne słabych kwasów i
ich soli lub słabych zasad i ich soli. Rolę mieszanin
buforowych spełniają również roztwory wodorosoli np.
NaHCO
3
, NaH
2
PO
4
lub Na
2
HPO
4
.

Cechy charakterystyczne roztworów buforowych:
praktycznie stałe stężenie jonów wodorowych
podczas rozcieńczania roztworu
niewielka zmiana stężenia jonów wodorowych po
dodaniu do roztworu niewielkich ilości mocnego
kwasu lub mocnej zasady - mniejszych niż stężenie
składników buforu (kwasowość roztworu buforowego
nie powinna zmienić się więcej niż o jednostkę pH).

Roztwory buforowe odgrywają ważną rolę w
procesach biochemicznych organizmów roślinnych
i zwierzęcych, zapewniając ściśle określoną
kwasowość środowiska, zmienną w bardzo wąskim
tylko zakresie (płyny komórkowe, krew, limfa, itp).
Bufory mają również znaczenie w chemii
analitycznej oraz w wielu procesach
technologicznych (np. fermentacja, galwaniczne
pokrycia metaliczne, itp.)

Przykłady roztworów buforowych:
bufor octanowy: CH
3
COOH, CH
3
COONa
w zakresie pH = 3,5 - 6
bufor amonowy: NH
3
· H
2
O, NH
4
Cl
w zakresie pH = 8 - 11
bufor fosforanowy: KH
2
PO
4
, K
2
HPO
4
w zakresie pH = 5,5 - 8
bufor boranowy: H
3
BO
3
, Na
2
B
4
O
7
w zakresie pH = 7 - 9

Pojemność buforowa
Działanie buforujące roztworu buforowego jest
ograniczone,
a skuteczność tego działania zależy od stężenia
substancji składowych.
Miarą zdolności roztworu buforowego do
przeciwdziałania wpływom zmieniającym jego pH jest
zdolność buforowa, wyrażona zwykle liczbą moli
mocnego kwasu lub zasady, która wprowadzona
do 1 dm
3
roztworu buforowego zmienia jego pH
o jedność.
Pojemność buforowa jest wprost proporcjonalna do
stężenia roztworu buforowego. Optymalne działanie
buforujące wykazuje bufor, w którym stężenie kwasu
(zasady) jest w przybliżeniu równe stężeniu soli. W
takich warunkach bufory są najmniej wrażliwe na
dodatek mocnego kwasu lub zasady.
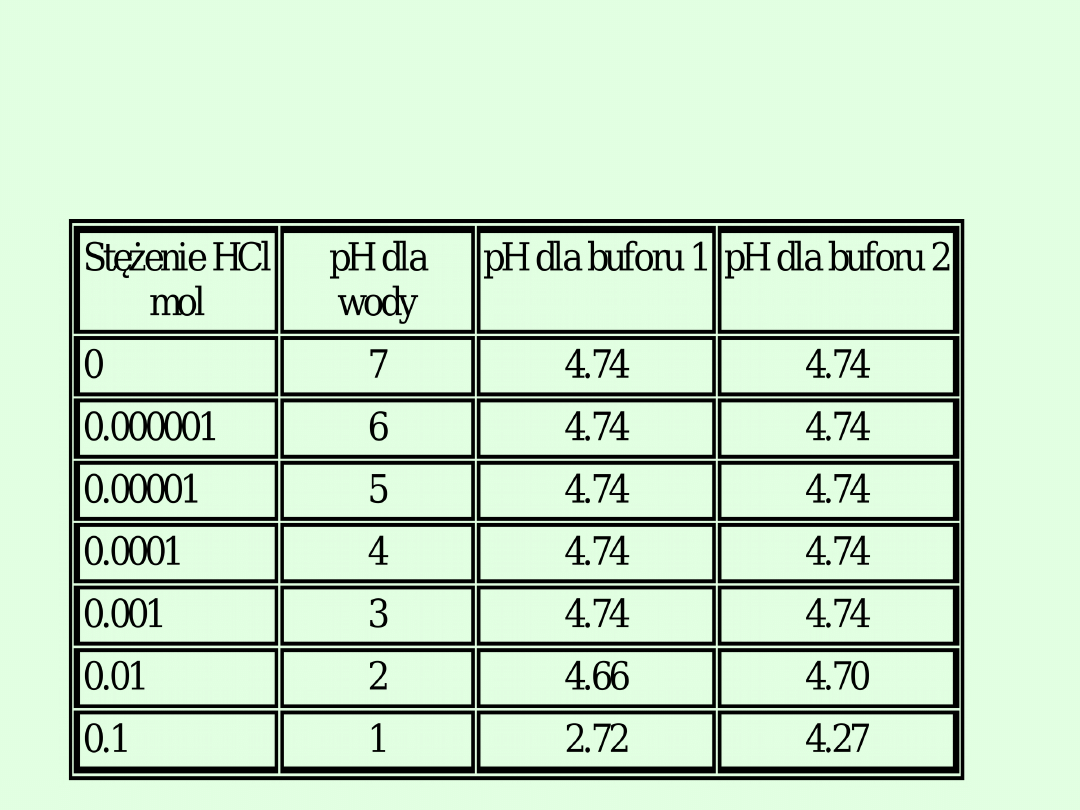
Efekt dodawania kwasu solnego do wody i dwóch
roztworów buforowych
bufor nr1 to (C
kwasu
/ C
soli
= 0,1 / 0,1)
bufor nr 2 to (C
kwasu
/ C
soli
= 0,2 / 0,2)
Działanie buforu
Bufor octanowy: 0,1 M kwas octowy + 0,1 M octan
sodowy (CH
3
COOH i CH
3
COONa), K
kwasu
= 1,76 ·
10
-5
K
kwasu
= [H
+
]
.
[CH
3
COO
–
] / [CH
3
COOH] ,
kwas jest minimalnie zdysocjowany więc C
kwasu
= 0,1;
[CH
3
COO
–
] = C
soli
= 0,1;
Zatem wyliczając [H
+
] z wzoru na stałą:
[H
+
] = 1,76 · 10
-5
· 0,1 / 0,1
to pH = -log 1,76 · 10
-5
=
4,75

Do 1000 cm
3
tego buforu dodajemy 10 cm
3
1M HCl
([H
+
]=0,01 mol)
H
+
+ CH
3
COO
–
→ CH
3
COOH
[CH
3
COO
–
] = 0,1 - 0,01 = 0,09
[CH
3
COOH] = 0,1 + 0,01 = 0,11
Aktualne stężenie [H
+
] = 1,76 · 10
-5
· 0,11 / 0,09 = 2,15
· 10
-5
pH = -log 2,15 · 10
-5
=
4,67
Zmiana: 4,75 4,67 !!!
Po dodaniu takiej ilości kwasu do 1 dm3 wody, pH
zmieni się:
10
-2
+ 10
-7
=???
pH: 7 2 !!!!
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
3 Równowagi jonowe w roztworach
Cwiczenia 5 - Równowagi jonowe - pH roztworow, Wykładnik stężenia jonów wodorowych (pH) -- zadania
1 12 2010 Równowagi jonowe w układach heterogenicznych
Równowagi jonowe w roztworach
Równowagi jonowe w roztworach
3 Równowagi jonowe w roztworach
38 Równowagi jonowe w roztworach wodnych (dysocjacja, iloczyn jonowy wody, pH, indykatory pH, roztwo
Równowaga kwasowo zasadowa fizjot3
APARATURA DO OCENY RÓWNOWAGI STATYCZNEJ
5a Równowaga kwasowo
12a Równowaga ciecz para w układach dwuskładnikowych (a)id 14224 ppt
Równowaga kwasowo zasadowa fizjot3
Zaburzenia rownowagi wodnej do druku 9
więcej podobnych podstron